Method Article
海馬神経原性ニッチを研究するための単一核RNAシーケンシングと組み合わせたニューロンの蛍光活性化核ネガティブソーティング
要約
ここでは、マウス歯状回から単離された単一の核を配列決定する方法を紹介し、蛍光活性化核(FAN)ソーティングによってほとんどのニューロンを除外します。このアプローチは、高品質の発現プロファイルを生成し、神経幹細胞などの希少な集団を含む、ニッチに代表される他のほとんどの細胞タイプの研究を容易にします。
要約
成体海馬神経新生(AHN)は、歯状回(DG)の顆粒下ゾーン(SGZ)内の増殖性および静止性神経幹細胞(NSC)の生涯にわたる維持と、新しく生まれたニューロンから顆粒細胞層の顆粒細胞への分化で構成されており、多くの研究で十分に検証されています。遺伝子組み換え動物、特にげっ歯類を使用することは、AHNを調節するシグナル伝達経路を調査し、海馬の神経原性ニッチを構成する各細胞型の役割を研究するための貴重なツールです。後者に対処するために、単一核単離と次世代シーケンシングを組み合わせた方法は、各細胞集団の遺伝子シグネチャを特定するためにAHNの分野で大きな影響を及ぼしました。しかし、DG内のより希少な細胞集団を表現型的にプロファイリングするには、これらの技術のさらなる改良が必要です。ここでは、蛍光活性化核ソーティング(FANS)を利用して、NeuN抗原の非染色核を選択することにより、解剖したばかりのDGから分離された単一核懸濁液からほとんどのニューロン集団を除外し、単一核RNAシーケンシング(snRNA-seq)を実行する方法を紹介します。この方法は、AHNの細胞間制御をさらに調査し、種を超えた新しい細胞マーカーとメカニズムを明らかにするための潜在的な足がかりです。
概要
成人期の海馬ニューロンの継続的な生成は、成人海馬神経新生(AHN)とも呼ばれ、学習、記憶獲得/クリアランス、パターン分離などの認知機能に関連しており、認知障害を予防するための老化および神経変性疾患における回復力の重要なメカニズムであるように思われます1,2,3 .げっ歯類は、免疫細胞化学や次世代シーケンシング(NGS)法など、いくつかの方法を使用してAHNを研究するための選択モデルです。これらの結果の他の種への翻訳は議論の余地があります。実際、AHNはほとんどの種で観察されていますが、生涯を通じて持続する程度、特にヒト4,5,6,7,8では定期的に議論されています。
現在までに、様々な内因性および外因性のシグナル伝達経路がAHN1を調節することが確認されている。しかし、細胞間コミュニケーションがAHNに与える影響は、まだ明らかになったばかりです9。これはまず、遺伝子改変動物を用いてin vivo解析を行うには、現在知られている細胞マーカーの特異性が不十分であることに起因する可能性がある。実際、多くの研究は、複数の細胞型で発現するダブルコルチンやグリア線維性酸性タンパク質(GFAP)などのマーカーに依存しています1。第二に、成体の海馬ニッチ10の複雑さと高度な細胞多様性は、すべての細胞タイプのプロファイリングに技術的な課題をもたらします。これは特に、NSCやグリア細胞などの異なる集団の分析パイプラインで使用される重複する細胞マーカーを使用したバイオインフォマティクス分析の場合に当てはまり、AHN 7,11を評価する際に物議を醸す結論をもたらします。第三に、膨大な数のニューロンは、AHNの微調整制御におけるそれらの役割が顕著になりつつあるにもかかわらず、星状細胞、希突起膠細胞または上衣細胞などのそれほど豊富でない細胞集団の研究を弱体化させる9。一緒に、これらの制限はげっ歯類から他の種に結果を翻訳する能力に影響を与えます。これは、海馬神経原性ニッチなどの複雑な組織をin vitroで再現することの難しさ、およびヒト組織を含む研究における組織処理のための標準化されたプロトコルの欠如とともに高品質の組織にアクセスするための多くのハードルによって特に増幅されます12,13。したがって、細胞集団をプロファイリングし、歯状回(DG)内の新しい細胞マーカーを特定するための新しいアプローチを開発し、最終的にはAHN制御に対する各細胞タイプのさまざまな寄与をよりよく理解することが重要です。
これを達成するために、RNAシーケンシングと組み合わせた単一細胞(sc)および単一核(sn)単放散は、DG14などの複雑な組織の調査に不可欠になっています。そのため、マウス成体海馬ニッチから単一細胞を単離するための細胞濃縮の戦略は、主にNSCを調べるために行われてきました15、16。DGから非神経細胞を濃縮するための興味深い戦略は、GluR1/Cd24ダブルネガティブシングルセルのシーケンシングによって適用され、バイオインフォマティクス解析後にアストロサイトとNSCの間に明確なクラスターなしで1,408個の細胞がシーケンスされました17。これは、細胞の完全性とRNAを損なう単一細胞の調製に必要な過酷な酵素消化が原因である可能性があります。この技術的問題を回避するために、代わりに単一核単離を使用するいくつかの方法が開発されており、複雑な組織に特に適している11,18。しかし、DG内またはより広義には海馬-嗅内系内のニューロンの優位性は、これらの脳領域内に存在する細胞集団全体を研究するためのサンプリングバイアスを生成する。さらに、シングルセルライブラリの調製のためにロードする細胞数が限られているため、配列決定された単一核の分析パイプラインにおける主要な細胞集団の存在が強調されます。実際、大きなニューロンクラスターはしばしば注釈を付けて分析されますが、他の細胞集団は過小評価されているか、見逃されています5,11。
これらのバイアスを克服し、マウスDGに存在するニューロン以外の細胞型をプロファイリングできるようにするために、本研究では、蛍光活性化核ソーティング(FANS)18 の原理を用いて、ニューロン核抗原(NeuN、 Rbfox3とも呼ばれます)。この抗原の選択は、NeuNを信頼できるニューロンマーカーとして記述している文献19 と、このアプローチに核タンパク質を使用する必要性によって導かれました。次に、NeuN陰性FACSソーティング細胞を、10x GenomicsプラットフォームでRNAシーケンシング用に調製しました。この結果は、NeuN発現細胞を排除することで、グリア細胞集団および希少細胞集団の細胞型特異的で高品質のトランスクリプトームプロファイリングが可能になることを示しています。
プロトコル
動物の世話と実験手順は、フランシスクリック研究所のガイドライン、および英国内務省のガイドラインと法律に従って実施されました。
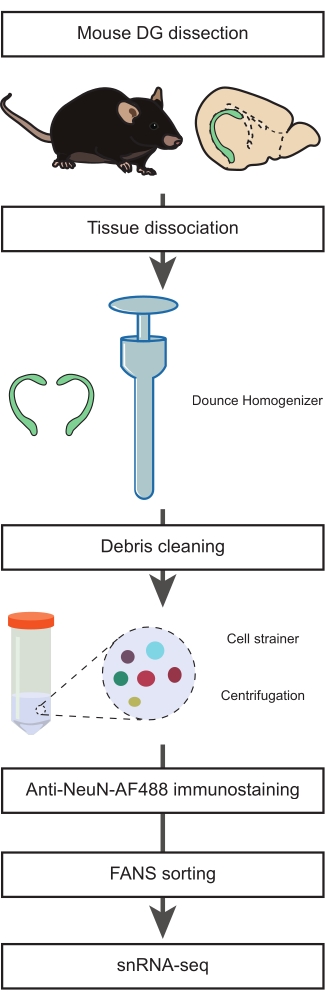
図1:非神経細胞集団のsnRNA-seqのための成体マウスの解剖されたDGからの単一核懸濁液の調製。 マウスDGの解剖、単一核の懸濁液の調製、NeuN免疫染色、およびsnRNA-seqを進める前の陰性NeuN-FANSソーティングを含むプロトコルの主なステップを説明するフロー図。 この図の拡大版を表示するには、ここをクリックしてください。
1. DGの解剖(タイミング:15分)
- 核分離培地1および2(NIM1およびNIM2)、ホモジナイズバッファー(HB)、および洗浄培地(WM)を準備します(補足表1)。必要になるまで、すべてのバッファー、培地、試薬、およびツールを氷上に置きます。Dounceホモジナイザー( 材料表を参照) を準備中(均質化ステップの最低1時間前)に氷の上に置きます。
注:NIM1は、4°Cで最大6か月間調製および保存できます。NIM2、HB、およびWMは新たに準備する必要があります。
注意: DTT、プロテアーゼ阻害剤、およびTriton X-100は注意して操作してください。これらの化合物は、皮膚や目を刺激し、急性毒性があり、水生環境に有害です。これらの化学物質を使用するときは、保護手袋、衣服、目と顔の保護具を着用し、取り扱い後は手をよく洗い、環境への放出を避けてください。 - 内務省スケジュール1の手順20に従って、生後22か月のオスのC57Bl / 6Jマウスを頸部脱臼により安楽死させます。
注:この研究における22ヶ月齢のマウスの使用に関する理論的根拠については、議論を参照してください。ただし、このプロトコルは、生涯にわたって任意の年齢で実行できます。 - 安楽死させたマウスから脳を解剖し、氷のように冷たい1x PBSで満たされた10cmのペトリ皿に移します(図1)。ペトリ皿を氷の上に置きます。メスを使用して小脳を取り除き、両方の半球の間で(矢状軸に沿って)脳を半分に切断します。
- 新しい10cmのペトリ皿に氷のように冷たいPBSを入れ、氷の上に置きます。脳の半分を新しいペトリ皿に移します。双眼鏡を使用してDGを解剖し、この手順を繰り返して、脳の後半から2番目のDGを取得します。
注意: これらの手順(手順1.2〜1.4)は、前述の手順21から適応されました。細胞の完全性を維持するために、この段階でできるだけ迅速に進めることが重要です。 - 2つのDGを予冷したダウンスホモジナイザーに移し、1mLの冷たいHBを加えます。
2.組織解離、単核分離、抗NeuN免疫染色(タイミング:2時間)
- 緩い「A」乳棒を10ストローク、続いてタイトな「B」乳棒を15ストロークで組織を均質化します。
注意: ダウンスの均質化は、摩擦や発泡によって引き起こされる熱を減らすために、氷上でモルタルを穏やかなストロークで実行する必要があります。手順中は、すべてのバッファーと機器を予冷し、氷上に保管する必要があります。 - ホモジネートをプレチルド15 mLチューブに移します。Dounceホモジナイザーを1 mLの冷たいHBですすぎ、同じチューブに混ぜ合わせます。3 mLのHBを15 mLチューブに加え、氷上で5分間インキュベートします。チューブを穏やかに反転させて2倍に混ぜます。
- 70 μmのストレーナーキャップを0.5 mLのHBで50 mLの試験管で事前に濡らします。ステップ2.2の核懸濁液を、15 mLチューブをセルストレーナーにそっと傾けて濾します。セルストレーナーを0.5 mLのHBで洗浄します。
- セルストレーナーを取り外し、スイングバケット遠心分離機を使用して、試験管を500 x g で4°Cで5分間遠心分離します。上澄み液を捨てる。
注:ホモジネートに濾すと、フローサイトメトリーとsnRNA-seqの下流ステップに不可欠な破片を減らすのに役立ちます。 - P1000ピペットを使用して、ペレットを4 mLのHBに穏やかに再懸濁します。氷上で5分間インキュベートします。500 x g で4°Cで10分間スピンします。 上清を捨て、ペレットを3 mLのWMに再懸濁します。
- 35 μmのストレーナーキャップを15 mLの試験管に0.5 mLのWMで事前に湿らせます。 ステップ2.5の核懸濁液を細胞ストレーナーに通し、P1000ピペットを使用して一度に0.5 mLを穏やかにピペッティングします。
- ストレーナーキャップを0.5 mLのWMで洗浄し、チューブを氷の上に置きます。ろ液を新しい15 mLチューブに移し、500 x gで5分間および4°Cで遠心分離します。上清を捨て、ペレットを3 mLのWMに再懸濁します。
- 500 x g で4°Cで5分間スピンします。 上清を廃棄し、マウス抗NeuN、Alexa Fluor 488結合抗体(抗NeuN-AF488、1:32,000)および1 μg/mL DAPIを含む1 mLのWMにペレットを再懸濁します。暗闇の中で氷の上で45分間インキュベートします。
注:単離された核の免疫染色を最適化するには、抗体を滴定して、フローサイトメトリーの分析とソーティングに最適な希釈率を決定することをお勧めします。次に、適切なコントロールを実行して、染色条件が最適であることを確認します。例えば、結合した抗NeuN-AF488抗体を用いて、陰性対照(すなわち、抗体を添加しない、補足図1A)および陽性対照(すなわち、抗体による染色、補足図1B)を実行して、非染色集団と染色集団の分離を評価した。 AF488標識抗体の使用を開始する場合は、特異性を評価するためにAF488標識アイソタイプコントロールを実行することをお勧めします。非結合抗体を使用する場合、二次抗体の非特異的結合を評価するために、核調製物にのみ二次抗体を添加するなどの追加の制御が必要になる場合があります。
3.ニューロン集団を除外するための蛍光活性化核選別(FANS)(タイミング:45分)
- 免疫染色した核懸濁液を5 mL試験管に移し、フローサイトメトリー手順が開始されるまで氷上に保管します。
注:2匹のマウスDGよりも大きな組織片で作業する場合、溶液中の核密度が高くなった場合にFACSの目詰まりを避けるために、WMバッファーでさらに希釈する必要があります。 - チューブをFACS機器に入れる前に、サンプルを低速で3秒間ボルテックスします(材料表を参照)。
注意: (FACSセットアップ)選別機は、メーカーの推奨に従って、手順の開始時に校正粒子と位置合わせする必要があります。落下遅延は、FACSモデルに従ってビーズまたはミクロスフェア( 材料表を参照)で較正されました。試料は4°Cの純度モードで選別した。収集量を減らすために、核をフローサイトメーターの推奨圧力で70μmのノズルで選別しました。核は、50 μLのWMを含む1.5 mLの低結合チューブ( 材料の表を参照)に分類されました。すべての収集チューブは、核がチューブの壁に付着するリスクを減らすために、4°Cで一晩PBS + 5%BSAでコーティングされました。 - 染色された核懸濁液のサンプルからデータを取得するには、細胞破片と凝集核を除外するために、DAPI高さとDAPI領域にゲートを設定します(図2A)。さらに、ログサイドスキャタ(SSC)エリアとログ前方スキャタ(FCS)エリアにゲートを設定することにより、残りのDAPI染色された凝集体または細胞破片から単一の核を分離します(図2B)。
- 図2Cに示すように、NeuN-AF488陰性集団を分離するために、抗NeuN-AF488およびFSC領域のゲートを設定します。
- 分析後、上記のゲーティング戦略を使用して、50 μLのWMで満たされた1.5 mLの収集チューブでNeuN-AF488陰性集団を分類します。
注:上記のゲーティング戦略と成体マウスの脳からDGを分離するための解剖手順に従って、NeuN-AF488陰性集団は単一核の~14%を占めると予想されます。
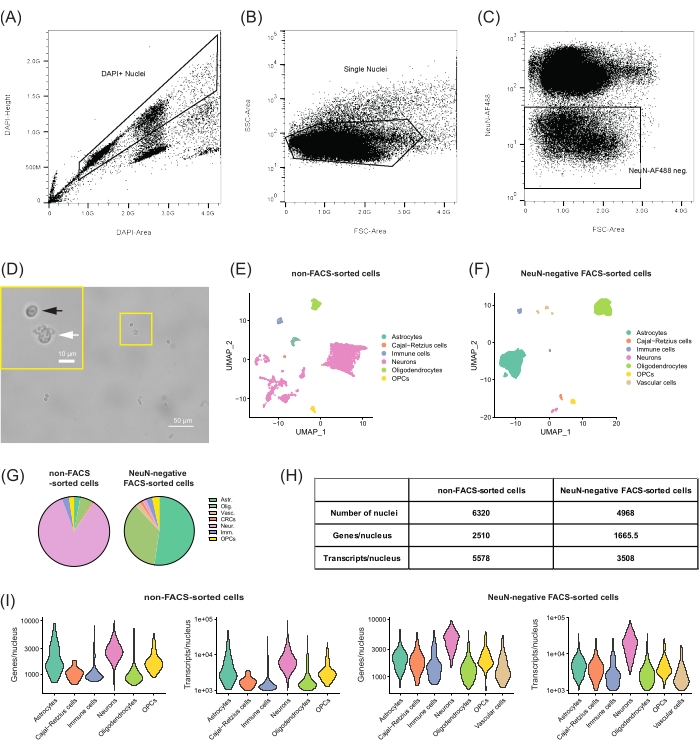
図2:DGからの非神経細胞集団の単離とトランスクリプトミクスプロファイリング。 (A-C)NeuN-AF488陰性単核を単離し、細胞破片を排除するためのゲーティング戦略。(A)単離された核の代表的なサンプルのFANSドットプロットで、DAPI +核の選択と細胞の破片と凝集体の排除のためのゲート設定を示しています。(B)FSC領域およびSSC領域を用いた関連する単一核のさらなる選択。(C)NeuN-AF488が陽性集団を除外し、負の単一原子核をソートするためのゲート。(D)不良品質の核(白矢印)と比較して、破片の量が少なく、良質の核の割合が高い(丸い形、黒い矢印)良好な単一核懸濁液の顕微鏡写真。スケールバー = 50 μm、10 μm(挿入図)。(E,F)snRNA-seqデータの解析と、22ヶ月齢のC57BL/6J雄マウスのDGから単離された別個の細胞集団のプロファイリング。(E)非FACSソーティングセルおよび(F)NeuN陰性FACSソーティングセルからの単一核プロファイルの次元縮小のための均一なマニホールド近似および投影(UMAP)プロット、セルタイプ別に色分け。(G)両方のサンプルで同定された細胞タイプの頻度を比較する円グラフ。(H)配列決定されたサンプルのそれぞれの指標:核の数、遺伝子の中央値、および核あたりの転写物。(i)両サンプルにおける各細胞型について検出された遺伝子および転写産物の数の分布を示すバイオリンプロット。アスト。=星状細胞、オリグ。=希突起膠細胞、Vasc。= 血管細胞, CRC = カハール・レチウス細胞, 神経. = ニューロン, Imm.=免疫細胞、OPCs=希突起膠細胞前駆細胞。この図の拡大版を表示するには、ここをクリックしてください。
4. 単一核RNAシーケンシングを行うための単一核懸濁液の調製(タイミング:30分)
- 選別後、1%BSAを含むPBS1 mLを回収チューブに加え、チューブ壁の液滴を捕集し、500 x g で4°Cで5分間回転させます。 上清を捨て、50μLを残す。
注意: 遠心分離された核は、チューブの底にあるペレットを観察するのが難しい場合があるため、注意して取り扱ってください。スイングバケット遠心分離機を使用すると、ペレットを破壊することなく上清を廃棄するのに役立ちます。 - ピペットは遠心分離した核を再懸濁します。0.5 mLマイクロチューブ中の5 μLのトリパンブルーに5 μLの核懸濁液を加えます。
注意: トリパンブルーは健康に有害であり、癌を引き起こす可能性があり、生殖能力や胎児に損害を与える疑いがあるため、取り扱いには注意してください。保護手袋、衣服、目と顔の保護具を着用してください。すべての安全上の注意を読んで理解するまで、取り扱わないでください。 - 血球計算盤または自動セルカウンターを使用して、濃度を測定し、単一細胞懸濁液の生存率を評価します( 材料の表を参照)。ライブラリの準備と核の配列決定を、ステップ5で詳しく説明するように実行します。
注:シーケンシングに高品質であると見なされたサンプルは、顕微鏡下で細胞破片のない円形で規則的な核形状を示しました(図2D)。核膜周囲のハローの存在または複数の核の凝集は、損傷した核の兆候であり、そのような細胞懸濁液はsnRNA-seqでは考慮されるべきではありません(図2D)。測定された核の濃度は300〜700核/μLの範囲内でした。
5. ライブラリの準備とシーケンシング
注:次の手順の説明は、この研究で使用された社内シーケンスプラットフォームに基づいています( 材料表を参照)。そのため、別のプラットフォームを使用すると、一部の設定が異なる場合があります。ここでは、重要な手順のみを説明し、各パラメーターは、最初に使用する前に最適化されていますが、選択したメーカーのガイダンスとプロトコルに従って決定する必要があります。RNAの分解を回避し、シーケンシングの最適な品質を確保するために、選別された核懸濁液を濃縮した後、ライブラリの調製をできるだけ早く実行することが重要です。
- 7,000〜10,000個の核をマイクロフルイディクスシングルセルチップにロードします。
- ロードされた核をナノリットルスケールの液滴に分割し、提供されたコントローラーと選択したサプライヤーからの試薬を使用します。各液滴内の核を溶解し、RNAを逆転写します。
注:液滴内では、得られたすべてのcDNAが同じ細胞バーコードを共有していました。 - 選択したサプライヤーからのガイドラインに従ってsnRNA-seq用のライブラリを準備し、シーケンシングプラットフォームとの互換性を確保します。電気泳動、蛍光測定、またはqPCRベースの方法を使用して最終ライブラリの品質と濃度を確認し、該当する場合は、シーケンシングの前にそれらを等モルプールします。
- プールされた3 ̹遺伝子発現ライブラリを変性させ、メーカーの推奨に従って希釈します。
- ペアエンド、シングルまたはデュアルインデックスシーケンシングを、セルあたり50,000リードペアのシーケンシング深度を持つ次世代シーケンシングプラットフォームで実行します。
結果
ここで提示されるプロトコルは、snRNA-seqを実行するためにDGから単離された非ニューロン単一核の懸濁液を調製する方法を記載している。FANSの有無にかかわらず、バイオインフォマティクスクラスタリングにより、DG内の既知の細胞タイプに対応する核のグループが十分に分離されていることが明らかになりました(図2E、F)。FACSで選別されていないサンプル内では、配列決定された高品質の核の大部分は3つのニューロングループで構成されていました(このサンプルの全核の84.9%、図2E、G、H)。DGにおいて最も代表される細胞集団が顆粒ニューロン、他の興奮性ニューロン(標識興奮性ニューロン)、および抑制性ニューロン10であることを考慮すると、このような結果が期待される。同定された非ニューロンクラスターは、主にアストロサイト、オリゴデンドロサイト、オリゴデンドロサイト前駆細胞(OPC)、免疫細胞(3.3%)、カハールレツィウス細胞(0.6%)などのグリア細胞型(11.1%)で構成されていました。NeuN陽性集団を除外するためにFANSを実行する場合(NeuN陰性FACSソートサンプル;図2F,G,H)では、グリア細胞のクラスターが優勢となった(81.3%)。より多くのグリア核を単離することで、ファンなしでクラスター化するさまざまな集団のより良いセグメンテーションが可能になります。実際、NSCまたはアストロサイトで発現する特定の遺伝子を再クラスタリングして分析すると、4つのサブクラスターが分離しました(補足図2A、B)。より特異的な細胞マーカーを調べ、細胞タイプ全体の遺伝子発現レベルを評価すると、HopsおよびNotch2の発現が高く、Aldh1a1またはAqp4の発現がほとんどない主要な星状細胞集団とは別に分離するNSCの小さなクラスターが検出されました(補足図2C)。ただし、アストロサイトとNSCの間で遺伝子発現が重複しているため、さまざまなサブタイプの細胞を特異的にプロファイリングして特定するには、さらなる分析が必要になります。さらに、NeuN陰性FANSサンプルには、細胞特異的マーカーの発現について相互参照した場合、内皮細胞、周皮細胞、および血管軟髄膜細胞を含む血管細胞(2.3%)として標識された追加のクラスターがありました(データ示さず)。
シーケンシング用のライブラリを生成するために選択されたプロトコルのガイダンスに従って、FANSの有無にかかわらず高品質の発現プロファイルが取得されました。50,000リード/核で配列決定されたサンプルでは、低品質の核を除外した後、FACSでソートされていないサンプルでは核あたり平均2,510個の遺伝子(5,578転写物、図2H)、NeuN陰性FANSサンプルでは1,665.5遺伝子(3,508転写物)が検出されました(図2H、I)。これらの指標は、このプロトコルが、異なるアプローチを用いた研究に匹敵する単一核の高品質のトランスクリプトームプロファイリングを生成し22,23、FACSソーティングのプロセスがその後のsnRNA-seqの核に損傷を与えないことを確認しています。特に、2つのサンプル間の核あたりの遺伝子数と転写物数の違いは、データ品質が低いためではなく、すべての非神経細胞タイプ(1,090遺伝子/核および1,785 転写物/核、図2I)。
まとめると、これらの代表的な結果は、FANSを用いたNeuN陰性核の選択が、新たに解剖された脳組織から低存在量の細胞タイプを単離し、snRNA-seq法 を介して これらの異なる細胞集団の高品質の単一核トランスクリプトームプロファイリングを実行するための強力なツールであることを示しています。
補足図1:FANSの免疫染色の検証。 核懸濁液を(A)陰性対照として抗NeuN-AF 488抗体なしで、または(B)抗体と共にインキュベートし、FACSソーターを通過させて免疫染色条件を検証した。 このファイルをダウンロードするには、ここをクリックしてください。
補足図2:アストロサイトクラスターの遺伝子発現解析と再クラスタリング。 (A) 図2Fのゲノムワイド発現プロファイルに基づく4968核のクラスタリングを示す、次元縮小のための一様多様体近似および投影(UMAP)プロット。細胞型呼び出しは、細胞型マーカーに基づいて行われた。(B)潜在的な細胞サブタイプを調査するためのさらなるサブセット化のために、(A)から選択された2579個の核で構成されるアストロサイトクラスター。Seurat (0-3) クラスタリングによって 4 つのサブタイプが検出され、異なる色で示されました。(C)4つの細胞型にわたる特定の細胞マーカーの遺伝子発現レベル。全てのプロットは、スーラRパッケージ24を用いて得られた。簡単に説明すると、RNA-seqカウントは、各細胞について総発現量で正規化され、スケールファクター(10,000)を掛けた。この結果は、ログ変換されました。変換された値は、UMAPが適用されて埋め込みを計算する前に、各セル内でスケーリングされ(分散が1にスケーリングされ)、中央に配置され(平均がゼロに設定)、x軸とy軸の値として使用されました。グラフは、2D 散布図上の次元削減手法の出力を表し、各ポイントは、削減手法によって決定されたセル埋め込みに基づいて、それぞれの x 座標と y 座標を持つセルを表します。類似の遺伝子シグネチャを有する細胞は、埋め込みによって互いに近接して配置される。 このファイルをダウンロードするには、ここをクリックしてください。
補足図3:神経原性系統におけるNeuNの遺伝子発現解析。 (A)公開データセット15からの神経原性系統のクラスタリングを示すUMAPプロット。UMAPは補足 図2のように生成されました。(B)アストロサイト(アクアポリン4 = Aqp4)、NSC(ホメオドメインのみのタンパク質= Hopx)、NeuN/Rbfox3(NSCおよび中間前駆細胞[IPC])、およびサイクリング細胞(サイクリン依存性キナーゼ6 = Cdk6)を示す神経原性系統にわたる特定の細胞マーカーの遺伝子発現レベル。 このファイルをダウンロードするには、ここをクリックしてください。
補足表1:研究で使用された培地とバッファーの組成。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
このプロトコルを正常に実行するには、DGの解剖が最初の重要なステップであり、損傷を受けないようにし、周囲の組織からの汚染を制限するための練習が必要です。経験から、海馬からのDGの分離は、解剖の速さを高め、組織の鮮度を改善して高品質のデータを生成するための技術の改良に取り組む熟練した研究者によって非常に迅速に取得できました。同様に、単一核の調製と再懸濁には、単一の実験で使用されるさまざまな条件にわたる一貫性が必要ですが、シーケンシング結果にバイアスをかける周囲RNAを放出する核膜を破壊する可能性のある過度のピペッティングの回避も必要です。高品質の核を調製するための前述の推奨事項に加えて、シーケンシングを進める前に、単一核懸濁液の濃度も考慮する必要があります。実際、メーカーのガイドラインによると、1,200 nuc/μLを超える濃度の調製物は、このレベルの核濃度が下流のバイオインフォマティクス分析に影響を与えるマルチプレットを形成するリスクが高いため、希釈する必要があります。注目すべきは、核濃度が500 nuc/μL未満のサンプルのシーケンシングは、コストがかかるため価値がない可能性があります。また、上級FACSユーザーのアドバイスに従って、すべてのゲーティングを設定し、サンプルと生物学的複製全体の設定との一貫性を保つことをお勧めします。同様に、RNAシーケンシング用のライブラリの準備には、高品質の結果を達成するためのトレーニングが必要であり、ほとんどのベンダーはこれを効率的に達成するための優れたサポートを提供しています。この方法は、この研究では新鮮な組織でのみテストされました。しかしながら、FANSは凍結組織25を用いても行われている。したがって、このプロトコルは、わずかな最適化ではありますが、凍結組織で実行できると仮定するのが合理的です。
このプロトコルは、海馬の神経原性ニッチ内のニューロン以外の細胞集団を調査するという特定のダウンストリームアプリケーションを念頭に置いて開発されました。実際、加齢におけるAHNの障害は、ニッチ1,2,3,9内の周囲の細胞に起因する可能性があることを示す証拠が増えています。特に、星状細胞と希突起膠細胞はAHNの重要な調節因子として出現します。しかし、RNAシーケンシングと組み合わせたDGからの単離は、さまざまな結果を生み出しており、この仮説をこの手法で評価することは困難です1,17。FACSソーティングのNeuN陰性核のこのアプローチにより、FACSソーティングされていないサンプルと比較して、より多くのアストロサイトと希突起膠細胞の分離が可能になり、より良いバイオインフォマティクス分析が可能になります。このプロトコルは、生涯にわたってすべての年齢に適用可能であり、ここに提示された老齢動物の組織に関する代表的なデータは、この方法が老化した海馬の神経原性ニッチを調査するために堅牢であるという概念実証を提供します。この方法の使用を拡大し、さまざまな生物学的問題に適応させるには、これらのマーカーに対して最もよく検証された抗体の徹底的な滴定とともに、他のニューロン核膜抗原をテストできることを考慮することが重要です。例えば、DGのNSCからの神経分化過程を研究する場合、2型細胞や神経芽細胞などの一部の細胞型はNeuNを発現し始めます(補足図3)。したがって、これらの細胞型を特異的に調査するには、別の抗原が必要になります。逆に、NeuN陰性FACSソーティング後も、おそらくこれらの集団におけるNeuNの発現が低いかまったくないため、一部のニューロンが同定されました(例:.、皮質カハール-レツィウスニューロン19)。さらに、NeuNは希突起膠細胞の亜集団で発現することが報告されており26、これらの亜集団が関心事である場合、偏った結果をもたらす可能性があります。したがって、FANSの使用を開始する際の抗原の選択は、特定の生物学的質問に対する正確な答えを妨げる細胞集団の包含または除外を避けるために慎重に検討する必要があります。これに同意して、このプロトコルでテストされた仮説を検証または反論する前に、各シーケンシング結果を直交アッセイ(免疫組織化学やRNAスコープなど)によってさらに検証することも推奨されます。最後に、FANSを含むステップをさらに開発して、所望の細胞集団を除外および/または含めるためのより精巧な選別戦略を備えた複数の抗体を含めることができます。
最終的に、このプロトコルに記載されている技術は、他の種と一緒に使用するといくつかの制限がある可能性があります。たとえば、ニッチは、増殖性および静止性のNSCまたはDGの特定のサブ領域内で制限された新生児ニューロンが存在するげっ歯類で非常によく定義されていますが、海馬の神経原性ニッチが他の種でどのように描写されるべきかはまだ明らかではありません。実際、増殖細胞は、非ヒト霊長類およびヒトではDGの連続ゾーン内に整列しているのではなく、DGの周りに散在しており、扁桃体にも存在する可能性があります7。したがって、他の種のDGよりも広い領域を解剖して分離することは、このプロトコルの使用に影響を与える可能性があります。特に、組織調製のための解離および粉砕ステップは、より大きな組織片を扱う際に最適化される必要があるであろう27、28。バイオインフォマティクス解析に関しては、近交系の飼育されたげっ歯類は非常に均質で非常によく注釈されたゲノムを持っていますが、ヒトゲノムの遺伝的多様性と、異なる細胞集団(NSCや星状細胞など)を明確に区別するための不十分な数の細胞マーカーを組み合わせると、分析のために多くの正規化が必要であり、細胞の小さなクラスターが特定された場合に異なる結論につながる可能性があります7。11.このような状況では、細胞濃縮が依然として好ましい選択肢であるか、分析能力を高めるために他の戦略と一緒に使用する必要があります。
それにもかかわらず、現在のアプローチは、AHNの調節における潜在的に重要な細胞集団ではあるが、十分に研究されていない細胞集団の役割の調査を可能にすることができる。これは特に、神経変性疾患の発症と進行に中心的な役割を果たす星状細胞の集団に当てはまる可能性があります29,30。この研究は、アストロサイトやその他の希少細胞集団が、DG内に存在するニューロンの大部分を除外するだけで識別およびプロファイリングできることを示しました。異なるアプローチを用いた他の研究では、同じ範囲の細胞集団から核の同様の回収を達成することができなかった5、11、17。さらに、この研究の結果は、このアプローチを使用して、この細胞集団の特異的濃縮なしにNSCクラスターを単離することが可能であることを実証しています15。
結論として、この方法に従い、改善することは、AHNの調節に対する海馬神経原性ニッチの文脈的役割に関連する未解決の問題に対処するための一歩前進となるでしょう。特に、AHN9の調節に関連する細胞集団における高齢および罹患した脳における遺伝子発現レベルに関する新しい洞察をもたらし、NSCの 潜在的な不均一性1の特定をサポートし、またはAHNにおける血管系の役割に対処する可能性があります。最終的に、この方法は、同様の質問や問題を持つ他の成体幹細胞ニッチに適用することができます。
開示事項
SG、TL、およびSKは、米国ニュージャージー州ラーウェイにあるMerck & Co., Inc.の子会社であるMerck Sharp & Dohme LLCの従業員であり、米国およびカナダ以外ではMSDとして知られています。SGはMerck & Co., Inc.(米国ニュージャージー州Rahway)の株主です。
謝辞
著者らは、技術サポートを提供してくれたLachlan HarrisとPiero Rigo、原稿に関するフィードバックを提供してくれたJason M. UslanerとDitte Lovattに感謝したいと思います。この研究は、MRCからの助成金支援と、Cancer Research UK(FC0010089)、UK Medical Research Council(FC0010089)、Wellcome Trust(FC0010089)、およびWellcome Trust Investigator Award(106187/Z/14/Z)から資金提供を受けているMSD、Francis Crick Instituteとの競争前の研究協力によって支援されました。スペース不足のために議論や引用ができなかった多くの著者にお詫び申し上げます。
資料
| Name | Company | Catalog Number | Comments |
| 0.5ml microtube | Eppendorf | 30124537 | |
| 10.00µm Flouresbrite YG Carboxylate Microspheres | Polysciences | 15700-10 | |
| 15 mL polypropylene centrifuge tubes | Corning | 430052 | |
| 2 pairs of sterile Dumont #5 forceps | Fine Science Tools | 11252-30 | |
| 4′,6-diamidino-2-phenylindole (DAPI) | Sigma Aldrich | D9564-10MG | |
| 4150 TapeStation System | Agilent | N/A | |
| 5 mL round bottom high clarity polypropylene test tube with snap cap | Falcon | 352063 | |
| 5 mL round bottom polystyrene test tube with cell strainer snap cap | Falcon | 352235 | |
| 50 mL polypropylene centrifuge tubes | Corning | 430829 | |
| 70 µm cell strainer | Falcon | 352350 | |
| 8 peak SPHERO Rainbow Calibration Particles | BD Biosciences | RCP-30-5A | |
| Accudrop Beads | BD Biosciences | N/A | |
| Allegra X-30R Centrifuge | Beckman Coulter | N/A | |
| Anti-NeuN antibody, clone A60, Alexa Fluor 488 conjugated | Millipore | MAB377X | |
| BD FACSAria Fusion Flow Cytometer | BD Biosciences | N/A | |
| Beckman Coulter MoFlo XDP | Beckman Coulter | N/A | |
| Chromium Controller | 10x Genomics | N/A | |
| Chromium Next GEM Single Cell 3' Reagent Kits v3.1 | 10x Genomics | PN-1000121; PN-1000120; PN-1000213 | |
| BSA 7.5% | Gibco | 15260037 | |
| Dithiothreitol (DTT) | Thermo Scientific | R0861 | |
| Dounce tissue grinder set: mortar, loose pestle (A) and tight pestle (B) | KIMBLE | D8938-1SET | |
| Eppendorf Tubes Protein LoBind 1.5ml | Eppendorf | 30108116 | |
| Halt, 100x Protease inhibitor | ThermoFisher | 78429 | |
| HiSeq 4000 Sequencing System | Illumina | N/A | Sequencing configuration: 28-8-0-91 |
| KCl | Any chemical supplier | Laboratory made | |
| LUNA-FX7 Automated Cell counter | Logos Biosystems | N/A | |
| MgCl2 | Any chemical supplier | Laboratory made | |
| N°10 guarded sterile disposable scalpels | Swann-Morton | 6601 | |
| Nuclease-free water | Sigma Aldrich | W4502-1L | |
| Pair of sterile student surgical scissors | Fine Science Tools | 91401-12 | |
| PBS | Any chemical supplier | Laboratory made | |
| RNase Inhibitor 40 U µl-1 | Ambion | AM2684 | |
| RNasin 40 U µl-1 | Promega | N211A | |
| Sterile Petri dish | Corning | 430167 | |
| Sucrose | Sigma Aldrich | 59378-500G | |
| Tris buffer, pH 8.0 | Any chemical supplier | Laboratory made | |
| Triton X-100 10% (v/v) | Sigma Aldrich | T8787-250ML | |
| Trypan blue | Invitrogen | T10282 |
参考文献
- Gillotin, S. Targeting impaired adult hippocampal neurogenesis in ageing leveraging intrinsic mechanisms regulating neural stem cell activity. Ageing Research Reviews. 71, 101447(2021).
- Urban, N., Blomfield, I. M., Guillemot, F. Quiescence of adult mammalian neural stem cells: A highly regulated rest. Neuron. 104 (5), 834-848 (2019).
- Hanspal, M. A., Gillotin, S. A new age in understanding adult hippocampal neurogenesis in Alzheimer's disease. Neural Regeneration Research. 17 (12), 2615-2618 (2022).
- Zhang, H., et al. Single-nucleus transcriptomic landscape of primate hippocampal aging. Protein & Cell. 12 (9), 695-716 (2021).
- Franjic, D., et al. Transcriptomic taxonomy and neurogenic trajectories of adult human, macaque, and pig hippocampal and entorhinal cells. Neuron. 110 (3), 452-469 (2022).
- Moreno-Jimenez, E. P., Terreros-Roncal, J., Flor-Garcia, M., Rabano, A., Llorens-Martin, M. Evidences for adult hippocampal neurogenesis in humans. Journal of Neuroscience. 41 (12), 2541-2553 (2021).
- Sorrells, S. F., et al. Positive controls in adults and children support that very few, if any, new neurons are born in the adult human hippocampus. Journal of Neuroscience. 41 (12), 2554-2565 (2021).
- Zhou, Y., et al. Molecular landscapes of human hippocampal immature neurons across lifespan. Nature. 607, 527-533 (2022).
- Bonafina, A., Paratcha, G., Ledda, F. Deciphering new players in the neurogenic adult hippocampal niche. Frontiers in Cell and Developmental Biology. 8, 548(2020).
- Amaral, D. G., Scharfman, H. E., Lavenex, P. The dentate gyrus: fundamental neuroanatomical organization (dentate gyrus for dummies). Progress in Brain Research. 163, 3-22 (2007).
- Habib, N., et al. Massively parallel single-nucleus RNA-seq with DroNc-seq. Nature Methods. 14 (10), 955-958 (2017).
- Flor-Garcia, M., et al. Unraveling human adult hippocampal neurogenesis. Nature Protocols. 15 (2), 668-693 (2020).
- Moreno-Jimenez, E. P., et al. Adult hippocampal neurogenesis is abundant in neurologically healthy subjects and drops sharply in patients with Alzheimer's disease. Nature Medicine. 25 (4), 554-560 (2019).
- Kalinina, A., Lagace, D. Single-cell and single-nucleus RNAseq analysis of adult neurogenesis. Cells. 11 (10), 1633(2022).
- Harris, L., et al. Coordinated changes in cellular behavior ensure the lifelong maintenance of the hippocampal stem cell population. Cell Stem Cell. 28 (5), 863-876 (2021).
- Shin, J., et al. Single-cell RNA-seq with Waterfall reveals molecular cascades underlying adult neurogenesis. Cell Stem Cell. 17 (3), 360-372 (2015).
- Artegiani, B., et al. A single-cell RNA sequencing study reveals cellular and molecular dynamics of the hippocampal neurogenic niche. Cell Reports. 21 (11), 3271-3284 (2017).
- Nott, A., Schlachetzki, J. C. M., Fixsen, B. R., Glass, C. K. Nuclei isolation of multiple brain cell types for omics interrogation. Nature Protocols. 16 (3), 1629-1646 (2021).
- Sarnat, H. B., Nochlin, D., Born, D. E. Neuronal nuclear antigen (NeuN): a marker of neuronal maturation in early human fetal nervous system. Brain Development. 20 (2), 88-94 (1998).
- Guidance on the Operation of ASPA. , Available from: https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_dat/file/662364/Guidance_on_the_Operation_of_ASPA.pdf (2022).
- Hagihara, H., Toyama, K., Yamasaki, N., Miyakawa, T. Dissection of hippocampal dentate gyrus from adult mouse. Journal of Visualized Experiments. (33), e1543(2009).
- Habib, N., et al. Disease-associated astrocytes in Alzheimer's disease and aging. Nature Neuroscience. 23 (6), 701-706 (2020).
- Ding, J., et al. Systematic comparison of single-cell and single-nucleus RNA-sequencing methods. Nature Biotechnology. 38 (6), 737-746 (2020).
- Hao, Y., et al. Integrated analysis of multimodal single-cell data. Cell. 184 (13), 3573-3587 (2021).
- Mussa, Z., Tome-Garcia, J., Jiang, Y., Akbarian, S., Tsankova, N. M. Isolation of adult human astrocyte populations from fresh-frozen cortex using fluorescence-activated nuclei sorting. Journal of Visualized Experiments. (170), e62405(2021).
- Zhang, Y., et al. An RNA-sequencing transcriptome and splicing database of glia, neurons, and vascular cells of the cerebral cortex. Journal of Neuroscience. 34 (36), 11929-11947 (2014).
- Marti-Mengual, U., Varea, E., Crespo, C., Blasco-Ibanez, J. M., Nacher, J. Cells expressing markers of immature neurons in the amygdala of adult humans. European Journal of Neuroscience. 37 (1), 10-22 (2013).
- Zhang, X. M., et al. Doublecortin-expressing cells persist in the associative cerebral cortex and amygdala in aged nonhuman primates. Frontiers in Neuroanatomy. 3, 17(2009).
- Ding, Z. B., et al. Astrocytes: a double-edged sword in neurodegenerative diseases. Neural Regeneration Research. 16 (9), 1702-1710 (2021).
- Phatnani, H., Maniatis, T. Astrocytes in neurodegenerative disease. Cold Spring Harbor Perspectives in Biology. 7 (6), 020628(2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved