Method Article
腸内細菌叢-神経系軸を研究するためのGut-on-a-chipモデル
要約
neuroHuMiXは、近位および代表的な共培養条件下での細菌、上皮細胞、および神経細胞の相互作用を研究するための高度なガットオンチップモデルです。このモデルにより、腸内細菌叢と神経系の間のコミュニケーションの根底にある分子メカニズムを解明することができます。
要約
人体は、ヒト細胞で構成されているのと少なくとも同じ数の微生物細胞によってコロニーを形成しており、これらの微生物のほとんどは腸内にあります。腸内細菌叢と宿主の相互作用は広く研究されていますが、腸内細菌叢が腸内神経系とどのように相互作用するかはほとんどわかっていません。これまでのところ、腸内細菌叢と神経系の相互作用を研究するための生理学的に代表的な in vitro モデルは存在しません。
このギャップを埋めるために、人工多能性幹細胞由来の腸管ニューロンをデバイスに導入することにより、ヒト-微生物クロストーク(HuMiX)腸オンチップモデルをさらに開発しました。その結果、モデル「neuroHuMiX」は、半透膜で分離されたマイクロ流体チャネル全体で、細菌、上皮細胞、神経細胞の共培養を可能にします。異なる細胞タイプが分離されているにもかかわらず、細胞は可溶性因子を介して互いにコミュニケーションをとることができ、同時に各セルタイプを別々に研究する機会を提供します。このセットアップにより、腸内細菌叢が腸内神経細胞にどのような影響を与えるかについての最初の洞察が可能になります。これは、ヒトの腸内細菌叢と神経系の軸を研究し、理解するための重要な第一歩です。
概要
ヒトの腸内細菌叢は、ヒトの健康と病気に重要な役割を果たしています。過去10年半にわたって広く研究され、健康と病気の調節におけるその潜在的な役割が現在確立されています1。マイクロバイオームの破壊は、不均衡な微生物群集(嚥下障害)を引き起こし、肥満、炎症性腸疾患、結腸直腸癌などの多くの慢性疾患、さらにはパーキンソン病などの神経変性疾患の病因に関与していると仮定されています2,3。
ヒトの腸内細菌叢は神経疾患と関連していますが、腸内細菌叢が腸内神経系とどのようにコミュニケーションを取り、影響を与えるかはまだ不明です。ヒトの腸神経系は、すぐに研究できる場所ではないため、これまで実験では動物モデルが用いられてきました4。しかし、動物モデルとヒト5の明らかな違いを考えると、ヒトの腸を模倣したin vitroモデルの開発は、当面の関心事である。このような状況の中、ヒト人工多能性幹細胞(iPS細胞)の分野が急成長し、進歩することで、代表的な腸ニューロン(EN)を得ることができました6。iPS細胞由来のENは、細胞培養インサート、オルガノイド、Organs-on-a-chipなどのin vitro培養モデルにおける腸管神経系の研究を可能にします7,8。
ヒト-微生物クロストーク(HuMiX)モデルは、ヒトの腸を模倣したガット・オン・チップ・モデルである9。初期のHuMiXモデル(以下、初期装置と呼ぶ)は、上皮細胞(Caco-2)および細菌細胞10,11を収容した。しかし、腸内細菌叢と神経系のつながりを研究するために、iPS細胞由来のEN6もシステムに導入されています(図1)。神経細胞、上皮細胞、細菌細胞の近位共培養により、異なる細胞タイプを個別に分析し、ヒトの腸を模倣した環境で異なる細胞タイプ間の相互作用を研究することができます。
近年、Organs-on-a-chip(例えば、Gut-on-a-chip)モデルを用いて、より生理学的に代表的な方法で臓器を研究するモデルの開発が進んでいます。これらのモデルは、絶え間ない栄養素の供給と老廃物の除去、および酸素レベルやバリアの完全性などのリアルタイムモニタリングにより、人間の腸内環境をより代表しています8,12。これらのモデルは、特に宿主細胞に対する腸内細菌の影響の研究を可能にします。しかし、Organ-on-a-chipを使用して腸内細菌叢と神経系の相互関係を研究できるようにするには、神経細胞をそのようなシステムに統合する必要があります。そこで、HuMiXをさらに発展させ、neuroHuMiXシステム(以下、本デバイス)を確立する目的は、腸管上皮細胞や細菌と近位共培養する腸管神経細胞を含む腸管チップモデルの開発でした。
プロトコル
1. 細胞培養と選別
- 人工多能性幹細胞由来腸ニューロン
注:iPS細胞を培養するのは、実行開始の6週間前です。ENの分化プロトコルは、Fattahiらから採用されています6。- 1%ペニシリン-ストレプトマイシン(P/S)を添加したiPS細胞培養培地2mL/ウェルで、マトリックスゲルコーティングされた6ウェルプレート上でiPS細胞を培養します。
- 80%〜90%のコンフルエントで、細胞を継代し、同じ培地を使用してマトリックスゲルコーティングプレートに播種し、37°C、5%CO2、および90%相対湿度(RH)でインキュベートします。
- iPS細胞誘導では、融解後2継代後、80%〜90%のコンフルエントで、マトリックスゲルでコーティングされた6ウェルプレートに100,000細胞/ウェルの密度で細胞を播種します。上記の培地+ROCK阻害剤Y-27632(1:2,000)中で37°Cで24時間インキュベートします。
- 24時間後、 表1に従って、上清培地をDay 0培地と交換します。誘導プロセスの細胞選別中にネガティブコントロールとして使用するコントロールウェルを 1 つ含めます。導出期間全体にわたって、0日目のメディア構成でコントロールを適切に維持します。 表1に従って、2日目から10日目まで1日おきに培地を交換します。
- 11日目に、このプロトコルの次のステップで使用されるCD49d陽性細胞の細胞をソートします。
- CD49d陽性細胞に基づいて選別する細胞とコントロールウェルをプールします。細胞を300 × gで3分間遠心分離します。細胞ペレットを2%ウシ血清アルブミン(BSA)+ 1%P/Sの1xリン酸緩衝生理食塩水(PBS)に再懸濁します。
- 各細胞ロット(プールおよびコントロール)を2つに分け、1つの画分を抗ヒトCD49d抗体で染色し、もう1つの画分をアイソタイプコントロール抗体で染色します。
- メイン細胞集団をゲートし、次に単一細胞をゲートし、それに基づいて表面にCD49dを示す細胞が選択されます。これらの細胞を回収し、分化の次のステップに役立てます。
注:通常、選別された細胞の30%〜40%がCD49d陽性です。
- 選別した細胞のうち2〜400万個を、N2B27培地( 表2を参照)+ FGF2 + CHIR中の超低接着プレートの6ウェルプレート1枚に4日間移し、スフェロイド形成を可能にします。
- 15日目に、GDNFおよびアスコルビン酸(AA)を含むN2B27培地の2 mL/ウェルにポリL-オルニチン/ラミニン/フィブロネクチン(P/L/F)でコーティングされた6ウェルプレートにスフェロイドを再播種します。2〜3日ごとに培地を交換してください。
注:コーティング比:ポリL-オルニチン、15 μg/mL;ラミニン、2 μg/mL;フィブロネクチン、2 μg/mL in 1x PBS。 - 3週間後、装置内で接種するために細胞を使用する。
- Caco-2 (カコ 2)
注:Caco-2細胞は、実行の少なくとも1週間前に解凍してください。- T75フラスコに1×10個の6個の Caco-2細胞をRPMI 1640グルタミンサプリメント+ HEPES + 10%ウシ胎児血清(FBS)に播種します。37°C、5%CO2、90%RHでインキュベートします。
注:これらの実験では、融解後の1回目または2回目の継代でCaco-2を使用するのが理想的です。
- T75フラスコに1×10個の6個の Caco-2細胞をRPMI 1640グルタミンサプリメント+ HEPES + 10%ウシ胎児血清(FBS)に播種します。37°C、5%CO2、90%RHでインキュベートします。
2. HuMiXの実行準備
- ポリカーボネート製の蓋の準備とコーティング
- 一対のポリカーボネート(PC)蓋(図2)と4本のネジを、デバイス機器の初期サイクルを使用してオートクレーブします(詳細については、 表3 を参照)。
- バイオセーフティキャビネットで、PCの底部の蓋の四隅に4本のネジを挿入し( 図3を参照)、滅菌済みの正方形のペトリ皿に移して2段階のコーティングプロセスを行います。
- 1日目に、PBSに1.5%ポリL-オルニチン(1個)2 mLをPCの蓋の中央に加えます。37°C、5%CO2、90%RHで一晩インキュベートします。
- 翌日、溶液を取り出し、PBS(1x)に0.2%のラミニンと0.2%のフィブロネクチンを含む溶液と交換して、神経細胞室の表面を覆います。蓋を37°C、5%CO2、90%RHで一晩インキュベートします。
- インキュベーション後、コーティング液をPCの蓋に残し、シャーレをシーリングフィルムで閉じます。使用するまで保管するために4°Cに置いてください。
- 使用前にコーティング液を取り除き、コーティングが完全に乾くまでバイオセーフティキャビネットで30分間風乾します。
- ガスケットの準備とコーティング
注意: このセクションでは、半透膜をシリコンガスケットに貼り付けてガスケットを準備する方法について説明します。最初のオートクレーブステップの後、ガスケットはコラーゲンまたはムチンでコーティングされ、腸上皮細胞または細菌の接着を可能にします。ムチンでコーティングされた膜は、人間の腸内に存在する粘液バリアを模倣しています。- 孔径1μmのポリカーボネートメンブレンをコラーゲンガスケットに、孔径50nmのポリカーボネートメンブレンを下部と上部のサンドイッチガスケットの間に取り付けます。メンブレンを取り付けた状態でガスケットをオートクレーブするには、デバイス装置の初期サイクルを使用します( 表3を参照)。
- メンブレンをコーティングするには、各ガスケットを滅菌済みの正方形の皿に入れます。
注:コーティングは、バイオセーフティキャビネット内の無菌状態で行われます。- コラーゲンガスケットについては、3 mLのコラーゲン(50 μg/mL)をメンブレンに加え、37°Cで3時間インキュベートします。
注:コラーゲンを添加するときは、メンブレンを傷つけないように、ピペットチップでメンブレンに触れないように注意してください。 - ムチンコーティングの場合は、上部ガスケット側を上にしてサンドイッチガスケットをペトリ皿に入れ、メンブレンの上面を3 mL(0.025 mg/mL)のムチンでコーティングします。ガスケットを37°Cで1時間インキュベートします。
- コラーゲンガスケットについては、3 mLのコラーゲン(50 μg/mL)をメンブレンに加え、37°Cで3時間インキュベートします。
- インキュベーション時間後、コラーゲン溶液とムチン溶液をそれぞれのガスケットから吸引し、バイオセーフティキャビネットでメンブレンを30分間風乾します。皿を閉じ、実験室のシーリングフィルムで密封し、使用するまでガスケットを4°Cで保管します。
- チューブアセンブリ
注意: このセクションでは、デバイスの灌流用のチューブを組み立てる方法について説明します。組み立てる前に、すべての部品をオートクレーブするか、滅菌パッケージに個別に梱包されている部品を購入してください。すべてのコンポーネントをバイオセーフティキャビネットに入れます。- 各デバイスおよび各チューブラインに3本のチューブライン、ポンプチューブライン1本、長いMarpreneチューブ(20 cm)2本、短いMarpreneチューブ(8 cm)2本、流出ボトル用の40 mm針1本、250 mLの流入ボトル用の120 mm針1本、または小型の流入ボトル用の80 mm針を使用します。 3つのオスと7つのメスのルアー-バーブコネクタ、3つのルアーアダプター、および2つの3方向活栓バルブ。
- 上記のオートクレーブ滅菌済みコンポーネントを使用して、チューブラインを左から右に組み立てます(図4)。
注意: 各接続ステップの間に、各コンポーネントに70%エタノールをスプレーします。
- 培地調製
注:このセクションでは、デバイス内のさまざまな細胞タイプに合わせて培地を調製する方法と、培地を無菌状態で血清ボトルに移す方法について説明します。- RPMI 1640 に 10% 0.22 μm ろ過した熱不活化 FBS を添加します。N2B27 メディアに GDNF と AA を新たに補充します。
- 培地を無菌条件下で血清ボトルに移します。200 mL の RPMI 1640 培地を 250 mL のボトルに、30 mL の N2B27 培地を 50 mL のボトルに移します。
- 細菌培地(RPMI 1640 + 10% FBS + 5% De Man、Rogosa、およびShapre培地[MRS])は、実験の最後の24時間にのみ必要であるため、後の段階で調製します。
- セプタムでボトルを閉じ、アルミニウム圧着し、オートクレーブします。
- メディアを移送するには、適切なデキャッパー(直径 = 20 mm)を使用してアルミニウム圧着を取り外します。セプタムも取り外します。準備した培地をボトルに触れずに美容液ボトルに慎重に注ぎます。
- 滅菌するには、ポータブルブンゼンバーナーを使用してボトルの開口部を炎上させます。セプタムに70%エタノールをスプレーし、ボトルに追加し、シールクリンパーを使用してアルミニウム圧着で閉じて、ボトルを密封します。
- 密閉したボトルを37°C、5%CO2 のインキュベーターに24時間入れて培地を37°Cに温め、メディアボトルをデバイスに使用する前に、目に見える汚染の兆候がないことを確認します。
3. HuMiXの起動
- NeuroHuMiXアセンブリ
メモ: 本項では、デバイスの組み立て方法について説明します。要するに、クランプシステムは滅菌され、締め直され、その後、PCの底蓋がクランプのベースに置かれます。次に、コーティングされたガスケットとPCの上部の蓋を積み重ね、続いてクランプの上部を積み重ねます。最後に、クランプを締めてガスケットを圧縮し、システムを漏れのない気密にします。 図4 は、組み立てに必要なさまざまな部品を示しています。- 組み立てる前に、クランプと2つのPC蓋(上部と下部)をオートクレーブします。
- クランプの上部と下部の組み立てに使用するネジを締めます(図4C、D)。オートクレーブプロセスの前にネジを開き、後で締め直します。
- コーティングして乾燥させた(ステップ2.2.3)下部のPC蓋(図4 A1)を正方形のペトリ皿から、PC蓋の角にある4本のネジを握ってクランプベースの上部に移します。
注意: 汚染のリスクを減らすために、PCの蓋に触れないでください。 - 滅菌ピンセットを使用して、上皮チャンバーガスケットを上に向けて(つまり、 メンブレンを上にして)PCの蓋の上に置きます。ネジを使用してガスケットとPCの蓋の位置を合わせ、蓋の角にある入口ポートと出口ポートがガスケットの開口部に合っていることを確認します(図3)。
- 滅菌ピンセットを使用して、サンドイッチガスケットをコラーゲンガスケットの上に置き、上面を上にします。
- PCの上部の蓋をサンドイッチガスケットの上に置きます。汚染のリスクを減らすために、蓋の端にのみ触れてこれを行ってください(蓋の上部または下部には触れないでください)。クランプカバーのバーブがメンブレンアセンブリの入口と出口の開口部に合っていること、および下部のPC蓋のネジが上部PCの蓋の開口部に収まっていることを確認します。
- デバイスを閉じるには、クランプ蓋(クランプの上部)をPCの蓋の上に置きます。蓋の開口部が、PCの上部の蓋の入口と出口のバーブと一致していることを確認します。ラッチを閉じます。閉じたデバイス(図5)をボンネットの下に置いて、プライミングされたチューブラインに接続します(手順3.2.6)。
- チューブラインのプライミング
注意: このセクションでは、チューブをインボトルとアウトフローボトル、およびポンプに接続し、その後チューブを培地でプライミングして、洗浄および滅菌中に使用された残留生成物を除去し、チューブ内に気泡が存在しないことを確認する方法について説明します。- チューブラインのプライミングは、バイオセーフティキャビネットで行われます。フィルター付きの曝気ニードルを各流入ボトルと流出ボトルのセプタムに挿入します。清潔で滅菌済みのピンセットを使用して、120 mmの針を250 mLの血清ボトルに挿入します。80 mmの針を50 mLの血清ボトルに挿入します。
- 各チューブラインの端にある40 mmのニードルを流出血清ボトルに挿入します。デバイスごとに、3つのチューブラインに2つの排出ボトルがあります。上皮チューブラインとニューロンチューブラインの40mm針は、培地廃棄のために同じ排出ボトルに接続されています。バクテリアチューブラインは、2番目の流出ボトルに送られます。
- ポンプチューブラインをポンプカセットに挿入します。チューブラインの三方活栓がすべて開いていることを確認します。
- 最初に、蠕動ポンプをセットして、流入した媒体を5rpmの速度で流出ボトルに導きます( 表4を参照)。
注:チューブラインのプライミング中は、速度を最大10 rpmまで上げてプロセスを加速できます。 - スタートボタンを押してポンプを始動し、ポンプ動作の方向が時計回りであることを確認します。メディアが流出ボトルに落下したら、漏れがなく、チューブラインと接続ポイントに気泡が残っていないことを確認します。チューブとコネクタを軽くたたくか、ポンプ速度を上げて、残っている気泡を取り除きます。
- すべてのチューブラインが流出ボトルに落下したら、最初のデバイスを接続するための流量を2rpmに設定します。
- デバイスのプライミング
注:このセクションでは、すべてのチャンバーが培地で満たされ、プレコートされていることを確認して、システム内に気泡が残らず、接種中に細胞が容易に接着できるように、デバイスを細胞培養培地でプライミングする方法について説明します。- 装置のプライミングは、無菌条件下でバイオセーフティキャビネット内で行われます。デバイスを接続するには、デバイスの下部チャンバーであるニューロンラインを接続することから始めます。
- ラインを接続するには、三方活栓バルブ(図5C)を閉じ、まず流出側から始めて、チューブをバーブに押して、短いチューブをメスのルアーコネクタから外し、デバイスからの出口ポートに接続します。適切な接続を確保し、漏れや汚染の可能性を減らすために、チューブをコネクタの奥まで押し下げて、チューブが蓋に接触していることを確認してください。流入チューブも同じ方法で接続します。1本のラインがデバイスに完全に接続されたら(流入と流出)、三方活栓を開きます。
- 上皮株で前のステップを繰り返し、次に細菌株で繰り返します。ポンプの流量を2rpmに保ちます。圧力の上昇による漏れを避けるために、ポンプ速度を2.5rpmに上げますが、それ以上は上げないでください。ポンプが装置内のチャンバーをプライミングできるようにします。
- 流出血清ボトルを常に監視します。気泡がチャンバー、ライン、またはコネクタに詰まった場合、内部に気泡が入ったチューブラインは流出チャンバーに落下しなくなります。気泡を取り除くには、まずデバイスを数分間稼働させます。これで問題が解決しない場合は、流出の三方活栓を閉じて、短時間低下している他のラインの 1 つを閉じます。
- デバイスのすべてのチャンバーが完全にプライミングされたら(すべてのチャンバーが細胞培養培地で満たされ、デバイスに気泡が残っていない場合)、ポンプ速度を0.5rpmに下げます。これで、デバイスは細胞接種の準備が整いました。
4. 細胞の調製と接種
注:このセクションでは、デバイスの接種に必要なさまざまな種類の細胞を調製する方法と、気泡を導入せずに滅菌した方法でデバイスに接種する方法について説明します。さらに、神経細胞の培地リフレッシュメントを行う方法、およびデバイス内で細菌培養用の培地を調製する方法についても説明します。
- 上皮細胞
- トリプシン-エチレンジアミン四酢酸(EDTA)を使用してフラスコからCaco-2細胞を分離し、RPMI 1640 + 10% FBSに再懸濁し、トリパンブルー排除アッセイを使用してノイバウアー細胞カウンターでカウントします。Caco-2細胞懸濁液(3分、300 × g)を遠心分離し、上清を廃棄して残りのトリプシン-EDTAを除去します。Caco-2細胞をRMPI 1640 + 10% FBSに再懸濁し、350,000細胞/mLの懸濁液を得ます。デバイスごとに、1.5 mLの容量が必要です。
- Caco-2細胞懸濁液1.5 mLを滅菌済み2 mLシリンジに移し、シリンジ内に残っている空気や気泡を取り除きます。
- 細菌室と神経室のチューブの三方活栓バルブを閉じます。細菌室と神経室のチューブをポンプから外し、それぞれのチューブが入ったカセットをローターから取り外します。
- 上皮チャンバーに通じる流入チューブの三方活栓バルブのキャップを開き、三方活栓バルブを回して、媒体の流れをデバイスから「オープンコネクタ」にリダイレクトします(図5C)。三方活栓バルブの開放端に媒体の滴が現れるまで、媒体を流します。
- 上皮細胞の入ったシリンジをドロップドロップ接続方式で「オープンコネクタ」に挿入し、気泡を発生させずにシリンジをコネクタに挿入できるようにします。三方活栓のバルブを回して、流入ボトルからの媒体の流れを(ポンプを介して )停止し、接続されたシリンジから初期装置への流れを可能にします。上皮チャネルをポンプから外します。
- シリンジをゆっくりと押して、上皮室に細胞懸濁液を接種します。3秒あたり約1滴が流出ボトルに落ちるようにします。
- 1.5 mLの細胞懸濁液を加え、流出三方活栓のバルブを閉じます。シリンジを外し、三方活栓の開放端をキャップで閉じます。チャンバーを少なくとも2時間閉じたままにします。その間に、神経細胞に接種します。
- 神経細胞
- 培地中の細胞をピペットを使用してそれぞれのウェルから再懸濁することにより、ウェルから神経細胞を分離します。6ウェルプレートの1ウェル(9.6cm2)から完全にコンフルエントな細胞を各デバイスに接種します。
- 対応するN2B27培地容量(デバイスあたり1.5 mLの培地)+1 μLのフィブロネクチン/mLの細胞懸濁液に細胞ペレットを再懸濁します。再懸濁した細胞懸濁液1.5 mLを2 mLのシリンジに移し、シリンジに残っている気泡を取り除きます。充填したシリンジを滅菌済みの 50 mL コニカルチューブに入れ、プライミングした HuMiX デバイスを含むバイオセーフティキャビネットに移します。
- チューブラインの変更を除いて、上皮チャンバー接種について前述したのと同じ接種プロセスに従います。ここで、細菌と上皮のチューブラインをポンプから外します。
- 神経細胞の接種後、チューブラインの三方活栓をすべて閉じ、ポンプから外します。デバイスを37°C、5%CO2のインキュベーターに入れます。すべてのチャネルを2時間閉じたままにして、セルが取り付けられるようにします。
- 2時間後、細菌と上皮のチャネルをポンプに接続し、両方のラインの流入と流出の3方向活栓を開きます。培地交換中を除き、最初のデバイス実行から次の14日間は、ニューロンチャンバーを閉じたままにします。
- 14日間のランニング中、3〜4日ごとにニューロン室の培地を交換します。培地をリフレッシュする場合は、デバイスごとに 3 mL の新鮮な N2B27 培地を調製し、滅菌済みの 20 mL 血清ボトルに移します。滅菌セプタムとアルミニウム圧着シールを使用して、培地で血清ボトルを閉じます。
- 曝気と80mmの針を新しいボトルのセプタムに挿入します。古いボトルの針から新しいボトルの針にオスルアーを外して、インキュベーター内の古い培地ボトルを新しいものと交換します。
- カセットをニューロン室のポンプチューブとポンプに接続し、三方活栓を開きます。培地を0.5rpmで2時間流してから、ニューロンチューブの三方活栓を閉じ、ポンプから切り離し、次の培地交換まで行います。
5. 細菌の培養と接種
注:この研究では、12日目に、 Limosilactobacillus reuteri 株F275の液体培養物をグリセロールストックから蘇生しました。ニーズや研究デザインに応じて、他の細菌種を使用することもできます。
- 5 mLのMRSブロスが入ったチューブを3本用意し、1本の滅菌コントロールチューブと L.ロイテリ 接種用のチューブを2本用意します。接種ループを使用して、グリセロールストックの上部をこすり落とし、1つのチューブに移します。2本目の接種チューブで繰り返します。チューブを37°C、170rpmで一晩インキュベートします。
注:グリセロールストックを解凍しないでください。 - Roswell Park Memorial Institute(RPMI)1640 + 10% FBSと5%MRSブロスを混合して、初期デバイス用の新しい培地を調製します。デバイスあたり25 mLを調製し、無菌条件下で100 mLの血清ボトルに移します。滅菌セプタムとアルミニウム圧着でボトルを閉じます。ボトルを37°C、5%CO2 のインキュベーターに一晩置きます。
- ボトルをバクテリアチューブラインに接続する前に、RPMI 1640/MRS培地の各ボトルに曝気針と80mm針を追加します。
- それぞれ3 mLのRPMI 1640 + 10% FBS + 5% MRSブロスを含む新しいチューブを準備します。デバイスごとに少なくとも2つのチューブ、1つのコントロールと1つのチューブを準備します。L . reuteri 15 μLの一晩培養液(光学濃度[OD] > 2)を、新しく調製した2本のチューブに接種します。
- チューブを37°C、170rpmで1時間インキュベートし、その後、0.05〜0.10のODに達し、~1~10 ×7コロニー 形成単位(CFU)/mLに相当します。1.5 mLを2 mLのシリンジ(デバイスごとに1本)に移します。残りのバクテリア懸濁液は、CFUのめっきと生死染色に使用してください。
- デバイスの細菌接種については、ステップ4.1で述べたのと同じ手順に従いますが、ここでニューロンと上皮のチューブラインが閉じている点が異なります。
- 接種後、バルブを閉じ、ポンプから30分間切り離して、細菌チューブラインも閉じます。上皮チューブとバクテリアチューブラインを接続し、再度開きます。デバイスを37°C、0.5rpmでさらに24時間稼働させます。
6. HuMiXの開封とサンプリング
注:以下のセクションでは、さまざまな細胞タイプのサンプリングについて説明します。例えば、神経細胞ペレットはRNA抽出とその後の定量的ポリメラーゼ連鎖反応(qPCR)に使用され、細菌ペレットはDNA抽出と16S rRNA遺伝子配列決定に使用され、上清は酵素結合免疫吸着アッセイ(ELISA)やその他のアッセイ(乳酸アッセイなど)に使用されます。
- 初日の14日目に、すべての三方活栓を閉じ、チューブをポンプから外し、インキュベーターの装置を実験台に取り出します。
注意: デバイスを移動するときは、実際のデバイスを水平に保ってください。 - クランプをゆっくりと開く前に、デバイスに接続されているチューブラインを取り外し、クランプの蓋を取り外します。注意して、PCの上部の蓋を取り外し、培地を1.5 mLの微量遠心チューブに集め、氷の上に置きます。
- サンドイッチガスケットを静かに取り外し、上皮チャンバーから培地を収集します。セル層に触れないように注意してください。サンドイッチガスケットを正方形のシャーレに入れ、チャンバーが完全に覆われるまで(約1mL)、H2O中の滅菌0.9%NaCl溶液を細菌チャンバーに加えます。
- コラーゲンガスケットをゆっくりと取り外しながら、ニューロンチャンバーから培地を回収し、微量遠心チューブに移します。すべての培地チューブを氷の上に置きます。コラーゲンガスケットを正方形の皿に入れ、細胞層が完全に覆われるまで、数ミリリットルの1x PBSをCaco-2層に静かに加えます。
- PCの底蓋を正方形のペトリ皿に入れ、サンプリングプロセス中に神経細胞が乾燥しないように、神経細胞の上に約2 mLの1x PBSを静かに加えます。
- 細菌培地チューブを5,000 × g で4°Cで5分間遠心分離します。 上皮およびニューロン培地チューブを300 × g で4°Cで5分間遠心分離します。 遠心分離後、各チューブの上清を新しい微量遠心チューブに移し、すぐにドライアイス上に置きます。
- 上皮細胞
- PBSをガスケットからそっと取り出し、15 mLのコニカルチューブに集めます。2 mLのトリプシンを細胞に加え、ガスケットを37°C、5%CO2で5分間インキュベートします。インキュベーション後に2 mLのRPMI 1640をガスケットに加え、細胞を再懸濁し、別の15 mLコニカルチューブに回収します。
- 両方のチューブを300 × gで5分間遠心分離します。上澄みを捨てます。PBS洗浄液のペレットを300 μLのPBSに、細胞ペレットを1 mLのPBSに再懸濁します。
- 各チューブ50 μLを0.5 mLの微量遠心チューブに移し、自動セルカウンターおよびトリパンブルー排除アッセイの細胞数を確認します。再懸濁した細胞ペレット(1 mL)を1.5 mLチューブに移し、300 × g で5分間遠心分離します。
- 上清を除去し、細胞ペレットを250 μLの溶解緩衝液+1%β-メルカプトエタノールに再懸濁し、チューブをドライアイス上に置きます。
- 神経細胞
- 前のステップ(6.5)の神経細胞が入った透明なPC蓋を底に置いて、正方形のシャーレを逆位相差顕微鏡に持っていきます。
注:PBSを載せたPCの蓋を動かすときは、ニューロンネットワークが非常に簡単に剥がれるため、非常に穏やかにしてください。 - 明視野顕微鏡を用いて神経細胞の形態と細胞密度を観察し、接種前に最後の品質チェックを行います。細胞がスフェロイドから移動し、ニューロンネットワークが形成されたことを確認します。ニューロンネットワークは約90%コンフルエントである必要があります。詳細については、Fattahi et al.6 を参照してください。
- ベンチで、細胞をPBSに再懸濁し、1.5 mLチューブに回収します。チューブを300 × g で3分間遠心分離します。上清を廃棄し、細胞ペレットを250 μLの溶解緩衝液+1%β-メルカプトエタノールに再懸濁し、ドライアイス上に置きます。
注:免疫蛍光染色(IF)は、PCリッド上の神経細胞に対して行うことができます。ニューロンネットワークを破壊しないためにIF染色が望ましいアッセイである場合、細胞は4%パラホルムアルデヒド(PFA)でPCリッドに固定する必要がありますが、これは将来の実験でのPCリッドの再利用を妨げます。
- 前のステップ(6.5)の神経細胞が入った透明なPC蓋を底に置いて、正方形のシャーレを逆位相差顕微鏡に持っていきます。
- バクテリア細胞
- メンブレンに付着した細菌細胞を0.9%NaCl溶液に再懸濁します。細胞がしっかりと付着している場合は、細胞スクレーパーをそっと使用して、細菌細胞を膜から剥離します。
注意: スクレーパーを使用すると、セルが損傷し、死んだセルが増える可能性が高くなります。 - 細胞懸濁液を15 mLのコニカルチューブに集めます。以前に収集した培地から残ったペレットを15 mLのコニカルチューブに加えます。5,000 × g 、4°Cで5分間遠心分離します。 上清を廃棄し、細胞ペレットを1 mLの0.9% NaCl溶液に再懸濁します。
- この容量を3つに分け、核酸抽出用細菌ペレットの凍結用(650 μL)、MRSプレート上でのCFUプレーティング用(50 μL)、生死染色用(300 μL)に分けます。核酸抽出用ペレットの調製には、細胞懸濁液を微量遠心チューブに移し、5,000 × g で4°Cで5分間遠心分離し、上清を廃棄する。細胞ペレットをドライアイスの上に置きます。
- サンプリングの最後に、ドライアイス上のすべてのチューブを-80°Cの冷凍庫に移し、後のダウンストリーム分析のために保存します。
注:上清は、さらにガスクロマトグラフィー質量分析(GC-MS)分析に使用できます。さらに、開口部の間、コラーゲン被覆膜は、IFオクルージン染色に使用する半分、さらなる遺伝子発現解析のためのRNA抽出に使用する別の部分、および細胞カウントに使用する別の部分など、異なる分析のために異なる部分に分割することができます。
- メンブレンに付着した細菌細胞を0.9%NaCl溶液に再懸濁します。細胞がしっかりと付着している場合は、細胞スクレーパーをそっと使用して、細菌細胞を膜から剥離します。
結果
neuroHuMiXでは、細菌細胞、上皮細胞、神経細胞の3種類の細胞を共培養しました(図1)。すべての細胞が生存可能であることを確認するために、異なる細胞タイプに対して異なるアッセイを実施しました。例えば、細菌細胞のCFUカウント、上皮細胞の細胞数と細胞生存率アッセイを行い、神経細胞は顕微鏡分析 で 評価しました。
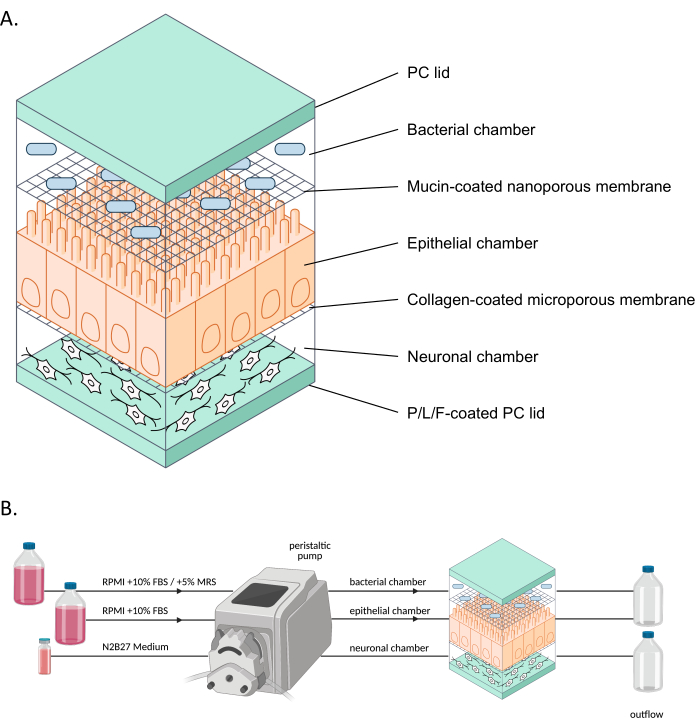
図1:neuroHuMiXとその実験装置の概略図。 (A)3つのチャンバーは、2つのPCの蓋の間に挟まれて閉じたままになっています。各チャンバーは、内部で増殖した細胞のための特定の培地で満たされています。異なるチャンバーは半透膜で隔てられており、膜を通過する可溶性因子を介した細胞間コミュニケーションが可能です。(B)neuroHuMiXセットアップの表現。各チャンバーは、異なる培地ボトルに接続されています。バクテリアチャンバーの場合、最初の12.5日間はチャンバーをRPMI + 10%FBSに接続し、最後の36時間はRPMI + 10%FBS + 5%MRSに変更します。 略語:PC =ポリカーボネート;P/L/F = ポリ L-オルニチン/ラミニン/フィブロネクチン;RPMI = ロズウェル パーク記念研究所細胞培養培地;MRS = De Man、Rogosa、およびShapre培地。この図の拡大版をご覧になるには、ここをクリックしてください。
細胞が適切に接着しているかどうかを判断するために、デバイスを開いたときに、コラーゲンでコーティングされた膜上の細胞層の形成を評価しました(図6A)。デバイス内の細胞が生存可能であることを確認するために、自動セルカウンターカウント(図6B)とトリパンブルー排除アッセイ細胞カウント(図6C)を実施しました。アッセイは、(i)ENで培養したCaco-2、(ii) L. reuteri で培養したCaco-2、および(iii)3つの細胞タイプすべての共培養を含むデバイス)の3つの異なるHuMiXセットアップのCaco-2細胞で実施しました。一元配置分散分析を用いた統計的検定では、細胞タイプ間に有意差は見られず、Caco-2細胞は、この研究で試験されたこれらすべての初期デバイスセットアップおよび条件で生存可能であることが示唆されました。このことは、 L. reuteri と2種類のヒト細胞の共培養中に到達した細菌密度が、ヒト細胞に対して細胞毒性効果を及ぼさないという事実を強調しています。
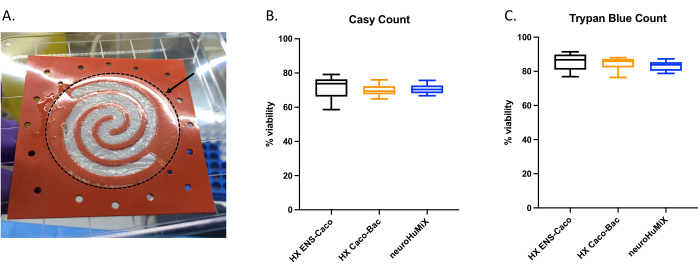
図6:コラーゲン被覆膜上のCaco-2細胞の評価。 (A)開封後のコラーゲン被覆膜上のCaco-2細胞の層。矢印はコラーゲンでコーティングされた膜を示しており、破線の円で囲まれています。Caco-2細胞は膜上で螺旋状に増殖していた。HuMiXでの14日後のCaco-2細胞の細胞生存率。細胞数は、(B)自動セルカウンターおよび(C)トリパンブルー排除アッセイ細胞数を用いて取得しました。Caco-2細胞数は、腸ニューロン(EN)との共培養(黒)、L.ロイテリとの共培養(オレンジ)、およびデバイス内(ENとL.ロイテリ)(青)のさまざまな培養セットアップから決定しました。一元配置分散分析を実行したところ、異なる培養設定間に有意差がないことが示されました(一元配置分散分析、p = 0.1234 [ns]、エラーバーは標準誤差を示します)。この図の拡大版をご覧になるには、ここをクリックしてください。
哺乳類細胞で ロイテリ菌 を培養できるように、まず培地を最適化し、装置で使用するように適合させました。RPMI 1640 の MRS の 5% 混合物(10% FBS を添加)は、 L. reuteri の増殖に最適であるが、これらのアッセイに用いた哺乳類細胞には細胞毒性がないことがわかった。続いて、CFUカウントを実施して、装置内で24時間培養した場合の L.ロイテリ の増殖を評価しました。CFUカウントは、2つの異なる初期デバイスセットアップ(図7)-デバイス内でCaco-2およびL.ロイテリと共培養したL.ロイテリ について評価しました。 どちらのセットアップでも、CFU数はHuMiX接種物および採取された細胞と有意に異なり(一元配置ANOVA、 p = 0.0002)、初期デバイス内で細菌細胞が増殖したことを示しました。
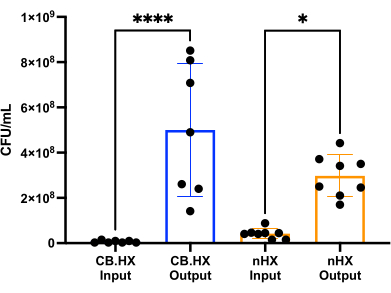
図7: Limosilactobacillus reuteri CFUの接種物(1:100,000に希釈)およびHuMiXでの24時間後。 2つの異なるセットアップ: L. reuteri と共培養したCaco-2細胞とデバイス。一元配置分散分析は、接種体と採取された細胞の間に有意差(p = 0.0002 [***])を示しており、細菌がHuMiX内で増殖していることを意味します。エラーバーは標準エラーを示します。略語:CB。HX = Caco-2 バクテリア HuMiX;nHX = neuroHuMiXです。 この図の拡大版をご覧になるには、ここをクリックしてください。
装置内でENを培養すると細胞の表現型が変化するかどうかを評価するために、倒立位相差顕微鏡を使用してENの肉眼的形態を観察しました。このステップでは、コンフルエントとENの両方の形態を評価しました。コンフルエントニューロンネットワークの確立は、細胞がコーティングされたデバイスのPCリッドにうまく付着していることを示しました。重要なことは、このことは、彼らがCaco-2および L. reuteriと共培養で成長したという考えを強調している。コンフルエントニューロンネットワークとガスケットで描かれた螺旋の間のエッジは、はっきりと明らかでした(図8)。
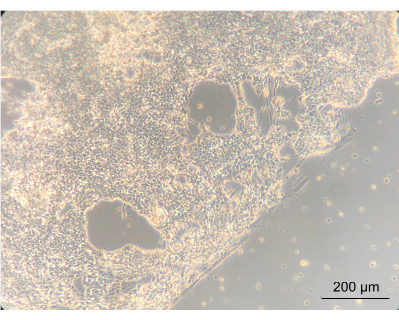
図8:装置で14日間培養した後の腸ニューロン。 画像の左側では、ニューロンがらせん状の合流層に成長しています。ニューロン層と細胞のない空間の間の端は、らせんの端です。拡大10倍、スケールバー=200μm。 この図の拡大版をご覧になるには、ここをクリックしてください。

図2:装置に使用されている蓋。画像は、上面(左)と下面(右)のPCカバーを示しています。 PCの蓋の両側は6.4cmです。略語:PC =ポリカーボネート。 この図の拡大版をご覧になるには、ここをクリックしてください。

図3:PC底面の蓋の上皮チャンバーガスケット。 PC蓋の底部に載置された上皮室ガスケットの上面図(左)と、PC蓋底部の入口及び出口と上皮室ガスケットの位置合わせを示す底面図(右)。ガスケットの両側とPCの蓋のサイズは6.4cmです。略語:PC =ポリカーボネート。 この図の拡大版をご覧になるには、ここをクリックしてください。

図4:デバイスの組み立て 。 (A)HuMiXを組み立てるためのさまざまな部品: (1)PCの底部の蓋。(2)コラーゲンコーティングされた微多孔膜を備えたガスケットを(1)の上に配置します。(3)ムチンでコーティングされたナノ多孔質膜を間に挟み、その上に(2)の上に置くサンドイッチガスケット。(4)(3)の上に置かれたPCの上部の蓋。ガスケットとPCの蓋の両側は6.4cmです。 (B)(A)のすべての部品を一緒に配置します。(C、D)組み立てられたデバイスの上面(左)と側面(右)の図。 B をクランプシステムに入れて、システムを閉じます。(C)トップクランプの各辺は8cmです。略語:PC =ポリカーボネート。 この図の拡大版をご覧になるには、ここをクリックしてください。
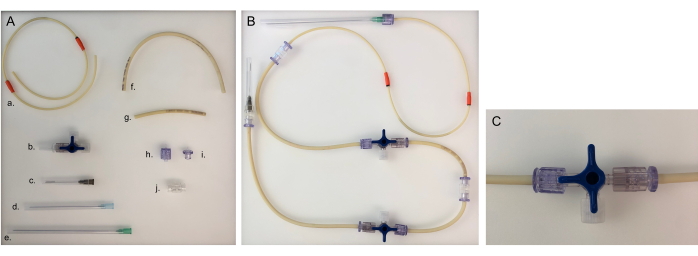
図5:チューブラインに必要な部品と、1つのチャンバーに組み立てられたチューブライン。 (A)チューブラインを構築するためのさまざまな部品: A.ポンプチューブライン;b. 三方活栓;c. 40 mmの針;d. 80 mmの針;e. 120のmmの針;長いチューブライン(20 cm);短いチューブライン(8 cm);h. 男性のルアー;i. 女性のLuer;j.アダプター。(B)細菌室または上皮室用の組み立てられたチューブライン。ニューロンチャンバーの場合、120mmの針を80mmの針に変更する必要があります。(C)三方活栓バルブを回して、装置からの媒体の流れを「開いたコネクタ」にリダイレクトし、チャンバーを閉じます。 この図の拡大版をご覧になるには、ここをクリックしてください。
| 日 | 0 | 2 | 4 | 6 | 8 | 10 |
| メディア構成 | 100%E6 | 100%E6 | 75%E6 | 50%E6 | 25%E6 | 100%N2 |
| + LDNの | + LDNの | 25% N2 | 50%のN2 | 75%のN2 | + LDNの | |
| + SBの | + SBの | + LDNの | + LDNの | + LDNの | + SBの | |
| + CHIR (英語) | + SBの | + SBの | + SBの | + CHIR (英語) | ||
| + CHIR (英語) | + CHIR (英語) | + CHIR (英語) | + RAの | |||
| + RAの | + RAの | |||||
| 分子 | [濃度] | |||||
| LDNの | 100 nM | |||||
| SBの | 10 μM | |||||
| CHIR (英語) | 3 μM | |||||
| レチノイン酸(RA) | 1μMの |
表1:メディア構成。
| メディア | 成分(材料表の濃度) | 容量(mL) |
| N2培地(50 mL) | DMEM-F12型 | 48 |
| N2サプリメント | 0.5 | |
| L-グルタミン | 0.5 | |
| ペニシリン/ストレプトマイシン | 0.5 | |
| NEAAの | 0.5 | |
| N2B27/ENS 培地(50 mL) | 神経基底 | 48 |
| N2サプリメント | 0.5 | |
| L-グルタミン | 0.5 | |
| ペニシリン/ストレプトマイシン | 0.5 | |
| B27-Aの | 0.5 |
表2:メディアレシピ。
| 滅菌温度(°C) | 116 |
| 滅菌時間(分) | 20 |
| 乾燥時間(分) | 10 |
| パルス | 3 |
| 終了温度(°C) | 99 |
表3:HuMiXオートクレーブの実行。
| 毎分回転数(rpm) | 平均流量(μL/min) |
| 0.5 | 13 |
| 2 | 79 |
| 5 | 180 |
表4:蠕動ポンプの流量。
ディスカッション
ヒトの腸内細菌叢が宿主の健康と病気に影響を与えることが現在確立されています。特にアルツハイマー病やパーキンソン病などの神経疾患において、マイクロバイオームの重要性を示唆する知識があるにもかかわらず3,13、腸内細菌叢が腸神経系、ひいては脳とどのように相互作用するかはほとんど不明のままです。
腸内細菌叢と神経系の相互作用を研究する代表的なモデルは、これまでのところ利用されていません。腸脳軸に関する研究は、伝統的にマウスモデルを用いて行われてきた13。マウスとヒトはゲノム配列の85%を共有しているが14、マウスとヒトを比較する際には考慮すべき大きな違いがある。腸に関しては、人間と比較して、マウスはもっぱら草食動物であることに注意することが重要です。その結果、彼らの消化管は、「胃内容排出」14などの長さと特徴が異なります。マウスの脳はまたマウスと人間の間の全面的な構造が異なっているという、重要な相違を示す15。重要なことに、ヒトは神経前駆細胞の細胞サイクルタイムが長い15。そのため、腸管細胞や神経細胞などヒト由来の細胞を含む代表的なモデルの開発が重要である5。これに関連して、 in vitroモデルを介して より再現性の高い研究を開発することで、動物モデルを使用する必要性が減り、再現性が向上します。
neuroHuMiXは、以前のHuMiXモデル9の高度なバージョンです。HuMiXは、上皮細胞と細菌細胞の近位および代表的な共培養を可能にするガットオンチップモデルです。細胞間コミュニケーションは、半透膜 を介した 分泌因子および代謝産物の近位共培養および拡散によって可能となる。しかし、ヒトの腸内環境を研究するための初期装置の有用性を拡大するためには、追加の細胞型の導入が必要である。そこで、iPS細胞由来のENを導入して開発されたneuroHuMiXは、細菌、腸管上皮細胞、ENの近位共培養を可能にしました。その結果得られた in vitro モデルにより、ヒトの神経系に関連するヒト腸内細菌叢に関する疑問に取り組むことができます。異なる種類の細胞、特に哺乳類細胞と細菌の共培養には、生存率の喪失、接着不良、合流点の全体的な損失など、いくつかの課題があります16。今回、この装置内で、細胞生存率を高く保ちながら、同じシステム内で3種類の異なる細胞を共培養できることを実証しました。
プロトコルの重要なステップは装置に接種する前にニューロンの細胞のconfluencyを保障することである-80%-90%の細胞のconfluencyおよび生存率。分析中の細胞増殖を評価することはできないため、細胞をモデルに導入する前に、細胞がコンフルエントで十分に増殖していることを確認することが最も重要です。これは制限要因となる可能性がありますが、デバイス内で観察される全体的な生存率とコンフルエンシーは一般的に高いです。
この装置は、チューブライン を介して 蠕動ポンプに接続されています。各セルチャンバーには、特定のチューブラインがあります。チューブは、媒体の灌流に蠕動ポンプの使用を可能にするポンプチューブと、ポンプチューブをデバイスに接続するチューブ、およびデバイスを流出/廃液ボトルに接続するチューブで構成されています。サンプリングポートは、流出媒体の接種とサンプリングを可能にするために、デバイスの前後に含まれています。各チャンバーは異なる培地に接続できるため、個々の細胞タイプに最適な培養条件を実現できます。各チャンバーは、培地供給の特定のニーズに応じて開閉できます。この装置では、神経細胞のチャンバーは実験のほとんどで閉じたままですが、細菌と上皮のチャンバーは常に開いているため、実験全体を通して新鮮な培地が得られます。媒体が途切れることなく流れるようにするには、チューブ、コネクタ、またはデバイス内に空気が残っていないことが重要です。したがって、プライミングステップで最初にデバイスを数分間動作させることが重要です。多くの場合、これで問題が解決します。そうでない場合は、流出の三方活栓を閉じることで、落下している他のラインの1つを短時間閉じることができます。これにより、媒体が気泡のあるラインにリダイレクトされ、チューブを通して気泡を外側に押し出すことで問題が解決します。
細胞培養実験では、培地は重要な要素であり、各細胞タイプにはそれぞれの培地があります。共培養セットアップでは、培地は、培地内で増殖する細胞の種類だけでなく、共培養内の他の細胞の種類にも適合している必要があります。これはデバイスの場合も同じで、細菌細胞、上皮細胞、神経細胞の3種類の細胞を内部に持つ3つの異なるコンパートメントがあるため、さらなる課題が生じます。しかし、10% FBSでRPMI 1640に5%MRSを添加して細菌培地を修飾することにより、すべての細胞タイプ、特に細菌細胞と上皮細胞をシステム内でうまく共培養できることを示しました。しかし、この装置では、異なる種類の細胞が近接して共培養されているため、互いに直接接触することはありません。これはヒトの腸内の細胞間の直接接触を完全には表しておらず、したがって制限されていますが、近位および代表的な共培養条件は、ダウンストリーム分析の強みです。可溶性因子は、異なるチャンバーと細胞タイプ間で交換されます。したがって、細胞はまだ互いに相互作用しています。さらに、細胞タイプを別々に採取して分析できるという事実により、健康なマイクロバイオームと病気のマイクロバイオームがさまざまな細胞タイプ(神経細胞を含む)に及ぼす影響を研究し、それによって細胞タイプ固有の読み出しを決定/取得することができます。もう一つの制限は、各実験の最後に装置を開いて細胞をチェックすることしかできないため、実験中に細胞の形態を追跡できないことです。
私たちの知る限り、neuroHuMiXはENを含む最初のガットオンチップモデルです。これは、腸内細菌叢と腸神経系のコミュニケーションを解明するための一歩です。これは、細菌種、上皮層、およびEN間の相互作用を調査できるモデルです。その設計により、異なる細胞タイプによって分泌される可溶性因子の交換と、それらが互いに及ぼす影響を研究することができます。今後は、iPS細胞由来のENだけでなく、iPS細胞由来の上皮細胞も装置内に搭載し、個別化モデルへの移行が重要になってきます。重要なことに、この個別化モデルは、プレバイオティクス、プロバイオティクス、およびシンバイオティクスのテストに使用でき10,11、パーソナライズされたスクリーニングと治療アプローチを開発する可能性があります17。パーソナライズされたneuroHuMiXは、最終的にヒトの腸内細菌叢の「暗黒物質」と、腸内細菌叢-神経系軸に沿った神経系との相互作用に光を当て、治療の評価と介入への道を開く可能性があります。
腸内細菌叢と神経系の軸に沿った相互作用の研究と理解を進めるためには、腸内神経系を含む腸チップを持つことができると結論付けることができます。NeuroHuMiXは、宿主細胞に対する細菌種の影響を研究することを可能にし、さらに生理学的に代表的な方法でモデルをさらに改善するための良い基盤を提供します。
開示事項
P.W.は、PCT/EP2013/056607、PCT/EP2016/062024、PCT/US2017/061602、PCT/EP2019/081424特許に発明者として記載されていることを宣言します。P.W.、C.S.、およびL.G.は、特許LU503075に発明者として記載されていることを宣言します。
謝辞
著者らは、K7系統の細胞を提供してくれたJared Sterneckert博士に感謝します。また、長年の共同研究者であるアリゾナ大学のフレデリック・ゼンハウザーン博士とマシュー・W・バレット博士には、エンジニアリング面での支援にも感謝します。また、neuroHuMiXの概略表現の設計に協力してくれたValentina Galata博士にも感謝します。本プロジェクトは、欧州連合(EU)の研究・イノベーションプログラム「Horizon 2020」(助成金契約863664)に基づき、欧州研究会議(ERC)から資金提供を受けています。 図 1 は、部分的に Biorender.com で作成されました。
資料
| Name | Company | Catalog Number | Comments |
| 2-Mercaptoethanol | Sigma Aldrich | 10712 | |
| Aeration cannula (length: 1.10 diameter: 30 mm) | VWR (B.Braun) | BRAU4190050 | |
| Agar-agar | Merck Millipore | 1.01614.1000 | |
| Aluminium Crimp | Glasgerätebau Ochs | 102050 | |
| Ascorbic acid | Sigma Aldrich | A4544 | |
| B-27 Supplement Minus Vitamin A (50x) | Gibco | 12587-010 | |
| Bacterial Cell Membrane, pore size: 1 µm | VWR (Whatman) | 515-2084 | |
| Caco-2 cells | DSMZ | ACC169 | |
| Cell Counter & Analyzer CASY | OMNI Life Sceince | ||
| CHIR | Axon Mechem BV | CT99021 | |
| Collagen I, Rat Tail | Invitrogen | A1048301 | |
| Costar 6-well Clear Flat Bottom Ultra-Low Attachment Plates | Corning | 3471 | |
| Difco Lactobacilli MRS Broth | BD Biosciences | 288130 | |
| Discofix 3-way stopcock | B. Braun | BRAU40951111 | |
| DMEM/F12, no glutamine | Thermofisher Scientific | 21331020 | |
| Dulbecco's Phosphate-Buffered Saline, D-PBS | Sigma Aldrich | 14190-169 | |
| Essential 6 Medium | Thermofisher Scientific | A1516401 | |
| Essential 8 Medium | Thermofisher Scientific | A1517001 | |
| Female Luer Lock to Barb Connector | Qosina | 11733 | |
| FGF2 | R&D Systems | 233-FB | |
| Fibronectin | Sigma Aldrich | F1141 | |
| Foetal Bovine Serum, FBS | Thermofisher Scientific | 10500-064 | |
| GDNF | PeproTech | 450-10 | |
| Human Cell Membrane, pore size: 50 nm | Sigma Aldrich (GE Healthcare) | WHA111703 | |
| HuMiX Gasket Collagen | Auer Precision | 216891-003 | |
| HuMiX Gasket Sandwich Bottom | Auer Precision | 216891-002 | |
| HuMiX Gasket Sandwich Top | Auer Precision | 216891-001 | |
| iPSC | Max Planck Institute for Molecular Biomedicine | K7 line | |
| L-Glutamine (200 mM) | Gibco | 25030081 | |
| Laminin from Engelbreth-Holmswarm | Sigma Aldrich | L2020 | |
| LDN193189 | Sigma Aldrich | SML0559 | |
| Limosilactobacillus reuteri | ATCC | 23272 | |
| Live/Dead BacLight Bacterial Viability kit | Thermofisher Scientific | L7012 | |
| Male Luer with Spin Lock to Barb | Qosina | 11735 | |
| Marprene tubing (0.8 mm x 1.6 mm) | Watson-Marlow | 902.0008.J16 | |
| Matrigel hESC-qualified matrix | Corning | 354277 | |
| Mucin, from porcine stomach | Sigma Aldrich | T3924 | |
| N2 Supplement (100x) | Gibco | 17502048 | |
| NEAA | Thermofisher Scientific | 11140050 | |
| Needle (length: 120 mm; diameter: 0.80 mm) | B.Braun (color code: green) | 466 5643 | |
| Needle (length: 40 mm; diameter: 0.70 mm) | Henke Sass Wolf (color code: black) | 4710007040 | |
| Needle (length: 80 mm; diameter: 0.60 mm) | B.Braun (color code: blue) | 466 5635 | |
| Neurobasal Medium | Gibco | 21103049 | |
| PE/Cy7 anti-human CD49d antibody | Biolegend | 304314 | |
| Penicillin-Streptomycin | Sigma Aldrich | P0781 | |
| Peristaltic pump | Watson-Marlow | 205CA | |
| Poly-L-ornithine Hydrobromide | Sigma Aldrich | P3655 | |
| Polycarbonate lids (HuMiX) | University of Arizona | HuMiX 1.0 / 2.0 | |
| Retinoic Acid | Sigma Aldrich | R2625 | |
| RLT Buffer (RNeasy Minikit) | Qiagen | 74104 | |
| RPMI 1640 Medium | Thermofisher Scientific | 72400-021 | |
| SB431542, ALK inhibitor | Abcam | ab120163 | |
| Serum bottles | Glasgerätebau Ochs | 102091 | |
| Syringe | BD Biosciences | 309110 | |
| Trypsin-EDTA solution | Sigma Aldrich | T3924 | |
| Y-27632 Dihydrochloride | R&D Systems | 1254 |
参考文献
- Heintz-Buschart, A., Wilmes, P. Human gut microbiome: function matters. Trends in Microbiology. 26 (7), 563-574 (2018).
- Toor, D., et al. Dysbiosis disrupts gut immune homeostasis and promotes gastric diseases. International Journal of Molecular Sciences. 20 (10), 2432 (2019).
- Braak, H., de Vos, R. A. I., Bohl, J., Del Tredici, K. Gastric α-synuclein immunoreactive inclusions in Meissner's and Auerbach's plexuses in cases staged for Parkinson's disease-related brain pathology. Neuroscience Letters. 396 (1), 67-72 (2006).
- Schmit, K. J., et al. Dietary fibre deprivation and bacterial curli exposure shift gut microbiome and exacerbate Parkinson's disease-like pathologies in an alpha-synuclein-overexpressing mouse. bioRxiv. , (2022).
- Fritz, J. V., Desai, M. S., Shah, P., Schneider, J. G., Wilmes, P. From meta-omics to causality: experimental models for human microbiome research. Microbiome. 1 (1), 14 (2013).
- Fattahi, F., et al. Deriving human ENS lineages for cell therapy and drug discovery in Hirschsprung disease. Nature. 531 (7592), 105-109 (2016).
- Wu, Q., et al. Organ-on-a-chip: Recent breakthroughs and future prospects. BioMedical Engineering Online. 19 (1), 9 (2020).
- May, S., Evans, S., Parry, L. Organoids, organs-on-chips and other systems, and microbiota. Emerging Topics in Life Sciences. 1 (4), 385-400 (2017).
- Shah, P., et al. A microfluidics-based in vitro model of the gastrointestinal human-microbe interface. Nature Communications. 7, 11535 (2016).
- Greenhalgh, K., et al. Integrated in vitro and in silico modeling delineates the molecular effects of a synbiotic regimen on colorectal-cancer-derived cells. Cell Reports. 27 (5), 1621-1632 (2019).
- Mao, J. H., et al. Genetic and metabolic links between the murine microbiome and memory. Microbiome. 8 (1), 53 (2020).
- Moysidou, C. M., Owens, R. M. Advances in modelling the human microbiome-gut-brain axis in vitro. Biochemical Society Transactions. 49 (1), 187-201 (2021).
- Kim, S., et al. Transneuronal propagation of pathologic α-synuclein from the gut to the brain models Parkinson's disease. Neuron. 103 (4), 627-641 (2019).
- Hugenholtz, F., de Vos, W. M. Mouse models for human intestinal microbiota research: a critical evaluation. Cellular and Molecular Life Sciences. 75 (1), 149-160 (2018).
- Marshall, J. J., Mason, J. O. Mouse vs man: Organoid models of brain development & disease. Brain Research. 1724, 146427 (2019).
- Goers, L., Freemont, P., Polizzi, K. M. Co-culture systems and technologies: taking synthetic biology to the next level. Journal of the Royal Society Interface. 11 (96), 20140065 (2014).
- Sedrani, C., Wilmes, P. Toward hypothesis-driven, personalized microbiome screening. Cell Reports Methods. 2 (1), 100139 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved