Method Article
高齢者の燃料利用と概日リズムを評価するための低侵襲法の使用
要約
末梢血単核細胞を利用して、燃料利用と概日リズムの相乗効果を評価するために、老化した個人に対する新しい低侵襲プロトコルが提示されます。
要約
老化は、身体障害や慢性疾患のリスクに相乗的かつ独立して寄与する複数の生理学的変化と関連しています。加齢に伴う身体障害の病因は複雑で多因子性ですが、ミトコンドリア機能の低下は、多くの高齢者の機能低下の進行と一致しているようです。加齢とともにミトコンドリア機能が低下する理由は解明されていませんが、燃料代謝と概日リズムの両方がミトコンドリア機能に影響を与えることが新たな科学で示されています。
近年の研究で、加齢とともに概日リズムが乱れ、概日リズムの乱れがミトコンドリア機能に影響を与える病理学的結果をもたらし、多くの加齢に伴う慢性疾患と重なることが立証されています。ミトコンドリア機能を直接評価するための現在の定量的方法は侵襲的であり、通常は筋生検が必要であり、潜在的な痛みとリスクのレベルが認識されていることを考えると、参加者の募集と研究のアドヒアランスに困難をもたらす可能性があります。したがって、高齢者の細胞レベルでのミトコンドリア機能の変化と概日パターンを評価するための革新的で比較的非侵襲的なプロトコルが適応されました。具体的には、リアルタイムの代謝フラックス分析装置を使用して、基質の利用可能性が異なる白血球のミトコンドリア生体エネルギー機能を評価します。
また、白血球における概日時計遺伝子の発現がミトコンドリアの生体エネルギーと相互相関し、概日リズムの結果が解析される。これらの革新的な方法論的アプローチは、高齢者のミトコンドリア基質の好みと概日リズムを研究するための低侵襲な方法を提供することにより、将来の臨床試験を支援すると考えられています。
概要
前世紀の進歩により、平均寿命は増加し、高齢者の人口は増加しました。将来を見据えると、米国では2020年から2050年にかけて、65歳以上の成人の割合が5%増加すると予測されています1。この平均余命の延長は、健康寿命(自立した機能に関連する寿命)の延長を意味するものではありません。現実には、老化は細胞の代謝と生理機能に影響を与える無数の生物学的変化を伴い、認知機能と身体機能の段階的な低下を引き起こします2,3。人間の平均余命が伸び続けるにつれて、4歳で機能的能力と自立を維持する必要性が高まっています。
加齢に伴う身体機能の低下と自立性の低下は多因子性であることは長い間知られていましたが、慢性疾患の発症や急性誘発事象と関連していることがよくあります5。逆に、これらの身体能力と筋肉特性の低下は、単一の疾患との明確な関連がなく、加齢に伴う障害の発症に関連していることが示されています6。慢性疾患や身体障害の正確な病因を知ることが難しいため、ミトコンドリア機能の障害は、高齢者の慢性疾患の発症と進行、および身体機能の喪失と一致すると考えられてきました7,8。
ミトコンドリアは、多くの細胞プロセスに必要なアデノシン三リン酸(ATP)の大部分を提供します9。酸化性の高い組織は、適切なエネルギー生産のためにミトコンドリアに依存しています。加齢とともに、酸化能力とミトコンドリアATP合成が低下します。この減少は、部分的にはミトコンドリアDNA(mtDNA)への酸化的損傷によるものであり、その結果、mtDNAの突然変異と欠失が徐々に蓄積されます10。mtDNAの突然変異と欠失の蓄積は、機能的な電子伝達鎖タンパク質の形成を減少させ、したがって、細胞のATP産生能力の低下を引き起こします。加齢に伴うミトコンドリア機能の低下は、心臓や骨格筋などの酸化性の高い組織で最も顕著である11。研究は、高齢のラットサンプルの腓腹筋ミトコンドリアが、若いサンプルと比較してATP産生および含有量が約50%減少することを示している12。さらに、ヒトの骨格筋におけるミトコンドリアATP産生能力は、生涯10年ごとに約8%減少することが示されています13。これらの知見は、加齢に伴うミトコンドリア機能の低下が、生物のエネルギー生産の減少に寄与している可能性を示唆している。
ミトコンドリアの活性の主要な調節因子は、ペルオキシソーム増殖因子活性化受容体γ(PPARγ)コアクチベーター-1(PGC-1α)14であると考えられている。PGC-1αの活性が低下したり、存在量が減少したりすると、ミトコンドリアの酸化活性が低下し、その結果、エネルギー生産が損なわれます。さらに、ミトコンドリアの質の低下は骨格筋の質に影響を及ぼし、その後、サルコペニア、ダイナペニア、および機能的能力の低下の発症または悪化につながる可能性があります15,16。ミトコンドリア機能と骨格筋の質の加齢に伴う同時低下の証拠は、ミトコンドリア障害と機能低下の病因との関連を示唆しています17。最近、これは機能的な地域生活の高齢者で確認され、骨格筋のミトコンドリア代謝の低下がこの集団の運動性の低下を予測することを示しています18。加齢に伴うミトコンドリアの衰退につながる正確なメカニズムは不明であるが、最近の証拠では、概日時計とミトコンドリア機能との間の相互的な相互作用が強調されており、ミトコンドリアの燃料利用と生合成に影響を及ぼしていることが明らかになっている19。
燃料利用
ミトコンドリアの機能は、燃料代謝と骨格筋組織の細胞レベルで使用される燃料の種類によって影響を受けるようである11。燃料の枯渇、特にヒトの炭水化物の枯渇の期間中、(ミトコンドリアの)エネルギー生産に対する燃料の好みが変化します。グルコースレベルが低いと、燃料の好みはグルコースから脂肪酸や酸由来のケトン体にシフトします。この代謝スイッチは、脂肪細胞における脂質代謝のアップレギュレーションとそれに続く血液中へのケトン体の放出の増加によって特徴付けられます4。ケトジェニックダイエットによるグルコースからケトンへの燃料利用のシフトは、ミトコンドリアの活性酸素種の産生、抗酸化防御、ATP合成、および生合成に有益な効果をもたらすようです20。
炭水化物代謝から脂質代謝への代謝切り替えは、環境栄養素の利用可能性が低い期間やグリコーゲン貯蔵が枯渇した場合に発生します。このスイッチが作動すると、貯蔵されたトリグリセリドは糖新生の基質であるグリセロールと遊離脂肪酸に分解され、遊離脂肪酸は肝臓に運ばれ、β酸化 によって アセチル補酵素A(アセチルCoA)に酸化されます。ケトン体は、主に肝臓で、3つのアセチルCoA分子をβ-ヒドロキシ-β-メチルグルタリル-CoAに2段階縮合させることによって合成され、さらにアセト酢酸や3-βetaヒドロキシ酪酸などのケトン体に加工されます21。これらのケトン体は、全身の組織に分布しており、最も消費量が多いのは心臓、脳、および骨格筋である21。加齢とともに、ミトコンドリア脂肪酸の酸化が損なわれ、代謝スイッチ22に影響を与える。ミトコンドリア燃料利用の障害は、さらなるミトコンドリア機能障害を引き起こし、それが今度は加齢性疾患および機能低下の一因となることが提案されている23。
末梢血単核細胞(PBMC)のミトコンドリア酸素消費量の変化は、機能不全と血管新生に関連するパターンを評価するために研究されています。Hartman ら は、酸素消費と多様な媒介性拡張との相関関係を明らかにすることを目的とした研究を行い、ミトコンドリア機能障害と血管平滑筋細胞機能障害との関連を示唆することがわかりました24。他の臓器に関しては、PBMCは、呼吸器測定によって決定されるように、より高い認知機能および脳機能と相関しています25。したがって、PBMCの生体エネルギーと呼吸能力は、全身の臓器や組織の機能的能力を評価するための潜在的なバイオマーカーとして役立つことができます。
概日リズム
ミトコンドリアの健康に影響を与えるもう一つの重要な要素は、概日リズムです。概日リズムは、環境的な手がかりがないときに起こる行動と生理学の~24時間の振動である26。これらのリズムは、システムと組織の恒常性をサポートするために予測的な方法で機能します。概日リズムの根底にあるメカニズムは、概日時計27と呼ばれる転写-翻訳フィードバックループである。概日時計のメカニズムが全身のほぼすべての細胞に存在することが、過去15年間で実証されてきた28。時間を保持することに加えて、分子時計メカニズムは、概日時計出力29と呼ばれる遺伝子発現の毎日のプログラムにも寄与している。クロックアウトプット遺伝子は各組織タイプに固有であり、細胞代謝、オートファジー、修復、および恒常性に重要な経路と機能的に関連しています。最近の証拠は、ミトコンドリアの健康が概日時計機能に依存しており、ミトコンドリアの生合成、燃料利用、マイトファジーなどのミトコンドリア機能に影響を与えることを示しています30。
前臨床研究と臨床研究の両方で新たな証拠が、老化を通じて概日リズムに乱れがあることを実証しています31。これには、正常な睡眠と覚醒のサイクルの乱れ、深部体温リズムの振幅の減少、フェーズ31の変化に適応する能力の遅延などが含まれます。例えば、ある研究では、成体マウスと老齢マウス(20+ヶ月)の概日システムに対して、光のスケジュールを6時間ずらすことで挑戦しました。その結果、老齢マウスは、活動パターンを新しい光のスケジュール32に再同調させるのに時間がかかることがわかった。概日行動の変化と一致して、組織時計の分析により、老化コホートでは中枢組織時計と末梢組織時計の両方が損なわれていることがわかりました。
最近では、いくつかのグループが、33歳までのさまざまな組織にわたる概日時計と時計出力のトランスクリプトーム分析を実施しました。これらの研究の結果は、概日時計の出力が経年変化とともに大規模に再プログラミングされていることを浮き彫りにしています。つまり、コアクロックはタイミング機能を維持していても、日常的に発現する遺伝子は大きく異なるということです。例えば、2つの研究では、ヒト被験者から4時間ごとに24時間にわたって筋生検を収集し、その結果、夜間のげっ歯類と昼行性のヒトとの間で時計遺伝子発現のピークとトラフが逆転することが決定された34,35,36。これは、時計遺伝子の発現を活動期と静止期のみに基づいて比較した場合(明暗期ではなく)、筋肉の時計遺伝子発現のパターンは種間で実質的に同じであることを示しています。この加齢に伴う時計出力の変化は、ミトコンドリア機能、DNA損傷と修復、オートファジーなど、老化の既知の特徴を含む経路の調節に障害をもたらすと提唱されている37。
研究の根拠
ミトコンドリア機能と身体機能の低下との関連は十分に確立されています。しかし、ミトコンドリア機能障害の根本的な原因については、依然として議論の余地があります。最近の研究では、細胞の燃料利用と概日リズムがこのプロセスに関与している可能性があることが示唆されています。筋生検サンプル中のミトコンドリア酸素消費量の測定など、ミトコンドリア機能を評価するための従来の方法は、しばしば痛みを伴い、侵襲的であると認識され、特に虚弱でサルコペニズムの成人など、筋肉量が少ない集団では参加を思いとどまらせる可能性がある38。
これらの制限を考慮すると、高齢者の細胞燃料利用と概日リズムの変化を評価するためのより侵襲性の低い方法が必要です。この研究は、新しい低侵襲プロトコルを評価することを目的としています この集団の燃料代謝と概日リズムを評価するために使用できます。この研究の結果は、加齢に伴う変化と医学的または行動的介入への反応の理解を深めることに貢献し、この分野の将来の研究のモデルとして機能します。
プロトコル
人間の参加者が関与する手順は、研究倫理委員会(Florida Ethics Policy 1.0104)およびフロリダ大学の治験審査委員会によって承認されています。
1. ミトコンドリア機能
- 末梢血単核細胞(PBMC)の単離
- 特別な8 mL採血管(16 mm x 125 mm、0.1 Mクエン酸ナトリウム抗凝固剤またはヘパリンナトリウム抗凝固剤のいずれかを含む)を使用してPBMCを採取します( 材料の表を参照)。
注:採血チューブには、チキソトロピー性ポリエステルゲルと勾配培地( 材料の表を参照)で構成される血液分離媒体が含まれており、白血球の分離を強化します。 - 8 mLの細胞調製チューブを採取後2時間以内に処理し、生存可能な結果を得てください。
- 採血チューブに血液を充填した後(穏やかに反転させるかミキサーで)、室温(RT)で最大2時間保持します。
- 採血チューブを2,000 g× g のフィッティングスイングアウトローターで15分間(または30,000 G-minに相当、2,000 × gを超えないように)遠心分離します。
注:これらのチューブは、通常の15mL遠心分離チューブよりも背が高いです。したがって、正しいローターの使用にはさらに注意を払う必要があります。 - 血漿層の~80%を吸引してバイオハザード廃棄物容器に廃棄し、15mLの遠心分離チューブで採血チューブから細胞層を採取します(トランスファーピペットを使用)。
注:15 mLチューブを使用する場合は、7 mLの細胞層を加え、滅菌リン酸緩衝生理食塩水(PBS)を14 mLに充填します。PBSに対する細胞の比率は1:1である必要があります。必要に応じて複数のチューブを使用してください。反転させてやさしく混ぜます。 - スイングアウトローターで900 × g で5分間(またはRTで4,500 G-minに相当)遠心分離します。
- 細胞ペレットを乱さずに、PBS溶液を吸引し、バイオハザード廃棄物容器に廃棄します。
- 細胞ペレットを1 mLの基礎培地(BM; 材料表を参照)に穏やかにトリチュレートして再懸濁します。BMを合計10mLに加え、反転させて穏やかに混合します。セルカウントを実行します。
- 細胞懸濁液をスイングアウトローターで900 × g でRTで5分間遠心分離します。
注:細胞を生体エネルギー評価に同じ日に使用する場合は、ステップ1.1.10に進みます。セルが保存のために凍結されている場合は、ステップ 1.1.13 に進みます。 - 目的の細胞濃度を達成するために、次の細胞ペレットを再懸濁するためのアッセイ培地(AM; 材料の表を参照)の容量を計算します。
注:例えば、播種密度が50 μL中150,000細胞/ウェルの場合、細胞懸濁液の所望濃度は300万細胞/mLです。 - 細胞ペレットを乱さずに、上清を吸引し、バイオハザード廃棄物容器に捨てます。
- 細胞ペレットを1 mL以下のAMに穏やかに再懸濁します。目的の細胞濃度について、計算された総体積にAMを加算します。これで、細胞をコーティングされた細胞培養プレートに播種する準備が整いました( 材料の表を参照)。
注: 次の手順は、セルを凍結して保存 (1.1.13-1.1.16) するためのものであり、同日処理には適用されません。 - 細胞を凍結する場合は、細胞ペレットを乱さずに上清を吸引し、バイオハザード廃棄物容器に廃棄します。
- 細胞を凍結培地( 材料表を参照)に所望の濃度(5〜1,000万細胞/ mL)で穏やかに再懸濁します。標識されたクライオバイアルで必要な量を分注します。
- 凍結容器( 材料表を参照)を使用して、細胞懸濁液を最低4時間または-80°Cで一晩ゆっくりと凍結します。
- 4時間後、または翌朝、クライオバイアルを液体窒素貯蔵に移し、気相に常駐させます。
- 測定の前日に、細胞培養マイクロプレート( 材料の表を参照)のウェル底部を細胞接着剤( 材料の表を参照)でコーティングします。製造元の指示に従って、推奨濃度22.4 μg/μLの接着剤を、0.1 M重炭酸ナトリウム(pH 8.0)で適切な量の接着剤ストック溶液を希釈して調製します。細胞培養マイクロプレートの各ウェルに25 μLの接着剤を塗布します。
- 20分後、各ウェルから残りの液体を吸い取り、200μLの滅菌精製水でウェルを2回洗浄します。プレートをバイオセーフティキャビネットで乾燥させます(~2時間)。
- プレートをアルミホイルで包むか、密閉した二次容器に入れ、4°Cの冷蔵庫に保管します。
- 特別な8 mL採血管(16 mm x 125 mm、0.1 Mクエン酸ナトリウム抗凝固剤またはヘパリンナトリウム抗凝固剤のいずれかを含む)を使用してPBMCを採取します( 材料の表を参照)。
- thereal-time metabolic flux analyzerによるPBMCの生体エネルギー評価
注意: フラックスアナライザーとマルチモードリーダー ( 資料表)、ウェルあたり 150,000 PBMC の最適な播種密度、最終アンカプラー カルボニル シアン化物-4(トリフルオロメトキシ)フェニルヒドラゾン(FCCP)濃度 2 μM、最終 Hoechst 33342 濃度 4 μM (注入後少なくとも 20 分のインキュベーション時間) が決定されました。- センサーカートリッジをハイドロブースターでハイドレートするには、ユーティリティプレート付きのセンサーカートリッジをボックスから取り出し、カートリッジの「センサーアップ」をベンチに置きます。200 μLのキャリブラント(材料表を参照)をユーティリティプレートの各ウェルにピペットで入れ、ハイドロブースターをユーティリティプレートにしっかりと置き、続いてセンサーカートリッジを置きます。閉じ込められた気泡を点検して取り除き、37°Cの非CO2インキュベーターに一晩置きます。
- フラックス分析装置の電源を入れ、続いてアッセイ分析ソフトウェアを開きます( 材料の表を参照)。温度を37°Cに設定します。 設定温度を安定させるために、機器を一晩オンのままにします。
注:次のプログラミング手順(1.2.4-1.2.10)は、実験の前日または当日に実行できます - アッセイ解析ソフトウェア(材料の表を参照)ファイルをプログラムするには、Substrate Oxidation Stress Testのテンプレートを開きます。[グループ定義] に移動し、[インジェクション ストラテジー] タブを開き、[インヒビター + Sub Ox ストレス テスト] を [エトモキシル + サブ オックス ストレス テスト] に編集し、さらに 2 つのインジェクション ストラテジー (UK5099 + Sub Ox ストレス テストと BTPES + サブ オックス ストレス テスト) を追加します。各注入ストラテジー内の[Injection Condition]ウィンドウで、[Port A]の[A]をクリックし、それぞれの阻害剤の最終濃度(Etomoxir:4 μM;UK5099:2μM;BTPES:3μM)。
- ポートB、C、Dをクリックし、それぞれの最終濃度を入力します(ポートB:オリゴマイシン濃度[1.50 μM]、ポートC:FCCP [2.0 μM];ポートD:ロテノン+アンチマイシンA [0.5μM])。Hoechst 33342, 4 μM をポート D のコンパウンドウィンドウに追加します。
- [前処理] タブを開き、該当する場合は前処理を選択します。例: コントロール、実験的、または慣習的 (ベースラインとフォローアップなど)。必要に応じて、下のウィンドウに説明を追加します。
- [アッセイ培地]タブを開き、[培地]プルダウンメニューから[RPMI 培地、pH 7.4]を選択し、ロット番号、培地を調製する人員、調製時間、培地に添加したサプリメント(10 mM グルコース、2 mM グルタミン、1 mM ピルビン酸、材料表を参照)を入力します。
- [Cell Type] タブを開き、[Name] に PBMC-Subject ID、[Cell Type] に PBMC、[Seeding density] に 150000、[Source] に [Subject ID] を入力し、セルを調製した人員、準備日、セル解凍日(該当する場合)を入力します。
- Generate Groupsをクリックし、Plate Mapに移動して、96ウェルプレートのウェルをそれぞれのグループに割り当てます。井戸 A1、A12、H1、H12 を背景井戸として割り当てたままにします。
- プロトコルに移動し、Equilibrateボックス(デフォルト設定)をチェックして、次の情報を入力します:ベースライン:5つの測定サイクル:3分間の混合、0分の待機、および3分間の測定。培地または阻害剤(ポートA):6つの測定サイクル:3分間の混合、0分間の待機、および3分間の測定。オリゴマイシン(ポートB):3つの測定サイクル:3分間の混合、0分間の待機、および3分間の測定。FCCP(ポートC):3つの測定サイクル:3分間の混合、0分の待機、および3分間の測定。ロテノン + アンチマイシン A + Hoechst 33342 (ポート D): 3 分間の混合、0 分間の待機、3 分間の測定の 3 サイクル。
- 生体エネルギー評価の日に、コーティングされた細胞培養マイクロプレートを冷蔵庫から取り出し、バイオセーフティキャビネットでRTまで温めます。
- 予熱したBM97 mLとサプリメント(ピルビン酸1 mL(最終濃度:1 mM)、グルコース1 mL(最終濃度10 mM)、グルタミン1 mL(最終濃度:2 mM)を混合してアッセイ培地(AM)を調製します。使用するまで、AMを非CO2 インキュベーターに37°Cで置きます。
- 細胞を播種するには、 A1、 H1、 A12、 H12 ( バックグラウンドウェルとして割り当て)を除く各ウェルに、150,000個のPBMCを含む50μLの細胞懸濁液(1.1.12から)を追加します。
クリティカル:最適なシード密度は事前に決定されています。 - 細胞プレートを蓋で覆い、バイオセーフティキャビネット内のRTで60分間細胞を休ませて、細胞の均一な分布を促進します。
クリティカル:顕微鏡で細胞を観察し、ウェル全体に望ましい均一な細胞分布を確認します。 - 細胞イメージングの場合は、最初の細胞インキュベーションの数時間前にマルチモードリーダー( 材料表を参照)をオンにします。リーダーの開始プロトコルが完了するのを待ってから、イメージングソフトウェアを開きます( 資料の表を参照)。イメージングソフトウェアを開き、 予熱温度 を 37°Cに設定します。
- アッセイ試薬を調製するには、アッセイキットの指示に従って試薬を再構成し、 表1に概説されているようにわずかな変更を加えます。
重大:最適な最終FCCPおよびHoechst33342濃度は、すでに決定されています。 - 60分間の細胞休止後、細胞培養顕微鏡でウェルを検査し、細胞凝集などの視覚的な異常がないか記録します。
- RTで細胞培養プレートを、マイクロプレート用のスイングアウトローターを備えた遠心分離機で、60 × g で1分間、最小の加速と最小のブレークで遠心分離します。プレートを回転させ、再度40 × g で1分間遠心分離します。加速とブレークを最小に設定します。細胞を非CO2 インキュベーターで37°Cで25〜30分間インキュベートします。
注:細胞イメージングを実施する場合、代わりに細胞プレートを予熱したマルチモードリーダーでインキュベートし( 材料の表を参照)、このインキュベーション期間中(最初の細胞インキュベーション)に各ウェルの明視野画像を撮影します。 - バーコードスキャナーで細胞培養プレートのバーコードをスキャンし(材料表を参照)、Start Brightfield Scan(明視野スキャンの開始)を選択し、細胞培養プレートをプレートトレイに置き、トレイの収縮を開始します。スキャンする細胞含有ウェルを選択し、スキャンを開始します。
- 最初の細胞インキュベーション中に、表1に示すように、 センサーカートリッジのポート に試薬をロードします :ポート(A):AM20μL(コントロール)、エトモキシル(ミトコンドリアへの長鎖脂肪酸輸送の阻害剤)、UK 5099(2-シアノ-3-(1-フェニル-1H-インドール-3-イル)-2-プロペン酸;ミトコンドリアピルビン酸担体の阻害剤)、またはBPTES(ビス-2-(5-フェニルアセタミド-1、3,4-チアジアゾール-2-イル)エチルサルフィド;グルタミン酸へのグルタミン変換の阻害剤); ポート(B):22μLのオリゴマイシン(ATPシンターゼの阻害剤); ポート(C):25μLのFCCP(アンカプラーカルボニルシアン化物-4(トリフルオロメトキシ)フェニルヒドラゾン); ポート(D):27 μLのロテノン/アンチマイシンA/Hoechst 33342(それぞれミトコンドリア複合体IおよびIIIの阻害剤、および核色素)。センサーカートリッジを37°Cの非CO2 インキュベーターにさらに5分間戻します。
注意: ポートのロードについては、製造元の指示に従ってください。 - 最初の細胞インキュベーション後、および細胞イメージングが完了した後(該当する場合)、細胞培養プレートをインキュベーターまたはプレートリーダーから取り出し、温かいAMを各ウェルに添加して、ウェルあたり180 μLの最終容量にします。セルプレートを37°CのノンCO2 インキュベーターにさらに15〜25分間置きます(2回目のセルインキュベーション)。
- メタボリックアッセイを開始するには、2回目の細胞インキュベーション中にセンサーのキャリブレーションを開始します。センサーカートリッジのキャリブレーションでアッセイを開始する準備ができたら、Run Assayをクリックします。プロンプトが表示されたら、センサーカートリッジを37°Cの非CO2インキュベーターからフラックス分析計トレイに移し、キャリブレーションを開始します。アッセイ解析ソフトウェアのプロンプトに従い、キャリブレーションが完了したら、セルプレートのユーティリティプレートを交換します。
注:キャリブレーションには約20分かかります。 - メタボリックアッセイ後、ソフトウェアのプロンプトに従って、センサーカートリッジと細胞プレートを装置から取り外します。センサーカートリッジをセルプレートから取り外し、セルプレートを蓋で覆います。
- 予備実験でHoechst色素のインキュベーション時間が決定されたら、プレートのバーコードをスキャンし、ソフトウェアの指示に従って、マルチモードリーダーで各細胞含有ウェルの蛍光画像を取得します。
注:イメージングおよびアッセイ解析ソフトウェアはインターフェースされているため、細胞数データをアッセイ解析データファイルにインポートして、データを細胞数に標準化することができます。
2. 概日時計遺伝子の発現
注: PBMC からの参加者の時計遺伝子の発現は、RNA 血液キットを使用して RNA を分離することによりレビューされます ( 資料の表を参照)。
- 参加者の血液の3 mLを、6 mLの安定化試薬を含むRNAチューブ( 材料の表を参照)に直接採取します。ボルテックスを10秒間渦巻きにして完全に混合します。
注:安定化試薬が参加者の血液サンプルと完全に混合されていない場合、研究エラーのリスクが高くなります。 - 安定化した血液サンプル1.0 mLを、赤血球溶解バッファー5 mLを入れた15 mLチューブに移します。氷上で10〜15分間インキュベートします。インキュベーション中にチューブを2回ボルテックスします。チューブを4°C、400 × g で10分間遠心分離します。
- ペレットを特定し、溶解した赤血球を含む上清を慎重に注ぎます。赤血球溶解バッファー 2 mL ( 材料表を参照) を添加し、細胞を再懸濁し、短時間ボルテックスした後、400 g × g で 4 °C で 10 分間遠心分離します。
- 上清を注ぎ、チューブを吸収紙の上で1〜2分間逆さまにしておきます。次のステップの前に、チューブの縁の周りの液体をきれいな紙で拭き取ります。
- 600 μLのRNA溶解バッファーを慎重に加えます( 材料の表を参照)。メーカーのプロトコルに従って、β-メルカプトエタノールを添加し、ペレットを再懸濁します。
- ライセートを2 mLコレクションチューブに入れた使い捨ての細胞ライセートホモジナイザー( 材料の表を参照)スピンカラムに直接ピペットで移し、最高速度で2分間遠心分離してホモジナイズします。使い捨ての細胞溶解物ホモジナイザースピンカラムを廃棄し、均質化されたライセートを保存します。
- 均質化したライセートに1容量(600 μL)の70%エタノールを加え、ピペッティングで混合します。形成された可能性のある沈殿物を含むサンプルを、2 mLコレクションチューブ内の新しいスピンカラムに慎重にピペットで移しますが、リムを湿らせないでください。>8,000 × gで15秒間遠心分離します。
- スピンカラム( 材料表を参照)を新しい2 mLコレクションチューブに移します。700 μLの厳格な洗浄バッファー( 材料表を参照)をスピンカラムに塗布し、>8,000 × g で15秒間遠心分離して洗浄します。フロースルーを破棄します。
- スピンカラムを慎重に開き、500 μLのマイルドな洗浄バッファーを加えます( 材料の表を参照)。キャップを閉め、全速力(20,000 × g)で3分間遠心分離します。
- スピンカラムを1.5 mLの微量遠心チューブに移し、30-50 μLのRNaseフリー水を直接シリカメンブレンにピペットで移します。>8,000 × g で1分間遠心分離し、RNAを溶出します。もう一度繰り返します。
注:RNAは-80°Cで保存できます。 - RNaseフリーのDNaseセット( 材料表を参照)を使用して、メーカーのプロトコールに従ってカラムでDNase処理を行います。
- 500 ngの全RNAとリアルタイムポリメラーゼ連鎖反応(PCR)システム( 材料表を参照)を使用して、メーカーのプロトコルに従ってcDNAを作製します。すべてのcDNAサンプルをRNaseフリー水で1:25に希釈し、4 mLを使用して定量的逆転写PCR(qRT-PCR)を行います。
- プライマー添加法( 材料表を参照)を使用して、表2に示す各プライマーの10 mMでqRT-PCRを完了します。リアルタイムシステムを使用した完全なqRT-PCR( 材料の表を参照)。
- Rpl26 mRNAレベルを使用して、選択した遺伝子のmRNAレベルを正規化します。2-DDCt法を使用して、相対定量を計算します。
- 所与のmRNAの発現が概日振動を示したかどうかを判断するには、1つの実験条件40で概日リズムを検出するためのLR_rhythmicity39尤度ベースの検定(p≤ 0.01を使用)を利用する。
3. データ分析計画
注: 医療インベントリは、薬の使用量43 に基づいて参加者を分類するために使用されます。
- 年齢、性別、体重、身長、血圧、心拍数、およびその他の危険因子を共変量として含める必要がある混合効果線形モデルを使用します。
- 被験者内のデータ相関を説明するために、ランダム効果項を含める必要があります。
- モデルフィッティングでは、階層原理による後退変数選択を実装する必要があります。
- 適合モデルから、適合モデル内のすべての共変量を前提として、時点 1 から時点 2 への測定値の変化を示します。
結果
提案されたプロトコルには、方法論の検証として機能する予備データが含まれています。このプロトコルには、ミトコンドリアの機能と細胞燃料の利用を調べるためのリアルタイムの代謝フラックス分析装置と、概日リズム遺伝子(BMAL1、CLOCK、Nfil2、Nr1d1、Dbp、Cry1、Per2など)を分析するためのRNA抽出とqRT-PCRが組み込まれています。
図1は、5人の対照参加者から分離されたヒトPBMCの酸素消費率(OCR)を、 初期解析から10日後に示しています。このデータは、事前値と事後値を比較するために使用され、コントロール、エトモキシル、UK5099、および BPTES の注射後の基礎呼吸、急性反応、最大呼吸、および予備容量の平均値を示します。特に、 図1C は、エトモキシル注射後に有意な否定的な急性反応を示していますが、基礎呼吸、最大呼吸、または予備容量には有意な影響は観察されませんでした。.
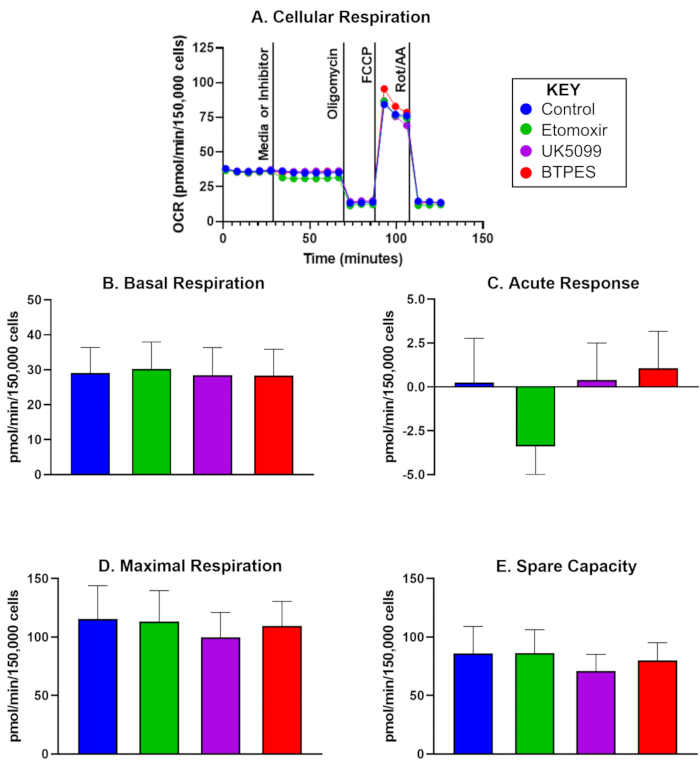
図1:単離されたヒト末梢血単核細胞(PBMC)の酸素消費量(A)対照被験者から単離されたPBMCのリアルタイム酸素消費率(OCR;pmol/(min・150,000細胞)をフラックスアナライザーで測定し、基質酸化アッセイで評価した。細胞は150,000細胞/ウェルの密度で播種されました。最初の注射は、培地(コントロール)または阻害剤(エトモキシル、UK5099、またはBPTES;詳細はテキストを参照)のいずれかであり、基礎細胞呼吸数を測定した後に行われました。ミトコンドリア基質の制限に対する急性反応は、阻害剤注射前後の基礎OCRの差として決定されました。ATP合成酵素阻害剤であるオリゴマイシンは、ATP産生共役呼吸を阻害し、プロトン漏れ呼吸を引き起こします。FCCP(アンカプラー)は、最大限の非結合呼吸を誘発します。ロテノンAとアンチマイシンA(それぞれ複合体IとIIIの阻害剤)は、非ミトコンドリア呼吸を除くすべての呼吸を阻害します(詳細についてはテキストを参照)。(B-E)細胞呼吸の定量化 (n = 5; データは ± SD の平均として表されます)。(B)阻害剤注射前の基礎OCR、(C)阻害剤に対する急性反応(阻害剤注射前の基礎速度に対するOCRの変化)、(D)最大OCR、および(E)予備容量(最大OCRと最初の注射後の基礎OCRの差)。エトモキシル注射に対する急性反応 (C) は、他の基質群と比較して、基礎条件下でのエネルギー基質としての OCR の脂肪酸への依存性が高いことを示唆している可能性がありますが、高エネルギー需要 (D) では OCR に顕著な影響はありません。この図の拡大版を表示するには、ここをクリックしてください。
| 化合物 | 化合物にAM(μL)を添加 | 在庫 (μM) | ワーキングストックのストック(μL) | 作業用AM(μL) | ワーキングストック(μM) | ワーキングストック (μL) [ポート] | 最終濃度 (μM) |
| エトモキシル | 700 | 160 | 500 | 1500 | 40 | 20 [A] | 4 |
| UK5099 | 700 | 80 | 500 | 1500 | 20 | 20 [A] | 2 |
| BPTESの | 700 | 120 | 500 | 1500 | 30 | 20 [A] | 3 |
| オリゴ | 420 | 150 | 300 | 2700 | 15 | 22 [B] | 1.5 |
| FCCPの | 720 | 100 | 600 | 2400 | 20 | 25 [C] | 2 |
| ロット/AA/H | 540 | 50 | 300 | 2700 | 5 | 27 [D] | 0.5 |
表1:基質酸化試験用の試薬の調製と、ストック溶液、作業溶液、最終溶液の濃度。 すべての試薬は、細胞水戸ストレス試験または基質酸化ストレス試験キットの一部です。略語:オリゴ=オリゴマイシン;FCCP =アンカプラーシアン化カルボニル-4(トリフルオロメトキシ)フェニルヒドラゾン;Rot/AA/H = ロテノン/アンチマイシン A/Hoechst 33342.エトモキシル、UK5099、BTPES:脂肪酸、グルコース、およびグルタミン酸化の阻害剤。
| BMAL1 | フォワード – GCACGACGTTCTTTCTTCTGT |
| リバース – GCAGAAGCTTTTTCGATCTGCTTTT | |
| 時計 | フォワード – CGTCTCAGACCCTTCCTCAAC |
| リバース – GTAAATGCTGCCTGGGTGGA | |
| 泣く1 | フォワード – ACTGCTATTGCCCTGTTGGT |
| リバース – GACAGGCAAATAACGCCTGA | |
| パー1 | フォワード – ATTCGGGTTACGAAGCTCCC |
| リバース – GGCAGCCCTTTCATCCACAT | |
| Per2 (パー2) | フォワード – CATGTGCAGTGGAGCAGATTC |
| リバース – GGGGTGGTAGCGGATTTCAT | |
| Rev-erb α | フォワード – ACAGATGTCAGCAATGTCGC |
| 逆 – CGACCAAACCGAACAGCATC |
表2:概日時計遺伝子プライマー。
ディスカッション
ミトコンドリア機能の低下と加齢に伴う概日リズムの調節は、加齢性疾患の要因としてますます見られています。食事や身体活動などのライフスタイルの変更を通じて概日リズムを変えることは、健康的な老化を促進し、老化に伴う運動能力の低下を減らすための潜在的な戦略を表しています。しかし、ミトコンドリア機能を直接評価する現在の方法は侵襲的であり、多くの場合、筋生検が必要であり、痛みやリスクが認識されるため、参加者の募集と保持に課題が生じる可能性があります。
採血などの低侵襲的な方法を通じて概日健康と代謝の健康のマーカーを評価することは、将来の研究で治療標的を探索およびテストするための貴重な結果を提供するでしょう。これらの低侵襲法は、概日リズムと代謝の健康との間の複雑な相互作用とそれらが機能に与える影響について新たな洞察を提供することにより、この分野を大きく前進させる可能性を秘めています。本研究の目的は、細胞のエネルギー代謝と概日リズムとの関係を評価することです。特に、生体エネルギーフラックス分析は、参加者の白血球における概日遺伝子群の遺伝子発現モニタリングとともに、さまざまな基質利用可能性条件下でのミトコンドリア機能の評価に使用されます。生体エネルギー発現と遺伝子発現という分析の両部門を用いることで、これら2つの基本的なプロセス間の関係を包括的に理解することができます。
この時系列データを概日リズムの観点から統計的に分析することで、概日リズムの強さ、範囲、タイミングについての洞察が得られます。結論として、遺伝子発現解析、細胞生体エネルギー学、および生物レベルでの代謝測定の統合は、ヒトのエネルギー代謝と概日リズムの相互作用に光を当てる新しく革新的なアプローチを構成します。
パイロット研究では、脂肪酸利用の制限に対するPBMCのOCRで急性反応を検出しました(カルニチンパルミトイルトランスフェラーゼ1aの阻害剤であるエトモキシルの注射後)。この知見は、この特定の参加者グループのPBMCでは、基礎呼吸中のエネルギー基質として脂肪酸に依存している可能性があることを示唆している。しかし、最大呼吸は影響を受けず、グルコースやグルタミンなどの代替エネルギー源が、エネルギー需要が高いときに脂肪酸の利用が減少することを補う可能性があることを示唆しています。今後の研究では、a)PBMCの生体エネルギーが全身のエネルギーを反映しているかどうか、b)時間制限のある食事などの介入がエネルギー基質の好みに影響を与えるかどうかを調査する必要があります。
PBMCのフラックス分析には、いくつかの重要なステップがあります。まず、実験サンプルを評価する前に、各ウェル内および各プレート全体に細胞が連続的に均一に分布していることを確認して、細胞播種密度(ウェルあたりの細胞数)を最適化し、最終的なFCCP濃度は、0、0.125、0.25、0.5、1.0、および2.0μMの濃度を使用して濃度テストランを実行して最適化する必要があります。 また、該当する場合は、Hoechst 33342の染色は、製造元の指示に従って最適化する必要があります。第二に、代謝データを細胞パラメータに正規化することは、実験間のデータの比較可能性にとって重要です。本プロトコルでは、Hoechst 33342染色細胞および細胞イメージングデバイスを用いたフラックス分析装置アッセイの終了後の細胞数について説明する。適切なデバイスが利用できない場合は、ウェルあたりの総細胞タンパク質や核DNA含有量など、別の標準化方法を適用できます。提案されているものと比較して、プロトコル内で利用できる注目すべき変更があります。具体的には、プロトコールは、ここで提案されている2つのキットのみと比較して、3つの阻害剤のそれぞれについて個別のアッセイキットを使用して完了することができます( 材料の表を参照)。
高齢者のエネルギー代謝と概日リズムとの相互作用を研究するための代理としてのPBMCの使用は、治療に対する彼らの反応が他の組織や臓器の反応を正確に反映できるという仮定によって制限されています。このアプローチは斬新で低侵襲ですが、脳、肝臓、骨格筋などのさまざまな組織や臓器がさまざまな条件下で異なる反応を示す可能性があることを認識することが重要です。前臨床試験では、摂食マウスと絶食マウスで時計遺伝子の発現が変化し、肝臓および筋肉組織におけるBMAL1標的遺伝子の部分的なアップレギュレーションにつながり、他のマウスのダウンレギュレーションにつながることが実証された41。これらの末梢組織および器官は、代謝過程を非常に代表しており、時計遺伝子発現メカニズム42に影響を与える環境手がかりによって影響を受ける可能性がある。末梢組織、臓器、および中心概日時計との関係を完全に理解するには、さらなる研究が必要です。
もう1つの制限は、参加者が処方箋を服用する資格を失わないことであり、統計分析に制限が生じる可能性があります。この制限を打ち消すために、将来の研究では、薬を服用している高齢者の集団で検証されている医療インベントリが使用されます43。参加者は、プロトコルのデータレビューセクションに記録された推奨薬に基づいて分類されます。1)機能低下を加速させる、2)機能低下を遅らせる、3)骨格筋機能に影響を与える、という結果が出ている薬剤には、全部で3つのカテゴリーがあります。
最後に、ヒトの骨格筋のミトコンドリアの酸化能力は、昼夜のリズムを示し、午後6時から午後11時の間にピークに達し、午前8時から午前11時の間に減少します44。これがPBMCのミトコンドリア酸化能力に当てはまるかどうかはまだ明らかではありません。しかし、予備的なデータは、PBMCとミトコンドリア代謝が関連していることを示唆しています45。筋生検とPBMCの変化に関する情報がそれほど明確でないことを考えると、結果を分析する際には注意が必要です。この制限を考えると、プロトコルを評価および開発する際には、この情報を念頭に置いておくことが重要です。これは、プロトコルの有効性と有効性を確保するのに役立つ貴重なコンテキストと洞察を提供する可能性があるためです。
私たちの知る限り、このプロジェクトで提案された方法を通じて燃料利用のパターンや概日リズムを評価した先行研究はありません。私たちの目的は、ミトコンドリアの燃料利用と概日の健康のマーカーの変化に対する応答性を調べることです。この研究は、高感度のバイオマーカーを測定するための低侵襲な方法を提示しており、筋生検が不可能な将来の介入研究の代替手段として役立つ可能性があります。
開示事項
著者には、開示すべき利益相反はありません。
謝辞
この研究は、Older American's Independence Center(NIH/NIA P30AG028740)から資金提供を受け、Clinical and Translational Science Institute(NIH/NCRR UL1TR000064)の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| Agilent Technologies Cell Imaging | Agilent Technologies | Cell image software | |
| Agilent/Seahorse Wave desktop program | Agilent Technologies | 5994-0039EN | Software used to analyse data from the celluar analyser and stress test assay |
| Agilent/Seahorse XFe96 Flux Analyzer | Agilent Technologies | S7800B | Real-time cellular flux analyzer; flux analyser |
| Bar Code Reader | Agilent Technologies | G2615-90007 | |
| Seahorse Wave Desktop Software | Agilent technologies | Data acquisition software; assay analysis; wave program | |
| Seahorse XF 1.0 M Glucose solution | Agilent Technologies | 103577-100 | Supplement to basal medium to make assay medium |
| Seahorse XF 100 mM Pyruvate solution | Agilent Technologies | 103578-100 | Supplement to basal medium to make assay medium |
| Seahorse XF 200 mM Glutamine solution | Agilent Technologies | 103579-100 | Supplement to basal medium to make assay medium |
| Seahorse XF Cell Mito Stress Test | Agilent Technologies | 103015-100 | Mitochondrial bioenergetic function assay |
| Seahorse XF Mito Fuel Flex Test | Agilent Technologies | 103260-100 | Mitochondrial bioenergetic function assay |
| Seahorse XF RPMI Medium | Agilent Technologies | 103576-100 | Basal medium for PBMCs |
| Seahorse XFe96 FluxPak mini | Agilent Technologies | 102601-100 | Sensor cartridges and cell culture microplates |
| Cytation 1 Cell Imaging Multi-Mode Reader | Agilent/BioTek | Multimode reader to image cells | |
| CPT Sodium Heparin Tube, 16 x 125 mm x 8.0 mL | Becton Dickinson | 362753 | Blood collection tubes for isolation of peripheral blood mononuclear cells |
| CellTak Cell and Tissue Adhesive | Corning | 354240 | Cell adherent to coat cell culture microplate |
| Phosphate Buffered Saline | Corning | 21-040-CV | Buffer to wash blood cells |
| Ficoll Paque Plus | Cytiva | GE17-1440-02 | Gradient medium |
| Lunar Prodigy DXA scanner | General Electric | EN 60601-2-7 5.1 | Whole body lean mass and fat/lean tissue mass ratio |
| Freezing container, Nalgene Mr. Frosty | MilliporeSigma | C1562 | Freezing container used to slow-freeze cell suspension |
| Buffer EL. | Qiagen | 79217 | Erythrocyte lysis buffer |
| Buffer RLT | Qiagen | 79216 | RNA lysis buffer |
| Buffer RPE | Qiagen | 1018013 | Mild washing buffer |
| Buffer RW1 | Qiagen | 1053394 | Stringent washing buffer |
| QIAamp DNA Micro Kit | Qiagen | 56304 | DNA preps: QIAamp MinElute Columns, Proteinase K, Carrier RNA, Buffers, Collection Tubes (2 ml) |
| QIAamp RNA Blood Mini Kit | Qiagen | 52304 | RNA blood kit; Used to isolate RNA |
| QIAshredder | Qiagen | 79656 | disposable cell-lysate homogenizers |
| RNase-Free DNase Set | Qiagen | 79254 | Used to perform DNA digest |
| 2-Mercaptoethanol (Reagent) | Thermo Fisher Scientific | MFCD00004890 | |
| 2-mL collection tubes, 100 count | Thermo Fisher Scientific | AM12480 | |
| Fast SYBR Green Master Mix | Thermo Fisher Scientific | 4385612 | Primers are added to this and used to carry out qRT-PCR |
| Microcentrifuge Tubes, 1.5 mL | Thermo Fisher Scientific | 69715 | Used to hold RNA purification filter during RNA purification |
| Narrow p1000 pipette tips | Thermo Fisher Scientific | 02-707-402 | |
| QuantStudio 3 Real-Time PCR System, MiniAmp Plus Thermal Cycler, and 96-Well Plates Package | Thermo Fisher Scientific | A40393 | |
| Tempus Blood RNA Tube | Thermo Fisher Scientific | 4342792 | RNA Tube |
| Tempus Spin RNA Isolation kit | Thermo Fisher Scientific | 4380204 | RNA extraction and isolation |
参考文献
- UN Department of Economic and Social Affairs. Population Division 2019, World Population Prospects. UN Department of Economic and Social Affairs. , (2019).
- Anton, S., Leeuwenburgh, C. Fasting or caloric restriction for healthy aging. Experimental Gerontology. 48 (10), 1003-1005 (2013).
- Dziechciaż, M., Filip, R. Biological psychological and social determinants of old age: Bio-psycho-social aspects of human aging. Annals of Agricultural and Environmental Medicine. 21 (4), 835-838 (2014).
- Anton, S. D., et al. Flipping the metabolic switch: understanding and applying the health benefits of fasting. Obesity. 26 (2), 254-268 (2018).
- Fried, L. P., Guralnik, J. M. Disability in older adults: evidence regarding significance, etiology, and risk. Journal of the American Geriatrics Society. 45 (1), 92-100 (1997).
- Manini, T. Development of physical disability in older adults. Current Aging Science. 4 (3), 184-191 (2011).
- Chung, H. Y., et al. Molecular inflammation: underpinnings of aging and age-related diseases. Ageing Research Reviews. 8 (1), 18-30 (2009).
- Sun, N., Youle, R. J., Finkel, T. The mitochondrial basis of aging. Molecular Cell. 61 (5), 654-666 (2016).
- Tarasov, A. I., Griffiths, E. J., Rutter, G. A. Regulation of ATP production by mitochondrial Ca2. Cell Calcium. 52 (1), 28-35 (2012).
- Chistiakov, D. A., Sobenin, I. A., Revin, V. V., Orekhov, A. N., Bobryshev, Y. V. Mitochondrial aging and age-related dysfunction of mitochondria. Biomed Research International. 2014, 238463 (2014).
- Boengler, K., Kosiol, M., Mayr, M., Schulz, R., Rohrbach, S. Mitochondria and ageing: role in heart, skeletal muscle and adipose tissue. Journal of Cachexia, Sarcopenia, and Muscle. 8 (3), 349-369 (2017).
- Drew, B., et al. Effects of aging and caloric restriction on mitochondrial energy production in gastrocnemius muscle and heart. American Journal of Physiology Regulatory, Integrative and Comparative Physiology. 284 (2), R474-R480 (2003).
- Short, K. R., et al. Decline in skeletal muscle mitochondrial function with aging in humans. Proceedings of the National Academy of Sciences. 102 (15), 5618-5623 (2005).
- Musci, R. V., Hamilton, K. L., Miller, B. F. Targeting mitochondrial function and proteostasis to mitigate dynapenia. European Journal of Applied Physiology. 118 (1), 1-9 (2018).
- Picca, A., et al. Targeting mitochondrial quality control for treating sarcopenia: lessons from physical exercise. Expert Opinion on Therapeutic Targets. 23 (2), 153-160 (2019).
- Fernandez-Marcos, P. J., Auwerx, J. Regulation of PGC-1α, a nodal regulator of mitochondrial biogenesis. The American Journal of Clinical Nutrition. 93 (4), 884-890 (2011).
- Kim, Y., Triolo, M., Hood, D. A. Impact of aging and exercise on mitochondrial quality control in skeletal muscle. Oxidative Medicine and Cellular Longevity. 2017, 3165396 (2017).
- Wang, H., Hiatt, W. R., Barstow, T. J., Brass, E. P. Relationships between muscle mitochondrial DNA content, mitochondrial enzyme activity and oxidative capacity in man: alterations with disease. European Journal of Applied Physiology and Occupational Physiology. 80 (1), 22-27 (1999).
- Tian, Q., et al. Muscle mitochondrial energetics predicts mobility decline in well-functioning older adults: The baltimore longitudinal study of aging. Aging Cell. 21 (2), e13552 (2022).
- Sardon Puig, L., Valera-Alberni, M., Cantó, C., Pillon, N. J. Circadian rhythms and mitochondria: connecting the dots. Frontiers in Genetics. 9, 452 (2018).
- Gano, L. B., Patel, M., Rho, J. M. Ketogenic diets, mitochondria, and neurological diseases. Journal of Lipid Research. 55 (11), 2211-2228 (2014).
- Liesa, M., Shirihai, O. S. Mitochondrial dynamics in the regulation of nutrient utilization and energy expenditure. Cell Metabolism. 17 (4), 491-506 (2013).
- Lesnefsky, E. J., Chen, Q., Hoppel, C. L. Mitochondrial metabolism in aging heart. Circulation Research. 118 (10), 1593-1611 (2016).
- Hartman, M. L., et al. Relation of mitochondrial oxygen consumption in peripheral blood mononuclear cells to vascular function in type 2 diabetes mellitus. Vascular Medicine. 19 (1), 67-74 (2014).
- Mahapatra, G., et al. Blood-based bioenergetic profiling is related to differences in brain morphology in African Americans with Type 2 diabetes. Clinical Science. 132 (23), 2509-2518 (2018).
- Moore-Ede, M. C. Physiology of the circadian timing system: predictive versus reactive homeostasis. The American Journal of Physiology. 250 (5), R737-R752 (1986).
- Young, M. W. Life's 24-hour clock: molecular control of circadian rhythms in animal cells. Trends in Biochemical Sciences. 25 (12), 601-606 (2000).
- Yoo, S. H., et al. PERIOD2::LUCIFERASE real-time reporting of circadian dynamics reveals persistent circadian oscillations in mouse peripheral tissues. Proceedings of the National Academy of Sciences. 101 (15), 5339-5346 (2004).
- Zhang, R., Lahens, N. F., Ballance, H. I., Hughes, M. E., Hogenesch, J. B. A circadian gene expression atlas in mammals: implications for biology and medicine. Proceedings of the National Academy of Sciences. 111 (45), 16219-16224 (2014).
- de Goede, P., Wefers, J., Brombacher, E. C., Schrauwen, P., Kalsbeek, A. Circadian rhythms in mitochondrial respiration. Journal of Molecular Endocrinology. 60 (3), R115-R130 (2018).
- Hood, S., Amir, S. The aging clock: circadian rhythms and later life. The Journal of Clinical Investigation. 127 (2), 437-446 (2017).
- Sellix, M. T., et al. Aging differentially affects the re-entrainment response of central and peripheral circadian oscillators. The Journal of Neuroscience. 32 (46), 16193-16202 (2012).
- Sato, S., et al. Circadian reprogramming in the liver identifies metabolic pathways of aging. Cell. 170 (4), 664-677 (2017).
- Lundell, L. S., et al. et al. feeding alters lipid and amino acid metabolite rhythmicity without perturbing clock gene expression. Nature Communications. 11 (1), 4643 (2020).
- Perrin, L., et al. Transcriptomic analyses reveal rhythmic and CLOCK-driven pathways in human skeletal muscle. eLife. 7, e34114 (2018).
- Gutierrez-Monreal, M. A., Harmsen, J. -. F., Schrauwen, P., Esser, K. A. Ticking for metabolic health: the skeletal-muscle clocks. Obesity. 28, S46-S54 (2020).
- Wolff, C. A., et al. Defining the age-dependent and tissue-specific circadian transcriptome in male mice. bioRxiv. 42 (1), 111982 (2023).
- Wilson, D., Breen, L., Lord, J. M., Sapey, E. The challenges of muscle biopsy in a community based geriatric population. BMC Research Notes. 11 (1), 830 (2018).
- Ding, H., et al. Likelihood-based tests for detecting circadian rhythmicity and differential circadian patterns in transcriptomic applications. Briefings in Bioinformatics. 22 (6), 224 (2021).
- Ding, Z., Lamb, T. M., Boukhris, A., Porter, R., Bell-Pedersen, D. Circadian clock control of translation initiation factor eIF2α activity requires eIF2γ-dependent recruitment of rhythmic PPP-1 phosphatase in Neurospora crassa. mBio. 12 (3), e00871 (2021).
- Di Francesco, A., Di Germanio, C., Bernier, M., de Cabo, R. A time to fast. Science. 362 (6416), 770-775 (2018).
- Kalfalah, F., et al. Crosstalk of clock gene expression and autophagy in aging. Aging. 8 (9), 1876-1895 (2016).
- Psaty, B. M., et al. Assessing the use of medications in the elderly: methods and initial experience in the cardiovascular health study. Journal of Clinical Epidemiology. 45 (6), 683-692 (1992).
- van Moorsel, D., et al. Demonstration of a day-night rhythm in human skeletal muscle oxidative capacity. Molecular Metabolism. 5 (8), 635-645 (2016).
- Janssen, J. J. E., et al. Extracellular flux analyses reveal differences in mitochondrial PBMC metabolism between high-fit and low-fit females. American Journal of Physiology. Endocrinology and Metabolism. 322 (2), E141-E153 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved