このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
微小血管断片からの血管新生熱発生脂肪組織の三次元培養
要約
ここでは、機能的な血管新生ベージュ脂肪組織を設計するための簡単なアプローチとして、げっ歯類またはヒト脂肪組織から分離された微小血管断片の使用を概説する詳細なプロトコルを提示します。
要約
エンジニアリング熱発生脂肪組織(例えば、ベージュまたは褐色脂肪組織)は、代謝性疾患の潜在的な治療法として、または健康診断および薬物検査のための個別化された微小組織の設計のために研究されている。現在の戦略はしばしば非常に複雑であり、熱発生脂肪組織の多細胞および機能的特性を正確に完全に描写することができません。微小血管断片は、脂肪組織から単離された細動脈、細静脈、および毛細血管からなる小さな無傷の微小血管であり、血管新生および脂肪組織形成を可能にする単一の自家細胞源として機能する。この記事では、脂肪組織および培養条件から微小血管断片を分離するためのプロトコルを含む、微小血管断片から3次元、血管化、および機能的な熱発生脂肪組織を生成できるように培養条件を最適化する方法について説明します。さらに、ベストプラクティス、および操作された組織を特徴付けるための技術が議論され、げっ歯類とヒトの両方の微小血管断片からのサンプル結果が提供されます。このアプローチは、肥満や代謝性疾患の治療法の理解と開発に活用できる可能性があります。
概要
このプロトコルの目的は、単一の潜在的に自己由来の微小血管断片(MVF)から血管新生ベージュ脂肪組織を開発するためのアプローチを説明することです。茶色とベージュの脂肪組織は、代謝調節に関連する有益な特性を示すことが実証されています。ただし、成人のこれらの脂肪組織デポーの量が少ないため、特に肥満や2型糖尿病などの病状では、全身代謝への潜在的な影響が制限されます1,2,3,4,5,6,7。肥満とその併存疾患に関連する有害な代謝効果を予防するための治療標的として、茶色/ベージュ色の脂肪に大きな関心が寄せられています8,9,10,11,12。
MVFは、脂肪組織から直接単離し、培養し、長期間にわたって三次元構成で維持することができる血管構造である13、14、15。私たちのグループや他のグループからの以前の研究は、特に脂肪組織形成に関連するように、MVFの多細胞および多能性能力を利用し始めています16,17,18。この研究の積み重ねとして、私たちは最近、健康な2型糖尿病のげっ歯類モデル19およびヒト被験者(50歳以上の成人)20に由来するMVFに、熱発生またはベージュ色の脂肪組織を形成するように誘導できる細胞が含まれていることを実証しました。
本明細書は、単一ソースMVFが利用される革新的なアプローチであり、ベージュ脂肪組織だけでなく、その関連する重要な血管成分21も作成することができる。この技術の使用は、熱発生脂肪組織形成のための簡単な組織工学的アプローチを探している研究にとって非常に価値がある可能性があります。ベージュ色の脂肪組織を設計することを目指す他の方法22、23、24、25、26、27、28とは異なり、この研究に記載されているプロセスは、複数の細胞型または複雑な誘導レジメンを使用する必要はありません。血管化されたベージュおよび白色脂肪モデルは、げっ歯類およびヒト由来のMVFで作成でき、大きな翻訳の可能性を示しています。このプロトコルの最終製品は、褐色脂肪組織に匹敵する構造と代謝機能を備えた操作されたベージュの熱発生脂肪組織です。全体として、このプロトコルは、簡単にアクセスでき、おそらく自家ソースMVFが、代謝障害を研究するための価値のある治療的介入およびツールである可能性があるという考えを提示します。
プロトコル
本研究は、動物愛護法および動物愛護規則施行規則に準拠して、実験動物の飼養及び利用に関する手引きの原則に従って実施された。すべての動物の手順は、テキサス大学サンアントニオ校の施設動物管理および使用委員会によって承認されました。
注:以下に説明する手順では、オスのルイスラットが使用されます。雌およびマウス微小血管断片(MVF)コレクションについては、わずかなプロトコル調整を行う必要があります29。ヒトMVF(h-MVF)を使用するプロトコルの場合、必要なステップは、メーカーのプロトコルに従ったh-MVFの再懸濁、増殖培地の調製(1.3)、フィブリンヒドロゲルの形成(5)、および培養(6)のみです。プロトコルの概要については、 図 1 を参照してください。
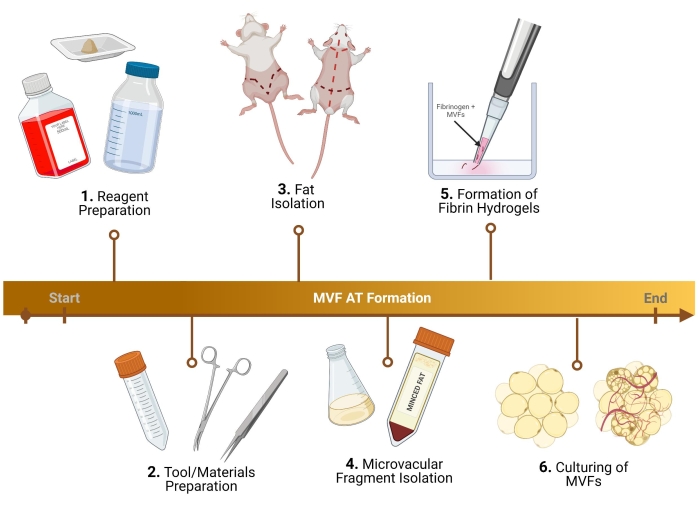
図1:実験の概要。 MVFを用いた熱発生脂肪組織形成のための分析前の6つの重要なステップの内訳。 この図の拡大版を表示するには、ここをクリックしてください。
1. 試薬調製
注:以下の試薬は、1匹のラットに対応し、計量してバイオフード内で製造しました。
- ウシ血清アルブミン(BSA)をPBSで調製します。
- 洗浄ステップ(1 mg/mL、0.1%)および消化(4 mg/mL、0.4%)のために希釈するPBS中の10 mg/mL(1.0%)BSAを調製します。
- ステップ1.1.1-1.1.5に従って、ステップ1.1.1で述べたように、異なる濃度のBSAを準備します。
- 10 mg/mL の BSA を PBS 溶液中に (1% の BSA を PBS 溶液中で)
- 500 mgのBSAと500 mLのPBSを50 mLのコニカルチューブに加え、溶液をボルテックスしてBSAを溶解します。
- 過剰な気泡が形成された場合は、溶液を350 x g で2分間遠心分離します。フィルター 0.22μmのナイロンネットフィルターで溶液を滅菌します。
- 1 mg/mL の BSA を PBS 溶液中で (0.1% BSA を PBS 溶液中)
- 500 mL滅菌ボトルで15 mLの10 mg/mL BSAをPBS中の135 mLのPBSに加え、15 mLの10 mg/mL BSAをPBSで1:10に希釈し、ボトルを静かに振って均一な混合物を確保します。
- 4 mg/mL の PBS 溶液中の BSA (PBS 中の 0.4% BSA)
- 100 mL滅菌ボトルに35 mLの10 mg / mL BSAをPBSで10 mL + 57.5 mLのPBSを加えて、35 mLの10 mg / mL BSAをPBSで1:2.5で希釈し、ボトルを静かに振って均一な混合物を確保します。
- ミンチ脂肪パッドの消化のためにBSAでコラゲナーゼを準備します。
- 6 mg/mL のコラゲナーゼを準備します。
- 50 mLのコニカルチューブで、72 mgのコラゲナーゼを量ります(「エピ用」のラベル)。
- 3本の50 mLコニカルチューブに、それぞれ144 mgのコラゲナーゼ(「Ing 1用」、「Ing 2用」、および「SubQ用」のラベル)を量ります。
- 秤量したコラゲナーゼは使用時まで4°Cで保存する。
注:消化直前までBSA / PBSを追加しないでください。 - 72 mgのコラゲナーゼを含むチューブに、PBS中の4 mg/mL BSAを12 mL加えます。
- 144 mgのコラゲナーゼを含むチューブに、PBS中の4 mg/mL BSAを24 mL加えます。
- チューブを振って均一な溶液を確保し、0.22μmのナイロンネットフィルターで溶液をろ過滅菌します。
- 6 mg/mL のコラゲナーゼを準備します。
- アミノカプロン酸(ACA)を添加した増殖培地を準備して、単離されたMVFをフィード/分化させます。
- 成長培地(GM):20%FBS、1%ペニシリン-ストレプトマイシン(ペン連鎖球菌)、0.2%マイコプラズマ予防薬、および1 mg / mLACAをDMEMに補給します。
- 白色脂肪原培地(WAM)を準備します。
- WAM誘導:DMEM / F12に20%FBS、1%ペン連鎖球菌、0.2%マイコプラズマ予防薬、10 μg / mLインスリン、10 μmのフォルスコリン、1 μmのデキサメタゾン、および1 mg / mLACAを補給します。
注:h-MVFの場合は、さらに125μMのインドメタシンを追加します。 - WAMメンテナンス:DMEM / F12に20%FBS、1%ペン連鎖球菌、0.2%マイコプラズマ予防薬、5 μg / mLインスリン、および1 mg / mLACAを補充します。
注:h-MVFの場合は、インスリン濃度を10μg/mLに変更してください。
- WAM誘導:DMEM / F12に20%FBS、1%ペン連鎖球菌、0.2%マイコプラズマ予防薬、10 μg / mLインスリン、10 μmのフォルスコリン、1 μmのデキサメタゾン、および1 mg / mLACAを補給します。
- ベージュ脂肪原培地(BAM)を準備します。
- BAM誘導:DMEM/F12に20%FBS、1%ペン連鎖球菌、0.2%マイコプラズマ予防薬、10 μg/mLインスリン、10 μmのフォルスコリン、1 μmのデキサメタゾン、1 μmのロシグリタゾン、20 nM 3,3′,5-トリヨード-L-チロニン(T3)、および1 mg/mL ACAを補給します。
注: h-MVF の場合は、T3 の濃度を 120 nM に変更します。 - BAMメンテナンス:DMEM/F12に20%FBS、1%ペン連鎖球菌、0.2%マイコプラズマ予防薬、5 μg/mlインスリン、10 μmのフォルスコリン、1 μmのロシグリタゾン、20 nM T3、および1 mg/mL ACAを補給します。
注:h-MVFの場合、インスリン濃度を10 μg / mLに変更し、T3濃度を120 nMに変更します。
- BAM誘導:DMEM/F12に20%FBS、1%ペン連鎖球菌、0.2%マイコプラズマ予防薬、10 μg/mLインスリン、10 μmのフォルスコリン、1 μmのデキサメタゾン、1 μmのロシグリタゾン、20 nM 3,3′,5-トリヨード-L-チロニン(T3)、および1 mg/mL ACAを補給します。
- トロンビンを準備し(ストック分注溶液が利用できない場合にのみ作成する必要があります)、フィブリンゲルに使用する凝固剤を作成します。
- 10 U/mL トロンビン (DDH2O) 中:
- 製造業者からのバイアル中の1〜5mLのddH2Oを使用してトロンビン粉末を再懸濁し、再懸濁を250mLビーカーに移す。
- 溶液を100 mLに引き上げ、溶液を何度も上下にピペットして、均一な混合物を確保します。溶液を15 mLコニカルチューブ(~10 mL/チューブ)に分注し、アリコートを-20°Cの冷凍庫に保管します。
注意: 使用するには、トロンビンを室温(RT)で解凍します。
- 10 U/mL トロンビン (DDH2O) 中:
2.工具/材料の準備
注意: すべての機器は、使用前にオートクレーブ/滅菌する必要があります。
- 精巣上体/鼠径部/皮下脂肪の分離(定義された手術領域で行われる手術)
- 使い捨てのアンダーパッド、はさみ2つ、止血剤1つ(オプション)、鉗子2つ、およびPBSに10〜15 mLの1 mg / mL BSA(0.1%)を含む4つの50 mLコニカルチューブの可用性を確保します。
- 微小血管断片の分離
- ミンチ(バイオフードで行う)の場合、コーティングされていない滅菌100 mmペトリ皿3枚、鉗子1対、および湾曲したはさみ1組を用意してください。
- 消化と分離(バイオフードで行われる)のために、1対のはさみ、1対の鉗子、8つのコーティングされていない滅菌100 mmペトリ皿、3つのコーティングされていない滅菌35 mmペトリ皿、コラゲナーゼの重量を測定し、4°Cで、4つの250 mLフラスコ、中央に穴のある1つのプラスチックホルダー、4つの500 μMスクリーン(丸い正方形で3つにカット)、 4つの37 μMスクリーン(丸みを帯びた正方形で3つにカット)、および11本の50 mLコニカルチューブ。
- フィブリン再懸濁
- フィブリンヒドロゲル(バイオフード内で行う)の場合、フィブリノーゲン、トロンビン、および増殖培地(試薬調製中に製造)が利用可能であることを確認してください。
3.脂肪分離プロトコル
- 準備手順
- ビーカーにエタノールを入れて、手術器具を使用する前に洗浄および消毒します。次に、ラットを扱うためのテーブルを準備し、シェービングステップ中に生成された毛皮を吸引するための真空準備をします。
- 事前に準備した50 mLのコニカルチューブ(それぞれ10 mLの1 mg / mL BSAを含む)を配置する氷の入ったバケツを準備します。それに応じてチューブにラベルを付けます。
注:両側を抽出する必要があり、この領域から集められる脂肪の量は精巣上体および後部皮下と比較して最大になる傾向があるため、鼠径脂肪用に2つの別々の円錐管が必要になる場合があります。 - 必要な手術器具を備えた定義された手術領域で安楽死させたラットから始めます。一般に、CO2 は、IACUCプロトコルに従ってラットを安楽死させるために使用される。
- バリカンを使用して、関心のある領域の周りでラットを剃ります。具体的には、精巣上体と鼠径部の脂肪を分離するために、鼠径部と腹部の半分の間を剃ります(この領域の毛皮には小さい方のシェーバーを使用してください)。背中全体を剃って、肩甲骨の間にある後部皮下脂肪を取得します(ラットの裏側の毛皮が厚いため、より大きなシェーバーを使用するのが最善です)。
- ラットに70%エタノールを噴霧して無菌的に調製します。一般的に、2回カットする領域を掃除することをお勧めします。
- 異なる脂肪貯蔵所の分離
- 鼠径(皮下)
- 仰臥位で、はさみで陰茎の下の皮膚を持ち上げます。ハサミで切開を開始し、中央から始めて横方向に切断し、「V」字型を形成し、ラットの裏側にループして脂肪蓄積全体にアクセスします。下の脂肪が損なわれないように表面的に切ることを忘れないでください。切断ステップ中に、相互接続された筋膜組織を切断することにより、脂肪から皮膚を確実に分離します(図2A)。
- 筋膜が適切に切断されたら、鼠径脂肪の両側が見えることを確認します(鼠径部から背中に向かって鼠径部に伸びています)。次に、10 mLの1 mg / mL BSAを含む2つの別々の円錐形のチューブで両側から脂肪を取り除きます(図2B)。
- 精巣上体(内臓)
- 腹部の皮膚を切り裂き、睾丸を囲む薄い層を注意深く切り取って、精巣上体脂肪を収穫します(図2C)。
- 鉗子で、脂肪組織をそっと引き出し、ハサミを使って切り取ります。目に見える主要な血管を解剖することは避けてください(精巣と精巣上体を採取する場合は、バイオフードの洗浄ステップ中にそれらを取り除きます)。
- 除去した脂肪を、PBS中の1 mg / mL BSAを10 mL入れた50 mLのコニカルチューブに注意深く入れます。
注:精巣上体脂肪の除去は、鼠径部脂肪を除去した後に行う必要があります。精巣上体脂肪は一般に体積が小さく、鼠径脂肪の下、精巣および精巣上体を囲む腹部皮膚の下に位置する。
- 後皮下
- ラットをうつ伏せ(背側を上にして)し、大きなハサミを使用して、背中の皮膚(この領域の皮膚は厚い)を頭皮まで切り、皮膚のすぐ下で深く切りすぎないように注意します(図2D)。
- 皮膚を組織に接続する筋膜を切断します。脂肪は肩甲骨間領域にあります。皮下脂肪と褐色脂肪を区別/分離するためにメモします。褐色脂肪は背骨に近いです(図2E)。
- 脂肪を単離し、PBS中の1 mg/mL BSAを10 mL入れた対応する50 mLコニカルチューブに入れます。
- 鼠径(皮下)
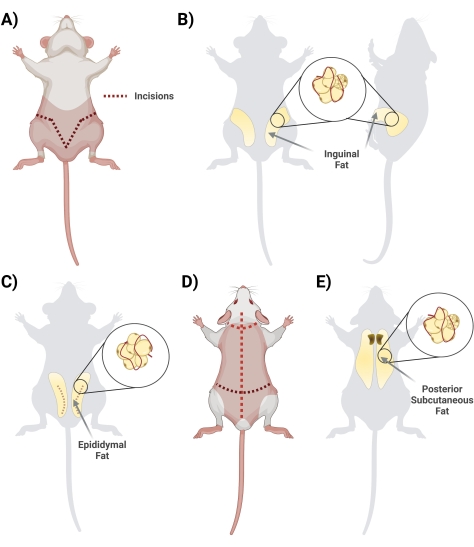
図2:異なる脂肪組織デポーの単離 。 (A)鼠径脂肪組織の切除に必要な初期切開。(B)鼠径脂肪貯蔵所の場所。(C)精巣上体脂肪貯蔵所の位置、アクセスに必要な外皮の切開に注目する。(D)マウスが追加の脂肪にアクセスする傾向があるように配置された後、追加の切開が必要です。(E)後部皮下脂肪デポの位置。 この図の拡大版を表示するには、ここをクリックしてください。
4.微小血管フラグメント分離プロトコル
- ラットから切除した脂肪を含む50mLのコニカルチューブをバイオフードに入れます。
- 鉗子を使用して、脂肪を標準の100 mmペトリ皿に入れます(組織の水分補給を維持するために、PBSに1 mg / mL BSAを~0.5 mL入れます)。
- 目に見える血管や筋肉/無関係な組織を脂肪からきれいにして取り除きます。
- 脂肪をハサミで~10分間ミンチします(10mLのピペットで移せるように十分にミンチします)。
- PBSに1 mg/mL BSAを~0.5 mL添加して塊がないか確認します。必要に応じてミンチを続けます。
- ミンチ脂肪を10 mLピペットで滅菌した250 mLフラスコに移します。
メモ: ピペットを使用してボリュームをメモします。 - 最終容量が20 mLになるように十分なBSA(1 mg / mL)を追加します。
- PBS中の4 mg / mL BSAをコラゲナーゼに追加します(コラゲナーゼ最終濃度:6 mg / mL)(つまり、72 mgのコラゲナーゼの場合は12 mL、コラゲナーゼ144 mgの場合は24 mL)。
注意: ミンチは時間に敏感であるため、ミンチが完了するまで追加しないでください。 - コニカルチューブを静かに振って均一な溶液を確保し、0.22μmのナイロンネットフィルターで溶液をろ過滅菌します。
- 精巣上体脂肪の場合は、~8-10分間消化します。鼠径部および後部皮下脂肪については、37°Cの水浴中で~15〜20分間消化し、フラスコを円を描くように振る(脂肪がほんの少しの塊しか残っていないところに到達した瞬間に停止する)。
- 消化された脂肪を50 mLの円錐形のチューブ(~30 mL /チューブがあるはずです)に移し、チューブに「消化脂肪」というラベルを付けます。
- チューブを400 x g で4分間回転させます。紡糸後、ペレットは赤でなければなりません(図3A)。
- スピン中は、滅菌済みの37 μMスクリーンと500 μMスクリーンを、PBSに5 mLの1 mg/mL BSAを入れた滅菌ペトリ皿に入れ、使用前にプレソークします。
- スピン後、上清を「廃棄物」とラベル付けされた50 mLのコニカルチューブにデカントします。表面の脂肪を取り除き、MVFで作られたペレットを乱さないように、デカンテーションを穏やかに実行します。
- ペレット(「消化脂肪」)を含むチューブにPBS中の1 mg / mL BSAを10 mL加えます。ペレットを2倍に粉砕(ピペットで上下)します。
- 破片を乱さないように、ペレットが粗くなりすぎないようにしてください。
- 500 μMスクリーンをプラスチック製スクリーンホルダーの上にある新しいペトリ皿に入れます(図3B)。
- 同心円を用いて500μMスクリーン上で「消化ペレット」チューブから10mLのピペットを採取した(図3C)。
- PBSでさらに5 mLの1 mg / mL BSAでフィルターを洗浄します。目的の細胞はペトリ皿にろ過されます。したがって、500μMのスクリーンを廃棄し、ろ過した液体をペトリ皿の中に保存してください。
- 37 μMスクリーンをプラスチックスクリーンホルダーの上にある新しいペトリ皿に入れます。
- 37 μMスクリーンを使用する前に、ピペットを交換して塊を取り除きます。
- 同心円を使用して37μMスクリーン上での最初のろ過から得られた液体をピペットします。
- PBSでさらに5 mLの1 mg / mL BSAでフィルターを洗浄します。目的の細胞はフィルターに残るため、ろ過された液体は廃棄されますが、37 μMのスクリーンは保存してください。
- 37 μMスクリーンを、PBS中の1 mg/mL BSAを5 mL含む新しいペトリ皿にスライドさせます。
- 皿を円錐形のホルダーに軽くたたき、破片を取り除きます。液体/細胞がペトリ皿からこぼれる可能性があるため、激しく振らないでください。
- PBS中の追加の5 mL 1 mg / mL BSAでフィルターをすすぎます。所望の細胞は、ペトリ皿内の溶液中に残るであろう。37 μMのスクリーンと、除去された液体を含むフラグメントをペトリ皿内に保存します。
- BSA +フラグメント含有液体を滅菌済みの50mLコニカルチューブに移します。
- 37 μMスクリーンのすすぎをさらに数回繰り返し(毎回、PBS中の1 mg/mL BSAを~5 mLで)、円錐形のチューブに追加します。収集された総量が~15-20 mLになるまで繰り返します。.最終的に、所望の細胞がペトリ皿内の溶液から収集され、円錐形のチューブに入れられる。この時点で、最後のすすぎ後に37 μMスクリーンを廃棄しますが、液体を含む除去された破片を50 mLコニカルチューブ内に保存します。
- ハサミを使用して200 μLのピペットチップの端を切り取ります。50 mLチューブを静かに振とうし、20 μLのサンプルを2つ取り出し、清潔な35 mmペトリ皿に入れます。
- ペトリ皿中の各サンプル中のフラグメントの数を数えて、単離されたMVFの総数を得る。
フラグメントの合計 =
- 液体を含む残りの除去されたフラグメントを50 mLコニカルチューブに400 x g で4分間回転させ、MVFを収集します。
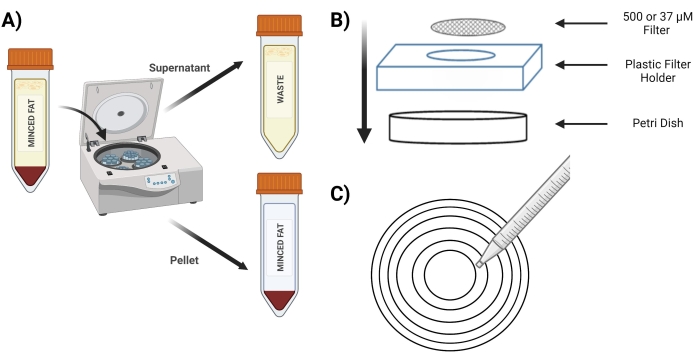
図3:MVFの単離 。 (A)脂肪組織の消化後、スピンダウン後のMVF含有ペレットと上清の分離の描写。(B)MVFのろ過と閉じ込めのための消耗品のレイアウト。 (C)ろ過/洗浄ステップの同心円法の図。 この図の拡大版を表示するには、ここをクリックしてください。
5.フィブリンヒドロゲルの形成
- 計算例:
注:以下は、~15,000-20,000 MVF / mLで播種されたMVFと、フィブリノーゲンを20 mg / mLの濃度で使用した2:5のフィブリノーゲン:トロンビンゲル比の計算です。- 250 μLのゲルを5つ作るには、総容量1,250 μLが必要です。ピペッティングエラーを常に考慮するため、1.5 mLのゲルに十分な量を作ってください。
- 次のようにして、必要なフィブリノーゲンの量を計算します。
 、X1 = 428.57 μLのフィブリノーゲン
、X1 = 428.57 μLのフィブリノーゲン - 次のように必要なトロンビンの量を計算します。
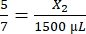 、X2 = 1,071.43 μLのトロンビン
、X2 = 1,071.43 μLのトロンビン - 428.57 μLの必要量に対して、次のように500 μLのフィブリノーゲンを作ります。
20 mg/mL * 0.5 mL = 10 mgのフィブリノーゲン。これを500 μLのDMEMに再懸濁します。 - 各ゲルを取得するには、次のようにフィブリノーゲンとトロンビンの量を計算します。
- フィブリノーゲン:
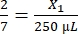 、X1 = 71.43 μLのフィブリノーゲン(DMEM中)+ MVF
、X1 = 71.43 μLのフィブリノーゲン(DMEM中)+ MVF - トロンビン:
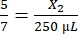 、X2 = 178.57 μLのトロンビン
、X2 = 178.57 μLのトロンビン
- フィブリノーゲン:
- 次のようにして、必要なフィブリノーゲンの量を計算します。
- 250 μLのゲルを5つ作るには、総容量1,250 μLが必要です。ピペッティングエラーを常に考慮するため、1.5 mLのゲルに十分な量を作ってください。
- MVFフィブリンゲルキャスティング
- スピンダウンしたフラグメント内の液体の大部分を50 mLコニカルチューブにデカントします。ピペットを使用して、円錐管の縁に引っかかる少量の液体を取り除きます。
- ゲルが作られるウェルにトロンビンを追加します(図4A)。
- 200 μLのピペットチップの端をクリップし、フィブリノーゲンを使用してMVFを穏やかに再懸濁すると、ゲル中に一度~15,000-20,000 MVF/mLの最終密度が得られます。
- 200 μLのピペットチップの端をクリップし、MVF+フィブリノーゲンをトロンビン溶液にそっと入れます。素早く上下にピペッティングして、均質な混合物を確保します。すべてのゲルが作成されるまで繰り返します(図4B)。
- ウェルプレートをインキュベーター(37°C、5%CO2)に~15分間入れて、ゲル架橋を可能にします(図4C)。
- 各ウェルに100〜150 μLの成長培地を追加します。
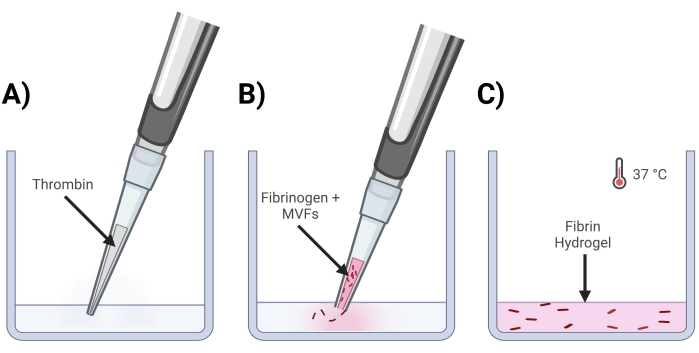
図4:MVFフィブリンゲルの形成 。 (A)5/7部のトロンビン混合物を対応するウェルにピペットで入れます。(B)次に、クリップされたピペットチップ(MVFを乱さないため)を使用して、2/7部のフィブリノーゲン+ MVF混合物をウェルにピペットで入れ、穏やかに混合します。(C)最後に、完成したすべてのゲルを37°Cのインキュベーターに入れ、ヒドロゲルを完全に固化させてから培地を上に置きます。 この図の拡大版を表示するには、ここをクリックしてください。
6. MVFの培養条件
- 非血管化白色およびベージュ脂肪組織(+GMコントロール)を培養するために、図5に示すタイムライン19を使用する。
- 血管化された白色およびベージュ色の脂肪組織(+GMコントロール)の培養のために、図6に示すタイムライン19を使用する。
- ヒドロゲルは、研究のための培養期間中、インキュベーター(37°C、5%CO2)に維持し、培地を1日おきに交換する必要があります。分析用サンプルの固定と取り扱いについては、既発表の著作物16,19,20を参照してください。

図5:非血管化脂肪組織形成のタイミング。 この図は、Acosta et al.19から修正されています。 この図の拡大版を表示するには、ここをクリックしてください。
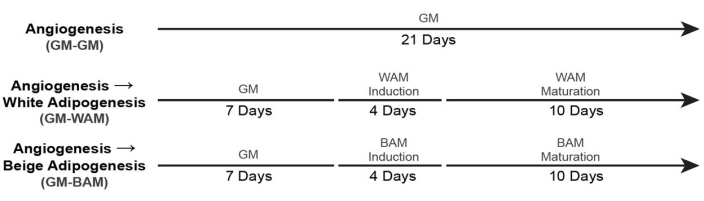
図6:血管新生脂肪組織形成のタイミング。 この図は、Acosta et al.19から修正されています。 この図の拡大版を表示するには、ここをクリックしてください。
結果
ベージュ/褐色脂肪組織のいくつかの重要な表現型の形態学的特徴があります:それは多房性であり、小さな脂肪滴を含み、多数のミトコンドリアを所有し(生体内でその特徴的に「茶色がかった」外観の理由)、それに応じて高い酸素消費率/ミトコンドリア生体エネルギーを有し、高度に血管新生され、脂肪分解/インスリン刺激グルコース取り込みを増加させ、そして最も悪名高い、 熱...
ディスカッション
ブラウン/ベージュの脂肪組織工学の分野は、ほとんど未成熟であり22,23,24,25,26,27,28であり、脂肪モデルの大部分は白色脂肪組織用に開発されています8,22,31
開示事項
著者らは、この研究は、潜在的な利益相反と解釈される可能性のある商業的または金銭的関係がない状態で実施されたと宣言しています。
謝辞
アコスタ博士は、国立衛生研究所の助成金CA148724およびTL1TR002647によってサポートされています。ゴンザレス・ポラス博士は、国立衛生研究所の国立糖尿病・消化器・腎臓病研究所の支援を受けており、賞番号F32-0DK122754で報告されています。この研究は、国立衛生研究所(5SC1DK122578)とテキサス大学サンアントニオ校の生物医学工学科によって部分的にサポートされました。内容は著者の責任であり、必ずしも国立衛生研究所の公式見解を表すものではありません。図は部分的に Biorender.com で作成されました。
資料
| Name | Company | Catalog Number | Comments |
| Aminocaproic Acid | Sigma Aldrich | A2504-100G | Added in DMEM at the concentration of 1 mg/mL |
| Blunt-Tipped Scissors | Fisher scientific | 12-000-172 | Sterilize in autoclave |
| Bovin Serum Albumin (BSA) | Millipore | 126575-10GM | Diluted in PBS to 4 mg/mL and 1 mg/mL |
| Collagenase Type 1 | Fisher scientific | NC9633623 | Diluted to 6 mg/mL in BSA 4 mg/mL, Digestion of minced fat |
| Dexamethasone | Thermo Scientific | AC230302500 | Diluted in ethanol at a 2 mg/ml stock concentration |
| Disposable underpads | Fisher scientific | 23-666-062 | For fluid absorption during surgery |
| Dissecting Scissors | Fisher scientific | 08-951-5 | Sterilize in autoclave |
| Dulbecco′s Modified Eagle′s Medium (DMEM) | Fisher scientific | 11885092 | |
| Dulbecco′s Modified Eagle′s Medium/Nutrient Mixture F-12 Ham (DMEM/F12) | Sigma Aldrich | D8062 | |
| Fetal Bovine Serum | Fisher scientific | 16140089 | Added in DMEM to 20% v/v. |
| Fibrinogen | Sigma Aldrich | F8630-25G | Solubilized in DMEM at the concentration of 20 mg/mL, Protein found in blood plasma and main component of hydrogel |
| Flask, 250 mL | Fisher scientific | FB500250 | Allows for digestion of fat using a large surface area |
| Forceps | Fisher scientific | 50-264-21 | Sterilize in autoclave, For handling of tissue and filters |
| Forskolin | Sigma Aldrich | F6886 | Diluted in ethanol at a 10 mM stock concentration |
| Human MVF | Advanced Solutions Life Scienes, LLC | https://www.advancedsolutions.com/microvessels | Human MVFs (hMVFs) isolated from three different patients (52-, 54-, and 56-year old females) were used in the current study. |
| Indomethacine | Sigma Aldrich | I7378 | Diluted in ethanol at a 12.5 mM stock concentration |
| Insulin from porcine pancreas | Sigma Aldrich | I5523 | Diluted in 0.01 N HCl at a 5 mg/ml stock concentration |
| MycoZap | Fisher scientific | NC9023832 | Added in DMEM to 0.2% w/v, Mycoplasma Prophylactic |
| Pennycilin/Streptomycin (10,000 U/mL) | Fisher scientific | 15140122 | Added in DMEM to 1% v/v. |
| Petri dishes, polystyrene (100 mm x 15 mm). | Fisher scientific | 351029 | 3 for removal of blood vessels and mincing, 8 (lid) for presoaking of screens & 8 (dish) for use when filtering with 500 or 37 µM screens |
| Petri dishes, polystyrene (35 mm x 10 mm). | Fisher scientific | 50-202-036 | For counting fragments |
| Phosphate Buffer Saline (PBS) | Fisher scientific | 14-190-250 | Diluted to 1x with sterile deionized water. |
| Rat Clippers (Andwin Mini Arco Pet Trimmer) | Fisher scientific | NC0854141 | |
| Rosiglitazone | Fisher scientific | R0106200MG | Diluted in DMSO at a 10 mM stock concentration |
| Scissors | Fine Science Tools | 14059-11 | 1 for initial incision, 1 for epididymal incision, 1 for tip clipping |
| Screen 37 µM | Carolina Biological Supply Company | 652222R | Cut into 3" rounded squares and sterilized in ethylene oxide, Fragment entrapment and removal of very small fragments/single cells and debris |
| Screen 500 µM | Carolina Biological Supply Company | 652222F | Cut into 3" rounded squares and sterilized in ethylene oxide, Removes larger fragments/debris |
| Serrated Hemostat | Fisher scientific | 12-000-171 | Sterilize in autoclave, For clamping of skin before incision |
| Steriflip Filter 0.22 μm | Millipore | SE1M179M6 | |
| Thrombin | Fisher scientific | 6051601KU | Diluted in deionzed water to 10 U/mL, Used as a clotting agent turning fibrinogen to fibrin |
| Thyroid hormone (T3) | Sigma Aldrich | T2877 | Diluted in 1N NaOH at a 0.02 mM stock concentration |
| Zucker diabetic fatty (ZDF) rats - obese (FA/FA) or lean (FA/+) male | Charles River | https://www.criver.com/products-services/find-model/zdf-rat-lean-fa?region=3611 https://www.criver.com/products-services/find-model/zdf-rat-obese?region=3611 | Obtained from Charles River (Wilmington, MA). Rats were acquired at 4 weeks of age and fed Purina 5008 until euthanasia (15-19 weeks of age). Glucose levels (blood from the lateral saphenous vein) were greater than 300 mg/dL in all FA/FA rats used in the study. All animals were housed in a temperature-controlled environment with a 12-h light-dark cycle and fed ad libitum. |
参考文献
- Cohen, P., Spiegelman, B. M. Brown and beige fat: molecular parts of a thermogenic machine. Diabetes. 64 (7), 2346-2351 (2015).
- Liu, X., et al. Brown adipose tissue transplantation reverses obesity in Ob/Ob mice. Endocrinology. 156 (7), 2461-2469 (2015).
- Tharp, K. M., Stahl, A. Bioengineering beige adipose tissue therapeutics. Frontiers in Endocrinology. 6, 164 (2015).
- Barquissau, V., et al. White-to-brite conversion in human adipocytes promotes metabolic reprogramming towards fatty acid anabolic and catabolic pathways. Molecular Metabolism. 5 (5), 352-365 (2016).
- Kim, S. H., Plutzky, J. Brown fat and browning for the treatment of obesity and related metabolic disorders. Diabetes & Metabolism Journal. 40 (1), 12-21 (2016).
- Lizcano, F., Vargas, D. Biology of beige adipocyte and possible therapy for type 2 diabetes and obesity. International Journal of Endocrinology. 2016, 9542061 (2016).
- Mulya, A., Kirwan, J. P. Brown and beige adipose tissue: therapy for obesity and its comorbidities. Endocrinology and Metabolism Clinics of North America. 45 (3), 605-621 (2016).
- Murphy, C. S., Liaw, L., Reagan, M. R. In vitro tissue-engineered adipose constructs for modeling disease. BMC Biomedical Engineering. 1, 27 (2019).
- Srivastava, S., Veech, R. L. Brown and brite: The fat soldiers in the anti-obesity fight. Frontiers in Physiology. 10, 38 (2019).
- Samuelson, I., Vidal-Puig, A. Studying brown adipose tissue in a human in vitro context. Frontiers in Endocrinology. 11, 629 (2020).
- Wang, C. -. H., et al. CRISPR-engineered human brown-like adipocytes prevent diet-induced obesity and ameliorate metabolic syndrome in mice. Science Translational Medicine. 12 (558), (2020).
- Kaisanlahti, A., Glumoff, T. Browning of white fat: agents and implications for beige adipose tissue to type 2 diabetes. Journal of Physiology and Biochemistry. 75 (1), 1-10 (2019).
- Sato, N., et al. Development of capillary networks from rat microvascular fragments in vitro: the role of myofibroblastic cells. Microvascular Research. 33 (2), 194-210 (1987).
- Laschke, M. W., Später, T., Menger, M. D. Microvascular fragments: More than just natural vascularization units. Trends in Biotechnology. 39 (1), 24-33 (2021).
- Hoying, J. B., Boswell, C. A., Williams, S. K. Angiogenic potential of microvessel fragments established in three-dimensional collagen gels. In Vitro Cellular & Developmental Biology-Animal. 32 (7), 409-419 (1996).
- Acosta, F. M., Stojkova, K., Brey, E. M., Rathbone, C. R. A straightforward approach to engineer vascularized adipose tissue using microvascular fragments. Tissue Engineering. Part A. 26 (15-16), 905-914 (2020).
- Acosta, F. M., et al. Adipogenic differentiation alters properties of vascularized tissue-engineered skeletal muscle. Tissue Engineering. Part A. 28 (1-2), 54-68 (2021).
- Strobel, H. A., Gerton, T., Hoying, J. B. Vascularized adipocyte organoid model using isolated human microvessel fragments. Biofabrication. 13 (3), 035022 (2021).
- Acosta, F. M., et al. Engineering functional vascularized beige adipose tissue from microvascular fragments of models of healthy and type II diabetes conditions. Journal of Tissue Engineering. 13, 20417314221109337 (2022).
- Gonzalez Porras, M. A., Stojkova, K., Acosta, F. M., Rathbone, C. R., Brey, E. M. Engineering human beige adipose tissue. Frontiers in Bioengineering and Biotechnology. 10, 906395 (2022).
- Herold, J., Kalucka, J. Angiogenesis in adipose tissue: The interplay between adipose and endothelial cells. Frontiers in Physiology. 11, 1861 (2021).
- McCarthy, M., et al. Fat-On-A-Chip models for research and discovery in obesity and its metabolic comorbidities. Tissue Engineering Part B: Reviews. 26 (6), 586-595 (2020).
- Klingelhutz, A. J., et al. Scaffold-free generation of uniform adipose spheroids for metabolism research and drug discovery. Scientific Reports. 8 (1), 523 (2018).
- Yang, J. P., et al. Metabolically active three-dimensional brown adipose tissue engineered from white adipose-derived stem cells. Tissue Engineering. Part A. 23 (7-8), 253-262 (2017).
- Vaicik, M. K., et al. Hydrogel-based engineering of beige adipose tissue. Journal of Materials Chemistry B. 3 (40), 7903-7911 (2015).
- Tharp, K. M., Stahl, A. Bioengineering beige adipose tissue therapeutics. Frontiers in Endocrinology. 6, 164 (2015).
- Tharp, K. M., et al. Matrix-assisted transplantation of functional beige adipose tissue. Diabetes. 64 (11), 3713-3724 (2015).
- Harms, M. J., et al. Mature human white adipocytes cultured under membranes maintain identity, function, and can transdifferentiate into brown-like adipocytes. Cell Reports. 27 (1), 213-225 (2019).
- Frueh, F. S., Später, T., Scheuer, C., Menger, M. D., Laschke, M. W. Isolation of murine adipose tissue-derived microvascular fragments as vascularization units for tissue engineering. Journal of Visualized Experiments. (122), e55721 (2017).
- Cannon, B., Nedergaard, J. Brown adipose tissue: Function and physiological significance. Physiological Reviews. 84 (1), 277-359 (2004).
- Unser, A. M., Tian, Y., Xie, Y. Opportunities and challenges in three-dimensional brown adipogenesis of stem cells. Biotechnology Advances. 33, 962-979 (2015).
- Dani, V., Yao, X., Dani, C. Transplantation of fat tissues and iPSC-derived energy expenditure adipocytes to counteract obesity-driven metabolic disorders: Current strategies and future perspectives. Reviews in Endocrine & Metabolic Disorders. 23 (1), 103-110 (2022).
- Xu, X., et al. Adipose tissue-derived microvascular fragments as vascularization units for dental pulp regeneration. Journal of Endodontics. 47 (7), 1092-1100 (2021).
- McDaniel, J. S., Pilia, M., Ward, C. L., Pollot, B. E., Rathbone, C. R. Characterization and multilineage potential of cells derived from isolated microvascular fragments. Journal of Surgical Research. 192 (1), 214-222 (2014).
- Gealekman, O., et al. Depot-specific differences and insufficient subcutaneous adipose tissue angiogenesis in human obesity. Circulation. 123 (2), 186-194 (2011).
- Altalhi, W., Hatkar, R., Hoying, J. B., Aghazadeh, Y., Nunes, S. S. Type I diabetes delays perfusion and engraftment of 3D constructs by impinging on angiogenesis; which can be rescued by hepatocyte growth factor supplementation. Cellular and Molecular Bioengineering. 12 (5), 443-454 (2019).
- Altalhi, W., Sun, X., Sivak, J. M., Husain, M., Nunes, S. S. Diabetes impairs arterio-venous specification in engineered vascular tissues in a perivascular cell recruitment-dependent manner. Biomaterials. 119, 23-32 (2017).
- Laschke, M. W., et al. Adipose tissue-derived microvascular fragments from aged donors exhibit an impaired vascularisation capacity. European Cells & Materials. 28, 287-298 (2014).
- Später, T., et al. Vascularization of microvascular fragment isolates from visceral and subcutaneous adipose tissue of mice. Tissue Engineering and Regenerative Medicine. 19 (1), 161-175 (2021).
- Später, T., et al. Adipose tissue-derived microvascular fragments from male and female fat donors exhibit a comparable vascularization capacity. Frontiers in Bioengineering and Biotechnology. 9, 777687 (2021).
- Laschke, M. W., Menger, M. D. The simpler, the better: tissue vascularization using the body's own resources. Trends in Biotechnology. 40 (3), 281-290 (2022).
- Yang, F., Cohen, R. N., Brey, E. M. Optimization of co-culture conditions for a human vascularized adipose tissue model. Bioengineering. 7 (3), 114 (2020).
- Pilkington, A. -. C., Paz, H. A., Wankhade, U. D. Beige adipose tissue identification and marker specificity-Overview. Frontiers in Endocrinology. 12, 599134 (2021).
- Chiou, G., et al. Scaffold architecture and matrix strain modulate mesenchymal cell and microvascular growth and development in a time dependent manner. Cellular and Molecular Bioengineering. 13 (5), 507-526 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved