Method Article
新しいマイクロスピロメトリーツールを用いたサンゴホロビオントの生理学的特性評価
要約
このプロトコルでは、サンゴのホロビオントの生理学的特徴を調査するために使用できるマイクロスピロメトリーシステムのセットアップと実行について説明します。
要約
代謝活動は、エネルギーを含む生物のプロセスの合計として定義され、地球上の生命の機能と進化を理解する上で非常に重要です。したがって、生物の代謝率を測定することは、生物の生理学的状態、それらの生態学的役割、および陸生および水生生態系内の種に対する環境変化の影響を説明する中心にあります。サンゴ礁では、サンゴとその義務的な藻類共生生物(Symbiodiniaceae)との間の共生機能を定量化し、気候変動を含む環境ストレス要因がサンゴの健康にどのように影響するかを評価するために、代謝の測定が使用されてきました。この重要性にもかかわらず、サンゴの子孫の代謝率測定に関連する方法、したがってデータが不足しており、おそらくサイズが小さいためです。このギャップに対処するために、本研究は、小さな(ミリメートルサイズの範囲)海洋動物の生態の呼吸を測定するためのカスタムセットアップを開発することを目的としていました。この低コストでセットアップが簡単なため、代謝率の測定が改善されるはずです。これは、サンゴ礁の回復のためにサンゴの有性生産を利用する応用生態学的研究に不可欠です。
概要
呼吸は、生物の全体的な代謝活動を示す重要な生物学的測定値ですが、他の重要な形質(成長)と同様に、小さな生物では測定が困難です1。呼吸は、酸素の使用による有機分子の酸化として定義できます。このプロセスは、生物の生存に不可欠な細胞機能(代謝)に必要な化学エネルギーを生成します。あるいは、嫌気性代謝は酸素負債2をもたらす。呼吸数は、密閉チャンバー内での酸素濃度の経時的な使用量(したがって減少)を測定するオプトードを使用して決定でき、一般にレスピロメトリー3として知られています。大多数の生物が酸素を蓄えていないことを考えると、代謝速度は呼吸と炭素使用量の直接的な相関関係から推測できます。このため、呼吸数は毎日の炭素使用量に変換でき、成長、繁殖、および一般的にサンゴのストレスや白化につながる熱波条件を含む環境ストレス4,5の時期に代謝恒常性を維持する能力などの重要な代謝機能に情報を提供します。
サンゴ礁は世界的に加速度的に減少しています。このサンゴ礁には、渦鞭毛藻の共生虫科、菌類、細菌、ウイルスなどのパートナーが生息しており、総称して「ホロビオント」と呼ばれています6。海水温が上昇すると、高温は渦鞭毛藻の共生虫(以下、共生生物)の喪失につながるため、サンゴ、ひいてはサンゴ礁は生き残るための圧力が高まっています。貧栄養熱帯水域のサンゴには、無機窒素やリンなど、多くの栄養素が利用できない8。これに対処するために、サンゴは渦鞭毛藻の共生生物(Symbiodiniaceae)と義務的な栄養共生を形成し、サンゴの宿主が生き残り、炭酸カルシウムの骨格を堆積させるために必要な栄養素の大部分を提供します9。機能的な共生は、パートナー間の高レベルの炭素共有によって特徴付けられる可能性があり10,11、共生の調節には動的なホメオスタシス12が含まれます。
暑熱ストレスの間、この動的な調節と伝達が中断され、嚥下障害と漂白が起こります(参考文献13でレビュー)。したがって、光合成や呼吸などの代謝測定は、サンゴの健康な状態と調節されていない非細菌叢状態の両方を解明する可能性を秘めており、個体発生全体にわたってこれらのプロセスを正確に測定することは、生物の機能を理解する上で重要です。これは、大量の白化現象の頻度と規模が増加するにつれて特に重要であり、気温が上昇するにつれて炭素移動が減少することがわかっている共生生物からの栄養分担の変化に影響を与える可能性があります14。これは、共生生物が栄養素を隔離するメカニズムによるものか、またはハード生理学的トレードオフ(熱耐性は向上するが宿主の生存率は低下する)によるものかも知れない15,16,17。共生の破綻は共生生物と宿主の両方に起因している可能性があるが、その主な要因は共生生物の細胞機能不全である可能性が高い18。しかし、海水温の上昇によるストレスは、この共生を不安定にします。共生生物から宿主への炭素分担は減少し19,20、サンゴの飢餓が続く可能性があります。これは、宿主の使用量の増加(「固定炭素の異化作用の増加」)によるサンゴの脂質と炭水化物の貯蔵の減少に反映されている可能性があり、おそらく共生生物による共有の減少が原因である11。サンゴの共生生物の光合成と呼吸の貢献と並んで、サンゴ動物の呼吸は、サンゴの健康、これらのパートナー間の白化と栄養素交換の影響、および環境変化を生き残ることに関連する表現型であるホロビオントの成長を理解するための重要な尺度です8,21,22.最後に、多くのサンゴが共生していることを考えると、呼吸に加えて光合成を特徴付けるためのレスピロメトリーの使用は、P:R比を文脈化し、共生が安定しているかどうかを理解するのに特に役立ちます(例えば、参考文献23)。
したがって、環境の変化はサンゴとその共生生物のエネルギー収支に変化を引き起こし、成長の違いにつながります14。対処するために、サンゴの宿主は、その代謝要求を満たすために呼吸と脂質の使用量を増やすことができます。熱ストレスは、溶存酸素の変化によって測定されるこの呼吸の増加により、正味の生産性を60%低下させる可能性がある14。また、共生動物は窒素同化と炭素保持を増加させ14,24、これらの蓄えを利用してエネルギーを自身の修復と保護のメカニズムにシフトさせる可能性があります25,26。NとCのバランスは成長を調節するために重要であり、特にPは27であり、共生生物の個体数の動的な調節として現れる可能性がある。実際、広大なサンゴ礁(>1,000 km)のサンゴから収集された証拠は、サンゴの種類によって異なるものの、宿主がPの調節を通じて共生生物の成長を制限する能力を持っていることを示唆しています27。
まとめると、これらの研究は、環境の変化による栄養素の生産または移動(すなわち、共生傾向)のいずれかの同時進行の減少を伴う熱耐性の獲得を示唆しています。したがって、マイクロスピロメトリー による 酸素使用量の定量化などの強力な単一稚魚法を使用して、代謝に関連する基本的なメカニズムを理解し、耐熱性の獲得の理解などの保存の問題に適用する必要があります。これは、サンゴの稚魚とその藻類共生生物の間の栄養関係を調査することを目的とした生理学的測定のためのマイクロスピロメトリーツールとしてここで紹介されていますが、他の小さな海洋生物に適しています。
生物による酸素の使用または生成は、それらを個々の密閉された呼吸測定チャンバーまたは「呼吸計」(以下、チャンバー)に入れることによって測定でき、酸素変化はオプトード3を使用して測定されます。オプトードは、光パルスを使用して酸素濃度を測定するプローブであり、時間の経過に伴う測定値を記録することで、呼吸速度や光合成速度を計算できます。実際には、呼吸の測定はサンゴの光合成の測定に似ていますが、サンゴが完全な暗闇で孵化することを除いて。1日の光合成総量からサンゴと共生生物の1日の総呼吸数を差し引くと、酸素差(酸素デルタ)が生じます2,3。一般に、生物は生成するよりも多くの酸素を使用するため、欠乏が生じます。これは、酸素と炭素が一定の比率で消費されるため、炭素当量に変換できます2。余剰炭素は、サンゴの成長、粘液の合成と繁殖、およびその他の重要な代謝ニーズに使用できます12。
このプロトコルでは、0.5 μmのろ過海水で満たされたカスタムメイドの1.5 mLガラスチャンバー設計(GL25スレッド、高さ20 mmのバイアル、バンプ/リッジ、平らな地面のリム、穴付きのスクリューキャップ、材料表を参照)を使用して、個々のサンゴの稚魚の呼吸速度(R)を測定するために採用されたマイクロ呼吸法(図1)について説明します。光ファイバーオプトード(材料表参照)を蓋の側面の穴から各チャンバーに挿入した。個々のサンゴは、チャンバー内の水が適切に混合されるように、磁気攪拌棒の上の硬いメッシュのフロースルースターラープレートプラットフォームの上に取り付けられました。ここでの代表的な例では、複数のコントローラーを同時に実行していたため、2つのコントロールまたは「ブランク」(試料の存在以外は同一のチャンバー)を3つの複製試料チャンバーと同時に測定しました。ただし、セットアップ例(図2)では、4つのチャネルの使用のみを示しています。これは、複数のコントローラーと複数のフロースルースタンドを使用して増やすことができます。このシステムでは、再循環フロースルー(75 L/hに設定された連続的で穏やかな流量)システムを使用して、あらかじめ設定された水温(制御の場合は27°C、高温応力の場合は31°C)で各チャンバーをカスタムメイドの水槽に浸すことによって、温度を制御することもできます。攪拌板プラットフォームと歯車付き攪拌板は、任意のサイズにすることができ、ガラスチャンバーの数に対応するために、必要に応じて大きくまたは小さくすることができます。この例では、プラットフォームとプレートは約34 cm x 26 cm x 3 cmでした(材料表)。オプトードのキャリブレーションは、この実験設定に適した水温と塩分濃度で酸素飽和度が 0% と 100% を表す 2 つの標準溶液を使用して、各分析の前に実行しました。
プロトコル
1.呼吸室内の機器とサンゴのセットアップ
注:2018年10月の満月の日にマグネティック島(南緯19度6.249分、東経146度51.728分)のサンゴ礁から、繁殖準備が整ったサンゴ(すなわち、 種Acropora tenuis コロニーの断片化された小枝からピンクがかった色素沈着した卵子/精子の束が見えるもの)を採取し、サンゴの産卵のために実験室に持ち込んだ。 サンゴの稚魚が繁殖し、成長した場所。
- 測定当日は、青色のポリパイプとコネクタを使用して2枚の水槽プレートを接続します( 材料表を参照。 図1 [5]、 図2A、B)。これらは、青いポリパイプと給湯器/チラーに接続した後、インキュベーターとして機能します。回転測定チャンバーが設置されていないときは、透明なウォーターバスプレートを通してモータープレートがはっきりと見えることを確認してください。
- 2本のホースを給湯器/チラーに接続します( 材料表を参照)。給湯器/チラーのスイッチを入れ、希望の実験温度(27°Cまたは31°C)を設定します。
- ウォーターバスのベース(ステップ1.1)を磁気ギア(図1 [6、7]および 図3A)でベースモータープレートに接続し、次にこのアセンブリを電源(図3B)に接続します。電源をオンにしてギアを作動させると、チャンバー内の攪拌機バーが作動します。
- 必要に応じて、バルブコネクターのノブを使用して水流を調整します(たとえば、30 rpmでゆっくりと攪拌しながら、75 L/hに設定した連続的で穏やかな流量)。
- レスピロメトリーチャンバーを組み立てるには、磁気ビーズ(図1 [1.5])をガラスチャンバー(図1 [1.6])に追加し、次に不透明なプラスチック製のフロースルースタンドベース(図1 [1.4])をガラスチャンバー(図4A)に追加します。チャンバーと磁気ビーズのサイズは、関心のある生物と研究システムによって異なります。
注意: プラスチックベースには穴があり、底面の磁気ビーズの動きによる水の流れと循環を可能にします。 - 水槽用接着剤(材料表を参照)を使用して、プラスチックベースに配置された黒い結束バンドにサンゴを接着します(図4B-D)。これを行うには、まずサンゴの稚魚を黒いプラスチック片に接着し、次にこの部分をプラスチックベースに接着します。サンゴがしっかりと固定されたら(接着剤の硬化はほぼ瞬時に行われます)、Oリング(図4A)で蓋をガラスチャンバーにねじ込みます。これらのアクションは、別の洗面器で水中で実行し、スピロメトリーチャンバー内に空気がないことを確認します。
注:呼吸計内の水の量(すなわち、有効容量= 1.5 ml)は、チャンバーを水中に完全に沈めることによって決定されました。水量に対して、非常に小さなサンゴの質量/密度からの変位は無視できると仮定します。ここでは、1.5 mLの微量遠心チューブをスケール用に示しています(図4A)。 - チャンバーをウォーターバスにしっかりと入れます(図5A)。ガラスチャンバーが実験用の温度制御された水と接触していることを確認してください。
- O2 光ファイバーケーブル( 材料表を参照)を、蓋チャンバーの側面に開けられた穴に挿入して、酸素センサースポット(以下、スポットと呼びます; 材料表を参照)に接触するように接続します。これらの小さなスポットは酸素に敏感で、チャンバー内から光ファイバーケーブルを介して信号を検出して送信します。
- 配管テープ(白く薄いセルフシールテープ)を追加して、ケーブルがぴったりとフィットし、水室内にしっかりと留まるようにします。チャンバー内に、茶色の触手が上を向いて、個々のサンゴが見えるようにします(図5Bを参照)。
注:装置内のコンポーネントのコスト見積もりを 表1に示します。
- 配管テープ(白く薄いセルフシールテープ)を追加して、ケーブルがぴったりとフィットし、水室内にしっかりと留まるようにします。チャンバー内に、茶色の触手が上を向いて、個々のサンゴが見えるようにします(図5Bを参照)。
2.O2 システムを用いた呼吸測定の標準操作手順
- 酸素測定ソフトウェアを開きます( 材料表を参照)。
- 校正を行う部屋の温度を測定します。これは、後でキャリブレーション段階(ステップ2.8)で必要になります。
- 光学センサーとキャップを組み立てます。これを行うには、すべての光ファイバーをO2 モジュールの一致するポートに接続します。キャップ 1 とセンサー 1、キャップ 2 とセンサー 2 などを一致させてください。
- キャリブレーション用のチャンバーをセットアップするには、まず清潔なスポンジを少量の逆浸透(RO)水で湿らせ、各チャンバーに挿入します。
注意: スポンジは滴り落ちず、湿らせてください。光ファイバースポットに滴り落ちる場合があります。次のステップに進む前に、スポットが濡れていないことを確認してください。 - チャンバーを逆さまにして、対応する光ファイバーを取り付けます(図6)。これにより、光ファイバーに触れることなくチャンバーのネジを外し、0%キャリブレーション用の亜硫酸ナトリウムを追加することができます。
- キャリブレーションを開始する前に、各センサーの信号を確認してください。ソフトウェアインターフェースのすべてのタブに目を通し、信号値(左上隅)をチェックし(図7A)、大きく変化していないことを確認します。実験セットアップの許容値については、O2 マニュアルを確認してください(関心のある生物と条件によって異なります)。この特定のセットアップでは、室温が25.3°Cの場合、FTC(セル正常範囲を通る酸素センサースポットフロー)が20.59で、信号が179.5で許容されます。
- [プログラム]を開き、ソフトウェアの設定をチェックして、以下に概説するように正しいことを確認します。プログラムを開いた直後にポップアップウィンドウが表示されない場合は、ソフトウェアインターフェイスの左下隅にある[設定]ボタンをクリックして実行できます。
- 外部温度センサーが作動していることを確認します(図7B)。設定を [Fixed temperature](固定温度 )に変更します(図7C)。次に、室温の値を追加し、[ 設定を他のすべてのチャンネルにコピー]をクリックします。
- 設定を [Reduce Signal Drift ]に変更します(図7C)。次に、[ センサー設定 ]を選択し、 レベル2を選択します。そうしないと、小容量を使用する場合、ドリフトが非常に大きくなり、校正が困難になります。
- チャンネルの一般設定を確認してください。適切な場合は [OK] を押します。[ 設定をすべてのチャネルにコピー] をクリックし、[ OK] をクリックします。
- センサーを校正します。チャンネル1のキャリブレーションについては、 チャンネル1 タブに移動し、 キャリブレーション ボタンを押します。 水中または湿った空気中の2点を選択します。
- 「空気」キャリブレーションでは、発泡スチロールを水に浸し、チャンバー内に置き、信号が安定するのを待ちます(エアキャリブレーションの前後の画像を参照)。安定したら、「空気の設定」を押します。 air>Calibrate>airをクリックします。
- 0%と100%のキャリブレーションを設定します(図7D)。チャンバーをキャップから取り外し、次のキャップに入れて、最初のセンサーの0%校正が終了したときに空気校正信号の準備が整うようにします。トランスファーピペットを使用し、キャップに2%亜硫酸ナトリウムを充填します。信号が安定するのを待ちます。
注意: 信号は通常、空気のキャリブレーションと比較して安定するのに時間がかかります。「値が通常の範囲外です」という警告メッセージが表示された場合は、亜硫酸ナトリウムが新鮮であることを確認してください。すべてのチャンネルに対して同じキャリブレーションプロセスを繰り返します。100 mLのRO水に2 gを加えて亜硫酸ナトリウムを調製します。 - 校正が完了したら、呼吸室をよくすすぎ、呼吸室とキャップを乾かします。光ファイバーの穴に水がないことを確認してください。
- 生物(この例では単一のサンゴの幼魚)を呼吸室に入れ、蓋で閉じます。蓋をするときは、チャンバーが完全に水没し、内部に空気がまったくないときに必ず行ってください。
- チャンバーを攪拌プレートにしっかりと置き、光ファイバーを接続します。
- 電源をオンにします。チャンバー内の水が完全に混ざっていることを確認してください。チラー/ヒーターの温度を選択した実験温度に設定します。
- ポンプとヒーターをオンにします(手順1.2および1.4)。
- O2測定ソフトウェアインターフェースのログを押して、記録を開始します。
結果
データ処理と分析
スピロメトリー実験の生データを処理する方法は多数ありますが、Rパッケージ respR28を使用することをお勧めします。オープンサイエンスと再現性を提唱する上記のプロトコルの共有に合わせて、このパッケージは、データ処理と分析を再現しやすい形式で共有することを可能にし、それを念頭に置いて設計されています。これは、無料のオープンソースプラットフォームであり、プローブシステムに依存しず、CRANまたはGitHubから簡単にインストールできます。 respR の完全なコードと例は保守されており、https://github.com/januarharianto/respR にあります。
respRパッケージには、スピロメトリーデータをインポート、可視化、品質管理を行う機能や、自動または手動で選択した領域から呼吸数を計算する機能があります。また、バックグラウンド呼吸のレートや、一般的に使用される出力単位への変換レートを調整することもできます。マイクロスピロメトリーシステムからのデータを処理する手順を以下に詳しく説明します。この研究では、例としてスピロメトリーシステムからのデータを使用しましたが、このパッケージは、市販されているほとんどの酸素プローブシステムや汎用のRデータオブジェクトからの入力も受け入れます。完全なドキュメントやチュートリアルなど、パッケージの詳細については、パッケージの Web サイト (https://januarharianto.github.io/respR/index.html) を参照してください。
生データのインポート
生の出力ファイル(.txt)がインポートされます。 respR は形式を認識し、後続の関数で使用できる汎用 R データ フレームに解析します。ただし、これはオプションであることに注意することが重要です。これらのファイルと事実上すべての酸素時系列データは、R の基本的な知識を持つ人なら誰でも基本関数 (以下を参照) を使用してインポートすることもできます。
#load respR
ライブラリ(respR)
#Import ---
データ<-import_file("file.txt")
#Firesting-Pryo ファイルが検出されました
データの検査と視覚化
データ分析タスクの重要な部分は、データをプロットして検査し、明らかな異常やパターンを探したり、単に理解に役立てたりすることです。ここでは 、非 数値値や欠損値など、スピロメトリーデータに共通する問題をチェックするinspect関数(図8A)が使用されています。
酸素カラムを1本 #inspect
Insp <-inspect(データ、時間 = 3、酸素 = 8、幅 = 0.2)
また、この関数は酸素時系列をプロットし、ローリングレート(下のパネル)を計算して、このレートが実験の過程でどのように変化するかを解明するのに役立ちます。これらのローリングレートプロットは、これらのレート曲線のどの領域を抽出する必要があるかを通知するのに役立ちます。標準またはルーチンの代謝率の場合、望ましい領域は、速度が安定を示す領域です(例:.、約3,000時点以降; 図8B)。
ここでは、酸素の減少は、全時系列パネルの行200付近でのみ検出可能になります。このようなパターンは、スピロメトリーデータでは非常に一般的です。実験開始時には、システムが安定し、試験片が実験条件に順応するため、不安定な状態が長引くことがよくあります。レートは、この最初の不安定性の後の時系列からのみ抽出することが推奨されており、これも視覚化の重要性を強調しています。
抽出率
respR には、呼吸数を抽出するための2つの機能があります。1 つ目は calc_rate() 関数で、時間、行、または酸素レベルの領域を指定することで、速度を手動で抽出できます。これは、スピロメトリー分析では非常に一般的であり、選択基準が決定され、一貫して適用されている限り、レートを決定する完全に受け入れられる方法です28。
より堅牢で客観的な方法は、データの線形領域を識別する auto_rate() 関数を使用することです。これらの領域は、機械学習を使用して自動的に割り当てられる、一貫して持続する呼吸数を持つ領域です。この機能は、低シグナルの検出にも役立ちます(この年齢ではバイオマスが少ないため、今回の研究で使用したサンプルのように)。この関数は、独立し、客観的で、統計的に頑健な方法28を用いて、最も直線的、最小、および最大レートの識別を可能にする。この例では、3,000 から 5,000 の時点付近で発生する線形領域を特定します。複数の線形領域が識別され得るが、このセクションは最高ランクの、または最も線形な領域であることに留意されたい(図8C)。
#Determine 最も直線的な(つまり、一貫した)レート
レート <-auto_rate(insp)
背景調整
対照実験からのバックグラウンド率は、上記の例と同様の方法で決定でき、 adjust_rate()関数を使用して検体レートを調整するために使用できます(図9A;ここでは完全な分析は示さず、調整のみを示していることに注意してください)。完全な例は、 respR のWebサイトで詳しく説明されています。
バックグラウンドの #Adjust 率
rate_adj <-adjust_rate(rate, by = bg) #saved bg オブジェクト
印刷(rate_adj)
レートの換算
最後のステップは、生データの元の単位、呼吸計の有効容積、およびブランク測定値への正規化を含むその他の実験データを使用して、レートを目的の出力単位に変換することです(図9B)。出力は、絶対呼吸数、つまり標本全体の呼吸数、または質量または表面積固有の速度にすることができます。表面積比率はここで使用した出力であり、具体的には、絶対率を試験片の表面積で割ったものです(図9C)。
前述したように、このシステムは非常に小さな試料を測定するために開発されました。したがって、低い値とブランク測定値と重複する可能性があることが予想されました。ブランク内にはある程度の信号が予想され、調べてみると、これらの値は、プローブのドリフト、わずかな温度変化、またはプローブの気泡などが原因で、一般的な実験ノイズの予想される範囲内にあります。設計上、試験片サイズが小さく、有効体積が小さいため、ブランクの使用は、特に各ランで特に重要です。ここでは、代表的な値を例として挙げています(図10)。試験片のサイズが小さいため、各ランでブランクを使用して、ランごとの測定を標準化することをお勧めします。
これらの空白値は、処理測定値を標準化するために使用されます。サンゴは酸素を生成することに加えて呼吸することを考えると、代謝率は負の値から正の値までの範囲です。ここでは、微小呼吸ツールから検出された呼吸値の範囲の代表的な結果の例を示します。これらの結果は、1匹のサンゴの稚魚で成功した実験から決定されました(図10)。全体として、サンプルのサイズが小さいため、このサンプルのデータセットでは(設計上)呼吸を検出するのが難しいと予想されました。これは、この低い信号閾値を捕捉する上でのこの方法の価値を強調しています。これらの代表的な結果は、テストされた最小の検体サイズでの暗闇での呼吸を示しており、このシステムの最小検出閾値を強調しています。また、2つの条件(コントロールストレスと高温ストレス)で測定しました。実行ごとに測定されたブランクに標準化した後、値はゼロに近い値(対照)から応力処理の中央値~-5e-5 の範囲でした。さすがに呼吸は少なかった。これらの結果は、ブランクの代表値と、これらの非常に小さなサンプルの対照と高温の比較を明確に示しています。

図1:サンゴのホロビオント(サンゴ動物+共生生物)または任意の小型生物(<1 mm)の生理学的特性評価のための新しいマイクロレスピロメトリーツールの概略図。 特注の蒸着チャンバーが作られました(番号1;1.1-1.6)。これらには、酸素センサースポット(1.2)を備えた蓋(1.1)が含まれ、個々の稚魚(1.3)は、マグネチックスターラー(1.5)の上に設置されたフロースルースタンド(1.4)に置かれ、これらはすべてガラスチャンバー(1.6)内に収まります。コントローラー (2) は、蓋 (1) に収まる光ファイバーケーブルでスポットに取り付けられ、コンピューター (3) に接続されます。ヒーター/チラー(4)は、モーター(8)と電源(9)によって駆動されるギア(7)を備えた攪拌プレート(6)の上部にあるフロースルー水(方向を示すシェブロン矢印で示される)を備えた回転測定プレート(5)に接続します。 この図の拡大版をご覧になるには、ここをクリックしてください。

図2:マイクロスピロメトリーのセットアップ。 (A)1枚のスピロメトリープレート、または(B)複数のプレートに接続するなど、複数のオプションが用意されています。 この図の拡大版をご覧になるには、ここをクリックしてください。

図3:レスピロメトリープレート上部の特注マグネチックスターラープレート。 各チャンバーには、(A)下にマグネチックスターラーギア、(B)モーターで駆動、(C)ヒーター/チラーにチューブで接続されたスピロメトリープレートがあります。 この図の拡大版をご覧になるには、ここをクリックしてください。

図4:カスタムの呼吸測定チャンバーのセットアップ。 (A)コンポーネント(左から右へ:蓋、ガラスバイアル、スタンド、スケール用1.5mlチューブ、スターラーバー)。(B)試験片が収まる個別のフロースルースタンド。(C)フロースルースタンドの上から見た図。(D)蓋をねじ込んだ状態で、スタンドをガラスバイアルの内側に置いた状態。 この図の拡大版をご覧になるには、ここをクリックしてください。

図5:攪拌機プレート内に配置されたガラスバイアル。 (A)特注の攪拌機プレート (B)蓋付きのガラスバイアル全体のクローズアップ。稚サンゴは、結束バンドの上にあるここの蓋(茶色の点)を通して見え、光ファイバーは蓋の開口部に配置されています。 この図の拡大版をご覧になるには、ここをクリックしてください。

図6:チャンバーを逆さまに置き、校正の準備を整えた状態。 この図の拡大版をご覧になるには、ここをクリックしてください。
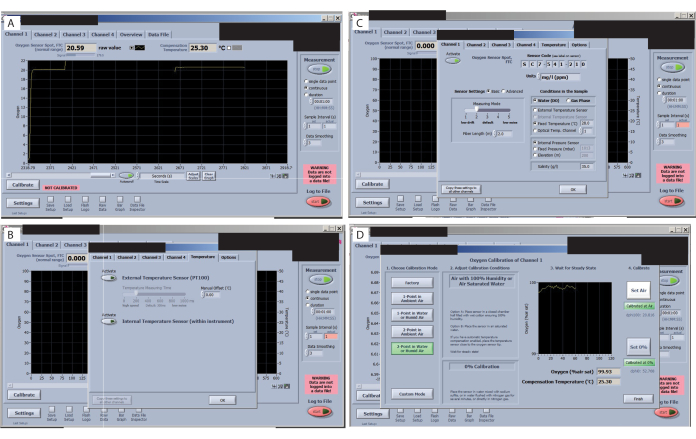
図7:酸素測定ソフトウェアの主な手順。 (A)各センサーの信号を確認します。この研究とセンサーに最適な信号は、酸素センサースポットFTC(正常範囲)に示されています。(B)信号ドリフトを確認します。(C)処理温度を設定して確認します。(D)0%と100%のキャリブレーションを設定して確認します。 この図の拡大版をご覧になるには、ここをクリックしてください。

図8: respR 解析出力ステップI. (A)コマンドと出力を検査します。(B)レートの安定性を確認します。(C)最も線形率を決定します。 この図の拡大版をご覧になるには、ここをクリックしてください。
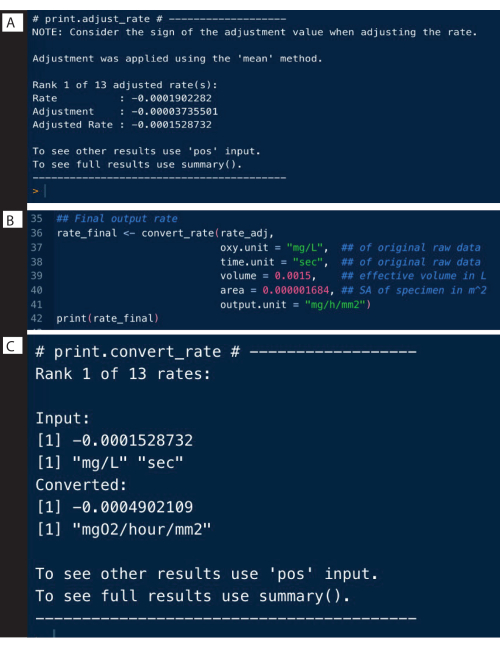
図9: respR 解析出力ステップII. (A)バックグラウンドのレートを調整し、(B)変換し、(C)レートを確認します。 この図の拡大版をご覧になるには、ここをクリックしてください。
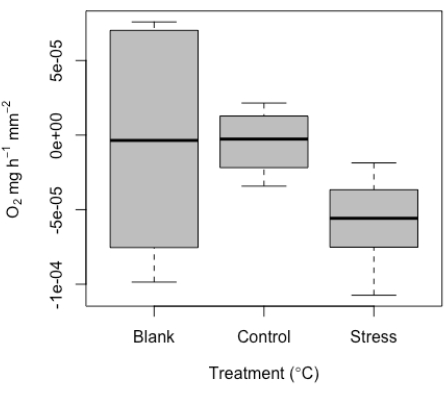
図10:マイクロスピロメトリーツールから得られた代表的な結果。 個々のサンゴの稚魚を複製する呼吸の中央値(O2 ±標準誤差)は、ブランク値、および制御下および高温ストレス条件下の個体の呼吸を含む。 この図の拡大版をご覧になるには、ここをクリックしてください。
ビデオ1:測定セッション中の稚サンゴが入ったスピロメトリーチャンバーのトップダウンビュー。このビデオをダウンロードするには、ここをクリックしてください。
表1:呼吸測定装置のコンポーネントのコスト見積もり。この表をダウンロードするには、ここをクリックしてください。
ディスカッション
この研究は、小さな固着性水生生物によって消費および生成される酸素の量を定量化するために使用できるカスタムメイドのマイクロスピロメトリーセットアップの構築について概説しています。このプロトコルの重要な要素には、スポットを含むチャンバーのセットアップと、 respR パッケージを使用した低信号の較正が含まれ、低信号は浅いまたはノイズの多いスロープに代表されるレートとして定義できます。カスタムチャンバーとそのセットアップにより、低信号でも検出でき、Rパッケージの使用により、浅いスロープやノイズの多いスロープの発生が結果の誤った解釈(誤検知など)につながる可能性のある問題から保護されます。
他のユーザーに必要となる可能性のある変更には、カスタムメイドのチャンバー内で目的の生物を確保することが含まれます。この場合、小型で硬い結束バンドと水槽用接着剤を使用して、1匹の稚魚をプラスチックベースに固定し、ネクタイに接着しました。なお、この実験では、サンゴの稚魚を黒いビニールシートの上に定着させました。このプラスチックにより、サンゴの稚魚を簡単に取り除くことができ、プラスチックから効果的に滑り落ち、除去中にサンゴを物理的に傷つけないようにしました。サンゴの稚魚は沈殿する基材に付着するため、人工ペプチド16 を使用して同様のプラスチック材料に沈殿させ、接着プロセスのための除去を容易にすることをお勧めします。ハンドリングストレスと呼吸反応への影響をさらに最小限に抑えるために、多くの成体のサンゴストレス実験で一般的であるように、結束バンドに取り付けられたサンゴを1〜2週間順応させることをお勧めします。ふたの斑点の上に生物を固定し、水の循環を可能にするために、他の変更が必要になる場合があります。もう1つの重要なトラブルシューティングステップは、特に酸素時系列の傾きで、速度を決定する必要がある信号検出です。結局のところ、これは、明らかに不安定なデータを除外するために適切な判断を下すことと、 respR 内の関数を組み合わせて、一貫して選択された領域からレートを抽出できるようにするか、データの線形領域を特定することによって自動的にレートを抽出できるようにすることに帰着します。これを行う方法のその他の例は、 respR の Web サイトで入手できます。
この方法は、呼吸の下限の測定を非常に小さく、固着した海洋無脊椎動物にまで拡張するために開発されました。明らかな制限は、このプロトコルは、より大きなバイオマス用に設計されたプロトコルと比較して、偽陽性が発生しやすい可能性があることです。しかし、これらの下限値を測定することが設計のポイントであったことを考えると、これは設計に織り込まれており、この手順をrespRパッケージとともに使用して、誤検出に対する保護を強化することができます。また、呼吸30を測定するための他のシステム、およびこれよりも少ない容量(~0.5〜1mL)の個々のカイアシ類31のスピロメトリーを含む小さな生物の測定のための他のシステムが存在するが、高価であるか、または特定の成分(攪拌能力)を欠いていることを認識することも重要である。ただし、このシステムはオープンソースであり、商用システム(コアマイクロプレートシステムなど)と比較して比較的低コストです。このシステムには、他のシステムにはない可能性のある攪拌などの重要な方法論的考慮事項も組み込まれています。内部攪拌棒機能は、多くの海洋生物(例えば、泳ぐカイアシ類)の自然な水の混合を再現するために不可欠ですが、これはしばしば不可能であり、データをほとんど使用できない可能性があります。対照的に、利用可能な他の混合方法には、追加の機器が必要で混合の成功が限られている巨大なロッカーベンチに呼吸計全体を置くこと、または生物に障害を引き起こす可能性のある振動による混合が含まれます。このため、サンゴの稚魚やその他の非常に小さな固着性生物にスピロメトリーを行うことができる唯一のシステムです。参考までに、ここに含まれた標本のサイズ範囲は、2.1〜3.6個のポリープ(わずか数ヶ月齢に相当)の範囲であり、最小から最大までの平均面積は1.3〜4.5mm2であった。
スピロメトリーは生態学研究の基本的な手段であり、この目的のために多くの方法が存在します。しかし、これらの既存の方法のほとんどは、魚全体、サンゴの破片、海草などの高バイオマスサンプルを対象としています32,33,34。この方法は、個々のサンゴの稚魚を使用した最初の方法です。さらに、この方法は、生物の機能に関する重要な生理学的情報を提供するため、多くの潜在的な用途があります。これは、ベースラインの健康推定値を特徴付け35、暑熱ストレス36などのサンゴの個体発生中の急性または長期ストレスの役割を理解し、またはサンゴ礁の健康を保護および改善するために管理者が設定できるしきい値を提供する37ことを目的とした研究にとって重要です。サンゴがホロビオントであり、共生生物群集がこの段階と生後1年間を通して比較的柔軟であることを考えると38、生物全体の機能を完全に文脈化するために、スピロメトリーデータと時間の経過に伴う群集の変化を組み合わせることは興味深いことです。重要なことは、この手法が「オープンサイエンス」技術に貢献し、オープンに共有、改善、標準化できるカスタム実験セットアップを作成するためのアウトラインを提供するのに役立つことです。
開示事項
著者は何も開示していません。
謝辞
著者らは、Sam Noonan氏の支援とアドバイス、最初の回転測定チャンバーの使用についてSven Uthicke氏、エンジニアリングイラストレーションを担当のBen Shelab氏、および呼吸測定チャンバーのアダプターとホルダーの特注加工をしてくれたオーストラリア海洋科学研究所のワークショップに感謝します。サンゴは、AIMS G12 / 35236.1のグレートバリアリーフ海洋公園の許可の下で収集されました。珊瑚は倫理許可を必要としません。
資料
| Name | Company | Catalog Number | Comments |
| Cost | |||
| (1.1 – 1.6) Custom respirometry chambers | LabGlass Party Ldt. | 1.5 ml | $407.26 |
| 1.1 lids | AIMS workshop | Vial GL25 thread | ~$10 |
| 1.2 fiber-optics spots (FireStingO2 II fiberoptic optodes) | PyroScience | Oxygen sensor spots, 125 µm PET foil, Ø5 mm, with optical isolation, SN: 183801947 | $41.25 AUD each |
| 1.3 individual organism | NA | NA | NA |
| 1.4 flow-through stand | AIMS workshop | Custom | included in points 5 and 6 price (the workshop gave me an estimate of the lids, stand with gears, motor, incubation flow through |
| 1.5 magnetic stirrer | Any manufactuer is suitable | NA | ~$2? |
| 1.6 glass chamber (vial GL25 thread x 20 mm high, with bump/ridge, flat-ground rim, screw cap with hole, Labglass Pty Ltd, Stafford QLD) | Labglass Pty Ltd, Stafford QLD | Vial GL25 thread x 20 mm high, with bump/ridge, flat-ground rim, screw cap with hole | $50.9 AUD |
| 2 FireSting controller (2) | PyroSciences | NA | 4 sensors is 4000 Euros. 8 sensors used here. |
| 3 computer | NA | NA | NA |
| 4 heater/chiller | VWR International | NA | Small models around $4,000 AUD |
| 5 respirometry plate platform | AIMS workshop | 34 cm x 26 cm x 3 cm (although any dimensions are adequate to fit desired number of chambers) | $1250 AUD |
| 6 stirrer plate with gears (7) | AIMS workshop | 34 cm x 26 cm x 3 cm | $1250 AUD |
| 8 powered by the motor | AIMS workshop | Custom | $700 AUD |
| 9 power supply | Non-specific | NA | ~$300 AUD |
| Aquarium glue | Seachem reef glue | 20g | $14 |
| Oxygen Logger Software | PyroScience | NA | NA |
| Polypipe and connectors | John Guest | NA | $20 |
| Sodium Sulfite | Sigma | S0505-250G (CAS number 7757-83-7) | $54 |
参考文献
- Quigley, K. M. A fast, precise, in-vivo method for micron-level 3D models of corals using dental scanners. Methods in Ecology and Evolution. 13 (10), 2159-2166 (2022).
- Svendsen, M. B. S., Bushnell, P. G., Steffensen, J. F. Design and setup of intermittent-flow respirometry system for aquatic organisms. Journal of Fish Biology. 88 (1), 26-50 (2016).
- Lighton, J. R. B. Measuring Metabolic Rates: a Manual for Scientists. , Oxford University Press. (2018).
- Carey, N., Harianto, J., Byrne, M. Sea urchins in a high-CO2 world: partitioned effects of body size, ocean warming and acidification on metabolic rate. The Journal of Experimental Biology. 219 (Pt 8), 1178-1186 (2016).
- Clark, T. D., Sandblom, E., Jutfelt, F. Aerobic scope measurements of fishes in an era of climate change: respirometry, relevance and recommendations. The Journal of Experimental Biology. 216 (Pt 15), 2771-2782 (2013).
- Voolstra, C. R., et al. Extending the natural adaptive capacity of coral holobionts. Nature Reviews Earth & Environment. 2 (11), 747-762 (2021).
- Hoegh-Guldberg, O. Climate change, coral bleaching and the future of the world's coral reefs. Marine and Freshwater Research. 50 (8), 839-866 (1999).
- Morris, L. A., Voolstra, C. R., Quigley, K. M., Bourne, D. G., Bay, L. K. Nutrient availability and metabolism affect the stability of coral-symbiodiniaceae symbioses. Trends in Microbiology. 27 (8), 678-689 (2019).
- Yellowlees, D., Rees, T. A. V., Leggat, W. Metabolic interactions between algal symbionts and invertebrate hosts. Plant, Cell & Environment. 31 (5), 679-694 (2008).
- Rädecker, N., et al. Using Aiptasia as a model to study metabolic interactions in cnidarian-Symbiodinium symbioses. Frontiers in Physiology. 9, 214(2018).
- Matthews, J. L., et al. Optimal nutrient exchange and immune responses operate in partner specificity in the cnidarian-dinoflagellate symbiosis. Proceedings of the National Academy of Sciences. 114 (50), 13194-13199 (2017).
- Davy, S. K., Allemand, D., Weis, V. M. Cell biology of cnidarian-dinoflagellate symbiosis. Microbiology and Molecular Biology Reviews. 76 (2), 229-261 (2012).
- Weis, V. M. Cellular mechanisms of Cnidarian bleaching: stress causes the collapse of symbiosis. The Journal of Experimental Biology. 211 (Pt 19), 3059-3066 (2008).
- Baker, D. M., Freeman, C. J., Wong, J. C. Y., Fogel, M. L., Knowlton, N. Climate change promotes parasitism in a coral symbiosis. The ISME Journal. 12 (3), 921-930 (2018).
- Chakravarti, L. J., van Oppen, M. J. H. Experimental evolution in coral photosymbionts as a tool to increase thermal tolerance. Frontiers in Marine Science. 5, 227(2018).
- Quigley, K. M., Alvarez Roa, C., Beltran, V. H., Leggat, B., Willis, B. L. Experimental evolution of the coral algal endosymbiont, Cladocopium goreaui: lessons learnt across a decade of stress experiments to enhance coral heat tolerance. Restoration Ecology. 29 (3), e13342(2021).
- Buerger, P., et al. Heat-evolved microalgal symbionts increase coral bleaching tolerance. Science Advances. 6 (20), eaba2498(2020).
- Bieri, T., Onishi, M., Xiang, T., Grossman, A. R., Pringle, J. R. Relative contributions of various cellular mechanisms to loss of algae during cnidarian bleaching. PLoS One. 11 (4), e0152693(2016).
- Tremblay, P., Gori, A., Maguer, J. F., Hoogenboom, M., Ferrier-Pagès, C. Heterotrophy promotes the re-establishment of photosynthate translocation in a symbiotic coral after heat stress. Scientific Reports. 6, 38112(2016).
- Tremblay, P., Grover, R., Maguer, J. F., Hoogenboom, M., Ferrier-Pagès, C. Carbon translocation from symbiont to host depends on irradiance and food availability in the tropical coral Stylophora pistillata. Coral Reefs. 33 (1), 1-13 (2014).
- Wooldridge, S. A. Is the coral-algae symbiosis really 'mutually beneficial' for the partners. Bioessays. 32 (7), 615-625 (2010).
- Wooldridge, S. A. Breakdown of the coral-algae symbiosis: towards formalising a linkage between warm-water bleaching thresholds and the growth rate of the intracellular zooxanthellae. Biogeosciences. 10 (3), 1647-1658 (2013).
- Coles, S. L., Jokiel, P. L. Effects of temperature on photosynthesis and respiration in hermatypic corals. Marine Biology. 43, 209-216 (1977).
- Marubini, F., Davies, P. S. Nitrate increases zooxanthellae population density and reduces skeletogenesis in corals. Marine Biology. 127, 319-328 (1996).
- Iglesias-Prieto, R., Matta, J. L., Robins, W. A., Trench, R. K. Photosynthetic response to elevated temperature in the symbiotic dinoflagellate Symbiodinium microadriaticum in culture. Proceedings of the National Academy of Sciences. 89 (21), 10302-10305 (1992).
- Karako-Lampert, S., Katcoff, D. J., Achituv, Y., Dubinsky, Z., Stambler, N. Responses of Symbiodinium microadriaticum clade B to different environmental conditions. Journal of Experimental Marine Biology and Ecology. 318 (1), 11-20 (2005).
- Blanckaert, A. C. A., Reef, R., Pandolfi, J. M., Lovelock, C. E. Variation in the elemental stoichiometry of the coral-zooxanthellae symbiosis. Coral Reefs. 39, 1071-1079 (2020).
- Harianto, J., Carey, N., Byrne, M. respR-An R package for the manipulation and analysis of respirometry data. Methods in Ecology and Evolution. 10 (6), 912-920 (2019).
- Gamble, S., Carton, A. G., Pirozzi, I. Open-top static respirometry is a reliable method to determine the routine metabolic rate of barramundi. Lates calcarifer. Marine and Freshwater Behaviour and Physiology. 47 (1), 19-28 (2014).
- Burford, B. P., et al. Rapid range expansion of a marine ectotherm reveals the demographic and ecological consequences of short-term variability in seawater temperature and dissolved oxygen. The American Naturalist. 199 (4), 523-550 (2022).
- Morozov, S., McCairns, R. J. S., Merilä, J. FishResp: R package and GUI application for analysis of aquatic respirometry data. Conservation Physiology. 7 (1), coz003(2019).
- Leclercq, N., Gattuso, J. -P., Jaubert, J. Primary production, respiration, and calcification of a coral reef mesocosm under increased CO2 partial pressure. Limnology and Oceanography. 47 (2), 558-564 (2002).
- Anthony, K. R. N., Hoegh-Guldberg, O. Variation in coral photosynthesis, respiration and growth characteristics in contrasting light microhabitats: an analogue to plants in forest gaps and understoreys. Functional Ecology. 17, 246-259 (2003).
- Moulin, L., et al. Long-term mesocosms study of the effects of ocean acidification on growth and physiology of the sea urchin Echinometra mathaei. Marine Environmental Research. 103, 103-114 (2015).
- Quigley, K. M., Bay, L. K., van Oppen, M. J. H. Genome-wide SNP analysis reveals an increase in adaptive genetic variation through selective breeding of coral. Molecular Ecology. 29 (12), 2176-2188 (2020).
- Brunner, C. A., Ricardo, G. F., Uthicke, S., Negri, A. P., Hoogenboom, M. O. Effects of climate change and light limitation on coral recruits. Marine Ecology Progress Series. 690, 65-82 (2022).
- Quigley, K. M., Alvarez Roa, C., Torda, G., Bourne, D., Willis, B. L. Co-dynamics of Symbiodiniaceae and bacterial populations during the first year of symbiosis with Acropora tenuis juveniles. MicrobiologyOpen. 9 (2), e959(2020).
- Quigley, K. M., Bay, L. K., Torda, G., Willis, B. L. Leveraging new knowledge of Symbiodinium community regulation in corals for conservation and reef restoration. Marine Ecology Progress Series, 600. , 245-253 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved