このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
非アルコール性脂肪性肝疾患の進行を評価するための新しい in vivo マイクロコンピュータ断層撮影イメージング技術
* これらの著者は同等に貢献しました
要約
食事誘発性非アルコール性脂肪性肝疾患(NAFLD)マウスモデルを使用して、NAFLDの進行段階を評価するための非侵襲的方法としての新しい in vivo マイクロコンピューター断層撮影イメージング技術の使用について説明します、主に肝血管ネットワークに焦点を当てます NAFLD関連の肝調節不全に大きく関与しているため。
要約
非アルコール性脂肪性肝疾患(NAFLD)は世界的な健康問題であり、NAFLDの影響は、効果的な治療法の現在の欠如によって悪化しています。NAFLDのタイムリーで正確な診断(等級付けを含む)とモニタリング、および潜在的な治療法の開発を妨げるかなりの制限要因は、肝微小環境構造の特性評価と時空間的かつ非侵襲的な方法での疾患病期のスコアリングにおける現在の不十分さです。食餌誘発性NAFLDマウスモデルを用いて、NAFLDの進行段階を評価するための非侵襲的方法として、主に肝血管網に焦点を当て、in vivo マイクロコンピュータ断層撮影(CT)イメージング技術の使用を検討しましたNAFLD関連の肝調節不全に大きく関与しているため。このイメージング手法により、肝脂肪症と機能的組織取り込みの縦断的分析、および血管網の相対血液量、門脈直径、および密度の評価が可能になります。NAFLDの進行中の肝血管網の適応を理解し、これを提案された方法を使用して疾患の進行(脂肪症、炎症、線維症)を特徴付ける他の方法と相関させることは、マウスのNAFLD研究のための新しい、より効率的で再現性のあるアプローチの確立への道を開くことができます。このプロトコルはまた、疾患の進行に対する新しい治療法の開発を調査するための前臨床動物モデルの価値を向上させることが期待されています。
概要
非アルコール性脂肪性肝疾患(NAFLD)は、人口の約25%、病的肥満の人の>80%に影響を与える代謝性疾患です1。これらの個人の推定3分の1は、肝脂肪症、炎症、および線維症を特徴とする非アルコール性脂肪性肝炎(NASH)に進行します2。NASHは、肝硬変および肝細胞癌(HCC)の発症リスクが有意に高い疾患段階です3,4。このため、NASHは現在、肝移植の2番目に多い原因であり、まもなく肝移植の最も重要な予測因子になると予想されています5,6,7。その有病率と重症度にもかかわらず、NAFLDには疾患特異的な治療法はなく、既存の治療法はインスリン抵抗性や高脂血症などの疾患に関連する病状に取り組むことのみを目的としています5,6。
近年、内皮、そして一般に脂肪組織や肝臓などの代謝組織の血管網の病態生理学的役割と適応は、特に肥満や代謝調節不全の間に、研究においてより重要性を増しています7,8。内皮は、血管網を内部に裏打ちする細胞単層であり、機能的および構造的障壁として作用する。また、血栓症、代謝産物輸送、炎症、血管新生などのさまざまな生理学的および病理学的プロセスにも寄与します9,10。肝臓の場合、血管網は、とりわけ、肝臓類洞内皮細胞(LSEC)として定義される高度に特殊化された細胞の存在によって特徴付けられる。これらの細胞は基底膜を欠いており、複数のフェネストラを持っているため、血液と肝実質の間で基質を簡単に移動できます。LSECは、その独特の解剖学的位置と特徴により、NAFLD / NASH中の肝臓の炎症や線維症の発症など、肝臓の病態生理学的プロセスにおいて重要な役割を果たす可能性があります。実際、LSECがNAFLDの過程で受ける病理学的、分子的、および細胞の適応は、疾患の進行に寄与します11。具体的には、NAFLD中に起こるLSEC依存性肝血管新生は、炎症の発症およびNASHまたはHCC12への疾患の進行に有意に関連している。さらに、肥満関連の早期NAFLDは、LSECにおけるインスリン抵抗性の発症を特徴とし、これは肝炎症または他の進行したNAFLD徴候の発症に先行します13。
さらに、LSECは最近、いくつかの病因の肝疾患における肝血流および血管網適応の中心的な調節因子として浮上しています14,15。実際、慢性肝疾患は、顕著な肝内血管収縮および血流に対する抵抗の増加を特徴とし、門脈圧亢進症の発症に寄与する16。NAFLDの場合、いくつかのLSEC関連のメカニズムがこの現象に寄与しています。例えば、上述のように、LSEC特異的インスリン抵抗性は、肝血管系のインスリン依存性血管拡張の減少と関連している13。その上、疾患の経過にわたって、肝血管系は血管収縮剤に対してより敏感になり、さらに肝血流の障害に寄与し、剪断ストレスの出現をもたらし、どちらも正弦波微小循環の破壊をもたらす17。これらの事実は、血管系が肝疾患の重要な標的であることを示唆しています。それにもかかわらず、NAFLD / NASHのタイムリーな診断とモニタリング、および潜在的な治療法の開発を妨げる制限要因は、肝臓微小環境と(微小)血管構造の一貫した特徴付け、および時空間的および非侵襲的な方法での疾患段階のスコアリングの不十分さです。
マイクロコンピュータ断層撮影(CT)イメージングは、現在、生体内の解剖学的情報を正確に描写するためのゴールドスタンダードの非侵襲的イメージング方法です。マイクロCTとMRIは、広範囲の病状をカバーし、画像化された構造と組織に並外れた解像度と詳細を提供できる2つの補完的なイメージング方法を表しています。特にマイクロCTは非常に高速で正確なツールであり、骨疾患や関連する骨表面変化18などの病状の研究、経時的な肺線維症の進行の評価19、肺がんとその病期分類の診断20、さらには歯科病理21の検査によく使用されます。
マイクロCTのイメージング技術は、X線と物質との相互作用に関して、さまざまな臓器のさまざまな減衰特性に基づいています。X線減衰の差が大きい臓器は、CT画像で高コントラストで描かれています(つまり、肺は暗く見え、骨は明るく見えます)。非常に類似した減衰特性を示す器官(異なる軟部組織)は、CT画像22上で区別することが困難である。この制限に対処するために、ヨウ素、金、およびビスマスに基づく特殊な造影剤が、 in vivo での使用について広く研究されています。これらの薬剤は、それらが蓄積する組織の減弱特性を変化させ、循環からゆっくりと除去され、血管系全体または選択された組織の均一かつ安定した混濁を可能にする23。
ヒト診断において、CT画像およびMRI由来のプロトン密度脂肪画分などの同等の技術は、肝脂肪含有量の測定にすでに使用されている24,25。NAFLDの文脈では、病理学的病変または小血管を正確に区別するために、高い軟部組織コントラストが不可欠です。この目的のために、肝臓組織特性の増強されたコントラストを提供する造影剤が利用される。このようなツールと材料は、血管網の構造と密度、脂質沈着/脂肪症、肝臓における機能的組織の取り込み/脂質(カイロミクロン)移動など、複数の肝臓の特徴と可能な病理発現の研究を可能にします。さらに、肝相対血液量および門脈直径も評価することができる。非常に短いスキャン時間で、これらすべてのパラメーターは、NAFLDの評価と進行に関する異なる補完的な情報を提供し、非侵襲的で詳細な診断を開発するために使用できます。
この記事では、NAFLDの進行段階を評価するための非侵襲的方法として、新しい in vivo マイクロCTイメージング技術を使用するための段階的なプロトコルを提供します。このプロトコルを使用して、肝脂肪症および機能的組織取り込みの縦断的分析、ならびに相対血液量、門脈直径、および血管網の密度の評価を、肝疾患のマウスモデルに実行および適用できます。
Access restricted. Please log in or start a trial to view this content.
プロトコル
すべての手順は、欧州および国内の福祉規制に従ってBIOEMTECHの担当者によって実行され、国家当局によって承認されました(ライセンス番号EL 25 BIOexp 45 / PN 49553 21/01/20)。すべての実験は、ARRIVEガイドライン26に準拠して設計および報告されました。マウスは、ギリシャのアテネにあるギリシャパスツール研究所から購入しました。
注:動物は、相対湿度50%〜60%、12時間の明暗サイクル(明07:00 am-07:00 pm)の部屋で、レールと段ボールのチューブが豊富な個別に換気されたケージにグループ収容されました。現代のタイプの脂肪強化食で広く使用されている果糖およびブドウ糖含有甘味料である高脂肪食(HFD)と高果糖コーンシロップ(HFCS)の組み合わせを使用して、NAFLDを信頼できるモデルとして認識しました27,28,29,30。7〜8週齢で、雄のC57BL / 6マウスに、脂肪から10%のキロカロリーを含む通常の食事(n = 2)または水中に5%のHFCSを添加した脂肪からのキロカロリーの60%を含むHFD(n = 2)のいずれかに22週間自由摂取を与えた。体重はデジタル天びんを使用して毎週取得され、実験期間中、動物福祉はスコアシートを使用して隔日で監視されました。画像化プロトコルの最後に、マウスを頸部脱臼を介して安楽死させた。
1.動物の準備
メモ: イメージングプロトコルの概要を 図 1 に示します。
- 3%〜4%のイソフルラン(室内空気中)を使用してマウスに麻酔をかけ、専用の加熱パッドを使用して体温を維持します。
注意: スキャンを開始する前に、ペダル離脱反射がないことを使用して、十分な麻酔の深さを確認する必要があります。 - 実験前に動物の目に眼科用軟膏を塗布してください。
- 動物をCTスキャナークレードルに入れ、ノーズコーンを固定し、メンテナンスのために1.5%〜3%のイソフルラン(室内空気中)に切り替えます。
注:ペダル離脱反射がないことは、麻酔の維持のためのイソフルランの適切な割合を確認するために使用する必要があります。. - マウスを継続的に監視します。
2. スキャン前の準備
注:イメージングは、最初の造影剤が循環および組織から適切に除去されることを可能にするために、2つの実験段階で実行されます。eXIA(第1造影剤)は第1相に、ExiTron(第2造影剤)は第2相に投与され、以下の「イメージングワークフロー」セクション(セクション3)に記載される。
- 造影剤(実験段階に応じてeXIAまたはExiTronのいずれか)が室温に3時間到達するまで待ちます。
- CTスキャナーで次のスキャンパラメータを設定します:50kVpの管電圧と460μAの電流での高分解能プロトコル、非スパイラル、720投影/回転、4回転、4分の取得時間。
3. イメージングワークフロー
- 実験フェーズ1
- 最大のコントラストを得るために、6 μL / g体重の希釈されていない用量で投与される最初の造影剤の量を計算して準備します。
- 尾静脈カテーテルを生理食塩水で満たし、造影剤で満たされた注射器に接続して、尾静脈カテーテルを準備します。
- 造影前の全身(WB)および肝臓のベースラインスキャンを取得します。
- シリンジまたはカテーテルに気泡や詰まりがないことを確認してください。
- プレフィルドカテーテルを尾静脈に挿入し、1〜3分の持続時間でゆっくりと手動で行われる注射 を介して 造影剤を投与します(ボーラス注射としてではありません)。シリンジポンプは、適切な注入速度に設定すると使用できます。
注意: 動物の尾をぬるま湯に入れて血管拡張を誘発し、カテーテルの挿入を助けることができます - 表1に示すように、異なる時点でWBスキャンと肝臓スキャンを取得します。
注:すべてのポイントの取得が不可能な場合は、最大の肝吸収のポイントである注射後45分(PI)とクリアランスが達成された48時間のPIに焦点を当てる必要があります。
- 実験フェーズ2
- 第1造影剤による最終読み取りの10日後(48時間PI)に第2造影剤を投与するために、セクション1に記載のようにマウスを再度準備する。
- 手順 2.1-2.2 を実行します。
- 最大のコントラストを得るために、8 μL / g体重の希釈されていない用量で投与される2番目の造影剤の量を計算して準備します。
- 尾静脈カテーテルを生理食塩水で満たし、造影剤で満たされた注射器に接続して、尾静脈カテーテルを準備します。
- 造影前のWBおよび肝臓ベースラインスキャンを取得して、相対的な血液量と肝脂肪症を評価します。
- 最初の造影剤の完全なクリアランスを示すスキャンでコントラストが検出されないことを確認します。
- プレフィルドカテーテルを尾静脈に挿入し、1〜3分の持続時間でゆっくりと手動で行われる静脈内注射 を介して 造影剤を投与します(ボーラス注射としてではありません)。シリンジポンプは、適切な注入速度に設定すると使用できます。
- 表1に示すように、異なる時点でWBスキャンと肝臓スキャンを取得します。
注:WBスキャンは10分と4時間のPIで取得されます。それらの間の有意な時間経過は、体内のトレーサー生体分布およびその相対的なクリアランスの評価を可能にする。
4.データの抽出と分析
注:このプロトコルでは、特定の画像処理ソフトウェア( 材料表を参照)に基づくデータ抽出および分析手順が提供されます。説明されている手順は、別のソフトウェアを使用する場合は調整する必要がある場合があります。
- 肝脂質沈着/脂肪症の評価。
注:肝脂肪症の評価には造影剤を使用せず、対照と病理の比較を行います。異なるマウス間の組織減衰特性の偏差が比較的大きいため、密度値は、次の式に従って、前述のように、脾臓(無脂肪組織)および脂肪(絶対脂肪組織)に対する肝臓について正規化されます25: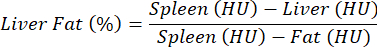
- 分析を実行するには、造影前のスキャンのDICOMファイルをロードし、バー/コントラストを調整して、肝臓、脾臓、および白色脂肪組織(WAT)をはっきりと確認します。
- フロントパネルのツールプルダウンメニューからモデリングオペレーターツールにアクセスし、3D ROIツールを選択します。
- 3D ROIオペレータで、ROIの追加を選択して複数のROI(組織ごとに最大8つ)を生成し、肝臓(できれば左内側葉、右内側葉、左外側葉の領域)と脾臓が透明に見え、明らかな血管や脂肪がない領域でサンプリングを実行します。
注意: WATの場合、ROIは内臓脂肪組織デポの中央で選択されます。推奨領域を 図 2 に示します。肝臓/脾臓比を使用し、WATを含まない正規化方法も、以前に確立された31として適用できます。 - [3D ペイント モードと侵食/拡張]機能で [2D] を選択し、表示されるインターフェイスを使用して各 ROI の名前と色を指定します。
- 直径 8 ピクセルの [ 球体 ペイント ROI] ツールを使用して、2D ROI を手動で描画します。
- 図3Aに示すように、横面の十字線ツールを使用して、対象領域の2D ROIをセグメント化してサンプリングを実行します。
- 図3Bに示すように、矢状面と冠状面で選択した点をクリックして、2D ROIのセグメンテーションを完了します。
- 残りの ROI を定義するプロセスを繰り返します。
注意: サンプリングするときは、ノイズが発生し、各ROIの計算されたハウンズフィールドユニット(HU)値の信頼性に影響を与える可能性があるため、臓器境界領域を避けてください。 - セグメント化された ROI に満足したら、 ナビゲーションに移動し、 テーブルの表示 を選択して、各 ROI の計算された HU 値を含む定量化テーブルを表示します。
注:関心のある値は、関心のある臓器のROIに含まれるボクセル(HU)の数値平均値を含む「平均」列にリストされています。目的の値をメモするか、[ テーブルのエクスポート] を選択してテーブル全体を保存します。 - 肝臓、脾臓、およびWATの平均HUを計算し、その値を上記の式に差し込んで、肝臓脂肪の割合を計算します。
- 肝臓における機能的組織取り込み/脂質(カイロミクロン)移行
注:機能的組織の取り込み/脂質(カイロミクロン)の移動は、以前に公開された方法32に基づいて、最初の造影剤注入後45分と48時間に取得したスキャンから分析されます。コントラストは、以下の式を使用して、さまざまな組織と時点について計算されます。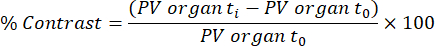
PV器官tiは、時間ti(0時間から48時間の範囲)における臓器における平均ピクセル値であり、PV器官t0は、コントラストのない画像における臓器における平均ピクセル値である。- この分析を実行するには、eXIA Scan DICOMファイルをロードし、バー/コントラストを調整して、肝臓、脾臓、左心室をはっきりと確認します。
- フロントパネルのツールプルダウンメニューからモデリングオペレータにアクセスし、3D ROIツールを選択します。
- 3D ROI 演算子 で、ROI の追加 を選択して、肝臓の複数の ROI をセグメント化します。
- 3D ペイント モードと侵食/拡張機能で、直径 8 ピクセル、-1 侵食の球ペイント ROI ツールを使用します。
注意: 各臓器がはっきりと見えるスライスで複数のROIを選択します。境界領域はノイズを発生させ、各 ROI の計算された HU 値の信頼性に影響を与える可能性があるため、避けてください。これにより、小さな臓器容積に対応する複数の3D ROIがサンプリングされます。 - 表示されるインターフェイスを使用して、各ROIの名前と色を指定します。
- 設計されたROIに満足したら、 ナビゲーションに移動し、 テーブルの表示 を選択して、各ROIの計算されたHU値を含む定量化テーブルを表示します。
注:関心のある値は、ROIに含まれるボクセル(HU)の数値平均値を表示する「平均」列の下に一覧表示されます。各臓器のROIの平均HU値は、PV臓器tiに対応します。目的の値をメモするか、[テーブルのエクスポート] を選択してテーブル全体を保存します。 - PV器官t0を得るために、造影剤注入前の肝臓、脾臓、および左心室の平均輝度を計算するために、造影剤前DICOMファイルを使用して上記のすべてのステップを繰り返した。
- 上記の式に値を挿入して、機能的組織の取り込み/脂質(カイロミクロン)の移動に対応するパーセンテージコントラストを抽出します。
- 肝血管網の構造と密度
注:肝血管網の構造と密度の分析は、以前に公開された方法論に基づいています33 第2造影剤の10分間PIを得られた肝臓スキャンに対して行う。- この分析を実行するには、ExiTronスキャンDICOMファイルをロードし、バー/コントラストを調整して肝血管ネットワークをはっきりと表示します。
- フロントパネルのツールプルダウンメニューからモデリングオペレータにアクセスし、3D ROIツールを選択します。
- 3D ROI 演算子で、ROI の追加 を選択して、肝臓の 3D ROI を生成します。
- [3D ペイント モード]および[侵食/拡張]機能で、[3D]を選択します。
注: -1 侵食で [ 球 ペイント ROI ]ツールを使用して、コロナ面全体のセグメンテーション レイヤーを定義します。ROIペイントツールの直径は、各レイヤーに応じて調整する必要があります(必要な/不要なボクセルの選択を追加/削除するため)。肝臓の体積を最初に冠状面全体で定義し、次に横面と矢状面を使用してROIを修正することをお勧めします。このプロセスには精度が必要です。ユーザーは、肝臓のすべての領域が定義されたROIに含まれるようにしながら、各ROIレイヤーをセグメント化するときに、他の組織、血管、および骨を含めないように細心の注意を払う必要があります。このため、肝臓の解剖学的境界に精通することが重要です。 - 得られた肝臓ROIに満足したら、最初にセグメント化された肝臓ROIに属さないすべてのボクセルを画像データから削除するためにカットを実行します。このためには、ROIセレクターから肝臓の ROIを選択し、[ カットの実行] アイコンをクリックします。この操作により、バックグラウンドが削除され、肝臓のROIは変更されません。
注意: 元に戻す/やり直し機能は、 3D ROIツールで実行されるすべての操作に適用できますが、ROIをカットするアクションを元に戻すことはできません。したがって、このアクションの前に、ユーザーは最初の肝臓ROIをDICOM形式で保存することを検討する場合があります。 - 結果として生じる肝臓ROIには、血管網と周囲の組織が含まれ、これらを除去する必要があります。このためには、[ROIのリセット]ほうきボタンをクリックして肝臓の ROIをリセット します。
- 表示されるインターフェイスを使用して、肝臓のROIのすべてのピクセルを背景に転送します。
注:この操作後も肝臓のROIは存在しますが、ボクセルは含まれなくなります。 - 血管関連ピクセルのみが含まれるように肝臓のROIを再セグメント化するには、魔法の杖のアイコンで示される セグメンテーションアルゴリズム に移動し、[ 接続されたしきい値]を選択します。
- しきい値を適用する前に、入力ドロップダウン メニューから ROI を 出力 として定義し、背景を 入力 として定義します。
- 各しきい値フィールドの左側にある最小アイコンと最大アイコンをクリックしてしきい値を設定し、最大値と最小値を入力し、血管ネットワークを取得します。
注:選択した範囲内のピクセルのみが結果のROIに含まれます。異なる動物間で閾値を調整することで、各動物に注入される造影剤の正確な量に関して、同じ解剖学的領域が考慮されることが保証されます。これは、数値が同一でなくても、選択された組織間で一定です。 - 十字線ツールを使用して血管網がはっきり見えるポイントをクリックし、[適用]をクリックしてセグメンテーションを実行します。
- 最大強度投影(MIP)ビューアをアクティブにします。
- 結果として得られる肝臓のROIを、MIPビューで血管網がどれだけ明確に表示されるかという観点から評価します。
- 組織が肝臓のROIの一部に残っている場合は、セグメント化された肝臓のROIが血管網を明確に表すまで 、最小 しきい値を調整して手順4.3.5〜4.3.11を繰り返します。
- 得られた肝臓ROIに満足したら、計算された肝臓ROI体積(立方ミリメートル単位)を含む定量化テーブルを生成します。
注:関心のある値は、肝臓のROIに含まれるボクセル(HU)の数値体積値を含む「mm3」列にリストされています。目的の値をメモするか、[ テーブルのエクスポート] を選択してテーブル全体を保存します。
- 肝相対血液量
注:線維症の進行中に新たに形成された血管の量と有意に相関する肝相対血液量(rBV)の測定には、造影剤前のスキャンと2回目の造影剤注射後4時間のスキャンが使用されます。分析は、前述のように行われる34。- この分析を実行するには、ExiTronスキャンDICOMファイルをロードし、バー/コントラストを調整します。
注: MIP ビューアを無効にする:環境設定 で、読み込み時に MIP ビューアを無効にするチェックボックスをオンにします。大規模なデータセットの場合、これにより読み込み速度が向上します。 - フロントパネルのツールプルダウンメニューからモデリングオペレータにアクセスし、3D ROIツールを選択します。このツールは、2D 領域と 3D 領域の両方を描画、視覚化、保存、および定量化するための高度なオプションを提供します。
- 3D ROIオペレータで、ROIの追加を選択し、肝臓用と大血管用の2つのROIをセグメント化します。
- [3D ペイント モードと侵食/拡張]機能で、[2D]を選択します。
注意: 肝臓には直径8〜10ピクセル、血管には4〜6ピクセルの スフィア ペイントROIツールを使用することをお勧めします。ただし、ペイントツールの直径は、選択する領域がどれだけ小さいかに応じて調整できます。 - 表示されるインターフェイスを使用して、各ROIの名前と色を指定します。
注: 対象の組織の中央部分のスライスを 2 つから 5 つ選択し、セグメンテーション レイヤーを定義して、各組織の 2D ROI を生成します。各スライスの領域を選択するときは、 図4に示すように、ノイズが発生し、各ROIの計算されたHU値の信頼性に影響を与える可能性があるため、臓器境界領域を避けてください。 - 設計されたROIに満足したら、 ナビゲーションに移動し、 テーブルの表示 を選択して、各ROIの計算されたHU値を含む定量化テーブルを表示します。
注:関心のある値は、ROIに含まれるボクセル(HU)の数値平均値を表示する「平均」列の下に一覧表示されます。目的の値をメモするか、[ テーブルのエクスポート] を選択してテーブル全体を保存します。 - 造影剤注入前の肝臓の平均輝度を得るために、造影剤前のDICOMファイルに対してすべての手順を繰り返します。このためには、肝臓に対してのみ手順4.4.2-4.4.5を実行します。
- 同等の時点での各組織の平均HU値を計算し、得られた値を以下の式に挿入します。
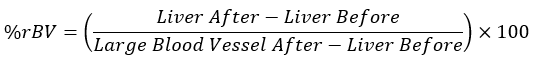
注:造影剤注射後の大きな血管は100%rBVと見なされ、造影剤投与前の肝臓は0%rBVと見なされます。
- この分析を実行するには、ExiTronスキャンDICOMファイルをロードし、バー/コントラストを調整します。
- 門脈径
注:門脈直径測定では、肝rBV測定に使用されたのと同じスキャンが前述のように分析されます35。- ExiTronスキャンDICOMファイルをロードし、バー/コントラストを調整します。
- 上腸間膜静脈と脾静脈の接合部の上に3〜4スライスの横面を見つけます(図5)。
- 定規ツールを使用して、2点間の正確な距離(つまり、円形の静脈領域の直径)を測定します。
注:距離は画像上で抽出されますが、 ナビゲーション に移動して[テーブルの表示]を選択して計算された距離を含む定量化 テーブル を表示するか、[ テーブルのエクスポート ]を選択して結果を保存することもできます。
Access restricted. Please log in or start a trial to view this content.
結果
この代表的な研究では、造影剤を含まないマイクロCTイメージングは、対照と比較してNAFLDのマウスの肝脂肪の割合が高いことを示し(表2)、病理を確認しました。ExiTron造影剤と上記の肝血管網アーキテクチャおよび密度分析を用いて、肝血管網の総体積密度は、健常対照と比較してNAFLDを有するマウスにおいて高いことが見出された(図6、表2)。N...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
ヒトにおけるNAFLDの診断と病期分類に現在推奨されている方法は肝生検であり、出血の複雑さのリスクとサンプリングの不正確さを伴います40。それどころか、動物モデルでは、そのような診断は死後の組織学によって行われますが、生存可能な肝生検のプロトコルは現在利用可能であり、研究デザインが許可されている場合に推奨されます41。死後組織学?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者は開示するものは何もありません。
謝辞
図 1 は BioRender.com を使用して作成しました。この作業は、ギリシャ研究イノベーション財団(#3222からA.C.)によってサポートされました。アンナ・ハジハンビは、肝臓研究財団のロジャーウィリアムズ肝臓研究所から資金提供を受けています。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| eXIA160 | Binitio Biomedical, Inc. | https://www.binitio.com/?Page=Products | |
| High fat diet with 60% of kilocalories from fat | Research Diets, New Brunswick, NJ, USA | D12492 | |
| High-fructose corn syrup | Best flavors, CA | hfcs-1gallon | |
| Lacrinorm ophthalmic ointment | Bausch & Lomb | ||
| Normal diet with 10% of kilocalories from fat | Research Diets, New Brunswick, NJ, USA | D12450 | |
| Viscover ExiTron nano 12000 | Milteny Biotec, Bergisch Gladbach, Germany | 130-095-698 | |
| VivoQuant | Invicro | ||
| X-CUBE | Molecubes, Belgium | https://www.molecubes.com/systems/ |
参考文献
- Lazarus, J. V., et al. Advancing the global public health agenda for NAFLD: A consensus statement. Nature Reviews. Gastroenterology & Hepatology. 19 (1), 60-78 (2022).
- Takahashi, Y., Fukusato, T. Histopathology of non-alcoholic fatty liver disease/non-alcoholic steatohepatitis. World Journal of Gastroenterology. 20 (42), 15539-15548 (2014).
- Huang, D. Q., El-Serag, H. B., Loomba, R. Global epidemiology of NAFLD-related HCC: Trends, predictions, risk factors and prevention. Nature Reviews Gastroenterology & Hepatology. 18 (4), 223-238 (2021).
- Niederseer, D., Wernly, B., Aigner, E., Stickel, F., Datz, C. NAFLD and cardiovascular diseases: Epidemiological, mechanistic and therapeutic considerations. Journal of Clinical Medicine. 10 (3), 467(2021).
- Lefere, S., et al. Differential effects of selective- and pan-PPAR agonists on experimental steatohepatitis and hepatic macrophages. Journal of Hepatology. 73 (4), 757-770 (2020).
- Chrysavgis, L., Papatheodoridi, A. M., Chatzigeorgiou, A., Cholongitas, E. The impact of sodium glucose co-transporter 2 inhibitors on non-alcoholic fatty liver disease.Journal of Gastroenterology and Hepatology. Journal of Gastroenterology and Hepatology. 36 (4), 893-909 (2021).
- Li, M., Qian, M., Xu, J. Vascular endothelial regulation of obesity-associated insulin resistance. Frontiers in Cardiovascular Medicine. 4, 51(2017).
- Pi, X., Xie, L., Patterson, C. Emerging roles of vascular endothelium in metabolic homeostasis. Circulation Research. 123 (4), 477-494 (2018).
- Chiu, J. J., Chien, S. Effects of disturbed flow on vascular endothelium: Pathophysiological basis and clinical perspectives. Physiological Reviews. 91 (1), 327-387 (2011).
- Koyama, Y., Brenner, D. A. Liver inflammation and fibrosis. The Journal of Clinical Investigation. 127 (1), 55-64 (2017).
- Nasiri-Ansari, N., et al. Endothelial cell dysfunction and non-alcoholic fatty liver disease (NAFLD): A concise review. Cells. 11 (16), 2511(2022).
- Lefere, S., et al. Angiopoietin-2 promotes pathological angiogenesis and is a therapeutic target in murine non-alcoholic fatty liver disease. Hepatology. 69 (3), 1087-1104 (2019).
- Pasarin, M., et al. Insulin resistance and liver microcirculation in a rat model of early NAFLD. Journal of Hepatology. 55 (5), 1095-1102 (2011).
- Hammoutene, A., Rautou, P. E. Role of liver sinusoidal endothelial cells in non-alcoholic fatty liver disease. Journal of Hepatology. 70 (6), 1278-1291 (2019).
- Sun, X., Harris, E. N. New aspects of hepatic endothelial cells in physiology and non-alcoholic fatty liver disease. American Journal of Physiology. Cell Physiology. 318 (6), C1200-C1213 (2020).
- Iwakiri, Y., Shah, V., Rockey, D. C. Vascular pathobiology in chronic liver disease and cirrhosis - current status and future directions. Journal of Hepatology. 61 (4), 912-924 (2014).
- Baffy, G. Origins of portal hypertension in non-alcoholic fatty liver disease. Digestive Diseases and Sciences. 63 (3), 563-576 (2018).
- Ruhli, F. J., Kuhn, G., Evison, R., Muller, R., Schultz, M. Diagnostic value of micro-CT in comparison with histology in the qualitative assessment of historical human skull bone pathologies. American Journal of Physical Anthropology. 133 (4), 1099-1111 (2007).
- Rodt, T., et al. Micro-computed tomography of pulmonary fibrosis in mice induced by adenoviral gene transfer of biologically active transforming growth factor-beta1. Respiratory Research. 11 (1), 181(2010).
- Deng, L., Xiao, S. M., Qiang, J. W., Li, Y. A., Zhang, Y. Early lung adenocarcinoma in mice: Micro-computed tomography manifestations and correlation with pathology. Translational Oncology. 10 (3), 311-317 (2017).
- Feng, J., et al. Abnormalities in the enamel in bmp2-deficient mice. Cells, Tissues, Organs. 194 (2-4), 216-221 (2011).
- Kagadis, G. C., Loudos, G., Katsanos, K., Langer, S. G., Nikiforidis, G. C. In vivo small animal imaging: current status and future prospects. Medical Physics. 37 (12), 6421-6442 (2010).
- Starosolski, Z., et al. Ultra high-resolution in vivo computed tomography imaging of mouse cerebrovasculature using a long circulating blood pool contrast agent. Scientific Reports. 5, 10178(2015).
- Caussy, C., Reeder, S. B., Sirlin, C. B., Noninvasive Loomba, R. quantitative assessment of liver fat by MRI-PDFF as an endpoint in NASH trials. Hepatology. 68 (2), 763-772 (2018).
- Lubura, M., et al. Non-invasive quantification of white and brown adipose tissues and liver fat content by computed tomography in mice. PLoS One. 7 (5), e37026(2012).
- Perciedu Sert, N., et al. The ARRIVE guidelines 2.0: Updated guidelines for reporting animal research. PLoS Biology. 18 (7), e3000410(2020).
- Tetri, L. H., Basaranoglu, M., Brunt, E. M., Yerian, L. M., Neuschwander-Tetri, B. A. Severe NAFLD with hepatic necroinflammatory changes in mice fed trans fats and a high-fructose corn syrup equivalent. American Journal of Physiology. Gastrointestinal and Liver Physiology. 295 (5), G987-G995 (2008).
- Machado, M. V., et al. Mouse models of diet-induced non-alcoholic steatohepatitis reproduce the heterogeneity of the human disease. PLoS One. 10 (5), 0127991(2015).
- Jensen, T., et al. Fructose and sugar: A major mediator of non-alcoholic fatty liver disease. Journal of Hepatology. 68 (5), 1063-1075 (2018).
- Nevzorova, Y. A., Boyer-Diaz, Z., Cubero, F. J., Gracia-Sancho, J. Animal models for liver disease - A practical approach for translational research. Journal of Hepatology. 73 (2), 423-440 (2020).
- De Rudder, M., et al. Automated computerized image analysis for the user-independent evaluation of disease severity in preclinical models of NAFLD/NASH. Laboratory Investigation. 100 (1), 147-160 (2020).
- Willekens, I., et al. Time-course of contrast enhancement in spleen and liver with Exia 160, Fenestra LC, and VC. Molecular Imaging and Biology. 11 (2), 128-135 (2009).
- Das, N. M., et al. In vivo quantitative microcomputed tomographic analysis of vasculature and organs in a normal and diseased mouse model. PLoS One. 11 (2), e0150085(2016).
- Ehling, J., et al. CCL2-dependent infiltrating macrophages promote angiogenesis in progressive liver fibrosis. Gut. 63 (12), 1960-1971 (2014).
- Zhang, J., et al. Gamna-Gandy bodies of the spleen detected with susceptibility weighted imaging: maybe a new potential non-invasive marker of esophageal varices. PLoS One. 8 (1), e55626(2013).
- Chen, Y., Li, J., Zhou, Q., Lyu, G., Li, S. Detection of liver and spleen stiffness in rats with portal hypertension by two-dimensional shear wave elastography. BMC Medical Imaging. 22 (1), 68(2022).
- Lessa, A. S., et al. Ultrasound imaging in an experimental model of fatty liver disease and cirrhosis in rats. BMC Veterinary Research. 6, 6(2010).
- Abikhzer, G., Alabed, Y. Z., Azoulay, L., Assayag, J., Rush, C. Altered hepatic metabolic activity in patients with hepatic steatosis on FDG PET/CT. AJR. American Journal of Roentgenology. 196 (1), 176-180 (2011).
- Newman, E. M., Rowland, A. A physiologically based pharmacokinetic model to predict the impact of metabolic changes associated with metabolic associated fatty liver disease on drug exposure. International Journal of Molecular Sciences. 23 (19), 11751(2022).
- Tsai, E., Lee, T. P. Diagnosis and evaluation of non-alcoholic fatty liver disease/non-alcoholic steatohepatitis, including noninvasive biomarkers and transient elastography. Clinics in Liver Disease. 22 (1), 73-92 (2018).
- Oldham, S., Rivera, C., Boland, M. L., Trevaskis, J. L. Incorporation of a survivable liver biopsy procedure in mice to assess non-alcoholic steatohepatitis (NASH) resolution. Journal of Visualized Experiments. 146, e59130(2019).
- Boll, H., et al. Comparison of Fenestra LC, ExiTron nano 6000, and ExiTron nano 12000 for micro-CT imaging of liver and spleen in mice. Academic Radiology. 20 (9), 1137-1143 (2013).
- Ashton, J. R., West, J. L., Badea, C. T. In vivo small animal micro-CT using nanoparticle contrast agents. Frontiers in Pharmacology. 6, 256(2015).
- Rothe, J. H., et al. Time course of contrast enhancement by micro-CT with dedicated contrast agents in normal mice and mice with hepatocellular carcinoma: Comparison of one iodinated and two nanoparticle-based agents. Academic Radiology. 22 (2), 169-178 (2015).
- Toczek, J., et al. Computed tomography imaging of macrophage phagocytic activity in abdominal aortic aneurysm. Theranostics. 11 (12), 5876-5888 (2021).
- Mannheim, J. G., et al. Comparison of small animal CT contrast agents. Contrast Media & Molecular Imaging. 11 (4), 272-284 (2016).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved