Method Article
オルガノイド共培養を用いた食道線維芽細胞の機能特性評価と可視化
要約
オルガノイド-線維芽細胞共培養は、 in vivo 幹細胞ニッチを研究するためのモデルを提供します。ここでは、食道オルガノイド-線維芽細胞共培養のためのプロトコルについて説明する。さらに、ホールマウントイメージングを使用して、線維芽細胞とオルガノイドの相互作用を視覚化します。
要約
上皮幹および前駆細胞は、生涯を通じて上皮バリアの形成および維持に寄与する。ほとんどの幹細胞および前駆細胞集団は、解剖学的に異なる場所に隠れており、ステム性を維持するニッチシグナルとの排他的な相互作用を可能にします。上皮オルガノイド培養の開発は、恒常性および疾患における幹細胞および前駆細胞の役割を理解するための強力なツールを提供するが、ニッチ環境内での相互作用はほとんど存在しないため、幹細胞の挙動に影響を与える因子の同定が妨げられている。線維芽細胞は、上皮幹と前駆細胞の運命を指示する上で重要な役割を果たします。ここでは、食道前駆細胞の再生および分化における線維芽細胞亜集団の描写を可能にする包括的なオルガノイド-線維芽細胞共培養プロトコルが提示される。このプロトコルでは、食道から上皮細胞と線維芽細胞の両方を並行して単離する方法が記載されている。トランスジェニックレポーターまたは野生型マウスのいずれかから食道前駆細胞と線維芽細胞亜集団の両方を単離するための明確な蛍光活性化細胞選別戦略が概説されています。このプロトコルは、特定の線維芽細胞亜集団の単離に対応するために適応できる汎用性の高いアプローチを提供します。食道上皮オルガノイド単培養の確立と継代がこのプロトコルに含まれているため、共培養システムとの直接比較が可能です。さらに、上皮-線維芽細胞相互作用の詳細な画像解析を可能にする3Dクリアリングアプローチについても説明します。まとめると、このプロトコルは、食道幹細胞ニッチ成分 をインビトロで同定および理解するための比較および比較的ハイスループットの方法を記載する。
概要
オルガノイドは、幹細胞および前駆細胞の特性評価、ならびに幹細胞ニッチの細胞成分に由来するシグナル伝達の手がかりを理解するための3Dインビトロアッセイとして使用されます1,2,3,4。マウス食道オルガノイドは2014年に初めて記載され、いくつかの論文では、食道オルガノイドの維持と通過に必要なR-Spondin(RSPO)、NOGGIN、上皮成長因子(EGF)などの成長因子が特定されており5,6,7、in vivoにも同様のシグナル伝達の手がかりが必要であると主張しています。 前駆細胞の再生。しかしながら、成長因子は一般に非生理学的濃度で添加され、必ずしもin vivoシグナル伝達環境を反映しないオルガノイド増殖条件をもたらす。
線維芽細胞は、多くの幹細胞ニッチにおいて前駆細胞特性を支える不均一な間質細胞集団である8。上皮前駆細胞と線維芽細胞を同じオルガノイド培養に組み合わせることで、外因的に補充された成長因子の濃度を抑えたオルガノイド形成が可能になります。腸管および肝上皮由来のオルガノイド共培養系が記載されているが、食道オルガノイド-線維芽細胞共培養を確立するためのプロトコルは依然として優れている9、10、11。
このプロトコルでは、トランスジェニックPdgfrαH2BeGFPマウス12または古典的な抗体染色を有する野生型マウスのいずれかを使用して、食道からの線維芽細胞に対する2つの蛍光活性化細胞選別(FACS)戦略が概説されている。線維芽細胞の異なる亜集団は、選択した細胞表面マーカーを使用して単離することができ、それによってプロトコルに柔軟性を提供する。さらに、オルガノイド形態を保存する3D蛍光イメージング技術を使用して、線維芽細胞とオルガノイドの相互作用を特徴付けます。オルガノイドクリアリングは、オルガノイドの光透過深さを増加させる迅速な方法を提供し、オルガノイドと線維芽細胞の結合の視覚化を改善し、オルガノイド構造全体の再現を可能にします。このプロトコルは、食道オルガノイド共培養とホールマウントイメージング戦略を組み合わせて、線維芽細胞とオルガノイドの相互作用の機能的特性評価を可能にします。
プロトコル
この研究のための動物実験は、ストックホルムノラ・ジュルフェルソクセティスカ・ネムンド(倫理許可番号14051-2019)によって承認されました。動物は、欧州実験動物科学協会連盟の勧告に従って病原体のない状態で飼育された。
1. 事前準備
- 解離に使用した酵素ストック溶液( 材料の表を参照)を氷上で解凍します。成長因子還元型(GFR)基底膜マトリックス(マトリックス)のアリコートを4°Cで解凍します。
- 培地を準備します。オルガノイド培養および共培養には 表1 に記載の培地を使用し、プロトコルを開始する前に調製してください。
2.食道上皮と間質の解剖と分離
注意: 解剖および組織処理に使用されるすべての器具が無菌であることを確認してください。食道3個あたりハンクス平衡塩溶液(HBSS)で2 mLの解離溶液( 材料の表を参照)を準備します。
- C57BL/6Jマウスなど、選択したマウス系統を使用してください。マウスの食道発達は生後(p)70日後に終了するため、p7013より古いマウスを使用することをお勧めします。8〜10個のオルガノイド共培養を確立するのに十分な材料を提供するため、4〜5匹のマウスを使用してください。
注:オルガノイド形成効率は、マウスの年齢とともに低下します。特定の線維芽細胞亜集団が対象である場合、線維芽細胞収率が低いために、確立できるオルガノイド共培養の数が制限されている可能性があります。 - 線維芽細胞集団の単離のために、遺伝子改変(例えば、PdgfrαH2BeGFP)または野生型(WT)マウスを使用する。WTマウスを用いる場合、抗体染色を行い、FACS を介して 間質から特異的線維芽細胞亜集団を単離する。
- CO2窒息によりマウスを安楽死させる。鉗子と解剖ハサミを使用して食道を解剖します。食道全体を除去するには、胃の真上の食道の遠位端と気管の始めの近位端を切断します。食道をPBSに浸し、氷の上に置きます。
- 解剖顕微鏡(総倍率範囲8x〜40x)と鉗子を使用して、筋筋外皮を機械的に除去します。1対の鉗子を使用して解剖された食道の遠位端を保持し、もう一方の鉗子を使用して、解剖された食道の遠位端から近位端まで筋肉をつかんで引っ張ります。筋肉層を取り除いて捨てます。
- 食道を縦方向に開きます。これは、組織の損傷を防ぐために、ボール先端を備えたマイクロダイセクションスプリングハサミを使用して最適に機能します。食道の一端を持ってスプリングハサミのボールを食道の内腔に挿入し、端をつかんだまま食道を切り開きます。
- 食道を1.5 mLのマイクロ遠心チューブまたは24ウェルプレートに入れます。開いた食道をHBSS中の0.5 mg/mLサーモリシン溶液中で、ロッカーシェーカーで37°Cで15分間インキュベートします。食道をサーモリシン溶液に完全に沈めます。
注:使用するサーモリシン溶液の量は、ウェルまたはチューブのサイズによって異なります。いくつかの食道を同じウェルまたはチューブに入れて沈めることができます。 - サーモリシン溶液から食道を取り出します。解剖顕微鏡を使用して、食道上皮を間質から慎重に分離します。細かい鉗子を使用して、組織の上皮側と間質側の両方をつかみ、ゆっくりと引き離して2つの層を分離します。
注:間質は、透明な上皮とは対照的に、白くて不透明な外観によって識別されます。間質は固有層および粘膜下層を含む。 - 上皮層と間質層を、HBSS中の200 μLの解離溶液を入れた2つの別々の1.5 mLマイクロ遠心チューブに移します。氷の上に置きます。
3. 食道前駆細胞の単離
注:食道前駆細胞(ステップ2)と線維芽細胞(ステップ3)の単離は同時に行うことができます。HBSS(1%FBS)中の1%FBSの50 mLチューブを準備します。
- 分離した食道上皮を1.5 mLの微量遠心チューブ(ステップ2.8)からきれいなペトリ皿に移し、鋭利なメスを使ってミンチにします。200 μLの解離溶液でペトリ皿からミンチ組織を収集し、1.5 mLマイクロ遠心チューブに戻します。
注:200 μLのピペットチップを使用して、片を1.5 mLのマイクロ遠心チューブに戻すことができる場合、上皮は適切にミンチされます。 - 800 μLの新しい解離溶液を1.5 mLのマイクロ遠心チューブに加え、総容量1 mLにします。
注:十分な量の解離溶液を追加することが重要です。1〜3食道あたり、1 mLの溶液が推奨されます。より多くの食道が一度に処理されるとスケールアップします。 - ミンチ上皮層を含むチューブをロッカーシェーカーに37°Cで60分間置きます。200 μLのピペットチップを使用して溶液を約20回上下にピペットで15分ごとに行い、消化を促進します。
- 60分後、200 μLのピペットチップを使用してさらに20回ピペットで上下させます。溶液を40 μmのセルストレーナーに通し、新しい1.5 mLマイクロ遠心チューブに入れます。300 x g で 4 °C で 10 分間遠心分離します。
注意: セルストレーナーを1%FBSで濡らしてから、セルを濾してから、セルのフィルターへの付着を最小限に抑えます。上皮は完全には消化されず、組織片はまだ見えます。ただし、インキュベーションが長くなると、細胞の生存率が低下し、生細胞の収量は向上しません。 - 1 mLピペットで余分な液体を除去して上清を廃棄し、ペレットを1 mLの1%FBSに再懸濁します。300 x g で 4 °C で 10 分間遠心分離します。
- 遠心分離の際、食道前駆細胞のFACS用の結合抗体ミックスを調製する。
- 100万細胞あたり1%FBSの200μLに1μLのCD324-PE-Cy7(エカドヘリン)とCD104-A647(インテグリン-β4)を混合します。
注:1 μLの抗体(最終容量200 μL)は、1つまたは2つの食道に十分です。より多くの食道を一度に処理する場合は、抗体染色液の容量を増やしてください。
- ペレットを200 μLの抗体ミックスに再懸濁し、フローサイトメトリーチューブに移します。蛍光抗体を添加した後、シグナルの漂白を避けるために細胞懸濁液を暗所に保ちます。細胞を4°Cで30分間インキュベートします。 3 mLの1%FBSを加え、300 x g で4°Cで10分間遠心分離した後、細胞を1%FBSの最小200 μLに再懸濁します。
注:500 μLの1%FBSは、最大4つまたは5つの食道に使用されます。より多くの食道が一度に処理されるときに体積を増やすと、100〜300イベント/秒のFACS流量を達成できます。イベント数が増えると選別効率が低下し、流速が増加すると細胞の生存率が低下します。 - FACSソーティングの5分前に、死細胞染色マーカーを最終濃度1:10,000まで添加して、生細胞を分離します。FACSマシンを使用して前駆細胞をソートします(ゲーティング戦略については 図1 を参照)。200 μLの基本オルガノイド培地で満たされた1.5 mLマイクロ遠心チューブに細胞を回収します(表1)。
4.間質層からの線維芽細胞の分離
- 解剖ハサミを使用して、200 μLの解離溶液を含む1.5 mLチューブでストーム層を細かく切り取ります(ステップ2.8)。200 μLのピペットチップを使用して溶液を上下にピペットで移すことができたら、組織を適切にミンチします。
- 800 μLの新しい解離溶液を1.5 mLのマイクロ遠心チューブに加え、総容量1 mLにします。
注:十分な量の解離溶液を追加することが重要です。1〜3食道あたり、1 mLの溶液が推奨されます。より多くの食道が一度に処理されるとスケールアップします。 - チューブをロッカーシェーカーに37°Cで30分間置きます。15分後、200 μLのピペットチップを使用して溶液を約20回上下にピペットで動かし、消化を促進します。
- 30分間の酵素消化後、200 μLのピペットチップを使用してさらに20回ピペットで上下させます。溶液を70 μmのセルストレーナーを通して新しい1.5 mLマイクロ遠心チューブに入れます。300 x g で 4 °C で 10 分間遠心分離します。
注意: フィルターへの細胞の接着を最小限に抑えるために、細胞に負担をかける前に、セルストレーナーを1%FBSで濡らしてください。 - 1 mLピペットで余分な液体を除去して上清を廃棄し、ペレットを1 mLの1%FBSに再懸濁します。300 x g で 4 °C で 10 分間遠心分離します。
注:蛍光標識線維芽細胞を含む遺伝子改変マウス系統を使用する場合、抗体染色は任意である。抗体染色が不要な場合は、ステップ3.7に進み、サンプルをフローサイトメトリーチューブに移します。- 遠心分離中に、線維芽細胞のFACS単離のためのコンジュゲート抗体ミックスを調製します。100万細胞あたり1%FBSの200 μLに1 μLのCD26-APC(DPP4)を混合します。
注:1 μLの抗体は、1つまたは2つの食道に十分です。より多くの食道を一度に処理する場合は、抗体染色液の容量を増やしてください。
- 遠心分離中に、線維芽細胞のFACS単離のためのコンジュゲート抗体ミックスを調製します。100万細胞あたり1%FBSの200 μLに1 μLのCD26-APC(DPP4)を混合します。
- ペレットを1%FBS中の200 μLのコンジュゲート抗体ミックスに再懸濁し、フローサイトメトリーチューブに移します。細胞を4°Cで30分間インキュベートします。
- 3 mLの1%FBSを加え、300 x g で4°Cで10分間遠心分離します。 細胞を1%FBSの最低200 μLで再懸濁します。
注:500 μLの1%FBSは、最大4つまたは5つの食道に使用されます。より多くの食道が一度に処理されるときに体積を増やすと、100〜300イベント/秒の流量を達成できます。イベント数が多いほど選別効率が低下し、流速を上げると細胞の生存率が低下します。蛍光抗体を添加した後は、シグナルの漂白を避けるために細胞懸濁液を暗く保つ必要があります。 - FACSソーティングの5分前に、死細胞染色マーカーを最終濃度1:10,000まで添加して、生細胞を分離します。FACSマシンを使用してセルをソートします(ゲーティング戦略については 図1 を参照)。200 μLの基本オルガノイド培地で満たされた1.5 mLマイクロ遠心チューブに細胞を回収します(表1)。
5. 食道オルガノイドの樹立と培養
注:低ER低(オルガノイド共培養)、ENR(オルガノイド)培地(説明 については 表1 を参照)、および37°Cの48ウェルプレートを予温します。 解凍したマトリックス(ステップ1で調製)を氷上に置きます。他のブランドのマトリックスはオルガノイド形成効率に悪影響を与えるため、マウス食道オルガノイド培養にはここで提供されているマトリックス( 材料の表を参照)を使用することをお勧めします。
- オルガノイド共培養では、選別した上皮細胞と線維芽細胞をチューブ内で1:2の割合で混合します。マトリックスドームごとに、5,000個の上皮細胞と10,000個の線維芽細胞を使用します。より多くのドームを準備する場合は、5,000個の上皮細胞と10,000個の線維芽細胞の倍数を1本のチューブに追加します。線維芽細胞を含まないオルガノイド培養では、マトリックスドームあたり5,000個の上皮細胞を使用します。
- 混合細胞集団を300 x g で5分間遠心分離します。上清を200 μLピペットで慎重に除去して廃棄します。
- ペレットを冷たい塩基性オルガノイド培地に再懸濁し、300 x g で5分間遠心分離することにより、細胞を1回洗浄します。セルを氷の上に置きます。
- 80%のマトリックスと20%の冷たい塩基性オルガノイド培地からなるミックスを準備します。マトリックスが室温(RT)で固まるように、すべてを氷の上に置きます。
- 遠心分離後の上清を200 μLピペットで慎重に除去して廃棄します。細胞を10 μLのマトリックスミックス/ドームに再懸濁し、氷上に戻します。
- 37°Cのインキュベーターから予温した48ウェルプレートを取り出し、20 μLピペットを使用してウェルごとに1つのマトリックスドームを作成します。各ドームには、10 μLの80%マトリックス、5,000個の上皮細胞、および10,000個の線維芽細胞が含まれています。プレートを逆さまにしてインキュベーターに移し、ドームを37°Cでさらに20〜30分間固化させます。
注:マトリックスドーム体積の減少および/または細胞数の増加は、オルガノイド形成効率に影響を与えます。 - オルガノイド共培養を含むマトリックスドームに200 μLの予温したER低培地(表1)を追加し、上皮オルガノイドのみを含むそれぞれのマトリックスドームにENR培地(表1)を加え、プレートをインキュベーターに入れます。
- オルガノイドを37°Cおよび5%CO2で成長させる。最初の2日間は、10 μMの岩石阻害剤(Y-27623)を培地に補給します。ロック阻害剤は、ストレス誘発性細胞死を防ぎ、オルガノイド培養の成功の可能性を高めます。
- 2〜3日ごとに培地を更新します。温度に敏感なマトリックスの解離を防ぐために、媒体が暖かいことを確認してください。
- めっき後6〜8日目に実験の分析を行う。オルガノイドは最大14日間培養することができます。14日目頃、ドームの完全性の喪失が観察されます。
6. オルガノイドの継代
注:共培養で増殖したオルガノイドの継代は、線維芽細胞の喪失をもたらします。したがって、継代時にはすべてのオルガノイドにENR培地を使用することが推奨されます。ENR、PBS、および48ウェルプレートを37°Cで予熱します。
- 培地を取り出し、マトリックスドームを含むウェルを予熱したPBSで洗浄します。200 μLの冷たい0.25%トリプシン溶液を加え、ピペットを上下に動かしてマトリックスドームを破壊します。
注:マトリックスは温度に敏感であり、マトリックスドームの分解に役立つため、冷たい0.25%トリプシンの使用をお勧めします。 - オルガノイドをトリプシンと共に37°Cで~20分間インキュベートします。10分後にピペットを上下に動かして、オルガノイドの解離を増加させます。5〜10分ごとに顕微鏡で解離プロセスを監視します。トリプシンは細胞の生存率を低下させるため、理想的な解離時間を特定するのに役立ちます。
- 20分後、200 μLのピペットでオルガノイドを上下にピペットでピペットし、オルガノイドを解離させます。細胞を1.5 mLのマイクロ遠心チューブに集め、1 mLの塩基性オルガノイド培地を加え、300 x g でRTで5分間遠心分離します。
- オプション:最良のオルガノイド増殖条件を確保し、新しいオルガノイドが単一細胞に由来するようにするには、事前に湿らせた40 μm細胞ストレーナーで細胞を濾します。細胞懸濁液をろ過すると、解離しにくいオルガノイドコアや細胞凝集塊が除去されます。
- 80%のマトリックスと20%の冷たい塩基性オルガノイド培地からなるマトリックスミックスを調製します。マトリックスがRTで固まるように、すべてを氷の上に置きます。
- 上清を200 μLのピペットで慎重に除去して廃棄し、細胞を10 μLのマトリックスミックス/ドームに再懸濁し、混合物を氷上に戻します。
注:オルガノイドは、ドーム密度に応じて1:5から1:10の比率で分割できます。上皮細胞は、5,000細胞/ドームでカウントして再播種することもできます。 - 37°Cのインキュベーターから予熱した48ウェルプレートを取り出し、1ウェルにつき1つのドームを作ります。プレートを逆さまにしてインキュベーターに移し、ドームを37°Cでさらに20〜30分間固化させます。
- 200 μLの予熱したENR培地をそれぞれのオルガノイドドームに加えます。最初の2日間は、10 μMの岩石阻害剤(Y-27623)を培地に補給します。
- 2〜3日ごとに培地を更新します。温度に敏感なマトリックスの解離を防ぐために、媒体が暖かいことを確認してください。
7. ホールマウント染色のためのオルガノイド処理
注意: オルガノイドがプラスチックに付着しないように、使用前にチップとチューブをPBSで10%FBSでコーティングしてください。ピペットチップの場合、チップを使用する前に、10%FBS/PBS溶液で1回または2回上下にピペットするだけで十分です。チューブの場合は、チューブに10%FBS / PBSを充填してから、溶液を取り除きます。
- オルガノイド培地を除去し、200 μLの氷冷PBSをマトリックスドームに加えます。プレートを氷の上に5〜10分間置きます。
- ピペットを上下に動かし、溶液を0.6 mLマイクロ遠心機の非付着チューブに移します。オルガノイドを底に沈降させるために、100 x g で30〜60秒間遠心分離します。
注:過剰なピペッティングと長時間の遠心分離はオルガノイドを破壊し、線維芽細胞とオルガノイドの相互作用を破壊します。 - 余分な液体を取り除き、氷のように冷たいPBSを追加します。オルガノイドを底に沈降させるために、100 x g で30〜60秒間遠心分離します。
- 余分な液体を取り除き、氷上で30分間、PBS溶液中の200 μLの冷たい4%ホルムアルデヒドでオルガノイドを固定します。
注意: ホルムアルデヒドは有毒であり、常に化学ヒュームフードで使用する必要があります。ニトリル手袋、安全メガネ、白衣は常に着用する必要があります。 - オルガノイドを固定するとオルガノイドが沈み、遠心分離は不要になります。チューブを直立させてオルガノイドを沈め、2〜3分待ってからホルムアルデヒドを取り除き、500 μLの冷たいPBSを加えてホルムアルデヒドを洗い流します。
- オルガノイドを沈め、余分なPBSを取り除き、500 μLの新鮮な冷たいPBSを加えます。オルガノイドを沈め、余分なPBSを除去し、500 μLのブロッキングバッファー(5%正常ロバ血清、1%BSA、および0.5%トリトンX-100PBS溶液)を加えます。チューブをロッカーシェーカーにRTで60分間置きます。
注:ブロッキングは、4°Cで一晩(O / N)行うこともできます。 - オルガノイドを沈め、ブロッキングバッファーを除去し、一次抗体を含む200 μLのブロッキングバッファーにオルガノイドを再懸濁します( 材料の表を参照)。オルガノイドをロッカーシェーカーO/N上で4°Cに保ちます。
注:核タンパク質、低発現タンパク質、または非特異的な染色を示す抗体の染色を改善するために、4°Cで1〜2日間インキュベーション時間を長くすることができます。 オルガノイドをロッカーシェーカーに置くことは、オルガノイドが凝集するのを防ぎ、染色効率を高めるため、不可欠です。 - オルガノイドを沈め、一次抗体ミックスを除去し、500 μLの0.02%Triton X-100をPBS(0.02%Tx)溶液でRTで60分間洗浄します。
注:より長い一次抗体のインキュベーションが必要な場合は、4°CでPBS O/N中の0.02%Txで洗浄ステップを追加します。 - オルガノイドを沈め、洗浄バッファーを除去し、ブロッキングバッファーO/Nに200 μLの蛍光標識二次抗体を4°Cで加えます。 蛍光二次抗体を添加した後は、シグナルの漂白を避けるためにオルガノイドを暗所に保管してください。
- オルガノイドを沈め、二次抗体ミックスを除去し、500 μLの0.02%TxをRTで60分間使用してオルガノイドを洗浄します。
- 必要に応じて、核染色用に200 μLのDAPI(0.25 μg/mL)溶液でオルガノイドを対比染色します。サンプルをロッカーシェーカーのRTで60分間インキュベートします。
- オルガノイドを沈め、DAPI溶液を除去し、500 μLのPBSでオルガノイドをRTで15分間洗浄します。
- オルガノイドを沈め、余分な液体をすべて取り除きます。10 μLの透明化溶液をオルガノイドに加え、RTで15分間インキュベートします。
注:透明化溶液は粘性があるため、透明化溶液をピペッティングする前に、20 μLのピペットチップの外側部分を切り取ってください。より大きなスペーサーをイメージングに使用すると、より多くのクリアリングソリューションを追加できます。オルガノイドを透明化しない場合には、透明化溶液の代わりにマウント液を使用することができます。クリアリングソリューションは、イメージング時のバックグラウンドを減らし、イメージング深度を増やします。 - 0.05 mmの両面粘着性のある4ウェルスペーサーを顕微鏡スライド上に置きます。1ウェルにオルガノイドを含む10 μLの透明化溶液を加え、スペーサーの上にカバースリップを置きます。
注:オルガノイドは、スペーサーを使用せずに取り付けることもできます。スペーサーはオルガノイドの形状を損なわず、オルガノイドが平らになるのを防ぎます。 - スライドをRT O / Nに保ち、オルガノイドをクリアします。長期保管の場合は、スライドを4°Cに保ちます。 共焦点顕微鏡システムを使用して画像を取得します。
結果
食道は、上皮、固有層、粘膜下組織、および外筋筋のさまざまな層に分かれています(図1A)。線維芽細胞は、間質と呼ばれる粘膜下層および固有層内に存在します。このプロトコルでは、外筋筋が機械的に除去され(図1B)、間質に存在する線維芽細胞(PdgfrαH2BeGFP+)の喪失にはつながりません(図1C)。解離する前に、上皮は間質から分離され、2つの組織セグメントが生じます(図1B)。2つの層を分離することは、脆弱な間質層と比較して、より堅牢な上皮層の解離時間を増加させる機会を提供する。このようにして、生存可能な上皮前駆細胞ならびに間質線維芽細胞の両方を生じる効率的な単離プロトコルが確立される(図1B)。食道前駆細胞は、その高いINTEGRIN-β4およびE-CADHERIN発現に基づいてソートされます(図1C、D)。
線維芽細胞の亜集団は、別個のマーカーを用いて単離することができる。このプロトコルでは、一般的に使用される線維芽細胞マーカーPDGFRαおよびDPP4(CD26)に基づく線維芽細胞単離のための戦略が提供される。PdgfrαH2BeGFP レポーター発現またはDPP4抗体のいずれかによる単離は、単離された細胞の約50%が線維芽細胞であることを示しています(図1E、F)。さらに、PDGFRα+線維芽細胞の70%はDPP4+であり、大きく重複しているが同一ではない線維芽細胞集団が得られることを示しています。上皮細胞集団と間質細胞集団の両方を単離した後、食道前駆細胞を単独で、またはマトリックスドーム内で線維芽細胞と一緒に培養します。オルガノイド形成に対する線維芽細胞の寄与を研究するために、共培養は成長因子還元培地中で維持される(図1G)。
食道前駆細胞は、EGF、NOGGIN、およびRSPO(ENR)の存在下でオルガノイドを形成します。ノギンを除去し、RSPOの量を減らす(25 ng / μL;ER低)は、オルガノイド形成を防ぐのに十分である(図2A)。興味深いことに、DPP4+またはPDGFRα+線維芽細胞のいずれかをER低培地の食道前駆細胞に加えると、オルガノイド形成能が回復し、両方の線維芽細胞集団に対する支持機能が実証されます(図2A-D)。PdgfrαH2BeGFP導入遺伝子の可視化は、線維芽細胞がオルガノイド形成中に上皮前駆細胞と密接に接触していることを示している(図2A)。6日目の時点で、PdgfrαH2BeGFP+線維芽細胞は共培養中にまだ豊富に存在しています。線維芽細胞は、ドーム全体、オルガノイドの近くおよび接触(完全な矢印)に存在し、またはオルガノイドに付着している(矢じり;図2D)。
ホールマウント染色は、線維芽細胞とオルガノイドとの相互作用の3D表現を示しています(図3)。クリアリングソリューションを使用せずにマウントプロトコル全体を実行することは可能ですが、オルガノイドの透明度とレーザー透過性が低下します(図3B、z-view)。オルガノイドを取り付ける場合、スペーサーはオルガノイドの形態を維持するのに役立ちます。対照的に、カバーガラスをオルガノイドに直接メッキすると(スペーサーなし)、オルガノイドが平らになり、オルガノイド構造が失われます(図3A、B)。
DPP4+線維芽細胞とPDGFRα+線維芽細胞の両方がオルガノイドに巻き付いていることがわかっています(図3C、ビデオ1、およびビデオ2)。食道オルガノイドの分化は、異なるマーカーを用いて評価することができる。図4は、提供された染色プロトコルが、染色が容易なケラチン(KRT14/13)および染色が困難な転写因子(TRP63/KLF4)に適していることを示しています。共培養プロトコルは、インビボ13,14で実証され、ENR培地で増殖したオルガノイドに見られるように、同様の分化パターンを持つオルガノイドを生成します。KRT14+またはTRP63+の前駆細胞は外層を形成し、KRT13+またはKLF4+の分化細胞は内側に配向します。
このプロトコルは、食道幹細胞ニッチを in vitro で研究するためのツールを提供し、オルガノイドと線維芽細胞の間の相互作用を視覚化します。抗体を用いて線維芽細胞を単離するためのプロトコルを実施することにより、この方法は適応可能であり、トランスジェニックマウスを必要とせずに線維芽細胞亜集団の研究に使用することができる。
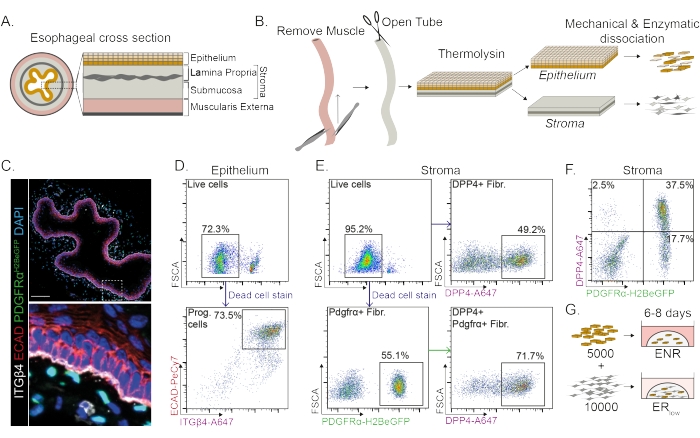
図1:食道からの前駆細胞および線維芽細胞亜集団の単離。 (A)食道のさまざまな層の概略図。間質には固有層と粘膜下組織が含まれています。(B) 絶縁プロトコルの概略図筋肉(筋筋)は鉗子を使用して機械的に除去されます。残りの食道を切り開き、サーモリシン中でインキュベートして上皮層を間質から分離する。上皮と間質を分離し、機械的にミンチし、酵素的に消化して単一細胞懸濁液にします。次に、解離した細胞を染色し、FACS用に調製します。(C)外筋筋層から剥離した食道の断面で、間質にPdgfrαH2BeGFP+線維芽細胞を示す。インテグリン-Β4(ITGβ4)およびE-カドヘリン(ECAD)のダブルポジティブ細胞は、食道の上皮前駆細胞です。スケールバー= 100μm。 (D)上皮細胞単離の代表的なフローサイトメトリープロットは、すべての単一細胞からの生細胞の割合(上のパネル)を示す。下のパネルは、すべての生細胞から単離されたITGβ4+ ECAD+前駆細胞の割合を示しています。(E)生細胞の割合を示す間質細胞単離の代表的なフローサイトメトリープロット(左上のパネル)。すべての生細胞における単離されたDPP4+線維芽細胞(Fibr.;右上パネル)およびPdgfrα+線維芽細胞(左下パネル)の割合を示す代表的なフローサイトメトリープロット。Pdgfrα+線維芽細胞の70%もDPP4+です(右下パネル)。(F)DPP4+のみの細胞(2.5%)、DPP4+ PDGFRα+細胞(37.5%)、およびPDGFRα+のみの細胞(17.7%)を示す間質の代表的なフローサイトメトリープロット。パーセンテージはすべての生細胞のものです。(G)上皮のみの細胞を、50 ng/μL EGF、100 ng/μL NOGGIN、および250 ng/μL RSPO(ENR)の存在下でマトリックスドームに播種するか、EGFおよび低濃度のRSPO(25 ng/μL)の存在下で線維芽細胞と一緒に播種します。この図の拡大版を表示するには、ここをクリックしてください。
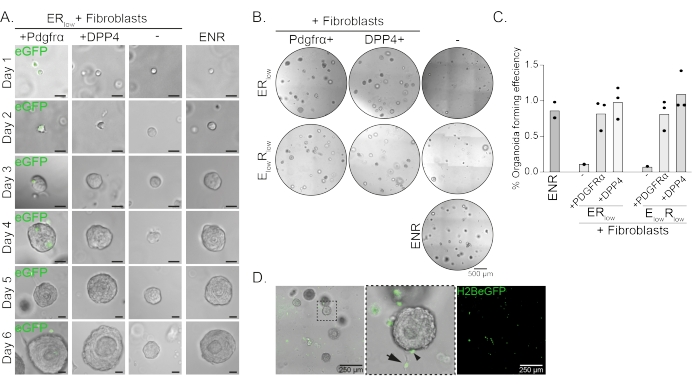
図2:オルガノイド共培養の代表的な結果。 (A)1日目から6日目までのオルガノイドの成長を示す明視野画像。PdgfrαH2BeGFP+線維芽細胞と共培養したオルガノイドを用いた明視野画像も、核内eGFPシグナルを示しています。スケールバー= 25μm。 (B)6日目のマトリックスドーム全体の明視野画像。左の列は、ER低またはE低R低培地でPdgfrα+線維芽細胞の存在下で増殖したオルガノイド共培養を示しています。中央の列は、ER低またはE低R低培地でDPP4+線維芽細胞の存在下で増殖したオルガノイド共培養を示しています。右の列は、ENR培地で増殖させたオルガノイド単培養物を示す。ENR培地 = EGF (50 ng/μL)、ノギン (100 ng/μL)、および RSPO (250 ng/μL)低小胞体 = EGF および 25 ng/μL RSPO です。E低 R低 = 5 ng/μL EGF および 25 ng/μL RSPO です。スケールバー=500μm。 (c)オルガノイド形成効率(%)(すなわち、異なる培養条件でオルガノイドを形成する細胞の割合)を示すグラフ。各ドットはマトリックスドームを表し、バーは条件ごとのすべてのドットの平均を表します。(D)PdgfrαH2BeGFP+線維芽細胞と共培養した6日目のオルガノイドの明視野および蛍光画像。PdgfrαH2BeGFP+線維芽細胞はドーム全体に存在し、オルガノイドに付着し(矢じり)、付着していないがオルガノイドと接触している(完全な矢印)。スケールバー = 250 μm。 この図の拡大版を表示するには、ここをクリックしてください。
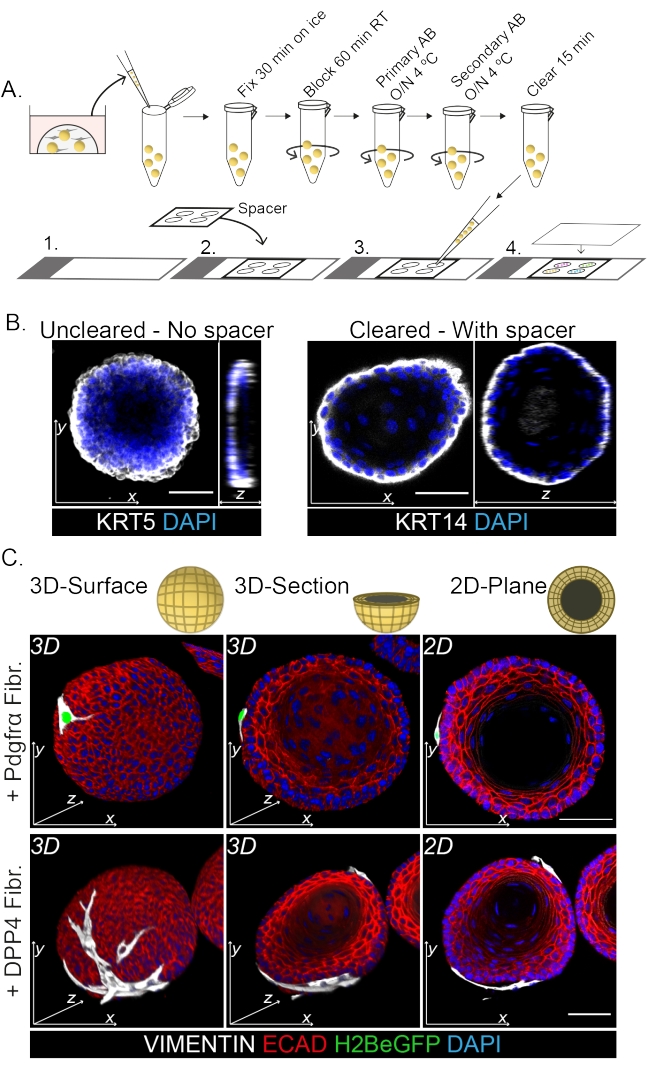
図3:線維芽細胞とオルガノイドの相互作用を研究するためのホールマウント染色プロトコル 。 (A)マウント免疫蛍光プロトコル全体の概略図。AB =抗体。(B)透明化されたオルガノイドと比較してレーザー光の透明度と透過性が低下していることを示す未透明のホールマウント染色の免疫蛍光写真。スペーサーが存在しないと、オルガノイドが平坦化し、オルガノイドの形態が失われます。(C)共培養オルガノイドのホールマウント画像は、ビメンチン+線維芽細胞(Fibr.)がオルガノイドに巻き付けられ、密着しているオルガノイドの3D表面を示しています。3D断面と2D平面画像は、オルガノイドの内腔を示しています。スケールバー = 50 μm。 この図の拡大版を表示するには、ここをクリックしてください。
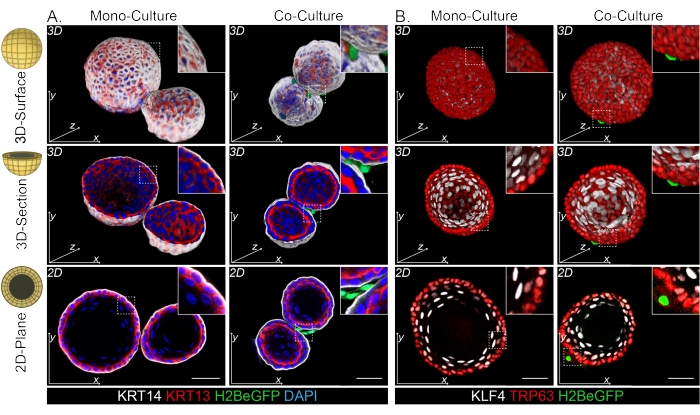
図4:ホールマウント画像は、明確な基底細胞集団と基底上細胞集団を明らかにし ます。 (A)外層にKRT14+基底細胞とKRT13+分化した基底上細胞を示すPdgfrαH2BeGFP+線維芽細胞を用いた単培養および共培養オルガノイドのホールマウント染色。スケールバー= 50μm。(B)外層のTRP63+基底細胞とKLF4+分化基底上細胞を示すPdgfrαH2BeGFP+線維芽細胞による単培養および共培養オルガノイドのホールマウント染色。スケールバー = 50 μm。 この図の拡大版を表示するには、ここをクリックしてください。
表1:オルガノイド培地成分を記載した表。この表をダウンロードするには、ここをクリックしてください。
ビデオ1:PdgfrαH2BeGFP+線維芽細胞がオルガノイドに巻き付き、密着しています。 このビデオは 、図3Cの上部パネルに付属しています。 図3C のスケールバーは50μmで、オルガノイドの直径は~120μmです。ビメンチンは白、E-カドヘリンは赤、PdgfrαH2BeGFPは緑、DAPIは青で示されています。 このビデオをダウンロードするには、ここをクリックしてください。
ビデオ2:DPP4+線維芽細胞がオルガノイドに巻き付き、密着している。 このビデオは、 図3Cの下部パネルに付属しています。 図3C のスケールバーは50μmで、オルガノイドの直径は~120μmです。ビメンチンは白、E-カドヘリンは赤、DAPIは青で表示されます。 このビデオをダウンロードするには、ここをクリックしてください。
ディスカッション
ここで提示されたプロトコルは、機能的な食道上皮-線維芽細胞相互作用を調査するための in vitro モデルを確立します。
上皮層は間質から分離されており、上皮コンパートメントと間質コンパートメントの両方に対して最適化された解離プロトコルを可能にします。上皮解離プロトコルの最適化にもかかわらず、組織凝集塊は明らかなままです。15分ごとに激しく上下にピペッティングすると、塊の数とサイズが大幅に減少します。他のプロトコルは、トリプシンを使用して上皮層をさらに解離させる5、6。ここで、トリプシンの使用、または解離時間をさらに増加させることは、上皮細胞の生存率およびオルガノイド形成効率の低下をもたらす傾向があるので、推奨されない。上皮とは対照的に、間質は容易に解離し、解離溶液中で30分は~90%の線維芽細胞生存率を有する単一細胞懸濁液をもたらす(図1E)。プロトコルで上皮-ストーム分離ステップを除外すると、解離時間が大幅に増加し、線維芽細胞の生存率が低下し、上皮細胞の収量が低下します。さらに、間質から上皮を分離することで、共培養のセットアップ時に、各集団の細胞数を決定し、異なるマウス系統の上皮細胞と線維芽細胞を混合する機会が得られます。
オルガノイド増殖に対する線維芽細胞機能の研究は、幹細胞生物学において一般的に使用される方法である9,10,11,15,16。確立された共培養培地は、10%ウシ胎児血清(FCS)9,15を添加したDMEMまたは成長因子低減培地10,16のいずれかである。このプロトコルでは、成長因子還元培地を使用して、線維芽細胞が大部分静止しているin vivo幹細胞ニッチの状態を模倣します。FCSは、共培養において線維芽細胞の活性化および増殖をもたらす成長因子に富む血清であり、おそらくin vivo状態とは異なる線維芽細胞状態に対応する。FCSを除外し、成長因子を低減することにより、培地単独(ER低)がオルガノイド増殖を支持せず、線維芽細胞の増殖を刺激しないようにすることで、オルガノイド増殖に対する線維芽細胞の影響を単離することができる。この培地では、NOGGINが除去され、RSPOが最小限に抑えられます(10%RPSO)。NOGGINとRSPOの両方が食道オルガノイドの成長に不可欠であることが実証されています6。EGFは、それ自体ではオルガノイドの増殖をサポートしないため、共培養培地に保持されました。しかし、線維芽細胞は、EGF還元培地(E低R低;図2B、D)。
オルガノイド共培養は、トリプシン処理中に線維芽細胞が失われるため、継代によって持続することはできません。ただし、食道オルガノイドは維持、拡張し、単培養としてさらなる実験に使用できるため、オルガノイド継代がプロトコルに含まれていました。単培養からの継代オルガノイドは、新たに単離された線維芽細胞との共培養をセットアップするために使用できます。初代細胞を使用することの欠点は、複数のオルガノイド共培養をセットアップするために必要なマウスの数です。線維芽細胞の小さな亜集団に焦点を当てると、得られる共培養の数は限られています。他のプロトコルでは、線維芽細胞は、オルガノイド共培養をセットアップするために使用する前に、まず培養中で増殖される10。しかしながら、線維芽細胞は継代中に形態および同一性を変化させることを、一次皮膚および心臓線維芽細胞を用いることによって示される17、18。食道線維芽細胞の従来の2D継代は、形態と表現型の両方の変化をもたらし、線維芽細胞の in vitro 濃縮は、内因性幹細胞ニッチの表現コピーを目的とした共培養には適していないことを示しています。
ホールマウント染色は、線維芽細胞とオルガノイドの相互作用を維持および視覚化するためのツールを提供します。すべてのオルガノイドが線維芽細胞に直接付着しているわけではありませんが、ほとんどのオルガノイドは線維芽細胞と接触していることに注意してください( 図2Cを参照)。上皮-線維芽細胞の相互作用を維持するためには、オルガノイドの取り扱いに注意し、激しいピペッティング、ボルテックス、高速回転を避けることが重要です。最適な固定は、3D組織構造を維持し、内因性蛍光を維持するために重要です。H2BeGFPシグナルを保持するには30分の固定で十分であり、このプロトコルで使用される抗体に最適ですが、これは使用する蛍光色素と抗体によって異なる場合があります。オルガノイドをクリアすると、光の散乱が減少し、3D構造全体の視覚化が大幅に向上します。オルガノイドが小さいため、クリアリングは簡単かつ迅速です。ただし、レーザー走査型共焦点顕微鏡を使用してオルガノイド全体をイメージングするには、複数のZスタックを作成する必要があるため、時間がかかる場合があります。スピニングディスクのような共焦点顕微鏡は、イメージング時間を短縮するために使用できます。
全体として、線維芽細胞の存在下で増殖した食道オルガノイドは、食道幹細胞ニッチの側面を理解するための貴重なツールを提供します。さらに、ホールマウントクリアリングは、線維芽細胞とオルガノイド間の相互作用を視覚化するためのアクセス可能な方法を提供します。
開示事項
著者は利益相反を宣言しません。
謝辞
この研究はERC StG TroyCAN(851241)によってサポートされました。E.E.はCancerfondenのポスドクアソシエイトです。M.G.はラグナル・ソデルバーグ・フェローであり、キャンサーフォンデンのジュニア研究者です。バイオメディカムフローサイトメトリーコア施設、バイオメディカムイメージングコア(BIC)、比較医学バイオメディカム(KMB)動物施設など、カロリンスカ研究所のコア施設からの技術支援に感謝しています。プロトコルを注意深く読み、コメントしてくれたGenanderラボのメンバーに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| B-27 Supplement (50X), serum free | Thermo Fisher (Gibco) | 17504001 | |
| Corning Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix | fisher scientific | 356231 | |
| Dimethyl sulfoxide | Sigma-Aldrich | 276855-100ML | |
| DMEM/F-12 | Thermo Fisher (Gibco) | 11320074 | |
| DPBS | Thermo Fisher (Gibco) | 14190250 | |
| Fetal Bovine Serum | Sigma-Aldrich | F7524 | |
| GlutaMAX Supplement | Thermo Fisher (Gibco) | 35050061 | |
| HBSS, no calcium, no magnesium, no phenol red | Thermo Fisher (Gibco) | 14175-129 | |
| Normal Donkey Serum | Jackson Immuno | 017-000-121 | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher (Gibco) | 15140122 | |
| Triton X-100 solution | Merck | 93443-100ML | |
| Trypsin-EDTA (0.25%), phenol red | Thermo Fisher (Gibco) | 25200-056 | |
| Chemicals, Peptides, and recombinant proteins | |||
| DAPI Solution | Thermo Fisher | 62248 | |
| Dissociation solution: 0.25 mg/ml Liberase TM, 0.25 mg/ml Dnase in HBSS | |||
| Dnase I | Sigma-Aldrich | 11284932001 | |
| Formaldehyde, 37%, with 10-15% methanol | Sigma-Aldrich | 252549-1L | |
| Liberase | Sigma-Aldrich | 5401127001 | |
| N-Acetyl-cysteine | Sigma-Aldrich | A9165-25G | |
| Noggin murine | Peprotech | 250-38 | |
| RapiClear 1.47 | SunJin Lab | #RC147001 | |
| Recombinant Mouse EGF Protein, CF | R&D systems | 2028-EG-200 | |
| R-spondin-1 murine | Peprotech | 315-32 | |
| SYTOX Blue Dead Cell Stain | Thermo Fisher | S34857 | |
| Thermolysin | Sigma-Aldrich | T7902-25MG | |
| Y-27632 dihydrochloride | Sigma-Aldrich | Y0503-5MG | |
| Plastic & Glassware | |||
| Corning Sterile Cell Strainers 40um | VWR | 15360801 | |
| Corning Sterile Cell Strainers 70um | VWR | 431751 | |
| Menzel Deckgläser/ cover slips | Thermo Fisher | Q10143263NR15 | |
| SafeSeal reaction tube, 1.5 mL, PP | Sarstedt | 72.706 | |
| Snap Cap Low Retention Microcentrifuge Tubes 0.6 mL | Thermo Fisher | 3446 | |
| SuperFrost Slides | VWR | 631-9483 | |
| Tools | |||
| 0.05 mm 4 circular well iSpacer | SunJin Lab | #IS204 | |
| Dumont #5 forceps, biology tip | F.S.T | 11252-20 | |
| ImmEdge Pen | VectorLaboratories | H-4000 | |
| Spring Scissors Angled to Side Ball Tip 8mm Cutting Edge | F.S.T | 15033-09 | |
| Instruments | |||
| Confocal microscope Stellaris 5 | Leica | ||
| Dissection microscope ZEISS Stemi 305 | Zeiss | ||
| FACS ARIA III | BD Biosciences | ||
| Conjugated Antibodies for FACS | |||
| Alexa Fluor 647 anti-mouse CD104 Antibody Clone: 346-11A | 123608 | 123608 | |
| APC anti-mouse CD26 (DPP-4) Antibody | H194-112 | H194-112 | |
| PE/Cy7 anti-mouse/human CD324 (E-Cadherin) Antibody | 147310 | 147310 | |
| Antibodies for Immunofluorescence | |||
| CD104 (ß-integrin 4) Clone: 346-11A | BioLegend | 553745 | |
| Cytokeratin 14 | Acris Antibodies (AbD Serotec) | BP5009 | |
| Cytokeratin13 Clone: EPR3671 | abcam | ab92551 | |
| E-cadherin (CD324) Clone: 2.40E+11 | Cell Signaling Technology | 3195 | |
| Keratin 5 Polyclonal Chicken Antibody, Purified Clone: Poly9059 | BioLegend | 905901 | |
| p63 Clone: 4a4 | abcam | ab735 | |
| Recombinant Anti-KLF4 antibod Clone: EPR20753-25 | abcam | ab214666 | |
| Vimentin | Sigma-Aldrich | AB5733 | |
| Secondary antibodies | |||
| Donkey anti-species* antibodies with fluorophore of choice | Jackson Immuno |
参考文献
- Sachs, N., et al. Long-term expanding human airway organoids for disease modeling. The EMBO Journal. 38 (4), 100300(2019).
- Lohmussaar, K., et al. Patient-derived organoids model cervical tissue dynamics and viral oncogenesis in cervical cancer. Cell Stem Cell. 28 (8), 1380-1396 (2021).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Smukler, S. R., et al. The adult mouse and human pancreas contain rare multipotent stem cells that express insulin. Cell Stem Cell. 8 (3), 281-293 (2011).
- Zheng, B., et al. A new murine esophageal organoid culture method and organoid-based model of esophageal squamous cell neoplasia. iScience. 24 (12), 103440(2021).
- DeWard, A. D., Cramer, J., Lagasse, E. Cellular heterogeneity in the mouse esophagus implicates the presence of a nonquiescent epithelial stem cell population. Cell Reports. 9 (2), 701-711 (2014).
- Kasagi, Y., et al. The esophageal organoid system reveals functional interplay between notch and cytokines in reactive epithelial changes. Cellular and Molecular Gastroenterology and Hepatology. 5 (3), 333-352 (2018).
- Plikus, M. V., et al. Fibroblasts: Origins, definitions, and functions in health and disease. Cell. 184 (15), 3852-3872 (2021).
- McCarthy, N., et al. Distinct mesenchymal cell populations generate the essential intestinal BMP signaling gradient. Cell Stem Cell. 26 (3), 391-402 (2020).
- Cordero-Espinoza, L., et al. Dynamic cell contacts between periportal mesenchyme and ductal epithelium act as a rheostat for liver cell proliferation. Cell Stem Cell. 28 (11), 1907-1921 (2021).
- Pastula, A., et al. Three-dimensional gastrointestinal organoid culture in combination with nerves or fibroblasts: a method to characterize the gastrointestinal stem cell niche. Stem Cells International. 2016, 3710836(2016).
- Hamilton, T. G., Klinghoffer, R. A., Corrin, P. D., Soriano, P. Evolutionary divergence of platelet-derived growth factor alpha receptor signaling mechanisms. Molecular and Cellular Biology. 23 (11), 4013-4025 (2003).
- McGinn, J., et al. A biomechanical switch regulates the transition towards homeostasis in oesophageal epithelium. Nature Cell Biology. 23 (5), 511-525 (2021).
- Zhang, Y., Bailey, D., Yang, P., Kim, E., Que, J. The development and stem cells of the esophagus. Development. 148 (6), (2021).
- Ohlund, D., et al. Distinct populations of inflammatory fibroblasts and myofibroblasts in pancreatic cancer. The Journal of Experimental Medicine. 214 (3), 579-596 (2017).
- Pentinmikko, N., et al. Notum produced by Paneth cells attenuates regeneration of aged intestinal epithelium. Nature. 571 (7765), 398-402 (2019).
- Janson, D., Rietveld, M., Willemze, R., El Ghalbzouri, A. Effects of serially passaged fibroblasts on dermal and epidermal morphogenesis in human skin equivalents. Biogerontology. 14 (2), 131-140 (2013).
- Landry, N. M., Rattan, S. G., Dixon, I. M. C. An improved method of maintaining primary murine cardiac fibroblasts in two-dimensional cell culture. Scientific Reports. 9 (1), 12889(2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved