単離マウス脳ミクログリアにおける核内フローサイトメトリーを用いたグローバルヒストン翻訳後修飾の定量化
要約
この研究は、単離された脳ミクログリアにおける核内フローサイトメトリーを用いた全体的なヒストン修飾の定量化のためのプロトコルについて説明しています。この研究には、データ収集に使用されたミクログリア分離プロトコルも含まれています。
要約
遺伝子発現制御は、ヒストンテールへの翻訳後修飾の付加や除去など、クロマチン構造の修飾によって部分的に行われます。ヒストン翻訳後修飾(HPTM)は、遺伝子発現または抑制を促進することができます。例えば、ヒストンテールリジン残基のアセチル化は、正電荷を中和し、テールと負電荷を帯びたDNAとの相互作用を減少させます。ヒストンテールDNA相互作用の減少により、基礎となるDNAへのアクセス性が向上し、転写因子へのアクセスが増加します。アセチル化マークは、ブロモドメイン含有転写活性化因子の認識部位としても機能し、遺伝子発現の亢進をもたらします。ヒストンマークは、細胞分化中、およびさまざまな細胞環境や刺激に応答して動的に制御できます。次世代シーケンシングアプローチにより、個々のヒストン修飾のゲノム位置を特徴付け始めていますが、同時に調べることができるのは1つの修飾のみです。HPTMには何百もの異なるものがあるため、より広範なゲノムシーケンシングアプローチを実施する前に、ヒストン修飾のスクリーニングに使用できるグローバルHPTMのハイスループットで定量的な測定方法を開発しました。このプロトコルは全体的なHPTMsを検出する流れのcytometryベースの方法を記述し、生体 内の ティッシュからの文化のセルか隔離されたセルを使用して行なうことができる。細菌由来の免疫刺激(リポ多糖)に応答するHPTMの全体的なシフトを検出するためのアッセイの感度を実証するために、単離されたマウス脳ミクログリアからの例データを提示します。このプロトコルは、HPTMの迅速かつ定量的な評価を可能にし、抗体によって検出できるあらゆる転写調節因子またはエピジェネティック制御因子に適用できます。
概要
エピジェネティクスは、基礎となるDNA配列を変化させることなく遺伝子発現を調節するメカニズムの研究です。遺伝子発現のエピジェネティックな制御は細胞内で動的であり、さまざまな環境刺激に対して迅速かつ協調的な応答を可能にします。この動的調節は、ヒストンタンパク質(H2A、H2B、H3、H4)がDNA1によってしっかりと巻かれた八量体コアに組み立てられたヌクレオソームのレベルでのクロマチン構造の変化によって部分的に起こります。ヒストンタンパク質とDNAの相互作用は、DNAの転写機構へのアクセスを制御し、最終的に遺伝子発現やクロマチン生物学の他の側面を制御することができます2。ヒストンタンパク質は、負に帯電したDNA骨格と静電相互作用を形成する正に帯電した残基を特徴とする非構造化テールを持っています。これらの相互作用により、DNAが密集し、DNAへのアクセス性が低下します。ヒストン翻訳後修飾(HPTM)と呼ばれるヒストンテールへの共有結合修飾は、これらの相互作用を調節することができます3,4。最もよく特徴づけられているHPTMには、ヒストンテールのアセチル化とメチル化があり、ヒストンテールとDNAの間の静電相互作用の親和性を変化させ、基礎となるDNAへのアクセス性に差があり、特定の部位でこれらのHPTMを認識する転写因子が動員されます。HPTMは、HPTMを認識するリーダー、沈着するライター、HPTMを除去する消しゴムと呼ばれる3つの重要な酵素によって制御されています。したがって、リーダー、ライター、または消しゴム酵素の動員または溶解は、最終的にHPTMの状況を変え、クロマチンの構造と機能を支配し、それらの制御と読み出しを細胞生物学と機能の理解に不可欠にすることができます3,4。
中枢神経系(CNS)の細胞は、環境刺激に適応するためにトランスクリプトームを変化させるため、エピジェネティックに柔軟です。DNAメチル化、ノンコーディングRNA、HPTMなどのエピゲノムの変化が、記憶形成やシナプス機能に重要な役割を果たしていることが示唆されています5。関連するリーダー、ライター、または消しゴムの操作によってHPTMダイナミクスを混乱させると、連想学習と長期的な増強がブロックまたは強化される可能性があります6,7,8。中枢神経系に常在する免疫細胞であるミクログリアは、エピゲノムのダイナミックな変化を通じて免疫刺激に応答してトランスクリプトームを急速に制御します9,10,11。ミクログリアのエピゲノムとトランスクリプトームは、脳環境から除去された後、培養培地中でわずか数時間で変化することが研究で示されているため、局所的な脳環境へのこの高いレベルの適応は、孤立した状況での調査を困難にします11。さらに、ミクログリアは脳細胞の10%しか構成していないため、組織全体のレベルでの変化を調べる測定は感度と特異性に欠けています12,13。その結果、ミクログリアを迅速に単離して、HPTMレベルなどのエピジェネティックな変化を調べる必要があります。
HPTMの検査に一般的に使用される方法には、クロマチン免疫沈降シーケンシング(ChIP-seq)やターゲット下での切断、タグメンテーションシーケンシング(CUT&Tag-seq)などがあります4。これらの手法は、個々のHPTMに高度に特異的であり、特定のゲノムコンテキスト内のHPTMの存在を知らせることができるが、1回の実験で多くの可能なHPTMのうちの1つしか調べることができない11,14したがって、多大な時間と費用の投資を必要とするそのような実験を進める前に、まず地球規模の変化を調べることによって、さらなる調査のために潜在的に興味深いHPTMのリストを絞り込むことは非常に価値があるHPTM のレベル。世界のHPTMレベルを調べるための2つの主要なアプローチは、免疫組織化学とウェスタンブロット分析ですが、どちらのアプローチも半定量的でスループットが低く、多数の組織切片または単離細胞を必要とします15,16。そこで、全球のHPTMレベルを迅速かつ単一細胞レベルで調べることができる高感度で定量的な手法の開発を目指しました。
提示されたプロトコルは、核内フローサイトメトリーを使用して、全体的なHPTMレベルを迅速に検出することを可能にします。がん細胞に関する以前の研究は、臨床的観点からグローバルレベルを調べることの重要性を正当化しています17,18。また、関心のある特定のHPTMのゲノム位置を評価する前に、スクリーニング方法としてグローバルレベルを使用する研究も一般的です19,20。ミクログリアの場合、細胞収量が低いため、単離後の全体的なレベルの評価は困難です。Panらは、3匹の動物のミクログリアをプールしてウェスタンブロットによるタンパク質レベルの検出を可能にした単離されたミクログリアからの全体的なHPTMレベルを提示しています19。当社のプロトコルを使用することで、はるかに少ない細胞インプットで全体的な変化を検出できるため、動物ごとに複数のマークをスクリーニングでき、サンプルをプールする必要がなくなります。
ここでは、単離されたミクログリアの定量的核内フローサイトメトリーを介してHPTMレベルを迅速に検出するプロトコルについて説明します。簡潔にするためにHPTM定量に特化していますが、このプロトコルは、リーダー、ライター、および消しゴム酵素のグローバルレベルの定量化にも同じ方法で使用できます。このプロトコルは、ミクログリアの単離法と、HPTMレベルを決定するためのフローサイトメトリーベースの方法の2つの部分に分かれています。単離法により、RNA単離とHPTMレベル評価の両方に使用できる細胞が得られ、同じサンプルから遺伝子発現とHPTMレベルを評価できます。さらに、HPTM評価の方法は、プロトコルに示されているように、他の細胞タイプで使用できます。
プロトコル
すべての動物飼育プロトコルは、カナダ動物管理評議会のガイドラインに従って、ブリティッシュコロンビア大学の動物管理委員会によって承認されました。
1. ミクログリア単離のための脳内消化
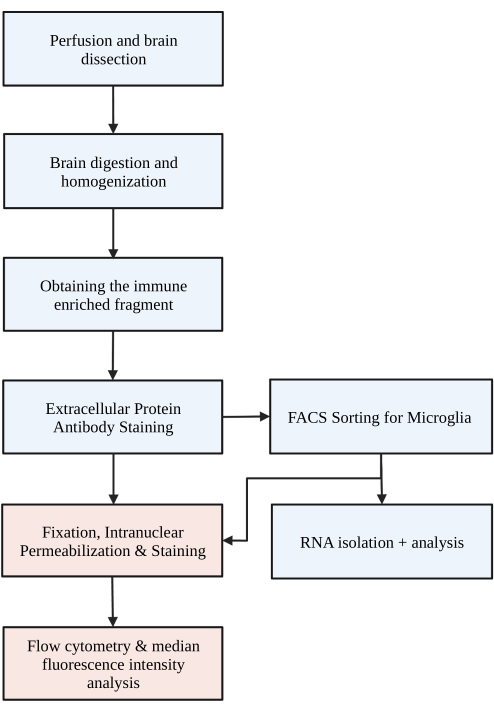
図1:プロトコルの簡単なフローチャート マウスは最初にHBSSで経心灌流され、脳が解剖されます。その後、脳は化学的消化と機械的破壊によって解離され、単一細胞の均質化になります。免疫濃縮画分は不連続密度勾配によって収集され、その後、細胞はP2RY12について染色されます。染色された細胞は、1)RNA分析または下流タンパク質分析につながる蛍光活性化細胞ソーティング(FACS)によって選別されるか、2)核内タンパク質の固定、透過処理、染色のいずれかです。タンパク質レベルは、フローサイトメトリーによって決定された目的チャネルの蛍光強度の中央値によって定量されます。青色で着色されたボックスは、プロトコルステップ1)ミクログリア分離のための脳消化の一部です。赤色で着色されたボックスは、プロトコールステップ2)タンパク質発現解析のための核内フロー染色の一部です。BioRender.com で作成。 この図の拡大版をご覧になるには、ここをクリックしてください。
- 試薬の調製
注:HPTM解析のためにRNAと細胞の両方を収集する抽出を計画している場合は、転写および翻訳阻害剤を含むように修正する項目について、セクション1.7.1を参照してください。ただし、氷上に保管すると細胞がほとんど静止しているため、タンパク質シグナルを評価するだけの場合は、これは必要ありません。- 蛍光活性化セルソーティング(FACS)バッファー(サンプルあたり 20 mL):ウシ血清アルブミン(BSA)を 1x Hanks 平衡塩溶液(HBSS)に溶解し、2% BSA 溶液を調製します。EDTAを最終濃度1 mMになるまで2%BSA溶液に溶解します。0.2μmのフィルターでフィルター滅菌し、使用前に4°Cで最大1週間保存してください。
- 消化バッファー(サンプルあたり 1 mL):パパインバイアルを HBSS で再溶解し、0.5 mM EDTA を含む 1 mM L-システイン中で最終濃度 20 U/mL にします。37°Cで最低10分間、または組織を消化する準備ができるまで活性化します。使用直前に、DNase I を活性化パパイン溶液に添加し、最終濃度を 200 U/mL にします。実験当日に準備し、保管しないでください。
- 等張密度グラジエント溶液(サンプルあたり 5.5 mL):10 x HBSS を低温密度グラジエント培地に添加し、最終濃度が 1 x HBSS になるようにすると、最終密度は 1.117 g/mL になります。使用前に少なくとも30秒間混合するボルテックス。使用するまで氷の上に置いてください。
- 37% 密度グラジエント溶液(サンプルあたり 4 mL):1x HBSS に等張密度グラジエントを加えて、最終濃度 37%、最終密度 1.043 g/mL にします。37% 密度グラジエントの mL ごとに 20 μL のフェノールレッドを添加し、レイヤリング中に可視化するためのピンク色の溶液を調製します。使用前に少なくとも30秒間ボルテックスします。使用するまで氷の上に置いてください。
- 70% 密度グラジエント溶液(サンプルあたり 2 mL):1x HBSS に等張密度グラジエントを加え、最終濃度 70%、最終密度 1.082 g/mL にします。密度70%培地1 mLあたり5 μLのトリパンブルーを添加し、積層中に可視化するためのブルー溶液を調製します。使用前に少なくとも30秒間ボルテックスします。使用するまで氷の上に置いてください。
- 灌流と脳解剖
注:灌流プロトコルは、マウス開胸術、経心灌流、および脳除去のビデオ描写を特徴とするPoselらに似ています21.ここでは、成体のC57BL/6J雄マウスと雌マウス(10-15週齢、20-30g)を使用していますが、このプロトコルはどのマウスでも開胸術を行うことができます。すべての動物実験は、実験を行う前に、施設倫理委員会の承認を受けなければなりません。- マウス麻酔:つま先をつまむか、マウスの足をしっかりとつまんだときの反射の欠如で確認できる外科的麻酔の平面を通過するまで、100%酸素中の4%イソフルランでマウスに麻酔をかけます。マウスを仰向けに置き、プラスチックトレイに傾けて置かれた外科用解剖ボードに4本の前足をしっかりと固定し、鼻がイソフルオランのノーズコーンに固定されていることを確認します。移送後、動物がまだ麻酔の手術面を過ぎていることを確認してから、先に進んでください。
- マウス胸郭切開術:鉗子を使用して腹部の皮膚をつかんで持ち上げ、皮膚と腹壁を浅く切開して、下行大動脈や下にある臓器に損傷を与えることなく甲状体を露出させます。
- 鉗子で甲状骨をつかみ、胸郭の下に横方向切開をして横隔膜と肝臓を露出させます。細いハサミを使用して胸郭の長さに沿って横隔膜を慎重に浅く切り込み、組織ハサミを使用して胸郭を貫通し、胸骨をマウスの頭の近くの手術ステーションに固定して、経心灌流のために心臓と肺を露出させます。
- 経心灌流:蠕動灌流ポンプを準備し、チューブの一端に26.5Gの針を取り付けます。チューブの一端をコールド1x HBSSのバイアルに挿入し、ポンプのスイッチを入れてチューブを1x HBSSで完全に満たすことで、手順のためにチューブをプライミングします。
- 鈍鉗子で心臓を押さえながら、灌流チューブを取り付けた26.5Gの針先を心臓の左心室に挿入し、右心房を小さく切開します。灌流ポンプをオンにして、少なくとも15〜20 mLの冷たい1x HBSSで2~4 mL/分の速度でマウスを慎重に灌流します。
注:完全な灌流は、肝臓が血液をきれいにし始め、心臓と同じ色になったときによく示されます。 - 脳の除去:組織解剖ハサミを使用してマウスの首を切り落とし、首から鼻までの頭皮を正中線で切開します。皮膚のフラップを横に剥がして頭蓋骨を露出させ、解剖ハサミで頭蓋骨の尾端にある余分な組織と骨を取り除きます。
- はさみの片方の刃を頭蓋骨の下に慎重にスライドさせ、鋭い側を骨に向けて大孔に入れ、鼻に向かって正中線を慎重に切り取ります。解剖ハサミを使用して、頭蓋骨の付け根と鼻の近くの両方に横方向の切り込みを入れます。細かい鉗子を使用して、頭蓋骨を正中線から外側に命を吹き込み、頭蓋骨の破片を割って脳を露出させます。へらで脳をそっと持ち上げ、解剖しみ紙の上に置きます。
- 脳の解剖:氷で満たされた閉じたペトリ皿の上に、1x HBSSで濡らした解剖しみ紙の上に脳を置きます。小脳を取り除き、きれいなカミソリの刃を使用して脳半球を二等分します。
- 海馬と重なる皮質をそのままに保ちながら、各半球から脳幹、線条体、白質を取り除きます。単離された皮質と海馬組織を含む半球を、5 mLのコールド1x HBSSを含む15 mLチューブに移し、氷上に保管します。
注:解剖は、斬首から解剖した組織を氷上の1x HBSSに最終的に配置するまでに2分以内で組織を冷たく保つために、できるだけ早く実行することが重要です。複数の動物からミクログリアを単離する場合、脳を1x HBSSの氷上に~1時間保存してから、動物のコホート全体を消化などの処理に進めることができます。
- 脳の消化と均質化
- 機械的および化学的解離:各マウスの脳組織と消化バッファー1 mLを氷上の個々のペトリ皿に入れます。清潔なメスの刃を使用して、脳を細かく切り刻みます(<1 mm)。
- プラスチック製のトランスファーピペットからチップを切り取り、ミンチにした脳を氷上の24ウェルプレート内の別々のウェルに慎重に移します。プレートを透明なフレキシブルフィルムで覆い、氷上で30分間インキュベートします。
注:正しく刻むと、脳組織はよくみじん切りにしたニンニクに似ています。 - ダンスホモジナイズ:消化した脳液を各ウェルから、それぞれ 5 mL の冷たい FACS バッファーで満たされた氷上の個々の 7 mL ガラスドンスホモジナイザーに移します。緩い乳棒(A)で各脳を約30〜40回、単一の細胞懸濁液が得られるまで静かに叩きます。Aの杵で2倍にした後、タイトな杵(B)で3〜4回静かに跳ねて、単一細胞の懸濁液を確保します。
注意: ホモジナイザーの底にある組織を押しつぶさないように、乳棒を3/4以上押し下げないでください。最終的な解決策は不透明で乳白色でなければなりません。
注:1回の実験で複数の脳を消化する場合は、各サンプルが消化バッファーに30分間のみ含まれるように、脳内消化物をFACSバッファーに移すタイミングを計ります。過剰消化は表面タンパク質の切断を引き起こし、下流の抗体結合とシグナルを低下させる可能性があります。
- 免疫濃縮フラグメントの入手
- 密度勾配の確立:ホモジネートを各脳から別々の 15 mL ポリプロピレンチューブに移し、2.125 mL の等張密度勾配と上部をそれぞれ FACS バッファーで 8.5 mL に加え、最終濃度が 25% の密度勾配を得ます。15mlのチューブを20回静かに反転させて、完全に混ぜます。
- 細目盛り付きトランスファーピペットを使用して、4 mL の 37% 密度グラジエントを各チューブに静かに下敷きし、清潔な層を確立するように細心の注意を払います。トランスファーピペットを切り替え、2 mL の 70% 密度グラジエントを静かに下敷きにします(図 2A)。4°Cに冷却した遠心分離機に移し、制動ランプをゼロに設定して500 x g で20分間回転させます。
- 免疫濃縮フラグメントの回収:クリーントランスファーピペットを使用し、クリーントランスファーピペットを使用して、15 mLチューブ内の容量の上部からミエリンを静かに吸引し、廃棄します。トランスファーピペットを使用して、密度グラジエントの上部フラグメントを清潔な 15 mL ポリプロピレンチューブに慎重に集めます。
- 免疫濃縮フラグメント(70%と37%の密度グラジエント層が合流する位置で上1.5 mL、下1.5 mL)を新しい15 mLポリプロピレンチューブに慎重に集めます(図2B)。免疫濃縮サンプルに 10 mL の FACS バッファーを加えて密度グラジエント培地を希釈し、チューブを 20 回静かに反転させて完全に混合します。
注:細胞はチューブの側面に付着する傾向があるため、液体を採取しながらチューブの側面に沿ってピペットをゆっくりと一周させることにより、採取ステップ中にサンプル中のすべての細胞を回収してください。 - 15 mLのチューブを4°Cの遠心分離機で500 x g で10分間遠心分離し、下り坂のランプブレーキをゼロに設定して、免疫濃縮サンプル中の細胞をペレット化します。スピンが終了したらすぐに、ペレット(見えない場合があります)を乱さないように注意しながら、15 mLチューブに約300 μLの液体を残して、上清を慎重に除去します。
- 上清を別の 15 mL チューブに集めて、細胞がスピン中でペレット化されたことを確認します(再懸濁ペレットの細胞数で検証したら、この画分を廃棄します)。P1000ピペットを使用して細胞ペレットを300μLの容量で再懸濁した後、血球計算盤で細胞をカウントし、総細胞収量を推定します。
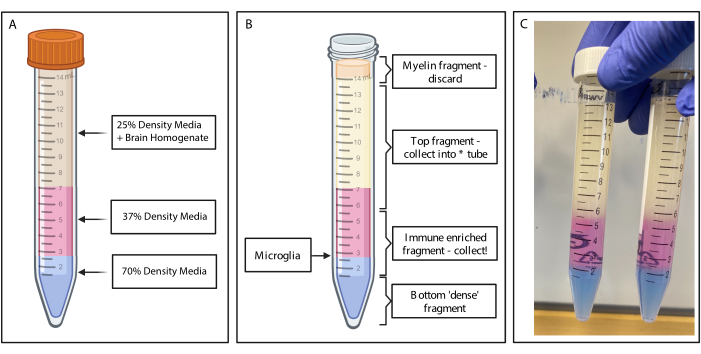
図2:不連続密度勾配による免疫濃縮フラグメントの取得。 (A)脳ホモジネートを25%密度培地に作製し、フェノールレッドを介してピンク色に着色された37%密度培地4mLを下敷きにし、トリパンブルーを介して青色に着色された70%密度培地2mLを下敷きにします。(B)遠心分離後、フラクションが分離した。ミクログリアは、37%および70%密度の培地断片の界面にあります。ミエリン断片は 15 mL チューブの上部にあり、廃棄されます。一番上のフラグメントは、スピンが失敗した場合に備えてバックアップとして収集され、細胞は回収されません。その場合は、この分数を使用して勾配を繰り返すことができます。免疫濃縮画分は下流で回収されます。赤血球を含む下部画分はチューブ内に残り、廃棄されます。(C)完全なレイヤーを描いた図の例。BioRender.com で作成。 この図の拡大版をご覧になるには、ここをクリックしてください。
- 細胞外抗体染色
- ブロッキング:氷上の丸底96ウェルプレートに細胞を移し、ブレーキ付きで500 x g で遠心分離して細胞をペレット化します。プレートをはじいて上澄みを処分し、細胞ペレットをウェルの底にそのまま残して、シンク内の上澄みをすばやく取り除きます。
- P200ピペット(最終濃度10 μg/mL、希釈係数1:50)を用いて、抗マウスCD16/32 FC-Receptorブロッキング試薬を含む50 μLのFACSバッファーに細胞を再懸濁し、単球または他のFcR担持細胞への抗体の非特異的結合を防ぎます。氷上で10分間インキュベートします。
- 抗体染色:P2RY12-アロフィコシアニン(APC;希釈係数1:50、濃度4 μg/mL、最終ウェル濃度1:100、濃度2 μg/mL)およびBiolet 525ライブデッド染色(希釈係数1:50、最終ウェル濃度1:100)を含む2倍マスターミックスを適切な容量で調製します。50 μLの染色マスターミックスを細胞懸濁液(セクション1.5.1でブロッキングした後に得られたもの)に加え、氷上で暗所でプレートを30分間インキュベートします。
注:このプロトコルでは、P2RY12でセルを染色することを提示します。第一に、P2RY12はミクログリアの恒常性マーカーであり、特定の疾患状況でダウンレギュレーションすることができます。例えば、5XFADアルツハイマー病モデルマウスはP2RY12レベルをダウンレギュレートしており、22の同定が困難になる可能性がある。単離に使用できる代替染色剤には、Tmem119、Cd11b、およびCD4523が含まれます。第二に、コンジュゲート蛍光色素APCは、目的の抗体パネルに合わせて調整できます。ただし、APCやPEなどの明るい蛍光色素を選択すると、陽性と陰性の母集団を簡単に区別できるようになります24。 - 染色後、200 μLのFACSバッファーを各ウェルに直接添加して細胞を洗浄します。4°Cで500 x g でスピンし、フリックして上清を除去します。P200ピペットで200 μLのFACSバッファーに細胞を再懸濁し、4°Cで500 x g でスピンし、プレートをフリックしてウェルからバッファーを除去します。
- フローコントロールの準備:染色する前に、ステップ1.5.1でブロッキングした後、必要な量の細胞を各サンプルから分離し、必要なフローコントロールを行います。
注:ゲートを確立するには、各実験にフロー制御が必要です。流量制御は、追加の動物から、または各実験ウェルの一部から採取できます。高い信頼性でゲートを確立するには、コントロールごとに 10,000 から 30,000 個のセルが必要であるため、セルを分割する場合は、コントロールごとに十分なセルを割り当てるようにしてください。- 関連するフローコントロールには、染色なし、生死、P2RY12アイソタイプコントロールの3つがあります。無防汚化のためには、抗体を添加しないでください。P2RY12アイソタイプコントロールでは、細胞を生存色素(1:100)とAPCに結合したアイソタイプコントロール抗体(1:100)で処理します。
- 生デッドコントロールを調製するには、細胞を別のウェルに分注し、細胞容量の半分を 500 μL のチューブに移します。500μLのチューブを-80°Cの冷凍庫に5分間入れた後、37°Cのインキュベーターに5分間入れて細胞を死滅させます。死細胞のアリコートを生デッドコントロールウェルに戻し、バイオレット525(希釈係数1:100)のアミン結合生存率色素で染色して、死細胞をマークします。
注:このプロトコールは、上清除去のためのフリック法によるプレート染色用に書かれています。ただし、これには、スピンが完了した直後に上澄み液を除去する必要があり、フリックは、ペレットを乱すことなく上清をすばやく除去するのに十分な力で行う必要があります。あるいは、1.5 mLのRNAse/DNaseフリーチューブを染色に使用し、以下の変更を加えて染色することもできます。 細胞を1.5 mLの微量遠心チューブに移し、800 x g で4°Cで5分間ペレット化します。 ピペットで上清を吸引します。ヒント:スピードを上げるために、P200チップを備えた5 mLトランスファーピペットを使用すると、上清を迅速かつ正確に吸引できます。吸引するときは、ペレットを確認してください。ペレットが見えない場合は、50 μLの上清を残し、それに応じて計算を調整してください。抗体を洗い流すときは、FACSを追加して抗体の希釈率を上げ(200 μLではなく1000 μL)、上清の不完全な除去を考慮してください。サイトメーターによっては、1.5 mLチューブをソーティングに使用することで、必要な供給量を減らすことができます。
- ミクログリアのFACS選別
- 調製:各ウェルをP200ピペットで200 μLのFACSバッファーに再懸濁し、標識付きフローソートチューブに移し、FACSバッファーを合計500 μLに添加して、1 mLあたり約5 x 105 イベントの濃度にします。分析まで暗所で氷上に保管してください。1.5 mL RNAseフリーチューブに細胞のクッションとして100 μLのFACSバッファーを添加して、ポストソーティングチューブを調製します。
- サイトメーターの設定:100 μmのノズルでセットアップしたフローサイトメトリーセルソーターで細胞をソーティングします。18〜20psiを使用してセルを並べ替えます。
- ゲーティング:サイトメーターでは、サイドスキャッター(SSC)面積と前方散乱(FSC)高さを使用して細胞サイズをゲートし、デブリを区別するために無染色コントロールを使用し、SSC-Aを対数軸上に置いて細胞集団を可視化し、細胞を厳密に選択するようにゲートします(ゲートS1; 図3)。ダブレットを除去するには、FSC-HとFSC-Wをプロットし、細胞集団の周囲に密接なゲートを形成し、破片やダブレットを除去します(ゲートS2)。P2RY12アイソタイプコントロールを使用して、APCチャンネルの細胞を検査し、自家蛍光のゲートを設定してP2RY12+細胞を決定します。無染色および生死コントロールを使用して、525 nm紫色で蛍光を発しない細胞を生細胞としてゲートします。
- ソート:紫色525 nmとAPCをプロットし、P2RY12+でFMO(MG)によって生きている集団を決定します。これらの細胞をラベル付きのポストソートチューブにソートします(図3)。最終的なソート率は、イベント全体の約50%であり、イベント全体の損失の大部分はゲートS1で除去された破片です(~70%のイベントはセルです。 表1)。
- RNAの単離と分析
- 転写および翻訳阻害剤:RNA抽出を計画する場合、関連するトランスクリプトームシグネチャーを単離するリスクを排除するために、翻訳および転写の阻害剤をバッファーステップに含めます。アクチノマイシンD、アニソマイシンおよびトリプトリドを含むMarshらによって記述されたインヒビターカクテルを調製する25。
- 阻害剤の調製:阻害剤ストックを再構成し、以下のように保存します:ジメチルスルホキシド(DMSO)中のアクチノマイシンDを5 mg/mLに再溶解し、-20°Cで保存します。 トリプトリドをDMSOで10 mMに再溶解し、-20°Cで光から保護して保存します。アニソマイシンをDMSOで10 mg/mLに再溶解し、光から保護して4°Cで保存します。すべての阻害剤ストックは、再構成後1か月以内に保管してください。.
- バッファーの修飾: プロトコルの 4 つの異なるバッファーに阻害剤を次のように添加します。 経心灌流を行う場合は、アクチノマイシン D (5 μg/mL、ストックから 1:1000) およびトリプトリド (10 μM、ストックから 1:1000) で HBSS を調製します。灌流後、アクチノマイシンD(5 μg/mL、ストックから1:1000)、トリプトライド(10 μM、ストックから1:1000)、アニソマイシン(27.1 μg/mL、ストックから1:368.5)を含むHBSSで脳をラボに輸送します。アクチノマイシンD(5 μg/mL、ストックから1:1000)、トリプトリド(10 μM、ストックから1:1000)、アニソマイシン(27.1 μg/mL、ストックから1:368.5)でFACSバッファーを調製します。アクチノマイシンD(5 μg/mL、ストックから1:1000)、トリプトリド(10 μM、ストックから1:1000)、アニソマイシン(27.1 μg/mL、ストックから1:368.5)で消化バッファーを調製します。アクチノマイシンD(5 μg/mL、ストックから1:1000)、トリプトリド(10 μM、ストックから1:1000)、アニソマイシン(27.1 μg/mL、ストックから1:368.5)を含むHBSSを使用して、ソート後の洗浄バッファーを調製します。
注意:阻害剤を添加する場合は、使用直前に添加し、調製したバッファーを使用中に光から保護してください。原液の凍結融解は避けてください。
- ソーティング後の洗浄:細胞はFACSバッファー中の1.5 mLのRNaseフリーチューブにソーティングされており、RNAの単離を妨げるため、細胞を洗浄する必要があります。細胞を1000 x g 、4°C、5分間スピンし、上清を除去し、約50 μLの液体を残します。
- アクチノマイシンD(5 μg/mL、ストックから1:1000)、トリプトリド(10 μM、ストックから1:1000)、アニソマイシン(27.1 μg/mL、ストックから1:368.5)を含む1x HBSSを200 μL添加し、完全に混合します。スピンを繰り返し、50 μLの液体を残して上清を除去します(洗浄1)。200 μL のポストソート洗浄バッファーを加え、十分に混合してスピンを繰り返し、上清を除去し、25 μL の液体を残します(洗浄 2)。
- RNA抽出:ミクログリア細胞からのRNA単離には、低インプットRNA単離キットを使用して、RNA収量が高く、RINスコアが9を超えます(推奨製品については、以下および 資料表 を参照)。細胞ペレットに、推奨キット+β-メルカプトエタノール(1:100)の溶解緩衝液350 μLを加え、よく混合します。
注: 必要に応じて、この時点でプロトコルを一時停止できます。サンプルは、RNA抽出まで-80°Cの溶解バッファーに保存できます。保存後にRNAを抽出する場合は、ライセートを氷上で融解し、キット固有の単離手順に進んでください。 - ライセートをカラムベースの細胞シュレッダー(推奨製品については 材料表 を参照)に移し、最高速度で4°Cで2分間遠心分離します。最低14 μLのRNaseフリー水に溶出し、必要に応じて濃度を決定します。RNAは、この時点以降、あらゆるダウンストリームアプリケーションに使用できます。
- 転写および翻訳阻害剤:RNA抽出を計画する場合、関連するトランスクリプトームシグネチャーを単離するリスクを排除するために、翻訳および転写の阻害剤をバッファーステップに含めます。アクチノマイシンD、アニソマイシンおよびトリプトリドを含むMarshらによって記述されたインヒビターカクテルを調製する25。
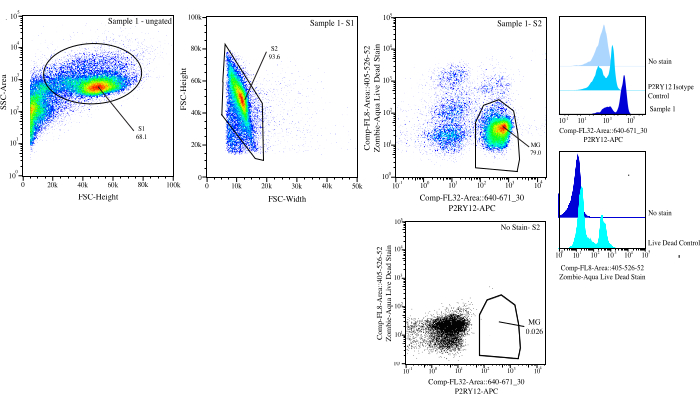
図3:フローソートのゲーティング戦略 イベントは、SSC-A と FSC-H (S1) のセル サイズに対してゲートされます。次に、細胞をFSC-HとFSC-W(S2)で一重項になるようにゲーティングします。一重項細胞は、P2RY12-アイソタイプコントロールを用いて、Comp-FL8-A::405-526-52(バイオレット525生死染色)で陰性の場合は生細胞として、Comp-FL32-A::640-671_30(P2RY12-APC)で陽性の場合はP2RY12+としてソートされます。細胞はMGとして標識され、生細胞とP2RY12+の両方がソートされます。 この図の拡大版をご覧になるには、ここをクリックしてください。
| ゲーテッド・ポピュレーション | 親の頻度 | 合計の頻度 | 数える |
| S1の | 68.10% | 68.10% | 162186 |
| S2>S1の | 93.59% | 63.70% | 151707 |
| P2Ry12+ (670+) > S2 > S1 | 83.05% | 52.90% | 125986 |
| ライブ (525-) > S2 > S1 | 92.78% | 59.10% | 140752 |
| MG(P2RY12+ライブ)>S2>S1 | 78.96% | 50.30% | 119794 |
表1: ゲーティング率と予想されるイベント数を含むサンプル系列テーブルの例。
2. 蛋白質発現解析のための核内流動染色
注:他の細胞タイプはこの時点で開始することができ、このプロトコルはHEK293細胞、BV2ミクログリア様細胞、およびヒトIPSC由来ミクログリアを含む培養細胞でテストされます。
- 細胞の固定と染色
注:以下のプロトコルでは、核染色に最適化された細胞内染色キットを使用してください。見る 材料表 製品の推奨事項について。- セクション1.5.2の細胞外染色した細胞を96ウェルプレート(5 x 104- 1 x 106 細胞)に分注します。細胞を4°C、500 x g で5分間スピンし、フリックしてFACSバッファーを除去します。
注:中央値レベルの信頼度の高いデータを得るには、ウェルあたり最低 10,000 個の細胞を使用する必要があります。推奨される最大値はありませんが、異なる変動係数(CV)による有意な影響がないように、実験全体を通して細胞数を一定に保つのが最善です。 - 固定および透過処理:200 μL の 1x 固定濃縮液を加え、P200 ピペットで穏やかに混合して細胞を再懸濁します。暗所で45〜60分間インキュベートします。 プレートを室温(RT)で500 x g で5分間遠心分離し、フリックして上清を廃棄します。
注: 必要に応じて、この時点でプロトコルを一時停止できます。上清を廃棄した後、免疫細胞の長期保存バッファーに細胞を再懸濁します(推奨製品については 、材料表 を参照)。サンプルは4°Cで12〜18時間保存でき、光から保護され、透明フィルムで覆われて緩衝液の蒸発を保護します。 - 200 μL の 1x 透過処理バッファーを各ウェルに加え、P200 でピペットして混合します。室温で500 x gでプレートを5分間遠心分離し、フリックして上清を廃棄します。透過処理バッファーの洗浄を合計3回繰り返します。
- フローコントロールの準備:必要なフローコントロールのために、各サンプルから細胞の体積を分割します(コントロールウェルあたり10,000〜30,000個の細胞で十分です)。
- 無染色コントロールを調製するには、未染色細胞のソートまたは分注から無染色細胞を、抗体を受け取らない別のウェルに固定します。
- 蛍光マイナス1(FMO)コントロールを調製するには、そのチャンネルの抗体を除くパネル上の各抗体について細胞を分注します。
- 関連するチャネルについては、アイソタイプコントロール抗体をゲーティング用のFMOに含めます。例えば、P2RY12-APCとH3K27Ac-AlexaFluor568を含むパネルでは、(1)H3K27Ac-AlexaFluor568とP2RY12アイソタイプコントロール抗体のみを含むAPC-FMOと、(2)P2RY12-APCとアイソタイプコントロールプライマリーおよび568セカンダリーのみを含む568-FMOの2つのFMOが存在する必要があります。
注:このプロトコールは、単一のHPTMを試験するために提示されていますが、異なる蛍光色素に結合した多数のHPTMを含むパネルを確立することができます。
- 一次抗体染色:適切な濃度の一次抗体を含む 1x 透過化バッファー 50 μL を各ウェルに加えます。暗闇のRTで30分間インキュベートします。200 μL の 1x 透過処理バッファーで 2 回洗浄します。
注:各HPTMに使用した抗体の濃度は、 材料表に記載されています。濃度は、アセチル化マークのHDAC阻害剤など、劇的な増加を引き起こす刺激剤で処理された培養細胞でさまざまな濃度の抗体をテストし、未処理細胞と処理済み細胞の両方が検出範囲内(アイソタイプコントロールを超え、サイトメーターの最大検出範囲未満)に十分収まっていることを確認することによって決定されます。HPTMの最適な抗体濃度は、蛍光色素チャネルの平均蛍光強度の中央値が5 x 104 から1 x 105の間である必要があります。 - 二次抗体染色:200 μL の 1x 透過処理バッファーと 2% 正常ロバ血清(NDS)で 10 分間室温でブロックし、室温で 500 x g で 5 分間回転させ、フリックして上清を除去します。
- 2% NDSと適切な濃度の二次抗体を含む1x透過処理バッファー50 μLを加え、暗所の室温で30分間インキュベートします。200 μL の 1x 透過処理バッファーをウェルに添加して希釈し、プレートを室温で 500 x g で 5 分間遠心分離し、フリックして上清を廃棄します。200 μL の 1x 透過処理バッファーで細胞を 2 回洗浄します。
メモ: 必要に応じて、この時点でプロトコルを一時停止します。P200ピペット(推奨については 材料表 を参照)で免疫細胞用の長期保存バッファー200 μLに細胞を再懸濁し、光から保護して4°Cで12〜24時間保存します。 - フローサイトメトリーの準備:プレートを室温で500 x g で5分間遠心分離し、フリックして上清を廃棄します。フローサイトメトリー用のP200ピペットを使用して、200 μLのFACSバッファーに細胞を再懸濁します。サイトメーターに輸送するための透明フィルムで密封します。
- セクション1.5.2の細胞外染色した細胞を96ウェルプレート(5 x 104- 1 x 106 細胞)に分注します。細胞を4°C、500 x g で5分間スピンし、フリックしてFACSバッファーを除去します。
- フローサイトメトリー
- 提案された抗体パネルを分析するには、サイトメーターにバイオレット(405 nm)、ブルー(488 nm)、イエロー(561 nm)、レッド(633 nm)の少なくとも4つのレーザーが装備されていることを確認してください。サイトメーターには、FITC(青-525 nm)、KRO(紫-525 nm)、PE(黄-585 nm)、APC(赤-660 nm)を検出するためのフィルターが必要です。選択したサイトメーターに応じて抗体を追加します。
- キャリブレーションと標準化:各実験の開始時に、レインボー蛍光ビーズを泳動し、ビーズのピークが以前の実験で実行した目標値に匹敵するまで光電子増倍管(PMT)電圧を調整します。この標準化方法により、時間の経過に伴う機器のドリフトに対応できます。
- 補正:実験用にPMT電圧とゲインを設定した後、抗体捕捉補正ビーズを使用して、抗体パネルの補正マトリックスを確立します。この計算により、蛍光色素が他のチャンネルのシグナル変化に寄与していないことを確認できます。これは、複数の抗体をマルチプレックス化する際にますます必要になります。
- サイズゲーティング:ドットプロットで、SSC-Aを対数にプロットし、FSC-Hを線形にプロットします。デブリをゲートアウトし、S1ゲートを使用してセルサイズを選択します。FSC-WとFSC-Hのドットプロットでシングレットセルを選択し、ゲートをS2として選択します。(図4)。
- 蛍光色素ゲートの確立:各蛍光色素チャンネルに関連する FMO を使用してゲートを確立し、単一パラメーターのヒストグラムを使用して各チャンネルの正のシグナルを決定します(図 4)。
- サンプルの測定:確立されたゲーティング戦略を使用してサンプルを慎重に記録します。P2RY12+シグナルを用いてミクログリアを同定し、ミクログリアのみのそれぞれのチャネルにおけるタンパク質の発現を決定します。
- フローサイトメトリーデータ解析
- 解析ゲートの確立:解析ソフトウェアのユーザーインターフェースでサイトメーターに上記の手順を使用し、解析用の記録に使用したのと同じゲートを使用します。
- フローサイトメトリー解析ソフトウェアを使用してMFI値を取得します(推奨事項については 、資料表 を参照)。 フロー解析のためのサイトメーターゲーティング戦略を要約します。統計の追加機能を使用して、補正されたチャネルの高さで関心のある母集団の中央値(例:568+)を選択します。テーブルエディターを使用して、各チャンネルの蛍光強度(MFI)の中央値をスプレッドシートにエクスポートし、統計解析を進めます(表2)。
注: 補足ファイルS1 には、リポ多糖(LPS)およびリン酸緩衝生理食塩水(PBS)注入マウスのサンプルデータと、ゲーティング戦略とMFI値を含むサンプル分析ファイルが含まれています。 - タンパク質の倍数変化に対するMFI値の分析:MFI値を取得した後、対照または未処理の集団に対するMFIの倍数変化を計算します(式1)。MFIの倍数変化は、タンパク質レベルの倍率の変化を反映しています。倍率変化値を使用して、発現の変化を評価し、t検定または分散分析を使用して統計的有意性を計算します。
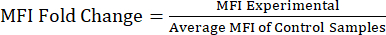 数式 1
数式 1
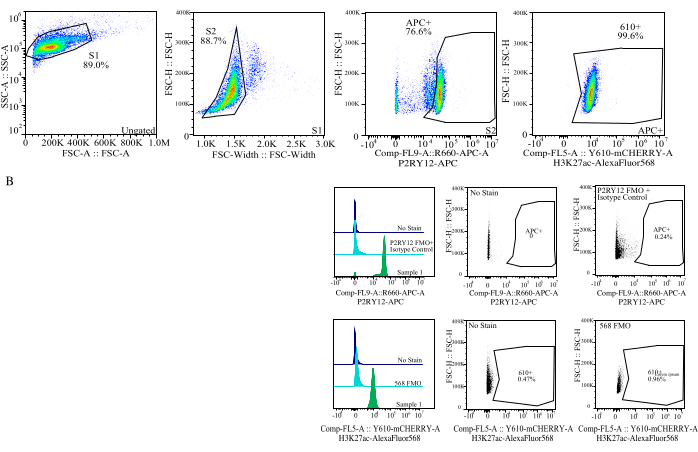
図4:タンパク質MFI評価のためのゲーティング戦略。 イベントは、SSC-A と FSC-H (S1) のセル サイズに対して最初にゲートされます。次に、FSC-H と FSC-W(S2)のシングレットについて、細胞をゲーティングします。次に、一重項細胞は、アイソタイプコントロール抗体を含むAPC-FMOコントロールの蛍光に基づいてゲートが確立されたP2RY12-APCシグナル(APC+)によってミクログリアとして識別されます。次に、細胞はComp-FL5-A::Y610-mCherry上のH3K27Ac-AlexaFluor568シグナルに対してゲーティングされます。610+細胞の蛍光強度は、タンパク質発現のプロキシとして決定されます。 この図の拡大版をご覧になるには、ここをクリックしてください。
代表的な結果
成体マウスを経心灌流し、ミクログリア単離のために犠牲にした。ミクログリアを氷上で単離し、P2RY12-APCおよびバイオレット525生死抗体で染色した。P2RY12が陽性で、バイオレット525の生死染色が陰性と判定された細胞を、生きたミクログリアとして選別した。解剖したマウス脳からのミクログリアの平均収量は、1.28 x 105 ± 0.05(平均±標準誤差(SEM)、N = 100)でした。雌(1.25 x 105 ± 0.09 [平均±SEM、N=46])および雄(1.32 x 105 ± 0.07 [平均±SEM、N=54])マウス(t(98)=0.6365、p=0.526)のミクログリアの収量に差はありません。特定の脳領域から単離した場合、マウス皮質からのミクログリアの平均収量は8.3 x 104 ± 0.08(平均± SEM、N = 15)であり、マウス海馬からのミクログリアの平均収量は4.1 x 104 ± 0.02(平均±SEM、N = 16)です。予想通り、各脳領域からのミクログリアの収量には有意差があります(F(2, 128)=25.25, P<0.0001)。ミクログリア単離後、低インプットRNA単離キットを用いて単離細胞からRNAを抽出した。一貫して RNA 完全性スコア (RIN) は 9.0 (9.62 ± 0.05) を超え、細胞あたりの RNA の平均収量は 0.25 ± 0.01 pg でした (平均 ± SEM、N=32; 補足ファイルS2)。
成体マウスは、犠牲の24時間前に1 mg / kgのリポ多糖(LPS)を腹腔内に注射されました。.マウスにHBSSを経心灌流し、記載されたプロトコルに従って脳全体からミクログリアを単離した(図5A)。各染色について、20,000〜30,000個の細胞を抗体の各パネルに割り当てました。ヒストン3リジン27アセチル化(H3K27Ac)の全体的なレベルを、単離されたミクログリアでフローサイトメトリーによって評価しました。雌雄マウスでは、LPS処理により、雌性でMFIが正常化されると、H3K27Acの増加が誘発された(t(6)=9.676, p<0.0001;図5B)。染色された細胞のヒストグラムを調べると、集団は同様の変動で正規分布したままです。しかし、細胞は蛍光の増加にシフトし、その結果、MFIが増加しました(図5C)。同じ処理でH3K9Acを調べると、H3K9Acも同様に増加しています(t(6)= 7.299、p = 0.0003;図5D,E)しかし、H3K9AcシグナルのPBSに対するLPSの倍率変化はH3K27Acシグナルよりも小さい。
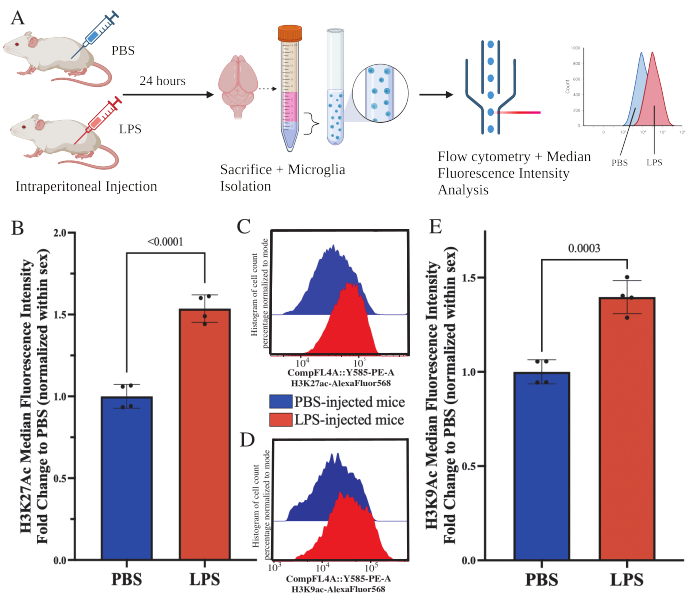
図5:単離されたミクログリアにおけるヒストンのアセチル化の全体的な変化。 (A)マウスは、犠牲の24時間前にリン酸緩衝生理食塩水(PBS)または1 mg / kgのリポ多糖(LPS)を腹腔内に注射されます。ミクログリアは免疫濃縮画分から採取され、フローサイトメトリーおよび全体的なヒストン翻訳後修飾評価のために固定されます。蛍光強度の中央値は、タンパク質発現の代理として評価されます。BioRender.com で作成。(B)H3K27Acの全体的なレベルは、LPS処理に応答して増加しました。PBSへのフォールド変化は、実験とセックスで正規化されています。対応のない両側t検定、t(6)=9.676、p<0.0001。棒グラフはSEM±平均を示しています。 N = 8匹の動物。2 つの独立した実験で条件ごとに 2 つ。(C)H3K27Ac蛍光強度のシフトを示すヒストグラムの例。モーダルは、PBSを注入したマウスとLPSを注入したマウスのヒストグラムを示しています。(D)H3K9Ac蛍光強度のシフトを示すヒストグラムの例。モーダルは、PBSを注入したマウスとLPSを注入したマウスのヒストグラムを示しています。(E)H3K9Acの全体的なレベルは、LPS処理に反応して増加しました。PBSへのフォールド変化は、実験とセックスで正規化されています。対応のない両側 t 検定、t(6)=7.299、p=0.0003。棒グラフはSEM±平均を示しています。 N = 8匹の動物。2 つの独立した実験で条件ごとに 2 つ。 この図の拡大版をご覧になるには、ここをクリックしてください。
記載された方法が、全体的なヒストン修飾定量に以前に使用された他の方法に匹敵することを確認するために、比較ツールとしてイムノブロットを使用することを目指しました。しかし、単離されたミクログリアからの収量は、合理的な評価を可能にするには低すぎます。そこで、培養したBV2細胞を用いて、細胞内フローサイトメトリー法とウェスタンブロット(WB)を比較しました。BV2細胞は、完全培地(DMEMF12、10%FBS、1xペニシリン/ストレプタマイシン、および1xL-グルタミン)で37°C、5%CO2で増殖させました。細胞を0.25%トリプシン-EDTAで継代し、250,000細胞/ウェルの密度で播種し、還元血清培地(DMEM F12、2%FBS、1xペニシリン/ストレプトマイシン、および1xL-グルタミン)で処理し、37°C、5%CO2で12時間回収しました。細胞を25 ng/mL LPSで24時間処理した後、上記のように固定するか、WB溶解緩衝液で溶解しました。H3K27Acの信号は、WBの負荷制御としてGAPDHを用いて、両方の方法で行った。PBSコントロールと比較した正規化蛍光強度の分析を、各グループについて決定しました(図6A)。WBによる正規化H3K27Acシグナルの変化を調べたところ、対応のないt検定(t=3.024、df=5、p=0.0293)で有意と判定されたH2Oコントロールと比較して、LPS処理条件が1.527倍増加しました。フローサイトメトリーを用いて変化を調べたところ、LPS処理条件に1.482倍の増加が見られ、有意であると判断されました(t=7.843、df=10、p<0.0001)。2因子分散分析を使用して方法を比較したところ、治療(F(1,15)=45.21,p<0.0001)の有意な効果があるが、方法(F(1,15)=0.05545、p=0.8697)または交互作用(F(1,15)=0.02785、p=0.8697)には有意な効果がないと判断された。さらに、2 因子 ANOVA では、LPS 処理 (F(1,7)=0.02170,p=0.8870)、方法(F(1,7)=0.01191, p=0.9162) または相互作用 (F(1,7=0.01191, p=0.9162; 図6B)。このデータのブロットとヒストグラムシフトの例も示されています(図6C、D)。
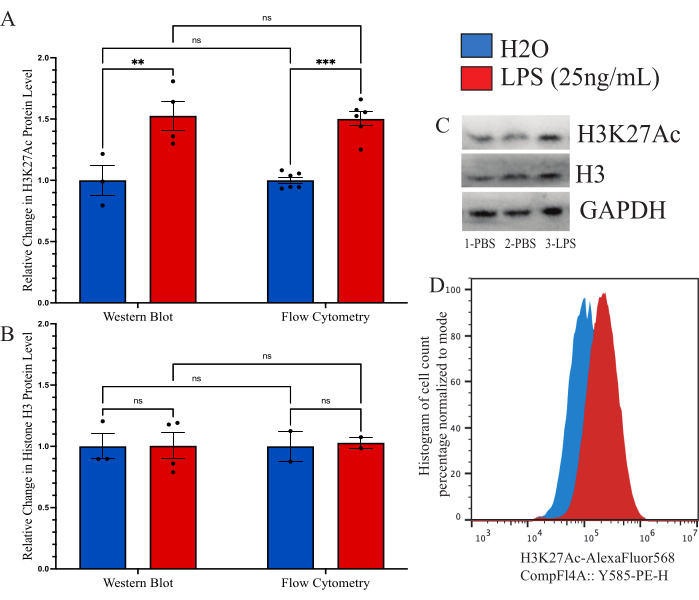
図6:フローサイトメトリーとウェスタンブロットの全体的なヒストン修飾変化を定量化するための分析法の比較。 (A)BV2細胞は、分析前に25 ng/mLのリポ多糖(LPS)またはH2Oで24時間処理されます。H3K27Acの蛍光強度は、フローサイトメトリーとウェスタンブロットの両方で、ビヒクルコントロールであるリン酸緩衝生理食塩水(PBS)の倍数変化として表されます。2因子分散分析では、LPS処理(F(1,15)=45.21、p<0.0001)の有意な効果が示されましたが、方法(F(1,15)=0.05545、p=0.8697)または交互作用(F(1,15)=0.02785、p=0.8697)では有意な効果は示されませんでした。多重仮説検定のテューキーの補正が残差に適用されました。* は 0.0332、** は 0.0021 です。(B)ヒストンH3の蛍光強度は、フローサイトメトリーとウェスタンブロットの両方でPBSに対する倍数変化として表されます。2因子分散分析では、LPS処理(F(1,7)=0.02170、p=0.8870)、方法(F(1,7)=0.01191、p=0.9162)、交互作用(F(1,7=0.01191、p=0.9162)の有意な効果は示されませんでした。(C)ブロットの例と(D)フローサイトメトリーシフトが描かれています。ヒストグラムのサイズは、モード蛍光強度に存在する細胞の数に基づいてパーセントに正規化されます。棒グラフは平均SEMを示しています。 n = 2つの独立した実験、実験ごとに条件ごとに2つ。 この図の拡大版をご覧になるには、ここをクリックしてください。
これらの結果を総合すると、この手法を使用して、単離されたミクログリアの全体的なHPTMレベルを定量的に評価できることが示されました。さらに、この方法は以前の手法に匹敵するが、必要な細胞入力量がはるかに少ないことが示されました。加えて、図示しないが、適切な補償を用いることで、本技術は、異なるHPTMを評価する同じパネル上の複数の抗体と共に用いることができる。
補足ファイル S1: 解析ファイルの例。 このファイルには、wsp解析ファイルと、H3K27Acで染色された無染色、P2RY12FMO、568FMO、2つのPBS処理動物、および2つのLPS処理動物を含む7つのfcsファイルが含まれています。このファイルの目的は、成功した実験がどのように見えるかを描写できる実験の分析とゲーティングを示すことです。 このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル S2: 分離データ。 含まれているファイルには、記載されたプロトコルからのミクログリアとRNA収量を含むミクログリアソート後の関連データが含まれています。 このファイルをダウンロードするには、ここをクリックしてください。
| ゲーテッド・ポピュレーション | 親の頻度 | 合計の頻度 | 数える |
| S1の | 89.00% | 89.00% | 25672 |
| S2>S1の | 88.73% | 78.97% | 22779 |
| APC+ > S2 > S1 | 76.61% | 60.50% | 17452 |
| 610+ > APC+ > S2 > S1 | 99.56% | 60.24% | 17376 |
表2: サンプル系統図の例は、正確なタンパク質検出に必要なパーセンテージとイベント数を示しています。
ディスカッション
提示されたプロトコルは、フローサイトメトリーによる全体的なHPTMレベルの定量的評価を可能にします。このプロトコルは新しい方法を示すが、前の調査は同じようなアプローチ26を使用して蛋白質の量的な査定をした。HPTMの全体的なレベルを評価するために使用された以前の方法には、免疫組織化学およびウェスタンブロット16、17、19、20が含まれます。提示されたフローサイトメトリーベースの方法は、定量化が容易な方法ですが、ウェスタンブロットおよび免疫組織化学は半定量的であり、スループットが低くなります。ウェスタンブロットは細胞溶解に依存しているため、タンパク質の正常化と、実験条件27によって変化しないと想定されるローディングコントロールタンパク質の両方を必要とする。免疫組織化学は半定量的であり、単一細胞レベルで検査せずにタンパク質の量を定量的に評価することは困難であるため、非常に低いスループットです16。同様に、単離されたミクログリアの場合、ウェスタンブロットははるかに多くのタンパク質インプットを必要とするため、収量が限られているため、フローサイトメトリー法を使用することの利点があります19。細胞数が少ないため、同じ動物から複数の染色パネルを実行することができます。
しかし、他の方法と同様に、すべての抗体がフローサイトメトリーでうまく機能するわけではないため、この手法には抗体のコストや入手可能性などの制限があります。さらに、イムノブロットと比較して、必要な抗体の濃度がはるかに高くなります。マルチプレックス化により、同じ細胞パネルに複数の抗体を使用できますが、分析後に細胞から抗体を剥がすことはできないため、細胞の使用は抗体種ごとに1つに制限されます。これは、同じブロットを繰り返し使用できるイムノブロットとは異なります。ただし、抗体の入手可能性とサイトメーターの検出チャネルの数によっては、最大12個のマークを同時に検査することが可能です。
現在の方法では、特定のゲノム位置ではなく、タンパク質発現の全体レベルのみを捕捉しており、グローバルレベルの変化は、個々のゲノム遺伝子座の変化を反映していない可能性があります。同様に、全体レベルで変化が見られないからといって、ゲノム遺伝子座に変化がないというわけではなく、単に全体的な変化の合計が治療間の差がないことを意味するだけである。そのため、この手法は、ゲノム解析に関心のあるHPTMを同定するためのスクリーニングとして使用されることを意図しています。さらに、この方法では、コントロールへの倍数変化として評価される場合を除き、異なるタンパク質マーク間での比較はできません。したがって、これは、タンパク質測定のためのELISAなどの標準曲線ベースの方法と比較して制限されます。
提示されたプロトコルは、生きた脳ミクログリアを分離するための戦略を提供します。このプロトコルは、ミクログリアの単離のためにP2RY12タンパク質の発現に依存しています。しかし、P2RY12はミクログリアの恒常性マーカーであり、5XFAD22などの疾患モデルではダウンレギュレーションされ得る。したがって、疾患モデル動物を使用する場合は、ミクログリアの単離を助けるために、TMEM119、CD11b、またはCD45などの他のマーカータンパク質を必ず選択してください23。同様に、このプロトコルを海馬や皮質からの分離として提示します。このプロトコルは、白質領域を含む他の脳領域からミクログリアを分離するために機能しますが、関心領域のサイズによっては、十分なミクログリアを得るために複数の動物が必要になる場合があります。
提示されたプロトコルは、生きた脳ミクログリアを確実に単離することができますが、単離段階では、誤って実行すると細胞収量を低下させる可能性のあるいくつかのステップがあります。
このプロトコルの灌流は、免疫濃縮フラグメント中のミクログリアの割合が高くなり、ソーターでの時間が短縮されます。ただし、灌流は必要なく、必要に応じて他の安楽死方法を使用できます。
ミクログリアの単離中は、ミエリンを完全に除去する必要があります。フローサイトメーターは、細胞が細いチューブを高速で移動できることに依存しています。ミエリンは粘度が高く凝集しやすいため、サイトメーターに問題を引き起こし、しばしば目詰まりを引き起こし、機器の損傷やサンプルの破壊を引き起こし、収量を大幅に低下させます。下流で問題が発生しないように、免疫が豊富な断片の収集中にすべてのミエリンを除去するように注意してください。
プレート染色とチューブ染色:このプロトコルでは、1.5 mLチューブまたは96ウェルプレートのいずれかで細胞を染色するための2つのオプションについて説明しました。それぞれのユースケースは実験によって異なります。しかし、一般的にチューブ染色は、フリックを誤って行うと細胞が失われるリスクがあるため、プレート染色よりも収量に影響を与えるリスクが低くなります。各チューブの上清を吸引するのに時間がかかるため、プレート染色ははるかに高速です。固定前(選別など)は、収率を最大化し、紛失のリスクを減らすためにチューブ染色を行ってください。しかし、HPTM解析では、細胞を核内染色のために固定すると、ペレットはより安定し、フリックによる損失のリスクが軽減されます。
不連続な密度勾配の確立:層状化を確立する際、免疫濃縮画分を得るためには、層を適切に設定することが不可欠です。層が乱れたり混ざり合ったりして曇っているように見えると、細胞が目的の位置に選別されず、免疫が豊富な細胞画分を得ることが困難になります。これが発生した場合は、密度培地でスピンしてミエリンを除去し、残りの画分全体を回収し、3 mLのFACSバッファーで1 mLの密度培地に希釈し、よく混合します(これには複数のチューブが必要です)。ブレーキを0にして、500 x g で10分間スピンします。上清を廃棄し、~300 μL の溶液のみを残します。サンプル全体と染色剤を採取します。これにより、ソート率が低下し、サイトメーターで費やす時間が長くなりますが、収量は同等です。
単離法を用いる場合、RNAとHPTM評価用の細胞を同じマウス脳から採取できることは有益です。この状況では、生きたミクログリアを選別した後、細胞を分割して、RNA評価に一部(適切なRNA収量を得るための最小入力細胞数は75,000細胞)と、さらなるフローサイトメトリー分析(MFIの良好な決定のためのウェルあたり最小10,000細胞)に割り当てることができます。この場合、フローサイトメーターによるソーティングが必要です。ただし、細胞をHPTM解析にのみ使用する場合は、ソーティングは不要であり、免疫画分をP2RY12抗体およびHPTM抗体で染色できます。その後、フローソーティングの場合と同様に、P2RY12+ミクログリアに対してサイトメーターのゲーティングを設定し、ミクログリア内のHPTMシグナルのみを解析することができます。ソートをなくすことで、プロトコルをより速く、より費用対効果の高いものにすることができます。さらに、培養細胞からHPTMを評価する場合は、染色プロトコルから始めるだけで十分であり、 図6に示すように細胞マーカー抗体は必要ありません。HPTM評価プロトコルは、培養細胞、初代細胞、IPSC由来細胞など、多くの細胞タイプに使用できます。
最後に、ミクログリアの分離下流での用途は2つしか紹介していませんが、ChIP、CUT&Tag、CUT&RUNなどのエピジェネティックな手法など、他にも多くの用途があります。ゲノムエピジェネティック技術の場合、特定の遺伝子座での変化を特徴づけることが関心事であるが、実験に合わせたクロマチンマーク11 のライターおよびイレイザー用の特異的阻害剤を選択し、プロファイリングされたミクログリアエピジェネティック修飾が、酵素消化などの単離手順のどのステップからの技術的アーティファクトでもないことを確認する。定量的フローサイトメトリーなどを用いてエピジェネティックマークの全体レベルの変化を評価する場合、手技によって誘発された変化は、全体レベルで検出されるほど大きくはないと予想されます。
全体として、ここで紹介した方法は、フローサイトメトリーによってヒストン修飾やその他のエピジェネティックな変化の全体的レベルを定量化するための新しいシングルセル法を提供します。この手法は、 in vivoでLPSに応答するミクログリアのエンハンサーマーカーH3K27acの全体的な変化を検出するのに十分な感度があることを実証しました。これは、LPS刺激後のH3K27acの以前のChIPシーケンシングと一致しており、LPS28に反応するエンハンサーの劇的なリモデリングが示されています。この方法の応用により、発生および疾患におけるさまざまな脳細胞タイプにわたる全体的なエピジェネティックな変化を調べることができます。
開示事項
著者は何も開示していません。
謝辞
図5のイムノブロットを手伝ってくれたYanyang Baiに感謝します。この研究は、Canadian Institutes for Health Research [CRC-RS 950-232402 to AC] の支援を受けました。カナダ自然科学工学研究評議会[RGPIN-2019-04450、DGECR-2019-00069からAC];スコティッシュ・ライト・チャリタブル・ファウンデーション[21103からAC]およびブレイン・カナダ・ファウンデーション[AWD-023132からAC];ブリティッシュコロンビア大学アボリジニ大学院フェローシップ(6481からMT);ブリティッシュコロンビア大学院奨学金(6768からMT);Canadian Open Neuroscience Platform Student Scholar Award(10901からJK);ブリティッシュコロンビア大学4年制博士フェローシップ(6569からJK)。資金提供者は、研究デザイン、データ収集と分析、出版の決定、または原稿の準備に関与していませんでした。
資料
| Name | Company | Catalog Number | Comments |
| 0.5M EDTA | Invitrogen | AM9260G | |
| 15 mL Falcon Centrifuge Tubes, Polypropylene, Sterile | Falcon | 352196 | |
| 24-well Clear Not Treated Plates | Costar | 3738 | |
| 2-Mercaptoethanol | Gibco | 21985023 | |
| 96 Well Clear Polystyrene Microplate, clear round bottom, non treated surface | Corning | 3788 | |
| Acetyl Histone 3 K9 (C5B11) | Cell Signalling Technology | 9649S | Dilution: 1:100 |
| Acetyl Histone H4 K8 (2594) | Cell Signalling Technology | 2594S | Dilution: 1:100 |
| Acetyl-Histone H3 K27 (D5E4) | Cell Signalling Technology | 8173S | Dilution: 1:100 |
| Acetyl-Histone H3 Lys27 (MA523516) | Invitrogen | MA523516 | Dilution: 1:100 |
| Actinomycin D | New England Biolabs | 15021S | |
| Anisomycin | New England Biolabs | 2222S | |
| Anti-Histone H3 (tri methyl K4) | Abcam | ab213224 | Dilution: 1:100 |
| Anti-Lactyl-Histone H4 (Lys 12) Rabbit mAb | PTM Biolabs | PTM-1411RM | Dilution: 1:250 |
| Anti-L-Lactyllysine Rabbit pAb | PRM Biolabs | PTM-1401RM | Dilution: 1:250 |
| Apc anti-P2RY12 Antibody, Clone: S16007D | BioLegend | 848006 | |
| BSA | Tocris | 5217 | |
| Cyto-Last Buffer | BioLegend | 422501 | |
| dimethylsulfoxide, sterile | Cell Signalling Technology | 12611S | |
| DNAse I | STEMCELL Technologies | 07900 | |
| Donkey Anti Mouse AlexaFluor488 | Jackson ImmunoResearch | 715-546-150 | Dilution: 1:500 |
| Donkey Anti Rabbit AlexaFluor488 | ABclonal | AS035 | Dilution: 1:500 |
| Donkey Anti Rabbit AlexaFluor568 | Invitrogen | A10042 | Dilution: 1:500 |
| Donkey Anti Rabbit Brilliant Violet 421 | BioLegend | 406410 | Dilution: 1:500 |
| Fisherbrand Disposable Graduated Transfer Pipettes | Fisherbrand | 13-711-9AM | |
| Fisherbrand Disposable PES Filter Unit, 250mL | Fisherbrand | FB12566502 | |
| H3K18ac Polyclonal Antibody | Invitrogen | 720095 | Dilution: 1:100 |
| HBSS (10X), no calcium, no magnesium, no phenol red | Gibco | 14185052 | |
| HBSS, no calcium, no magnesium, no phenol red | Gibco | 14175103 | |
| Histone 3 Trimethyl K27 (ab6002) | Abcam | ab6002 | Dilution: 1:100 |
| KONTES Dounce Tissue Grinders 125mm 7mL | VWR | 885300-0007 | |
| Lactyl-Histone H3 (Lys 18) Rabbit mAb | PTM BIolabs | PTM-1406RM | Dilution: 1:250 |
| Lipopolysacharide | Sigma-Aldrich | L5418 | |
| Normal Donkey Serum | Jackson ImmunoResearch | 017-000-121 | |
| OneComp eBeads Compensation Beads | Invitrogen | 01-1111-41 | |
| PDS Kit, Papain Vial - Worthington Biochemical | Cedarlane | LK003178 | |
| Percoll | Sigma-Aldrich | GE17-0891-02 | |
| Phenol Red | VWR | RC57004 | |
| QIAshredder | Qiagen | 79656 | |
| Rainbow Fluorescent Particles, 1 peak (3.0-3.4 uM - Mid Range Intensity | BioLegend | 422905 | |
| RNase-free Microfuge Tubes, 1.5 mL | Invitrogen | AM12400 | |
| Rneasy Plus Micro Kit | Qiagen | 74034 | |
| Round Bottom Polypropylene Tubes with Caps, 5 mL | Corning | 352063 | |
| Triptolide | New England Biolabs | 97539 | |
| True Nuclear Transcription Factor Buffer Set | BioLegend | 424401 | |
| TruStain FcX PLUS (anti-mouse CD16/32) Antibody | BioLegend | 156604 | |
| Trypan Blue | VWR | 97063-702 | |
| Zombie Aqua Fixable Viability Kit | BioLegend | 423102 |
参考文献
- Miller, J. L., Grant, P. A. The Role of DNA Methylation and Histone Modifications in Transcriptional Regulation in Humans. Epigenetics: Development and Disease. 61, 289-317 (2013).
- Kouzarides, T. Chromatin Modifications and Their Function. Cell. 128 (4), 693-705 (2007).
- Bannister, A. J., Kouzarides, T. Regulation of chromatin by histone modifications. Cell Research. 21 (3), 381-395 (2011).
- Barski, A., et al. High-resolution profiling of histone methylations in the human genome. Cell. 129 (4), 823-837 (2007).
- Vogel Ciernia, A., LaSalle, J. The landscape of DNA methylation amid a perfect storm of autism aetiologies. Nature Reviews. Neuroscience. 17 (7), 411-423 (2016).
- Keiser, A. A., et al. Systemic HDAC3 inhibition ameliorates impairments in synaptic plasticity caused by simulated galactic cosmic radiation exposure in male mice. Neurobiology of Learning and Memory. 178, 107367 (2021).
- McQuown, S. C., et al. HDAC3 is a critical negative regulator of long-term memory formation. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 31 (2), 764-774 (2011).
- Barrett, R. M., et al. Hippocampal Focal Knockout of CBP Affects Specific Histone Modifications, Long-Term Potentiation, and Long-Term Memory. Neuropsychopharmacology. 36 (8), 1545-1556 (2011).
- Datta, M., et al. Histone Deacetylases 1 and 2 Regulate Microglia Function during Development, Homeostasis, and Neurodegeneration in a Context-Dependent Manner. Immunity. 48 (3), 514.e6-529.e6 (2018).
- Belhocine, S., et al. Context-dependent transcriptional regulation of microglial proliferation. Glia. 70 (3), 572-589 (2022).
- Gosselin, D., et al. An environment-dependent transcriptional network specifies human microglia identity. Science (New York, N.Y.). 356 (6344), eaal3222 (2017).
- Kettenmann, H., Hanisch, U. -. K., Noda, M., Verkhratsky, A. Physiology of Microglia. Physiological Reviews. 91 (2), 461-553 (2011).
- Sullivan, O., Ciernia, A. V. Work hard, play hard: how sexually differentiated microglia work to shape social play and reproductive behavior. Frontiers in Behavioral Neuroscience. 16, 989011 (2022).
- Das, P. M., Ramachandran, K., vanWert, J., Singal, R. Chromatin immunoprecipitation assay. BioTechniques. 37 (6), 961-969 (2004).
- Mahmood, T., Yang, P. C. Western blot: technique, theory, and trouble shooting. North American Journal of Medical Sciences. 4 (9), 429-434 (2012).
- Crowe, A., Yue, W. Semi-quantitative Determination of Protein Expression Using Immunohistochemistry Staining and Analysis: An Integrated Protocol. BIO-PROTOCOL. 9 (24), (2019).
- Seligson, D. B., et al. Global histone modification patterns predict risk of prostate cancer recurrence. Nature. 435 (7046), 1262-1266 (2005).
- Liu, B., et al. Global Histone Modification Patterns as Prognostic Markers to Classify Glioma Patients. Cancer Epidemiology, Biomarkers & Prevention. 19 (11), 2888-2896 (2010).
- Pan, R. Y., et al. Positive feedback regulation of microglial glucose metabolism by histone H4 lysine 12 lactylation in Alzheimer's disease. Cell Metabolism. 34 (4), 634.e6-648.e6 (2022).
- Zhang, D., et al. Metabolic regulation of gene expression by histone lactylation. Nature. 574 (7779), 575-580 (2019).
- Pösel, C., Möller, K., Boltze, J., Wagner, D. C., Weise, G. Isolation and Flow Cytometric Analysis of Immune Cells from the Ischemic Mouse Brain. Journal of Visualized Experiments. (108), 53658 (2016).
- Oblak, A. L., et al. Comprehensive Evaluation of the 5XFAD Mouse Model for Preclinical Testing Applications: A MODEL-AD Study. Frontiers in Aging Neuroscience. 13, 713726 (2021).
- Bohlen, C. J., Bennett, F. C., Bennett, M. L. Isolation and Culture of Microglia. Current Protocols in Immunology. 125 (1), e70 (2019).
- McKinnon, K. M. Multiparameter Conventional Flow Cytometry. Flow Cytometry Protocols. 1678, 139-150 (2018).
- Marsh, S. E., et al. Dissection of artifactual and confounding glial signatures by single-cell sequencing of mouse and human brain. Nature Neuroscience. 25 (3), 306-316 (2022).
- Wang, L., Gaigalas, A. K., Marti, G., Abbasi, F., Hoffman, R. A. Toward quantitative fluorescence measurements with multicolor flow cytometry. Cytometry Part A. 73A (4), 279-288 (2008).
- Rumbaugh, G., Miller, C. A. Epigenetic changes in the brain: measuring global histone modifications. Methods in Molecular Biology (Clifton, N.J). 670, 263-274 (2011).
- Xavier, A. M., et al. Systematic delineation of signaling and epigenomic mechanisms underlying microglia inflammatory activity in acute and chronic brain pathologies. BioRvix. , (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
JoVEについて
Copyright © 2023 MyJoVE Corporation. All rights reserved