オルガノイド研究のためのマウス腸陰窩および単一幹細胞からのオルガノイドの3D培養
要約
マウス小腸陰窩を単離し、陰窩から腸3Dオルガノイドを培養するためのプロトコルについて説明します。さらに、上皮下細胞ニッチの非存在下で単一の腸幹細胞からオルガノイドを生成する方法について述べる。
要約
現在、オルガノイド培養は、さまざまな臓器におけるさまざまな生物学的側面や疾患の in vitro 研究のための重要なツールです。マウス小腸陰窩は、3D細胞外マトリックスで培養すると腸上皮を模倣するオルガノイドを形成することができます。オルガノイドは、さまざまな腸の恒常性機能を果たすすべての細胞タイプで構成されています。これらには、パネート細胞、腸内分泌細胞、腸細胞、杯細胞、および房細胞が含まれます。十分に特徴付けられた分子を培養培地に添加して、Gタンパク質共役受容体5を含むロイシンリッチリピートで標識された腸幹細胞(ISC)を濃縮し、特定の系統の分化を促進するために使用されます。これらの分子には、上皮成長因子、ノギン(骨形成タンパク質)、およびR-スポンジン1が含まれます。さらに、単一のエリスロポエチン産生肝細胞受容体B2(EphB2)陽性ISCからオルガノイドを生成するためのプロトコルも詳細に説明されています。この方法の記事では、小腸陰窩と単一のISCを組織から分離し、オルガノイドの効率的な確立を確実にする技術について説明します。
概要
2009年に最初に確立された腸管オルガノイドは、成熟組織との形態学的および機能的類似性から、腸生物学を研究するための強力なin vitroツールとして浮上しています。近年、成体組織幹細胞由来の培養オルガノイドの技術進歩により、自己複製・分化能を有する腸管幹細胞(ISC)の長期培養が可能になってきています。これらのオルガノイドは、胃腸生理学および病態生理学に関する基礎的およびトランスレーショナル研究に広く使用されています1,2,3,4,5,6。Cleversグループによって開発された3Dオルガノイドは、生理学的関連性が改善された腸上皮を研究するための強力なツールを提供します7。腸管オルガノイドは組織幹細胞に由来し、複数の細胞種で構成されているため、腸上皮の機能を要約します。注目すべきことに、シングルソーティングロイシンリッチリピート含有Gタンパク質共役受容体5陽性(Lgr5+)幹細胞は、Paneth細胞や上皮ニッチや間質ニッチ7などのISCニッチなしで3Dオルガノイドを生成することもできます。しかし、シングルソーティングLgr5+細胞のオルガノイド形成能は、クリプト細胞やISC-Paneth細胞ダブレット8と比較して低い。
エチレンジアミン四酢酸(EDTA)インキュベーションまたはコラゲナーゼ解離の方法が上皮の緩みおよび陰窩の放出を引き起こすことを示す研究が増えている。酵素的解離は陰窩の細胞状態に影響を与える可能性があるため、通常、機械的単離法を使用して組織を解離します。機械的消化は迅速な技術ですが、この方法は、一貫性のない陰窩収量または不十分な細胞生存率に関連している可能性があります9。したがって、EDTA処理と機械的解離を組み合わせて、より良いクリプト収率を生成することができます。この記事に示されている方法論の特徴は、EDTAキレート化10後の組織断片の激しい振とうの使用です。激しい振とうにより、小腸の陰窩絨毛複合体から陰窩を効率的に分離することができます。手動振とうの程度によって分離が決まります。したがって、複合体から暗号を取得することは、この分野の実験者にとって重要です。さらに、適切なスキルにより、絨毛の汚染を最小限に抑え、陰窩の数を増やすことができます。
したがって、マウス由来の小腸オルガノイドを使用するこの実験プロトコルは、解離のためにEDTAで処理した後、物理的な力で陰窩をよりよく分離することができます。エリスロポエチン産生肝細胞受容体B2(EphB2)の発現パターンは、陰窩環境を部分的に反映していることが知られている。例えば、EphB2陽性細胞は下から上に11に編成されている。EphB2発現に基づいて蛍光活性化細胞選別(FACS)を行い、得られた細胞をEphB2高、EphB2メッド、EphB2ロー、およびEphB2陰性の4つのグループに分けた。次に、野生型(WT)マウスにおける単一選別EphB2高 細胞からのオルガノイド増殖が実証された。
プロトコル
すべてのマウス実験はサントリー動物倫理委員会(APRV000561)によって承認され、すべての動物は実験動物の管理と使用に関する委員会のガイドラインに従って維持されました。ム スムスクルスの 標準的なWT株(C57BL6 / J)を使用しました。10週齢から20週齢までの雄および雌両方のマウスを使用した。マウスをCO2 窒息で安楽死させた。
1.小腸の分離
- 十二指腸および空腸の近位半分を含む小腸を実験用ハサミで切除する。
- 組織をペトリ皿に移し、5 mLシリンジで5 mLの冷たいPBS-ABx(PBS +ペニシリン-ストレプトマイシン[1%] + ゲンタマイシン[0.5%])で小腸を洗い流して、管腔内容物を取り除きます。
- ティッシュを実験用ハサミで縦に切り開き、振とうしながら冷たいPBS-ABxで手洗いします。
注:スライドで絨毛をこすり落とすことにより、絨毛の汚染を減らすことができます12。 - 実験用ハサミを使用して、約5 mm x 5 mmの腸セグメントの断片を収集します。フラグメントをピンセット付きの50 mLチューブに移し、25 mLのコールドPBS-ABxを加えます。
- 25 mLの冷たいPBS-ABxで10回前後に攪拌して断片を洗浄し、50 mLチューブ内の腸内容物を除去します。
2.クリプト分離
- 2 mM EDTAを含むPBS-ABx中で、振とうせずに氷上で30分間インキュベートします。
- 細胞外マトリックス(ECM)の固化を容易にするために、事前に37°Cの組織培養インキュベーター内で24ウェルプレートをインキュベートします。
- 細胞培養システムからEDTA溶液を真空ポンプで吸引し、25 mLの新鮮で冷たいPBS-ABxを加え、次に手で30x-40xで激しく上下に振って陰窩-絨毛複合体を放出します。
注:分離された陰窩と絨毛は、懸濁液からの25μLの液滴を4倍の倍率で顕微鏡観察することによって確認できます。 - 次に、懸濁液を70μmのストレーナーで1回ろ過します。
- 懸濁液を390 × g で4°Cで3分間遠心分離します。
- クリプトペレットを20 mLのソルビトールDMEM(アドバンストDMEM/F12 + ペニシリン-ストレプトマイシン[1%] + ゲンタマイシン[0.5%] + ウシ胎児血清[1%] + ソルビトール[2%])にピペッティングで再懸濁し、クリプト懸濁液を2つの新しい15 mLチューブに移し、2つの10 mL溶液に分割して低速で遠心分離します。
注:大きな細胞塊と細胞/破片は、低速遠心分離を使用して分離できます。大きな細胞塊はペレットにあり、細胞/破片は上清にあります。 - 2つの陰窩懸濁液を80 × g で4°Cで3分間遠心分離し、上清を穏やかに吸引します。
注意: ペレットの形成が弱いので、あまり誤嚥しないでください。各チューブに2mLの上清を残します。 - 10 mLのソルビトールDMEMを各チューブに再度加えます。懸濁液を80 × g で4°Cで3分間遠心分離します。
- 上清を吸引した後、各チューブに2 mLの上清を残し、再懸濁のために10 mLのソルビトールDMEMを加え、クリプト懸濁液を80 × g で遠心分離し、最後の3分間を4°Cで行います。
- 上清を吸引した後、各チューブに2 mLの上清を残し、10 mLの完全DMEM(アドバンストDMEM/F12 + ペニシリン-ストレプトマイシン[1%] + ゲンタマイシン[0.5%] + ウシ胎児血清[1%])を加えて、上下にピペッティングしてペレットを再懸濁し、1分間放置します。
注:フローティングクリプトを効率的に取得するには、1分間待ちます。 - 1分後、各10 mL懸濁液を合計20 mLに集め、70 μmのセルストレーナーで1回ろ過して陰窩を精製します。
- 基本的に純粋な陰窩を播種する前に、ろ過された完全なDMEM内の陰窩の数を数え、290 × g で4°Cで3分間遠心分離します。
- 25 μLの液滴を6 cmの皿に3点ずつ滴下します。顕微鏡下で4倍の倍率で陰窩の数を数え、25μLの液滴あたりの陰窩の濃度を計算します。
- 1ウェルあたり40 μLのECMで100個の陰窩を吊り下げます。ピペットを上下に5x-10xして、ECM内の陰窩の均質な懸濁液を得てから、37°Cに予熱した24ウェルプレートに播種します。
注意: 重合を避けるために、ECMは常に氷上に置いてください。ECMで気泡が発生しないように慎重にピペットで行います。 - ECMの重合のために、24ウェルプレートを37°C、5%CO2 インキュベーター内で15分間インキュベートします。
- 最後に、ECMをマウス上皮成長因子(EGF)、組換えマウスR-スポンジン1、および組換えマウスNogginを含む500 μLの培養液で室温で覆います。ウェルあたりの材料の最終濃度は次のとおりです:ペニシリン-ストレプトマイシン(1%)、それぞれ50 U / mL;ゲンタマイシン (0.5%), 25 μg/mL;EGF, 20 ng/mL;ノギン、100 ng / mL;R-スポンジン 1, 500 ng/mL;L-グルタミン、2 mM。
- 5%CO2 インキュベーター内で37°Cでクリプト培養を開始します。
注:24ウェルプレート内のオルガノイドの培地については、 表1を参照してください。 - 3時間ごとに20倍の対物レンズを備えた記録タイムラプス画像顕微鏡で、オルガノイドの形態形成を最大7日間観察する長期ライブイメージングを実施します。1 μmのzステップ(1 μm x 5ステップ)で連続Zスタック画像を取得します。
- 一日おきに培地を交換してください。
3. 蛍光活性化セルソーティング(FACS)
- マウスから陰窩を分離します(セクション2を参照)。
- 単離した陰窩を2 mLのトリプシンで37°Cで30分間処理します。
- 10 mLのPBSで反応を停止し、20 μmのセルストレーナーを通過させます。
- 溶液を390 × g で4°Cで3分間遠心分離し、100 μLの完全DMEMで再懸濁します。
- 抗EphB2 APC結合抗体(1/50)を添加し、氷上で30分間インキュベートします。
- 細胞をPBSで3倍洗浄し、最後に7-アミノアクチノマイシンD(7-AAD)(1/100)を加えます。
- 染色された細胞をFACS で ソートします。
- 面積スケーリング係数を調整し、セル サイズ (前方散乱、FSC-A) と粒度 (側方散乱、SSC-A) に従って並べ替えます。
- 7-AAD陰性細胞と陽性細胞を、波長488 nmおよび50 mVパワーに設定したレーザーで生存率について分類します。
- 波長640 nm、出力100 mVに設定されたレーザーを使用して、EphB2高(EphB2高)、EphB2中(EphB2med)、EphB2低(EphB2低)、およびEphB2陰性(EphB2陰性)の細胞を分類するためにゲートを画定します。
- 5%CO2インキュベーター内で37°CでEphB2高細胞培養を開始する。
4. シングルセル培養オルガノイド
- 段階的なEphB2表面レベル11に従って細胞分離法を実行し、4つの異なる集団(高、中、低、および陰性)を取得します。
- 回収し、390 × g で4°Cで3分間遠心分離してペレット化し、ピペッティングによって単一選別されたEphB2ハイ セルをECMに埋め込み、続いて24ウェルプレート(100シングレット/ 40 μLのECM /ウェル)に播種します。
- ステップ2.14と同様に、ECMを重合させ、最初の2日間はRho関連キナーゼ(ROCK)阻害剤(10 μM)を含む培養液でECMを覆い、EphB2高 細胞を維持します。
注:ROCK阻害剤はアノイキスに対して有効です。 - 倒立顕微鏡を使用して40倍の倍率で細胞を手動で検査し、スフェロイド形成と陰窩突起のある生存可能なオルガノイドを観察します。
代表的な結果
マウス小腸オルガノイドを生成するために、EDTA処理と機械的単離法の組み合わせを使用して、陰窩を効率的に単離することができる10,13。この研究の結果は、ほとんどすべての孤立した陰窩がすぐに密封され、上皮ニッチから絞り出された後、円錐形に見えることを示しました(図1A)。絨毛汚染を最小限に抑えるために、得られた懸濁液を70μmの細胞ストレーナーに通し、次いで濾液を遠心分離した。一部のクリプトはろ過および懸濁中に中断されるため、これらの手順は慎重に実行する必要があります。結果は、最終画分のほとんどすべての陰窩が統合され、培養での使用に適していることを示しました(図1B)。すべてのメッキされた陰窩を個別に視覚化するために、ウェルあたり100個の陰窩を播種しました(図1C)。特定の陰窩培養培地(図1D)を添加した後、オルガノイドの発達を顕微鏡で毎日モニターした。さらに、陰窩からのオルガノイドの成長は、それらの発達を監視するためにタイムラプス画像によって観察されました(図1Eおよび補足ビデオS1)。培養された地下室はステレオタイプの方法で行動しました。オルガノイドの内腔は、大量のアポトーシス細胞で満たされていた。ISCの活発な増殖と分化は、出芽を伴う陰窩領域で発生しました(図1Eおよび補足ビデオS1)。出芽は、ISCの遊走および増殖ならびにPaneth細胞分化と結びついた。分化したPaneth細胞は常に出芽部位に位置していた(補足図S1)。オルガノイドは10倍の倍率の倒立顕微鏡を用いて培養中で安定であることが確認されたため、この手法は、発生中の小腸における陰窩形成を調べ、新しい腸上皮細胞を産生するための組織再生能力とISC長期生存能力を決定するために使用できます14,15,16。
Lgr5はISCマーカーとして定義され、マウスLgr5+細胞は3Dオルガノイドを形成します7。しかし、細胞表面ではLGR5タンパク質の存在量が少なく、高親和性抗LGR5抗体が不足しているため、FACSによるマウスISCの効率的な単離は困難である。EphB2は、腸組織からのマウスおよびヒトISCの精製のための表面マーカーとして以前に同定されている17,18。EphB2の発現パターンは、ISCマーカーに関与する複雑さを増大させる。EphB2陽性細胞は増殖区画全体に組織化され、陰窩の下部でピークに達するが、陰窩の上部に向かって勾配で減少する11。パネート細胞および前駆細胞も陰窩に局在する。Paneth細胞は主にその位置決めに必要なEphB3を発現し、陰窩内のそれらの上の前駆細胞は主にEphB2を発現する。したがって、両方の細胞型の汚染は、抗EphB2抗体を用いたISC精製の過程で起こり得る。したがって、それらのマーカー遺伝子発現およびFACSによってEphB2を用いて単離された細胞のオルガノイド形成能を評価するべきである。
これらの事実に基づいて、FACS分析を用いて、EphB2表面標識細胞をWTクリプト19から単離することができる。EphB2の発現が、ISC特異的マーカー遺伝子(Lgr5、Ascl2、およびOlfm4)および前駆細胞特異的マーカー遺伝子(Ki67、Myc、およびFoxM1)などの特異的マーカーの発現を有する4つのグループを区別できるかどうかが研究されている。この実験は、EphB2高細胞がEphB2メッド細胞とは異なり、主にISCであることを示しました20,21。最後に、細胞単離法に基づき、得られた細胞を4つの群(EphB2高細胞、EphB2med細胞、EphB2低細胞、およびEphB2陰性細胞)に分けた(図2)。次に、FACSによってソートされた高レベルのEphB2を発現する単一細胞を、オルガノイド増殖のために培養した。単一のEphB2高細胞を独立して局所治療に適用し、正常な小腸を連想させる自己組織化陰窩絨毛構造を再現することができます(図3)。しかしながら、他の群(EphB2med、EphB2low、およびEphB2neg)に由来する細胞は、オルガノイド20を生成しない。
以前の研究では、シングルソーティングされたLgr5-GFPhi 細胞の~6%が陰窩絨毛オルガノイドを開始することができました7。しかし、残りの細胞はオルガノイドを生成することができず、最初の12時間7以内に死亡した。著者らは、これは隔離手順に内在する物理的および/または生物学的ストレスの結果であると推定しました7。WTマウスにおける単一選別されたEphB2高 細胞からも6%未満のオルガノイド増殖が得られた。培養5日目までに、スフェロイド様構造が形成された(図3)。7日目から9日目にかけて、陰窩を形成するためのスポットの避難が起こりました(図3)。重要なことに、選択されたROCK阻害剤をシングルソーティングEphB2高 細胞に適用することで、解離誘導性アポトーシスが減少し、オルガノイド増殖の効率が向上しました。
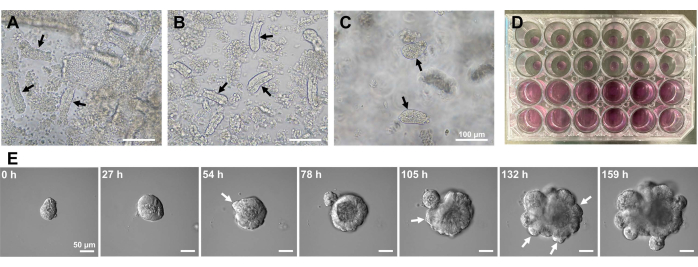
図1:マウス小腸オルガノイドの作製。 (A)EDTAキレート化と機械的解離の組み合わせによって調製された陰窩。(B)得られた精製された陰窩。(C)細胞外マトリックスに埋め込まれた陰窩。(A-C)黒い矢印は地下室を示します。(D)陰窩とオルガノイドの三次元培養。(E)陰窩に由来する成長オルガノイドの代表的な画像。白い矢印は、陰窩の出芽を示しています。スケールバー=(A-C)100μmおよび(E)50μm。 この図の拡大版を表示するには、ここをクリックしてください。
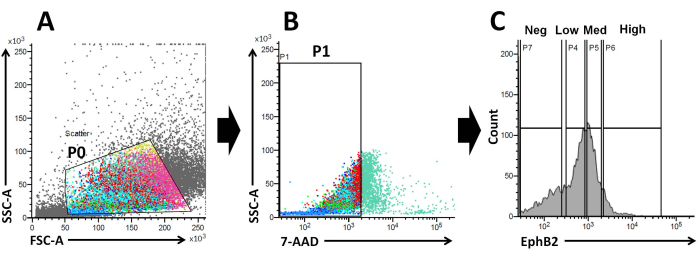
図2:野生型マウスのEphB2陽性(EphB2+)細胞の集団を取得するためのフローサイトメトリーゲーティング戦略 。 (A)前方散布図と側方散布図を使用して、それぞれサイズと粒度に従って細胞を分離します。(B)蛍光散乱は、細胞の7-AAD(PerCP)蛍光強度に従って生細胞を分離するために使用されます。7-AAD陰性細胞集団のゲートを選択した。(C)EphB2高(EphB2高)、EphB2中(EphB2メッド)、EphB2低(EphB2低)、およびEphB2陰性(EphB2陰性)の細胞集団のゲートを選択しました。略語:FSC-A =前方散乱ピーク面積;SSC-A = 側方散乱ピーク面積;7-AAD = 7-アミノアクチノマイシンD. この図の拡大版を表示するには、ここをクリックしてください。
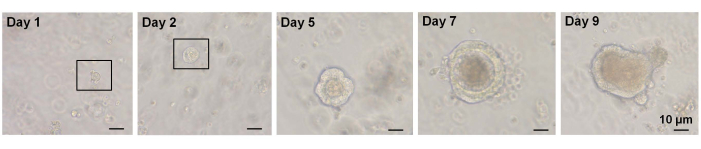
図3:野生型マウスにおける単一選別EphB2高 細胞オルガノイド増殖の経時変化。 この図の拡大版を表示するには、ここをクリックしてください。
表1:24ウェルプレート用培地。この表をダウンロードするには、ここをクリックしてください。
補足ビデオS1:成長するオルガノイドのタイムラプス画像。 スケールバー = 50 μm。 このファイルをダウンロードするには、ここをクリックしてください。
補足図S1:オルガノイドにおける抗リゾチーム抗体染色の代表像。 白い矢印は、パネス セルを示します。略称:DIC = 微分干渉コントラスト顕微鏡。スケールバー = 10 μm. このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
このプロトコルは、小腸陰窩およびその後の3Dオルガノイドの培養を一貫して単離する方法を説明する。陰窩放出率を向上させるために、EDTA処理後に激しく振とうする機械的分離法を確立しました。培地組成は、佐藤らの元のプロトコールとは異なる7。元の培地は比較的高価です。したがって、薬理学的阻害剤、組換え成長因子、および/または馴化培地を含むマウス小腸オルガノイド用の培養培地およびカスタマイズされた培地を 表1に示します。Wnt3Aおよび N-アセチルシステインは、このプロトコルの培地には含まれていません。Paneth細胞がWnt3を発現すると、細胞はWnt3を産生し、ISCの維持をサポートします。さらに、陰窩分離の過程では、調整された媒体は使用されません。オルガノイドモデルは動的であり、細胞的および構造的不均一性を有する(Paneth細胞、腸細胞、杯細胞、腸内分泌細胞、房細胞、およびISC)。したがって、これらのオルガノイドは、オルガノイド生物学の基本的な問題を研究するために大規模に使用することができます。
EphB2勾配は、成体小腸の陰窩-絨毛軸に沿ったISCステム性と増殖を維持します18。単離された陰窩と比較して単一のEphB2細胞からオルガノイドを作製することの利点は、ISCがさまざまなヒト腸疾患において重要な役割を果たすため、マウスISCの生物学を理解することに関連しています。単一のEphB2高発現ISCは、単一のLgr5発現ISCからのオルガノイドの開発と同様の方法でオルガノイドを形成するために培養することができます。最も重要なステップは、FACSを使用して陰窩内のEphB2発現に従って、細胞を4つのグループ(EphB2高、EphB2メッド、EphB2低、およびEphB2陰性)に正確に分割することです。前方散乱対側方散乱(FSC対SSC)プロットは、サイズと粒度に基づいて目的のセルを識別するために一般的に使用されます。FSCはセルサイズを示し、SSCはP0ゲート内のセルの複雑さまたは粒度に関係します(図2A)。この研究では、定義されたゲート(P0)内にある細胞を、その後、生存率について分析しました。次に、それらの生存率は、7-AAD蛍光シグナルの陰性および陽性集団に従って決定された。7-AAD陰性細胞と陽性細胞の境界は、細胞汚染が最小限の陽性で陰性細胞を獲得するように厳密に決定された。EphB2ゲートは、EphB2の段階的表現に基づいて大まかに設定されました。
4つのグループが正確に分割されていることを確認するために、選択された遺伝子のmRNA発現を分析しました。ISCマーカーのmRNAレベルは、EphB2高細胞20において高い。さらに、前駆細胞特異的マーカーのmRNAレベルは、EphB2メッド細胞20において比較的高い。しかし、EphB2低およびEphB2陰性細胞におけるEphB2抑制は、EphB2高およびEphB2メッド細胞20のそれと比較して低いかまたは陰性である。前述の対策は、めっき前にEphB2高細胞集団の濃縮を確実にするために取られるべきである。しかしながら、EphB2高細胞からの6%未満のオルガノイド増殖は、陰窩単離中の激しい振盪ではなく、培養過程中の幹細胞の死によるものかもしれない。選択的Rho関連キナーゼ(ROCK)阻害剤をヒト胚性幹細胞に適用すると、解離誘導性アポトーシスが著しく減少することが示されています22。したがって、技術的な変更として、生存率を改善するために、ROCK阻害剤をより高濃度でより長いインキュベーションで添加することを試みる価値があります。
ISCの隣にあるWnt3A分泌パネスセルは、ISCに不可欠なサポートを提供します8。実際、ISC-Paneth細胞ダブレットは、単一のISCと比較してオルガノイド形成能力が大幅に増加しています8。さらに、培養の最初の3日間に100 ng/mLの濃度でWnt3Aを添加すると、オルガノイド形成能が向上することが示されています8。したがって、別の技術的変化として、外因性のWnt3Aを添加すると、単一のEphB2高発現ISCのオルガノイド形成能力が向上する可能性があります。
in vivoアプローチと比較して、オルガノイドは遺伝子操作、悪性腫瘍表現型の分析、および薬物スクリーニングに容易に使用できます20,23。EDTAキレート化と機械的単離法の組み合わせは、陰窩から小腸オルガノイドを作成するのに効果的で再現性があり、時間効率が高く、高度な経験がなくてもラボスタッフでも簡単に追跡できます。したがって、EDTAによる処理後に激しい振とうを伴う機械的単離を加えることで、マウス小腸オルガノイドをex vivoで効率的に確立し、他の成人上皮組織のオルガノイド培養および疾患モデリングのための潜在的なツールを提供することができます。
腸管上皮細胞は分極され、頂端側が内腔に向けられるように配向している。ただし、3Dオルガノイドの内腔に面する頂端側は内部にあります。したがって、この組織は、上皮細胞に対する栄養素、微生物、代謝物などの管腔成分の影響を研究する際に問題となる頂端側へのアクセスを妨げます。この欠点を回避するために、2D単層としてのオルガノイド細胞の培養が開発された24。将来の応用に関しては、オルガノイド細胞単層の培養は、これが最も効率的で扱いやすいシステムを表すため、利用される予定です。
開示事項
著者は宣言する利益相反はありません。
謝辞
本研究は、科学研究費補助金 基盤研究(C)からT.T.(課題番号JP17K07495、JP20K06751)の支援を受けて行われました。長期タイムラプスイメージング用機器(LCV100;オリンパス)。
資料
| Name | Company | Catalog Number | Comments |
| 1.5 mL Eppendorf tube | Eppendorf | 0030 125.215 | |
| 5 mL syringe | TERUMO | SS-05SZ | |
| 15 mL Falcon tube | Iwaki | 2325-015 | |
| 20 μm cell strainer | Sysmex | 04-004-2325 | |
| 24-well plate | Iwaki | 3820-024 | |
| 50 mL Falcon tube | Iwaki | 2345-050 | |
| 60 mm tissue culture dish | FALCON | 353002 | |
| 70 μm cell strainer | Falcon | 352350 | |
| 100 mm Petri dish | Iwaki | 3020-100 | |
| 7-AAD | BD Biosciences | 559925 | |
| Advanced DMEM/F12 | Gibco | 12634-010 | |
| Alexa Fluor 568 Goat Anti-Mouse IgG (H+L) | Invitrogen | A-11004 | |
| Anti-EphB2 APC-conjugated antibody | BD Biosciences | 564699 | |
| C57BL6/J mice | Japan SLC, Inc. | ||
| Clean bench | HITACHI | CCV-1306E | |
| Confocal laser scanning microscope | Olympus | FV3000 | |
| EDTA (0.5 mol/L) | Nacalai Tesque | 06894-14 | 2 mM |
| FACSMelody | BD Life Sciences-Biosciences | 661762 | |
| Fetal bovine serum | Sigma | 173012 | 1% (v/v) |
| Fiji (software) | https://fiji.sc/ | ||
| Gentamicin (10 mg/mL) | Nacalai Tesque | 16672-04 | 25 μg/mL |
| Hammacher laboratory scissor | SANSYO | 91-1538 | |
| Incubator | Panasonic | MCO-170-PJ | |
| Laboratory tweezer | AS-ONE | 7-164-04 | |
| L-Glutamine 200 mM | Gibco | 25030081 | 2 mM |
| Matrigel | BD Biosciences | 354230 | ECM for 3D organoids |
| Mouse Anti-Human Lysozyme | LSBio | LS-B8704-100 | |
| Murine EGF (20 μg/mL stock solution) | PeproTech | 315-09 | 20 ng/mL |
| PBS 1x | Gibco | 10010-023 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140-122 | 50 U/mL |
| Pipetman (10 μL, 20 μL, 200 μL, and 1,000 μL) | GILSON | 1-6855-12, -13, -15, and -16 | |
| Recombinant murine Noggin (20 μg/mL stock solution | R&D Systems | 1967-NG-025 | 100 ng/mL |
| Recombinant murine R-Spondin 1 (250 μg/mL stock solution) | R&D Systems | 3474-RS-050 | 500 ng/mL |
| Sorbitol | Nacalai Tesque | 32021-95 | 2% (w/v) |
| TE2000-S (inverted microscope) | Nikon | 24131 | |
| Time-lapse image microscope | Olympus | LCV100 | |
| TrypLE Express 1x | Gibco | 12605-010 | |
| ULVAC | ULVAC KIKO Inc. | 100073 | |
| Y-27632 | Fujifilm | 331752-47-7 | 10 μM |
参考文献
- Clevers, H. Modeling development and disease with organoids. Cell. 165 (7), 1586-1597 (2016).
- Seidlitz, T., et al. Human gastric cancer modelling using organoids. Gut. 68 (2), 207-217 (2019).
- Nikolaev, M., et al. Homeostatic mini-intestines through scaffold-guided organoid morphogenesis. Nature. 585 (7826), 574-578 (2020).
- Artegiani, B., Clevers, H. Use and application of 3D-organoid technology. Human Molecular Genetics. 27, R99-R107 (2018).
- Lancaster, M. A., Knoblich, J. A. Organogenesis in a dish: modeling development and disease using organoid technologies. Science. 345 (6194), 1247125 (2014).
- Dedhia, P. H., Bertaux-Skeirik, N., Zavros, Y., Spence, J. R. Organoid models of human gastrointestinal development and disease. Gastroenterology. 150 (5), 1098-1112 (2016).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Paneth cells constitute the niche for Lgr5 stem cells in intestinal crypts. Nature. 469 (7330), 415-418 (2011).
- Aronowitz, J. A., Lockhart, R. A., Hakakian, C. S. Mechanical versus enzymatic isolation of stromal vascular fraction cells from adipose tissue. Springerplus. 4 (1), 713 (2015).
- Takahashi, T. New trends and perspectives in the function of non-neuronal acetylcholine in crypt-villus organoids in mice. Methods in Molecular Biology. 1576, 145-155 (2019).
- Batlle, E., et al. β-catenin and TCF mediate cell positioning in the intestinal epithelium by controlling the expression of EphB/ephrinB. Cell. 111 (2), 251-263 (2002).
- Baghdadi, M. B., Kim, T. -. H. Analysis of mouse intestinal organoid culture with conditioned media isolated from mucosal enteric glial cells. STAR Protocols. 3 (2), 101351 (2022).
- Takahashi, T., et al. Non-neuronal acetylcholine as an endogenous regulator of proliferation and differentiation of Lgr5-positive stem cells in mice. FEBS Journal. 281 (20), 4672-4690 (2014).
- Barker, N. Adult intestinal stem cells: Critical drivers of epithelial homeostasis and regeneration. Nature Reviews Molecular Cell Biology. 15 (1), 19-33 (2014).
- Fordham, R. P., et al. Transplantation of expanded fetal intestinal progenitors contributes to colon regeneration after injury. Cell Stem Cell. 13 (6), 734-744 (2013).
- Miyoshi, H., et al. Wnt5a potentiates TGF-β signaling to promote colonic crypt regeneration after tissue injury. Science. 338 (6103), 108-113 (2012).
- Jung, P., et al. Isolation and in vitro expansion of human colonic stem cells. NatureMedicine. 17 (10), 1225-1227 (2011).
- Merlos-Suárez, A., et al. The intestinal stem cell signature identifies colorectal cancer stem cells and predicts disease relapse. Cell Stem Cell. 8 (5), 511-524 (2011).
- Mao, W., et al. EphB2 as a therapeutic antibody drug target for the treatment of colorectal cancer. Cancer Research. 64 (3), 781-788 (2004).
- Takahashi, T., et al. Muscarinic receptor M3 contributes to intestinal stem cell maintenance via EphB/ephrin-B signaling. Life Science Alliance. 4 (9), e202000962 (2021).
- Jung, P., et al. Isolation of human colon stem cells using surface expression of PTK7. Stem Cell Reports. 5 (6), 979-987 (2015).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
- Schulte, L., Hohwieler, M., Müller, M., Klaus, J. Intestinal organoids as a novel complementary model to dissect inflammatory bowel disease. Stem Cells International. 2019, 8010645 (2019).
- Puzan, M., Hosic, S., Ghio, C., Koppes, A. Enteric nervous system regulation of intestinal stem cell differentiation and epithelial monolayer function. Scientific Reports. 8 (1), 6313 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
JoVEについて
Copyright © 2023 MyJoVE Corporation. All rights reserved