Method Article
ラット腸管オルガノイドの作製と操作
* これらの著者は同等に貢献しました
要約
ここでは、ラット腸管オルガノイドを作製し、いくつかのダウンストリームアプリケーションで使用するためのプロトコルを紹介します。ラットはしばしば好ましい前臨床モデルであり、堅牢な腸オルガノイド系は、in vivo研究に付随するin vitroシステムの必要性を満たします。
要約
オルガノイドを使用して生理機能や細胞の運命決定を評価する場合、 in vivo の状況を厳密に再現するモデルを使用することが重要です。したがって、患者由来オルガノイドは、疾患モデリング、創薬、個別化治療スクリーニングに使用されます。マウス腸オルガノイドは、腸の機能/生理機能と幹細胞の動態/運命決定の両方の側面を理解するために一般的に利用されています。しかし、多くの疾患の文脈では、ラットは疾患の病態生理学の点でヒトとの生理学的類似性が高いため、モデルとしてマウスよりも好まれることがよくあります。ラットモデルは、 in vivoで利用可能な遺伝的ツールが不足しているため限界があり、ラット腸オルガノイドは脆弱で長期培養が困難であることが証明されています。ここでは、十二指腸と空腸からラット腸オルガノイドを確実に生成するために、以前に発表されたプロトコルに基づいて構築します。ラット腸管オルガノイドを利用した機能的膨潤アッセイ、ホールマウント染色、2Dエンテロイド単分子膜の作製、レンチウイルス形質導入など、いくつかのダウンストリームアプリケーションの概要を説明します。ラットオルガノイドモデルは、ヒトとの生理学的関連性を保持し、迅速に遺伝子操作が可能で、ヒト腸オルガノイドの調達に伴う障壁なしに容易に入手できる in vitro モデルに対するフィールドのニーズに対する実用的なソリューションを提供します。
概要
ヒトの小腸上皮構造と細胞組成は複雑であり、その生理学的機能を反映しています。小腸の主な役割は、その内腔を通過する食物から栄養素を吸収することです1。この機能を最大限に引き出すために、腸表面は、吸収表面積を増やす絨毛と呼ばれる指のような突起と、幹細胞を収容して絶縁する陰窩と呼ばれるカップ状の陥入に編成されています。上皮内では、異なる機能を果たすために、さまざまな特殊な吸収性細胞および分泌細胞タイプが生成されます1。この複雑さのため、高継代形質転換不死化細胞株の腸などの組織をモデル化することは困難でした。しかし、幹細胞、特に成体幹細胞とその分化メカニズムの研究により、3D腸管オルガノイド培養の開発が可能になりました。オルガノイドモデルの使用は、無傷の腸に見られるいくつかの構造成分と細胞タイプの不均一性を再現していることもあって、この分野を変革しました。腸管オルガノイドは、活性幹細胞集団の維持により、 in vitro で長期培養することができます2。
腸オルガノイドは、幹細胞生物学、細胞生理学、遺伝病、栄養学を研究するための適応可能なモデル3,4、また新しい薬物送達方法を開発するためのツール5として急速に普及しています。さらに、患者由来オルガノイドは、疾患モデリング、創薬、個別化治療スクリーニングなどに利用されています6,7,8,9。しかし、ヒト腸オルガノイドにはまだ課題があります。組織の入手可能性、治験審査委員会の承認要件、および倫理的問題により、ヒトサンプルの広範な使用が制限されています。さらに、腸陰窩から産生されるヒト腸オルガノイドは、未分化幹細胞の維持、または成熟細胞型の分化誘導のために、2つの異なる培養条件を必要とする10。これは、幹細胞と成熟分化細胞タイプが同時に存在し、継続的に生成/維持されるin vivoとは対照的です1。一方、マウス腸オルガノイドは、成長因子のそれほど複雑でないカクテルで増殖するため、培地組成のこの切り替えを必要とせず、幹細胞と分化細胞を同じ培地コンテキストに維持することができます2,11。しかし、ヒトと比較した場合のマウスの腸管の大きな違いにより、マウスオルガノイドは多くの場合、最適ではないモデルになる可能性があります。全体として、ウマ、ブタ、ヒツジ、ウシ、イヌ、ネコなどの大型哺乳類由来の多くの腸管オルガノイドは、ヒト腸オルガノイドの培養条件よりもマウス腸オルガノイドに近い培養条件で正常に生成されています12。マウスオルガノイドとヒトオルガノイドの成長因子条件の違いは、幹細胞のニッチ組成の違いと、幹細胞の生存、増殖、維持に対する要件の違いを反映している可能性があります。そのため、1)ヒト腸細胞組成によく似ており、2)ヒト腸管オルガノイドのような成長因子を必要とする幹細胞を含み、3)未分化および分化コンパートメントを連続的に維持できる、容易に入手できるモデルオルガノイド系が求められています。理想的には、システムは、in vivo実験とin vitro実験を相関させ、連携して使用できるように、一般的に使用される前臨床動物モデルからのものです。
ラットは、腸の生理学と生化学がヒトと非常によく似ているため、腸の生理学や薬理学の研究に一般的に使用される前臨床モデルであり13、特に腸の透過性に関して14。マウスに比べて比較的大きいため、外科的処置に適しています。ブタを含む大型動物モデルが使用されることもあるが、ラットはより手頃な価格のモデルであり、飼育に必要なスペースが少なく、市販の標準系統が容易に入手できる15。ラットモデルを使用することの欠点は、in vivo研究のための遺伝的ツールキットがマウスと比較して十分に開発されておらず、ノックアウト、ノックイン、トランスジェニックなどの新しいラット系統の作製には法外なコストがかかることが多いことです。頑健なラット腸オルガノイドモデルの開発と最適化により、遺伝子操作、薬理学的治療、およびヒトへの重要な生理学的関連性を保持するアクセス可能なモデルでのハイスループット研究が可能になります。しかし、あるげっ歯類オルガノイドモデルと別のオルガノイドモデルの利点は、研究対象の特定のプロセスや遺伝子に大きく依存します。ヒトに見られる特定の遺伝子は、マウスでは偽遺伝子であるが、ラットでは偽遺伝子ではない可能性がある16,17。さらに、種特異的な細胞サブタイプは、シングルセルRNAseq18,19,20によってますます明らかにされています。最後に、ラットとマウスの腸疾患モデルは、表現型にかなりのばらつきを示すことが多いため21,22、ヒトに見られる症状と疾患プロセスをより厳密に再現するモデルをダウンストリーム作業用に選択する必要があります。ラット腸オルガノイドモデルの作製は、研究者が状況に最も適したモデルシステムを選択する際の柔軟性と選択肢を提供します。ここでは、ラット腸オルガノイドの生成のために既存のプロトコル23,24を拡張し、十二指腸または空腸からのラット腸オルガノイドの生成と維持のためのプロトコルを概説する。さらに、レンチウイルス感染、ホールマウント染色、フォルスコリン膨潤アッセイなど、いくつかのダウンストリームアプリケーションについても説明します。
プロトコル
注:すべての細胞培養は、組織培養フード内で適切な無菌技術を使用して取り扱う必要があります。この研究におけるすべての動物研究は、イェール大学の動物管理委員会(IACUC)によって承認されました。
1. 細胞培養試薬の調製
- R-spondin 1 馴化培地は、製造元の指示に従って調製します。Wnt3aコンディショニングメディアは、製造元の指示に従って準備します。 表 1 の説明に従って AdDMEM+ を準備します。
- ガストリンを滅菌dH2Oに再懸濁し、100μMストックを調製する。分注し、-80°Cで保管します。 N-アセチルシステインを滅菌水に再懸濁し、100 mMストックを調製します。分注し、-20°Cで最大1か月間保管します。
- 組換えヒトノギンをリン酸緩衝生理食塩水(PBS)+0.1%ウシ血清アルブミン(BSA)に再懸濁し、250 μg/mLストックを調製します。分注し、-80°Cで保管します。 組換えマウス上皮成長因子(EGF)をPBS + 0.1% BSAに再懸濁し、100 μg/mLのストックを調製します。分注し、-80°Cで保管します。
- 組換えヒトIGF-1をPBS + 0.1% BSAで希釈し、100 μg/mLのストックを調製します。分注し、-80°Cで保管します。 組換えヒトFGF-2を5 mM Tris(pH 7.6)に再懸濁し、100 μg/mLストックを調製します。分注し、-80°Cで保管します。
注:すべての成長因子について、培地の最終濃度の100倍になるようにPBS + 0.1% BSAで中間希釈液を使用してください。-20°Cで保管してください。
2. ラット小腸オルガノイドの樹立
注:このプロトコルは、ラット腸オルガノイド23,24の以前に公開された2つのプロトコルから変更されました。
- 表2に従ってラット腸管オルガノイド培地(rIOM)を調製し、ウォーターバスを37°Cに設定しました。 この完全な培地は、4°Cで5日間安定です。
- 15 mL のコニカルチューブに PBS 中の 3 mM エチレンジアミン四酢酸(EDTA)10 mL を調製し、氷上に保管します。250 μLの細胞外マトリックス抽出物(EME)を氷上で解凍します。
- ネズミを一晩断食し、自由に水を飲めます。 IACUC承認のプロトコルに従ってラットを安楽死させます。このプロトコルでは、成体の雄のSprague Dawleyラット(体重~200g)をCO2吸入によって安楽死させました(資料表)。頸椎脱臼は、安楽死の二次的な方法として用いられた。
- 解剖には滅菌オートクレーブ滅菌鉗子と解剖ハサミを使用してください。安楽死させたラットを解剖面の腹側を上にして置きます。鉗子で皮膚層をつまみます。次のカットは表面レベルで行う必要があるため、この皮膚層をカットするだけで、内臓を損傷するほど深くはありません。
- 腹腔を開くには、大きくて鋭い解剖ハサミを使用して、腹部の中央にある大きな縦方向の表面レベルの切り込みで皮膚層を切り取ります。次に、そのカットから、両側に1つずつ、2つの短い水平カットを作成します。鉗子を使用して皮膚をはがし、腹腔を露出させます。腹膜を切断して、腹腔内の内臓を完全に露出させ、腸にすぐにアクセスできるようにします。
- はさみと鉗子を使用して、胃の位置を特定し、黄色がかったセグメントとして表示される、約2〜3 cm離れた十二指腸を特定します。近位空腸は、十二指腸と空腸の間のランドマークとして機能するトレイツの靭帯から約4〜5cm遠位に位置しています。
- 単離した腸片を10cmのシャーレに入れます。腸間膜の目的の腸セグメントをできるだけきれいにします。10 mLの氷冷PBSで、管腔内容物がなくなるまで洗い流します。ペーパータオルの上で、腸の部分を~2cmの長さに切ります。各腸片を縦方向に開いて、上皮を露出させます。
- ガラス顕微鏡スライドを使用して、露出した管腔表面をこすり、絨毛を取り除きます。氷上で調製したEDTA溶液に腸片を入れます。10rpmに設定されたチューブリボルバーで4°Cで30分間回転させます。
- 解剖顕微鏡で、円錐形チューブの内容物を10cmのシャーレに注ぎます。さらに~5 mLの氷冷PBSを加えます。
- 細かい鉗子を使用して、腸のセグメントを持ち、激しく振る。PBSへの上皮放出を見ることができます。最初は、PBSには主に絨毛が含まれます。
- シェイクを続けます。絨毛を含むPBSを定期的に廃棄し、10 mLの新鮮な氷冷PBSを腸の断片に加えます。破片を振とうを続け、絨毛がPBSに放出されなくなるまで、この洗浄ステップを繰り返しますが、代わりにPBSには主に陰窩が含まれています。細胞の生存率が損なわれないように、陰窩の単離は15分を超えないようにしてください。
- 残りの腸の断片を捨てます。ペトリ皿に残っているPBSを腸陰窩用に濃縮します。組織培養フードで、PBSを含む陰窩を回収し、70 μmのセルストレーナーでろ過します(材料表)。
- 250 x g で5分間遠心分離します。上清を除去し、ペレットを5 mLのAdDMEM+に再懸濁します。再び250 x g で5分間遠心分離します。
注意: スイングバケットローター付きの遠心分離機を使用することをお勧めします。 - 上清を除去し、ペレットに~50 μLの培地を残します。ペレットを残りの培地に再懸濁し、氷上でEMEのアリコートに加えます。静かに上下にピペットで移動させ、EME全体で陰窩を均等に吊り下げます。気泡の発生は避けてください。
- 50 μL の EME ドームを 35 mm 組織培養皿に播種し、37 °C、5% CO2 組織培養インキュベーターで 20 分間インキュベートします。
- 10 μM Y27632 と 10 μM CHIR99021(表 3)を含む 2 mL の rIOM (表 2) を加えます。継代後、Y27632およびCHIR99021を中止することができます。
- rIOM は 2 日から 3 日ごとに交換します。必要に応じて、オルガノイドの初期数、サイズ、および増殖速度に応じて、通常は3〜7日の間に継代します。
3. 継代ラット腸管オルガノイド
- 250 μL の EME アリコートを氷上で解凍し、rIOM を 37 °C に予熱します。
- オルガノイドを含む35 mmプレートから培地を吸引し、1 mLの解離試薬を添加して、オルガノイドをEMEドームから直ちに放出します。
- 断片化されたオルガノイドを含む解離試薬を直ちに15 mLのコニカルチューブに移します。培養プレートを2 mLのAdDMEM+で洗浄し、断片化されたオルガノイドを含む15 mLのコニカルチューブに加えます。
- ガラス製のパスツールピペットを使用して、15〜20回静かに上下にピペットで移動し、オルガノイドを断片化します。350 x g で2分間遠心分離します。
- コニカルチューブの底部から~50 μLの溶液をEMEに加えます。ピペットで静かに上下に動かして混ぜます。泡を作らないでください。
- 50 μL の EME ドームを 35 mm のディッシュに播種し、37 °C、5% CO2 組織培養インキュベーターで 20 分間インキュベートします。
- 10 μM Y27632 と 10 μM CHIR99021 で 2 mL の rIOM を加えます。成長培地は2〜3日ごとに交換してください。メディアを変更する場合、Y27632 と CHIR99021 は省略できます。
4. ラット腸管オルガノイドの凍結保存と融解
- 凍結保存ラット腸オルガノイド
注:凍結保存プロトコルは、ヒトおよびマウスオルガノイドの以前のプロトコルから変更されました25。凍結前に、オルガノイドは初代培養で少なくとも2つの継代を持っている必要があります。凍結保存の前に、大きなスフェロイドまたはわずかに出芽したオルガノイドまでオルガノイドを増殖させることが、融解後の生存可能なオルガノイドの収量が高くなるため、お勧めします。これは、R-spondin馴化培地を15%に増やすか、オルガノイド培養物に10 mMのニコチンアミド(表3)を添加することで達成できます。- 顕微鏡を使用して、35 mmディッシュ上のオルガノイドの数を数えます。200個のオルガノイドが各クライオバイアルに分注されるようにクライオバイアルを標識します。
- 35 mmディッシュからrIOMを取り外します。2 mLの冷組織培養グレードのPBSと交換してください。
- P1000チップを使用して、培養皿の底部からEMEドームをピペッティングで上下に動かし、PBSに放出します。ピペットで上下に~20回繰り返してEMEを分解し、オルガノイドを放出します。オルガノイドとPBSを15 mLのコニカルチューブに集めます。
- 2 mLの冷たいPBSを培養皿に加え、ピペットで上下させて、残っているオルガノイドをPBSに放出します。PBS を 15 mL コニカルチューブに移します。
- オルガノイドを290 x g で5分間遠心分離してペレット化します。オルガノイドペレットを破壊することなく上清を除去し、廃棄します。
- 5 mLの冷たいAdDMEM+に静かに再懸濁して、ペレットを洗浄します。200 x g で4分間遠心分離します。上澄みを慎重に取り除いて廃棄します。
- オルガノイドペレットをオルガノイド200個あたり1 mLの低温凍結培地に再懸濁します。1 mLのオルガノイドを凍結培地に分注し、標識クライオバイアルごとに分注します。クライオバイアルを冷凍容器に入れます。
- オルガノイドを-80°Cの凍結容器で24時間保存した後、クライオバイアルを液体窒素に移して長期保存します。
- ラット腸管オルガノイドの融解
注:このプロトコルは、ヒトおよびマウスの腸管オルガノイドを融解するための以前のプロトコルから変更されました26。- 250 μL の EME アリコートを氷上で解凍します。15% R-spondin 馴化培地、10 μM Y27632、10 μM CHIR99021を添加した rIOM を調製します。37°Cで温める。
- 室温で2 mLの霜取り培地(表3)を15 mLのコニカルチューブに加えます。
- 液体窒素からオルガノイドのバイアルを取り出し、バイアルを37°Cのウォーターバスに入れ、バイアルがほぼ完全に解凍されるまで解凍します。
- 1 mLの霜取り媒体をバイアルに加え、すべての内容物を霜取り媒体を含む円錐形のチューブに移します。バイアルを1 mLの解凍媒体で2回洗浄し、コニカルチューブに移します。
- 200 x g で5分間遠心分離します。培地を吸引し、オルガノイドとともに~50 μLの培地を残します。オルガノイドを含む培地を250 μLのEMEに移します。
- 気泡を避けながら、ピペッティングで上下させることにより、EMEを介してオルガノイドを均等に分配します。6個の50μLドームを35 mmの組織培養皿にピペットで移します。
- 組織培養インキュベーターで15〜20分間インキュベートして、EMEを重合させます。調製したrIOMを2 mL皿に加えます。
- 2 日後、メディアを rIOM と交換します。Y27632およびCHIR99021の使用を一時停止することができます。オルガノイドの成長は、融解後の最初の継代で遅くなる可能性があります。実験を開始する前に、融解後にオルガノイドを2回継代することをお勧めします。
5. 3Dオルガノイドからのラット腸管2D単分子膜の作製
注:以下のプロトコルは、~300個の腸管オルガノイド/ドームを含む50 μL(35 mmディッシュ)の6つのドームから始めて、EMEでコーティングされた48ウェルプレートの24ウェルを生成するために必要な容量を説明しています(スケール:1つのドームで4つのウェルを生成します)が、必要に応じてスケールアップまたはスケールダウンできます。書かれているように、このプロトコルは4-5日で~80%のコンフルエンスを達成します。コンフルエント度が高くなると、細胞は再び3Dオルガノイド構造を獲得し始めます。低コンフルエンス(≤40%)では、細胞は単層のままで、~14日間生存可能です。研究の目的が 2D 単層を使用することである場合は、1 つのドームで 24 ウェルプレートの 8 つのウェルが生成されるようにスケールダウンします。ウェルをコラーゲンIでコーティングして単層を形成することもできます。
- 塗装面の処理
- プレートをEMEでコーティングするには、EMEを低温AdDMEM+で1:20に希釈します(表1)。コラーゲンでコーティングする場合は、メーカーの指示に従ってコラーゲンIを準備してください。AdDMEM+ で 5 mg/mL のコラーゲン I を 100 μg/mL(この場合は 1:50)に希釈します。
- 200 μLの希釈EMEまたはコラーゲンでプレートをコーティングし、ウェル表面全体を覆います。組織培養インキュベーターで37°Cで1〜2時間インキュベートします。 表4に従って、2D単層培養(rIOM2D)用のラット腸管オルガノイド培地を調製します。
- 単分子膜の生成
- オルガノイドを含む35 mmプレートから培地を吸引します。PBSを1 mL添加します。
- P1000チップで引っ掻いてウェル内のEMEを破壊します。ピペットで上下に約20回動かして、すべてのEMEを緩めます。すべてを15 mLのコニカルチューブに移します。
- 35 mm プレートに 1 mL の PBS を加えて追加のオルガノイドを回収し、同じ 15 mL コニカルチューブに移します。
- 350 x g で 2 分間遠心分離し、EME 残渣を含む上清を吸引します。オルガノイドペレットに1 mLのトリプシン溶液を加え、37°Cで2分間インキュベートします。
- P1000チップを使用して10回ピペットで上下させ、2 mLのAdDMEM+を加えてトリプシンを中和します。
- 350 x g で5分間遠心分離します。上清を吸引し、4.8 mL の rIOM2D を加えます(表 4)。細胞ペレットを再懸濁します。
- オルガノイドを配置する前に、AdDMEM+中の余分なEMEまたはコラーゲンをウェルから取り出します。次に、200 μL のオルガノイドを rIOM2D に添加し、10 μM の Y27632 をプレコートした各ウェルに加えます。
- 4〜16時間後、培地を回収し、1,000 x g で1分間遠心分離します。上清を新しい15 mLコニカルチューブに移し、ペレットを廃棄します。
- 各ウェルを 300 μL の PBS で洗浄し、遠心分離した rIOM2D を各ウェルに 200 μL 添加します。rIOM2D を 2 〜 3 日ごとに変更し、Y27632 の使用を一時停止します。
- 2D単分子膜からの3Dオルガノイドの改質
注:EMEで増殖した単分子膜は3Dオルガノイドを改質するように誘導できますが、コラーゲンIで増殖した単分子膜は3Dオルガノイドに効率的に戻りません。通常、単層から生成されたオルガノイドのウェルを2〜3個使用して、5日目に50μLのEMEのドームを1個作ることができます。- EME を rIOM2D で 1:4 に希釈します。単分子膜のコンフルエントが~80%に達したら、培地を慎重に吸引し、単層を含むウェルに希釈したEMEを100 μL添加します。
- 組織培養インキュベーターで37°C、5%CO2 で20分間インキュベートします。その後、100 μLのrIOM2Dを添加し、組織培養インキュベーターに戻します。3Dオルガノイドは、希釈したEMEを追加してから5日以内に生成されます。
- 小さなオルガノイドが再形成した後(~5日目)、rIOMを調製します。すべてのウェルの内容物を回収し、ピペッティングで上下させてEMEを破壊し、15 mLのコニカルチューブに移します。
- 350 x g で2分間遠心分離します。上清とEME残渣を吸引します。
- 1 mLの冷たいAdDMEM+を加え、350 x g で2分間遠心分離します。上清を除去し、培地を~50 μL残します。
- 培地とオルガノイド 50 μL を 250 μL の EME アリコートに移します。ピペットを上下に動かして、オルガノイドをEME全体に分散させます。
- 50 μL の EME ドームを 35 mm のディッシュにピペットで入れ、組織培養インキュベーターで 20 分間インキュベートします。
- 2 mL の rIOM と 10 μM Y27632 を加えます。成長培地は2〜3日ごとに交換してください。メディアを変更する場合、Y27632 は省略できます。
6.遺伝子操作
- 2D単分子膜の一過性トランスフェクション
注意:セクション5.1に従って、ラット腸上皮単層を48ウェルプレートに調製します。トランスフェクションは、70%〜80%のコンフルエントで実施する必要があります。トランスフェクションを行う前に、必ずウェル内の培地を 200 μL の新鮮な rIOM2D と交換してください。プラスミドDNAの260/280nmおよび260/230nmの吸光度比を計算します。良好なトランスフェクション結果を得るためには、これらを1.8以上にする必要があります。
注:プラスミドコントロールを使用して、トランスフェクションの効率を計算します。蛍光タンパク質をコードするプラスミドは、簡便にするために推奨されます。このプロトコルでは、pLJM1-EGFP27 が使用されました。- 1 mg/mL の 20 kDa ポリエチレンイミン(PEI; 表3)。各ウェルについて、チューブA(プラスミド0.6 μg+還元血清培地50 μL)およびチューブB(PEI1.8 μL+還元血清培地50 μL)を調製します。DNA:PEI比を1:3に維持します。
- 両方のチューブを30秒間ボルテックスします。チューブAとチューブBを組み合わせ、再び30秒間ボルテックスします。必要に応じて、遠心分離機を使用してスピンダウンします。室温で20分間インキュベートします。
- DNA/PEI複合体を2D単分子膜に滴下して静かに添加します。プレートを静かに渦巻かせて混ぜます。37°C、5%CO2でインキュベートします。この発現は通常、24時間後に検出できます。
注:3Dオルガノイド構造に戻す必要がある場合は、トランスフェクション後48時間待ってから希釈したEMEを添加してください。
- ラット腸管オルガノイドのレンチウイルス形質導入
注意: レンチウイルスを使用する前に、教育機関から適切な承認と専門的なトレーニングを受けてください。レンチウイルスを取り扱うときは、常に適切な個人用保護具(PPE)を着用してください。ここでは説明しませんが、オルガノイドの感染を成功させるには、高品質で濃縮されたレンチウイルスが不可欠です。このプロトコルは、空のpLJM1-EGFPベクターを利用しました27 可溶性GFPを発現する。このプロトコルは、以前に公開されたプロトコルから変更されています28.形質導入効率は、ウイルス粒子の品質と濃度、オルガノイドの小細胞クラスターへの効率的な解離、および発現する遺伝子に依存します。感染後5日で計算すると、選択前の平均形質導入効率は19.4%(±標準偏差6.5%)でした。- レンチウイルス感染の 2 日前に、形質導入されるレンチウイルスごとに 24 ウェルプレートの 2 つの高密度ウェルを継代 (セクション 3) することを計画します。24ウェルプレートの各ウェルは、EMEの50 μLドームを1つ収容できます。
- EMEが固まったら、0.5 mLのrIOMを添加し、10 mMのニコチンアミド、10 μMのY27632、および2.5 μMのCHIR99021を添加します。これにより、大きなスフェロイド形態が誘導され、レンチウイルス形質導入の効率に有利になります。プレーティング後2日以内に、ラットオルガノイドは大きなスフェロイドになります。有意な分化(すなわち、出芽)が観察された場合は、オルガノイドを再継代します。
- 濃縮されたウイルスを氷上で解凍します。 表3に従って、新鮮な形質導入培地を調製します。
- P1000チップを使用して、ピペッティングで上下に動かし、細胞培養皿の底部からEMEドームを培地に放出します。ピペットで上下に20回続けてEMEを分解し、オルガノイドを放出します。
- オルガノイドと培地を15 mLのコニカルチューブにピペットで移します。オルガノイドが同じ遺伝子型を持ち、同じ系統に由来する場合、すべてのウェルを一緒にプールすることができます。
- 各ウェルを1 mLの冷たいAdDMEM+で2回洗浄します。AdDMEM+ を回収し、同じ 15 mL コニカルチューブに移します。
- ガラス製のパスツールピペットを使用して、ラットオルガノイドを機械的に破壊します。これは、細胞の小さな多細胞クラスターを目的としているため、重要なステップです。ピペットで上下に~30回。4倍の対物レンズを使用して、顕微鏡下で破壊の効率を確認します。細胞懸濁液が主に細胞クラスターで構成され、オルガノイドがほとんど残っていないまで、このプロセスを続けます。
注:あるいは、オルガノイドを室温で 200 x g で 5 分間遠心分離し、上清を慎重に除去し、組織培養インキュベーターで 37 °C に予熱した従来のトリプシン/EDTA に代わる 1 mL の組換え酵素に再懸濁することもできます。オルガノイドをトリプシン置換液中で37°Cのウォーターバス中で2分間インキュベートし、定期的にボルテックスして解離を促進します。トリプシン置換による長時間のインキュベーションは、細胞死を促進する可能性があるため、避けてください。4倍の対物レンズを使用して、顕微鏡下で破壊の効率を定期的にチェックします。懸濁液が主に単一細胞で構成されており、細胞培養回数が少ない場合は、4 mLのAdDMEM+を添加してトリプシン置換を希釈し、次の手順に進みます。 - 細胞クラスターを含む 15 mL のコニカルチューブを 200 x g で 4 °C で 5 分間回転させます。 細胞ペレットを乱さないように注意しながら、上清を慎重に取り除いて廃棄します。
- 細胞クラスターをウェルあたり230 μLの形質導入培地に再懸濁し、感染させます。感染には、レンチウイルスごとに48ウェルプレートのウェルを1つ使用します。
- 230 μL の細胞懸濁液を標識 48 ウェルプレートの各ウェルにプレーティングします。各ウェルに20μLの濃縮ウイルスを加えます。P1000チップを使用して、各ウェルでウイルス/細胞溶液を混合し、プレートを透明フィルムで密封します。
- 脊椎置換を行う:プレートを600 x g で32°Cで1時間遠心分離します。 プレートを開封し、37°C、5% CO2 で6時間インキュベートします。
- 24ウェルプレートを37°Cのインキュベーターで予熱します。
- インキュベーション後、各ウェルを上下にピペットで移し、内容物をラベル付きの1.5 mLチューブに移します。各ウェルを750 μLのAdDMEM+で洗浄し、チューブに移します。チューブを600 x g で4°Cで5分間回転させます。
- 遠心分離機からチューブを取り出し、氷上に保管します。P1000チップを使用して、上清を慎重に取り除き、適切に廃棄します。
- 細胞ペレットをEMEに再懸濁し、予熱した24ウェルプレートに50 μLのドームを播種します。EMEが重合するまで37°Cで15〜20分間インキュベートします。
- 各ウェルに、10 mM ニコチンアミド、10 μM Y27632、2.5 μM CHIR99021を添加した 500 μL の rIOM を加えます。
- 感染の1日後に培地をrIOMプラス10μM Y27632と交換します。2〜3日ごとにメディアを交換してください。選択が行われる場合は、感染後48〜72時間で選択を追加します。.ピューロマイシンの選択には、2 μg/mL のピューロマイシンを使用します。
7. オルガノイドの免疫蛍光全マウント染色
- 培地を吸引し、PBS-Tween 20(PBS-T)中の4%パラホルムアルデヒド(PFA)(表3)を細胞培養皿内のオルガノイドに添加します。室温で10分間インキュベートします。
- ピペッティングで上下に動かして、オルガノイドをEMEから放出します。オルガノイドを0.75 mLチューブに集めます。オルガノイドは、数分以内に重力によってチューブの底に沈殿します。必要に応じて、100 x g で1分間遠心分離します。
- トランスファーピペットを使用してPFAを除去し、オルガノイドをPBS-Tに再懸濁します。オルガノイドをチューブの底に沈殿させます。PBS-Tを除去し、200 μLのブロック溶液に再懸濁します(表3)。
- ロッカーまたはダイテーターで室温で45分間インキュベートします。オルガノイドは凝集してチューブの底に沈殿することがあります。定期的にチューブを指でフリックして再懸濁し、溶液全体に分散させます。
- オルガノイドをチューブの底に沈殿させます。必要に応じて、100 x g で1分間遠心分離します。ブロック溶液を除去します。
- 100 μLのブロック溶液で希釈した一次抗体を添加します。ナテーティングミキサーで室温で24rpmで45分間インキュベートします。抗体濃度は、使用する抗体によって異なります。
注:このステップは、一次抗体に基づいて、4°Cで一晩まで延長できます。 - オルガノイドをチューブの底に沈殿させます。必要に応じて、100 x g で1分間遠心分離します。
- トランスファーピペットを使用してPBS-Tで5回洗浄します。24rpmのニューテーティングミキサーで室温で5分間インキュベートします。この手順を 2 回繰り返します。
- 1:200に希釈した二次抗体と、100 μLのブロック溶液で希釈した4',6-ジアミジノ-2-フェニルインドール(DAPI)50 μg/mLを加えます。ナテーティングミキサーで室温で24rpmで30分間インキュベートします。
- オルガノイドをチューブの底に沈殿させます。必要に応じて、100 x g で1分間遠心分離します。二次抗体を除去します。トランスファーピペットを使用してPBS-Tで5回洗浄します。
- 室温で24rpmのニューテーティングミキサーで5分間インキュベートします。洗浄手順を2回繰り返します。
- オルガノイドを洗浄している間に、VALAPシーラント(表3)のアリコートを40〜50°Cで加熱して液化します。絵筆を使って、カバーガラスほどの大きさの顕微鏡スライドにVALAPの薄い正方形を描きます。22 mm x 22 mm の No. 1.5 カバーガラスを使用します。
- ハサミを使用して、P200ピペットチップの端を切ります。オルガノイドをスライド上のVALAPウェルに移します。ティッシュワイプを使用して、PBS-Tを慎重に吸い取ります。オルガノイドを乾燥させないでください。
- VALAP ウェルに褪色防止用封入剤を浸水させます(表 3)。~22 mm x 22 mmの正方形の場合、これには100〜150 μLの褪色防止剤が必要です。
- オルガノイドはクラスター化することができます。必要に応じて、ピペットチップで褪色防止剤を渦巻き、オルガノイドを再分配します。22 mm x 22 mm No. 1.5カバーガラスで取り付け、気泡を避けます。VALAPの薄層を端に塗ってカバーガラスを密封します。
注:倒立顕微鏡の場合、オルガノイドは35 mmのガラス底ディッシュに取り付けることもできます。
8. フォルスコリンによるラット腸管オルガノイドの腫脹
- rIOMで継代した後、3〜5日間オルガノイドを増殖させます。オルガノイドは24ウェルプレートで増殖させ、同じ領域を簡単に再イメージングできるようにすることをお勧めします。フォルスコリン(T0)を添加する前の画像をキャプチャします。
- フォルスコリン(表3)をオルガノイド培地に直接添加し、最終濃度を10 μMにします。 同量のジメチルスルホキシド(DMSO)をコントロールウェルに添加します。
- コントロールウェルとフォルスコリン処理ウェルを15〜30分ごとに定期的に画像化します。イメージングを行わないときは、オルガノイドをインキュベーターに保管するか、インキュベーションで制御されたイメージングシステムを使用してください。最大腫れは120分で観察する必要があります。.
- 標準的なプロトコルに従って、取得した画像から相対的な腫れを計算します29。
結果
ラット十二指腸オルガノイドおよび空腸オルガノイドは、セクション2で概説したプロトコルを用いて作製した。陰窩の分離段階では、絨毛がPBSから効率的に枯渇することが非常に重要です。EMEに陰窩で埋め込まれた絨毛が多すぎると、培養全体が死に、オルガノイド系統の確立に失敗する可能性があります。このため、解剖スコープで陰窩を分離することは有用であり、ヴィラールの枯渇を視覚的に確認することができます。 図1 は、代表的なヴィラールの破片と陰窩を示しています(図1A)。絨毛と比較して陰窩のサイズが大幅に小さいことに注意してください(図1B)。メッキ後、陰窩は今後数日間で回転楕円体に拡大し、4〜7日目までに発芽して分化し始めます(図2)。オルガノイドが広範囲に発芽した段階に達したら、継代する必要があります。継代中は、オルガノイド数を拡大できるように、陰窩芽を分裂させるのに十分なほどオルガノイドを破壊することが重要です(図3B)。
凍結後のオルガノイドの回収が成功するかどうかは、オルガノイドが凍結された状態に大きく依存します。高度に増殖する未分化状態のオルガノイドは、最高の効率で回収します。したがって、出芽して分化するのではなく、球状で嚢胞性になるように誘導することをお勧めします。これを達成するために、培地中のWntリガンドR-スポンジンの量を増やし、培地にニコチンアミドを含めることによって、Wntを過剰に活性化することができ、これはいくつかの培養系においてオルガノイド形成と細胞生存をサポートすることが示されている30,31。図3Aは、融解後わずか2日後の健康なオルガノイド培養を示しています。また、BSAを融解中に培地に含ませることは、マウスの腸管オルガノイドよりもデリケートであることが証明されているラットの腸管オルガノイド培養の生存にも役立ちました。
3Dオルガノイド培養は、正常な腸管構造の一部を再現するため好まれることが多いですが、ライブイメージング、トランスフェクション、レンチウイルス形質導入など、他のアプローチは技術的に困難になります。3Dオルガノイド32 (図4)から生成された2D単分子膜の使用により、プラスミドの導入効率を高めることができます。3D腸オルガノイドは従来、一過性のトランスフェクションに耐性がありますが、EGFPをコードするプラスミドは、脂質ベースのトランスフェクション法を用いて導入することができます。PEIを使用した最も費用対効果の高いアプローチは、ステップ6.1(図5)に概説されていますが、エレクトロポレーションおよび市販のトランスフェクション試薬でも同等の結果が得られています(データは示していません)。今後の研究では、これらのアプローチがCRISPRコンストラクトを単層に導入するために使用できるかどうかに焦点が当てられます。
トランスフェクション後に2D単層から3Dオルガノイドを改質し、陰窩の3D構造コンポーネントとの通過可能なラインとして維持できることが重要でした。興味深いことに、EMEに播種された2次元単分子膜は、EMEを細胞の上部に戻すと容易に小さなスフェロイドに再形成されましたが、コラーゲンI基質は3次元構造の再形成には不十分でした(図6)。
一過性トランスフェクションは多くの研究に有用ですが、レンチウイルスを細胞に導入する必要があるため、安定な系統の形成がより有用であることがよくあります。ラット腸オルガノイドは、以前に発表されたプロトコルを変更することによりレンチウイルスに感染しました(図7)。プロトコルの重要なステップは、オルガノイドを小さな凝集体または細胞クラスターに破壊することです。培養物が効率的に破壊されず、オルガノイドが無傷のままであれば、レンチウイルス粒子は細胞内に侵入しません。感染後、オルガノイドは回復し、再増殖しなければなりません。ここで概説されているプロトコルでは、選択前に細胞の10%〜48%(平均:19.4%±6.5%)によるウイルス粒子の通風管が可能です。
オルガノイドのホールマウント染色は、EME残基の除去が不完全であったり、抗体の浸透度が不完全であったりすると、困難になることがあります。ここで概説したプロトコールでは、オルガノイドの堅牢な染色が可能です。また、共焦点顕微鏡でのオルガノイドの可視化は、カバーガラスから離れすぎていると困難になることがあります。VALAPを使用することで、オルガノイドがカバーガラスによって押しつぶされるのではなく、イメージングを容易にするためにカバーガラスの近くに沈殿するように、ある程度の高さのウェルが作成されます。アピカルアニオンチャネル嚢胞性線維症膜貫通コンダクタンスレギュレーター(CFTR)およびファロイジンに対する標識F-アクチンに対する代表的な染色を 図8に示します。
最後に、オルガノイドは機能アッセイにおいて有用です。嚢胞性線維症患者由来の患者由来オルガノイドは、cAMPアゴニストのフォルスコリンによる治療が強力なCFTR媒介性体液分泌を誘発し、オルガノイドの腫脹を引き起こすため、CFTR機能のスクリーニングに使用されています29,33-37。この研究の目標の1つは、in vivoの前臨床試験と並行して使用できるオルガノイドモデルを特定して開発することでした。そこで、ラットの腸管オルガノイドがフォルスコリン誘発性腫脹を起こすかどうかを調べることを目指しました。実際、フォルスコリン処理の30分以内にラットオルガノイドは膨潤し、120分で最大の効果が観察されました(図9)。
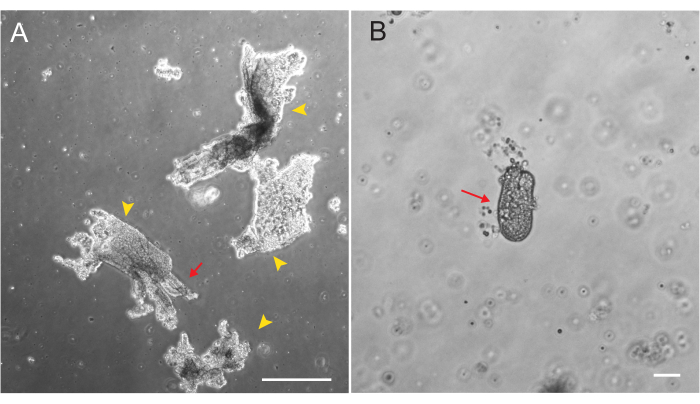
図1:上皮単離中のVillar断片と 陰窩。 (A)陰窩分離プロトコル中のEDTA溶液中のビラール断片の代表的な画像。黄色の矢印はヴィラールの破片を示しています。赤い矢印は、ヴィラールの破片に取り付けられた地下室を描いています。相対的なサイズの違いに注意してください。(B)形態を可視化するための単一陰窩(赤矢印)の高倍率画像。スケールバー:100 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。
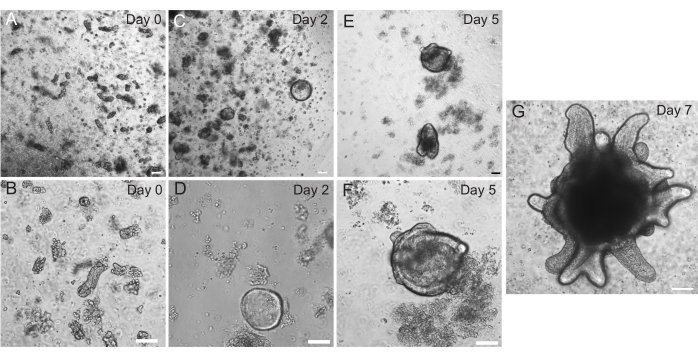
図2:ラットの腸管オルガノイドの進行。 ラット空腸陰窩は、単離直後にEMEでメッキされました(A、B)。2日以内に、地下室は回転楕円体(C、D)になりました。5日目までに、彼らは陰窩の芽(E、F)を開始し始め、それは7日目(G)までに精緻化され、成長しました。スケールバー:100 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。
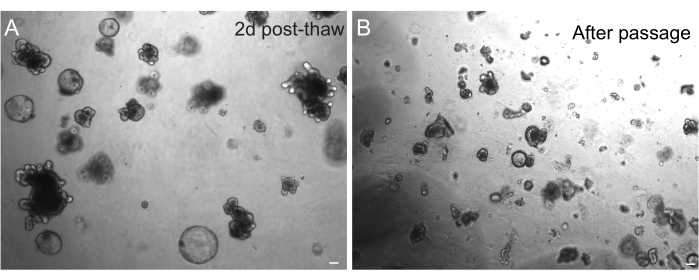
図3:融解および継代後のオルガノイド。 (A)ラット空腸オルガノイドは、凍結保存後に概説されたプロトコルに従って融解した。融解後わずか2日でスフェロイドと出芽オルガノイドの両方が存在することに注意してください。(B)概説されたプロトコルに従った継代直後のAに示されているのと同じオルガノイド株。AとBの構造の相対的なサイズの違いと、Bの単一のクリプト様ドメインの存在に注目してください。スケールバー:100 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。
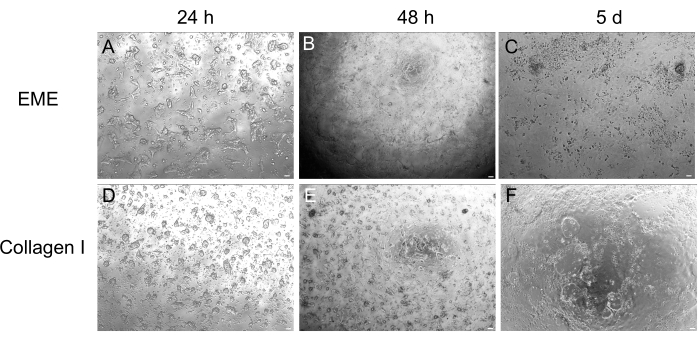
図4:3Dオルガノイドからの2D単分子膜形成。 (A-C) EMEにおける2D単分子膜の進行。(D-F)コラーゲンIの2D単分子膜の進行。5日目までに、各条件は~80%のコンフルエントさをもたらしました。スケールバー:100 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。
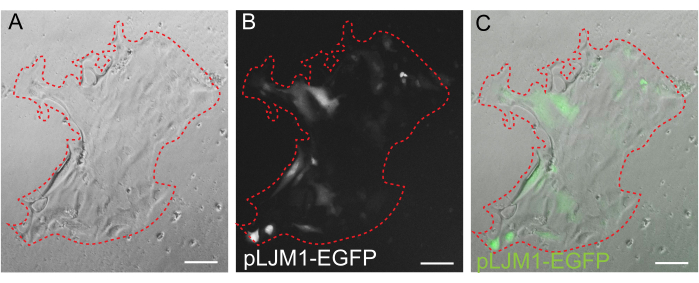
図5:2D単分子膜の一過性トランスフェクション。 PEIを用いてpLJM1-EGFPプラスミドを一過性にトランスフェクションしたEME上に成長した2D単分子膜の代表的な画像。(A)明視野、(B)蛍光(GFP)、(C)オーバーレイ。赤い点線は単層の境界を示しています。スケールバー:100 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。
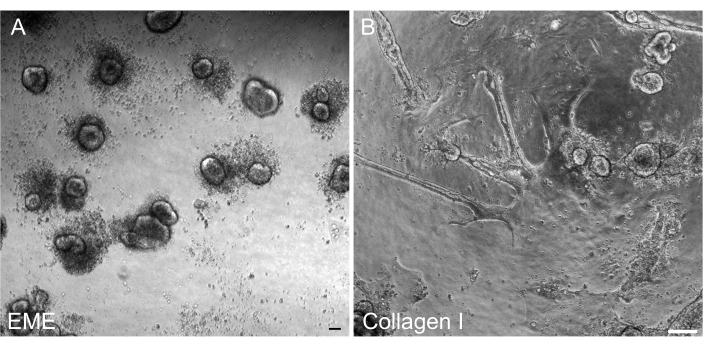
図6:EME上の2D単分子膜からの3Dオルガノイドの再形成 。 (A)EMEで成長した2D単分子膜からの3Dオルガノイドの形成。オルガノイドは、単分子膜の頂端表面にEMEを添加してから5日後に効率的に形成されます。小さな3Dスフェロイドを取り囲む死細胞の豊富さに注目してください。(B)コラーゲンI上に成長した2D単分子膜の頂端表面にコラーゲンIを添加してから5日後の2D単分子膜の持続性。 スケールバー:100μm。 この図の拡大版をご覧になるには、ここをクリックしてください。
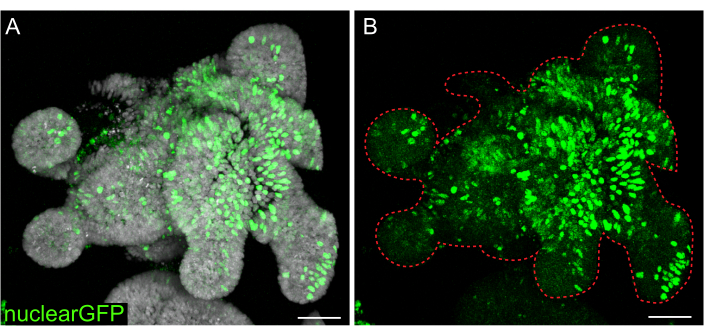
図7:3Dオルガノイドのレンチウイルス感染。 ラット空腸オルガノイドは、概説されたプロトコルを使用して核GFPレンチウイルス粒子に感染しました。5日間の回収と増殖の後、オルガノイドを固定し、DAPIで対比染色しました。(A)DAPI:グレー;nuclearGFP:緑。(B)原子力GFP:緑。赤い点線はオルガノイド境界を示す。スケールバー:50 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。
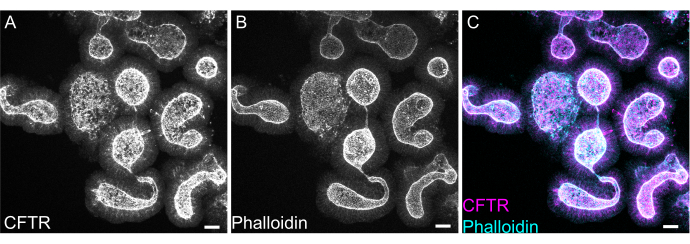
図8:ラット腸管オルガノイドの全マウント免疫 蛍光法。 (A)CFTR、(B)ファロイジン、および(C)ラット空腸オルガノイドの融合したホールマウント免疫蛍光法。オルガノイドにおけるCFTR染色の頂端濃縮( Aはグレー、 Cはマゼンタ)に注目してください。ファロイジンはF-アクチンをマークし、頂端のブラシ境界( Bでは灰色、 Cではシアン)を目立つように標識します。スケールバー:25 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。
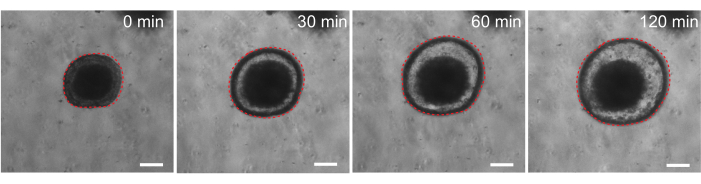
図9:ラットの腸管オルガノイドはフォルスコリン刺激で膨潤する。 cAMPアゴニストforskolin添加後のラット腸管内オルガノイド腫脹の代表的な経時変化。0分時間は、10μMフォルスコリンを添加する直前の時点を表す。画像は、同じオルガノイドを30分間隔で示しています。フォルスコリン添加後120分で最大の腫脹が観察された。赤い点線はオルガノイド境界の輪郭を描いています。オルガノイド内腔の真ん中にある暗い物質は、死んだ細胞で構成されています。スケールバー:100 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。
表1:AdDMEM+レシピ 標準AdDMEM+培地(ここで紹介する方法のベースとなる培地)を作るための材料です。 この表をダウンロードするには、ここをクリックしてください。
表2:ラット腸管オルガノイド培地(rIOM)レシピ。 組換えタンパク質の溶媒および保存条件を含む、標準的なラット腸オルガノイド培地の詳細なレシピ。 この表をダウンロードするには、ここをクリックしてください。
表 3: ソリューション。 プロトコル全体で使用される他のソリューションを作るためのレシピと手順。 この表をダウンロードするには、ここをクリックしてください。
表 4.2D単層培養用ラット腸管オルガノイド培地(rIOM2D)。 単層の2D成長に最適化されたオルガノイド培養培地の修正レシピ。 この表をダウンロードするには、ここをクリックしてください。
ディスカッション
ラット腸オルガノイドモデルの開発は、 in vivo の臓器に見られる重要な機能的特徴を保持し、前臨床試験、薬物スクリーニング、および機能アッセイのための有望なツールです。この in vitro モデルは、 in vivo の前臨床消化器病研究と並行して使用することができ、ラットは腸のサイズが大きく、ヒトと生理学的側面を共有し、場合によってはより優れた疾患モデルであるため、しばしば好ましいモデルである38。ここでは、ラット腸管陰窩の単離、ラット腸管オルガノイドの生成と長期培養、ならびに機能的フォルスコリン膨潤アッセイ、ホールマウント免疫蛍光法、2D単層培養、レンチウイルス遺伝子操作などのダウンストリームアプリケーションのための堅牢なステップバイステップのプロトコルについて概説します。ラット腸管オルガノイドは、マウスモデルの病態生理学が不適切である多くの疾患状況に関連している可能性が高く、マウス腸管オルガノイドと比較してヒト腸生理学のより良いモデルを提供する可能性があります。
継代および増殖可能な長寿命オルガノイド培養を確立するには、腸管上皮増殖の維持に必要な主要な成長因子を特定することが不可欠です。マウスオルガノイドは、ほとんどの場合、EGF、R-spondin、およびNogginの単純なカクテルで増殖するが、Nogginは腸管オルガノイド培養に必要ではないことが報告されている39。馴化培地は組換え成長因子を置き換えることができ、最も一般的に使用される細胞株は、Wnt3a、Rspondin-3、およびNoggin39、L-Wnt3a、およびHA-Rspondin1-Fc293T細胞を分泌するL-WRNである40。L-WRN馴化培地は、マウスの腸管オル ガノイドの増殖だけでなく、イヌ、ネコ、ニワトリ、ウマ、ウシ、ヒツジ、ブタなど、いくつかの家畜やコンパニオンアニマルの腸オルガノイドの増殖もサポートするのに十分である12。しかし、ヒト腸オルガノイドは、増殖増殖期(すなわち、小さなスフェロイドから大きなスフェロイドへの進行)と分化期(すなわち、分化した細胞型の生成と成熟)に異なる培地製剤を必要とするため、成長因子の要件が大きく異なります10。ラット腸管オルガノイドの培地要件は、ヒト腸管オルガノイドの増殖増殖培地の培地要件とよく似ていますが、特にラットオルガノイドは、この培地環境での増殖と分化の両方が可能であり、培養要件が大幅に簡素化されています。当初の試みは、L-WRNで培養した培地でラット腸管オルガノイドの確立と増殖に焦点を当てていましたが、長期培養は希薄であり、ラット腸管オルガノイド株は頑健性の欠如に悩まされていました(データは示していません)。これは、L-WRN細胞株がR-spondin 3を分泌するように操作されているのに対し、ここで推奨されている293T-Rspo1細胞株はR-spondin 1を分泌するように操作されているためと考えられます。ラットおよびヒトオルガノイドはR-spondin 1を好む可能性があり、L-WRN馴化培地におけるラットオルガノイド株の障害の原因となる可能性があります。
in vivo環境を最もよく再現するには、幹細胞の生存、維持、増殖を可能にし、細胞のターンオーバーと個別の細胞型への同時分化イベントを維持できるオルガノイド培養条件を開発することが重要です。したがって、組換えタンパク質および/または馴化培地中のタンパク質の濃度は、この完璧なバランスをとるために厳密に滴定および制御する必要があります。特に、腸管オルガノイド培養物の損失を避けるためには、最適なWntレベルが不可欠です。馴化培地中のWntが少なすぎると、成長をサポートできず、幹細胞の喪失とその後のオルガノイド死につながります。Wntの過剰活性化は、オルガノイドを嚢胞性で未分化にします10。ここでは詳しく説明しませんが、L-Wnt3aおよび293T-Rspo1馴化培地の各バッチを、トップフラッシュ細胞株41などのWntレポータールシフェラーゼアッセイを用いて試験することを強く推奨します。以前の研究では、L-Wnt3a培地の最適なバッチは、1%のL-Wnt3aと比較して、12.5%で15倍のシグナル増加、50%で300倍のシグナル増加をもたらすはずであると説明されています10。ラットオルガノイドはマウスオルガノイドよりも培養要件、特にWnt活性化レベルに対して感受性が高いため、これらの追加の品質管理ステップは、ラットオルガノイド培養の頑健性と信頼性を促進するのに大いに役立ちます。同様のレポーターラインは、ノギン馴化培地中のBmp活性および相対ノギン濃度の試験には利用できないため、ノギンレベルを正確に制御するために、可能であれば組換えノギンを使用することが望ましい。マウス腸オルガノイドはNoggin39の非存在下で増殖および維持できますが、これはラット腸オルガノイド培養では試みられていません。
細胞培養の要件を超えて、ラットオルガノイド株の初期確立の成功は、陰窩単離中の分化絨毛の効率的な枯渇に大きく依存します。高レベルのヴィラール汚染は陰窩死を引き起こしますが、これはおそらく死にゆく細胞からの信号または必須因子の隔離によるものです。これらの分化した絨毛を上皮製剤から正確かつ一貫して枯渇させるためには、実体鏡の助けを借りて上皮分離を行うことが推奨される。放出される上皮を目視で確認することで、PBSを廃棄して交換するタイミングを明確に判断できます(図1)。絨毛が十分に枯渇するまで、陰窩は収集しないでください。Villar細胞は終末分化しており、培養中にオルガノイドを生成することはできません。さらに、ラット腸管オルガノイドのその後の継代や、下流用途への使用には、繊細な注意が必要です。解離試薬中で長時間(10分)インキュベーションすると、有意な細胞死とオルガノイド株の喪失が生じます。
ここでは、ラットオルガノイドから腸管単分子膜を生成するための簡便で迅速なプロトコルについて説明します。EMEとコラーゲンI基質は上皮に異なる効果があり、研究の目的に応じて活用できます。EMEは、単一細胞の迅速かつ効率的な接着と細胞突起の形成を可能にします。対照的に、表面をコラーゲンIでコーティングすると、これらのプロセスが遅れます。単分子膜が約80%のコンフルエントに達すると、EMEで増殖した細胞は再び3Dオルガノイド構造を生成し始めます。しかし、継続的な成長のための十分な物理的および化学的サポートが不足しています。このオルガノイド状態への逆戻りは、EMEの単分子層を50%〜80%のコンフルエントに維持することで防ぐことができます。単分子膜の頂端表面に希釈EMEを添加すると、de novoオルガノイドの迅速な回収と形成が促進され、収束領域がより迅速かつ容易に生成されます。コラーゲンI表面では、細胞は均一な単層を形成し、小さなクラスターを生成することができます。しかし、単層の上にコラーゲンIを付加するだけでは、オルガノイド形成を誘導するには不十分です。EMEは、単分子膜表面に添加する際には、新生オルガノイドが克服するためのより強い機械的抵抗があるため、希釈する必要があります。しかし、この希釈されたEMEでは、大きなオルガノイドの堅牢な形成はできません。de novoで生成されたラットオルガノイドが表面から自然に剥離した場合は、直ちに除去し、原液EMEに移して、構造的支持と増殖を回復させる必要があります。このステップではオルガノイドのサイズが小さいため、オルガノイドの継代は、堅牢な増殖が確立されるまで推奨されません。EMEがオルガノイドの改形成をサポートできる理由の根本的な生物学的意義は、コラーゲンIがこれを行うことができるかどうかは明らかではありません。しかし、3Dコラーゲンで増殖した細胞は、出芽オルガノイドを形成することができず、長期的な維持をサポートできないことが報告されています42,43。市販のEME製品は、細胞外タンパク質、主にラミニンとコラーゲンIVの不均一な混合物です44。したがって、タンパク質の異なる組成と、異なる細胞複合体を使用して細胞外マトリックスに関与する上皮細胞の能力は、EMEのリモデリングを可能にしますが、コラーゲンIのリモデリングは可能にしません。コラーゲンI由来の単分子膜をEMEに入れてオルガノイドの形成と成長をサポートできるかどうかはテストされていません。
ここでは、ラット腸管オルガノイドモデルの遺伝子操作について説明し、3Dオルガノイドのレンチウイルス形質導入および2D単層の一過性トランスフェクションのプロトコルを概説します。レンチウイルスオルガノイド形質導入の効率の低さを克服するために、2D単分子膜の一過性トランスフェクション用のプロトコルが開発されました。単層の平坦な形態と露出した頂端ドメインは、ウイルスやDNA含有複合体へのアクセスを容易にします。pLJM1-EGFPベクターを用いたEGFPレポーターの発現を、この手法のバリデーションに用いた。GFPレポーターの発現は24時間後に観察され、単層で5〜6日間維持されました。単分子膜のレンチウイルス形質導入に焦点を当てた今後の研究は、3Dオルガノイド形質導入よりも高い効率を持つ可能性があります。上記のプロトコルを用いることで、感染した2D単分子膜から3Dオルガノイドを改質し、安定した系統の作製を容易にすることができます。注意を払えば、ラット腸管オルガノイド株は1年以上にわたって正常に維持され、多くの継代にわたって安定を維持し、凍結保存され、融解に成功し、レンチウイルス形質導入を使用して遺伝子改変されるため、ヒトとの生理学的関連性を保持し、アクセス可能で扱いやすい in vitro 腸オルガノイドモデルの必要性に対処できます。
開示事項
何一つ。
謝辞
スミグレイ研究室とアミーン研究室の皆さんの思慮深い議論に感謝します。この研究は、チャールズ・H・フッド財団のチャイルドヘルス助成金と嚢胞性線維症財団の助成金(004741P222)からカンザス州に、国立衛生研究所の国立糖尿病・消化器・腎臓病研究所からNAに助成金番号2R01DK077065-12で支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 3-D Culture Matrix Rat Collagen I | Cultrex/R&D Systems | 3447-020-01 | |
| 70 µm cell strainer | Corning/Falcon | 352350 | |
| Advanced DMEM/F12 | Gibco/Thermo Fisher | 12634010 | |
| Amphotericin B | Sigma Aldrich | A2942-20ML | |
| B-27 Supplement (50X), serum free | Thermo Fisher | 17504044 | |
| CHIR99021 | Cayman Chemical | 13122 | |
| CryoStor | Stem Cell Technologies | 100-1061 | |
| Cultrex HA-Rspondin1-Fc 293T cells | R & D Systems | 3710-001-01 | |
| FBS | Gibco/Thermo Fisher | 16-000-044 | |
| Gastrin I (human) | Sigma Aldrich | G9145 | |
| Gentle Cell Dissociation Reagent | Stem Cell Technologies | 100-0485 | |
| Glutamax | Thermo Fisher | 35-050-061 | |
| Growth factor-reduced Matrigel, phenol red-free | Corning | 356231 | |
| HEPES | AmericanBio | AB06021 | |
| Lanolin | Beantown Chemical | 144255-250G | |
| L-glutamine | Gibco/Thermo Fisher | A2916801 | |
| L-Wnt3a cells | ATCC | CRL-2647 | |
| N-2 Supplement (100X) | Thermo Fisher | 17502-048 | |
| N-acetylcysteine | Sigma Aldrich | A9165-5G | |
| Nicotinamide | Sigma Aldrich | N0636 | |
| Opti-MEM I Reduced Serum Medium | Gibco/Thermo Fisher | 31985070 | |
| Paraffin | Fisher Scientific | P31-500 | |
| Parafilm | Sigma Aldrich | P7793 | transparent film |
| PBS | Thermo Fisher | 10010023 | |
| Penicillin/Streptomycin | Gibco/Thermo Fisher | 15140122 | |
| pLJM1-EGFP | Addgene | 19319 | |
| Polybrene | Millipore | TR-1003-G | |
| Polyethylenimine hydrochloride (PEI) | Sigma Aldrich | 764965 | |
| p-phenylenediamine | Acros Organics/Thermo Fisher | 417481000 | |
| Puromycin | VWR | J593-25mg | |
| Recombinant human FGF2 protein | Peprotech | 100-18B-250ug | |
| Recombinant human IGF-1 protein | Biolegend | B356441 | |
| Recombinant human Noggin protein | R & D Systems | 6057-NG-100 | |
| Recombinant mouse EGF protein | Thermo Fisher | PMG8041 | |
| Sprague Dawley rat | Charles River Laboratories | Strain 001 | |
| Triton X-100 | American Bioanalytical | AB02025-00500 | |
| TrypLE Express Enzyme | Gibco/Thermo Fisher | 12604013 | |
| Y27632 dihydrochloride | Sigma Aldrich | Y0503 |
参考文献
- Beumer, J., Clevers, H. Cell fate specification and differentiation in the adult mammalian intestine. Nature Reviews. Molecular Cell BiologyI. 22 (1), 39-53 (2021).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Yin, Y. -. B., de Jonge, H. R., Wu, X., Yin, Y. -. L. Enteroids for nutritional studies. Molecular Nutrition & Food Research. 63 (16), 1801143 (2019).
- Cai, T., et al. Effects of six common dietary nutrients on murine intestinal organoid growth. PLoS One. 13 (2), e0191517 (2018).
- Davoudi, Z., et al. Gut Organoid as a new platform to study alginate and chitosan mediated PLGA nanoparticles for drug delivery. Marine Drugs. 19 (5), 282 (2021).
- Vlachogiannis, G., et al. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science. 359 (6378), 920-926 (2018).
- Yin, Y. B., de Jonge, H. R., Wu, X., Yin, Y. L. Mini-gut: a promising model for drug development. Drug Discovery Today. 24 (9), 1784-1794 (2019).
- Zietek, T., et al. Organoids to study intestinal nutrient transport, drug uptake and metabolism - update to the human model and expansion of applications. Frontiers in Bioengineering and Biotechnology. 8, 577656 (2020).
- Gunther, C., Winner, B., Neurath, M. F., Stappenbeck, T. S. Organoids in gastrointestinal diseases: from experimental models to clinical translation. Gut. 71 (9), 1892-1908 (2022).
- Pleguezuelos-Manzano, C., et al. Establishment and culture of human intestinal organoids derived from adult stem cells. Current Protocols in Immunology. 130 (1), 106 (2020).
- Zhao, Z., et al. Organoids. Nature Reviews Methods Primers. 2 (1), 94 (2022).
- Powell, R. H., Behnke, M. S. WRN conditioned media is sufficient for in vitro propagation of intestinal organoids from large farm and small companion animals. Biology Open. 6 (5), 698-705 (2017).
- Fagerholm, U., Johansson, M., Lennernas, H. Comparison between permeability coefficients in rat and human jejunum. Pharmaceutical Research. 13 (9), 1336-1342 (1996).
- Dubbelboer, I. R., Dahlgren, D., Sjogren, E., Lennernas, H. Rat intestinal drug permeability: A status report and summary of repeated determinations. European Journal of Pharmaceutics and Biopharmaceutics. 142, 364-376 (2019).
- Bryda, E. C. The Mighty Mouse: the impact of rodents on advances in biomedical research. Missouri Medicine. 110 (3), 207-211 (2013).
- Zhang, Z., Carriero, N., Gerstein, M. Comparative analysis of processed pseudogenes in the mouse and human genomes. Trends in Genetics. 20 (2), 62-67 (2004).
- Lambracht-Washington, D., Fischer Lindahl, K. Active MHC class Ib genes in rat are pseudogenes in the mouse. Immunogenetics. 56 (2), 118-121 (2004).
- Busslinger, G. A., et al. Human gastrointestinal epithelia of the esophagus, stomach, and duodenum resolved at single-cell resolution. Cell Reports. 34 (10), 108819 (2021).
- Burclaff, J., et al. A proximal-to-distal survey of healthy adult human small intestine and colon epithelium by single-cell transcriptomics. Cellular and Molecular Gastroenterology and Hepatology. 13 (5), 1554-1589 (2022).
- Haber, A. L., et al. A single-cell survey of the small intestinal epithelium. Nature. 551 (7680), 333-339 (2017).
- Olivier, A. K., Gibson-Corley, K. N., Meyerholz, D. K. Animal models of gastrointestinal and liver diseases. Animal models of cystic fibrosis: gastrointestinal, pancreatic, and hepatobiliary disease and pathophysiology. American Journal of Physiology. Gastrointestinal and Liver Physiology. 308 (6), G459-G471 (2015).
- Lu, P., et al. Animal models of gastrointestinal and liver diseases. Animal models of necrotizing enterocolitis: pathophysiology, translational relevance, and challenges. American Journal of Physiology. Gastrointestinal and Liver Physiology. 306 (11), G917-G928 (2014).
- Fujii, M., et al. Human intestinal organoids maintain self-renewal capacity and cellular diversity in niche-inspired culture condition. Cell Stem Cell. 23 (6), 787-793 (2018).
- Hedrich, W. D., et al. Development and characterization of rat duodenal organoids for ADME and toxicology applications. Toxicology. 446, 152614 (2020).
- How to Cryopreserve Intestinal Organoids. STEMCELL Available from: https://www.stemcell.com/technical-resources/area-of-interest/organoid-research/intestinal-research/tech-tips-protocols/how-to-cryopreserve-intestinal-organoids.html (2023)
- How to Thaw Intestinal Organoids. STEMCELL Available from: https://www.stemcell.com/technical-resources/educational-materials/protocols/how-to-thaw-intestinal-organoids.html (2023)
- Sancak, Y., et al. The Rag GTPases bind raptor and mediate amino acid signaling to mTORC1. Science. 320 (5882), 1496-1501 (2008).
- Van Lidth de Jeude, J. F., Vermeulen, J. L., Montenegro-Miranda, P. S., Vanden Brink, G. R., Heijmans, J. A protocol for lentiviral transduction and downstream analysis of intestinal organoids. Journal of Visualized Experiments. (98), e52531 (2015).
- Boj, S. F., et al. Forskolin-induced swelling in intestinal organoids: an in vitro assay for assessing drug response in cystic fibrosis patients. Journal of Visualized Experiments. (120), e55159 (2017).
- Regent, F., et al. Nicotinamide promotes formation of retinal organoids from human pluripotent stem cells via enhanced neural cell fate commitment. Frontiers in Cellular Neuroscience. 16, 878351 (2022).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Breau, K. A., et al. Efficient transgenesis and homology-directed gene targeting in monolayers of primary human small intestinal and colonic epithelial stem cells. Stem Cell Reports. 17 (6), 1493-1506 (2022).
- Berkers, G., et al. Rectal organoids enable personalized treatment of cystic fibrosis. Cell Reports. 26 (7), 1701-1708 (2019).
- deWinter-de Groot, K. M., et al. Forskolin-induced swelling of intestinal organoids correlates with disease severity in adults with cystic fibrosis and homozygous F508del mutations. Journal of Cystic Fibrosis. 19 (4), 614-619 (2020).
- Dekkers, J. F., vander Ent, C. K., Beekman, J. M. Novel opportunities for CFTR-targeting drug development using organoids. Rare Diseases. 1, 27112 (2013).
- Dekkers, J. F., et al. A functional CFTR assay using primary cystic fibrosis intestinal organoids. Nature Medicine. 19 (7), 939-945 (2013).
- van Mourik, P., Beekman, J. M., vander Ent, C. K. Intestinal organoids to model cystic fibrosis. European Respiratory Journal. 54 (1), 1802379 (2019).
- Tong, T., et al. Transport of artificial virus-like nanocarriers through intestinal monolayers via microfold cells. Nanoscale. 12 (30), 16339-16347 (2020).
- Miyoshi, H., Stappenbeck, T. S. In vitro expansion and genetic modification of gastrointestinal stem cells in spheroid culture. Nature Protocols. 8 (12), 2471-2482 (2013).
- Ootani, A., et al. Sustained in vitro intestinal epithelial culture within a Wnt-dependent stem cell niche. Nature Medicine. 15 (6), 701-706 (2009).
- Xu, Q., et al. Vascular development in the retina and inner ear: control by Norrin and Frizzled-4, a high-affinity ligand-receptor pair. Cell. 116 (6), 883-895 (2004).
- Jabaji, Z., et al. Type I collagen as an extracellular matrix for the in vitro growth of human small intestinal epithelium. PLoS One. 9 (9), e107814 (2014).
- Sachs, N., Tsukamoto, Y., Kujala, P., Peters, P. J., Clevers, H. Intestinal epithelial organoids fuse to form self-organizing tubes in floating collagen gels. Development. 144 (6), 1107-1112 (2017).
- Aisenbrey, E. A., Murphy, W. L. Synthetic alternatives to Matrigel. Nature Reviews Materials. 5 (7), 539-551 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved