パーキンソン病モデルにおけるミトコンドリア形態の組織学的検討
* これらの著者は同等に貢献しました
要約
本研究では、マウスの脳組織 をin situで免疫染色し、画像解析を行い、ミトコンドリアの形態を解析する手法を提示する。また、パーキンソン病モデルにおいて、タンパク質凝集によって誘発されるミトコンドリア形態の変化を検出する方法についても説明します。
要約
ミトコンドリアは細胞のエネルギー代謝において中心的な役割を果たしており、その機能はエネルギー需要が高いため、神経細胞にとって特に重要です。したがって、ミトコンドリア機能障害は、パーキンソン病を含むさまざまな神経疾患の病理学的特徴です。ミトコンドリアネットワークの形状と組織は高度に可塑性であるため、細胞は環境の手がかりやニーズに応答することができ、ミトコンドリアの構造もミトコンドリアの健康と密接に関連しています。ここでは、ミトコンドリアタンパク質VDAC1の免疫染色とその後の画像解析に基づいて、ミトコンドリアの形態を in situ で研究するためのプロトコルを提示します。このツールは、パーキンソン病の病態に深く関与する凝集しやすいタンパク質であるα-シヌクレインの凝集体によって誘発されるミトコンドリア数と形状の微妙な違いを検出できるため、神経変性疾患の研究に特に役立つ可能性があります。この方法により、pS129病変を有する黒質がミトコンドリア断片化を示すことを報告できます(アスペクト比、ARの減少によって示唆されるように)事前に形成された線維頭蓋内注射パーキンソンモデルで健康な隣接するニューロンと比較して。
概要
中枢神経系はATPを強く要求しており、ニューロンはATPを使用して、イオン勾配、神経伝達物質の合成、シナプス小胞の動員、放出、リサイクルをサポートし、局所的なタンパク質の翻訳と分解を可能にします。脳が使用するATPの95%以上はミトコンドリア1によって産生されます。したがって、ミトコンドリアの機能不全がニューロンに特に有害であることは驚くべきことではありません。実際、ミトコンドリア機能障害は、パーキンソン病(PD)やアルツハイマー病(AD)などの神経変性疾患を含むいくつかの神経疾患において重要な役割を果たしています2,3。
ミトコンドリアの機能やホメオスタシスに関連するPDをコードするタンパク質には、パーキン4,5,6、PTEN誘導キナーゼ1(PINK1)7,8、DJ-19など、複数の遺伝子が明確に関連しています。PDにおけるミトコンドリア機能障害の役割のさらなる証拠は、ミトコンドリア電子伝達鎖の複合体Iの阻害剤(ロテノンやMPTPなど)による治療が、in vitroおよびin vivoでPDのいくつかの側面を再現することである10。しかし、酸化ストレス、カルシウム恒常性の変化、ユビキチン-プロテアソームおよびオートファジー-リソソーム系の破綻、タンパク質凝集など、多くの病理学的プロセスがミトコンドリアの欠損とともにPDのニューロン喪失を引き起こす可能性があると述べることが重要である(11,12,13およびでレビュー)。
ミトコンドリアは形状が不均一であり、個々のユニットに加えて、それらは一般的に拡張された網状および管状ネットワークとして見られます。ミトコンドリアの構造と細胞の位置は、その機能にとって重要です14。実際、ミトコンドリアネットワークは非常に動的であり、細胞のニーズを満たし、環境の手がかりに応答するために、核分裂、融合、およびマイトファジーの頻繁なプロセスを経ます15,16。さらに、ミトコンドリアの形態は、ミトコンドリアの健康状態と密接に関連しています。例えば、ヒトの視神経萎縮では、ミトコンドリアの活性を低下させる遺伝子変異により、ミトコンドリアが異常で細く、過融合する17。一方、ミトコンドリアの断片化やミトコンドリアの過剰融合など、ミトコンドリアの形態異常を呈するヒトの疾患は種々あり、ミトコンドリアの機能に悪影響を及ぼしている(18号の文献でレビュー)。PDの文脈では、私たちらは以前に、異常なミトコンドリア形状がα-シヌクレイン凝集体に応答する機能不全と相関することを示しました19。ミトコンドリアの形態は、PDと他の疾患の両方の文脈でin vitroで広く研究されていますが20,21,22、in vivo切片からのミトコンドリア形態の評価のためのプロトコルは不足しています。このため、PDなどの疾患におけるミトコンドリアのin vivo研究は、トランスジェニック動物23や、細胞の分解能を提供できない中脳抽出物の評価に大きく依存する。
ここでは、ミトコンドリアタンパク質VDAC124の免疫染色とそれに続くパラフィン包埋組織切片の画像解析に基づいて、ミトコンドリアの形態をその場で研究するためのプロトコルが提示されます。私達はまたin vitroおよび生体内のPDモデルでこのプロトコルの結果を示す: SNCA (Synucleinのアルファ)を過剰発現するneuroblastomaのセルおよびαシヌクレインのpre-formed Fibrils (PFFs)の頭蓋内注入に服従したマウスからの頭脳ティッシュ。α-シヌクレイン(細胞内)またはphosphoSer129-α-シヌクレインpS129(マウス脳内)に対する抗体による共免疫染色により、サンプル中の凝集タンパク質病理(それぞれ過剰発現したα-シヌクレインおよびα-シヌクレインフィブリル)を有する細胞を同定し、陰性細胞は同じサンプル内で非病理学的コントロールとして機能しました。この解析と本稿に記載したデータにより、アスペクト比の低下が観察され、SNCAを過剰発現する細胞またはpS129病変を呈する細胞におけるミトコンドリアの断片化が示された。
プロトコル
このセクションに記載されているすべての手順は、バスク大学リファレンスM20/2022/212、バスク州政府、スペイン政府、および欧州連合によって提供された倫理的枠組みに従って実行されています。
1. SNCA過剰発現SH-SY5Y細胞におけるミトコンドリア形態解析
注:ここでは、その場で得られた結果の比較として役立つ、研究用のin vitro材料の生成の簡単な説明が提供されます。このタイプの分析は、ミトコンドリア形態のin vivo実験を開始する前に実行することをお勧めします。
- 細胞接着性を高め、平らな光学底部 96 ウェルプレートへの細胞接着を促進するには、25 μL/ウェルのコーティングマトリックス 1:1000 を DMEM F12 にピペッティングで添加します( 材料表を参照)。プレートを37°C、5%CO2で1時間インキュベートします。
- ノイバウアーチャンバーを使用してSH-SY5Yをカウントします。ピペッティングでコーティングマトリックスを除去し、10% FBS、2 mMグルタミン、ペニシリン/ストレプトマイシンを添加した50 μL/ウェルのDMEM F-12を、コーティングされた96ウェルプレートに10.000細胞/ウェルを播種します( 材料表を参照)。
- 細胞を37°C、5%CO2で24時間インキュベートします。
- ヒト野生型 SNCAを含むpcDNA3.1 250 ng、トランスフェクション試薬0.250 μL、トランスフェクションアジュバント0.250 L、トランスフェクション培地50 μLの混合物を各ウェルに調製します( 材料表を参照)。実験のウェルの総数を考慮してマスターソリューションを準備します。
- 手動ピペッティングで培地を除去し、ステップ1.4で調製した溶液を50μL/ウェルでピペッティングにより添加します。37°C、5%CO2でインキュベートします。
- トランスフェクション後、ピペッティングでトランスフェクション培地を除去し、PBSに25 μL/ウェルの4%パラホルムアルデヒド(PFA)を添加します。
注意:パラホルムアルデヒドは有毒な固定剤です。適切なPPEを使用してください。 - 室温(R.T)で5分間インキュベートします。ピペッティングで固定液を除去し、50 μL/ウェルのPBSを加えて1回洗浄します。ピペッティングでPBSを除去します。
- 25 μL/ウェルのTBSを0.05% Tween(TBS-T)および10%正常ロバ血清(NDS、 材料表を参照)とともにピペットで採取します。R.T.で1時間インキュベートし、非特異的なシグナルをブロックします。
- ウサギ抗αシヌクレイン抗体MJFR1 1:1000とマウス抗TOMM20抗体1:100のTBS-T溶液( 材料表参照)を、分析するウェルの数に応じて調製します。
- ステップ1.8のブロッキング溶液をピペッティングで除去し、ステップ1.9で調製した一次抗体の混合物を25 μL/ウェル加えます。4°Cで一晩インキュベートします。
- 一次抗体溶液を除去し、50 μL/ウェルのTBS-Tをピペッティングで添加および除去して3回洗浄します。
- 分析するウェルの数に応じて、TBS-T( 材料表参照)に、緑色の二次抗体抗マウス1:1000と赤色二次抗体抗ウサギ1:1000の溶液を調製します。
- ステップ 1.11 で説明した最後の洗浄から PBS を吸引した後、ピペットを使用して二次抗体混合物 25 μL/ウェルを添加し、プレートを R.T. で 1 時間インキュベートします。
- 二次抗体溶液をピペッティングで除去し、TBS-Tに25 μL/ウェルの2 g/mL DAPIを加えます。プレートをR.T.で5分間インキュベートします。
- ピペットを使用してDAPI溶液を除去し、ピペットで50μL/ウェルのTBS-Tを添加および除去して3回洗浄します。
- PBS 80 μL/ウェルを 0.02% アジ化ナトリウムでピペットし、プレートを 4 °C で保存します。
注意:アジ化ナトリウムは有毒です。適切なPPEを使用してください。 - 60倍対物レンズを搭載したハイコンテント自動蛍光顕微鏡または同等の共焦点イメージングシステムを使用して画像を撮影します( 材料表を参照)。
- ステップ3.15-3.21に従って、フィジーを用いて単一細胞のTOMM20シグナルの解析を行います。アポトーシス、壊死、または有糸分裂を起こしている細胞は避けてください。
注:そのために、細胞の収縮、膜のブレビング、細胞剥離、核の凝縮、DNA断片化、凝縮した核クロマチンが1つの平面に整列した太い鎖に組織化された凝縮など、顕微鏡で見えるアポトーシス、壊死、または有糸分裂の形態学的特徴を示す細胞を分析から除外します。
2. マウスにおけるPFFの作製とPFF頭蓋内注射
注:注入材料の生成と頭蓋内注入プロセスがここに示されています。このプロトコルは、Luk et al.25 から採用されています。
- PFF を得るには、0.5 mL の α-Syn (5 mg/mL;ペプチド、 材料表を参照)を37°C、250rpmのシェーカーで7日間、α-シヌクレインの凝集を誘導しました。
- 凝集したα-シヌクレインを振幅20%、0.25サイクルデューティで超音波処理し、最適なフラグメンテーションが得られるまで超音波処理し、透過型電子顕微鏡によるサンプルのネガティブ染色によって観察します。
- 雌雄の野生型C57Bl/6マウス(3ヶ月齢)に線条体PFF注射を施すには、メロキシカム/メタカム(5mg/kg)を生理食塩水で皮下投与する。また、1匹につき0.5mLの皮下注射を2回 行い、 滅菌生理食塩水1mLを投与する。これらの治療は、脱水症状、炎症、痛みを防ぎます。
- 誘導チャンバー内で 4% イソフルランと 0.7 L/min O2 で麻酔を誘発します。ペダルの反応がないことで麻酔の深さを確認してください。
- マウスの頭の上部を剃り、ヒートマットの上の定位装置のフレームに動物をそっと挿入します。
- 注射プロセス全体を通して、フェイスマスクを通して動物吸入麻酔(0.7 L / minO 2中の1%-2%イソフルラン)を提供することにより、麻酔面を維持します。.
- 定位フレームに動物を置きます。クロルヘキシジンスクラブと70%エタノールを交互に3回繰り返して手術部位を消毒します。マルカイン/ブピバカインを0.25%の皮下浸潤として局所的に(約100μL)塗布します。.
- 皮膚を0.5cm切開して頭蓋骨を露出させ、頭蓋骨に直径1mmの穴を開けて脳表面を露出させます。
- ステップ 2.2 で定位送達により得られた PFF 1.5 L を、Bregma からステップ 2.8 で示した座標に、-2.7 mm 背腹側 (上部脳から) に 100 nl/分の流量で 32 G ハミルトン シリンジで注入します。注射後5分でシリンジを抜きます。
- 縫合糸(サイズ:4-0、45 cm、 材料表を参照)必要に応じて3〜5針で傷口を縫合し、それぞれを2つの二重結び目と1つの結び目で接着します。麻酔薬の吸入を中止し、マウスをフレームから取り外します。
- マウスを適切な回復ケージに残してから、ホームケージに戻します。
- 翌週は、毎日の術後チェックを行います。動物の痛み、苦痛、または不快感は、ステップ2.3に示すように、24時間ごとにメロキシカム/メタカムを投与する必要があります。.
- 3か月後、腹腔内注射 により 、生理食塩水に200 mg / mLのペントバルビタールナトリウム300 μLを注射します。.痛み反射が失われたら、胸部を切開(2〜3cm)し、肋骨を持ち上げて心臓を露出させます。
- 23 G のバタフライニードルに接続された 50 mL シリンジを使用して、PBS 中の PBS 10 mL と PBS 中の 4% パラホルムアルデヒド 35 mL を 5 mL/分で次々と経心灌流します。
- 脳を除去し、4% PFAに後付けし、さらに4°Cで24時間加熱します。 PFA処理後、70%エタノール中で4°Cで保存してください。
- 脳を適切なプラスチック製の包埋ボックス( 材料表を参照)に入れ、R.T.で95%エタノールで1時間インキュベートします。
- R.T.で脳を100%エタノールに移し、新鮮な100%エタノールでこのステップを繰り返し、再び1時間インキュベートします。
- 脳をキシレンまたはキシレン代替品に移し、R.T.で1時間、新鮮な溶液で繰り返し、再び1時間インキュベートします。
- キシレンまたはキシレン代替品を除去し、サンプルを温かいパラフィン中で1時間インキュベートします。パラフィンを交換し、さらに1時間インキュベートします。
- 温かいパラフィンで包埋ボックスに脳をマウントし、一晩乾燥させます。ミクロトーム( 材料表参照)を用いて5μm切片を作製し、スライドガラスに取り付けます。
3. PFF注入マウスのパラフィン包埋脳切片の免疫組織化学によるミトコンドリア形態解析
- キシレン代替品に10回浸してスライドを脱ワックスします。スライドをキシレン代替品で2分間インキュベートします。キシレン代替品に再度10回浸します。
注:このステップは、パラフィンを除去し、サンプルの再水和を可能にするために必要です。 - 再水和:ステップ3.1で説明した手順を、100%EtOH、95%EtOH、70%EtOH、およびddH2Oで2回順に繰り返します。
- 以下の手順に従って抗原賦活化と免疫染色を行います。
- まず、サンプルをddH2Oの電子レンジ対応容器に移します。
- 4°Cで保存したpH 6のクエン酸100倍緩衝液( 材料表を参照)をウォームアップし(界面活性剤が沈殿している可能性があります)、350 mLの新鮮な1xクエン酸緩衝液を調製します。次に、クエン酸緩衝液を蓋付きの便利なプラスチック容器に注ぎます。
- スライドをクエン酸緩衝容器に入れ(CRITICAL:スライドが緩衝液のレベルより下にあることを確認してください)、蓋をします。
注意: 蓋が完全に閉まっていないことを確認してください、そうしないと、容器が電子レンジで破裂する可能性があります。 - 700 Wの電子レンジ:4分+5分休憩、1.5分+5分休憩。クエン酸緩衝液を補充し、再び電子レンジで1.5分+5分休憩、1.5分+5分休憩、1.5分+5分休憩します。
- 氷上のクエン酸緩衝液でサンプルを20分間冷却します。サンプルをddH2Oで洗浄します。
注:抗原賦活化は、特定の抗体要件によって異なる場合があります。
- ティッシュに触れずにペーパータオルでサンプルスライドを乾かします。組織の周りにパップペン( 材料表を参照)で長方形を描きます。
- すべてのスライドをスライド免疫染色ボックスに移し、TBS + 0.05 % TWEEN(TBS-T)で数回穏やかに洗浄します。TBS-Tの液滴がパップペンの長方形の内側にとどまっていることを確認します。
- ペーパータオルをタップして、サンプルからTBS-Tを取り除きます。50 μLのブロッキング溶液(TBS-T中の10%NDS)を各長方形に(組織に触れずに)添加し、室温で1時間インキュベートします。
注:体積は組織のサイズによって異なる場合があります。(1)Pap-Penn の領域がサンプル間で類似していること、(2)選択したバッファー容量でその領域が完全に覆われていることを確認してください。 - ペーパータオルを軽くたたいて、サンプルからブロッキング溶液を取り除きます。TBS-T中の一次抗体混合物50 μL/長方形を、抗チロシンヒドロキシラーゼ1:250と抗VDAC1 1:100および抗pSer129 α-シヌクレインEP1536Y 1:2000と一緒に静かにピペットで移動します( 材料表を参照)。
- 4°Cで一晩インキュベートします。
- スライド上でTBS-Tをピペッティングして洗浄し、ペーパータオルを軽くたたいて取り除きます。これを3回繰り返します。
- 50 μL/矩形の二次抗体混合物(緑色の二次抗チキン、赤色の二次抗マウス、遠赤色の二次抗ウサギ 1:1000 TBS-T)をピペッティングして添加します( 材料表を参照)。暗所で37°Cで1時間インキュベートします。
- 手順3.13の説明に従って、TBS-Tで3回洗浄します。
- DAPI 2 μg/mL in TBS-T で 1 分間インキュベートします。ペーパータオルをタップしてDAPI溶液を取り除きます。手順3.13の説明に従って、TBS-Tで3回洗浄します。
- ガラスカバーガラスをサンプルに取り付け、スライド2滴の封入試薬を使用します( 材料表を参照)。カバーガラスを静かに押して気泡を除去し、サンプルをR.T.で1時間乾燥させ、その後、暗所で4°Cで保管します。
- 60倍オイル対物レンズまたは共焦点技術を備えた構造化照明蛍光イメージングシステムを使用して、異なるフィールドの少なくとも50個の細胞を画像化します。
- 以下のステップに示すように、Fijiを使用して単一細胞のVDAC1シグナルの解析を実行します。
- まず、(必要に応じて)正または負のセルの周囲に等高線を描き、「切り抜き」機能を使用して、 関心領域(ROI) を選択して分離します。ROI選択の偏りを避けるために、分析に関係のないマーカー(つまり、ミトコンドリアマーカーではない)の蛍光シグナルを考慮して選択します。
- オプション:画像が過度にピクセル化されている場合は、「スムーズ」機能を使用して、より高いエッジ定義を取得します。
注:スムーズ機能を画像に適用した場合は、後続のすべての画像に適用してください。 - オプション: "Convolve" 関数 (カーネル モード、 プロセス > フィルター) を使用して、背景を減らします。
注意: これはオプションであり、セクションが薄いため、5 mセクションを使用する場合は通常は必要ありません。 - 「測定の設定」機能で 形状記述子 と しきい値制限 オプションをアクティブにします(これらが解析を通じてアクティブになっていることを確認してください)。
- 「調整」メニューで、 しきい値機能 を選択し、しきい値レベルを調整します。閾値の設定は、同じサンプルのすべてのセルに対して維持する必要があります。
- この記事の代表的な画像に示されているように、ミトコンドリアネットワークを適切に視覚化し、背景ピクセルを破棄するようにしてください。
- [解析]タブの [パーティクルの解析 ]ツールを使用します。ミトコンドリアを捕捉するために適切なサイズを設定します。この例では、size: 25-Infinity、activate: Pixel units、select: Show: Masks コマンドを使用して結果を視覚化しています。フィジーは、カウント、アスペクト比(AR)、およびその他の形状パラメータを計算して、新しいパネルに表示します。
- 必要に応じて、データの統計分析を実行します。この実験では、D'Agostino と Pearson の正規性検定による正規性検定の後、実験グループ間でフィジーが計算した平均アスペクト比 (AR) とカウントの差を分析するために t 検定を使用しました。
代表的な結果
組織におけるミトコンドリア形態の in situ 評価に適切なイメージングおよび分析条件が整っていることを確認するために、ミトコンドリア形態の既知のモジュレーターに応答してミトコンドリア形態を in vitro で探索することが推奨されます(セクション1)。一例として、SNCAはSH-SY5Y細胞において遺伝的に過剰発現し、前述のようにミトコンドリア形態の変化を誘発した26。ミトコンドリアの形態を悪化させるコントロールとして使用できる他の侮辱は、飢餓またはMPP+などのミトコンドリア活性阻害剤の使用です。細胞をトランスフェクションし、α-シヌクレイン(AS)を染色して、 SNCA+(AS+)細胞と SNCA-(AS-)細胞を分離しました。また、細胞のミトコンドリアネットワークを可視化するために、TOMM2027 で染色しました。この分析を5 μmの組織切片の分析にできるだけ近づけるために、複数の平面の最大投影ではなく、1つの共焦点面を分析しました。TOMM20の1つの共焦点面の形態学的解析により、SNCAの過剰発現に応答して、ミトコンドリアの総数とそのアスペクト比(AR)(細胞小器官の伸長と相関)の両方が減少することが明らかになりました(図1)。
上記のプロトコールの項に記載されているように、PFFを注射した動物の5 μmパラフィン包埋マウス脳切片のミトコンドリアタンパク質VDAC1について免疫染色を行いました。PDで変性する黒質(SNc)ドーパミン作動性ニューロンは、抗チロシンヒドロキシラーゼ(TH)との共免疫染色により明らかにされ、腹側被蓋野および外側黒質から局所的に分離されました。一方、抗phosphoSer129-α-シヌクレイン(pS129)染色により、pS129病変を有する細胞と健常細胞(pS129+とpS129-)を区別することができました。3種類の動物のSNc画像を撮影し、その後、TH陽性ニューロンのVDAC1染色を画像解析したところ、pS129病変を有するニューロンとこれらを欠くニューロンとの間で、ミトコンドリア数とアスペクト比の両方が減少することが明らかになりました(図2)。これらの結果は、pS129病変を有するニューロンのミトコンドリア形態が、pS129病変を欠損した細胞のミトコンドリア形態と比較して損なわれていることを示している。
この特定の実験はARの減少を示しており、それによってミトコンドリアの伸長の減少とミトコンドリアの形態の悪化を示すグローバルカウントの減少が強調されていますが、データの解釈は実験に依存する必要があります。例えば、ARとカウントの減少は、ミトコンドリア含量の全体的な減少と断片化を示している可能性があり、ARの減少がグローバルカウントの増加は、ミトコンドリアフラグメンテーションの表現型を指しています。したがって、両方のメジャーのコンテキストでデータを解釈することが重要です。
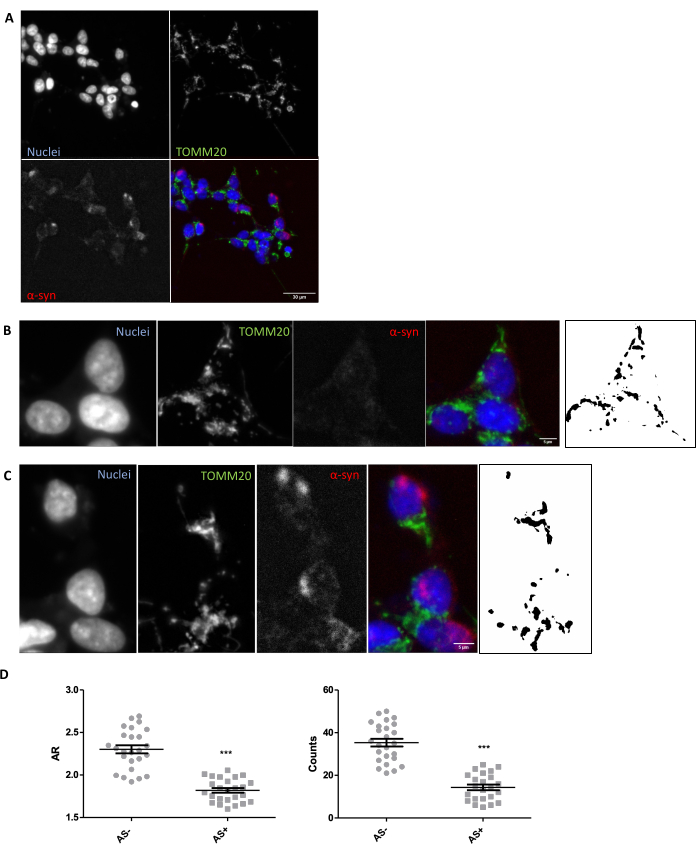
図1: SNCA過剰発現 in vitro モデルにおけるミトコンドリアの形態。 SNCA過剰発現細胞および過剰発現しない細胞(それぞれAS+およびAS-)におけるTOMM20(緑)、α-シヌクレイン(AS、赤)、およびDAPI(青)の共免疫染色(A)。AS-セル(B)とAS+セル(C)の詳細。パネル(B)と(C)の白黒画像は、「プロトコル」セクションで説明したフィジー関数を適用した後のTOMM20信号のマスクを表しています。このマスクにより、結果として得られる構造の形状を定量化できます。AS細胞およびAS+細胞(条件あたりN = 25細胞)のミトコンドリア数およびアスペクト比(AR)値を定量化し、個々の値および平均±SEMとして表しました。**p値<0.05のt検定(D)。正規性は、D'Agostino と Pearson の正規性検定によって評価されました。スケールバー: A、30 μm; B、C、5 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。
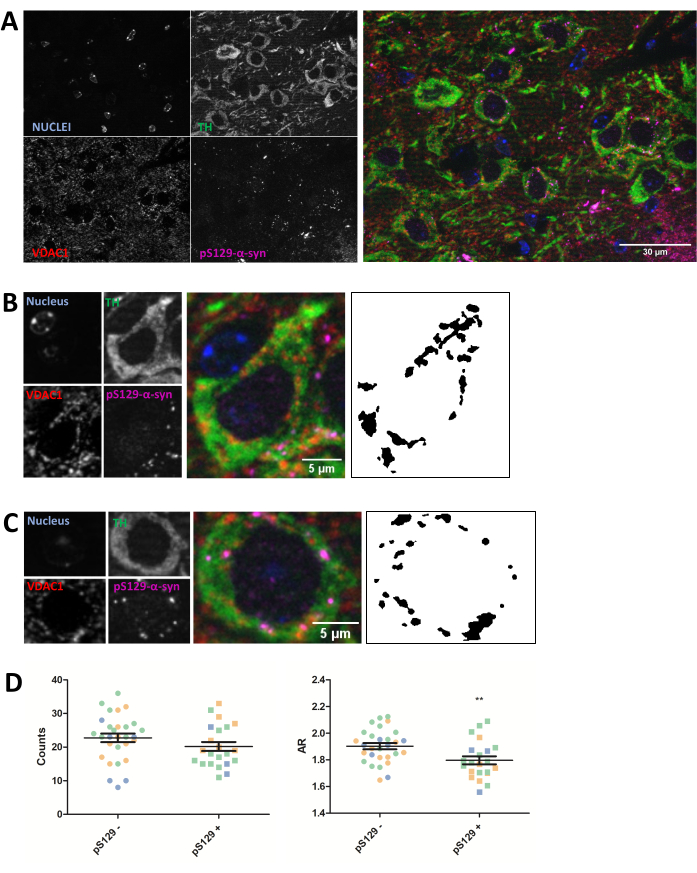
図2:ミトコンドリアの形態は、pS129病変を有するニューロンで影響を受ける。 PFF注入マウス(A)のSNcのTH(緑)、VDAC1(赤)、phosphoS129-α-シヌクレイン(マゼンタ)、DAPI(青)の共免疫染色。リン酸化S129-α-シヌクレイン陰性(pS129-)ドーパミン作動性ニューロン(B)とリン酸化S129-α-シヌクレイン陽性(pS129+)ドーパミン作動性ニューロン(C)の詳細。パネル(B)と(C)の白黒画像は、「プロトコル」セクションで説明したフィジー関数を適用した後のTOMM20信号のマスクを表しています。このマスクにより、結果として得られる構造の形状を定量化できます。陰性細胞と陽性細胞は、個々のグラフ化された値(青、緑、オレンジ)の異なる色で示されているように、3つの異なる動物のサンプルでカウントされました。ドーパミン作動性ニューロンにおけるpS129-(N = 29)対pS129+(N = 22)のミトコンドリア数およびAR定量は、SEM±平均値および個々の細胞値として表されました。**p値<0.05のt検定(D)です。正規性は、D'Agostino と Pearson の正規性検定によって評価されました。スケールバー: A、30 μm; B、C、5 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。
ディスカッション
全体として、この研究は、画像解析と組み合わせた免疫染色が、ミトコンドリアの形態を解析するための信頼できる方法であることを示しています。実際、ミトコンドリアの数や、細胞培養と組織の両方におけるアスペクト比などの形態学的パラメータを定量化することができます。ミトコンドリアの数は、サンプルの核分裂および融合メカニズムの機能状態に直接関係していますが、AR値はオルガネラの伸長に依存しています。この方法は、ミトコンドリアの形態、動態、機能の変化がよく知られている病理学的メカニズムであるPDのモデルにおけるミトコンドリア異常の迅速な評価に特に価値がある可能性があります28,29。α-シヌクレインはPDでも関連する役割を果たしており、実際、α-シヌクレインは、PD患者の死後診断に使用される細胞質原線維凝集体であるレビー小体の成分の1つです30。さらに、SNCA遺伝子の変異は、馴染みのあるPDと散発性のPDの両方の患者で見出された(31件のレビュー)。Ser129におけるα-シヌクレインのリン酸化は、PFF侮辱後に出現し、さまざまな毒性作用を誘発するレビー体様病状を標識することが広く示されている32,26。
今回紹介したツールを用いて、過剰発現および凝集したα-シヌクレイン(αシヌクレイン染色を有する細胞およびphosphoSer129α-シヌクレイン陽性病変を有する細胞)の存在下で、そのような病変を欠く細胞(α-シヌクレインおよびphosphoS129α-シヌクレイン陰性細胞)と比較して、ミトコンドリア数とAR値の減少を検出することができました。これらの結果は、α-シヌクレイン-ミトコンドリアの直接的な相互作用がミトコンドリアの機能と恒常性に毒性作用をもたらすことを示す以前の報告と一致していますPD 26,33 34。実際、α-シヌクレイン変異を持つマウスは、ミトコンドリアDNA損傷35とマイトファジー36,37の増加を示すことが報告されている。さらに、α-シヌクレイン濃度の上昇は、ミトコンドリアの分裂/断片化を促進し、ミトコンドリア内の活性酸素種を誘導し、α-シヌクレインを過剰発現する細胞株およびマウスモデルにおいてミトコンドリアタンパク質の発現を調節不全にすることが報告されています26,38,39。
このツールは、研究に使用される抗体に大きく依存することを強調することが重要です。適切な細胞内コンパートメントを検出するには、使用する抗体染色の慎重な形態学的評価が不可欠です。この手法は5μm切片に基づいているため、ミトコンドリア構造の分析には単一の焦点面が必要であり、表現型がなくても、ミトコンドリア形態の微妙な違いがこの方法では検出されない可能性があるため、表現型の存在を排除するものではありません。
この研究や他の研究は、以前にも同様のアプローチを用いてin vivoでミトコンドリアの形態を評価してきたが40、この評価のために詳細なプロトコルを研究コミュニティが利用できるようにする必要がある。本研究の意義は、ミトコンドリアの形態異常を評価し、潜在的な病態を特定するために、この方法をさまざまなin vivo疾患モデルに適用できることであり、最終的にはそのような疾患の治療のためのリード化合物のスクリーニングを容易にする可能性があります。この分析は現在、パラフィン包埋組織に限定されていますが、この方法の利点は、末期組織採取後のあらゆる疾患モデルに適用できることであり、非常に用途の広いツールとなっています。
開示事項
利益相反はご報告いたしません。
謝辞
本研究の資金提供者、特にIkerbasque、スペイン科学イノベーション省、Michael J Fox Foundation、IBRO、Achucarro Basque Center for Neuroscienceに感謝の意を表します。
資料
| Name | Company | Catalog Number | Comments |
| 32 G Hamilton syringe | Hamilton | 7632-01 | |
| 4',6-diamidino-2-fenilindol, dihidrocloruro (DAPI) | Invitrogen | D1306 | |
| 4/0 USP 45 cm suture | SSa90 pga | 32345n-36u | |
| Alexa fluor 488/594-Donkey anti-Mouse | Invitrogen | A21202; A21203 | green/red dye-Donkey anti-Mouse |
| Alexa fluor 594/647-Donkey anti-Rabbit | Invitrogen | A21207 A31573 | red/far red dye-Donkey anti-Rabbit |
| AlexaFluor 488-Donkey anti-Chicken | Jackson ImmunoResearch | 703-545-155 | green dye-Donkey anti-Chicken |
| Anti-PSer129 α-synuclein EP1536Y (Rabbit) antibody | Abcam | ab51253 | |
| Anti-TOM 20 (Mouse) antibody | Santa Cruz | sc-17764 | |
| Anti-Tyrosine Hydroxylase (Chicken) antibody | Abcam | ab76442 | |
| Anti-VDAC1 (Mouse) antibody | Santa Cruz | sc-390996 | |
| Anti-α-synuclein antibody MJFR1 (Rabbit) | Abcam | ab138501 | |
| Citrate buffer 100X stock: 120mM citrate buffer, 5% Tween in water (pH 6) | Home-made | ||
| Disposable base mold for tissue embedding | Fisher | 22-363-553 | Plastic embedding boxes |
| D-MEM F12 | Gibco | A321331020 | |
| EVOS M7000 Imaging System | ThermoFisher Scientific | High-content automated fluorescence microscope | |
| Fetal Bovine Serum | Gibco | 10270106 | |
| Flat optical bottom 96 well plates | Greiner | 675090 | |
| FluorSave Reagent | Millipore | 345789-20ML | Mounting reagent |
| Glutamine 200 mM | Gibco | 25030-024 | |
| ImmEdge Hydrophobic Barrier Pen | Vector Laboratories | H-4000 | PAP-pen |
| Lipofectamine and Plus Reagent | Invitrogen | 11668-019; 11514-015 | Transfection reagent and transfection adjuvant |
| Matrigel | Corning | 354230 | Coating matrix |
| Microtome | ThermoFisher Scientific | ||
| Normal Donkey Serum | Gibco | PCN5000 | |
| Opti-MEM | Gibco | 31985070 | Transfection medium |
| PCDNA4 plasmid (backbone) | Addgene | 41036 | |
| Penicillin/Streptomycin solution | Gibco | 15140-122 | |
| SH-SY5Y cells/well | ATCC | HTB-11 | |
| Xylene substitute | Labbox | 22L36504 | |
| Zeiss Axio Imager Apotome 2 | Carl Zeiss | Structured illumination fluorescence imaging system | |
| α-synuclein peptide | rpeptide | S-1010-2 |
参考文献
- Yang, Y., Lu, B. Mitochondrial morphogenesis, distribution, and parkinson disease. Journal of Neuropathology and Experimental Neurology. 68 (9), 953-963 (2009).
- Schapira, A. H. Mitochondria in the aetiology and pathogenesis of Parkinson's disease. The Lancet Neurology. 7 (1), 97-109 (2008).
- Swerdlow, R. H. Mitochondria and mitochondrial cascades in alzheimer's disease. Journal of Alzheimer's Disease. 62 (3), 1403-1416 (2018).
- Hedrich, K., et al. type, and origin of Parkin mutations: Review and case studies. Movement Disorders. 19 (10), 1146-1157 (2004).
- Kahle, P. J., Haass, C. How does parkin ligate ubiquitin to Parkinson's disease. EMBO reports. 5 (7), 681-685 (2004).
- Dawson, T. M., Dawson, V. L. The role of parkin in familial and sporadic Parkinson's disease. Movement Disorders. 25, S32-S39 (2010).
- Pickrell, A. M., Youle, R. J. The Roles of PINK1, Parkin, and Mitochondrial Fidelity in Parkinson's Disease. Neuron. 85 (2), 257-273 (2015).
- Zhi, L., et al. Loss of PINK1 causes age-dependent decrease of dopamine release and mitochondrial dysfunction. Neurobiology of Aging. 75, 1-10 (2019).
- Bonifati, V., et al. DJ-1(PARK7), a novel gene for autosomal recessive, early onset parkinsonism. Neurological Sciences. 24 (3), 159-160 (2003).
- Chia, S. J., Tan, E. -. K., Chao, Y. -. X. Historical Perspective: Models of Parkinson's Disease. International Journal of Molecular Sciences. 21 (7), 2464 (2020).
- Wilson, D. M., Cookson, M. R., Den Bosch, L. V. a. n., Zetterberg, H., Holtzman, D. M., Dewachter, I. Hallmarks of neurodegenerative diseases. Cell. 186 (4), 693-714 (2023).
- Moore, D. J., West, A. B., Dawson, V. L., Dawson, T. M. Molecular pathophysiology of Parkinson's disease. Annual Review of Neuroscience. 28 (1), 57-87 (2005).
- Olanow, C. W., Tatton, W. G. Etiology and pathogenesis of Parkinson's disease. Annual Review of Neuroscience. 22 (1), 123-144 (1999).
- Nunnari, J., Suomalainen, A. Mitochondria: In sickness and in health. Cell. 148 (6), 1145-1159 (2012).
- Okamoto, K., Shaw, J. M. Mitochondrial Morphology and Dynamics in Yeast and Multicellular Eukaryotes. Annual Review of Genetics. 39 (1), 503-536 (2005).
- Malpartida, A. B., Williamson, M., Narendra, D. P., Wade-Martins, R., Ryan, B. J. Mitochondrial Dysfunction and Mitophagy in Parkinson's Disease: From Mechanism to Therapy. Trends in Biochemical Sciences. 46 (4), 329-343 (2021).
- Zou, W., et al. Nanoscopic quantification of sub-mitochondrial morphology, mitophagy and mitochondrial dynamics in living cells derived from patients with mitochondrial diseases. Journal of Nanobiotechnology. 19 (1), 136 (2021).
- Navaratnarajah, T., Anand, R., Reichert, A. S., Distelmaier, F. The relevance of mitochondrial morphology for human disease. The International Journal of Biochemistry & Cell Biology. 134, 105951 (2021).
- Zambon, F., et al. Cellular α-synuclein pathology is associated with bioenergetic dysfunction in Parkinson's iPSC-derived dopamine neurons. Human Molecular Genetics. 28 (12), 2001-2013 (2019).
- Cherubini, M., Lopez-Molina, L., Gines, S. Mitochondrial fission in Huntington's disease mouse striatum disrupts ER-mitochondria contacts leading to disturbances in Ca2+ efflux and Reactive Oxygen Species (ROS) homeostasis. Neurobiology of Disease. 136, 104741 (2020).
- Parihar, M. S., Parihar, A., Fujita, M., Hashimoto, M., Ghafourifar, P. Alpha-synuclein overexpression and aggregation exacerbates impairment of mitochondrial functions by augmenting oxidative stress in human neuroblastoma cells. The International Journal of Biochemistry & Cell Biology. 41 (10), 2015-2024 (2009).
- Wiemerslage, L., Lee, D. Quantification of mitochondrial morphology in neurites of dopaminergic neurons using multiple parameters. Journal of Neuroscience Methods. 262, 56-65 (2016).
- Liu, Y. -. T., et al. Mt-Keima detects PINK1-PRKN mitophagy in vivo with greater sensitivity than mito-QC. Autophagy. 17 (11), 3753-3762 (2021).
- Shoshan-Barmatz, V., Shteinfer-Kuzmine, A., Verma, A. VDAC1 at the intersection of cell metabolism, apoptosis, and diseases. Biomolecules. 10 (11), 1485 (2020).
- Luk, K. C., et al. Pathological α-Synuclein transmission initiates parkinson-like neurodegeneration in nontransgenic mice. Science. 338 (6109), 949-953 (2012).
- Ryan, B. J., et al. REST protects dopaminergic neurons from mitochondrial and α-synuclein oligomer pathology in an alpha synuclein overexpressing BAC-transgenic mouse model. The Journal of Neuroscience. 41 (16), 3731-3746 (2021).
- Yamamoto, H., et al. Dual role of the receptor Tom20 in specificity and efficiency of protein import into mitochondria. Proceedings of the National Academy of Sciences. 108 (1), 91-96 (2011).
- Exner, N., Lutz, A. K., Haass, C., Winklhofer, K. F. Mitochondrial dysfunction in Parkinson's disease: molecular mechanisms and pathophysiological consequences. The EMBO Journal. 31 (14), 3038-3062 (2012).
- Grünewald, A., Kumar, K. R., Sue, C. M. New insights into the complex role of mitochondria in Parkinson's disease. Progress in Neurobiology. 177, 73-93 (2019).
- Baba, M., et al. Aggregation of alpha-synuclein in Lewy bodies of sporadic Parkinson's disease and dementia with Lewy bodies. The American journal of pathology. 152 (4), 879-884 (1998).
- Vázquez-Vélez, G. E., Zoghbi, H. Y. Parkinson's disease genetics and pathophysiology. Annual Review of Neuroscience. 44 (1), 87-108 (2021).
- Mahul-Mellier, A. -. L., et al. The process of Lewy body formation, rather than simply α-synuclein fibrillization, is one of the major drivers of neurodegeneration. Proceedings of the National Academy of Sciences. 117 (9), 4971-4982 (2020).
- Ganguly, U., et al. Interaction of α-synuclein and Parkin in iron toxicity on SH-SY5Y cells: implications in the pathogenesis of Parkinson's disease. Biochemical Journal. 477 (6), 1109-1122 (2020).
- Ganjam, G. K., et al. Mitochondrial damage by α-synuclein causes cell death in human dopaminergic neurons. Cell Death & Disease. 10 (11), 865 (2019).
- Martin, L. J., et al. Parkinson's Disease α-synuclein transgenic mice develop neuronal mitochondrial degeneration and cell death. The Journal of Neuroscience. 26 (1), 41-50 (2006).
- Choubey, V., et al. Mutant A53T α-Synuclein induces neuronal death by increasing mitochondrial autophagy. Journal of Biological Chemistry. 286 (12), 10814-10824 (2011).
- Chen, L., Xie, Z., Turkson, S., Zhuang, X. A53T Human α-synuclein overexpression in transgenic mice induces pervasive mitochondria macroautophagy defects preceding dopamine neuron degeneration. The Journal of Neuroscience. 35 (3), 890-905 (2015).
- Kamp, F., et al. Inhibition of mitochondrial fusion by α-synuclein is rescued by PINK1, Parkin and DJ-1. The EMBO Journal. 29 (20), 3571-3589 (2010).
- Nakamura, K., et al. Direct membrane association drives mitochondrial fission by the parkinson disease-associated protein α-synuclein. Journal of Biological Chemistry. 286 (23), 20710-20726 (2011).
- Park, J., et al. Abnormal mitochondria in a non-human primate model of MPTP-induced Parkinson's disease: Drp1 and CDK5/p25 signaling. Experimental Neurobiology. 28 (3), 414-424 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
JoVEについて
Copyright © 2023 MyJoVE Corporation. All rights reserved