イン・ビトロ 発生メカノバイオロジー研究のための胎児血管オンチップモデル
要約
ここでは、内皮細胞をヒト多能性幹細胞から分化させる簡単なワークフローと、それに続く機械的刺激の詳細なプロトコルについて説明します。これにより、内皮細胞の発生メカノバイオロジーの研究が可能になります。このアプローチは、機械的刺激後に培養チップから回収された生細胞のダウンストリームアッセイに適合します。
要約
心臓は、発生中に機能的に確立される最初の臓器であるため、妊娠の非常に早い段階で血液循環が始まります。胎児の循環は、胎児の成長を確実にするために酸素と栄養素を輸送するだけでなく、機械的な手がかりによって内皮層内で起こる多くの重要な発達イベントを制御します。生体力学的信号は、血管構造の変化を誘発し、動静脈の仕様を確立し、造血幹細胞の発生を制御します。発達中の組織にアクセスできないため、初期のヒトの発達における循環の役割の理解が制限されます。したがって、 in vitro モデルは、血管メカノバイオロジーの研究にとって極めて重要なツールです。この論文では、内皮細胞をヒト誘導多能性幹細胞から区別し、その後の流体デバイスへの播種を行い、機械的合図に対する応答を研究するプロトコルについて説明します。このアプローチにより、機械的刺激下で内皮細胞を長期間培養し、その後、表現型および機能特性評価のために内皮細胞を回収することができます。今回確立した in vitro モデルは、ヒト胎児期の血管発達を最終的に調整する機械的な手がかりによってシグナル伝達を行う細胞内分子機構の解明に有用です。
概要
胚発生中、心臓は機能を確立する最初の器官であり1、心内膜チューブ形成の初期段階から検出可能な収縮2。循環は、血管内の血液の流れによって媒介される機械的手がかりとともに、初期発達の多くの重要な側面を制御します。胎児循環の確立に先立って、血管系は一次毛細血管叢に組織化される。心が機能すると、この神経叢は静脈血管系と動脈血管系に再編成されます3。動静脈の仕様における機械的手がかりの役割は、血流開始前の動脈マーカーおよび静脈マーカーの汎内皮発現に反映されます4。
血行動態の力は、血管系自体の発達を制御するだけでなく、血球形成の制御においても基本的な役割を果たします。造血幹細胞および前駆細胞(HSPC)は、血原性内皮5,6,7,8と呼ばれる特殊な内皮細胞から出現し、発生の初期段階でのみ胚のさまざまな解剖学的領域に存在します。心臓欠損モデルは、in vitroモデルとともに、機械的手がかりが血原性内皮からのHSPC産生を指示し、増加させることを実証しました9,10,11,12,13,14。
異なるタイプのフローダイナミクスは、血原性内皮16,17と動脈細胞仕様18の両方において重要であることが知られている細胞周期15を差動的に制御することが示されている。全体として、機械的な手がかりは、発生中の細胞の同一性と機能の重要な決定要因です。新しいin vitro流体デバイスにより、in vivoでのヒト血液発生における発生メカノバイオロジーの研究に伴う限界を克服することができます。
この原稿のプロトコルの全体的な目標は、ヒト人工多能性幹細胞(iPS細胞)から in vitro で得られたヒト内皮細胞に対するせん断応力の影響を研究するための実験パイプラインを段階的に記述することです。このプロトコルには、iPS細胞の内皮細胞への微分と、その後の刺激プロトコルのための流動チップへの播種に関する詳細な指示が含まれています。これを使用して、さまざまな in vitro由来の内皮細胞を、流れに応じた配向を分析することにより、せん断応力を感知する能力についてテストできます。これにより、他の研究室は、せん断応力に対する応答と、さまざまな内皮細胞の同一性に対するその機能的影響に関する疑問に取り組むことができます。
プロトコル
注:すべての細胞培養技術は、層流フード内の無菌条件下で実施する必要があり、細胞は5%CO2を含む腐植雰囲気中で37°Cでインキュベートする必要があります。維持(rhbFGF)および分化プロトコル(rhBMP4、rhVEGF、rhbFGF、rhIL6、rhFLT3L、rhIGF1、rhIL11、rhSCF、rhEPO、rhTPO、rhIL3)の両方のためのすべてのサイトカイン調製に関する説明書は 、補足表S1に記載されています。
1. ヒトiPS細胞の培養 - 細胞の融解、維持、凍結
- 維持培地、成長因子、その他の試薬の調製
- ヒトES細胞全血清フリー培地サプリメント、25%ウシ血清アルブミン(BSA)36 mL、および55 mMのβ-メルカプトエタノール1 mLをダルベッコ修飾イーグル培地/F12(DMEM/F-12)基礎培地に添加して培地を調製します( 材料表を参照)。
- 1 mgの Rhoキナーゼ阻害剤 (iRock)を1 mLのDMSOに再懸濁し、50 μLのアリコートを作り、-20°Cで保存します。
注:これらのアリコートは、-20°Cで1年間保存できます。解凍後は4°Cで1週間保存できます。 - ビトロネクチン(VTN-N)溶液を氷上で解凍し、バイアルあたり60 μLを分注してから、-80°Cで保存します。 プレートをコーティングする直前に、60 μLのストックを6 mLのダルベッコリン酸緩衝生理食塩水(DPBS)で希釈します。最終濃度は 5 μg/mL です。
- iPS細胞株の融解
注:ヒト多能性幹細胞株SFCi55は、以前は社内で誘導され、さまざまな細胞タイプおよびさまざまな胚系統への分化に広く使用されていました19、20、21、22。- 6ウェルプレートの1ウェルを1 mLのVTN-N溶液で37°Cで1時間コーティングします。
注:インキュベーション後、コーティングされたプレートは4°Cで最大1週間保存できます。 - VTN-N溶液を吸引ピペットで吸引し、20 ng/mLのrhbFGFを添加した予熱培地1 mLを添加する(付表S1)。
- iPS細胞の入ったバイアルをウォーターバスで素早く解凍し、細胞を5 mLの予熱した培地に移します。
- 細胞を室温で300 × g で3分間スピンダウンします。
- 細胞ペレットを 0.5 mL の培地に再懸濁し、20 ng/mL のrhbFGF を添加します。
- すでに1 mLの培地を含む1つのコーティングウェルに細胞を移します。
- 合計1.5 mLの培地で、細胞を含むウェルに5 μLのiRockを加えます。
- インキュベーターで細胞を培養し、平日は毎日培地を交換し、細胞をダブルフィードし、通常の2倍の量の培地を細胞に追加して、週末に確実に給餌します。
注:細胞はiRockの存在下で24時間のみ増殖します。
- 6ウェルプレートの1ウェルを1 mLのVTN-N溶液で37°Cで1時間コーティングします。
- iPS細胞の維持と継代
- 20 ng/mLのrhbFGFを添加した新鮮な予熱培地で培地を毎日交換してください。
- 細胞の濃度が約80%に達したら、通常は週に2回、細胞を継代します。
- 細胞を継代するには、ステップ1.2.1および1.2.2で説明したように、プレートをVTN-Nでコーティングします。
- ウェルから培地を細胞で吸引し、DPBSで洗浄します。
- DPBSを吸引し、1 mLの解離試薬( 材料表を参照)を添加し、1分間インキュベートします。
- 解離試薬を吸引し、さらに3分間インキュベートします。プレートを両側で10回しっかりと叩きます。
注:解離ステップでは、インキュベーション時間とタッピング手順において、細胞タイプ固有の最適化が必要になる場合があります。 - 細胞に培地1 mLを加え、パスツールピペットで培地で一度洗浄し、ほとんどのコロニーが確実に回収されるようにします。
- 各ウェルに150 μLの細胞懸濁液を添加し、1ウェルから6ウェルへの継代比を求めます。
注:新しいバイアルを融解した直後は、1:1または2継代で1:1または2継代などの低い比率で細胞を継代し、1:6の比率で継代する前に安定した増殖段階に達するようにすることをお勧めします。 - インキュベーターで細胞を培養し、平日は毎日培地を交換し、週末に一度細胞をダブルフィードします。
- iPS細胞株の凍結
注:融解後、最初の2継代以内で細胞を凍結し、培養を開始するために凍結バイアルの低継代バッチを一定に維持します。細胞のコンフルエント度が約80%に達したら凍結します。- 培地を、20 ng/mL の rhbFGF と 5 μL の iRock を添加した新鮮な予熱培地に変更し、少なくとも 1 時間インキュベートします。
- 手順1.3.2.2-1.3.2.5の説明に従ってセルをデタッチします。
- 剥離した細胞を、5 mLの培地が入った15 mLの遠心チューブに回収します。
- 室温で300× g で3分間遠心分離します。
- 上清を吸引し、凍結保存液1 mLを加えます( 材料表参照)。
- パスツールピペットを使用して、細胞を静かに上下にピペットし、凍結保存液中で混合します。
メモ:過度なピペッティングは避けてください。これにより、細胞クラスターが解離するおそれがあります。 - 細胞懸濁液をそれぞれ0.5 mLの2つの凍結保存バイアルに分けます。
- 凍結保存バイアルを4°Cで予冷した凍結保存容器に移します。
- 細胞の入った容器を-80°Cの冷凍庫に24時間移してから、バイアルを液体窒素に移して長期保存します。
2. iPS細胞の内皮細胞への分化
- 分化培地、サイトカイン、成長因子の調製
- 表1に従って無血清分化培地(SFD)を調製する。この培地は、分化の0日目から5日目まで使用してください。
- 34 SFM基礎培地に34栄養サプリメントと5 mLのL-グルタミンサプリメントを添加して、CD34+ 細胞用の無血清培地(SFM-34)を調製します( 材料表を参照)。この培地は、分化の6日目以降に使用してください。
- 1 mg のCHIR99021を 716 μL の DMSO に再懸濁し、3 mM の溶液を得ます。完全に再懸濁するまで室温でインキュベートします。必要に応じて、37°Cですばやくウォームアップします。 20 μLのアリコートを作成し、-20°Cで最大6か月間保存します。解凍後はすぐに使用し、再度凍結したり保管したりしないでください。
- 補足表S1の指示に従ってサイトカインを再懸濁する。すべてのサイトカインのアリコートを-80°Cで保存します。
- 内皮細胞の分化
注:分化の各日について、に記載されているサイトカインの混合物に従って、予熱したSFD培地18 mL(培地/ウェル)を調製します。 表 2.- 0日目-胚様体(EB)の形成
- 表2に従って、18 mLのSFD培地とMix 1サイトカインを、各6ウェルプレート(3 mL/ウェル)に調製します。
- 2 mLの予熱したSFD培地とミックス1サイトカインを、撥細胞性6ウェルプレートの各ウェルに加えます( 材料表を参照)。
- EB を形成するには、ステップ 1.3.2.2-1.3.2.4 で説明されている手順に従います。
注:分化を開始するには、iPS細胞が70〜80%コンフルエントであることを確認してください。 - 1 mLの予熱したSFD培地とミックス1サイトカインを、分離した細胞クラスターの各ウェルに加えます。
- パスツールピペットを使用して、細胞クラスターを1:1の比率でEB形成用の撥細胞ウェルの1つのウェルに静かに移します。
- プレートをインキュベーターに入れた後、プレートを前後左右に動かして、EBをウェルに均等に分散させます。
- 1日目 - EBへの中程度の変化
注:このステップは、分化の1日目までに、EBと並んで懸濁液中の単一細胞が多数ある場合にのみ必要です。- 表2に従って、18 mLのSFD培地とMix 1サイトカインを、各6ウェルプレート(3 mL/ウェル)に調製します。
- EBでプレートを回転させて中央に移動させ、パスツールピペットを使用して15 mLの遠心チューブに回収します。
注:EBがひも状に凝集しているように見える場合は、15 mL遠心チューブに集める前に、P1000でピペッティングして分離してください。 - EBがチューブの底に落ち着くまで5〜10分待ちます。
注:EBが小さすぎる場合は、100 × g で5分間遠心分離して沈降させます。 - 細胞撥水プレートを滅菌水またはDPBSで洗浄し、単一の細胞や破片を取り除きます。
- EBから上清を抜き取らずに、慎重かつゆっくりと吸引します。
- 2 mLのSFDとMix 1サイトカインを、撥細胞プレートの各ウェルに加えます。
- 1 mL の SFD 培地と Mix 1 サイトカインを使用して、各開始ウェルに EB を再懸濁します - 6 ウェルプレートの場合は、6 mL の培地を追加します。
- すでに 2 mL の SFD 培地を含むウェルあたり 1 mL の容量で EB を撥細胞プレートに移します。
- プレートをインキュベーターに入れた後、プレートを前後左右に動かして、EBをウェルに均等に分散させます。
- 2日目 - CHIR99021の追加
- EBをプレートの中央に渦巻きさせ、ウェルの側面に 表2 に従ってCHIR99021を加えて、細胞との直接接触を避けます。
メモ:1日目に培地を交換しなかった場合は、CHIRのみを追加するのではなく、培地全体を交換してください。 表 2 に従って Mix 2 で SFD 培地 18 mL を調製し、各 6 ウェルプレート(3 mL/ウェル)を調製します。 - プレートをインキュベーターに入れた後、プレートを前後左右に動かして、EBをウェルに均等に分散させます。
- EBをプレートの中央に渦巻きさせ、ウェルの側面に 表2 に従ってCHIR99021を加えて、細胞との直接接触を避けます。
- 3日目 - EBのミディアムチェンジとMix 3サイトカインの添加
- 表2に従って3つのサイトカインを混ぜ合わせたSFD培地18 mLを、各6ウェルプレート(3 mL/ウェル)に調製します。
- ステップ 2.2.2.2-2.2.2.4 の説明に従って EB を収集します。
- 予熱した2 mLのSFD培地とMix 3サイトカインを撥細胞プレートに加えます。
- EBから上清を注意深く吸引します。1 mL/ウェルのSFDをMix 3サイトカインで添加します。
- ステップ2.2.2.8-2.2.2.9の説明に従って、ウェル間でEBを分配します。
- 6日目 - SFM-34の培地交換とMix 4サイトカインの追加
- 表2に従って4つのサイトカインを混ぜ合わせたSFD培地18 mLを、各6ウェルプレート(3 mL/ウェル)に調製します。
- ステップ 2.2.2.2-2.2.2.4 の説明に従って EB を収集します。
- 2 mLの予熱したSFM-34培地とミックス4サイトカインを撥細胞プレートに加えます。
- EBから上清を注意深く吸引します。SFM-34 を 1 mL/ウェルと Mix 4 サイトカインで添加します。
- ステップ2.2.2.8-2.2.2.9の説明に従って、ウェル間でEBを分配します。
- 0日目-胚様体(EB)の形成
3. CD34+ 細胞の単離とチップへの播種
注:CD34+ 細胞は、モノクローナルマウス抗体、抗ヒトCD34抗体、およびFcRブロッキング試薬(ヒトIgG)に結合したCD34マイクロビーズを含むCD34マイクロビーズキット( 材料表を参照)を用いたポジティブ単離アプローチによって単離されます。フローサイトメトリー解析では、単離の前後に細胞を染色してカラム単離の効率を検証することが重要です。
- 材料と試薬を準備します。
- 5 mL の 5% BSA 溶液と 200 μL の EDTA 0.5 M から 45 mL の DPBS を加えて洗浄バッファーを調製し、PBS + 0.5% BSA + 2 mM EDTA を得ます。分離ごとに新鮮なものを準備し、ろ過滅菌し、使用するまで冷蔵保管してください。
- rhLaminin 521 を DPBS Ca 2+ Mg2+ で 1:50 に希釈して調製したラミニン溶液で流体チップをコーティングします。各チップに使用中のチップに適した容量をコーティングし、播種前にインキュベーターで2時間インキュベートします。
注:コーティングには他のマトリックスを使用することもできますが、特定の細胞タイプ/実験でテストする必要があります。 - 表2に従って、SFM-34培地18 mLにMix 4サイトカインを添加してMix 4 SFM-34培地を調製し、ガス交換を容易にするために蓋を少し緩めてインキュベーター内の50 mLチューブに入れます。
- 選択した灌流セットとインキュベーターで使用するその他のチューブを配置して脱気します。
- 8日目 - EBの解離とCD34+ の単離
- ステップ 2.2.2.2-2.2.2.5 の説明に従って EB を収集します。
- 回収したEBのスタートウェルごとに1 mLの細胞解離試薬を添加します(6ウェルを回収した場合は、6 mLを追加します)。
- 細胞解離試薬中の EB 懸濁液 1 mL を、細胞忌避プレートの各ウェルに移します。
- インキュベーターで10分間インキュベートします。
- EBをP1000でウェルに対して10回以内で静かに上下にピペットで固定します。
- 手順3.2.4-3.2.5.を合計3回繰り返します。
注:EBの解離が困難な場合は、上記の手順を合計4回繰り返します。 - 解離したEBの各ウェルに5 mLの洗浄バッファーを添加します。
- 細胞を40 μmのストレーナーに通し、50 mLの遠心チューブに集めます。細胞懸濁液を10 μL採取して、細胞をカウントします。
注:単離の効率をテストするには、105 細胞/チューブを、後でフローサイトメトリーに使用する2つの異なるチューブ(未染色コントロールおよび事前ソートされたテストサンプル)に移します(ステップ4.3.9-4.3.13で説明)。6ウェルプレートの場合、ろ過後に~106個の細胞 を回収する必要があります。 - 細胞を300 × gで10分間スピンダウンします。
- 細胞を300 μLの洗浄バッファーに再懸濁し、ピペッティングを数回静かに行い、凝集液がないことを確認します。製造元のプロトコルに従ってください( 材料表を参照)。
- 流体チップへのCD34+ 細胞播種
注:プロトコルで使用される流体チップは、チャネルの高さが0.6 mm、長さが50 mmで、総成長面積は2.5 cm2 です(補足図S1)。このタイプのチップは、150μLの細胞懸濁液の総量で播種されます。 異なるチップを使用することができ、播種の量と細胞密度は増殖領域に応じて適合させる必要があります。使用する細胞株とその増殖に応じて、追加の最適化が必要になる場合があります。- 単離したCD34+ 細胞を、Mix 4サイトカインを含む予熱したSFM-34培地300 μLに再懸濁します。
- 10 μLの細胞懸濁液を採取し、細胞をカウントします。
- SFM-34を添加した150 μLの最終容量で2.5×105 細胞を再懸濁します。0.5 μL の iRock を添加します。
注:単離の効率をテストするには、105 細胞/チューブを、後でフローサイトメトリーに使用するチューブ(ソート後のテストサンプル)に移します(ステップ4.3.9-4.3.13で説明)。 - P200の先端をチャネルの端にあるリザーバー内に置いて、流体チップからラミニンをゆっくりと吸引します。
注意: 液体の収集が難しい場合は、チップの片側をゆっくりと持ち上げて、液体が反対側のリザーバーに移動するのを助けます。 - 細胞懸濁液をチャネルに着実に加えて、気泡が形成されないことを確認します。
注意: 手順3.3.4〜3.3.5をすばやく静かに実行して、ラミニンの乾燥とチップのチャネルでの気泡の形成を防ぎます。気泡が形成された場合は、チップの片側を持ち上げ、スライドを軽くたたいて気泡を動員します。貯水池に到達すると、空気界面に上昇し、チャネルに入ることができないはずです。 - チップをインキュベーターに移し、細胞がチャネルに完全に付着して細長く見えるように一晩放置します。
- 細胞が完全に付着したら、ステップ3.3.4と同様に培地を吸引し、サイトカインを添加したSFM-34 200 μLと交換します。
- これ以降は、細胞が90%〜100%の濃度に達するまで、毎日培地を交換してください。
4. 内皮細胞への連続フローの応用 - Aorta-on-a-chip
- 材料と試薬を準備します。
- 表2に従って、18 mLのSFM-34培地にMix 4サイトカインを添加してMix 4 SFM-34培地を調製し、ガス交換を容易にするために蓋を少し緩めてインキュベーター内の50 mLチューブに入れます。
- 選択した灌流セットと流路系セットアップに使用するチューブをインキュベーターに入れて脱気します。
- 流体システムアセンブリ
- 灌流セットをメーカーのプロトコルに従ってユニットに取り付けます。
メモ: システムには必ずクランプを使用してください。このステップでスライドクランプを使用する場合は、チップに接続する前にチューブ上でスライドさせる必要があります。 - 新しい流路チップを取り付け、サイトカインを添加したSFM-34培地を添加し、フード内の無菌条件下で両方のリザーバーを満たします。
- 気泡除去プログラムとキャリブレーションステップを実行します。
- セットが接続された流体ユニットをインキュベーターから取り外し、フードに移します。インキュベーターから細胞を含むチップも取り出します。
- テストチップの両側にチューブをクランプします。
- テストチップからチューブを取り外します。
注意: チューブの端にあるルアーコネクタに気泡がないことを確認してください。気泡が見える場合は、P200ピペットを使用して気泡を慎重に吸引し、必要に応じて培地を追加して、コネクタが培地で満たされていることを確認します。 - セルを含むチップをチューブに接続します。
- クランプを取り外すか開きます。
- システムをインキュベーターに移し、エアポンプを流体ユニットに接続します。
- ポンプ専用ソフトウェア(補足図S2)を使用して、 表3に示すせん断応力を徐々に増加させて、事前に選択したプログラムを開始します。
注:必要な特定の実験によっては、刺激プログラムを最適化する必要がある場合があります。ここで説明するのは、胎児循環の開始時に背側大動脈の壁が経験すると計算されたせん断応力を模倣した、5 dyn/cm2の最終値につながる漸進的なせん断応力の増加 である9。使用される最終的なせん断応力とは無関係に、セルがチップから剥離することなく力に適応できるように、時間の経過とともに徐々に増加させる必要があります。選択した刺激プロトコルが3日を超える場合は、通常18 mLに添加されるMix 4サイトカインを含むSFM-34を1 mL添加して、サイトカインをシステムに補充する必要があります。これを行うには、ポンププログラムを速やかに停止し、500 μLの添加培地を流路セット内の2本のシリンジのそれぞれに加えます。
- 灌流セットをメーカーのプロトコルに従ってユニットに取り付けます。
- 解析用細胞採取
- 解離バッファーをウォーターバスで予温します。
- インキュベーターから流体ユニットを取り外し、フードに移動させます。
- チップの両側にあるチューブをクランプし、チップのリザーバーからチューブを取り外します。
- チップから培地を静かに取り出し、DPBS Ca 2+ Mg2+と交換して細胞を洗浄します。
注:PBSで洗浄するこのステップは、細胞が剥離し始めたらスキップできます。 - 150 μLの解離バッファーを静かに添加し、37°Cで3分間インキュベートします。
注:細胞が単一で分離しているかどうかを顕微鏡で確認してください。それ以外の場合は、さらに2分間インキュベートします。チップはピペッティングによる細胞の剥離を補助することができないため、培地を吸引する前に細胞をチャネルから完全に剥離することが不可欠です。細胞を剥離するために、トリプシンやEDTAベースの緩衝液など、他の溶液を採用することができます。 - 1つのリザーバーから細胞を含む解離バッファーを回収し、15mLの遠心分離管に移し、DPBSでチャネルを1回洗浄して、分離したすべての細胞を回収します。
- 細胞の入った15 mLチューブに1 mLの洗浄バッファーを加え、10 μLを取って細胞をカウントします。
- 細胞懸濁液をフローサイトメトリーチューブで分割し、試験管あたり10〜5 個の細胞を持つようにします。
- チューブを300 × gで5分間回転させます。
- 染色する試験管ごとに50μLになるように染色液を調製します。CD34 PerCP-efluor710またはCD34-PEをそれぞれ1:100および1:200希釈で添加します。
- 細胞を50 μLの染色液に再懸濁し、4°Cで30分間インキュベートします。
- 2 mLの洗浄バッファーを添加して細胞を洗浄し、300 × gで5分間泳動します。
- ペレットを100 μLの染色液に再懸濁し、フローサイトメーターを使用してデータを取得します。
注:細胞は、150 μL の RNA 溶解バッファーを使用して RNA 抽出のためにチップ内で直接溶解したり、DPBS 中の 4% パラホルムアルデヒドを使用して室温で 10 分間イメージング用に固定したりすることもできます。
- 細胞配向解析
- 画像を解析し、FIJI23 (補足図S3)を用いて細胞配向の変化を定量化します。
- [分析] |ツール |ROIマネージャーメニュー。
- 多角形選択ツールを使用してセルの等高線を手動で描画し、[追加] をクリックするか、CTRL+T ショートカットを使用して、ROI マネージャーに追加します。
- 各 ROI の方向を測定するには、[ 分析] |[測定 ]メニューを設定します。
- 測定値をすべての ROI に適用します 。 ROIマネージャーのマルチメジャーコマンド。
注: この手順では、各 ROI に楕円を当てはめ、長楕円軸と短楕円軸の長さと角度を含むテーブルを生成します。 - テーブルをCSVファイルにエクスポートして、他のソフトウェアにインポートしてプロットします。
注: プロットに使用されるスクリプトは、https://gist.github.com/nicolaromano/708b3231d730ee7f70763a7cf885
0ddcです。
- 画像を解析し、FIJI23 (補足図S3)を用いて細胞配向の変化を定量化します。
結果
ここでは、iPS細胞由来の内皮細胞の分化とメカノ刺激のためのプロトコルについて述べ、機械的手がかりに対する反応を研究することを可能にします(図1)。このプロトコルは機能的にmechanosensitive endothelialセルの生産で起因する。ここでは、代表的な結果を提供し、分化中のサイトカイン刺激に細胞がどのように反応するかを評価するために、予想される表現型について説明します。
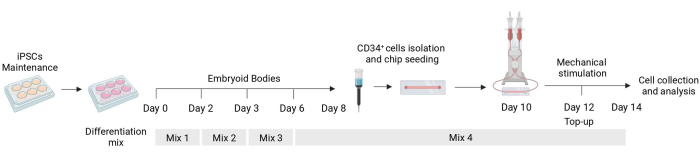
図1:分化および機械的刺激プロトコルの概略図。 サイトカインのさまざまなミックスのタイミング、CD34+細胞の単離、流体チップの播種、および機械的に刺激された細胞の最終分析を示す分化プロトコルの概略図。この図の拡大版をご覧になるには、ここをクリックしてください。
iPS細胞の培養
プロトコルは、自己複製状態で正しく増殖しているiPS細胞から開始することが重要です。文化の質を示す良い指標は、その成長の速さです。融解後、細胞が良好な分化を確実にする正しい増殖段階に達するまでに2〜3週間かかる場合があります。細胞が週に2回、1:6の比率で継代され、ほぼ完全なコンフルエントに達すると、継代が必要なその日に分化する準備が整います。
iPS細胞の内皮細胞への分化
分化の最初のステップは、胚様体(EB)の形成で構成され、細胞株に依存し、使用する特定の細胞株に対して何らかの最適化が必要な場合があります。プロトコルステップ1.3.2.2-1.3.2.4に記載されている解離は、解離試薬とのインキュベーションとその後のパスツールピペットとの解離を減少または延長することによって変更できます。さらに、このステップには、切削工具またはP100ピペットチップによるコロニーの物理的解離に加えて、他の解離試薬を使用することができる。良質のEBは、分化の2日目までに明確なエッジを示し、顕微鏡で観察すると透明で明るく見えます。暗い領域は、EB内の細胞死を示している可能性があります(図2)。
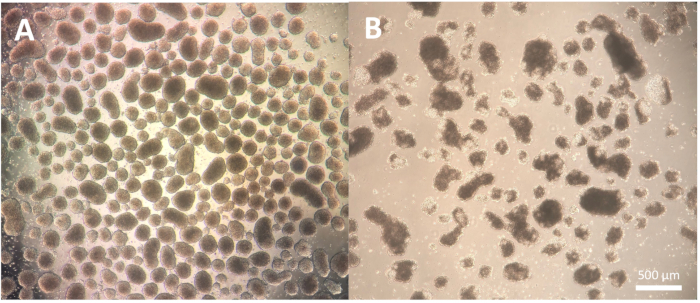
図2:胚様体の形態。 (A)2日目の胚様体は、明確に定義された外縁と一貫したサイズを示しています。(B)質の悪い2日目の胚様体は、構造の解離につながる広範な細胞死を示しています。スケールバー = 500 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。
2日目に、EBにCHIR99021を添加するとGSK-3タンパク質が阻害され、Wnt経路が活性化されます。細胞株が異なれば、CHIR処理に対する反応も異なるため、8日目に得られたCD34+ 細胞の数を異なる濃度で定量することにより、これを検証する必要があります(図3)。
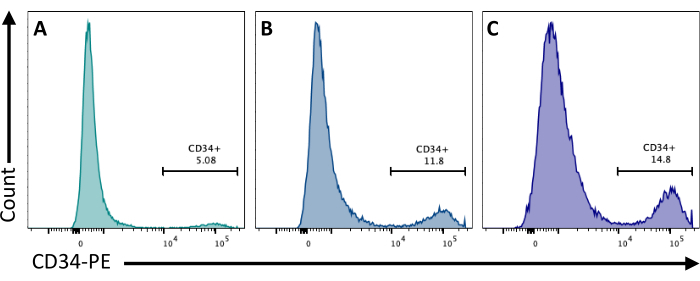
図3:異なるCHIR処理による内皮細胞の分化。 内皮細胞の関与は、2日目に(A)3 μM、(B)5 μM、および(C)7 μMでCHIR処理した後、CD34膜発現による分化の8日目にフローサイトメトリーによって定量化されました。 フローサイトメトリーのデータは、5つのレーザーサイトメーターと専用ソフトウェアを使用して取得しました( 材料表を参照)。 この図の拡大版をご覧になるには、ここをクリックしてください。
CD34+ 細胞単離
磁気ビーズを使用したCD34+濃縮により、カラムの溶出後に少なくとも80%のCD34+が得られることを検証することが重要です。十分な純度を確保するために、磁気単離から得られた細胞のアリコートをフローサイトメトリーで分析し、磁気濃縮に使用した抗体クローンとは異なる抗体クローンを使用するようにしてください。ここでは、4H11 クローンを使用し、濃縮後に ~85% の純度を達成しました(図 4)。
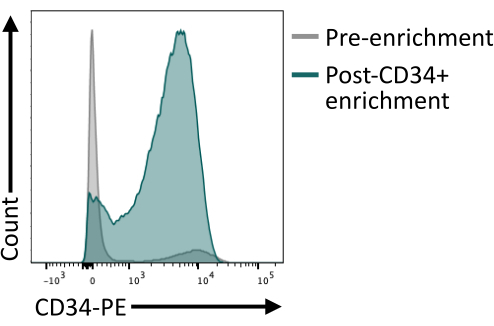
図4:磁気選別による濃縮前後のCD34の膜発現。 8日目の解離した胚様体(灰色)と磁気濃縮後の細胞(緑色)をCD34発現について染色し、フローサイトメトリーで分析したところ、ソーティング後の濃縮が成功したことが示されました。フローサイトメトリーのデータは、5 台のレーザーサイトメーターと専用ソフトウェアを使用して取得しました( 材料表を参照)。 この図の拡大版をご覧になるには、ここをクリックしてください。
細胞を流路に播種する
流路に細胞を播種する場合、内皮細胞の接着と増殖を追跡することが重要です。播種後、細胞がチャネルに完全に接着するまでに~5時間かかります(図5A)。この段階では、接着性を改善するために代替コーティング溶液をテストすることもできます。試験した細胞が機械感受性であり、したがって機械的刺激に応答できることを確認するために、細胞の配向を経時的に試験することができる。刺激を受ける前の細胞はランダムな向きを示し(図5Aおよび図5C)、流れの方向に平行に向きを変えます(図5B、C)。ここで説明するプロトコルでは、チャネルから細胞を採取して下流の解析、例えばフローサイトメトリーを行い、膜免疫表現型を研究し、刺激された細胞の内皮の同一性を得ることができます(図5D、E)。
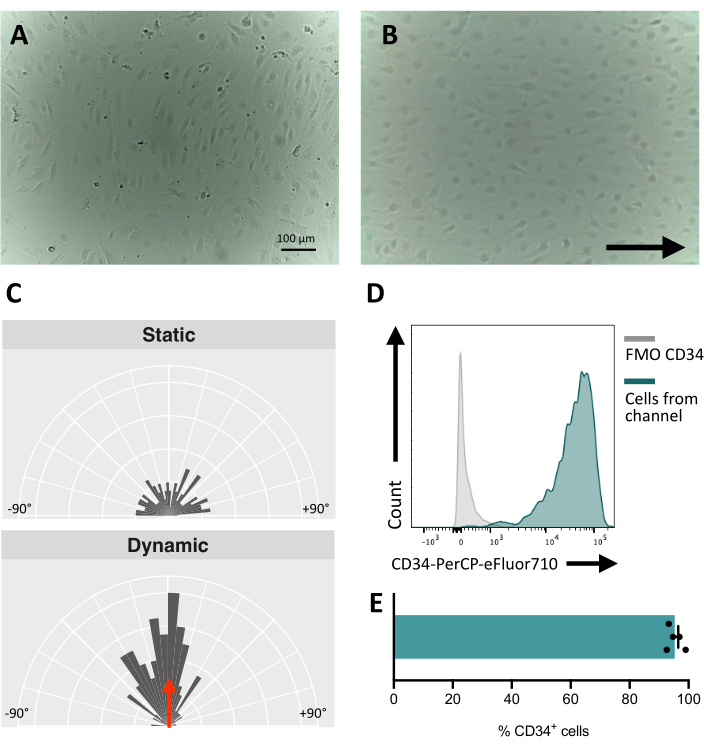
図5:ヒトiPS細胞由来内皮細胞の機械応答性 (A)播種後48時間で単離されたCD34+ 細胞のコンフルエント層。(B)動的培養下で3日間、内皮細胞の配向層を変更した。(C)5日間の動的培養後の内皮細胞の配向解析。(D)フロー下で5日間培養した細胞のCD34発現プロファイル。(E)流路から回収した細胞集団のCD34+ 細胞の割合。画像は倒立インキュベーター内顕微鏡を使用して撮影しました。フローサイトメトリーのデータは、5 台のレーザーサイトメーターと専用ソフトウェアを使用して取得しました( 材料表を参照)。スケールバー = 100 μm (A,B)。 この図の拡大版をご覧になるには、ここをクリックしてください。
| 試薬 | 在庫濃度 | 追加されたボリューム | 最終濃度 |
| イスコーブ修正ダルベッコ培地(IMDM) | - | 333 mLの | - |
| ハムのF-12栄養混合物(F-12) | - | 167 mLの | - |
| N-2サプリメント(×100) | 100倍 | 5 mLの | 1倍速 |
| B-27サプリメント(×50) | 50倍 | 10 mLの | 1倍速 |
| アスコルビン酸 | 10 mg/mL | 1.25メートル | 25 μg/mL |
| α-モノチオグリセロール(MTG) | 11.5メートル | 19.5μL | 448.5μM |
| ヒト血清アルブミン | 100 mg/mL | 2.5 mLの | 0.5 mg/mL |
| ホロトランスフェリン | 100 mg/mL | 0.75 mLの | 150 μg/mL |
表1:500 mLの無血清分化(SFD)培地の組成とレシピ。
| 差別化の日々 | サイトカインミックス | サイトカイン | 最終濃度 |
| 0日目 - 2日目 | ミックス1 | BMP4の | 20 ng/mLの |
| 2日目 | ミックス2 | CHIR99021 | 7 μM |
| 3日目以降 | 3と4を混ぜる | VEGFの | 15 ng/mL |
| bFGFの | 5 ng/mL | ||
| 6日目以降 | ミックス4 | IL6の | 10 ng/mL |
| FLT3L型 | 10 ng/mL | ||
| IGF1の | 25 ng/mL | ||
| IL11の | 5 ng/mL | ||
| SCFの | 50 ng/mLの | ||
| 欧州特許庁(EPO) | 3 U/mL | ||
| TPOの | 30 ng/mL | ||
| IL3の | 30 ng/mL |
表2:内皮細胞の分化に用いたサイトカインの混合物、SFD培地に添加した日数、および最終濃度。
| せん断応力(dyn/cm2) | 時間(h) |
| 0.5 | 1 |
| 1 | 1 |
| 1.5 | 1 |
| 2 | 1 |
| 2.5 | 1 |
| 3 | 1 |
| 3.5 | 1 |
| 4 | 1 |
| 4.5 | 1 |
| 5 | 実験終了まで |
表3:動的培養のせん断応力値とその適用期間。
補足図S1:このプロトコルに使用されるチップとチューブの形状と寸法。このファイルをダウンロードするには、ここをクリックしてください。
補足図S2:各ステップの説明を含むエアポンプを制御するソフトウェアのステップバイステップガイド。このファイルをダウンロードするには、ここをクリックしてください。
補足図S3:FIJIを用いた方位解析の手引きで、セル形状の図面、楕円フィッティング、最終測定値を示す。このファイルをダウンロードするには、ここをクリックしてください。
補足表S1:分化プロトコルで使用されるサイトカインのユニットサイズ、再懸濁量、およびストック濃度。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
私達がここに記述するプロトコルは制御されたせん断の圧力によって仲介される機械刺激への応答の調査および人間の多能性幹細胞からのmechanosensiveなendothelialセルの作成を可能にする。このプロトコルは完全にサイトカインベースであり、細胞治療用の細胞産生への翻訳の可能性についてGMP試薬と完全に互換性があります。
ヒトiPS細胞の誘導は、胚発生の初期段階の機器モデルを提供し、他の方法ではin vivoで研究することが困難なプロセスの研究を可能にします24。実際、研究に利用できるヒト胚組織は、循環を欠いた胚から採取されており、これは機械的な手がかりによって制御される分子シグネチャーに大きな影響を与える可能性があります。ここで説明するアプローチにより、せん断応力に対する細胞応答のライブイメージングとリアルタイム研究が可能になります。ヒトiPS細胞と流路系の組み合わせは、循環の開始が心血管系および血液系の確立をリモデリングおよび制御する際に、発生中の胎児組織の限られた可用性とアクセス不能を克服する研究モデルを提供します3,9,10,25。
プロトコルの限定はこのプロトコルから得られるendothelialセルが成長のティッシュにある異なったendothelialセルのさまざまな同一性を反映しないかもしれないことである。この制限を克服するために、所望の同一性または組織特異的表現型を得るために、流体刺激に先行する分化過程において、サイトカインの特異的な組み合わせが必要になる場合がある26。内皮サブセットの単離は、単離ステップ中に、より精緻な免疫表現型を用いて得ることができる。このプロトコルはCD34の表現にだけ基づいて内皮細胞を隔離し、それにより蛍光活動化させたセルソーティング(FACS)の代りにコラムの隔離を可能にする;これにより、細胞死と汚染のリスクが軽減されます。さらに、このプロトコルは、層流によって媒介されるせん断応力の役割を研究するために特別に設計されています。別の流体アプローチを使用して、伸張や圧縮などの他の機械的手がかりや、摂動や乱れた流れなどの他のタイプの流れの影響を研究する必要があります。
iPS細胞由来の内皮細胞は、胎児の背側大動脈で観察されるものと類似した不均一な動静脈細胞の同一性27を模倣していることを以前に示しました28,29,30。これは、血管の発達と細胞の仕様の文脈で特に重要であり、血液循環によって制御されることが知られています。さまざまなモデルでの研究では、循環の欠如が動静脈の仕様の変化をもたらすことが示されました11,14,31。機械的な手がかりと細胞の仕様を結びつけるメカニズムはまだ不明であり、ここで説明するパイプラインは、in vivoでテストできなかった洗練された機能研究を可能にします。
このパイプラインは、市販の流路を用いてヒトiPS細胞由来の内皮細胞の産生と刺激を記述しており、広く使用されているポリジメチルシロキサン(PDMS)デバイス12のようにデバイスを鋳造する必要性を回避している。さらに、PDMSチップを使用すると、刺激された細胞の収集が特に困難になりますが、このプロトコルでは、細胞をチャネルから簡単に取り出すことができます。これにより、分析能力が大幅に向上し、プロテオミクス解析やトランスクリプトーム解析、フローサイトメトリー、機能アッセイなど、さらなる培養や in vivo アッセイが必要な場合のあるその後の解析が可能になります。
開示事項
著者には開示すべき利益相反はありません。
謝辞
この研究は、欧州血液学会のResearch Advanced Grant 2021、American Society of HematologyのGlobal Research Award 2021、Welcome Trustとエジンバラ大学が資金提供するInternal Strategy Support Fund ISSF3の支援を受けました。フローサイトメトリー解析のサポートをしてくれたフローサイトメトリー施設のフィオナ・ロッシに感謝します。オープンアクセスの目的で、著者はクリエイティブ・コモンズ表示(CC BY)ライセンスを、この投稿から生じる著者が承認した原稿のバージョンに適用しています。
資料
| Name | Company | Catalog Number | Comments |
| 0.6 Luer uncoated slide | ibidi | IB-80186 | |
| 25% BSA | Life Technologies | A10008-01 | |
| 6-well plates | Greiner Bio-one | 657160 | |
| Accutase | Life Technologies | A1110501 | Cited as Dissociation reagent |
| Ascorbic acid | Merck | A4544-100G | |
| Aspiration pipette | Sardtedt | 86.1252.011 | |
| B27 supplement | Life Technologies | 17504044 | Cited as Neuronal cell culture supplement (50x) |
| BD FACS DIVA | BD Biosciences | Version 8.0.1 | Cited as flow cytometry software |
| BD LSR Fortessa 5 Laser | BD Biosciences | ||
| bFGF | Life Technologies | PHG0021 | |
| CD34 Microbead kit | Miltenyil Biotec | 30-046-702 | |
| CD34 PE clone 4H11 | Invitrogen | 12-0349-42 | |
| CD34 PerCP-eFluor 710 clone 4H11 | Invitrogen | 44-0349-42 | |
| Cellstar cell-repellent surface 6-well plates | Greiner Bio-one | 657970 | Cited as cell-repellent plate |
| CHIR99021 | Cayman Chemicals | 13122-1mg-CAY | |
| Cryostor CS10 cell cryopreservation | Merck | C2874-100ML | Cited as Cryopreservation solution |
| Dimethyl Sulfoxide | VWR | 200-664-3 | Cited as DMSO |
| DMEM/F-12 | Life Technologies | 10565-018 | |
| DPB Ca2+ Mg2+ | Life Technologies | 14080055 | |
| DPBS | Life Technologies | 14200075 | |
| EASY Strainer 40 μm | Greiner Bio-one | 542040 | |
| EDTA | Life technologies | 15575020 | |
| FcR Blocking Reagent | Miltenyil Biotec | 130-059-901 | |
| Fiji | Version 1.53c | ||
| Flow Jo | Version 10.7.1 | Cited as flow cytometry sanalysis oftware | |
| FLT3L | Peprotech | 300-19-10uG | |
| Fluidic unit | ibidi | 10903 | |
| GlutaMax | Life Technologies | 35050038 | Cited as L-glutamine supplement |
| Ham F-12 | Life Technologies | 11765054 | |
| Holo-transferrin | Merk | T0665-500MG | |
| Human Serum Albumin | Fujifilm UK LTD | 9988 | |
| Ibidi Pump system | ibidi | 10902 | Cited as Pump system |
| IMDM | Life Technologies | 12440053 | |
| Inverted microscope | ioLight/Thisle Scientific | IOL-IO-INVERT | Cited as inverted in-incubator microscope |
| Lyophilised BSA | Merck | A2153-100G | |
| MiniMACS Separator | Miltenyil Biotec | 130-042-102 | Cited as Magnetic separator |
| MS Columns | Miltenyil Biotec | 130-042-201 | Cited as Magnetic column |
| MTG | Merck | M6145-25ML | |
| N2 supplement | Life Technologies | 17502048 | |
| Notebook for pump system | ibidi | 10908 | |
| Paraformaldehyde 37-41% | Fisher Chemicals | F/1501/PB15 | |
| Pastette | Greiner Bio-one | 612398 | |
| Pen/Strep | Gibco | 15070063 | |
| Perfusion Set YELLOW/GREEN: 50 cm, ID 1.6 mm, 10 mL reservoirs | Ibidi | IB-10964 | Cited as Perfusion set |
| Polystyrene Round Bottom Tubes | Falcon | 352008 | Cited as Flow cytometry tubes |
| Prism 9 | Verison 9.4.0 | ||
| Pump control software | ibidi | version 1.6.1 | Cited as Pump software |
| ReLeSR | Stem cell tecchonologies | 5872 | Cited as Detaching solution |
| rhBMP4 | R&D | 314-BP-010 | |
| rhEPO | R&D | 287-TC-500 | |
| rhIGF1 | Peprotech | 100-11-100uG | |
| rhIL11 | Peprotech | 200-11-10uG | |
| rhIL3 | Peprotech | 200-03-10uG | |
| rhIL6 | R&D | 206-IL-010 | |
| rhLaminin-521 | Life technologies | A29248 | Cited as Laminin |
| rhSCF | Life Technologies | PHC2111 | |
| rhTPO | R&D | 288-TPN-025 | |
| rhVEGF | R&D | 293-VE-010 | |
| RLT Lysis Buffer | Qiagen | 79216 | |
| Serial Connector for µ-Slides: Sterile, Sterile | ibidi | IB-10830 | |
| StemPro-CD34 SFM media | Life Technologies | 10639011 | Cited as Serum-Free media for CD34+ cells (SFM-34) |
| StemPro-CD34 Nutrient Supplement | Life Technologies | 10641-025 | Cited as 34 nutrient supplement |
| StemPro hESC SFM | Life Technologies | A1000701 | Cited as Culture media |
| StemPro supplement | Life Technologies | A10006-01 | |
| Vitronectin (VTN-N) recombinant human protein, truncated | Invitrogen | A31804 | |
| Y-27632 dihydrochloride | Tocris | 1254 | Cited as iRock |
| β-Mercaptoethanol | Gibco | 21985023 |
参考文献
- Copp, A. J. Death before birth: clues from gene knockouts and mutations. Trends in Genetics. 11 (3), 87-93 (1995).
- Ji, R. P., et al. Onset of cardiac function during early mouse embryogenesis coincides with entry of primitive erythroblasts into the embryo proper. Circulation Research. 92 (2), 133-135 (2003).
- Peacock, H. M., Daems, M., Jones, E. A. V. Hemodynamic control of endothelial cell fates in development. Cardiac and Vascular Biology. 8, 127-166 (2021).
- Chong, D. C., Koo, Y., Xu, K., Fu, S., Cleaver, O. Stepwise arteriovenous fate acquisition during mammalian vasculogenesis. Developmental Dynamics. 240 (9), 2153-2165 (2011).
- Jaffredo, T., Gautier, R., Eichmann, A., Dieterlen-Lièvre, F. Intraaortic hemopoietic cells are derived from endothelial cells during ontogeny. Development. 125 (22), 4575-4583 (1998).
- Zovein, A. C., et al. Fate Tracing reveals the endothelial origin of hematopoietic stem cells. Cell Stem Cell. 3 (6), 625-636 (2008).
- Bertrand, J. Y., et al. Haematopoietic stem cells derive directly from aortic endothelium during development. Nature. 464 (7285), 108-111 (2010).
- Boisset, J. C., et al. In vivo imaging of haematopoietic cells emerging from the mouse aortic endothelium. Nature. 464 (7285), 116-120 (2010).
- Adamo, L., et al. Biomechanical forces promote embryonic haematopoiesis. Nature. 459 (7250), 1131-1135 (2009).
- Diaz, M. F., et al. Biomechanical forces promote blood development through prostaglandin E2 and the cAMP-PKA signaling axis. Journal of Experimental Medicine. 212 (5), 665-680 (2015).
- North, T. E., et al. Hematopoietic stem cell development is dependent on blood flow. Cell. 137 (4), 736-748 (2009).
- Lundin, V., et al. YAP regulates hematopoietic stem cell formation in response to the biomechanical forces of blood flow. Developmental Cell. 52 (4), 446.e5-460.e5 (2020).
- Li, J., et al. Mimicry of embryonic circulation enhances the hoxa hemogenic niche and human blood development. Cell Reports. 40 (11), 111339 (2022).
- Azzoni, E., et al. The onset of circulation triggers a metabolic switch required for endothelial to hematopoietic transition. Cell Reports. 37 (11), 110103 (2021).
- Li, Y. S. J., Haga, J. H., Chien, S. Molecular basis of the effects of shear stress on vascular endothelial cells. Journal of Biomechanics. 38 (10), 1949-1971 (2005).
- Batsivari, A., et al. Understanding hematopoietic stem cell development through functional correlation of their proliferative status with the intra-aortic cluster architecture. Stem Cell Reports. 8 (6), 1549-1562 (2017).
- Canu, G., et al. Analysis of endothelial-to-haematopoietic transition at the single cell level identifies cell cycle regulation as a driver of differentiation. Genome Biology. 21 (1), 157 (2020).
- Luo, W., et al. Arterialization requires the timely suppression of cell growth. Nature. 589 (7842), 437-441 (2020).
- Yang, C. -. T., et al. Activation of KLF1 enhances the differentiation and maturation of red blood cells from human pluripotent stem cells. Stem Cells. 35 (4), 886-897 (2017).
- Lopez-Yrigoyen, M., et al. A human iPSC line capable of differentiating into functional macrophages expressing ZsGreen: A tool for the study and in vivo tracking of therapeutic cells. Philosophical Transactions of the Royal Society B: Biological Sciences. 373 (1750), 20170219 (2018).
- Lopez-Yrigoyen, M., et al. Production and characterization of human macrophages from pluripotent stem cells. Journal of Visualized Experiments. 2020 (158), (2020).
- Fidanza, A., et al. Single cell analyses and machine learning define hematopoietic progenitor and HSC-like cells derived from human PSCs. Blood. 136 (25), 2893-2904 (2020).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131 (5), 861-872 (2007).
- North, T. E., et al. Hematopoietic stem cell development is dependent on blood flow. Cell. 137 (4), 736-748 (2009).
- Nguyen, J., Lin, Y. Y., Gerecht, S. The next generation of endothelial differentiation: Tissue-specific ECs. Cell Stem Cell. 28 (7), 1188-1204 (2021).
- Petazzi, P., et al. Arterial cells support the development of human hematopoietic progenitors in vitro via secretion of IGFBP2. bioRxiv. , (2022).
- Crosse, E. I., et al. Multi-layered spatial transcriptomics identify secretory factors promoting human hematopoietic stem cell development. Cell Stem Cell. 27 (5), 822 (2020).
- Calvanese, V., et al. Mapping human haematopoietic stem cells from haemogenic endothelium to birth. Nature. 604 (7906), 534-540 (2022).
- Zeng, Y., et al. Tracing the first hematopoietic stem cell generation in human embryo by single-cell RNA sequencing. Cell Research. 29 (11), 881-894 (2019).
- Hwa, J. J., et al. Abnormal arterial-venous fusions and fate specification in mouse embryos lacking blood flow. Scientific Reports. 7 (1), 11965 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved