単一核の配列のための凍結した哺乳類ティッシュからの単一核の隔離のための簡単で、速く、部分的に自動化されたプロトコル
要約
この研究では、下流の単一核RNAシーケンシングのために、凍結した哺乳類組織から高品質の核を単離するための、シンプルで迅速、かつ部分的に自動化されたプロトコルについて説明しています。
要約
単一細胞および単一核のRNAシーケンシングは、トランスクリプトーム情報が豊富であるため、一般的なラボアプリケーションとなっています。特に、単核RNAシーケンシングは、解離が困難な組織における遺伝子発現を調べるのに有用です。さらに、このアプローチは、凍結(アーカイブ)資料にも対応しています。ここでは、市販の機器と試薬を使用して部分的に自動化された方法でダウンストリームの単一核RNAシーケンシングのために、凍結哺乳類組織から高品質の単一核を分離するプロトコルについて説明します。具体的には、ロボット解離装置を使用して組織の均質化を自動化および標準化し、その後、最適化された化学的勾配を使用して核をろ過します。最後に、自動蛍光セルカウンターを使用して、核を正確かつ自動的にカウントします。このプロトコルの性能はマウス頭脳、ラットの腎臓およびcynoquingsのレバーおよび脾臓のティッシュで実証される。このプロトコルは、広範な最適化を必要とせずに、さまざまな哺乳類組織に容易かつ迅速に適応でき、下流の単一核RNAシーケンシングに良質の核を提供します。
概要
シングルセル(sc)およびシングルコアス(sn)RNAシーケンシングは、バルクRNAシーケンシングと比較して遺伝子発現の分解能が高いため、分子生物学および細胞生物学で一般的に使用されるプロトコルになっています。しかし、固体組織から良質なシングルセルおよびシングル核調製物を単離することは依然として課題であり、sc/sn-RNAseq実験ではしばしば律速ステップとなります。実際、細胞/核懸濁液1,2,3,4,5,6,7,8,9,10,11,12,13,14,15を得るために、さまざまな化学的および機械的手順を使用する多数のプロトコルが開発されています.さらに、このような製剤を破片や塊などから浄化するための戦略は、フローソーティングからろ過、洗浄まで多岐にわたります。このようなプロトコルは、多くの場合、手作業(ユーザー関連のばらつきにつながる)、時間がかかる(細胞/核の生存率の低下につながる)、および/または細胞/核の選別のためにフローサイトメーターへのアクセスを必要とする場合があります。この研究は、ダウンストリームのRNAシーケンシングアプリケーションのために、凍結した哺乳類組織からシンプル、迅速、かつ部分的に自動化された単一核分離プロトコルの開発に焦点を当てました。細胞単離とは対照的に、凍結組織の使用と互換性があり、サンプルの収集/処理をより実用化し、特に経時的な実験においてサンプルの偏りのないバッチ処理を可能にするため、特に核単離に特に焦点を当てました。さらに、核トランスクリプトームは細胞トランスクリプトームを完全には反映していませんが、いくつかの研究により、細胞型の割合は6,16,17,18,19変動する可能性があるにもかかわらず、単一核RNAシーケンシングデータは、細胞タイプ同定のためのシングルセルRNAシーケンシングデータに匹敵することが示されています。
核単離は、1)核を放出するための組織の機械的または化学的破壊、2)破片や塊のクリーンアップ、3)下流アプリケーションの準備のための核の正確なカウント、といういくつかのステップで構成されています。多くのプロトコルでは、ステップ1では、組織を破壊するためにDounceホモジナイザーの使用が頻繁に含まれます3,20。あるいは、化学的方法を使用することもできますが、これらは多くの場合、異なる組織に対して最適化する必要があります2,5,6。手作業による組織破壊手順では、オペレーターによるばらつきが生じやすく、核の質や収量にばらつきが生じることがわかっています。技術的なばらつきを最小限に抑え、組織間で機能するより一貫性のある再現性のあるプロトコルを持つために、市販のロボット組織解離器を使用するプロトコルが開発されました21。ステップ2では、通常、バッファー交換が核を洗浄する最も簡単な手段ですが、デブリをより完全に除去するために、比較的短いショ糖グラジエント遠心分離ステップの使用を採用しました。特に脳組織では、より効果的なミエリン除去のために、スクロースグラジエントの代わりにシリカコロイドグラジエントを使用しています。最後に、カウントの場合、血球計算盤の使用は、核をカウントおよび目視検査するためのゴールドスタンダードです。我々のプロトコルでは、このステップは、市販の自動蛍光セルカウンター22を用いて確実に自動化することができる。このプロトコルはテスト済みで、異なる哺乳類種(ラット、マウス、および非ヒト霊長類)の脳、腎臓、脾臓、肝臓などのいくつかの凍結哺乳類組織と互換性があり、液滴ベースの商用プラットフォームを使用して下流の単一核RNAシーケンシングに高品質の核を提供します。プロトコルはティッシュの準備から単一核のRNAの配列のワークフローの開始におよそ75分を取る。
プロトコル
すべての動物実験は、動物保護に関するスイス連邦規則を厳格に遵守してバーゼルシュタットの州獣医当局の承認を得て、またはドイツの動物福祉法に準拠して施設動物管理および使用委員会の承認を得て実施されました。
1. 組織および試薬/機器の準備
- 洗浄と器具の準備
- ベンチトップとピンセットを70%エタノールとRNase除染溶液で洗浄します。遠心分離機を4°Cに予冷します。
- 核分離カートリッジを冷蔵庫で4°Cで少なくとも30分間予冷します。
- ロボット解離装置を起動し、画面右上のスライダーを冷却に設定し、それをクリックして冷却を開始し、スライダーがオレンジ色に見えるようにして、冷却をオンにします。付属の核保存試薬(NSR)ボトルと核分離バッファー(NIB)ボトルに十分な液体が残っており、適切に冷却されていることを確認してください。
- ドライアイスを入れた発泡スチロールの箱を用意し、シャーレとメスの刃をドライアイスで予冷します。
- バッファー調製
- 表1に示すように、 1.5 Mスクロースクッション溶液(SCS)を調製します。SCS を 2 mL の DNase/RNase チューブに 500 μL のアリコートに分配し、サンプルあたり 4 つの 500 μL SCS アリコートを得ます。さらに使用するまで、アリコートを氷上に保管してください。
- 脳組織を処理する場合は、代わりに、シリカコロイド原液をNSRで希釈し、RNase阻害剤を添加することにより、 表2に記載されているように18%シリカコロイド溶液を調製します。サンプルあたり 3 mL の 18% シリカコロイド溶液を調製し、氷上に保管します。
2. 組織のホモジナイズと核の単離
- サンプルを-80°Cの冷凍庫から取り出し、すぐにドライアイスの上に置きます。
- 予冷したシャーレまたはドライアイス上の金属板で、予冷したメスでサンプルを15〜50 mgの小片にカットします(まだ適切なサイズでない場合)。サンプルが関心のある臓器構造を代表するものになるように、サンプルを正しい方向に切断してください。
注:このプロトコルでは、15〜50 mgが核抽出に最適なサンプルサイズです。クリーンアップ後に良好な収率を達成するには、少なくとも25 mgのサンプルサイズが推奨されます。少量のサンプルには、ロボット解離装置で少量のインプットを処理するために最適化された特別なカートリッジが用意されています。低分子インプット核単離カートリッジを使用して、下流の単一核 RNA シーケンシングに十分な収量で、わずか 4 mg の組織サンプルを解離しました。ラット肝組織からの低インプットカートリッジを用いた核収量の例を 表3に示す。 - 核分離カートリッジを冷蔵庫から取り出し、開梱し、グラインダーを取り外し、15 μLのRNase阻害剤(40 U / μL)をカートリッジの底にピペットで移します。
注:核抽出中、ロボット解離器はNIBとNSRをカートリッジに添加し、合計容量を3 mLにします(少量の核抽出プロトコルを使用)。抽出前に15 μLのRNase阻害剤(40 U/μL)をカートリッジに添加することにより、懸濁液のRNAse阻害剤濃度は0.2 U/μLになります。 - ピンセットを使用してカートリッジの底に組織サンプルを置きます。最適な破壊効率を得るために、サンプルをカートリッジの中央に正確に配置しないでください。
- 装置で [Run a Protocol ]を選択し、左上隅にある [Nuclei ]オプションをクリックします。
- メニューから [Low Volume Nuclei Isolation ] プロトコルを選択し、[ Modify] をクリックして中断速度が fast に設定されていることを確認します。ドアを開けてカートリッジを機器にロードし、赤いノブを持ち上げてステージをスライドさせます。
- カートリッジを指定された場所に挿入し、カートリッジロックを回転させ、赤いノブがカチッと所定の位置に収まるまでステージをスライドさせます。ドアを閉め、 Nextをクリックして装置で核抽出を開始します。所要時間は約7分です。
- 実行が終了したら、赤いノブを持ち上げてステージを引き出し、カートリッジを機器から取り外します。すぐにカートリッジを氷の上に置きます。
- 脳以外のすべての組織について、ステップ 3.1 に進みます。脳サンプルの場合は、ステップ3.2に直接進んでください。
3. 核のクリーンアップ
- ショ糖グラジエントのクリーンアップ
注:脳組織の場合は、この手順をスキップして、手順3.2に直接進んでください。RNAの分解を最小限に抑えるために、すべてのクリーンアップステップは氷上で行われます。バッファーとチューブ、および遠心分離機は予冷する必要があります。すべての再懸濁および混合ステップは、ボルテックスによって核の品質と完全性が損なわれる可能性があるため、慎重なピペッティングのみによって行われます。- 解離剤カートリッジの丸いホイルをピペットチップで慎重に突き刺します。
注:解離後、得られた核懸濁液の容量は約2 mLです。スクロースグラジエントのクリーンアップを容易にするために、核懸濁液を 2 つの 900 μL アリコートに分割し、クリーンアップ中に合計 1.8 mL の核懸濁液を使用します。 - 核懸濁液の最初の 900 μL アリコートをカートリッジから取り出し、2 mL チューブで事前に調製した 500 μL の SCS アリコートに加えます。混合物が均一になるまでピペッティングでよく混合します。
- 1,400 μL の核懸濁液と SCS 混合物を取り除き、チューブを斜めに保持し、混合物を滴下して、はっきりと見える相分離を作成し、新しい 500 μL SCS アリコートに慎重に重ねます( 図 1A を参照)。
- チューブを慎重に閉じ、相分離を妨げずに氷上に戻します。
- ステップ 3.1.2-3.1.4 を 2 回目の 900 μL の懸濁液アリコートと新しい SCS アリコートで繰り返し、グラジエント遠心分離のために相分離がはっきりと見える 2 本のチューブをサンプルあたり 2 本用意します。
- チューブを予冷した遠心分離機に慎重に加え、4°Cで13,000 x g で15分間回転させます。
- その間に、NSRのアリコートにRNase阻害剤を添加することにより、 表4に記載のNSRを調製する。サンプルあたり 1 mL の NSR を調製します。
注:この時点で、シングルセル遺伝子発現試薬ゲルビーズを-80°Cの冷凍庫から取り出して室温(RT)に平衡化させ、テンプレートスイッチオリゴを低TEバッファーに再懸濁することができます。 - 遠心分離後、ペレットを乱すことなく両方のチューブから上清を取り除き、メーカーの推奨に従って、ペレットを氷冷NSR50 μLに慎重に再懸濁します。同じサンプルの 2 つのペレットを新しい 1.5 mL チューブにプールし、900 μL の氷冷 NSR を合計容量 1 mL に添加します。ピペッティングでよく混ぜます。
- サンプルを500 x g で4°C、5分間、スイングバケットローター遠心分離機で遠心分離します。
注:特に核収量が低いと予想される場合や少量の組織から始める場合は、核の損失を最小限に抑えるために、スイングバケットローターを使用することを強くお勧めします。 - それまでの間、 表5に示すように、0.04%ウシ血清アルブミン(BSA)および0.2 U/μLのRNase阻害剤を含む1x PBS(Ca2+およびMg2+を含まない)をサンプルあたり500 μL調製します。
- ペレットを廃棄せずに上清を慎重に除去し、上記で調製したPBS溶液100 μLにペレットを再懸濁します(1x PBS + 0.04% BSA + RNase阻害剤、0.2 U/μL)。
注:小さな組織サンプルの場合、核濃度が低い可能性があるため、単一核 RNA シーケンシングに十分な高濃度を確保するために、ペレットをわずか 50 μL の PBS 溶液に再懸濁することをお勧めします。 - 手順 4 に直接進みます。
- 解離剤カートリッジの丸いホイルをピペットチップで慎重に突き刺します。
- シリカコロイドグラジエントクリーンアップ
注:脳組織の場合、核懸濁液からミエリンや破片を除去するには、スクロースグラジエントよりもシリカコロイドグラジエントの方が適しています。すべてのクリーンアップステップは、RNAの分解を最小限に抑えるために氷上で実行されます。バッファーとチューブ、および遠心分離機は予冷する必要があります。すべての再懸濁および混合ステップは、ボルテックスによって核の品質と完全性が損なわれる可能性があるため、慎重なピペッティングのみによって行われます。- 解離剤カートリッジの丸いホイルをピペットチップで慎重に突き刺します。
- 核懸濁液をカートリッジから取り出し、5 mLチューブに加えます。
- 予冷した遠心分離機で、4°Cで5分間、500 x g で遠心分離します。
- ペレットを乱さずに上清を慎重に除去し、ペレットを氷冷18%シリカコロイド溶液1 mLに再懸濁します。
- さらに2 mLの18%シリカコロイド溶液を加えて総容量を3 mLとし、ピペッティングでよく混合します。
- ブレーキをオフにした状態で、スイングバケットローター内でサンプルを700 x g で4°C、5分間遠心分離します。
- その間に、NSRのアリコートにRNase阻害剤を添加することにより、 表4 に記載のNSRを調製します。サンプルあたり 1 mL の NSR を調製します。
注:この時点で、シングルセル遺伝子発現試薬ゲルビーズを-80°Cのフリーザーから取り出してRTに平衡化し、テンプレートスイッチオリゴを低TEバッファーに再懸濁することができます。 - 上に浮遊するミエリン層を乱すことなく、遠心分離機からサンプルを慎重に取り出します。
- まず、ミエリン層を上から取り除いて廃棄します。次に、ペレットを乱すことなく、上澄み全体を慎重に取り除きます。
注:ミエリン層は、1 mLのピペットチップに滅菌糸くずの出ないワイプを巻き付けて、1〜2 mLの上清とともにミエリン層を吸引することで簡単に除去できます。 - ペレットを、メーカーの推奨に従って1 mLの氷冷NSRに再懸濁します。
- サンプルを500 x g で4°C、5分間遠心分離機にかけ、スイングバケットローターで遠心分離します。
注:特に核収量が低いと予想される場合や少量の組織から始める場合は、核の損失を最小限に抑えるために、スイングバケットローターを使用することを強くお勧めします。 - それまでの間、 表5に示すように、0.04%ウシ血清アルブミン(BSA)および0.2 U/μLのRNase阻害剤を含む1x PBS(Ca2+およびMg2+を含まない)をサンプルあたり500 μL調製します。
- ペレットを乱さずに上清を慎重に除去し、上記で調製した100 μLのPBS溶液にサンプルを再懸濁します(1x PBS + 0.04% BSA + RNase阻害剤、0.2 U/μL)。
注:小さな組織サンプルの場合、核濃度が低い可能性があるため、単一核 RNA シーケンシングに十分な高濃度を確保するために、ペレットをわずか 50 μL の PBS 溶液に再懸濁することをお勧めします。
4.カウント
- 計数する各サンプルについて、核懸濁液 10 μL を 20 μL の PBS 溶液で希釈し、希釈率を 1:3 にします。
- 計数するには、25 μLのヨウ化プロピジウム(PI)染色溶液を蛍光カウンター計数プレートの混合ウェルに加えます。希釈した核懸濁液25 μLを加え、ピペッティングでよく混合します。染色した50 μLのサンプルをミキシングウェルからローディングウェルに移します。
- セルカウンターに計数プレートをロードし、カウントを開始します。
注:核数は、露光時間700msの赤色蛍光チャンネルから取得されます。このチャンネルは、顕微鏡下でノイバウアーチャンバーとトリパンブルー染色による手動カウントと相互比較することにより、正確な核カウントが得られるように最適化されました。高濃度では、核同士が非常に接近しているため、ソフトウェアが核を分離することは困難です。この場合、適切な希釈液でサンプルを再計数することをお勧めします。核の完全性と清浄度は、明視野画像または顕微鏡下で評価できます。 - サンプルをPBS(1x PBS + 0.04% BSA + RNase阻害剤、0.2 U/μL)で希釈し、単一核RNAシーケンシングに必要な濃度にします。
注:700-1,200 nuclei/μLの濃度は、単一核RNAシーケンシングに最適であると考えられています。細胞濃度を低くすると、700 核/μL など、周囲の RNA によるバックグラウンド汚染が減少する可能性があります。
5. ライブラリの準備
- サンプルあたり8000〜10,000核の核回収を目標とするメーカーのプロトコルを使用して、単一細胞遺伝子発現試薬で単一核RNAシーケンシングを実行します。
6. シーケンシング
- ペアエンド、デュアルインデックス、および次のシーケンシングリードを使用して、必要なシーケンシング深度でライブラリをシーケンシングします:リード1:28サイクル、i7インデックス:10サイクル、i5インデックス:10サイクル、リード2:90サイクル。
代表的な結果
このプロトコルの性能そして多様性は3つのB6マウスからの新しい凍結した頭脳の後頭部皮質のティッシュ、3つのWistarのラットからの新しい凍結した横断的に切られた腎臓のティッシュ、3つのモーリシャスのCynoquusのマカクからのアーカイブの(11歳の)レバーおよび脾臓のティッシュの単一核のRNAの配列を行うことによって実証される。すべての動物は灌流されていませんでした。.
図1B、Cに示すように、ブレブ、デブリ、凝集の兆候のない良質な原子核が得られました。スクロースグラジエントベースのろ過は、さまざまな密度、スピン速度、時間を試験し、顕微鏡下で核の純度/完全性を評価し、核のサイズ分布と収量を評価することにより、デブリの大部分を除去するように最適化されました(図1D)。これにより、1.5 M のスクロースグラジエント密度を選択し、15 分の短いスピン時間を使用することができました。次に、核の品質をさらに評価するために、10X Cell Rangerを使用してデータを前処理し、Besca23を使用してさらに下流のデータ解析を行いました。ミトコンドリア含有量が>5%の核(損傷/ストレスを受けた核である傾向があるため)をろ過し、500〜7,000個の遺伝子を持つ核(空の液滴と多重項を最小限に抑えるため)を保持しました。少なくとも30個の核に存在する遺伝子のみを含めました。大脳皮質サンプルあたり8,000個の核、腎臓、肝臓、脾臓サンプルあたり10,000個の核をターゲットとしました。濾過後、3つの脳サンプルから10,644個の高品質核、3つの腎臓サンプルから14,960個の高品質核、3つの肝臓サンプルから18,795個の高品質核、3つの脾臓サンプルから13,882個の高品質核が得られました。図2A、D、G、Jは、各サンプルのUMI数、遺伝子数、およびミトコンドリア含有量の分布を表すバイオリンプロットを示しています。すべての脳サンプルのカウント数の中央値は、7,563 UMI/核および3,208 遺伝子/核であった。すべての腎臓サンプルのカウント数の中央値は、3,841 UMI/核および1,915 遺伝子/核でした。すべての肝臓サンプルのカウント数の中央値は、2,649 UMI/核および1,676 遺伝子/核でした。すべての脾臓サンプルのカウント数の中央値は、1,609 UMI/核および1,138遺伝子/核でした。次に、非常に多様な遺伝子を使用してクラスターを生成し、既知のマーカー遺伝子17、24、25、26を使用してアノテーションしました。図2B、E、H、Kに見られるように、各組織から予想される細胞型を同定することができました。さらに、図2B、E、H、Kに見られるように、すべての動物がすべてのクラスターに寄与しており、プロトコルによってもたらされた技術的変動性が全体的に低いことを示しています。さらに、細胞の割合は、UMIおよび遺伝子数と同様に、組織タイプごとの3つのサンプルすべてで同等でした(図2A、C、D、F、G、I、J、L)。注目すべき例外は肝臓で、3つの肝臓サンプル間の肝細胞集団は比率とプロファイルが異なっていました。これは、動物間の生物学的な違い(性別、年齢、代謝状態)によるものと考えられます。
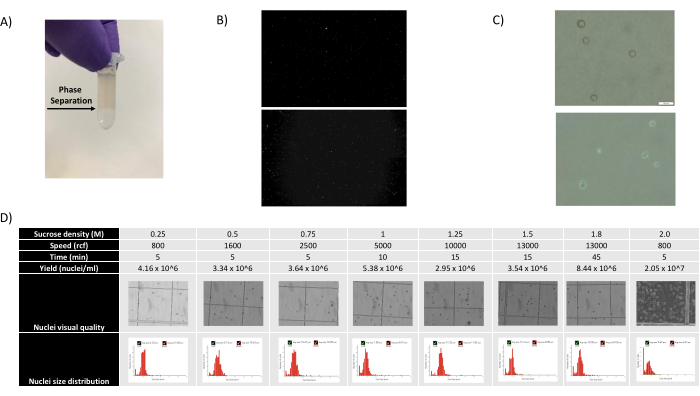
図1:核の質の評価とスクロースグラジエントの最適化 。 (A)スクロースグラジエント遠心分離中に予想される相分離を矢印で示しています。(B)プロトコールで得られたヨウ化プロピジウム染色ラットの腎臓(上)およびカニクイズ脾臓(下)の核の代表的な蛍光画像。(C)マウス肝臓(上)およびマウス脳(下)から単離された核の代表的な明視野顕微鏡画像、スケールバー500 μm。原子核の表面が規則的に滑らかであることは、核の質が良好であることを示しています。(D)ショ糖勾配の最適化。いくつかのショ糖密度、スピン速度、およびスピン時間を試験しました。各条件について、核、核サイズ分布、および核収量の明視野顕微鏡画像を示します。 この図の拡大版をご覧になるには、ここをクリックしてください。
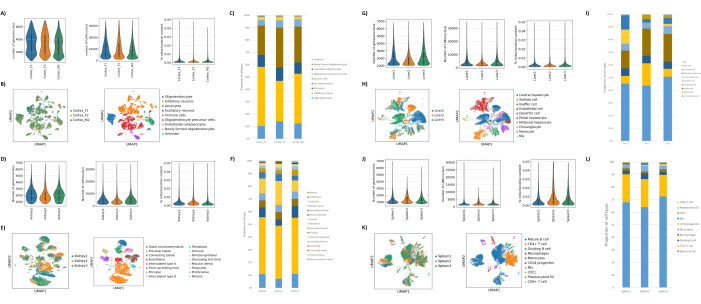
図2:マウス脳後頭皮質、ラット腎臓(皮質と延髄)、カニクイザルの肝臓と脾臓に関するsnRNAseqの代表的なデータ 。 (A)脳サンプルあたりの遺伝子/核、UMI/核、およびミトコンドリア含有量の割合を示すバイオリンプロット。(B)左パネル:脳内で同定されたクラスターに対する各サンプルの寄与を示すUMAPプロット。右パネル:脳組織のマーカー遺伝子に基づいてアノテーションされたクラスターの同一性を示すUMAP。(C)3つの脳サンプルで観察された細胞の割合。(D)腎臓サンプルあたりの遺伝子/核、UMI/核、およびミトコンドリア含有量の割合の分布を示すバイオリンプロット。(E)左パネル:腎臓で同定されたクラスターへの各サンプルの寄与を示すUMAPプロット。右パネル:腎臓組織のマーカー遺伝子に基づいてアノテーションされたクラスターの同一性を示すUMAP。(F)3つの腎臓サンプルで観察された細胞の割合。(G)肝臓サンプルあたりの遺伝子/核、UMI/核、およびミトコンドリア含有量の割合の分布を示すバイオリンプロット。(H)左パネル:肝臓で同定されたクラスターへの各サンプルの寄与を示すUMAPプロット。右パネル:肝臓組織のマーカー遺伝子に基づいてアノテーションされたクラスターの同一性を示すUMAP。(I)3つの肝臓サンプルで観察された細胞の割合。(J)脾臓サンプルあたりの遺伝子/核、UMI/核、およびミトコンドリア含量の割合の分布を示すバイオリンプロット。(K)左パネル:脾臓で同定されたクラスターへの各サンプルの寄与を示すUMAPプロット。右パネル:脾臓組織のマーカー遺伝子に基づいてアノテーションされたクラスターの同一性を示すUMAP。(L)3つの脾臓サンプルで観察された細胞の割合。 この図の拡大版をご覧になるには、ここをクリックしてください。
| コンポーネント | 在庫濃度 | サンプルあたりの容量 | 最終集中 |
| ショ糖クッション溶液 | 2メートル | 1500μL | 1.5メートル |
| ショ糖クッションバッファー | - | 500μL | - |
| ジチオスレイトール(DTT) | 1メートル | 2 μL | 1ミリメートル |
| RNAse阻害剤 | 40 U/μL | 10 μL | 0.2 U/μL |
表1:1.5Mスクロースクッション溶液(SCS)の調製。 この溶液は、ステップ 3.1 のクリーンアップ中のスクロースグラジエント遠心分離に使用され、プロトコルを開始する前に毎回新たに調製する必要があります。プロトコル中は、常にSCSを氷上に置いてください。この表に記載されているソリューションは、 材料表で参照されています。
| コンポーネント | 在庫濃度 | サンプルあたりの容量 | 最終集中 |
| シリカコロイド原液 | 90% | 600 μL | 18% |
| 核保存試薬(S2ゲノミクス) | - | 2400μL | - |
| RNAse阻害剤 | 40 U/μL | 15 μL | 0.2 U/μL |
表2:18%シリカコロイド溶液の調製。 この溶液は、ステップ 3.2 のクリーンアップ中のシリカコロイドグラジエント遠心分離に使用され、プロトコルを開始する前に毎回新たに調製する必要があります。プロトコル中は、常に18%シリカコロイド溶液を氷上に保管してください。
| 組織 | サンプル重量 | カートリッジ | 歩留まり |
| ラット肝臓 | 25ミリグラム | 核分離カートリッジ | 組織1mgあたり65,000核 |
| ラット肝臓 | 4ミリグラム | 小型入力核分離カートリッジ | 組織1mgあたり32,000核 |
表 3:スクロースグラジエントクリーンアップ後の低インプット核単離カートリッジと核単離カートリッジの核収量の比較。
| コンポーネント | 在庫濃度 | サンプルあたりの容量 | 最終集中 |
| 核保存試薬 | - | 1000μL | - |
| RNAse阻害剤 | 40 U/μL | 5 μL | 0.2 U/μL |
表4:核保存試薬(NSR)の調製。 この溶液は、ステップ3〜5の核分離中、およびステップ3.1.8のクリーンアップ中に使用されます。4°Cで最大4ヶ月間保存できます。クリーンアップステップ6の遠心分離ステップ中にRNase阻害剤を含む新しいアリコートを調製します。この表に記載されているソリューションは、 材料表で参照されています。
| 1x PBS + 0.04% BSAストック溶液 | |||
| コンポーネント | 在庫濃度 | 在庫量 | 最終集中 |
| PBS(Ca2+なし、Mg2+なし) | 1倍速 | 30 mLの | - |
| ウシ血清アルブミン(BSA) | 30% | 40 μL | 0.04% |
| 1x PBS + 0.04% BSA + 0.2 U/μL RNAse阻害剤 | |||
| コンポーネント | 在庫濃度 | サンプルあたりの容量 | 最終集中 |
| 1x PBS + 0.04% BSAストック溶液 | - | 500μL | - |
| RNAse阻害剤 | 40 U/μL | 2.5μL | 0.2 U/μL |
表5:PBS + 0.04%BSAの調製。 この溶液は、ステップ3.1.10のクリーンアップの最後に使用され、カウント後に核懸濁液を10X単一核RNAシーケンシング(カウントステップ4.4)に必要な濃度に希釈します。原液は4°Cで最長1ヶ月間保存できます。クリーンアップステップ6の遠心分離ステップ中にRNase阻害剤を含む新しいアリコートを調製します。
ディスカッション
私たちは、凍結哺乳類組織から高品質の単一核を得るための汎用性の高い部分的に自動化されたプロトコルを開発し、マウスの脳、ラットの腎臓、およびカニクイズの肝臓および脾臓組織でプロトコルを実証しました。
頭脳、腎臓、脾臓およびレバーティッシュ6,7,20,24,25,26の単一核のRNAの配列のための他の出版されたプロトコルのそれとこのプロトコルの性能を比較するとき、私達は私達が核ごとの遺伝子そしてUMIの計算の同じような数を検出でき、期待されたセルタイプを回復できることを観察する。既存の方法と比較して、このプロトコルにはいくつかの利点があります。まず、この研究のプロトコルは、単一核の組織均質化と単離を自動化します。これは、ロボット組織破壊装置21の使用によって達成される。ほとんどのプロトコルでは、ティッシュは単一核3,20を解放するためにDounceのホモジナイザーと均質化される。しかし、この手作業では、均質化中に加えられる力の量によっては、核収量や完全性にばらつきがあり、実験の再現性が損なわれる可能性があることに気付きました。ここでは、設定を固定した自動組織粉砕機を使用することで、実験全体で良好な核質と収率、より一貫性のある収量が得られました。さらに、このステップを自動化することで、プロトコルのハンズオン時間も短縮され(組織破壊ステップには約7分かかります)、ユーザーは次のステップに備えることができます。第二に、この研究で記述されたプロトコルは汎用性が高く、すなわち、異なる種からの異なる組織と互換性があります。これにより、異なる組織のホモジナイズバッファー/界面活性剤を同定するなど、時間のかかるプロトコルの最適化を回避できます2,5,6。第三に、このプロトコルは、クリーンな核を得るためにフローソーターへのアクセスに依存しないため、フローソーティングに必要な機器や専門知識を持たないラボでも利用しやすくなっています。代わりに、スクロースグラジエントベースのろ過を最適化して、ほとんどの破片を除去しました。ただし、特に脳組織では、より効率的なミエリン除去のために、スクロースグラジエントの代わりにシリカコロイドグラジエントを使用することが推奨されます。また、スクロース/シリカコロイドグラジエント遠心分離ステップの最後にスイングバケットローターを使用すると、核の損失が最小限に抑えられることもわかりました。したがって、このようなローターの使用を強くお勧めします。第四に、核を計数するための複数の方法(顕微鏡下での手動計数、いくつかの自動計数器の使用)を試験した後、自動蛍光細胞計数装置22の使用が推奨される。ヨウ化プロピジウムなどのDNAインターカレート色素を使用すると、核計数の精度が向上します。第五に、このプロトコルは、開始からマイクロ流体チップのロードまで約75分かかる。これにより、複数のサンプルを処理する際に核の完全性を高く保つことができます。最後に、このプロトコルは、最適な切断温度コンパウンド(OCT)包埋組織にも適合することがわかりました。そのような材料を用いる場合、均質化の前にメスを用いて組織をOCTブロックから除去することができる。
単一核RNAシーケンシングデータセットで頻繁に見られる課題の1つは、非核(ミトコンドリアなど)および核由来のアンビエントRNAの存在です27,28。私たちのプロトコルでは、ミトコンドリアRNA(非核アンビエントRNAのプロキシ)は、ろ過前でも低くなっています(示されている組織では0.1〜1.6%)。しかし、他のプロトコルやデータセットと同様に、豊富な細胞型(肝臓の肝細胞、脳のニューロンなど)の核で高発現した遺伝子からの周囲RNA汚染は依然として存在する27。CellBender、SoupXなどのいくつかのバイオインフォマティクスツールが存在し、核アノテーション29,30,31の前にそのような周囲のRNA汚染を除去することができる。このプロトコルのもう一つの制限は、組織破壊と核単離のステップは自動化されていますが、一度に1つのサンプルしか処理できないため、このステップのスループットは依然として限られていることです。ただし、このステップは組織片あたり約7分しかかからないため、複数のサンプルをバッチで処理できます。通常、バッチごとに4つのサンプルを処理しますが、バッチごとに最大6つのサンプルを処理し、良好な結果を得ています。2つのサンプルを同時に並列処理できるようにロボット解離器の最近の改良により、バッチあたり8〜12サンプルの処理が可能になり、単一核のカプセル化に使用されるマイクロ流体チップのスループットと互換性があります。
このプロトコルで単離された核は、ATAC-seqやsnRNAseqなど、他のプラットフォームを用いた他のダウンストリームアプリケーションには使用していませんが、ここで使用した遺伝子発現試薬で得られたデータの品質から、私たちのプロトコルは他のダウンストリームアプリケーションにも適合すると考えています。ただし、将来の作業では、ATAC-seqなどの他のダウンストリームアプリケーションでこのプロトコルをテストする予定です。
結論として、私たちは、さまざまな種類の凍結哺乳類組織との互換性があることが実証された、下流の単一核RNAシーケンシングのための迅速、シンプル、かつ部分的に自動化された核分離プロトコルを開発しました。
開示事項
すべての著者は、研究の実施中にF.ホフマン-ラロシュの従業員である/従業員でした。
謝辞
著者らは、この原稿で分析された動物組織を提供してくれたFilip Bochner、Marion Richardson、Petra Staeuble、Matthias Selhausenに感謝します。また、Petra Schwalie氏、Klas Hatje氏、Roland Schmucki氏、Martin Ebeling氏のバイオインフォマティクスのサポートにも感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 1 M DTT | Thermo Fisher Scientific | P2325 | |
| 10% Tween 20 | Bio-Rad | 1662404 | |
| 10x Magnetic Separator | 10x genomics | PN-120250 | |
| 10x Vortex Adapter | 10x genomics | PN-120251 | |
| 1x DPBS (10x), no calcium, no magnesium | Thermo Fisher Scientific | 14190144 | stored at 4°C |
| 30% Bovine Serum Albumin | Sigma-Aldrich | A9576_50ML | |
| 400 mM Tris-HCl, pH 8.0 | Thermo Fisher Scientific | 15568025 | |
| 40U/μl RNaseOUT Recombinant Ribonuclease Inhibitor | Thermo Fisher Scientific | 10777019 | Stored at -20 °C |
| Agilent High Sensitivity DNA Kit | Agilent | 5067-4626 | |
| Cellaca MX High-throughput Automated Cell Counter | Nexcelom Bioscience | CELMXSYSF2 | Automated fluorescent cell counter |
| Chromium Next GEM Chip G Single Cell Kit, 16 rxns | 10x genomics | PN-1000127 | Single cell gene expression reagent, stored at room temperature |
| Chromium Next GEM Secondary Holder | 10x genomics | PN-1000195 | |
| Chromium Next GEM Single Cell 3' Gel Bead Kit v3.1, 4 rxns | 10x genomics | PN-1000129 | Single cell gene expression reagent, stored at -80 °C |
| Chromium Next GEM Single Cell 3' GEM, Library & Gel Bead Kit v3.1, 4 rxns | 10x genomics | PN-1000128 | Single cell gene expression reagent |
| Chromium Next GEM Single Cell 3' Library Kit v3.1 4 rxns | 10x genomics | PN-1000158 | Single cell gene expression reagent, stored at -20 °C |
| Chromium Next GEM Single Cell 3'GEM Kit v3.1 4 rxns | 10x genomics | PN-1000130 | Single cell gene expression reagent, stored at -20 °C |
| Divided Polystyrene Reservoirs | VWR | 41428-958 | |
| DNA LoBind Tubes 1.5ml Eppendorf | Sigma-Aldrich | EP0030108051 | |
| DNA LoBind Tubes 2ml Eppendorf | Sigma-Aldrich | EP0030108078 | |
| Dry ice | - | - | |
| Dynabeads MyOne SILANE | 10x genomics | PN-2000048 | Single cell gene expression reagent, stored at 4 °C |
| Ethanol Pure | Sigma-Aldrich | E7023 | |
| Glycerin (Glycerol), 50% (v/v) | Ricca Chemical Company | 3290-16 | |
| Heatblock | |||
| High-Throughput Nexcelom Counting Plates | Nexcelom Bioscience | CHM24-A100-001 | Cell counter counting plate |
| Low TE Buffer (10 mM Tris-HCl pH 8.0, 0.1 mM EDTA) | Thermo Fisher Scientific | 12090015 | |
| Mini Centrifuge | - | - | |
| NovaSeq 6000 SP Reagent Kit v1.5 (100 cycles) | Illumina | 2002840 | |
| Nuclei Isolation Buffer | S2 Genomics | 100-063-396 | Stored at 4 °C |
| Nuclei Isolation Cartridge | S2 Genomics | 100-063-287 | Precooled at 4 °C before use |
| Nuclei PURE 2 M Sucrose Cushion Solution | Sigma-Aldrich | NUC201-1KT | Sucrose cushion solution |
| Nuclei PURE Sucrose Cushion Buffer | Sigma-Aldrich | NUC201-1KT | |
| Nuclei Storage Reagent | S2 Genomics | 100-063-405 | Stored at 4 °C |
| PCR Tubes 0.2 ml 8-tube strips | Eppendorf | 30124359 | |
| Percoll | GE Healthcare | 17-0891-02 | Silica colloid solution |
| PhiX Control v3 | Illumina | FC-110-3001 | |
| Qiagen Buffer EB | Qiagen | 19086 | |
| Qubit dsDNA HS Assay Kit | Thermo Fisher Scientific | Q32854 | |
| Refrigerated Centrifuge (Eppendorf 5804R) | Eppendorf | 5805000010 | |
| Refrigerated Centrifuge with Swinging-Bucket Rotor (Eppendorf 5810R) | Eppendorf | 5811000015 | |
| RNAseZap | Ambion | AM9780 | RNAse decontamination solution |
| Round cell culture petri dish | SPL | 330005 | |
| Scalpel disposable | Aesculap AG | BA210 | pre-cooled on dry ice before use |
| Single Index Kit T Set A, 96 rxns | 10x genomics | PN-1000213 | Single cell gene expression reagent, stored at -20 °C |
| Singulator 100 System | S2 Genomics | - | Commercially available robotic tissue dissociator |
| Sodium Hydroxide 1M | Sigma-Aldrich | 72068 | |
| SPRIselect Reagent Kit | Beckman Coulter | b23318 | |
| Sterile tweezers | - | - | |
| UltraPure DNase/RNase-Free Distilled Water | Thermo Fisher Scientific | 10977049 | |
| ViaStain PI Staining Solution | Nexcelom Bioscience | CS1-0109-5mL | Propidium iodide staining solution |
| Vortex Mixer+A2:D44 | VWR | - |
参考文献
- Burja, B., et al. An Optimized Tissue Dissociation Protocol for Single-Cell RNA Sequencing Analysis of Fresh and Cultured Human Skin Biopsies. Front Cell Dev Biol. 10, 872688 (2022).
- Kimbley, L. M., et al. Comparison of optimized methodologies for isolating nuclei from esophageal tissue. Biotechniques. 72 (3), 104-109 (2022).
- Maitra, M., et al. Extraction of nuclei from archived postmortem tissues for single-nucleus sequencing applications. Nature Protocols. 16 (6), 2788-2801 (2021).
- Nadelmann, E. R., et al. Isolation of nuclei from mammalian cells and tissues for single-nucleus molecular profiling. Current Protocols. 1 (5), e132 (2021).
- Rousselle, T. V., et al. An optimized protocol for single nuclei isolation from clinical biopsies for RNA-seq. Scientific Reports. 12, 9851 (2022).
- Slyper, M., et al. A single-cell and single-nucleus RNA-Seq toolbox for fresh and frozen human tumors. Nature Medicine. 26 (5), 792-802 (2020).
- Leiz, J., et al. Nuclei isolation from adult mouse kidney for single-nucleus RNA-sequencing. Journal of Visualized Experiments: JoVE. (175), 62901 (2021).
- Alvarez, M., et al. Isolation of nuclei from human snap-frozen liver tissue for single-nucleus RNA sequencing. Bio-Protocol. 13 (3), e4601 (2023).
- Ayhan, F., Douglas, C., Lega, B. C., Konopka, G. Nuclei isolation from surgically resected human hippocampus. STAR Protocols. 2 (4), 100844 (2021).
- Joshi, N., Misharin, A. Single-nucleus isolation from frozen human lung tissue for single-nucleus RNA-seq. Protocols.io. , (2019).
- Martelotto, L. G., Luciano Martelotto, L. 'Frankenstein' protocol for nuclei isolation from fresh and frozen tissue for snRNAseq. Protocols.io. , (2020).
- Masilionis, I., Chaudhary, O., Chaligne, R., Mazutis, L. Nuclei extraction for single-cell RNAseq from frozen tissue using Singulator™ 100. Protocols.io. , (2022).
- Matson, K. J. E., et al. Isolation of adult spinal cord nuclei for massively parallel single-nucleus RNA sequencing. Journal of Visualized Experiments: JoVE. (140), 58413 (2018).
- Mendelev, N., et al. Multi-omics profiling of single nuclei from frozen archived postmortem human pituitary tissue. STAR Protocols. 3 (2), 101446 (2022).
- Soule, T. G., et al. A protocol for single nucleus RNA-seq from frozen skeletal muscle. Life Science Alliance. 6 (5), e202201806 (2023).
- Bakken, T. E., et al. Single-nucleus and single-cell transcriptomes compared in matched cortical cell types. PLoS One. 13 (12), e0209648 (2018).
- Ding, J., et al. Systematic comparison of single-cell and single-nucleus RNA-sequencing methods. Nature Biotechnology. 38, 737-746 (2020).
- Hu, P., et al. Single-nucleus transcriptomic survey of cell diversity and functional maturation in postnatal mammalian hearts. Genes & Development. 32 (19-20), 1344-1357 (2018).
- Lake, B. B., et al. A comparative strategy for single-nucleus and single-cell transcriptomes confirms accuracy in predicted cell-type expression from nuclear RNA. Scientific Reports. 7, 6031 (2017).
- Narayanan, A., et al. Nuclei Isolation from Fresh Frozen Brain Tumors for Single-Nucleus RNA-seq and ATAC-seq. Journal of Visualized Experiments: JoVE. (162), 61542 (2020).
- Jovanovich, S., et al. . Automated processing of solid tissues into single cells or nuclei for genomics and cell biology applications with the Singulator™ 100 and 200 systems. , (2022).
- Bell, J., et al. Characterization of a novel high-throughput, high-speed and high-precision plate-based image cytometric cell counting method. Cell & Gene Therapy Insights. 7 (4), 427-447 (2021).
- Madler, S. C., et al. Besca, a single-cell transcriptomics analysis toolkit to accelerate translational research. NAR Genomics and Bioinformatics. 3 (4), lqab102 (2021).
- Wu, H., et al. Mapping the single-cell transcriptomic response of murine diabetic kidney disease to therapies. Cell Metabolism. 34 (7), 1064-1078 (2022).
- Han, L., et al. Cell transcriptomic atlas of the non-human primate Macaca fascicularis. Nature. 604 (7907), 723-731 (2022).
- Madissoon, E., et al. scRNA-seq assessment of the human lung, spleen, and esophagus tissue stability after cold preservation. Genome Biology. 21 (1), 1 (2019).
- Caglayan, E., Liu, Y., Konopka, G. Neuronal ambient RNA contamination causes misinterpreted and masked cell types in brain single-nuclei datasets. Neuron. 110 (24), 4043-4056 (2022).
- Luecken, M. D., Theis, F. J. Current best practices in single-cell RNA-seq analysis: a tutorial. Molecular Systems Biology. 15 (6), e8746 (2019).
- Fleming, S. J., et al. Unsupervised removal of systematic background noise from droplet-based single-cell experiments using CellBender. bioRxiv. , (2022).
- Yang, S., et al. Decontamination of ambient RNA in single-cell RNA-seq with DecontX. Genome Biology. 21 (1), 57 (2020).
- Young, M. D., Behjati, S. SoupX removes ambient RNA contamination from droplet-based single-cell RNA sequencing data. Gigascience. 9 (12), giaa151 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved