このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
シミュレーションスタディにおける複雑な脂質混合物を用いた現実的な膜モデリング
要約
膜脂質の構造と組成の多様性は、細胞プロセスに大きく寄与し、疾患のマーカーとなる可能性があります。分子動力学シミュレーションにより、膜と生体分子との相互作用を原子分解能で研究することができます。ここでは、複雑な膜システムを構築、実行、分析するためのプロトコルを提供します。
要約
脂質は細胞膜の構造的構成要素です。脂質種は細胞小器官や生物によって異なります。この多様性により、膜の機械的および構造的特性が異なり、この界面で発生する分子やプロセスに直接影響します。脂質組成は動的であり、細胞シグナル伝達プロセスを調節する役割を果たします。計算アプローチは、生体分子間の相互作用を予測し、実験観測物に分子的洞察を提供するためにますます使用されています。分子動力学(MD)は、統計力学に基づく手法であり、原子に作用する力に基づいて原子の動きを予測します。MDシミュレーションは、生体分子の相互作用を特徴付けるために使用できます。ここでは、この手法を簡単に紹介し、脂質二重層のシミュレーションに関心のある初心者向けの実践的な手順を概説し、初心者向けのソフトウェアでプロトコルを実証し、プロセスの代替案、課題、および重要な考慮事項について説明します。特に、複雑な脂質混合物を使用して目的の細胞膜をモデル化し、シミュレーションで適切な疎水性および機械的環境を捉えることの関連性を強調しています。また、膜の組成と特性が二重膜と他の生体分子との相互作用を調節するいくつかの例についても説明します。
概要
脂質は膜の主要成分であり、細胞の境界を提供し、細胞内の区画化を可能にします1,2,3。脂質は両親媒性で、極性頭部群と2つの疎水性脂肪酸尾部があります。これらは自己組織化して二重層になり、疎水性鎖と水との接触が最小限に抑えられます3,4。親水性の頭部基と疎水性の尾部のさまざまな組み合わせにより、グリセロリン脂質、スフィンゴ脂質、ステロールなど、生体膜にさまざまなクラスの脂質が生じます(図1)1,5,6。グリセロリン脂質は、グリセロリン酸、長鎖脂肪酸、および低分子量の頭部基で構成される真核細胞膜の主要な構成要素です7。脂質の命名法は、ヘッドグループの違いに基づいています。例としては、ホスファチジルコリン(PC)、ホスファチジルエタノールアミン(PE)、ホスファチジルセリン(PS)、ホスファチジルグリセロール(PG)、ホスファチジルイノシトール(PI)、または非修飾ホスファチジン酸(PA)などがあります5,6。疎水性の尾部に関しては、背骨構造とともに、飽和の長さと程度が異なります。可能な組み合わせは多数あり、その結果、哺乳類細胞には数千の脂質種が生じます6。膜脂質組成の変化は、内在性膜タンパク質と末梢タンパク質の両方の活性に影響を与える異なる機械的および構造的膜特性につながります2,6。
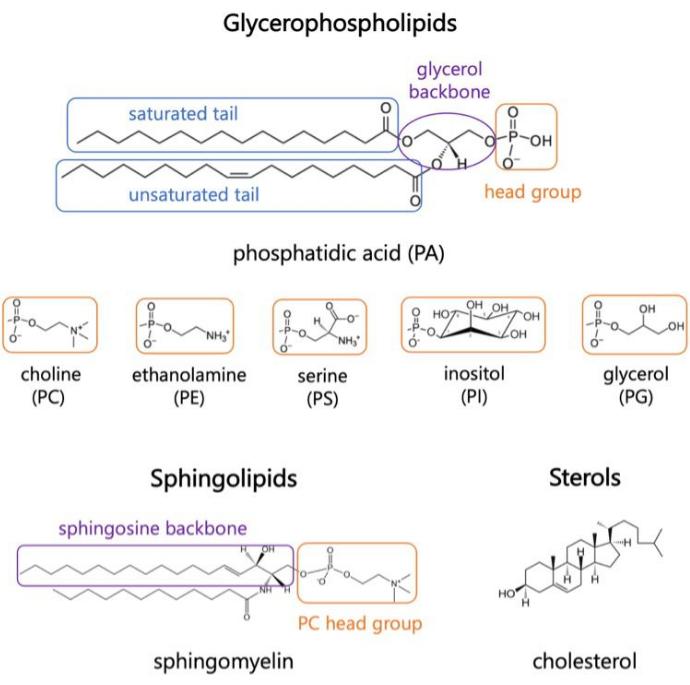
図 1.代表的な脂質構造。 脂肪酸のテールは青色のボックスで、一般的な脂質ヘッドグループはオレンジ色で、サンプルの骨格は紫色で示されています。 この図の拡大版をご覧になるには、ここをクリックしてください。
脂質は、細胞プロセス、シグナル伝達カスケードにおけるタンパク質の活性化、および健康な細胞の恒常性における積極的なプレーヤーです8,9。脂質動態の変化は、感染の結果であるか、疾患の病因のマーカーである可能性があります10,11,12,13,14,15。細胞のバリアとして、膜脂質と低分子の浸透におけるそれらの役割の研究は、薬物送達システムと膜破壊メカニズムに関連しています16,17。細胞小器官、組織、生物における化学的多様性と脂質種の比率の違いは、複雑な膜ダイナミクスを引き起こします2。したがって、脂質二重層のモデリング研究において、特に研究の目的が他の生体分子と膜との相互作用を調べることである場合、これらの特性を保持することが重要です。モデルで考慮する脂質種は、対象となる生物と細胞区画によって異なります。例えば、PG脂質は光合成バテリアの電子移動に重要であり18、リン酸化イノシトール脂質(PIP)は哺乳類細胞の原形質膜(PM)の動態とシグナル伝達カスケードの主要な役割を担っている19,20。細胞内では、PM、小胞体(ER)、ゴルジ体、およびミトコンドリア膜には、その機能に影響を与える固有の脂質量が含まれています。例えば、小胞体は脂質の生合成のハブであり、コレステロールをPMとゴルジ体に輸送します。脂質の多様性が高く、PCとPEが豊富に含まれていますが、ステロール含有量は低く、膜の流動性を促進します21,22,23,24。対照的に、PMは、生物25に応じて数百、さらには数千の脂質種を組み込んでおり、高レベルのスフィンゴ脂質およびコレステロールを含み、細胞内の他の膜と比較して特徴的な剛性を与える24。スフィンゴミエリン、PC、コレステロールが豊富な外側のリーフレットと、シグナル伝達カスケードに重要なPE、PI、およびPSが豊富な内側リーフレットを持つPMのような膜では、リーフレットの非対称性を考慮する必要があります24。最後に、脂質の多様性は、脂質ラフトとして知られる、パッキングと内部秩序が異なるミクロドメインの形成も促します24,26。これらは横方向の非対称性を示し、細胞シグナル伝達に重要な役割を果たすと仮定されており26、その一過性の性質のために研究が困難である。
蛍光透視法、分光法、巨大単層小胞(GUV)などのモデル膜系などの実験技術を使用して、生体分子と膜の相互作用が研究されてきました。しかし、関与する成分の複雑で動的な性質は、実験的手法だけでは捉えることが困難です。例えば、タンパク質の膜貫通ドメインのイメージング、そのような研究で使用される膜の複雑さ、および関心のあるプロセス中の中間状態または過渡状態の同定には制限があります27,28,29。1980年代に脂質単層および二重膜の分子シミュレーションが登場して以来29、脂質-タンパク質系とその相互作用を分子レベルで定量化できるようになりました。分子動力学(MD)シミュレーションは、分子間力に基づいて粒子の動きを予測する一般的な計算手法です。相加的相互作用ポテンシャルは、系30の粒子間の結合および非結合の相互作用を記述する。これらの相互作用をモデル化するために使用される一連のパラメータは、シミュレーション力場(FF)と呼ばれます。これらのパラメータは、第一原理計算、半経験的計算、量子力学的計算から得られ、X線および電子回折実験、NMR、赤外線、ラマンおよび中性子分光法などの方法から再現されたデータに最適化されています31。
MDシミュレーションは、さまざまなレベルの分解能32、33、34でシステムを研究するために使用できます。特定の生体分子相互作用、水素結合、その他の高分解能の詳細を特徴付けることを目的としたシステムは、全原子(AA)シミュレーションで研究されています。対照的に、粗視化(CG)シミュレーションは、計算コストを削減し、より大きなスケールのダイナミクスを調べるために、原子をより大きな官能基にまとめる33。これら2つの間に位置するのは、水素原子がそれぞれの重原子と組み合わされて計算を高速化する結合原子(UA)シミュレーションです33,35。MDシミュレーションは、脂質膜のダイナミクスと他の分子との相互作用を探索するための強力なツールであり、膜界面で関心のあるプロセスに分子レベルのメカニズムを提供するのに役立ちます。さらに、MDシミュレーションは、実験ターゲットを絞り込み、微視的相互作用に基づいて特定のシステムの高分子特性を予測するのに役立ちます。
簡単に言うと、初期座標、速度、温度や圧力などの条件が一定であれば、相互作用ポテンシャルとニュートンの運動の法則を数値積分して、各粒子の位置と速度が計算されます。これを反復的に繰り返すことで、シミュレーション軌跡30を生成する。これらの計算は MD エンジンで実行されます。いくつかのオープンソースパッケージの中で、GROMACS36は最も一般的に使用されているエンジンの1つであり、ここで説明するエンジンです。また、シミュレーションするシステムの初期座標を解析および構築するためのツールも含まれています37。他のMDエンジンにはNAMD38が含まれます。CHARMM39、およびAMBER40は、ユーザが所与のシステムの計算性能に基づいて自身の裁量で選択することができる。シミュレーション中の軌跡を視覚化し、結果を解析および解釈することが重要です。さまざまなツールが利用可能です。ここでは、拡張的な描画法や色付け法による3次元(3D)可視化、体積データの可視化、MDシミュレーションシステムの構築・準備・解析、メモリに余裕があればシステムサイズに制限のない軌道動画作成など、幅広い機能を提供するVisual Molecular Dynamics(VMD)について述べる41,42,43。
システムコンポーネント間の予測ダイナミクスの精度は、軌跡の伝搬に選択されたフリップフロップに直接影響されます。経験的なFFパラメータ化の取り組みは、少数の研究グループによって追求されています。MDの最も確立され、一般的なFFには、CHARMM39、AMBER 40、Martini44、OPLS 45、およびSIRAH 46が含まれます。全原子添加CHARMM36(C36)力場47は、実験構造データを正確に再現するため、膜系のAA MDに広く用いられている。もともとはCHARMMコミュニティによって開発されたもので、GROMACSやNAMDなどの複数のMDエンジンと互換性があります。一般的なFF全体の改善にもかかわらず、特定の研究システムへの関心に駆り立てられて、実験観測結果を厳密に再現する予測を可能にするためにパラメータセットを改善するための継続的な努力があります48,49。
脂質膜をシミュレーションする際の課題は、シミュレーションの軌跡の長さを決定することです。これは、分析する指標と特徴付けるプロセスに大きく依存します。通常、複雑な脂質混合物は、より多くの分子種が膜面上で拡散し、安定した側方組織に到達するのに十分な時間を必要とするため、平衡に達するまでに長い時間を必要とします。シミュレーションは、対象のプロパティがプラトーに達し、一定の値を中心に変動する場合に平衡状態にあると言われます。少なくとも100〜200 nsの平衡軌道を取得して、関心のある特性と相互作用に関する適切な統計分析を実行するのが一般的です。200〜500 nsの間でメンブレンのみのシミュレーションを実行するのが一般的ですが、脂質混合物の複雑さと研究課題によって異なります。タンパク質と脂質の相互作用は、通常、500〜2000nsの長いシミュレーション時間を必要とします。メンブレンシステムによるサンプリングと観察可能なダイナミクスを加速するためのいくつかのアプローチは、(i)膜内の脂質の末端炭素を有機溶媒に置き換えてサンプリングを加速する高移動性膜模倣(HMMM)モデルです50;(ii)水素質量再分配(HMR)は、システム内の重原子の質量の一部を水素原子の質量と組み合わせて、より大きなシミュレーションタイムステップ51の使用を可能にする。
以下のプロトコルでは、AA MD を使用して現実的な膜モデルを構築、実行、および解析するための初心者向けのアプローチについて説明します。MDシミュレーションの性質上、再現性と結果の適切な統計解析を考慮するために、複数の軌跡を実行する必要があります。現在のところ、対象のシステムごとに少なくとも 3 つのレプリカを実行するのが一般的です。目的の生物種とプロセスに脂質種を選択したら、膜のみのシステムのシミュレーション軌跡を構築、実行、および分析するための基本的な手順を概説し、 図 2 にまとめます。
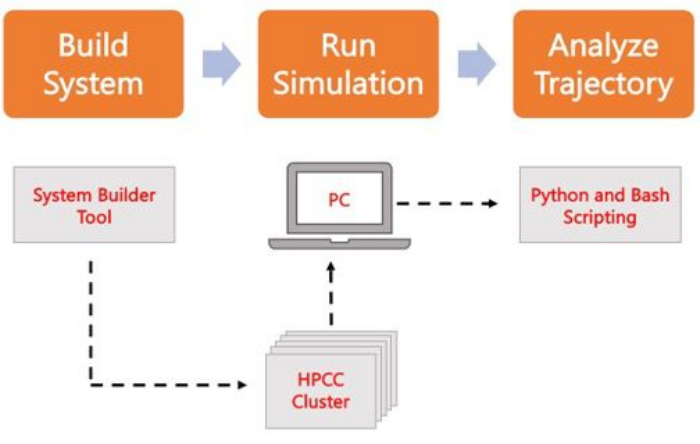
図 2.MDシミュレーションを実行するための回路図。 オレンジ色のボックスは、プロトコルに記載されている 3 つの主要なステップに対応しています。その下には、シミュレーションプロセスのワークフローがあります。システムのセットアップ中に、溶媒和膜システムの初期座標を含むシステムが、CHARMM-GUI Membrane Builderなどのシステム入力ジェネレータを使用して構築されます。入力ファイルをハイパフォーマンスコンピューティングクラスタに転送した後、GROMACSなどのMDエンジンを使用してシミュレーションの軌跡を伝搬します。軌道解析は、コンピュータクラスタまたはローカルワークステーション上で、視覚化とともに行うことができます。その後、GROMACSやVMDなどの解析コードが組み込まれたパッケージ、またはBashスクリプトや各種Pythonライブラリを使用して解析を行います。 この図の拡大版をご覧になるには、ここをクリックしてください。
プロトコル
1. システム座標の構築
- Web ブラウザーを使用して CHARMM-GUI.org (C-GUI) に移動します。トップメニューで[ Input Generator]に移動し、画面左側の垂直オプションから [Membrane Builder ]を選択します。
- バイレイヤーを構築するには、[ バイレイヤー ビルダー]を選択します。
注:初めてのユーザーは、最初の座標セットを作成する前に、無料アカウントをアクティブ化する必要があります。 - [メンブレンのみのシステム]を選択します。生成されたジョブ ID を保存してシステムを取得し、必要に応じてプロセス中に中断したところから続行します。
- 構築プロセスの各ステップでシステムを視覚化するには、ページ上部のボックスで [構造の表示 ] をクリックするか、結果の PDB ファイルをダウンロードします。成分の欠落、選択したインプット脂質種またはパッチサイズの誤りに注意してください。
- システムのコンポーネントを選択します。
- [ Heterogeneous Lipid ]オプションを選択すると、単一成分の二重層を構築する場合でも、次のようになります。をクリックしてから、「 矩形ボックス 」タイプを選択します。
- 水和オプションには、脂質あたり45個の水分子を選択します。これは、完全に水和された二重層を確保するのに十分です。
- 脂質成分の数に基づいてXYの長さを設定します。 次に、モデルに先立って決定された脂質種ごとに含める脂質の数を選択します。次項で説明するケーススタディでは、600種類の脂質が2枚のリーフレットに対称的に分布した膜モデルを構築しました。真核細胞の小胞体をモデル化するために、336 DOPC、132 DPPE、60 CHOL、72 POPI脂質の混合物をPIモデルに使用しました。PI-PS モデルでは、330 DOPC、126 DPPE、54 CHOL、66 POPI、および 24 DOPS の脂質があります。
注:C-GUIには、選択可能な脂質構造のライブラリが用意されています。化学構造の種名の横にある画像をクリックします。 - 上段と下段のリーフレットの脂質名の横にある2つのボックスに、希望の分子数を入力します。ケーススタディでは、対称的な膜組成が望まれます - 上部リーフレットと下部リーフレットの脂質の数が一致しないというエラーがないことを確認してください。非対称性が必要な場合は、各リーフレットの脂質の総数が正しいことを確認してください。非対称二重層の構築の詳細については、Park et al.52,53 の研究を参照してください。
- 脂質種リストの一番上に移動し、[ システム情報を表示]ボタンをクリックします。コンポーネントを組み立てて、システムを完成させます。
- より高速な収束のために距離ベースのアルゴリズムを用いてイオンを中和するオプションを選択する54。
- KCl のデフォルトの溶液濃度は 0.15 mM のままにします。これは、膜二重膜のシミュレーションボックスを中性にするための典型的な塩濃度です。
注:異なる濃度を使用する場合は、編集後に必ず[ 溶媒組成の計算 ]ボタンをクリックしてください。
- シミュレーションの条件と設定を選択します。
- FFオプションとして CHARMM36m を選択します。これは脂質およびタンパク質のシミュレーションに一般的に使用されますが、ユーザーはイントロダクションで説明した他のオプションを選択することもできます。
- MDエンジンとして GROMACS を選択し、対応するフォーマットのサンプル入力ファイルを取得します。
注: GROMACS には、サポート用のオンラインリソース、チュートリアル、フォーラムが複数あるため、新規ユーザーにお勧めします。ユーザーは、複数のMDエンジンから選択して、シミュレーションのパフォーマンスとコード構文の観点からオプションを調べることができます。 - Constant Particle-Pressure-Temperature(NPT)アンサンブルは、脂質二重層のシミュレーションで最もよく使用される動的アンサンブルです。
- ケルビン単位の温度と圧力を、バー単位をそれぞれ 303 K と 1 bar に設定します。生物学的プロセスの研究のために温度を298 Kから310 Kの間で設定し、液体の無秩序状態の二重層を確保するのが一般的です。
注:温度は、シミュレートするプロセスの条件によって異なり、必要に応じて変更できます。モデル内の脂質種に応じて、シミュレーションを実行する前に、純粋な脂質成分の転移温度よりも高い温度を設定します。
- 結果のファイルをダウンロードし、コンピューター クラスターに転送します。
- VMD や PyMol などの任意のソフトウェアで最終的なシステムを視覚化し、適切なセットアップを検査します。
注:例えば、シミュレーション中に脂質が画像原子と相互作用しないように膜の周囲に十分な水があること、およびリーフレットが適切にセットアップされていること(間にスペースや水がない二重層)を確認することをお勧めします。
- VMD や PyMol などの任意のソフトウェアで最終的なシステムを視覚化し、適切なセットアップを検査します。
2. MDシミュレーションの実行
- コンピューティングクラスタのC-GUIからファイルをアップロードして解凍します。 Gromacs ディレクトリに移動します。リラクゼーション送信スクリプトを作成します。
- 送信スクリプトの形式については、クラスターのガイドラインに従ってください。
- README ファイルの # Production コメントのすぐ上までリストされているコマンドを送信スクリプトにコピーします。
メモ : C-GUI のこのデフォルトは、システムの 6 段階の緩和を実行するループです。別の確立されたプロトコルが必要な場合は、C-GUIから作成してダウンロードした座標を読み取るように編集します。
- README ファイルの # Production コメントのすぐ上までリストされているコマンドを送信スクリプトにコピーします。
- 緩和スクリプトを送信し、運用実行に移行する前に、すべてのステップですべての出力ファイルがダウンロードされていることを確認します。完了したら、6ステップの実行中に生成されたGROMACSからの次の出力ファイルを確認します:*.log、*.tpr、*.gro、*.edr、*.trr / *.xtc
- 運用実行スクリプトを作成します。
- 緩和ステップのいずれかのサンプル gmx grompp コマンドと gmx mdrun コマンドの 1 つをテンプレートとして使用します。
- スクリプトを使用する前に、提供されている step7_production.mdp ファイルと同様のシミュレーション オプションを含む *.mdp ファイルを作成してください。
注: 提供されている既定のオプションは、膜シミュレーションの標準です。ディタンスはnmでリストされ、時間はピコ秒またはステップ数(ピコ秒/積分時間ステップ)で与えられます。nsteps を更新して目的のシミュレーション長 (dt * nsteps に等しい) まで実行し、nst[x,v,f]out を更新して積分ステップ数でデータ保存頻度を更新します。ケーススタディでは、シミュレーション長が500nsの場合(シミュレーション時間/積分ステップ=500,000ps/0.002ps)でnstepsを250,000,000に設定し、nst[x,v,f]outを50,000に設定して100psごとにデータを保存します
- 実際のシミュレーションを実行する前に、ベンチマーク スタディを実行して、リソースの最適な使用方法を決定します。
- 異なる数のコンピューティングノードを使用して、システムを1〜2ns実行します。
注: ER のケース スタディは、UB Center for Computational Research (CCR) のハイパフォーマンス コンピューティング クラスター55 で 2 ns で提出され、1 から 10 ノードでパフォーマンスがテストされました。 - 各設定のパフォーマンス (ns/日) を比較して、実行に最適なリソースを決定します。一般的な方法は、最大パフォーマンスの 75% から 80% になるノードの数を選択することです。
- 異なる数のコンピューティングノードを使用して、システムを1〜2ns実行します。
- 生産実行を実行します。
- 各システムを 3 回に分けて実行し、再現性を確保し、データの統計分析を行います。
- ベンチマークに基づいて、コンピューティング クラスターでの送信の許容キュー時間が経過した場合に、軌道を延長します。gmx convert-tpr コマンドを使用し、次に gmx mdrun コマンドを使用して、軌跡収集を続行します。
注: オプションについては、オンラインの GROMACS ドキュメント (https://manual.gromacs.org/) で説明されています。 - メンブレンのみのシステムの場合、時間の経過とともに脂質あたりの面積を計算して、システムが平衡に達しているかどうかを調べます。そうでない場合は、シミュレーションの軌跡を延長します。
3. 軌跡の解析
- 分析を実行する前にシステムを可視化して、目的の分子と特性評価を目的とした軌跡の部分を決定します。
- ファイル形式を *.xtc に変更したり、フレームをスキップしたりして、未加工の軌跡ファイル(*.trr)を圧縮し、ファイルサイズを縮小し、視覚化と分析のためにローカルステーションへのより効率的な転送を容易にします。
注:大型メンブレンシステムの場合、弾道から水を取り除くことで、ファイルサイズをさらに小さくすることができます。これは、GROMACSのインデックスファイル、VMDのTCLスクリプト、またはMDAnalysisやMDTrajなどのPythonライブラリを使用して実行できます。 - 脂質あたりの面積の時系列から決定された軌跡の平衡化部分で、選択した分析を実行します。
注:一般的な膜分析とその実行方法の詳細については、ディスカッションを参照してください。
結果
プロトコルの使用と得られる結果を説明するために、小胞体(ER)の膜モデルの比較研究について説明します。この研究の2つのモデルは、(i)ERで見つかった上位4つの脂質種を含むPIモデルと、(ii)アニオン性ホスファチジルセリン(PS)脂質種を追加したPI-PSモデルでした。これらのモデルは、後にウイルスタンパク質の研究に使用され、それが膜とどのように相互作用するか、PSへの関心は、ウイル...
ディスカッション
実験技術では、クライオ電子顕微鏡(クライオ電子顕微鏡)58、蛍光技術、原子間力顕微鏡(AFM)59を用いて、生体分子を高分解能で可視化することができます。しかし、生物学的経路、疾患の病因、治療送達の根底にある分子相互作用の相互作用とダイナミクスを原子レベルまたはアミノ酸レベルで捉えることは困難です。ここでは、脂質膜を研究するためのMD...
開示事項
著者は、開示すべき競合する利害関係を有していません。
謝辞
著者らは、この原稿の執筆中にシミュレーションの軌跡と議論をしてくれたJinhui Li氏とRicardo X. Ramirez氏に感謝します。O.C.は、バッファロー大学プレジデンシャルフェローシップと国立衛生研究所のイニシアチブの学生開発トレーニング助成金1T32GM144920-01によって支援され、マルガリータL.デュボコビッチ(PI)に授与されました。
資料
| Name | Company | Catalog Number | Comments |
| Anaconda3 | Anaconda Inc (Python & related libraries) | N/A | |
| CHARMM-GUI.org | Im lab, Lehigh University | N/A | |
| GROMACS | GROMACS development team | N/A | |
| Linux HPC Cluster | UB CCR | N/A | |
| MATLAB | MathWorks | N/A | |
| VMD | Theoretical and Computational Biophysics Group | N/A |
参考文献
- Vanni, S., Riccardi, L., Palermo, G., De Vivo, M. Structure and Dynamics of the Acyl Chains in the Membrane Trafficking and Enzymatic Processing of Lipids. Accounts of Chemical Research. 52 (11), 3087-3096 (2019).
- Harayama, T., Riezman, H. Understanding the diversity of membrane lipid composition. Nature Reviews Molecular Cell Biology. 19 (5), 281-296 (2018).
- Tanaka, M., Edward, H. .. . E. g. e. l. m. a. n. . Comprehensive Biophysics. , 261-272 (2012).
- Bruce Alberts, A. J., Julian Lewis, , Martin Raff, , Keith Roberts, , Peter Walter, . Molecular Biology of the Cell. , (2002).
- Watson, H. Biological membranes. Essays in Biochemistry. 59, 43-69 (2015).
- Coskun, &. #. 2. 2. 0. ;., Simons, K. Cell Membranes: The Lipid Perspective. Structure. 19 (11), 1543-1548 (2011).
- Douglas G, H. a. y. e. s., Daniel, K. Y., Solaiman, D., Richard, . Biobased Surfactants (Second Edition) eds. , 515-529 (2019).
- González-Rubio, P., Gautier, R., Etchebest, C., Fuchs, P. F. J. Amphipathic-Lipid-Packing-Sensor interactions with lipids assessed by atomistic molecular dynamics. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1808, 2119-2127 (2011).
- Halbleib, K., et al. Activation of the Unfolded Protein Response by Lipid Bilayer Stress. Molecular Cell. 67, 673-684 (2017).
- Andreasen, M., Lorenzen, N., Otzen, D. Interactions between misfolded protein oligomers and membranes: A central topic in neurodegenerative diseases. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1848 (9), 1897-1907 (2015).
- Calianese, D. C., Birge, R. B. Biology of phosphatidylserine (PS): basic physiology and implications in immunology, infectious disease, and cancer. Cell Commununication and Signaling. 18 (1), 41 (2020).
- Nieto-Garai, J. A., Contreras, F. X., Arboleya, A., Lorizate, M. Role of Protein-Lipid Interactions in Viral Entry. Advanced Biology. 6, 2101264 (2022).
- Mazzon, M., Mercer, J. Lipid interactions during virus entry and infection. Cell Microbiology. 16, 1493-1502 (2014).
- Colombelli, C., Aoun, M., Tiranti, V. Defective lipid metabolism in neurodegeneration with brain iron accumulation (NBIA) syndromes: not only a matter of iron. Journal of Inherited Metabolic Disease. 38 (1), 123-136 (2015).
- Saini-Chohan, H. K., Mitchell, R. W., Vaz, F. M., Zelinski, T., Hatch, G. M. Delineating the role of alterations in lipid metabolism to the pathogenesis of inherited skeletal and cardiac muscle disorders: Thematic Review Series: Genetics of Human Lipid Diseases. Journal of Lipid Research. 53 (1), 4-27 (2012).
- Martinotti, C., Ruiz-Perez, L., Deplazes, E., Mancera, R. L. Molecular Dynamics Simulation of Small Molecules Interacting with Biological Membranes. ChemPhysChem. 21 (14), 1486-1514 (2020).
- Li, J., Kalyanram, P., Rozati, S., Monje-Galvan, V., Gupta, A. Interaction of Cyanine-D112 with Binary Lipid Mixtures: Molecular Dynamics Simulation and Differential Scanning Calorimetry Study. ACS Omega. 7 (11), 9765-9774 (2022).
- Nagy, L., et al. Protein/Lipid Interaction in the Bacterial Photosynthetic Reaction Center: Phosphatidylcholine and Phosphatidylglycerol Modify the Free Energy Levels of the Quinones. Biochemistry. 43 (40), 12913-12923 (2004).
- Ramirez, R. X., Campbell, O., Pradhan, A. J., Atilla-Gokcumen, G. E., Monje-Galvan, V. Modeling the molecular fingerprint of protein-lipid interactions of MLKL on complex bilayers. Frontiers in Chemistry. 10, (2023).
- Dondelinger, Y., et al. MLKL Compromises Plasma Membrane Integrity by Binding to Phosphatidylinositol Phosphates. Cell Reports. 7 (4), 971-981 (2014).
- van Meer, G., Voelker, D. R., Feigenson, G. W. Membrane lipids: where they are and how they behave. Nature Reviews Molecular Cell Biology. 9 (2), 112-124 (2008).
- van Meer, G., de Kroon, A. I. P. M. Lipid map of the mammalian cell. Journal of Cell Science. 124 (1), 5 (2011).
- Lee, H. R., Lee, G. Y., You, D. G., Kim, H. K., Young, D. Y. Hepatitis C virus p7 induces membrane permeabilization by interacting with phosphatidylserine. International Journal of Molecular Sciences. 21 (3), 897 (2020).
- Casares, D., Escribá, P. V., Rosselló, C. A. Membrane Lipid Composition: Effect on Membrane and Organelle Structure, Function and Compartmentalization and Therapeutic Avenues. International Journal of Molecular Sciences. 20 (9), 2167 (2019).
- Marrink, S. J., et al. Computational Modeling of Realistic Cell Membranes. Chemical Reviews. 119 (9), 6184-6226 (2019).
- Janmey, P. A., Kinnunen, P. K. J. Biophysical properties of lipids and dynamic membranes. Trends in Cell Biology. 16 (10), 538-546 (2006).
- Brémaud, E., Favard, C., Muriaux, D. Deciphering the Assembly of Enveloped Viruses Using Model Lipid Membranes. Membranes. 12, 441 (2022).
- Campbell, O., Monje-Galvan, V. Protein-driven membrane remodeling: Molecular perspectives from Flaviviridae infections. Biophysical Journal. 122 (11), 1890-1899 (2022).
- Loschwitz, J., Olubiyi, O. O., Hub, J. S., Strodel, B., Poojari, C. S. Computer simulations of protein-membrane systems. Progress in molecular biology and translational science. 170, 273-403 (2020).
- Shell, M. S., Scott Shell, M. . Thermodynamics and Statistical Mechanics: An Integrated ApproachCambridge Series in Chemical Engineering. , 21-49 (2015).
- Yang, J., et al. Molecular Dynamic Simulation of Ni-Al Alloy-H2O Reactions Using the ReaxFF Reactive Force Field. ACS Omega. 8 (11), 9807-9814 (2023).
- Ingólfsson, H. I., Arnarez, C., Periole, X., Marrink, S. J. Computational 'microscopy' of cellular membranes. Journal of Cell Science. 129 (2), 257-268 (2016).
- Klauda, J. B. Perspective: Computational modeling of accurate cellular membranes with molecular resolution. The Journal of Chemical Physics. 149 (22), 220901 (2018).
- Chavent, M., Duncan, A. L., Sansom, M. S. P. Molecular dynamics simulations of membrane proteins and their interactions: from nanoscale to mesoscale. Current Opinion in Structural Biology. 40, 8-16 (2016).
- Khakbaz, P., Monje-Galvan, V., Zhuang, X., Klauda, J. B., Otto Geiger, . Biogenesis of Fatty Acids, Lipids and Membranes. , 1-19 (2017).
- Abraham, M. J., et al. GROMACS: High performance molecular simulations through multi-level parallelism from laptops to supercomputers. SoftwareX. 1, 19-25 (2015).
- Lemkul, J. A. From Proteins to Perturbed Hamiltonians: A Suite of Tutorials for the GROMACS-2018 Molecular Simulation Package. Living Journal of Computational Molecular Science. 1 (1), 5068 (2018).
- Phillips, J. C., et al. Scalable molecular dynamics on CPU and GPU architectures with NAMD. The Journal of Chemical Physics. 153 (4), 044130 (2020).
- Klauda, J. B., et al. Update of the CHARMM All-Atom Additive Force Field for Lipids: Validation on Six Lipid Types. The Journal of Physical Chemistry B. 114 (23), 7830-7843 (2010).
- Wang, J., Wolf, R. M., Caldwell, J. W., Kollman, P. A., Case, D. A. Development and testing of a general amber force field. Journal of Computational Chemistry. 25 (9), 1157-1174 (2004).
- John Stone, A. A., et al. . Using VMD. , (2011).
- Humphrey, W., Dalke, A., Schulten, K. VMD: Visual molecular dynamics. Journal of Molecular Graphics. 14 (1), 33-38 (1996).
- Hsin, J., Arkhipov, A., Yin, Y., Stone, J. E., Schulten, K. Using VMD: An Introductory Tutorial. Current Protocols in Bioinformatics. 24 (1), 5.7.1-5.7.48 (2008).
- Souza, P. C. T., et al. Martini 3: a general purpose force field for coarse-grained molecular dynamics. Nature Methods. 18 (4), 382-388 (2021).
- Jorgensen, W. L., Maxwell, D. S., Tirado-Rives, J. Development and Testing of the OPLS All-Atom Force Field on Conformational Energetics and Properties of Organic Liquids. Journal of the American Chemical Society. 118 (45), 11225-11236 (1996).
- Machado, M. R., et al. The SIRAH 2.0 Force Field: Altius, Fortius, Citius. Journal of Chemical Theory and Computation. 15 (4), 2719-2733 (2019).
- Huang, J., et al. CHARMM36m: an improved force field for folded and intrinsically disordered proteins. Nature Methods. 14 (1), 71-73 (2017).
- Mu, J., Liu, H., Zhang, J., Luo, R., Chen, H. F. Recent Force Field Strategies for Intrinsically Disordered Proteins. Journal of Chemical Information and Modeling. 61 (3), 1037-1047 (2021).
- Inakollu, V. S. S., Geerke, D. P., Rowley, C. N., Yu, H. Polarisable force fields: what do they add in biomolecular simulations. Current Opinion in Structural Biology. 61, 182-190 (2020).
- Ohkubo, Y. Z., et al. Accelerating Membrane Insertion of Peripheral Proteins with a Novel Membrane Mimetic Model. Biophysical Journal. 102 (9), 2130-2139 (2012).
- Hopkins, C. W., Le Grand, S., Walker, R. C., Roitberg, A. E. Long-Time-Step Molecular Dynamics through Hydrogen Mass Repartitioning. Journal of Chemical Theory and Computation. 11 (4), 1864-1874 (2015).
- Park, S., Beaven, A. H., Klauda, J. B., Im, W. How Tolerant are Membrane Simulations with Mismatch in Area per Lipid between Leaflets. Journal of Chemical Theory and Computation. 11 (7), 3466-3477 (2015).
- Park, S., Im, W., Pastor, R. W. Developing initial conditions for simulations of asymmetric membranes: a practical recommendation. Biophysical Journal. 120 (22), 5041-5059 (2021).
- Wu, E. L., et al. CHARMM-GUI Membrane Builder toward realistic biological membrane simulations. Journal of Computational Chemistry. 35 (27), 1997-2004 (2014).
- Center for Computational Research, U.a.B.. . CCR Facility Description. , (2019).
- Piggot, T. J., Allison, J. R., Sessions, R. B., Essex, J. W. On the Calculation of Acyl Chain Order Parameters from Lipid Simulations. Journal of Chemical Theory and Computation. 13 (11), 5683-5696 (2017).
- Li, J., Monje-Galvan, V. Effect of Glycone Diversity on the Interaction of Triterpenoid Saponins and Lipid Bilayers. ACS Applied Bio Materials. , (2023).
- Renaud, J. P., et al. Cryo-EM in drug discovery: achievements, limitations and prospects. Nature Reviews Drug Discovery. 17 (7), 471-492 (2018).
- Ando, T., Uchihashi, T., Kodera, N. High-Speed AFM and Applications to Biomolecular Systems. Annual Review of Biophysics. 42 (1), 393-414 (2013).
- Martínez, L., Andrade, R., Birgin, E. G., Martínez, J. M. PACKMOL: A package for building initial configurations for molecular dynamics simulations. Journal of Computational Chemistry. 30 (13), 2157-2164 (2009).
- Jewett, A. I., et al. Moltemplate: A Tool for Coarse-Grained Modeling of Complex Biological Matter and Soft Condensed Matter Physics. Journal of Molecular Biology. 433 (11), 166841 (2021).
- Jo, S., Kim, T., Iyer, V. G., Im, W. CHARMM-GUI: A web-based graphical user interface for CHARMM. Journal of Computational Chemistry. 29 (11), 1859-1865 (2008).
- Polêto, M. D., Lemkul, J. A. Integration of experimental data and use of automated fitting methods in developing protein force fields. Communications Chemistry. 5 (1), 38 (2022).
- Hynninen, A. P., Crowley, M. F. New faster CHARMM molecular dynamics engine. Journal of Computational Chemistry. 35 (5), 406-413 (2014).
- Kim, S. Issues on the Choice of a Proper Time Step in Molecular Dynamics. Physics Procedia. 53, 60-62 (2014).
- Grubmüller, H., Heller, H., Windemuth, A., Schulten, K. Generalized Verlet Algorithm for Efficient Molecular Dynamics Simulations with Long-range Interactions. Molecular Simulation. 6 (1-3), 121-142 (1991).
- Darden, T., York, D., Pedersen, L. Particle mesh Ewald: An N·log(N) method for Ewald sums in large systems. Journal of Chemical Physics. 98 (12), 10089-10092 (1993).
- . . Hepatitis C. , (2021).
- Braun, E., et al. Best Practices for Foundations in Molecular Simulations [Article v1.0]. Living Journal of Computational Molecular Science. 1 (1), 5957 (2018).
- Moradi, S., Nowroozi, A., Shahlaei, M. Shedding light on the structural properties of lipid bilayers using molecular dynamics simulation: a review study. RSC Advances. 9 (8), 4644-4658 (2019).
- Monje-Galvan, V., Klauda, J. B. Modeling Yeast Organelle Membranes and How Lipid Diversity Influences Bilayer Properties. Biochemistry. 54 (45), 6852-6861 (2015).
- Michaud-Agrawal, N., Denning, E. J., Woolf, T. B., Beckstein, O. MDAnalysis: A toolkit for the analysis of molecular dynamics simulations. Journal of Computational Chemistry. 32 (10), 2319-2327 (2011).
- Gowers, R., et al. MDAnalysis: A Python Package for the Rapid Analysis of Molecular Dynamics Simulations. SciPy. , (2016).
- McGibbon, R. o. b. e. r. t. . T., et al. MDTraj: A Modern Open Library for the Analysis of Molecular Dynamics Trajectories. Biophysical Journal. 109 (8), 1528-1532 (2015).
- Fortunato, M. E., Colina, C. M. pysimm: A python package for simulation of molecular systems. SoftwareX. 6, 7-12 (2017).
- Scherer, M. K., et al. PyEMMA 2: A Software Package for Estimation, Validation, and Analysis of Markov Models. Journal of Chemical Theory and Computation. 11 (11), 5525-5542 (2015).
- Song, W., et al. PyLipID: A Python Package for Analysis of Protein-Lipid Interactions from Molecular Dynamics Simulations. Journal of Chemical Theory and Computation. 18 (2), 1188-1201 (2022).
- Monje-Galvan, V., Klauda, J. B. Peripheral membrane proteins: Tying the knot between experiment and computation. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1858 (7, Part B), 1584-1593 (2016).
- Monje-Galvan, V., Voth, G. A. Binding mechanism of the matrix domain of HIV-1 gag on lipid membranes. eLife. 9, e58621 (2020).
- Wang, B., Guo, C. Concentration-Dependent Effects of Cholesterol on the Dimerization of Amyloid-β Peptides in Lipid Bilayers. ACS Chemical Neuroscience. 13 (18), 2709-2718 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved