ゼブラフィッシュ胚における光遺伝学的シグナル伝達の活性化
* これらの著者は同等に貢献しました
要約
シグナル伝達経路の光遺伝学的操作は、発生、再生、恒常性、および疾患においてシグナル伝達がどのように解読されるかを調べるための強力な戦略となり得ます。このプロトコルは早いゼブラフィッシュの胚の光酸素電圧感知の領域基づかせていた節および骨のmorphogenic蛋白質(BMP)のシグナリングの活性剤を使用するための実用的な指針を提供する。
要約
シグナル伝達経路は、発生、再生、恒常性、疾患などの基本的な生物学的プロセスを調整します。シグナリングを実験的に操作する方法は、これらの幅広い文脈でシグナリングがどのように解釈されるかを理解するために必要です。分子光遺伝学的ツールは、高度な時空間制御により、シグナル伝達経路活性の可逆的で調整可能な操作を提供することができ、in vitro、ex vivo、およびin vivoで適用されています。これらのツールは、青色光ホモ二量体化光-酸素-電圧センシング(LOV)ドメインなどの光応答性タンパク質ドメインとシグナル伝達エフェクターを結合し、シグナル伝達を光依存的に実験的に制御します。このプロトコルは光学的に入手しやすい早いゼブラフィッシュの胚のLOVベースの骨のmorphogenetic蛋白質(BMP)および結節シグナリングの活性剤bOptoBMPおよびbOpto結節を使用するための実用的な指針を提供する。適切な実験条件を決定するための迅速な表現型アッセイと、シグナル伝達を直接評価するための免疫蛍光アッセイの2つの対照実験について説明します。これらの対照実験は、ゼブラフィッシュの初期胚で光遺伝学的ツールを使用するためのパイプラインを確立するのに役立ちます。これらの戦略は、発達、健康、生理学におけるシグナル伝達の役割を調査するための強力なプラットフォームを提供します。
概要
シグナル伝達経路により、細胞は環境に応答し、組織および生物全体のスケールで活動を調整することができます。胚発生に重要なシグナルには、TGF-βスーパーファミリーメンバーである骨形成タンパク質(BMP)およびリンパ節1,2,3が含まれます。胚発生の間、これらのシグナルやその他のシグナルによって調節される経路は、遺伝子発現と追加のプロセスを制御して、多様な組織や器官が適切に発達し、インターフェースするようにすることで、ボディプランをパターン化します。先天性欠損症や癌などの病状は、シグナル伝達またはシグナル伝達に対する応答が乱されたときに発生する可能性があります4,5,6,7。シグナリングの厳密な調査にもかかわらず、レベルとダイナミクスがさまざまなコンテキストでどのように解読されるかについては、特に開発中に8,9,10,11、特に開発中に12,13,14,15,16,17,18,19でまだ発見されていないことがたくさんあります。
シグナリングがどのようにデコードされるかを理解するための理想的な実験は、シグナリングレベル、タイミング、ダイナミクスを高度な空間的および時間的制御で操作し、結果を評価することです。例えば、発達中の組織をパターン化するために、正確な空間シグナル伝達勾配が提案されている20,21。シグナル伝達勾配の空間分布を変えることは、この仮説を検証するのに役立つだろう22。さらに、多様な細胞応答を生成する上でのシグナル伝達ダイナミクスの重要性が明らかになってきています:同じシグナル伝達経路は、シグナル伝達周波数に応じて細胞に分化または増殖するように指示することができます(例えば9,23)。シグナル伝達の動態を容易に操作できる実験パラダイムは、動態と細胞の運命決定との関係を探る上で有用である8,12,13,14,15。
歴史的に、発生の文脈でシグナル伝達を操作するために複数の方法が使用され、根本的な発見につながっています1,2,3。シグナル伝達は、経路の機能喪失変異体、異所性阻害剤の発現、またはアンタゴニスト薬を用いてブロックすることができる。シグナル伝達を活性化する方法には、アゴニスト薬、組換えリガンド、リガンドまたは恒常的に活性な受容体の異所性発現、および経路阻害剤の機能喪失変異体が含まれる。これらの方法は、実験的管理の連続体に沿っています。例えば、変異体や異所性発現は、連続体のハンマー側に落ちるかもしれません。 これらのアプローチでは、経路活性の劇的な全身的変化が早期死亡を引き起こし、後の段階での調査を妨げたり、時間の経過とともに解きほぐすことが困難な多面的効果をもたらす可能性があります。さらに、レベルや継続時間など、一度に 1 つのシグナリング機能を個別に操作することは、多くの場合困難です。連続体のもう一方の端に向かって、いくつかの方法は、時間的および時には空間的制御を伴う薬物または組換えタンパク質にサンプルを曝露するマイクロ流体デバイス18,24,25、または同様の利点を提供することができる熱ショック誘発性および組織特異的プロモーターを含む遺伝的方法16,26,27など、より正確な実験制御を提供します.ただし、これらの方法は実行が困難で、可逆的ではなく、速度論が比較的遅くなったり、解像度が低かったりする可能性があり、一部のモデル システムでは使用できない場合があります。
分子光遺伝学的アプローチは、このツールキットへの強力な追加です。これらのアプローチは、シグナル伝達8,12,13,14,15を含む生物学的プロセスを操作するために異なる光の波長に応答するタンパク質を使用し、細胞培養から全動物まで、さまざまなシステムで使用するために数十年にわたって開発されてきました12,13,28。.従来のアプローチと比較すると、分子オプトジェネティクスは、多くの場合、生物学的プロセスに対してより高度な時空間制御を提供することができます:光遺伝学システムのコントローラーは光であり、光の波長、強度、持続時間、および曝露頻度の制御は比較的簡単です。共焦点顕微鏡や2光子顕微鏡などの高度なシステムにより、細胞内領域での空間制御が可能です29,30,31。シグナル伝達を光遺伝学的に操作するツールが開発され、Johnson et al.22、Čapek et al.32、Krishnamurthy et al.33、Huang et al.34に記載されているものを含むいくつかのシステムに適用されています。例えば、オプトジェネティクスによってもたらされる空間制御を利用して、この戦略は最近、ショウジョウバエの胚のシグナル伝達勾配を変更するために使用され、ハエの胚発生がこの勾配の変化に対して驚くほど頑健であることを実証しました22。また、光遺伝学的シグナル伝達活性化因子の可逆性と高速なオン/オフ動態は、シグナル伝達ダイナミクスの解読を調査するための魅力的なツールとなっています8,12,13,14,15,34,35,36。
初期のゼブラフィッシュ胚は、体外受精、透明、顕微鏡検査に適しており、遺伝的に扱いやすいため、光遺伝学的研究に適した in vivo システムです。光曝露は、母親の外部で発育する胚への送達が容易であり、光はそれらの不透明でない組織を透過してアクセスすることができ、生きたゼブラフィッシュの胚は(透明であることに加えて)イメージングによく耐え、既存の遺伝学的方法は、有用なトランスジェニックの開発に加えて、ノックダウンおよび過剰発現実験の簡単な機会を提供する37。
最近、青色光に曝露されたゼブラフィッシュの胚においてBMP38およびノード39シグナル伝達を活性化する光遺伝学的ツールが開発されました(図1)。これらのツールをbOpto-BMPおよびbOpto-Nodal(bは青色光活性化、Optoはオプトジェネティック)と呼んでいます。bOpto-BMP/Nodalは、同様の経路活性化メカニズムに基づいています。BMPまたはノードリガンドがそれぞれの受容体であるセリン-スレオニンキナーゼに結合すると、受容体キナーゼドメイン相互作用が促進され、シグナル伝達エフェクター(BMPではSmad1/5/9、ノードではSmad2/3)のリン酸化が引き起こされます。その後、リン酸化シグナル伝達エフェクターが核に移行し、標的遺伝子の発現を調節します3(図1A、D)。これらの受容体キナーゼ相互作用は、受容体キナーゼを光応答性二量体化タンパク質に結合させることによって光応答性にすることができます:光曝露により、これらのキメラタンパク質は二量体化し、受容体キナーゼドメインが相互作用してシグナル伝達を活性化します(図1B、C、E、F)。重要なことは、内因性受容体とは対照的に、bOpto-BMP/Nodalは細胞外リガンド結合ドメインを含まないため、リガンド非依存活性が保証されることです(図1C、F)。この光遺伝学的活性化戦略は、最初に受容体チロシンキナーゼ40,41,42で達成され、次に受容体セリン-スレオニンキナーゼに適用されました。
bOpto-BMP/Nodalは、藻類Vaucheria fridiga AUREO1タンパク質(VfLOV)43,44の青色光応答性(~450 nm)ホモ二量体化光-酸素-電圧センシング(LOV)ドメインを使用します。これらのコンストラクトは、膜を標的とするミリストイル化モチーフとそれに続くBMPまたはリンパ節受容体キナーゼドメインのいずれかで構成され、LOVドメインに融合しています(図1B、E)。青色光曝露はLOVホモ二量体化を引き起こし、受容体キナーゼドメインの相互作用を引き起こし、それぞれのSmadリン酸化と経路の活性化を引き起こします(図1C、F)。bOpto-BMPでは、Acvr1l(別名Alk8)およびBMPR1aa(別名Alk3)由来のI型受容体キナーゼドメインおよびBMPR2a由来のII型受容体キナーゼドメインとのコンストラクトの組み合わせが、シグナル伝達を最適に活性化することがわかった38(Addgene #207614、#207615、および#207616)。bOpto-Nodalでは、Acvr1ba由来のI型受容体キナーゼドメインおよびAcvr2ba由来のII型受容体キナーゼドメインとのコンストラクトの組み合わせが用いられる39。
bOpto-BMP/Nodalは、1細胞段階でmRNAを注入することにより、初期のゼブラフィッシュ胚に導入され、ノード解釈におけるシグナル伝達時間の役割を調査し39、ゼブラフィッシュがノードに応答する能力を失う理由を決定し45、BMP標的遺伝子がさまざまなBMPシグナル伝達レベルにどのように応答するかを調べるために使用されています38.これらのツールは、今後もさまざまな調査に役立つと思われます。しかし、光遺伝学的シグナル伝達活性化因子の強みは弱点でもあるため、光感受性サンプルは、不注意な異所性シグナル伝達活性を避けるために慎重に処理する必要があります。室内の光や日光にさらされると、bOpto-BMP/Nodalが活性化されます。
このプロトコルは、初期のゼブラフィッシュ胚でmRNAコード化されたLOVベースのBMPおよび結節活性剤を使用するための実用的な提案を提供します。まず、均一な光の露出と温度を制御するライトボックスを構築するための1つの戦略を詳述します(図2、補足ファイル1、補足ファイル2、補足ファイル3、補足ファイル4、補足ファイル5、補足ファイル6、補足ファイル7、補足ファイル8)。次に、光遺伝学的シグナル伝達活性化因子が期待どおりに振る舞うかどうか、つまり、光に曝露されたときにのみ経路活性を活性化するかどうかを判断する2つの重要な対照実験について説明します(図3)。最初の対照アッセイでは、光曝露胚と非曝露胚の受精後1日の表現型を調べます(図3A)。mRNAを注入した光曝露胚(非曝露胚は除く)は、BMPまたはリンパ節の過剰発現を表現コピーする必要があります(図4A、B;特にBMP表現型は、この時点で明確に区別できる46)。このアッセイは、迅速な活性読み出しを提供します。第2のコントロールアッセイでは、表現型が過剰なBMPまたはリンパ節シグナル伝達によって特異的に引き起こされるかどうかを決定し、シグナル伝達レベルの変化を直接観察するために、免疫蛍光染色を使用して、シグナル伝達活性が十分に記述されている場合、胞胚後期/原腸形成期初期の前後の20分間の光曝露後にリン酸化シグナル伝達エフェクター(それぞれpSmad1/5/9またはpSmad2/3)を検出する12、 16、17、47、48、49、50(図3Bおよび図4C)。(bOpto-BMP38 と bOpto-Nodal39 の両方で空間的に局在した活性化が実証されていますが、このプロトコルでは均一な光曝露とシグナリング活性化戦略についてのみ説明しています。理想的な局所実験条件を決定するために、特定の研究課題にbOpto-BMP/Nodalを適用する前に、これらの対照実験を実行することをお勧めします。
プロトコル
ゼブラフィッシュの研究プロトコルは、米国国立衛生研究所のNICHD動物管理および使用委員会(ASP 21-008)によってレビューされ、承認されました。すべてのゼブラフィッシュ研究は、実験動物の飼育と使用に関するガイドに準拠して実施されました。
1. ライト ボックスを造ること
- 光の露出と温度を制御するには、発光ダイオード(LED)マイクロプレートイルミネーターを光源として使用するライトボックスを構築します(図2A、 材料表、補足 ファイル1、補足ファイル2)。このカスタマイズ可能なイルミネーターは、複数の波長にわたって動的でプログラム可能な制御を提供します。
注:ライトボックスを構築するには多くの可能な戦略があり、別のアプローチがより適切な場合があります(たとえば、Gerhardt et al.51、Bugaj et al.52、Kumar and Khammash53、および https://www.optobase.org/materials/ の詳細を参照)。 - ライトボックスに次の機能を含めます:温度制御(28°Cはゼブラフィッシュの胚にとって理想的です)、不要な光(部屋の光や日光など)の排除、ターゲット領域(6ウェルプレートなど)をカバーする青色光の均一な送達、および光強度と露出ダイナミクスの制御。
注:bOpto-BMP/Nodalは青色光によって活性化されますが、一部の光遺伝学的ツールは他の波長に反応します。オプトジェネティックツールに適した波長を使用してください。 - インキュベーター(図2B)の上部に、LED出力レンズよりわずかに広い穴を開けます。
- インキュベーターの上部に穴あけによって破壊される電気部品がないことを確認します(材料表)。これは、インキュベーターの製造元に連絡し、直接尋ねることで確認できます。
- インキュベーターのトップパネルに既存の穴がある場合は、ステップドリルを使用して穴のサイズを1.25インチに増やします。それ以外の場合は、アーバー付きの1.25インチのホールソーを使用します。
- 光源を遮る内部パネルがある場合は、ライトコーンがふさがれないように適切なサイズの穴を開けます(図2A)。パネルは通常、薄い板金でできているため、損傷を防ぐために低速と金属製のドリルビットを使用してください(コバルトドリルビットを推奨)。
- LEDマイクロプレートイルミネーターをインキュベーターの上部に固定するためのLEDホルダーを構築します(図2C、補足ファイル3、補足ファイル4、補足ファイル5、補足ファイル6、補足ファイル7、補足ファイル8)。
- M3 ネジを使用して、4 つの M3 キューブ スタンドオフを垂直ブラケットに取り付けます。
- 2つのサイドブラケットを垂直ブラケットのキューブスタンドオフの左右に取り付けます。別のキューブスタンドオフをサイドブラケットの残りの穴に取り付けます。
- M6ネジを使用して、垂直ブラケットピースをLEDマイクロプレートイルミネーターアセンブリ(材料表)に取り付けます。LEDレンズガスケットをLEDシステムレンズの上に置きます。
- 組み立てた部品をインキュベーターパネルマウントに取り付け、次に垂直ブラケットとサイドブラケットのM3スタンドオフに取り付けます。インキュベーターガスケットをインキュベーター上部に開けた穴の上に置きます。
- インキュベーターパネルマウントをインキュベーターガスケットの上に置き、ガスケットとパネルの開口部がインキュベーターの穴と同心円になっていることを確認します。8番のネジを使用してパネルをインキュベーターの上部に取り付けます。このシールが遮光性であることを確認してください。
- インキュベーターの一番上の棚に6ウェルプレートを置きます。光線がプレートを均一に覆っているかどうかを確認します(図2A)。紙を使用して、光のカバレッジを視覚化します。
- プレート全体がビームで覆われていない場合は、シェルフを下に移動してLEDとプレートの間の距離を広げます。ここで説明するシステムでは、LED とシェルフの間には ~14 インチで十分です。
- 照度計を使用して、放射照度レベルと空間均一性を決定します(材料表)。
- 不注意な日光や室内光への曝露を避けるために、ウェザーストリップを使用して、インキュベーターのドアが遮光性であることを確認してください(図2A)。
- ゼブラフィッシュの胚は28°Cで頑健に発育する54。メモリカード温度計を使用して、ライトボックスが28°Cを保持するようにします。
2. 注射用mRNAの作製
注:pCS2+は、bOpto-BMPコンストラクト38 およびbOpto-Nodalコンストラクト39のベクターバックボーンです。このベクターはアンピシリン耐性です。.bOpto-BMPは、3つのコンストラクトで構成されています(図1B):BMPR1aa-LOV(Addgene#207614):LOVに融合したI型BMPR1aa受容体(別名Alk3)の推定キナーゼドメイン。Acvr1l-LOV(Addgene#207615):LOVに融合したI型Acvr1l受容体(別名Alk8)の推定キナーゼドメイン;およびBMPR2a-LOV(Addgene#207616):LOVに融合したII型BMPR2a受容体およびそれに続くC末端ドメインの推定キナーゼドメイン。bOpto-Nodalは、2つのコンストラクトで構成されています(図1E):Acvr1ba-LOV:LOVに融合したI型Acvr1ba受容体(別名Acvr1b)の推定キナーゼドメイン。Acvr2ba-LOV:LOVに融合したII型Acvr2ba受容体(別名Acvr2b)の推定キナーゼドメイン。
- プラスミドを直鎖化するには、NotI制限酵素を用いて37°Cで1〜3時間、2〜5μgのプラスミドDNAを消化します(材料表)。
注:プラスミドをPCRテンプレートとして使用して直鎖状DNAを生成することも可能です。 - 標準的なカラムベースの精製キット(材料表)を使用してDNAを精製します。
- mMessage mMachine キットなどの in vitro SP6 転写キットを使用して、直鎖状テンプレートから RNA を転写します(材料表)。メーカーの推奨に従って2つの反応を設定し、より高い収率を確保します。
- 標準的なカラムベースのRNAクリーンアップキット(材料表)を使用してRNAを精製します。また、沈殿による精製も可能です。
3. mRNAの注入
- 注射の少なくとも1日前に、注射皿とアガロースコーティングされた6ウェルプレートを作ります。
- ゼブラフィッシュ胚培地に1%アガロース200 mLを調製し、アガロースが完全に溶解するまでマイクロ波で加熱します。標準的なゼブラフィッシュ胚培地であれば、どれでも構いません。ただし、メチレンブルーは他のアプリケーションで下流のイメージングに影響を与える可能性があるため、胚培地から除外してください。
- 溶融したアガロースを100 mm x 15 mmのプラスチック製シャーレに慎重に注ぎます。皿を半分まで満たします。
- 注入皿型を胚培地ですすぎ、溶融アガロースの上に静かに置き、型とアガロースの間に気泡が閉じ込められないようにします。テープを使用して金型の背面にタブを作成し、簡単に配置および取り出すことができます。
- カビは溶融アガロースに浮かんでいるはずです。金型が沈んだ場合は、溶融アガロースから慎重に取り出し、手順3.1.3を繰り返します。
- アガロースが固まったら、タブを使用して金型をそっと取り除きます。これは、皿を4°Cに置くことで加速できます。
- 免疫蛍光実験のために脱コリオン化胚を扱う場合は、アガロースでコーティングされた6ウェルプレートを作製してください。
- 使い捨ての 10 mL プラスチックピペットを使用して、6 ウェルプレートの各ウェルの底を覆うのに十分な溶融アガロースを移送します。
- 注入ディッシュと 6 ウェルプレートは 4 °C で保管してください。 それらはすぐに使用するか、アガロースが乾燥または汚染されるまで(通常2〜3週間)保存することができます。
- 免疫蛍光実験のために脱毛胚を扱う場合は、フレームガラス製ピペットチップを調製してください。
- ガラスピペットの端をブンゼンバーナーの炎に挿入し、端が滑らかになるまで連続的に回転させます。脱絨毛胚は、ピペットの端に快適に収まる必要があります。開口部が胚の直径より下に縮小しないようにしてください。
- マイクロインジェクションニードルを購入するか、引きます(材料表)。交換が必要な場合に備えて、注射当日に予備の針を用意しておくことをお勧めします。
- 注射の前日に、研究所の標準作業手順書(SOP)に従ってゼブラフィッシュのブリーダーを設置します。オスとメスを分けてください。
- ライトボックスの温度調節器のスイッチを入れて、28°Cを維持します。 ライトボックスの温度が28°Cにとどまるようにするには、メモリカード温度計(材料表)を使用して温度を監視します。
- mRNA注入ミックスを調製します。各コンストラクトの等モル量を注入します。注入する量を経験的に決定する必要があります。
- bOpto-BMP転写産物のサイズは以下の通りです。
Acvr1l-LOV = 2007ヌクレオチド(nt)
BMPR1aa-LOV = 1983 nt
BMPR2a-LOV = 3409 nt - 等モル量を注入するには、BMPR1aa の 1.01 倍の Acvr1l コンストラクトを注入します。BMPR1aa の 1.72 倍の BMPR2a コンストラクトを注入します。
- bOpto-Nodal転写産物のサイズは次のとおりです。
Acvr1ba-LOVとAcvr2ba-LOVはどちらも1962 ntです。 - 等モル量を注入するには、各コンストラクトを同量注入します。
- 1つの経路を標的とするすべてのmRNAを1つの注入ミックスに組み合わせて、等モル注入ミックスを調製します。必要に応じて、フェノールレッド注入トレーサーを含めます。 図4に示すデータでは、各bOpto-Nodalコンストラクト(Acvr1ba-LOVおよびAcvr2ba-LOV)を15 pg、bOpto-BMPでは7.8 pgのAcvr1l-LOVおよびBMPR1aa-LOV、および13.4 pgのBMPR2a-LOVを使用しました。
- 注入液は -20 °C で保存してください。 注入ミックスの最適濃度が決定されたら、5〜10 μLのアリコートを作成し、-20°Cまたは-80°Cで保存します。.
- 注射日
- 表現型アッセイ(図3A)を実施する場合は、ラボのSOPに従って、1細胞段階で絨毛膜から細胞の中心に直接注入します。絨毛膜は、環境ストレス要因から胚を保護し、溶解した胚を封じ込めます。これは、溶解した胚を正確に定量するためのスコアリングに役立ちます(図4A、B)。
- 免疫蛍光アッセイ(図3B)を実施する場合、イメージングのために胚を最終的に脱絨毛する必要があります(図4C)。従って、1細胞の段階でdechorionated胚のセルの中心に直接注入して下さい(dechorionatingプロトコルのためのロジャース等55 を見なさい)。あるいは、固定後に胚を手動で脱毛することもできますが、これはプロナーゼによる脱毛よりも面倒です。
- 脱コリオン化胚を処理するには、フレームガラスピペットを使用します(ステップ3.1.10)。脱毛胚を空気やプラスチックにさらさないように注意してください。脱毛した胚を優しく取り扱ってください。
- ステージの進行を評価するための代理として、注射されていない胚の追加皿を準備します(ステップ4.3.5を参照)。代理胚が同じ実験胚のセットからのものであることを確認し、すべての胚が同じ親から同時に受精したことを確認します。これは、病期が関連する免疫蛍光アッセイには有用ですが、表現型アッセイには不要です。
- 表現型アッセイと免疫蛍光アッセイの両方に、1)非注入、非曝露、2)非注入、光に曝露、3)注入、非曝露、4)注入、光に曝露された条件を使用します。条件ごとに少なくとも 30 個の胚を選択します。最適な胚の健康のために、6ウェルプレートでウェルあたり30個を超える胚をインキュベートしないでください。
- 注入後、胚を標識ペトリ皿またはアガロースコーティングされた6ウェルプレート(脱コリオン化胚用)に移し、28°Cでインキュベートします。 胚はまだ光感受性ではありません。注入された胚は、受精後1.5時間(hpf)後に光に敏感であるかのように扱います。
4. 露光実験
注:放射照度45 W/m2 の~450 nmの光への曝露は、明らかな光毒性なしにbOpto-BMP/Nodalを強力に活性化します(露出計の情報については、 材料表を参照してください)。光遺伝学的に活性化されたシグナル伝達のレベルは、放射照度値38を変更することによって調整することができる。ただし、光毒性はより高い放射照度で評価する必要があります。
- 時間的制約のあるステップ。4〜16細胞の段階で、約1.5hpfで、未受精で不健康な胚を取り除きます。必要に応じて再分配し、各ウェルに同じ数の胚(30個以下)を確保します。
注:注入されたmRNAがタンパク質に翻訳されると、胚が光感受性になるため、4〜16細胞の段階でこのステップを実行することが重要です。胚が1.5hpfより前に有意に光感受性であるという証拠は観察されていない。1.5 hpf以降の胚を評価する場合、不注意による光活性化を最小限に抑えるには、赤色光を使用するか、LOV二量体化青色波長を遮断する赤色ゲル濾紙で光源(顕微鏡ステージを含む)を覆います(材料表)。- 胚を一貫して評価し、条件と実験の間の偏りのない分布を確保します。
- 表現型アッセイには、1.5 hpfから始まる次の1日間の光曝露プロトコルを使用します(図3A)。
- 露出していないコントロールプレートをアルミホイルで包みます。このプレートには、非注入胚と注入胚の両方を含める必要があります。プレートが完全に覆われていることを確認し、ホイルに裂け目が入らないように注意してください。このプレートを28°Cライトボックス(図2A)の下部棚に置きます。
- 露出プレートを28°Cライトボックスの一番上の棚に置きます(図2A)。胚培地の蒸発を防ぐために、カバーが皿にあることを確認してください。青色ライトをオンにします(45 W / m2 の放射照度はシグナリングを確実にアクティブにします)。
- ライトボックスのドアを閉めて、不注意な室内光の露出を避けてください。必要に応じて、ドアを閉める前に、ライトボックス内にメモリカード温度計を含めます。受精後1日で表現型がスコアリングされるまでドアを開けないでください(dpf;ステップ5.1を参照)。
- 免疫蛍光アッセイでは、胚を約40%エピボリー56 (~6 hpf)から20分間青色光に曝露し、曝露後すぐに非曝露対照とともに固定します(図3B)。エピボリー40%で20分間の青色光曝露は、シグナリングを再現性よく活性化します。
- 約1.5 hpfで、露出した皿と露出していない皿の両方をアルミホイルで別々に包みます。皿が完全に覆われていることを確認し、ホイルに裂け目が入らないように注意してください。プロキシディッシュは包装されていないままにしておきます。包装されたディッシュと包装されていないプロキシディッシュを28°Cのライトボックスに入れます(図2A)。まだLEDをオンにしないでください。
- 複数の量のmRNAを試験する場合、非曝露条件では、異なる量で注入された胚を個々のアガロースコーティングされた6ウェルプレートに分類すると、その後の固定中に不注意による光への曝露を最小限に抑えることができます。
- ライトボックスのドアを閉めて、不注意な室内光の露出を避けてください。
- ホルムアルデヒドストックを1xリン酸緩衝生理食塩水(PBS)で4%に希釈し、1 mLを事前に標識した2 mL丸底微量遠心チューブに1 mLを分注します。4°Cで保存してください。
- 5 hpf付近で、非注入胚を含むプロキシディッシュを取り出し、解剖スコープを使用して発生段階を評価します。代理胚の段階は、包装された皿の中の光感受性胚の段階を反映する必要があります。
- 包まれた皿も取り除いて、すべての皿が同じ温度になるようにします。代理胚が40%エピボリー(~6 hpf)に達するまで繰り返します。胚発生の進行は温度に敏感である54。したがって、皿がインキュベーターの外にいる時間が長ければ長いほど、胚が40%エピボリーに達するのに時間がかかります。
- 代理胚が40%エピボリーに達したら、露出した皿を開封し、ライトボックスの一番上の棚に置きます(図2A)。露出していない皿を包んだままにして、下の棚に置きます。すぐに青色のライトをオンにし、ドアを閉め、タイマーを20分にセットします(45 W / m2 の放射照度はシグナリングを確実にアクティブにします)。
- 固定の準備として、室内の光をできるだけ外します(窓のブラインドを閉める、頭上の照明を消す、スクリーンを消すなど)。ホルムアルデヒド含有チューブに適切なラベルが貼付されていることを確認してください。固定の直前に、ホルムアルデヒド含有チューブを4°Cから取り外し、ライトボックスの隣に置きます。
- 時間と光に敏感なステップ。20分間の光の露出の終わりに素早く動く準備をしてください。20分後、ライトボックスのドアを開き、露出していない皿を取り外します。
- フレームガラス製ピペットチップを使用して、光に敏感な胚を4%ホルムアルデヒドの対応するチューブにすばやく穏やかに移します。
- 不注意な光への曝露を避けるために、光感受性胚の移植時間(<45秒)を最小限に抑えます。ピペットに気泡がないことを確認してください。空気にさらされると、脱毛胚が破壊されます。
- 胚をホルムアルデヒドに放出するには、ガラスピペットチップをホルムアルデヒドに浸し、胚を液体に沈めます。ホルムアルデヒドに移される胚培地の量は、胚を先端の端に置いておくことで最小限に抑えます。
- 胚を移植した後、ピペットを同じウェルに戻し、上下にピペットで移動して詰まった胚を取り除きます。これにより、複数の状態の胚が誤って1つのチューブに収まるのを防ぎます。
- すぐに、曝露されていない、注射されていない胚に対して手順4.3.11〜4.3.13を繰り返し、続いて露出した胚(注射および非注射)を繰り返します。
- 固定胚を4°Cで一晩保存します。
5. 実験評価
- 表現型のスコアリングとイメージング
- 1 dpfで、理想的には24〜32 hpfで、ライトボックスから胚を取り除き、解剖スコープを使用して表現型を評価し、スコアリングルーブリックを作成します。これが実験的なエンドポイントです。不注意による光活性化はもはや問題ではありません。
- 絨毛膜にいる間に胚にスコアを付けて、簡単にします。ピペットまたはプローブを使用して胚を動かし、複数の角度から見ることができます。
- 過剰なBMPシグナル伝達を経験している胚は、Kishimotoらに詳述されているように、さまざまな程度の重症度で腹側化されます。199746(図4A、左パネル)。過剰な節間シグナル伝達を経験している胚は、過剰な中胚葉に関連するさまざまな発達障害を持っています(図4A、右パネル)1,3,47,57,58,59,60。多くの場合、1 dpf で溶解します。
- すべての条件で各胚をスコアリングします(図4B)。各ウェル内のすべての胚の概要画像を取得します。必要に応じて、メチルセルロース中の個々の代表的な胚を脱コリオン化して画像化します(図4A)。
- 免疫蛍光染色とイメージング
- 胚を4%ホルムアルデヒド中で4°Cで一晩インキュベートした後、ホルムアルデヒドを除去し、Tween20(PBST)を含む1xリン酸緩衝生理食塩水で3〜5回洗浄します。PBSTを除去し、100%メタノールを添加します。
- チューブを閉じ、静かに反転させて、残留PBSTとメタノールを混合します。メタノールで2回洗浄し、-20°Cで少なくとも2時間保存し、数年間保存します。
- pSmad1/5/9 (BMP)のimmunofluorescenceのプロトコルについてはロジャース等見なさい38。pSmad2/3 (結節点)のimmunofluorescenceのプロトコルについては、van Boxtel等17およびRogers等47を見なさい。
- 免疫染色された胚を、光学切片化が可能な顕微鏡(例えば、共焦点顕微鏡またはライトシート顕微鏡)を用いて画像化する。飽和を避け、同じ抗体で染色されたすべてのサンプル間で同一のイメージング条件を維持します。
- 蛍光は時間の経過とともに退色する可能性があるため、免疫蛍光染色が完了してから5日以内に画像化してください。
代表的な結果
ここで説明する2つの対照実験の目的は、bOpto-BMP/Nodalが、光の非存在下でのシグナル伝達に影響を与えることなく、青色光曝露に応答してそれぞれの経路を活性化するかどうかを判断することです。これらのコントロールを使用して、ラボで適切な実験ワークフローを確立してから、関心のある研究課題に bOpto-BMP/Nodal を適用してください。
表現型アッセイはわずか2日で完了し、シグナル伝達活性と光毒性の有用な指標を提供します(図3A)。注入された青色光曝露胚は、過剰なBMPシグナル伝達を表現写し出す必要があります(腹側化46;図4A、左パネル)またはリンパ節シグナル伝達(余分な中胚葉1,3,47,57,58,59,60に関連する発達障害(図4A、右パネル))。注入した場合、光に曝露された胚はアフェノチピクであり、mRNAの品質をテストし、さらに注入することを検討し、明るい光に常に曝露されるように光曝露戦略を再確認します(放射照度45 W/m2の~450 nmの光はシグナル伝達を強く活性化する必要があります)。対照的に、注入された非曝露胚は、注射されていない兄弟姉妹と同じに見えるはずです。注入された場合、未曝露胚は表現型を示し、注入するmRNAの量を減らし、未曝露胚が光曝露から保護されるように実験セットアップを再評価します。図4Bに示したデータは、適切なmRNA量と曝露条件での典型的な表現型実験の結果を示しています:注入された光曝露された胚では強いシグナル伝達活性が明らかであり、注入された非曝露された胚のごく一部のみが表現型を示します。
表現型アッセイは、光毒性を評価する機会も提供します。光毒性が無視できる場合、非注入、光曝露胚は、非注入、非曝露胚と同様に野生型に見えるはずです。非注入で光に曝露された胚に欠陥があるが、非注入で曝露されていない胚には欠陥がない場合は、光放射照度を減らすことを検討してください。45 W/m2 の放射照度は、明らかな光毒性なしにシグナリングを強力に活性化します。 図4B に示すデータは、非注入、光曝露、および非注入、非曝露胚の間に懸念される違いを示さず、無視できる光毒性を示しています。
免疫蛍光アッセイは、表現型アッセイ(2日)と比較してより多くの時間と労力(~1週間)を必要としますが、免疫蛍光染色はシグナル伝達経路の活性を直接読み取ることができ、肉眼的形態では反映されない可能性のある微妙なシグナル伝達の変化を明らかにする可能性があります。過剰なリンパ節シグナル伝達は、過剰なBMPシグナル伝達に特徴的な特異的な腹側化表現型とは対照的に、胚が1 dpf(多くの原因を持つ可能性がある)によって溶解することが多いため、bOpto-Nodalに対する応答を評価するために特に重要です46 (図4A)。注入された青色光曝露胚は、注入されていない光曝露胚と比較して、Smad1/5/9またはSmad2/3リン酸化が均一に増加するはずです。濃度が上昇しない場合、またはわずかにしか増加しない場合は、mRNAの品質をテストし、さらに注入することを検討し、光照射戦略を再確認してください。放射照度45W/m2 、約40%エピボリーの青色光に20分間曝露すると、シグナル伝達が強く活性化するはずです。pSmad染色が不均一な場合は、mRNAを(卵黄ではなく)細胞の中心部に注入すると、mRNAの分布がより均一になる可能性があります。
注入された未曝露胚は、非注入胚に匹敵するpSmadレベルを有するべきである。逸話として、bOpto-BMPよりもbOpto-Nodalの方が漏れやすいSmadリン酸化が観察されています。注入された未曝露胚でpSmadレベルが上昇した場合は、注入するmRNAの量を減らします。さらに、1)曝露されていない胚が不注意に光にさらされていないこと、および2)固定中の光曝露が最小限であることを確認するために、実験設定を再評価します。固定ステップでは、ライトボックスからの取り外しとホルムアルデヒドへの浸漬の間に45秒以内の経過を許可することが重要です。さらに、このステップでは、窓のブラインドを閉める、白色光源をオフにする、赤色光を使用する、または白色光源を青色遮光ゲル濾紙で覆うことにより、室内光と日光への曝露を最小限に抑えます(材料表)。
図4Cのデータは、適切なmRNA量と光曝露条件での典型的な免疫蛍光染色実験の結果を示しています:pSmadレベルは、非注入胚と非曝露胚で類似しているのに対し、注入された光曝露胚はより高いレベルのSmadリン酸化を示します。
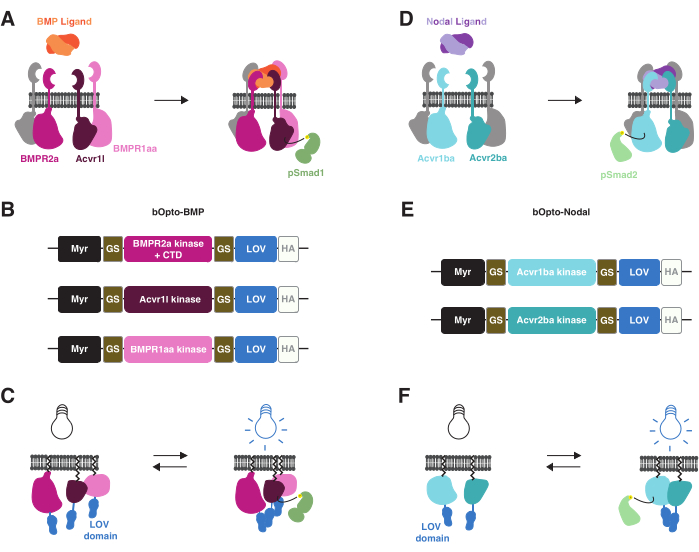
図1:bOpto-BMPおよび-Nodalシグナル伝達活性化戦略 。 (A)BMPリガンド結合により内因性BMPシグナル伝達経路が活性化され、I/II型受容体複合体の形成、Smad1/5/9のリン酸化、BMP標的遺伝子の発現が引き起こされる。I型受容体BMPR1aaおよびAcvr1lは、それぞれAlk3およびAlk8としても知られている。BMPR2aはII型受容体です。(b)bOpto-BMPコンストラクト38。BMPR1aaおよびAcvr1l由来の推定キナーゼドメインはLOVに融合する。BMPR2a-LOV融合体には、推定キナーゼドメインと受容体C末端ドメイン(CTD)が含まれています。すべての融合は、ミリストイル化モチーフ(Myr)で膜を標的としています。範囲はグリシン セリン(GS)のリンカーによって分かれている。コンストラクトは、CTDでHAエピトープタグでタグ付けされます。この3つのコンストラクトの組み合わせは、BMPシグナル伝達を最適に活性化することがわかった。(C)bOpto-BMPを介したBMPシグナル伝達の活性化。青色光を照射すると、LOVドメインが二量体化し、複雑な形成とシグナル伝達の活性化を引き起こすと考えられています。(D)内因性ノードシグナル伝達経路は、ノードリガンド結合によって活性化され、I/II型受容体複合体の形成、Smad2/3のリン酸化、およびノード標的遺伝子の発現につながります。I型受容体Acvr1baおよびII型受容体Acvr2baは、それぞれAcvr1bおよびAcvr2bとしても知られている。(E)bオプトノード構築物39。Acvr1baおよびAcvr2ba由来の推定キナーゼドメインがLOVに融合します。すべての融合は、ミリストイル化モチーフ(Myr)で膜を標的としています。ドメインはGSリンカーで区切られます。コンストラクトは、CTDでHAエピトープタグでタグ付けされます。(F)bOpto-Nodalを介したNodalシグナル伝達の活性化。青色光を照射すると、LOVドメインが二量体化し、複雑な形成とシグナル伝達の活性化を引き起こすと考えられています。 この図の拡大版をご覧になるには、ここをクリックしてください。
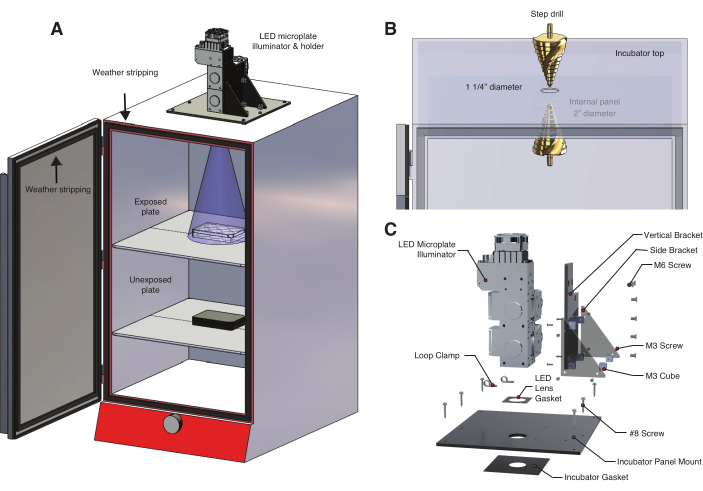
図2:光遺伝学的実験用の温度制御ライトボックス 。 (A)LEDマイクロプレートイルミネーターは、特注のLEDホルダーを使用してインキュベーターの上部に取り付けられます。最初の棚の6ウェルプレート内のゼブラフィッシュの胚は、インキュベーターの上部に開けられた穴から光にさらされます。下部の棚には、アルミニウム箔で包まれた6ウェルプレートに2組目の未露光対照胚が収められています。インキュベーターのドアは、部屋の光や日光に不注意にさらされるのを防ぐために、ウェザーストリップで裏打ちされています。(B)ステップドリルを使用してインキュベーターに穴を開ける手順の詳細。ここで使用したインキュベーターモデルには、2つ目の大きな穴を開ける必要のある内部パネルがあります(材料表)。(C)3波長照明システム用に設計されたカスタムLEDホルダーの詳細。 この図の拡大版をご覧になるには、ここをクリックしてください。
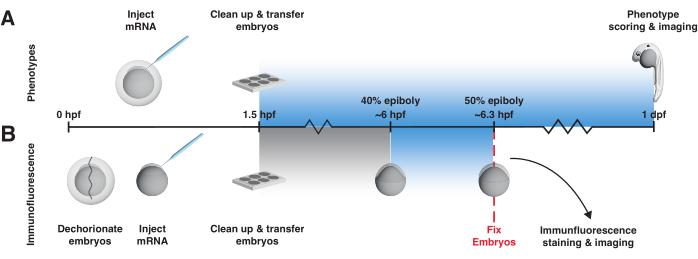
図3:bOpto-BMP/Nodal実験のワークフロー。 bOpto-BMP/Nodalの活性をテストするための表現型アッセイとpSmad免疫蛍光染色。胚は1細胞段階でmRNAを注入され、受精後1.5時間以内(hpf)にライトボックスに移されます。(A)表現型アッセイ。注入された胚と注射されていない兄弟姉妹は、暗闇で飼育されるか、1.5 hpfから受精後1日(DPF)まで均一な青色光にさらされます。光遺伝学的シグナル伝達活性は、過剰な経路活性と一致する表現型について胚をスコアリングすることによって評価できます。(B)pSmad免疫蛍光染色。注入された胚と注入されていない兄弟姉妹は、40%のエピボリー(~6 hpf)まで暗闇で飼育されます。次に、注入された胚の半分と注入されていない胚の半分を、均一な青色光に20分間さらします。曝露後、すべての胚を固定し、pSmadの免疫蛍光染色を行います。pSmad1/5/9またはpSmad2/3の上昇レベルは、それぞれBMPまたはリンパ節シグナル伝達の光遺伝学的活性化を反映しています。 この図の拡大版をご覧になるには、ここをクリックしてください。
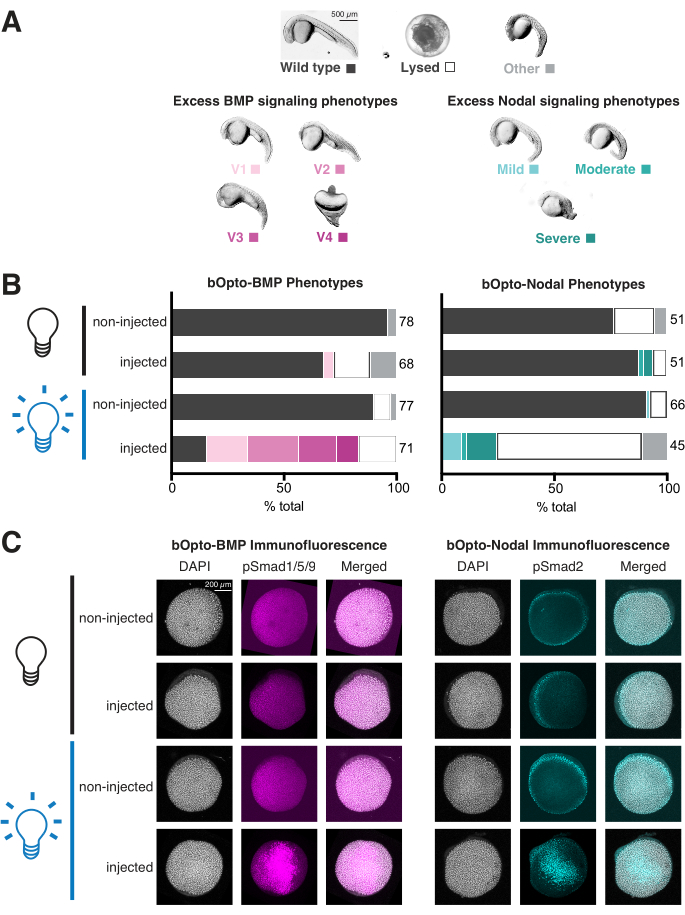
図4:ゼブラフィッシュ胚における光活性化シグナル伝達応答の評価。 ゼブラフィッシュの胚を1細胞期にbOpto-BMP/NodalをコードするmRNAを注入しました。(A)胚は、暗闇で飼育するか、受精後1.5時間(hpf)から均一な青色光に曝露しました。表現型は受精後1日(dpf)で採点されました。代表的な表現型が示されています。過剰なBMPシグナル伝達は腹側形成(左パネル)を引き起こし、過剰なリンパ節シグナル伝達は余分な中胚葉(右パネル)に関連する発達障害を引き起こします。スケールバー = 500 μm。 (B)表現型の定量化。注入された胚と注入されていない兄弟姉妹は、1.5 hpf(黒い球根)から暗闇で飼育されました。注入された胚の半分と注入されなかった胚の半分は、均一な青色光(青色電球)に曝露されました。(C)注入された胚と注入されていない兄弟姉妹は、1.5 hpf(黒い球根)から暗闇で飼育されました。40%エピボリー(~6hpf)で、注入された胚の半分と注入されなかった胚の半分が均一な青色光(青球)に曝露された。20分後、すべての胚を固定し、リン酸化Smad1/5/9またはSmad2/3のいずれかについて免疫蛍光染色を行った。pSmad強度が高いほど、BMP/リンパ節シグナル伝達が増加していることをそれぞれ示します。スケールバー = 200 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。
補足ファイル1:ライトボックスのフルアセンブリ。 ライトボックスアセンブリ全体の3Dビューを示す3D PDFファイル。 このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル2:ライトボックスの分解図。 分解されたライトボックスアセンブリの 3D ビューを示す 3D PDF ファイル。 このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル3:大型ライトガスケット。 CAD 図面ファイル (.DWG形式)を使用して、レーザーカッターを使用してLEDホルダー用の大きなライトガスケットを製造します。 このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル4:小型軽量ガスケット。 CAD 図面ファイル (.DWG形式)を使用して、レーザーカッターを使用してLEDホルダー用の小さなライトガスケットを製造します。 このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル5:アクリルプラットフォームベース。 CAD 図面ファイル (.DWGフォーマット)を使用して、レーザーカッターを使用してLEDホルダーアクリルプラットフォームベースを製造します。 このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル6:アクリルプラットフォーム垂直。 CAD 図面ファイル (.DWGフォーマット)を使用して、レーザーカッターを使用してLEDホルダーアクリルプラットフォームを垂直に製造します。 このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル7:アクリルサポート左。 CAD 図面ファイル (.DWG形式)を使用して、レーザーカッターを使用してLEDホルダーのアクリル左支持体を製作します。 このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル8:アクリル支持権。 CAD 図面ファイル (.DWG形式)を使用して、レーザーカッターを使用してLEDホルダーのアクリル右支持体を製作します。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
mRNAの注入は、ゼブラフィッシュの胚にbOpto-BMP/Nodalを導入するための現在の戦略です。この方法にはいくつかの欠点があります。まず、mRNAの適切な量はラボによって異なります。使用される量は、光の露出でシグナリングを強力に活性化するのに十分な量である必要がありますが、不注意による暗い活性化はありません。最適なmRNAレベルを見つけるためにいくつかの量をテストし、確立されたら、マスターミックスのアリコートを作成して、同じ量のmRNAを再現性よく導入することをお勧めします。第二に、注入されたmRNAの不均一な分布は、不均一なシグナル伝達活性化につながる可能性があります。卵黄ではなく細胞の中心部に注入することで、mRNAの均一な分布が促進されると考えられています。最後に、注入されたmRNAは時間の経過とともに分解されるため、このアプローチは古い胚での実験には適していない可能性があります。将来的には、これらの問題は、母体または薬物誘導性のプロモーターを持つbOpto-BMP/Nodalを遍在的に発現するトランスジェニックゼブラフィッシュ系統によって対処できる可能性があります。光感受性の可能性がある成体のゼブラフィッシュを扱うことは、この文脈では難しいかもしれませんが、ゼブラフィッシュ61,62とショウジョウバエ22,34,35,63のトランスジェニックは、光遺伝学的ツールを保有することに成功しています。
不注意による光活性化の回避は、オプトジェネティックツールにおける一般的な課題です。簡単にするために、1.5 hpfを超える注入された胚は光感受性として扱います。不注意による光の露出は、多くの場合、皿や皿をアルミホイルで包むだけで回避できます。ただし、1.5 hpfを超える生胚の目視観察を必要とする実験では、赤色光源を使用したり、白色光源をLOV二量体化波長を遮断する安価なゲル濾紙で覆ったりすることが可能です(材料表)。
ここで説明するライトボックスは、光の放射照度レベル、ダイナミクス、および波長を正確に制御する必要がある特定のアプリケーション向けに設計されています(図2)。このライト ボックスの他の利点は多数の6-well版のための均一軽い露出、わずかな不注意なサンプルの暖房、十分なスペース、および長命、スペクトル的によく特徴付けられる光源を含んでいる。ただし、研究用途によっては、異なる光照射戦略が望ましい場合があります。多くのラボでは、インキュベーターをLEDストリップで裏打ちしたり、サンプルの上にLEDパネルを吊り下げたり、培養皿の蓋にLEDを組み込んだりするなど、設置面積が小さく、よりシンプルで費用対効果の高い均一な光露光システムを開発しています32、38、39、40、64、65、66.重要なことに、このプロトコルで使用されるライトボックスは、ユーザーが(Bugaj et al.52とは対照的に)個々のウェルを独自に調整したり、光曝露の空間制御を提供したりすることはできません。空間的に局在した光遺伝学的活性化は、SPIMまたは共焦点系のレーザーを使用したbOpto-BMP38およびbOpto-Nodal39でそれぞれ実証されており、さまざまなモデルシステムにおける他の多くの光遺伝学的戦略でも実現されています(Rogers and Müller12で説明)。いくつかのアプローチは、細胞内の空間分解能29,30,31を達成しています。空間的に局在する光露光システムの実装は、このプロトコルの範囲外ですが、bOpto-BMP/Nodalによる空間活性化実験は、デジタルマイクロミラーデバイスやマスキングアプローチなどの特殊な機器を使用して理論的に可能です。読者は、光照射戦略にコミットする前に、光遺伝学的実験用のDIYライトボックスに関する広範な文献を探索することをお勧めします(たとえば、https://www.optobase.org/materials/ Gerhardt et al.51、Bugaj et al.52、Kumar and Khammash 53などを参照)。
分子光遺伝学的戦略は、変異体、異所性遺伝子発現、組換えタンパク質、薬物などの従来のアプローチと比較して、生物学的プロセスに対する高度な時空間制御を提供することがよくあります。光遺伝学的アプローチの利点に関心のある読者は、ゼブラフィッシュや他の生物で利用可能な他の公開ツールを調べることができます。これらには、追加のシグナル伝達経路を操作するツール32,65,67,68、遺伝子発現の調節61,64,66,69,70,71、タンパク質局在の改変31,72、およびアポトーシスの活性化62が含まれます.これらのツールやその他多くのツールは、分子オプトジェネティクスアプローチのためのキュレーションされたWebリソースであるOptoBaseに便利にカタログ化されています28。また、新しいオプトジェネティクスツールの作成に関心のある方のために、緑、赤、近赤外波長に応答する光応答性タンパク質など、幅広い戦略で採用されている光応答性タンパク質の有用な説明も掲載しています。私たちは、科学界が分子光遺伝学的アプローチの可能性を最大限に発揮できることを嬉しく思います。
開示事項
著者は何も開示していません。
謝辞
このプロトコルの資金は、KWR (ZIA HD009002-01) への NICHD 学内プログラムによって提供されました。Jeff Farrell 氏と彼の研究室には有益なフィードバックを、Will Anderson 氏には優れた技術サポートを、Leanne Iannucci 氏にはプロトコルのストレステストと放射照度の測定を、そしてゼブラフィッシュの健康維持に尽力してくださった NIH Shared Zebrafish 施設には感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Building a light box & Light exposure protocol | |||
| #8 x 1" Hex Self-drilling Screw | McMaster-Carr | 99663A222 | 1.4.5 |
| Digital Optical Power and Energy Meter | ThorLabs | PM100D | 1.7 4 |
| Incubator (142 liters) | Boekel Scientific | 139400 | 1.3.1 |
| Incubator Panel Mount (1/4" thick cast black acrylic) | Custom part / Piedmont Plastics | Incubator_panel | 1.4.4 |
| Large HSS Spiral Groove Step Drill Bit | CO-Z | SDB0001TA | 1.3.2 |
| LED lens gasket, Incubator gasket; 1/32" thick black silicone | McMaster-Carr | 5812T12 | 1.4.3 1.4.4 |
| LED microplate illuminator | Prizmatix | NA | 1.1 1.4.3 |
| M3 10mm Cube Standoff | Newark Eletronics | 005.60.533 | 1.4.1 |
| M3 x 10mm 316SS Flat Head Screw | McMaster-Carr | 91801A156 | 1.4.1 |
| M6 x 10mm 316SS Flat Head Screw | McMaster-Carr | 91801A305 | 1.4.3 |
| Memory card thermometer | Fisherbrand | 15-081-111 | 1.9 3.2.1 |
| Microscope Slide Power Meter Sensor Head (150 mW) | ThorLabs | S170C | 1.7 4 |
| Red gel filter paper #E106 | Rosco / B&H Foto & Electronics | 110084014805-E106 | 4.2.1 |
| Side Brackets (1/4" thick cast black acrylic) | Custom part / Piedmont Plastics | Side_bracket | 1.4.2 |
| Vertical Bracket (1/4" thick cast black acrylic) | Custom part / Piedmont Plastics | Vertical_bracket | 1.4.1 |
| Weather stripping: Light duty EPDM foam, 1/2" wd 1/4" tk | McMaster-Carr | 8694K12 | 1.8 |
| Generating mRNA | |||
| EZNA MicroElute Cycle Pure Kit | Omega | D6293-02 | 2.4 |
| GeneJET Miniprep Kit (250 rxns) | Thermo Scientific | K0503 | 2.2 |
| Microsample incubator (Hybex) | SciGene | 1057-30-0 | 2 |
| Microsample incubator 1.5 ml tube block (Hybex) | SciGene | 1057-34-0 | 2 |
| Nanodrop One Spectrophotometer | Thermo Scientific | ND-ONE-W | 2.4 |
| NotI-HF restriction enzyme | New England Biolabs (NEB) | R3189L | 2.1 |
| pCS2-Opto-Alk3 | Addgene | 207614 | 2 |
| pCS2-Opto-Alk8 | Addgene | 207615 | 2 |
| pCS2-Opto-BMPR2a | Addgene | 207616 | 2 |
| RNeasy Mini Kit (250 rxns) | Qiagen | 74106 | 2.3 |
| Injecting mRNA | |||
| Agarose (UltraPure) | Invitrogen / Thermo Fisher | 16500500 | 3.1.1 |
| 250 ml glass beakers | Fisherbrand | FB100250 | 3.3.2 |
| 6-well dishes (case of 50) | Falcon | 08 772 1B | 3.1.6 |
| B-8A ball joint | Narishige | B-8A | 3.3 |
| Back pressure unit (microinjection rig component) | Applied Scientific Instrumentation (ASI) | BPU | 3.3 |
| Foot switch (microinjection rig component) | Applied Scientific Instrumentation (ASI) | FWS | 3.3 |
| GJ-1 magnetic stand | Narishige | GJ-1 | 3.3 |
| Glass capillaries (4 in, OD 1 mm, filament) | World Precision Instruments | 1B100F-4 | 3.1.11 |
| Glass petri dish bottoms (for dechorionating) | Pyrex | 08-748A | 3.3.2 |
| Glass pipettes (5 3/4" with wide tip) | Kimble-Chase | 63A53WT | 3.1.9 |
| Injection dish molds | Adaptive Science Tools | tu1 | 3.1.3 |
| IP iron plate | Narishige | IP | 3.3 |
| M-152 micromanipulator | Narishige | M-152 | 3.3 |
| Micro pipette holder kit (microinjection rig component) | Applied Scientific Instrumentation (ASI) | MIMPH-MPIP-Kit | 3.3 |
| Micrometers | Meiji Techno America | MA285 | 3.3 |
| MPPI-2 pressure injector (microinjection rig component) | Applied Scientific Instrumentation (ASI) | MPPI-3 | 3.3 |
| Needle puller | World Precision Instruments | PUL-1000 | 3.1.11 |
| Petri dishes (100 mm x 15 mm, case of 500) | Falcon | 08-757-100D | 3.1.2 |
| Pipettor (10 ml, green) | Bel-Art | F37898-0000 | 3.3 |
| Pronase | Roche | 11459643001 | 3.3.2 |
| Squeeze bottles (500 ml) | Nalgene / Thermo Scientific | 2402-0500 | 3.3 |
参考文献
- Jones, W. D., Mullins, M. C. Cell signaling pathways controlling an axis organizing center in the zebrafish. Current Topics in Developmental Biology. 150, 149-209 (2022).
- Hill, C. S. Establishment and interpretation of NODAL and BMP signaling gradients in early vertebrate development. Current Topics in Developmental Biology. 149, 311-340 (2022).
- Zinski, J., Tajer, B., Mullins, M. C. TGF-β Family Signaling in Early Vertebrate Development. Cold Spring Harbor Perspectives in Biology. 10 (6), a033274 (2018).
- Shore, E. M., Kaplan, F. S. Inherited human diseases of heterotopic bone formation. Nature Reviews. Rheumatology. 6 (9), 518-527 (2010).
- Hebron, K. E., Hernandez, E. R., Yohe, M. E. The RASopathies: from pathogenetics to therapeutics. Disease Models & Mechanisms. 15 (2), dmm049107 (2022).
- Grant, M. G., Patterson, V. L., Grimes, D. T., Burdine, R. D. Modeling Syndromic Congenital Heart Defects in Zebrafish. Current Topics in Developmental Biology. 124, 1-40 (2017).
- Nusse, R., Clevers, H. Wnt/beta-Catenin Signaling, Disease, and Emerging Therapeutic Modalities. Cell. 169 (6), 985-999 (2017).
- Farahani, P. E., Reed, E. H., Underhill, E. J., Aoki, K., Toettcher, J. E. Signaling, Deconstructed: Using Optogenetics to Dissect and Direct Information Flow in Biological Systems. Annual Review of Biomedical Engineering. 23, 61-87 (2021).
- Purvis, J. E., Lahav, G. Encoding and decoding cellular information through signaling dynamics. Cell. 152 (5), 945-956 (2013).
- Wibisana, J. N., Okada, M. Encoding and decoding NF-kappaB nuclear dynamics. Current Opinion in Cell Biology. 77, 102103 (2022).
- Friedel, L., Loewer, A. The guardian's choice: how p53 enables context-specific decision-making in individual cells. TheFEBS Journal. 289 (1), 40-52 (2022).
- Rogers, K. W., Müller, P. Optogenetic approaches to investigate spatiotemporal signaling during development. Current Topics in Developmental Biology. 137, 37-77 (2020).
- Johnson, H. E., Toettcher, J. E. Illuminating developmental biology with cellular optogenetics. Current Opinion in Biotechnology. 52, 42-48 (2018).
- Bosman, S. L., Sonnen, K. F. Signaling oscillations in embryonic development. Current Topics in Developmental Biology. 149, 341-372 (2022).
- Li, P., Elowitz, M. B. Communication codes in developmental signaling pathways. Development. 146 (12), dev170977 (2019).
- Tucker, J. A., Mintzer, K. A., Mullins, M. C. The BMP signaling gradient patterns dorsoventral tissues in a temporally progressive manner along the anteroposterior axis. Developmental Cell. 14 (1), 108-119 (2008).
- van Boxtel, A. L., et al. A temporal window for signal activation dictates the dimensions of a Nodal signaling domain. Developmental Cell. 35 (2), 175-185 (2015).
- Sorre, B., Warmflash, A., Brivanlou, A. H., Siggia, E. D. Encoding of temporal signals by the TGF-β pathway and implications for embryonic patterning. Developmental Cell. 30 (3), 334-342 (2014).
- Economou, A. D., Hill, C. S. Temporal dynamics in the formation and interpretation of Nodal and BMP morphogen gradients. Current Topics in Developmental Biology. 137, 363-389 (2020).
- Rogers, K. W., Schier, A. F. Morphogen gradients: from generation to interpretation. Annual Review of Cell and Developmental Biology. 27, 377-407 (2011).
- Barkai, N., Shilo, B. Z. Robust generation and decoding of morphogen gradients. Cold Spring Harbor Perspectives in Biology. 1 (5), a001990 (2009).
- Johnson, H. E., Djabrayan, N. J. V., Shvartsman, S. Y., Toettcher, J. E. Optogenetic Rescue of a Patterning Mutant. Current Biology. 30 (17), 3414-3424 (2020).
- Imayoshi, I., et al. Oscillatory control of factors determining multipotency and fate in mouse neural progenitors. Science. 342 (6163), 1203-1208 (2013).
- Lin, B., et al. Synthetic spatially graded Rac activation drives cell polarization and movement. Proceedings of the National Academy of Sciences of the United States of America. 109 (52), E3668-E3677 (2012).
- Cui, K. W., et al. Spatially controlled stem cell differentiation via morphogen gradients: A comparison of static and dynamic microfluidic platforms. Journal of Vacuum Science & Technology. A, Vaccum, Surfaces, and Films. 38 (3), 033205 (2020).
- Faden, F., Mielke, S., Lange, D., Dissmeyer, N. Generic tools for conditionally altering protein abundance and phenotypes on demand. Biological Chemistry. 395 (7-8), 737-762 (2014).
- Shoji, W., Sato-Maeda, M. Application of heat shock promoter in transgenic zebrafish. Development, Growth & Differentiation. 50 (6), 401-406 (2008).
- Kolar, K., Knobloch, C., Stork, H., Znidaric, M., Weber, W. OptoBase: A web platform for molecular optogenetics. ACS Synthetic Biology. 7 (7), 1825-1828 (2018).
- Benedetti, L., et al. Light-activated protein interaction with high spatial subcellular confinement. Proceedings of the National Academy of Sciences of the United States of America. 115 (10), E2238-E2245 (2018).
- Krueger, D., De Renzis, S. Optogenetic Methods to Control Tissue Mechanics in Drosophila. Methods in Molecular Biology. 2540, 269-283 (2022).
- Buckley, C. E. Optogenetic Control of Subcellular Protein Location and Signaling in Vertebrate Embryos. Methods in Molecular Biology. 1920, 143-162 (2019).
- Čapek, D., et al. Light-activated Frizzled7 reveals a permissive role of non-canonical wnt signaling in mesendoderm cell migration. Elife. 8, e42093 (2019).
- Krishnamurthy, V. V., et al. Reversible optogenetic control of kinase activity during differentiation and embryonic development. Development. 143 (21), 4085-4094 (2016).
- Huang, A., Amourda, C., Zhang, S., Tolwinski, N. S., Saunders, T. E. Decoding temporal interpretation of the morphogen Bicoid in the early Drosophila embryo. Elife. 6, e26258 (2017).
- Johnson, H. E., Toettcher, J. E. Signaling dynamics control cell fate in the early Drosophila embryo. Developmental Cell. 48 (3), 361.e3-370.e3 (2019).
- Aoki, K., et al. Stochastic ERK activation induced by noise and cell-to-cell propagation regulates cell density-dependent proliferation. Molecular Cell. 52 (4), 529-540 (2013).
- Chow, R. W., Vermot, J. The rise of photoresponsive protein technologies applications in vivo: a spotlight on zebrafish developmental and cell biology. F1000Research. , (2017).
- Rogers, K. W., ElGamacy, M., Jordan, B. M., Müller, P. Optogenetic investigation of BMP target gene expression diversity. Elife. 9, e58641 (2020).
- Sako, K., et al. Optogenetic control of Nodal signaling reveals a temporal pattern of Nodal signaling regulating cell fate specification during gastrulation. Cell Reports. 16 (3), 866-877 (2016).
- Grusch, M., et al. Spatio-temporally precise activation of engineered receptor tyrosine kinases by light. The EMBO Journal. 33 (15), 1713-1726 (2014).
- Crossman, S. H., Janovjak, H. Light-activated receptor tyrosine kinases: Designs and applications. Current Opinion in Pharmacology. 63, 102197 (2022).
- Kainrath, S., Janovjak, H. Design and Application of Light-Regulated Receptor Tyrosine Kinases. Methods in Molecular Biology. 2173, 233-246 (2020).
- Takahashi, F., et al. AUREOCHROME, a photoreceptor required for photomorphogenesis in stramenopiles. Proceedings of the National Academy of Sciences of the United States of America. 104 (49), 19625-19630 (2007).
- Toyooka, T., Hisatomi, O., Takahashi, F., Kataoka, H., Terazima, M. Photoreactions of aureochrome-1. Biophysical Journal. 100 (11), 2801-2809 (2011).
- Vopalensky, P., Pralow, S., Vastenhouw, N. L. Reduced expression of the Nodal co-receptor Oep causes loss of mesendodermal competence in zebrafish. Development. 145 (5), dev.158832 (2018).
- Kishimoto, Y., Lee, K. H., Zon, L., Hammerschmidt, M., Schulte-Merker, S. The molecular nature of zebrafish swirl: BMP2 function is essential during early dorsoventral patterning. Development. 124 (22), 4457-4466 (1997).
- Rogers, K. W., et al. Nodal patterning without Lefty inhibitory feedback is functional but fragile. Elife. 6, e28785 (2017).
- Dubrulle, J., et al. Response to Nodal morphogen gradient is determined by the kinetics of target gene induction. Elife. 4, e05042 (2015).
- Harvey, S. A., Smith, J. C. Visualisation and quantification of morphogen gradient formation in the zebrafish. PLoS Biology. 7 (5), e1000101 (2009).
- Zinski, J., Tuazon, F., Huang, Y., Mullins, M., Umulis, D. Imaging and Quantification of P-Smad1/5 in Zebrafish Blastula and Gastrula Embryos. Methods in Molecular Biology. 1891, 135-154 (2019).
- Gerhardt, K. P., Castillo-Hair, S. M., Tabor, J. J. DIY optogenetics: Building, programming, and using the Light Plate Apparatus. Methods in Enzymology. 624, 197-226 (2019).
- Bugaj, L. J., Lim, W. A. High-throughput multicolor optogenetics in microwell plates. Nature Protocols. 14 (7), 2205-2228 (2019).
- Kumar, S., Khammash, M. Platforms for Optogenetic Stimulation and Feedback Control. Frontiers in Bioengineering and Biotechnology. 10, 918917 (2022).
- Urushibata, H., et al. Control of Developmental Speed in Zebrafish Embryos Using Different Incubation Temperatures. Zebrafish. 18 (5), 316-325 (2021).
- Rogers, K. W., Bläßle, A., Schier, A. F., Müller, P. Measuring protein stability in living zebrafish embryos using fluorescence decay after photoconversion (FDAP). Journal of Visualized Experiments. (95), e52266 (2015).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Developmental Dynamics. 203 (3), 253-310 (1995).
- Feldman, B., et al. Zebrafish organizer development and germ-layer formation require nodal-related signals. Nature. 395 (6698), 181-185 (1998).
- Shimizu, T., et al. Cooperative roles of Bozozok/Dharma and Nodal-related proteins in the formation of the dorsal organizer in zebrafish. Mechanisms of Development. 91 (1-2), 293-303 (2000).
- Rebagliati, M. R., Toyama, R., Fricke, C., Haffter, P., Dawid, I. B. Zebrafish nodal-related genes are implicated in axial patterning and establishing left-right asymmetry. Developmental Biology. 199 (2), 261-272 (1998).
- Gritsman, K., Talbot, W. S., Schier, A. F. Nodal signaling patterns the organizer. Development. 127 (5), 921-932 (2000).
- LaBelle, J., et al. TAEL 2.0: An Improved Optogenetic Expression System for Zebrafish. Zebrafish. 18 (1), 20-28 (2021).
- Mruk, K., Ciepla, P., Piza, P. A., Alnaqib, M. A., Chen, J. K. Targeted cell ablation in zebrafish using optogenetic transcriptional control. Development. 147 (12), dev183640 (2020).
- Johnson, H. E., et al. The spatiotemporal limits of developmental Erk signaling. Developmental Cell. 40 (2), 185-192 (2017).
- Motta-Mena, L. B., et al. An optogenetic gene expression system with rapid activation and deactivation kinetics. Nature Chemical Biology. 10 (3), 196-202 (2014).
- Patel, A. L., et al. Optimizing photoswitchable MEK. Proceedings of the National Academy of Sciences of the United States of America. 116 (51), 25756-25763 (2019).
- LaBelle, J., Woo, S. Light-Induced GFP Expression in Zebrafish Embryos using the Optogenetic TAEL/C120 System. Journal of Visualized Experiments. (174), e62818 (2021).
- Kainrath, S., Stadler, M., Reichhart, E., Distel, M., Janovjak, H. Green-light-induced inactivation of receptor signaling using cobalamin-binding domains. Angewandte Chemie. 56 (16), 4608-4611 (2017).
- Benman, W., et al. Temperature-responsive optogenetic probes of cell signaling. Nat Chem Biol. 18 (2), 152-160 (2022).
- Reade, A., et al. TAEL: a zebrafish-optimized optogenetic gene expression system with fine spatial and temporal control. Development. 144 (2), 345-355 (2017).
- Putri, R. R., Chen, L. Spatiotemporal control of zebrafish (Danio rerio) gene expression using a light-activated CRISPR activation system. Gene. 677, 273-279 (2018).
- Liu, H., Gomez, G., Lin, S., Lin, S., Lin, C. Optogenetic control of transcription in zebrafish. PLoS One. 7 (11), e50738 (2012).
- Buckley, C. E., et al. Reversible optogenetic control of subcellular protein localization in a live vertebrate embryo. Developmental Cell. 36 (1), 117-126 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
JoVEについて
Copyright © 2023 MyJoVE Corporation. All rights reserved