成体自己免疫性脳脊髄炎マウスからの主要な中枢神経系常在細胞型の同時単離
* これらの著者は同等に貢献しました
要約
これまでのところ、すべての主要な中枢神経系常在細胞タイプを同じマウスから同時に単離するためのプロトコルは、満たされていない需要です。プロトコルはneuroinflammationの間に複雑な細胞ネットワークを調査し、同時に必須のマウス数を減らすために素朴で、実験的な自己免疫の脳脊髄炎のマウスで適当なプロシージャを示す。
要約
実験的自己免疫性脳脊髄炎(EAE)は、多発性硬化症(MS)の最も一般的なマウスモデルであり、新しい治療戦略を開発するために、MSのまだ知られていない病因をさらに解明するために頻繁に使用されます。ミエリンオリゴデンドロサイト糖タンパク質ペプチド35-55(MOG35-55)EAEモデルは、免疫後10日以内に上行麻痺を伴う自己制限的な単相性疾患経過を再現します。マウスは、臨床スコアリングシステムを使用して毎日検査されます。多発性硬化症は、特定の時間的パターンを持つさまざまな病態メカニズムによって引き起こされるため、疾患の進行における中枢神経系(CNS)常在細胞型の役割の調査は非常に興味深いものです。このプロトコルの独特な特徴は大人のEAEおよび健康なマウスで適当なすべての主要なCNS常駐のセルタイプ(ミクログリア、オリゴデンドロサイト、astrocytesおよびニューロン)の同時隔離である。成体マウスの脳と脊髄の解離に続いて、磁気活性化細胞選別(MACS)を行い、ミクログリア、オリゴデンドロサイト、アストロサイト、ニューロンを単離します。フローサイトメトリーを使用して、精製した単一細胞懸濁液の品質解析を行い、細胞単離後の生存率を確認し、各細胞タイプの純度が約90%であることを示しました。結論として、このプロトコルは、健康なマウスとEAEマウスの複雑な細胞ネットワークを分析するための正確で包括的な方法を提供します。さらに、4種類の細胞すべてが同じマウスから単離されるため、必要なマウス数を大幅に減らすことができます。
概要
多発性硬化症(MS)は、脱髄、軸索損傷、神経膠症、神経変性を特徴とする中枢神経系(CNS)の慢性炎症性自己免疫疾患です。この分野では数多くの研究アプローチが行われているにもかかわらず、多発性硬化症の病態生理学はまだ完全には理解されていません1,2,3,4。多発性硬化症を調査するための最も一般的な動物モデルは、ミエリンオリゴデンドロサイト糖タンパク質ペプチド35-55(MOG35-55)誘発性実験的自己免疫性脳脊髄炎(EAE)であり、その臨床的および病態生理学的特徴の多くを共有しています5,6,7,8,9.これは、炎症、脱髄、および神経軸索変性につながるCNS特異的抗原に対する免疫系の応答に基づいています。実験的自己免疫性脳脊髄炎(EAE)は、MSに見られる神経炎症経路とシグナル伝達カスケードの調査に適したモデルです。
多発性硬化症に対する現在の治療法の選択肢は部分的にしか効果がなく、主に疾患の初期炎症期に焦点を当てています。しかし、多発性硬化症の神経変性成分は、長期的な治療アプローチにとって大きな課題であるようです。したがって、自己免疫疾患の分子および細胞メカニズムを包括的に研究するには、再現性のある正確な細胞単離プロトコルが必要です。10,11,12,13,14,15の単一細胞タイプを単離するためのプロトコルがいくつか存在したとしても、複数のCNS常在細胞集団を一度に同時に単離するニーズは満たされていません。中枢神経系常在細胞の単離に関する以前のプロトコルは、細胞の機能性と純度の維持に欠けており、隣接する細胞との共培養16,17,18または細胞内ネットワークex vivo19,20,21,22の複雑な分析には適していません。
このプロトコルの目的は、成人の健康なマウスとEAEマウスに適用可能なすべての主要なCNS常駐細胞タイプの純粋で生存可能な単一細胞懸濁液を同時に分離するための再現性のある包括的な方法を確立することでした。異なる細胞タイプは、磁気活性化セルソーティング(MACS)を用いて単離した23。細胞分離は、ポジティブセレクション、すなわち細胞タイプ特異的な表面マーカーの磁気標識、またはビオチン化とすべての望ましくない細胞の枯渇によるネガティブセレクションのいずれかによって達成できます。フローサイトメトリーを適用して、単離された単一細胞懸濁液の純度が90%を超え、生存率が少なくとも80%であることを確認しました。
結論として、主な目標は、健康なマウスとEAEマウスにおける複雑な細胞ネットワークと生化学的シグナル伝達カスケードの包括的かつ正確な分析を提供する神経炎症経路の調査のための汎用性の高いツールとして、すべての主要なCNS常在細胞タイプを同時に分離するためのプロトコルを確立することでした。
プロトコル
すべてのEAE実験は、10〜12週齢の雌のC57BL / 6Jマウスで誘導され、地方自治体(Landesamt für Natur, Umwelt und Verbraucherschutz Nordrhein-Westfalen)によって承認されました。また、ドイツとEUの動物保護法の遵守は、実験のあらゆる時点で保証されました。すべてのマウスは、個別に換気されたケージの動物飼育条件下で飼育されました。
注:以下の試薬量は、成体マウスの脳と脊髄1個を指し、以下ではCNS細胞懸濁液と名付けられ、重さは約20 mg〜500 mgです。複数のCNS細胞懸濁液の解離が計画されている場合、それに応じてすべての試薬の量と材料をスケールアップする必要があります。ダルベッコのリン酸緩衝生理食塩水(D-PBS、1x)は、カルシウムとマグネシウムを添加し、1 g/Lのグルコースと36 mg/Lのピルビン酸ナトリウムを添加して、実験全体を通して氷上に継続的に保管することをお勧めします。その後に細胞培養を予定している場合は、フードを使用してすべてのステップを無菌条件下で行ってください。それ以外の場合、次のプロトコルセクションを内部で実行する必要はありません。バッファーは氷上に保管します。予冷した溶液のみを使用し、実験全体を通してボルテックスを避けてください。全体的なワークフローについては、 図 1 を参照してください。
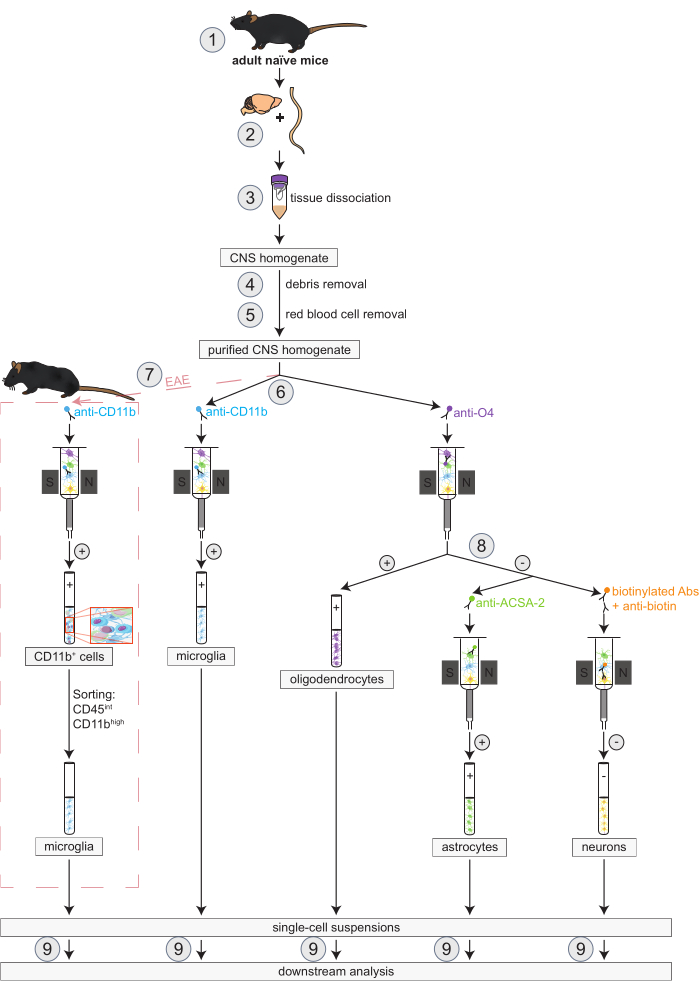
図1:ナイーブマウスとEAEマウスにおけるオリゴデンドロサイト、ミクログリア、アストロサイト、ニューロンの同時単離のワークフロー。ワークフローの最初のステップは、ナイーブマウスとEAEマウスの両方で同じです。EAEレプリケートで作業する場合は、EAE誘導を事前に実行する必要があります(1)。要するに、プロトコルは残骸(4)および赤血球(5)の取り外しに続くマウスの頭脳および脊髄の解剖(2)そして解離(3)から始まる。続いて、得られた精製されたCNS細胞懸濁液を2つのフラクションに分割し、MACSを介してオリゴデンドロサイトとミクログリアを同時に単離します(6)。ミクログリアは抗CD11bマイクロビーズで検出され、オリゴデンドロサイトは抗O4マイクロビーズ(ポジティブセレクション)で単離されます。オリゴデンドロサイトの負のフロースルー(8)から、アストロサイトは抗ACSA-2マイクロビーズを介して単離され(正の選択)、ビオチン標識によってニューロンが分離され、すべての非神経細胞が枯渇します(負の選択)。EAEマウスでは、CD11b+細胞の単離に続いて、CD45intCD11b高細胞の蛍光活性化セルソーティングを行い、マクロファージ、樹状細胞、単球、顆粒球、ナチュラルキラー細胞など、EAEコース中に神経炎症プロセスに関与することが知られている他のCD11b+免疫細胞を排除します(7)27,28,48.異なる中枢神経系常在細胞タイプを単離した後、純度分析を行うことができます(9)。略語:Abs =抗体;ACSA-2 = アストロサイト細胞表面抗原-2;CD11b = サイクリン依存性キナーゼ11B;CD45 =受容体型チロシン-プロテインホスファターゼC;CNS = 中枢神経系;EAE = 実験的自己免疫性脳脊髄炎;MACS = 磁気活性化セルソーティング;O4 = オリゴデンドロサイトマーカー O4.この数字は49 から変更されています。この図の拡大版をご覧になるには、ここをクリックしてください。
1. 活性EAEの誘導
- 試薬の調製
- 細胞分離の場合:PBバッファーを調製し、2〜8°Cで最大1週間保存します。ストック溶液を調製するには、サプリメントを含まない1x PBS(pH 7.2)475 mL+0.5%ウシ血清アルブミン(BSA)25 mLを加えます。BSAで調製した1:20希釈液を使用してください。
- フローサイトメトリーおよび蛍光活性化セルソーティング(FACS)の場合:2%ウシ胎児血清(FCS)および2 mM EDTAを含むFACSバッファー、PBSを調製し、2〜8°Cで保存します。 調製するには、サプリメントを含まない 1x PBS 500 mL と 10 mL の FCS + 2 mL EDTA(0.5 M EDTA ストックから)を加えます
- Bittner et al. 5 のプロトコルに従って予防接種を行います。簡単に言うと、200μgのMOG35-55ペプチドと200μgの結核菌を含む200μLの完全なフロイトアジュバントを含むエマルジョンの皮下注射によってEAEを誘導します。
- イソフルラン気化器を備えた麻酔室を使用して、2%イソフルランでマウスを麻酔します。麻酔中の乾燥を防ぐために、動物の目に獣医の軟膏を使用してください。
- 2時間後、Huntemannらのプロトコルに従って、100μLの1x PBSに溶解した100 ngの百日咳毒素(PTx)の腹腔内注射を注入します24。予防接種後2日目にPTx注射を繰り返します。
注意:胸骨横臥を維持するのに十分な意識を取り戻すまで、各動物を観察してください。注射処置を受けたマウスは、完全に回復するまで他のマウスの会社に戻されません。 結核菌 およびPTxの場合:吸入、摂取、皮膚や目との接触を避けてください。 結核菌 は自然免疫系の活性化因子です。PTxには多くの生物学的影響があります。 - 体重を監視し、マウスを臨床的に検査する2人の盲検化された研究者によって実行されるEAEの進行を毎日監視します。
- この目的のために、次のスコアリングシステムを使用して、EAEのグレード0-臨床徴候なし、グレード1-部分的な尾麻痺、グレード2-完全な尾麻痺、グレード3-中等度の後肢の脱力感、グレード4-完全な後肢の脱力感および運動失調性歩行、グレード5-軽度の対麻痺、グレード6-対麻痺、グレード7-対麻痺、グレード8-四肢麻痺、グレード9-四肢麻痺、 そしてグレード10の死。
- 実験へのさらなる参加には、次の除外基準を使用してください 臨床スコア > 7 または初期体重の 20% を超える体重減少。
- 脳と脊髄の解剖については、疾患の最大値を表すEAE誘導後16日目にEAEマウスを安楽死させます。
2. 中枢神経系組織調製(実施時間:マウス1匹あたり約10分)
- マウスを二酸化炭素で犠牲にした後、20 mLの1x PBSで各マウスの経心灌流から始めます。20 mLの1x PBSで再度灌流を繰り返します。
- マウスを仰臥位に置き、手足をカニューレで固定します。動物の前身に75%エタノールを塗布します。その時点では、それ以上の無菌対策は必要ありません。
- はさみの助けを借りて皮膚と筋膜を縦に切るセクションを作成して、腹部と胸部を開きます。
- 肋骨を横方向に切り、胸部を折りたたんで心臓に自由にアクセスできるようにします。上向きに折りたたまれた胸部をカニューレで固定します。
- ハサミを使って右の心房を開きます。20 mLの1x PBSをカニューレで左心室に塗布し、切開した右心房から血液を洗い流します。
- マウスの頭頂部の皮膚を縦断面で切断して頭蓋骨を露出させ、鉗子を使用して頭の周りの皮膚を移動させます。矢状縫合糸に沿ってハサミの助けを借りて頭蓋骨を切開します。
- 鉗子の先端を切開線に沿って挿入し、カロットを割って開きます。鉗子でカロットの残りの部分を取り除き、脳が完全に露出するようにします。
- 脳を慎重に取り出し、マウスの脳マトリックスに入れます。カミソリの刃を使って脳を厚さ1mmの矢状スライスに切ります。
- シリンジを脊柱管に挿入できるように、腸骨稜のすぐ上ではさみの助けを借りて脊柱を切断します。
注:脊髄を除去する最も簡単な方法は、PBSで脊柱管から洗い流すことです。それ以外の場合は、椎弓をハサミで個別に開いてから、脊髄を取り除く必要があります。 - 1x PBSを含む20G針を備えた20mLの注射器を使用して、脊柱管から尾側から頭蓋側まで脊髄を洗い流します。メスを使って脊髄を0.5cmの長さに切ります。
- 脳と対応する脊髄からなる各CNS細胞懸濁液を、約3 mLの冷たいD-PBSで満たされたマウス1匹の別々のペトリ皿に保管します。さらに処理するまで、皿を氷上に保管してください。
3.中枢神経系組織の解離(持続時間:中枢神経系細胞懸濁液の数に応じて約1〜1.5時間)
注:成体マウスの神経組織は、機械的解離と細胞外マトリックスの酵素的分解を組み合わせることによって解離されます。これにより、構造的完全性が維持され、細胞懸濁液をさらなる細胞単離手順に用いることができる。
- 中枢神経系細胞懸濁液あたり50 μLの酵素Pと1,900 μLのバッファーZからなる適切な量の酵素ミックス1を調製します。どちらの試薬も成人脳解離キットに属しています。
- 中枢神経系細胞懸濁液あたり、酵素A10 μLとバッファーY20 μLからなる酵素ミックス2を適切な量調製します。どちらの試薬も成人脳解離キットに属しています。
- 1,950 μLの酵素ミックス1をCチューブに移し、その後、1つのCNS細胞懸濁液の組織片を添加します。マウス1本につきCチューブを1本使用してください。
- 各Cチューブに30μLの酵素ミックス2を加えます。Cチューブをしっかりと閉じ、ヒーター付きのセル解離器のスリーブに逆さまに取り付けます。
- 37C_ABDK_01という名前の適切なプログラムを実行します(所要時間は30分)。プログラムの少なくとも最初の5分間を観察して、すべてのチューブが同じ速度で回転することを確認します。実行中にエラーが発生する可能性があります。次に、手順 6 に進みます。
- プログラムの最後の2分間で、解離したCNS細胞懸濁液ごとに、50 mLチューブに70 μmのストレーナを1本置きます。これらのストレーナーを2 mLのD-PBSで事前に湿らせます。
- プログラム終了後、解離器からCチューブを取り付け、遠心分離機に入れます。サンプルを300 x g 、4°Cで1分間遠心分離し、チューブの底にサンプルを採取します。
- サンプルを再懸濁し、事前に湿らせたストレーナに塗布します。空のCチューブに10 mLの冷たいD-PBSを加え、閉じます。軽く振って、サスペンションを対応するストレーナーに塗布します。
- ストレーナーを廃棄し、50 mLチューブを閉じます。細胞懸濁液を300 x g 、4°Cで10分間遠心分離します。その後、上澄み全体を非常に注意深く吸引します。
4.デブリ除去(所要時間:中枢神経系細胞懸濁液数により約1.5-2時間)
注:組織の解離は、多くの場合、ミエリンや細胞の破片を引き起こし、下流の分析を損なう可能性があります。デブリ除去溶液を添加することにより、このデブリをCNS細胞懸濁液から効率的に除去することができる。
- 細胞ペレットを、CNS細胞懸濁液ごとに3,100 μLのD-PBSで慎重に再懸濁します。ボルテックスしないでください。
- 複数のCNS細胞懸濁液を扱う場合は、1つの条件または実験グループに由来する最大2つのCNS細胞懸濁液を1本の15 mLチューブにプールします。
- 成人脳解離キットのデブリ除去溶液900 μLを1つのCNS細胞懸濁液に、または1,800 μLのデブリ除去溶液をプールした2つのCNS細胞懸濁液に加えます。
- チューブをひっくり返し、懸濁液を混ぜます。その後、4 mLの冷たいD-PBSを非常に穏やかに重ね合わせます。明確なグラデーションが表示されます(図2A)。
- チューブを3000 x g 、4°Cで10分間遠心分離し、フル加速、ブレーキをかけません。
- 分離が意図したとおりに行われると、3つの相が形成されます(図2C)。上部の2つの相を完全に吸引し(図2C-1,2)、廃棄します。ミエリン残渣が残らないことが重要です(図2E)。
注:グラジエントが機能せず、セルが緊急に必要な場合は、上部の 2 つの相を吸い取らないでください。代わりに、15 mL チューブに最大 15 mL の冷たい D-PBS を充填し、数回反転させます。1000 x g で4°Cで10分間、ブレーキなしで完全に加速して遠心分離します。上澄み液を吸い取り、手順4.1〜4.4を繰り返します。 - チューブに最大14 mLの冷たいD-PBSを充填し、閉じます。セルペレットがチューブの底から剥がれるまで、作業台の上でチューブを強力に反転させます。ボルテックスしないでください。
- サンプルを1000 x g 、4°Cで10分間遠心分離します。フルアクセルとフルブレーキを設定します。上澄み液を注意深く完全に吸引します。

図2:デブリ除去時の「すべきこと」と「すべきでないこと」。(A) 4 mL の PBS と重ね合わせた後のグラジエントの陽性例。4 mLのPBSからなる上相は、中枢神経系細胞懸濁液とデブリ除去溶液からなる下相と明確に区別できます。 (B) 4 mL の PBS で重ね合わせた後のグラジエントの負の例。このグラジエントでは、PBSと下の細胞懸濁液との間に明確な分離がありません。少量のPBSが細胞懸濁液中に拡散します。 (C) 遠心分離後のグラジエントの肯定的な例。3つの別々のフェーズを簡単に区別できます。グラジエントの上部(1)または下部の相(3)にはミエリン残基は見られません。中期にはすべてのミエリンが含まれています(2)。細胞ペレットは、15 mLチューブの底部に見えます。(D) 遠心分離後のグラジエントの負の例。3つのフェーズを正確に分離することはできません。一部のミエリン残基は、グラジエントの上部(1)と下部の相(3)に見られます。 (E) 2つのトップ相を吸引した後のグラジエントの肯定的な例。得られたサンプルには、細胞ペレットと上記の透明な上清のみが含まれています。ミエリン残渣は残っていません。 (F) トップ 2 相を吸引した後のグラジエントの負の例。サンプルにはまだミエリン残基が含まれています(黒矢印)。略語:CNS =中枢神経系;PBS = リン酸緩衝生理食塩水 この図の拡大版をご覧になるには、ここをクリックしてください。
5.赤血球除去(所要時間:中枢神経系細胞懸濁液数により約1時間)
注:このステップは、赤血球による後の汚染を防ぎ、CNS組織から単離された他の細胞タイプへの影響を最小限に抑えながら、赤血球の最適な溶解を保証します。以下の容量は、2匹の成体マウスの脳および脊髄に対応する100 mg〜1 gの神経組織に由来する細胞懸濁液について示されています。2つ以上のCNS細胞懸濁液を扱う場合は、それに応じてすべての試薬と総容量をスケールアップしてください。
- 赤血球除去溶液(RBCRS)の調製から始めます:プールされたCNS細胞懸濁液2個あたり。成人脳解離キットから赤血球除去ストック溶液(10倍)100 μLを900 μLのddH2Oで希釈し、最終希釈率を1:10にします。
- RBCRSは、使用するまで2〜8°Cで保管してください。未使用の残骸は一日の終わりに廃棄します。
- 最大 2 つの CNS 細胞懸濁液の細胞ペレットを 1 mL の RBCRS に再懸濁します。ボルテックスを避けてください。溶液を4°Cで10分間インキュベートします。
- 10 mLのコールドPBバッファーを2つのプールセル懸濁液に加えます。サンプルを300 x g 、4°Cで10分間遠心分離し、その後上清を完全に吸引します。
- 1つのCNS細胞懸濁液から各細胞ペレットを80 μLのPBバッファーにピペッティングして、ゆっくりと上下にピペッティングして再懸濁します。したがって、160 μLを使用して、2つのCNS細胞懸濁液に由来する細胞ペレットを再懸濁します。
- 同じ実験条件で複数の中枢神経系細胞懸濁液を扱う場合は、これらの細胞懸濁液をすべてプールします。
- 例えば、改良された計数チャンバーを使用して、細胞数を決定します。細胞懸濁液は通常、PBバッファーで1:50に希釈し、その後、0.4%トリパンブルー溶液でさらに1:10に希釈しました。
6. ナイーブマウスおよびEAEマウスにおける磁気ビーズプロトコル(所要時間:約1時間)
- さまざまなCNS細胞タイプを、表面抗原に特異的なMicroBeadsで磁気的に標識します。次に、細胞懸濁液をカラムに入れ、カラム内に保持されている標識細胞と、通過する標識されていない細胞を磁気的に分離します。
- カラムを磁場から除去した後、磁気標識された細胞をカラムからチューブに洗い流し、正に選択された細胞画分として入れます。
注:磁気ラベリングプロセスの容量は、最大1 x 107 合計セルに対して計算されます。より多くの細胞が得られた場合は、それに応じてすべての試薬と総容量をスケールアップします。細胞表面での抗体のキャッピングや非特異的細胞標識を防ぎ、単離された細胞集団の高い生存率を確保するために、迅速に作業し、予冷溶液のみを使用することをお勧めします。また、カラムリザーバーが空になったらすぐに、カラムが乾燥しないようにPBバッファーを添加して洗浄ステップを実行することも重要です。 - 精製した希釈されていないCNS細胞懸濁液を2つのフラクションに分割して、ミクログリアとオリゴデンドロサイトの以下の単離を行います。両方のフラクションの比率は、各セルタイプの目的のセル数によって異なります。
注:詳細(インキュベーション期間、詳細なプロトコルステップ、容量、試薬、細胞カウント方法)を 表1に示します。
表1:ナイーブマウスおよびEAEマウスからのオリゴデンドロサイトとミクログリアの同時磁気標識および単離のワークフロー。 どちらの細胞タイプも、ポジティブセレクションによって単離されます。同じ行にリストされているステップは、一度に実行されるように示されています。略語:CD11b =サイクリン依存性キナーゼ11B;EAE = 実験的自己免疫性脳脊髄炎;FcR = Fc受容体様タンパク質;O4 =オリゴデンドロサイトマーカーO4。 この表をダウンロードするには、ここをクリックしてください。
7.プロトコルの修正:EAEマウスにおけるミクログリアの単離のための追加選別(所要時間:約1.5-2時間)
注:EAEマウスを扱う場合、CD11b+細胞画分からミクログリア以外のCD11b+細胞集団(単球、マクロファージ、ナチュラルキラー細胞、顆粒球、樹状細胞など)を除去するために、FACSによるMACSベースの細胞単離プロトコルを補完する必要があります。それ以外の場合、この手順は無視できます。
- CD11b FITCおよびCD45 APC/Cy7(クローン30-F11、1:200)を添加した1x PBSを含む染色マスターミックスを調製します。5 x 106 細胞あたり100 μLの染色マスターミックスを使用します。使用前にすべての抗体をボルテックスします。
- ミクログリア細胞懸濁液を300 x g 、4°Cで10分間遠心分離し、上清を注意深く吸引します。
- 細胞ペレットを、5 x 106 細胞あたり100 μLの調製済み染色マスターミックスで再懸濁します。暗所で室温(RT)で15分間インキュベートします。
- 500 μL の PBS を添加して反応を停止し、サンプルを 300 x g および 4 °C で 10 分間遠心分離します。
- 上清を注意深く吸引し、10 μg/mL DNAse を添加した 1 x PBS で細胞ペレットを再懸濁し、最終濃度が 1 mL あたり 1 x 107 細胞になるようにします。選別が始まるまで、細胞を4°Cで保存します。
- 選別を開始する直前に、新しいFACSチューブにセットした100μmのストレーナーに細胞懸濁液を塗布します。
- 流量を毎秒1000イベントに設定し、100μmのノズルを使用します。CD45intCD11bハイ 細胞の所望の細胞集団を、室温で1x PBSで調製した新しい15 mLチューブにソートします。
8.ニューロンとアストロサイトの単離のためのオリゴデンドロサイトのネガティブフロースルーの準備(所要時間:約1時間)
注:ステップ6のオリゴデンドロサイトの陰性フロースルーは、ニューロンとアストロサイトのさらなる分離のために収集されます。この目的のために、細胞懸濁液は2つの部分に分割されます。CNS細胞懸濁液からのオリゴデンドロサイトの以前の分離により、O4+ 細胞による汚染は最小限に抑えられます。
- オリゴデンドロサイトのネガティブフロースルーを300 x g 、4°Cで10分間遠心分離し、上清を注意深く吸引します。
- オリゴデンドロサイト陽性画分の単離に以前に使用したプールされたCNS細胞懸濁液あたり80 μLのPBバッファーに細胞ペレットを再懸濁します。
- セルを数えます。細胞懸濁液をPBバッファーで1:50に希釈した後、改良された計数チャンバーを使用してO4- と推定される細胞の計数を行い、その後さらに0.4%トリパンブルーで1:10希釈します。
- 精製した原液の細胞懸濁液を2つの画分に分割し、ニューロンとアストロサイトを同時に分離します。両方のフラクションの比率は、各細胞タイプの好ましい量によって異なります。
注:詳細(インキュベーション期間、詳細なプロトコルステップ、容量、試薬、および細胞カウント方法)を 表2に示します。
表2:ナイーブマウスおよびEAEマウスからのニューロンとアストロサイトの同時磁気標識および単離のワークフロー。 どちらの細胞タイプも、オリゴデンドロサイトの負のフロースルーから単離されています。アストロサイトは抗ACSA-2マイクロビーズを介して正の選択として分離され、ニューロンはビオチン化によって精製され、負の選択としてすべての非神経細胞が枯渇します。同じ行にリストされているステップは、一度に実行されるように示されています。略語:抗ACSA-2 =アストロサイト細胞表面抗原-2;EAE = 実験的自己免疫性脳脊髄炎;FcR = Fc受容体様タンパク質;MACS = 磁気活性化セルソーティング。 この表をダウンロードするには、ここをクリックしてください。
9. 単離された中枢神経系常在細胞の純度分析(所要時間:約2時間)
注:単離された4つのCNS常在細胞集団すべてのフローサイトメトリーを実施して、それらの純度と生存率を測定および比較することをお勧めします。したがって、すべての細胞タイプを蛍光色素で標識した抗体で染色する必要があります。生細胞/死細胞染色は、固定可能な生存率色素(1:10,000)を使用して実施されます。
- 純度パネル - 細胞外染色プロトコール
- 染色ごとに50 μLのPBSに溶解した1 x 105 細胞を使用します。
- 細胞タイプ特異的表面マーカーを標的とする以下の蛍光色素標識モノクローナル抗体からなる2% FCS/2 mM EDTAをPBSに溶解した染色マスターミックスを調製します:CD11b FITC(クローン1/70、1:100)25、26、27、28、ビオチン-PE(クローンBio3-18E7、1:200)29、30、31、32、ACSA-2 PE-Vio615(クローンREA-969、1:200)33、34,35、O4 APC(クローンREA-576、1:400)、およびCD45 BV510(クローン30-F11、1:150)36,37。1 x 106細胞あたり1μgの抗CD16/32を添加して、Fc受容体3 8,39を遮断する。使用前にすべての抗体をボルテックスします。
- 細胞懸濁液を540 x g 、4°Cで5分間遠心分離し、上清を注意深く吸引します。
- 細胞ペレットを各マスターミックス100 μLに再懸濁し、暗所の室温でサンプルを15分間インキュベートします。
- 500 μL の 1 x PBS と 2% FCS/2 mM EDTA で細胞を洗浄し、サンプルを 540 x g および 4 °C で 5 分間遠心分離します。
- 上清を吸引し、細胞ペレットを 70 μL の 1x PBS と 2% FCS/2 mM EDTA で再懸濁します。
- サンプルをボルテックスして、細胞ペレットを完全に解離させます。その後、サンプルはフローサイトメトリー分析の準備が整います。
- 純度パネル - NeuNによる細胞内染色プロトコル
- ニューロン特異的核マーカーであるNeuNの細胞内染色には、各細胞集団の1 x 105細胞を使用する40,41。これは、生存可能なニューロンを染色するための追加の方法です。
- 各細胞集団の1 x 105 細胞をFACSチューブに移します。チューブあたり 2% FCS/2 mM EDTA を含む PBS 1 mL を添加します。チューブを540 x g 、4°Cで5分間遠心分離します。
- それまでの間、細胞タイプ特異的表面マーカーを標的とする以下の蛍光色素標識モノクローナル抗体からなる2% FCS/2 mM EDTAをPBSに溶解したマスターミックスを調製します:CD11b FITC(クローンM1/70、1:100)25,26,27,28、ビオチン-PE(クローンBio3-18E7、1:200)29,30,31,32、ACSA-2 PE-Vio615(クローンREA-969、1:200)33、34,35、およびCD45 BV510(クローン30-F11、1:150)36,37。
- 上清を吸引し、調製したマスターミックス100 μLに細胞を再懸濁し、暗所の室温でサンプルを10分間インキュベートします。
- 細胞を2% FCS/2 mM EDTAを含む100 μLのPBSで洗浄し、540 x g 、4°Cで5分間遠心分離します。
- その間に、200 μL の固定/透過処理溶液を調製します: 50 μL の固定/透過処理濃縮液の濃縮ストックを 150 μL の固定/透過化希釈液に加え、最終希釈率を 1:4 にします。
- 上清を吸引し、細胞を1x固定/透過液100 μLに再懸濁します。サンプルを4°Cで30分間インキュベートします。
- その間に、100 μL の透過処理バッファーストックを 900 μL の ddH2O に添加して 1 mL の 1x 透過処理/洗浄バッファーを調製し、最終希釈率が 1:10 になります。
- 100 μL の 1x 透過処理/洗浄バッファーで細胞を 1 回洗浄し、サンプルを 540 x g および 4 °C で 5 分間遠心分離します。
- その間に、NeuN(NeuN AF647、クローンEPR12763、1:200)と106細胞あたり 1 μgの抗CD16/32のみからなる1x透過処理/洗浄バッファーで別のマスターミックスを調製し、Fc受容体をブロックします。
- 上澄みを吸引する。固定および透過処理した細胞を50 μLのセカンドマスターミックスに再懸濁し、4°Cで30分間インキュベートします。
- サンプルを100 μLの1x透過処理/洗浄バッファーで洗浄し、540 x g 、4°Cで5分間遠心分離します。
- 上清を廃棄し、細胞ペレットを 2% FCS/2 mM EDTA を含む 70 μL の PBS に再懸濁します。その後、サンプルはフローサイトメトリー解析の準備が整います。
- フローサイトメーターにパネルをセットした後、フローサイトメトリー解析ソフトウェアを使用して純度分析用の細胞を取得します。
10. 統計解析
- グラフィカルな分析プログラムを使用して統計分析を実行し、グラフを設計します。データは平均±SEMで表されます。
代表的な結果
現在のプロトコルは、すべての主要なCNS常在細胞、すなわち、ミクログリア、オリゴデンドロサイト、アストロサイト、およびニューロンを1つのCNS複製から同時に分離する可能性を提供します。これは、この種の実験に必要なマウスの数を減らし、細胞レベルでの分子および生化学的分析の比較可能性を確保するために重要です。個々の細胞タイプが異なるCNS複製から単離されている場合、細胞間相互作用を真実にマッピングすることができず、単離プロセス中の潜在的な技術的逸脱により、さらに下流の解析にバイアスがかかる可能性があります。さらに、各細胞タイプからの分子的および生化学的所見は、同じEAEコンテキストに由来しないため、互いに比較できません。市販のシステム/キットを使用した既存のMACSプロトコルは、上記の細胞タイプの同時単離を可能にするように適合されました。
ミクログリアの単離は抗CD11bマイクロビーズを用いて行い、オリゴデンドロサイトは抗O4マイクロビーズ(表1)を介して単離し、抗ACSA-2マイクロビーズはアストロサイト(表2)の単離に用いた。対照的に、ニューロンの単離は負の選択を表し、すべての非ニューロン細胞のビオチン化と磁気標識によって達成されました(表2)。血液細胞を除くすべての非神経細胞(例えば、オリゴデンドロサイト、ミクログリア、アストロサイト、内皮細胞、および線維芽細胞)は、これらの非ニューロン細胞に発現する表面抗原に対して特異的に向けられたビオチン標識抗体を使用して磁気標識することができる(表2)。これらの磁気的に標識された非神経細胞を枯渇させることにより、高純度で生存可能な神経細胞集団を生成することができる30,42,43。
生成されたシングルセル懸濁液の純度分析用に、2つの新しいフローサイトメトリーパネルを設計しました。ここでは、生細胞/死細胞の識別と組み合わせた細胞タイプ特異的な表面マーカーと核マーカーを使用しました。
得られたマウスおよび細胞タイプごとの細胞収量(図3A)を分析したところ、平均8個が得られました。4 x 105 ± 3 x 104 ミクログリア、3.23 x 106 ± 1 x 105 オリゴデンドロサイト、8.6 x 105 ± 2 x 104 アストロサイト、4.5 x 105 ± 1 x 10 ナイーブマウスあたり4 ニューロン。
神経炎症の疾患モデルを調査する目的で、プロトコルはEAEのマウスモデルにも適用されました。マウスは、EAE誘導後16日目に安楽死させ、疾患の最大値を表した。このEAE設定では、約2.9×106 ±6.7×105 個のオリゴデンドロサイト、5.2×105 ±9×104 個のアストロサイト、4.4×105 ±4×104 個のニューロンが単離された。ミクログリア細胞の収量は、MACSステップの後に追加の細胞ソーティングを行ったため、EAEマウスあたり約1.7 x 105 ± 4 x 104 ミクログリアに減少しました(図3A)。
単離後、フローサイトメトリーによるさまざまな細胞集団の表現型特性評価により、すべての主要なCNS常在細胞タイプについて純度約90%の生存可能な単一細胞懸濁液が達成できることが証明されました(図3B)。ミクログリアは、文献44,45,46,47で定義されているように、CD45intCD11bが高いものとしてゲーティングされた。
EAEでは、ミクログリアをすべてのCD11b+細胞から選別して、神経炎症中に中枢神経系に移行する単球、好中球、ナチュラルキラー細胞、顆粒球、マクロファージなどの他のCD11b+免疫細胞と区別する必要がありました27,28,48。したがって、ミクログリアは、CD11b+細胞懸濁液からCD45intCD11高細胞として選別されました。ミクログリアの選別戦略全体を図4に示します。ナイーブマウスでは、ミクログリア集団は全生単一細胞の91.16%(CD11b+全個体群の96%)であった(図4A)。EAEマウスでは、ミクログリア集団は全生単一細胞の46.85%(CD11b+全集団の55%)であった(図4B)。MACS法とFACS法はどちらも単一細胞に機械的ストレスを加えますが、選別された精製ミクログリアの75.41%±8.63%が生存可能でした(図3B)。
最初のCNS細胞懸濁液から直接単離されたアストロサイトとニューロンは、オリゴデンドロサイトとの関連する汚染を示し、オリゴデンドロサイトの負のフロースルーからニューロンとアストロサイトを同時に分離することで、この汚染を防ぐことができるという仮定につながりました。フローサイトメトリー解析により、オリゴデンドロサイトのネガティブフロースルーから単離されたアストロサイトの純度は89.23%±2.78%であり、生存率は80.56%±1.41%であることが確認されました。これらの結果と同様に、O4- 細胞画分から単離されたニューロンの純度は81.25%±3.31%であり、生存率は83.90%±2.61%でした(図3B)。また、これらの知見は、オリゴデンドロサイトの単離に続いてのみ、これら2種類の細胞を同時に単離しても、生存可能な機能細胞の量に影響を与えないことを裏付けています。
単離された単一細胞懸濁液の生存率および純度に関する結果は、単離マウスで得られたものと比較してEAEマウスで非常に類似しており、このプロトコルがEAEの状況だけでなく健康なマウスにも適していることが確認されました(図3B)。
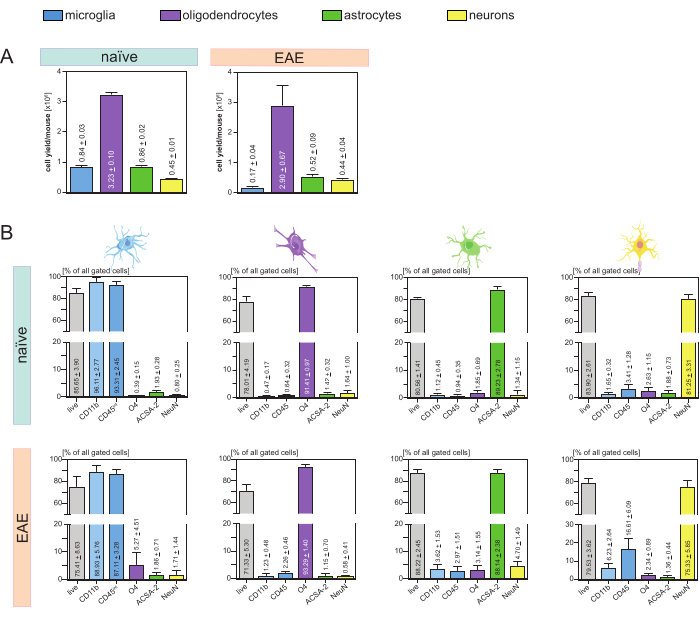
図3:単離されたCNS常在細胞の細胞収量とフローサイトメトリーによるバリデーション。(A) ナイーブマウスおよびEAEマウスにおけるCNS常在細胞の単離後のマウスおよび細胞タイプごとの細胞収量。棒グラフは、提示されたプロトコルの実装後のマウスおよび細胞タイプごとの細胞収量を視覚化します。ナイーブマウスでは5つの生物学的複製を解析し、EAEマウスでは4つの生物学的複製を解析した。それぞれの手段±SEMが描かれています。(B)精製された細胞画分の対応する純度および生存率分析。棒グラフは、得られた単一細胞懸濁液の生存率と純度を、細胞タイプ特異的マーカーの発現に基づいて示しています。NeuNは、ニューロンの細胞型特異的な核マーカーとして使用されました。5つの生物学的複製を取得し、健常マウスとEAEマウスの両方について、各細胞タイプについて比較しました。SEM±それぞれの手段が示されています。略語:抗ACSA-2 =アストロサイト細胞表面抗原-2;CD11b = サイクリン依存性キナーゼ11B;CD45 =受容体型チロシン-プロテインホスファターゼC;CNS = 中枢神経系;EAE = 実験的自己免疫性脳脊髄炎;MACS = 磁気活性化セルソーティング;NeuN =RNA結合蛋白質fox-1相同物3;O4 = オリゴデンドロサイトマーカー O4;SEM = 平均の標準誤差。この数字は49 から変更されています。 この図の拡大版をご覧になるには、ここをクリックしてください。
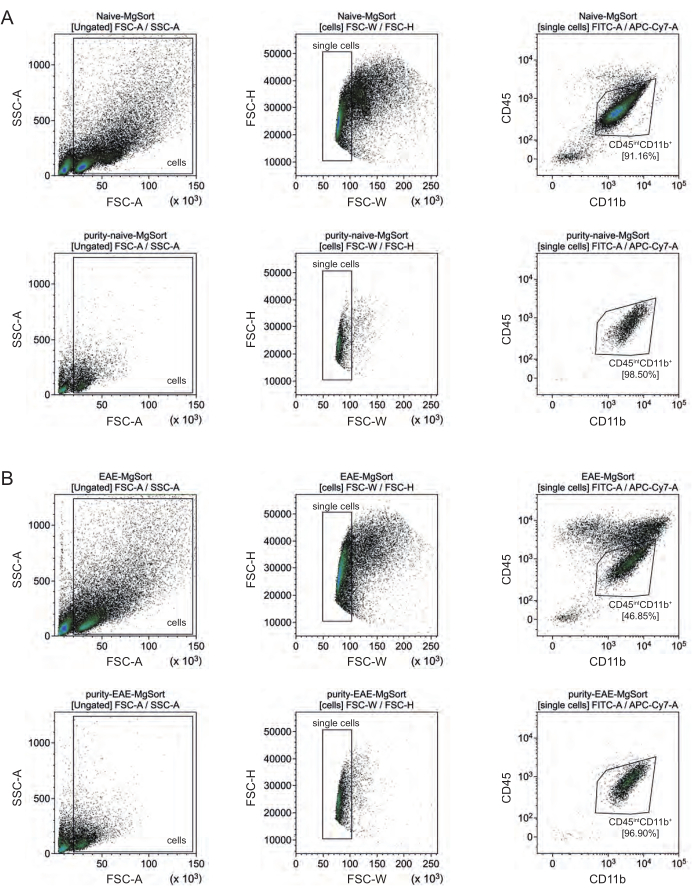
図4:CD11b+細胞単離後のミクログリアの細胞選別のためのゲーティング戦略。(A) ナイーブマウスおよび(B)EAEマウスにおけるゲーティング戦略。各パネルの上段はソート前のドットプロット、下段はソート後のドットプロットです。生細胞(SSC−A/FSC−A)および単一細胞(FCS-H/FSC-W)を選択した後、CD45intCD11b+ 細胞の集団をミクログリア集団として選別した。 この図の拡大版をご覧になるには、ここをクリックしてください。
ディスカッション
これまでのところ、質量分析とRNAシーケンシングを組み合わせて生体外でCNSに常在する細胞をマッピングする方法は、健康と疾患における非常に正確な細胞プロファイリングを提供しますが、この分野での野心的な技術的知識と専門知識が必要です50,51。さらに、機能解析ができず、非常に高価です。それに加えて、マイクロ流体ブレインオンチップシステムは、疾患メカニズムの迅速かつ手頃な価格のスクリーニングと、細胞の成長と移動を制限した新しい治療アプローチのテストを提供します52,53,54,55。また、中枢神経系オルガノイドは、将来、疾患経過中の細胞モデリング、細胞間接続、および相互作用の研究において、同等の代替手段となる可能性があります56,57,58,59。しかし、蛍光活性化および磁気活性化細胞選別は、現在、ex vivo 35,60,61で純粋で生存可能な単一細胞懸濁液を生成するための最も効果的な方法です。中枢神経系常在細胞型の単離のための他の確立された製造プロトコルが、磁気単離および先行細胞解離の個々のステップに関して類似している場合でも、それらは各細胞型に対して個別に実施されることを意図している。対照的に、現在のプロトコルでは、CNS常在細胞タイプごとに異なる単離法を論理的なコンテキストに統合しているため、一度に、1つのCNS細胞懸濁液から同時に実行できます(表1、表2)。これにより、1つのCNS細胞懸濁液からのマルチオミクス解析が可能になり、最終的には複雑な神経回路網の探索が可能になります。このプロトコルを実行するために複数の動物から複数の組織をプールすることが必須でなくても、このプールにより、さらなる下流分析のために十分な数の単離された細胞が確保されます。単一細胞型の単離に異なるマウスを使用すると、潜在的な細胞相互作用を解析する可能性が排除されます。さらに、以前のCNS解離に続く異なるCNS細胞タイプに対して個別の単離法を組み合わせることで、その後のすべての磁気分離ステップに1つの解離中枢神経系細胞懸濁液を使用することで、材料費を節約できます。さらに、異なるマウスの使用によって引き起こされる潜在的な技術的バイアスが最小限に抑えられます。
このプロトコルの限界の1つは、雌のC57BL/6Jマウスをほぼ独占的に使用できることです。EAE免疫プロトコルは雌マウス用に設計および確立されているため、この細胞単離プロトコルは雌のC57BL/6Jマウスにも実装されました。それにもかかわらず、ナイーブな雄マウスは、このプロトコルの開発中にも使用され、結果として生じる細胞数または純度への影響を認識しませんでした。別の制限は、正の選択の観点からニューロンを単離するための特定のマイクロビーズが存在しないため、ニューロンの磁気細胞の分離に影響を与えます。純粋な単一細胞懸濁液は、ビオチン標識とすべての非神経細胞の枯渇によって得られると想定されました(表2)。この仮定は、ニューロンの特異的核マーカーとしてNeuNを使用することによって検証され、前述のフローサイトメトリー純度パネルに統合されました。別の制限は、EAEマウスにおけるミクログリアの単離に関するものである。ここで、結果として得られる細胞収量は、MACSプロトコルの後に追加のソーティングステップがあるため、他の細胞タイプと比較して減少します。さらに、選別は他の細胞集団と比較してミクログリアの機械的ストレスを増加させると主張することができます。個々の選別戦略により、細胞収量が異なる場合があります。単離された細胞数が予想または望ましいものよりも少ない場合は、ゲーティング設定を調整するか、生死識別を改善することをお勧めします。
プロトコルの重要なステップは、デブリの除去です。グラジエントを非常にゆっくりと緩やかに層状にして、必要な 3 つの別々の相を作成する必要があります(図 2A)。2つのトップフェーズのミエリンやその他のデブリ残渣が完全に除去された場合にのみ(図2E)、純粋な単一細胞懸濁液を生成し、さらなる汚染を減らすことができます。得られた細胞懸濁液が純度を欠いている場合、これはおそらく、すべてのマイクロビーズの正しい使用の保証の次に最初に改善されるべきプロトコルのセクションです。
このタイプの実験では、高レベルの純度と生存率を得ることが困難な場合があります。トラブルシューティングの推奨事項は次のとおりです。
-無菌条件下での作業は、さまざまなマイクロビーズの汚染を防ぎ、特にその後の培養で繰り返し使用できるようにするために義務付けられています。
-取り違えを防ぐために、各チューブにラベルを付けることを強くお勧めします。
-非冷却の試薬/緩衝液の使用は避けてください。高い生存率を確保するために、実験全体を通してすべての細胞懸濁液を氷上に保管してください。
-異なる作業ステップ間の時間をできるだけ短くしてください。プロトコルには、実験の一時停止が推奨される特定の部分はありません。
-指定された潜伏期間を遵守することは非常に関連性があります。
結論として、1つのCNS複製からすべての主要なCNS常在細胞タイプを同時に分離するためのこの現在のプロトコルは、1つのCNS細胞懸濁液から複雑なニューロンネットワークと神経炎症経路を ex vivo で分析する可能性を提供します。したがって、中枢神経系に常在する細胞は、EAEにおける神経炎症、神経変性および/または寛解期など、疾患経過のさまざまな段階で調査することができます。さらに、細胞間相互作用や生化学的経路を個人レベルで研究することができ、実験グループ内のばらつきを減らすことができます。また、単離されたCNS細胞の画分を単離培養で培養し、さらなる機能アッセイと検証を行う機会もあります。このプロトコルは、前臨床および臨床研究のアプローチに影響を与える可能性のある大きな進歩を提供します。
開示事項
すべての著者は、利益相反がないことを宣言します。
謝辞
フィギュアはAdobe Illustrator(バージョン2023)と Servier Medical Art (https://smart.servier.com)を使用して作成されました。アントニア・ヘネスはユルゲン・マンチョ財団の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 70 μm cell strainers | Corning, MA, USA | 352350 | CNS tissue dissociation |
| ACSA-2 Antibody, anti-mouse, PE-Vio 615 (clone REA-969) | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-116-244 | Flow cytometry, store at 4 °C |
| Adult Brain Dissociation Kit, mouse, and rat | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-107-677 | Tissue dissociation,contains debris and red blood cell removal solutions; prepare aliquots of enzyme A and P upon arrival and store them at -20 °C; store the remaining kit at 4 °C |
| Anti-ACSA-2 MicroBead Kit, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-097-678 | MACS of astrocytes, store at 4 °C |
| Anti-mouse CD16/32 antibody | BioLegend, London, UK | 101301 | Flow cytometry, store at 4 °C |
| Anti-O4 MicroBeads, human, mouse, rat | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-094-543 | MACS of oligodendrocytes, store at 4 °C |
| AstroMACS Separation buffer | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-091-221 | MACS of astrocytes, store at 4 °C |
| Biotin Antibody, PE (clone Bio3-18E7) | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-113-853 | Flow cytometry, store at 4 °C |
| BRAND Neubauer counting chamber | Thermo Fisher Scientific,Waltham, MA, USA | 10195580 | Cell counting |
| Brilliant Violet 510 anti-mouse CD45 Antibody (clone 30-F11) | BioLegend, London, UK | 103137 | Flow cytometry, store at 4 °C |
| CD11b MicroBeads, human, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-049-601 | MACS of microglia, store at 4 °C |
| DNAse I, recombinant, Rnase-free | Merck KGaA, Darmstadt, Germany | 4716728001 | Flow cytometry, store at -20° C |
| D-PBS with Calcium, Magnesium, Glucose, Pyruvat | Thermo Fisher Scientific,Waltham, MA, USA | 14287080 | Buffer, store at 4 °C |
| D-PBS, without calcium, without magnesium | Thermo Fisher Scientific,Waltham, MA, USA | 14190250 | Buffer, store at 4 °C |
| eBioscience Fixable Viability Dye eFluor 780 | Thermo Fisher Scientific,Waltham, MA, USA | 65-0865-14 | Flow cytometry, store at 4 °C |
| eBioscience Foxp3/Transcription factor staining buffer set | Thermo Fisher Scientific,Waltham, MA, USA | 00-5523-00 | Flow cytometry, store at 4°C |
| Falcon (15 mL) | Thermo Fisher Scientific,Waltham, MA, USA | 11507411 | Cell tube |
| Falcon (50 mL) | Thermo Fisher Scientific,Waltham, MA, USA | 10788561 | Cell tube |
| Falcon Round-Bottom Polystyrene Test Tubes with Cell Strainer Snap Cap, 5 mL | Thermo Fisher Scientific,Waltham, MA, USA | 08-771-23 | Flow cytometry |
| FcR Blocking Reagent, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-092-575 | MACS of oligodendrocytes, store at 4 °C |
| Female C57BL/6J mice | Charles River Laboratories, Sulzfeld, Germany | Active EAE induction | |
| Fetal calf serum (FCS) | Merck KGaA, Darmstadt, Germany | F2442-50ML | Flow cytometry, store at -5 to -20 °C |
| FITC Rat Anti-CD 11b (clone M1/70) | BD Biosciences, San Jose, CA, USA | 553310 | Flow cytometry, store at 4 °C |
| Freund’s Complete adjuvant | Merck KGaA, Darmstadt, Germany | AR001 | Active EAE induction, store at 4 °C |
| GentleMACS C Tubes | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-093-237 | CNS tissue dissociation |
| GentleMACS Octo Dissociator with Heaters | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-096-427 | CNS tissue dissociation |
| Graphpad Prism 8.4.3 | Graphpad by Dotmatics | Graphical Analysis | |
| Isoflurane | AbbVie, North Chicago, IL, USA | Active EAE induction, store at 4 °C | |
| Kaluza Analysis Software V2.1.1 | Beckman Coulter, Indianapolis, IN, USA | Flow cytometry analysis | |
| LS Columns | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-042-401 | MACS |
| MACS BSA Stock Solution | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-091-376 | PB-buffer |
| MACS MultiStand | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-042-303 | MACS |
| MOG35–55 peptide | Charité, Berlin, Germany; alternatives: Genosphere Biotechnologies (Paris, France) or sb-Peptide (Saint Egrève, France) | Active EAE induction, store at -20 °C | |
| Mycobacterium tuberculosis strain H37 Ra | Becton, Dickinson and Company (BD),Franklin Lakes, NJ, USA | Active EAE induction, store at 4 °C | |
| Neuron Isolation Kit, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-115-390 | MACS of neurons, store at 4 °C |
| O4 Antibody, anti-human/mouse/rat, APC, (clone REA-576) | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-119-897 | Flow cytometry, store at 4 °C |
| Pertussis toxin in glycerol | Hooke Laboratories Inc., Lawrence, MA, USA | BT-0105 | Active EAE induction; store at -20 °C |
| pluriStrainer Mini 100 μm | pluriSelect Life Science UG, Leipzig, Sachsen, Germany | 43-10100-40 | Flow cytometry |
| QuadroMACS Separator | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-090-976 | MACS |
| Recombinant Alexa Fluor 647 Anti-NeuN antibody (clone EPR12763) | Abcam, Cambridge, UK | EPR12763 | Flow cytometry, store at -20 °C |
| Stainless Steel Brain Matrices, 1 mm | Ted Pella, Redding, CA, USA | 15067 | CNS tissue dissection |
| Trypan blue solution, 0.4% | Thermo Fisher Scientific,Waltham, MA, USA | 15250061 | Cell counting |
| UltraPure 0.5 M EDTA, pH 8.0 | Thermo Fisher Scientific,Waltham, MA, USA | 15575020 | Flow cytometry, store at room temperature |
参考文献
- Trapp, B. D., Nave, K. A. Multiple Sclerosis: An Immune or Neurodegenerative Disorder. Annu Rev Neurosci. 31 (1), 247-269 (2008).
- Stys, P. K., Zamponi, G. W., van Minnen, J., Geurts, J. J. Will the real multiple sclerosis please stand up. Nat Rev Neurosci. 13 (7), 507-514 (2012).
- Korn, T. Pathophysiology of multiple sclerosis. J Neurol. 255 (Suppl 6), 2-6 (2008).
- Ward, M., Goldman, M. D. Epidemiology and Pathophysiology of Multiple Sclerosis. CONTINUUM. 28 (4), 988-1005 (2022).
- Bittner, S., Afzali, A. M., Wiendl, H., Meuth, S. G. Myelin Oligodendrocyte Glycoprotein (MOG35-55) Induced Experimental Autoimmune Encephalomyelitis (EAE) in C57BL/6 Mice. J Vis Exp. (86), 51275 (2014).
- Bittner, S., et al. The TASK1 channel inhibitor A293 shows efficacy in a mouse model of multiple sclerosis. Exp Neurol. 238 (2), 149-155 (2012).
- Göbel, K., et al. Plasma kallikrein modulates immune cell trafficking during neuroinflammation via PAR2 and bradykinin release. Proc Natl Acad Sci U S A. 116 (1), 271-276 (2019).
- Ballerini, C. Experimental Autoimmune Encephalomyelitis. Methods Mol Biol. 2285, 375-384 (2021).
- Birmpili, D., Charmarke Askar, I., Bigaut, K., Bagnard, D. The Translatability of Multiple Sclerosis Animal Models for Biomarkers Discovery and Their Clinical Use. Int J Mol Sci. 23 (19), 11532 (2022).
- Tsatas, O., Ghasemlou, N. Isolation and RNA purification of macrophages/microglia from the adult mouse spinal cord. J Immunol Methods. 477, 112678 (2020).
- Calvo, B., Rubio, F., Fernández, M., Tranque, P. Dissociation of neonatal and adult mice brain for simultaneous analysis of microglia, astrocytes and infiltrating lymphocytes by flow cytometry. IBRO Rep. 8, 36-47 (2020).
- Diaz-Amarilla, P., et al. Isolation and characterization of neurotoxic astrocytes derived from adult triple transgenic Alzheimer's disease mice. Neurochem Int. 159, 105403 (2022).
- Galatro, T. F., Vainchtein, I. D., Brouwer, N., Boddeke, E. W. G. M., Eggen, B. J. L. Isolation of Microglia and Immune Infiltrates from Mouse and Primate Central Nervous System. Methods Mol Biol. 1559, 333-342 (2017).
- Altendorfer, B., et al. Transcriptomic Profiling Identifies CD8+ T Cells in the Brain of Aged and Alzheimer's Disease Transgenic Mice as Tissue-Resident Memory T Cells. J Immunol. 209 (7), 1272-1285 (2022).
- Lanfranco, M. F., Sepulveda, J., Kopetsky, G., Rebeck, G. W. Expression and secretion of apoE isoforms in astrocytes and microglia during inflammation. Glia. 69 (6), 1478-1493 (2021).
- Swire, M., Ffrench-Constant, C. Oligodendrocyte-Neuron Myelinating Coculture. Methods Mol Biol. 1936, 111-128 (2019).
- Park, J., Koito, H., Li, J., Han, A. Microfluidic compartmentalized co-culture platform for CNS axon myelination research. Biomed Microdevices. 11 (6), 1145-1153 (2009).
- Facci, L., Barbierato, M., Skaper, S. D. Astrocyte/Microglia Cocultures as a Model to Study Neuroinflammation. Methods Mol Biol. 1727, 127-137 (2018).
- Speicher, A. M., Wiendl, H., Meuth, S. G., Pawlowski, M. Generating microglia from human pluripotent stem cells: novel in vitro models for the study of neurodegeneration. Mol Neurodegener. 14 (1), 46 (2019).
- Homayouni Moghadam, F., et al. Isolation and Culture of Embryonic Mouse Neural Stem Cells. J Vis Exp. (141), 58874 (2018).
- Santos, R., et al. Differentiation of Inflammation-Responsive Astrocytes from Glial Progenitors Generated from Human Induced Pluripotent Stem Cells. Stem Cell Reports. 8 (6), 1757-1769 (2017).
- Tcw, J., et al. An Efficient Platform for Astrocyte Differentiation from Human Induced Pluripotent Stem Cells. Stem Cell Reports. 9 (2), 600-614 (2017).
- Miltenyi, S., Müller, W., Weichel, W., Radbruch, A. High gradient magnetic cell separation with MACS. Cytometry. 11 (2), 231-238 (1990).
- Huntemann, N., et al. An optimized and validated protocol for inducing chronic experimental autoimmune encephalomyelitis in C57BL/6J mice. J Neurosci Methods. 367, 109443 (2022).
- Martin, E., El-Behi, M., Fontaine, B., Delarasse, C. Analysis of Microglia and Monocyte-derived Macrophages from the Central Nervous System by Flow Cytometry. J Vis Exp. (124), 55781 (2017).
- Sarkar, S., et al. Rapid and Refined CD11b Magnetic Isolation of Primary Microglia with Enhanced Purity and Versatility. J Vis Exp. (122), 55364 (2017).
- Rodríguez Murúa, S., Farez, M. F., Quintana, F. J. The Immune Response in Multiple Sclerosis. Annu Rev Pathol. 17, 121-139 (2021).
- Engelhardt, B., Ransohoff, R. M. Capture, crawl, cross: the T cell code to breach the blood-brain barriers. Trends Immunol. 33 (12), 579-589 (2012).
- Elia, G. Biotinylation reagents for the study of cell surface proteins. Proteomics. 8 (19), 4012-4024 (2008).
- Berl, S., et al. Enrichment and isolation of neurons from adult mouse brain for ex vivo analysis. J Neurosci Methods. 283, 15-22 (2017).
- Turvy, D. N., Blum, J. S. Biotin Labeling and Quantitation of Cell-Surface Proteins. Curr Protoc Immunol. 18 (7), (2001).
- Mao, S. Y. Biotinylation of Antibodies. Methods Mol Biol. 115, 39-41 (1999).
- Kantzer, C. G., et al. Anti-ACSA-2 defines a novel monoclonal antibody for prospective isolation of living neonatal and adult astrocytes. Glia. 65 (6), 990-1004 (2017).
- Batiuk, M. Y., et al. An immunoaffinity-based method for isolating ultrapure adult astrocytes based on ATP1B2 targeting by the ACSA-2 antibody. J Biol Chem. 292 (21), 8874-8891 (2017).
- Pan, J., Wan, J. Methodological comparison of FACS and MACS isolation of enriched microglia and astrocytes from mouse brain. J Immunol Methods. 486, 112834 (2020).
- Donovan, J. A., Koretzky, G. A. CD45 and the immune response. J Am Soc Nephrol. 4 (4), 976-985 (1993).
- Hathcock, K. S., Hirano, H., Hodes, R. J. CD45 expression by murine B cells and T cells: Alteration of CD45 isoforms in subpopulations of activated B cells. Immunol Res. 12 (1), 21-36 (1993).
- Balogh, P., Tew, J. G., Szakal, A. K. Simultaneous blockade of Fc? receptors and indirect labeling of mouse lymphocytes by the selective detection of allotype-restricted epitopes on the kappa chain of rat monoclonal antibodies. Cytometry. 47 (2), 107-110 (2002).
- Becerril-García, M. A., et al. Langerhans Cells From Mice at Birth Express Endocytic- and Pattern Recognition-Receptors, Migrate to Draining Lymph Nodes Ferrying Antigen and Activate Neonatal T Cells in vivo. Front Immunol. 11, 744 (2020).
- Dent, M. A., Segura-Anaya, E., Alva-Medina, J., Aranda-Anzaldo, A. NeuN/Fox-3 is an intrinsic component of the neuronal nuclear matrix. FEBS Lett. 584 (13), 2767-2771 (2010).
- Duan, W., et al. Novel Insights into NeuN: from Neuronal Marker to Splicing Regulator. Mol Neurobiol. 53 (3), 1637-1647 (2016).
- Monteiro, R., Sivasubramanian, M. K., Balasubramanian, P., Subramanian, M. Obesity-Induced Sympathoexcitation is Associated with Glial Senescence in the Brainstem. FASEB J. 34 (S1), 1-1 (2020).
- Li, S., Chang, L., Teissie, J. . Electroporation protocols: mircroorganism, mammalian system, and nanodevice. , (2020).
- Kettenmann, H., Hanisch, U. K., Noda, M., Verkhratsky, A. Physiology of Microglia. Physiol Rev. 91 (2), 461-553 (2011).
- Haage, V., et al. Comprehensive gene expression meta-analysis identifies signature genes that distinguish microglia from peripheral monocytes/macrophages in health and glioma. Acta Neuropathol Commun. 7 (1), 20 (2019).
- Kosior, N., Petkau, T. L., Connolly, C., Lu, G., Leavitt, B. R. Isolating cells from adult murine brain for validation of cell-type specific cre-mediated deletion. J Neurosci Methods. 328, 108422 (2019).
- Jurga, A. M., Paleczna, M., Kuter, K. Z. Overview of General and Discriminating Markers of Differential Microglia Phenotypes. Front Cell Neurosci. 14, 198 (2020).
- Man, S., Ubogu, E. E., Ransohoff, R. M. Inflammatory Cell Migration into the Central Nervous System: A Few New Twists on an Old Tale. Brain Pathol. 17 (2), 243-250 (2007).
- Schroeter, C. B., et al. One Brain-All Cells: A Comprehensive Protocol to Isolate All Principal CNS-Resident Cell Types from Brain and Spinal Cord of Adult Healthy and EAE Mice. Cells. 10 (3), 651 (2021).
- Sankowski, R., et al. Mapping microglia states in the human brain through the integration of high-dimensional techniques. Nate Neurosci. 22 (12), 2098-2110 (2019).
- Brennan, F. H., et al. Microglia coordinate cellular interactions during spinal cord repair in mice. Nat Commun. 13 (1), 4096 (2022).
- Enright, H. A., et al. Functional and transcriptional characterization of complex neuronal co-cultures. Sci Rep. 10 (1), 11007 (2020).
- Mofazzal Jahromi, M. A., et al. Microfluidic Brain-on-a-Chip: Perspectives for Mimicking Neural System Disorders. Mol Neurobiol. 56 (12), 8489-8512 (2019).
- Chin, E., Goh, E. Blood-brain barrier on a chip. Methods Cell Biol. 146, 159-182 (2018).
- Miccoli, B., Braeken, D., Li, Y. E. Brain-on-a-chip Devices for Drug Screening and Disease Modeling Applications. Curr Pharm Des. 24 (45), 5419-5436 (2019).
- Giandomenico, S. L., et al. Cerebral organoids at the air-liquid interface generate diverse nerve tracts with functional output. Nat Neurosci. 22 (4), 669-679 (2019).
- Pellegrini, L., et al. Human CNS barrier-forming organoids with cerebrospinal fluid production. Science. 369 (6500), eaaz5626 (2020).
- Chhibber, T., et al. CNS organoids: an innovative tool for neurological disease modeling and drug neurotoxicity screening. Drug Discov Today. 25 (2), 456-465 (2020).
- Tang, X. Y., et al. Human organoids in basic research and clinical applications. Signal Transduct TargetTher. 7 (1), 168 (2022).
- Sutermaster, B. A., Darling, E. M. Considerations for high-yield, high-throughput cell enrichment: fluorescence versus magnetic sorting. Sci Rep. 9 (1), 227 (2019).
- Doughty, D., et al. Development of a novel purification protocol to isolate and identify brain microglia. Exp Biol Med. 247 (16), 1433-1446 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
JoVEについて
Copyright © 2023 MyJoVE Corporation. All rights reserved