このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
間質性肺疾患および末梢肺病変を診断するための経気管支肺凍結生検 - 段階的アプローチ
要約
間質性肺疾患および末梢肺病変を診断するための経気管支肺凍結生検(TBLC)は、高収率の診断で安全な手順です。柔軟な気管支鏡で言及されたさまざまな適応症に対してTBLCを実施するための段階的なアプローチについて説明します。これは、TBLCを実行する初心者の気管支鏡医に役立つ可能性があります。
要約
経気管支肺凍結生検 (TBLC) は、間質性肺疾患 (ILD) を診断するためのビデオ補助胸部手術肺生検 (SLB) の代替として、過去 10 年間でますます実施されている侵襲的な手順です。TBLCの適応症は、主に、特定のILDサブタイプをサブクラス化することでした。これは、事前の学際的なチームディスカッションに基づいて達成できない場合です。SLB は組織学的診断を確立するためのゴールド スタンダードと考えられていますが、TBLC は、SLB と同等の診断率が得られるため、未分類の ILD 患者の第一選択の組織学的診断モダリティとして徐々に提案されていますが、死亡率を含む合併症の点では SLB よりも優れています。近年、末梢肺病変に対する放射状気管支内超音波(R-EBUS)および電磁ナビゲーション気管支鏡検査(ENB)ガイド下TBLCも安全な手順として説明されており、鉗子生検と比較して診断率が向上する可能性があります。それでも、TBLCの診断特性は、手順のパフォーマンスの品質に依存しています。この記事では、前述のさまざまな適応症に対して柔軟な気管支鏡を使用してTBLCを実施するための段階的なアプローチを説明することを目的としています。これは、TBLCを実行する初心者の気管支鏡医に役立つ可能性があります。
概要
間質性肺疾患(ILD)は、気管支、肺胞、結合組織、血管、リンパ管など、間質を形成するすべての肺実質成分の1つ以上に影響を与える急性および慢性の肺疾患のグループを構成します。ILDは希少疾患であるにもかかわらず、200種類以上の異なるサブタイプが、臨床的、放射線学的、および細胞組織学的特性が異なる不均一な疾患カテゴリーを表しています。ILDは通常、炎症、線維症、またはその両方の組み合わせとして現れ、これが患者の通常の知覚症状である乾いた咳、運動時の呼吸困難、および疲労の根本的な原因です1,2。
ILDは、特発性間質性肺炎(IIP)、既知の病因の間質性肺炎(結合組織病、間質性肺疾患、薬物誘発性ILD、および作業関連じん肺症など)、肉芽腫性間質性罹患(サルコイドーシスおよび過敏性肺炎など)、および希少性ILD(多発性嚢胞性肺疾患および好酸球性肺炎など)に分類されます1.この分類とさらなる診断サブタイピングは、最適な治療とフォローアップを決定するための基本であり、予後を可能にします。ただし、診断のパズルは難しい場合があるため、利用可能な臨床情報(既往歴、素因、および潜在的な曝露を含む)および準臨床情報を胸部高解像度コンピューター断層撮影法(HRCT)、肺生理学、および学際的なチームディスカッション(MDD)に基づいて得られた自己免疫学として解釈することが推奨されます3,4,5。確信のあるMDD診断が得られない場合6,7、明確なILDサブタイプ診断の可能性を高めるための組織学的サンプリングは、経気管支肺凍結生検(TBLC)8,9の使用によって示される。厳選された患者では、TBLCは、ビデオ支援胸部手術肺生検(SLB)に近い診断精度を持つ安全な侵襲的処置と考えられており、これは依然として組織学的ILD診断の組織学的ゴールドスタンダードと見なされています10,11,12,13,14.TBLCの手技は、組織学的サンプリングのための特別な凍結プローブを適用し、推奨される透視ガイダンスとともに、体系的な気管支鏡検査として行われます。TBLCは、MDD設定を使用して、TBLC合併症の管理に精通したインターベンショナル呼吸器科医によって、三次ILDセンターで実施することが推奨されます。彼らはTBLCの専門知識9,10,11,15,16,17を持つ専用センターでトレーニングを受けています。
また、ILD診断のための放射状気管支内超音波検査(R-EBUS)と併用する手技として、TBLCが最近注目されている18,19。さらに、TBLCは、末梢肺病変(PPL)を診断するためにR-EBUSおよび電磁ナビゲーション気管支鏡検査(ENB)の両方と組み合わせて、従来の経気管支鉗子生検と比較した場合の診断歩留まりを改善しています20,21。しかし、この比較的新しい PPL 診断のアプローチは、標準的な手順としてまだ実装されていないため、この特定の領域ではさらなる証拠が必要です。本レポートの目的は、言及された適応症の臨床現場で柔軟な気管支鏡を使用してTBLCを実施するための段階的なアプローチを説明することです。
プロトコル
著者は、デンマークの2つのTBLCセンター(オーデンセ大学病院とオーフス大学病院)から来ており、どちらもヘルシンキ宣言の原則に従って研究を行っています。この研究は本質的に観察的であったため、倫理的な承認は必要ありませんでした。研究目的で含まれたすべての患者は、書面によるインフォームドコンセントを提供しました。TBLCコンダクタンスについて説明した段階的アプローチは、フレキシブル気管支鏡の使用に関連しており、国際的なガイドラインからの推奨事項、専門家の声明、最先端のレビュー、および2つのTBLCセンター9、10、11、15、16、17、22、23、24の経験の組み合わせに基づいていることを強調することが重要です。、25。
1. TBLC前の考慮事項
- TBLCが示されていることを確認することは、HRCT、生化学、および自己免疫学からの情報を以前のMDDに統合し、呼吸器科医や放射線科医が関与する患者では正当化されます。
- 表1に記載されている禁 ?? を回避して、適切な患者を選択します。.
| 相対的禁忌 | 絶対禁忌 |
| 必要肺活量(FVC)<予測値の50% | 血小板減少症 < 50 x 109/L または INR > 1.5 |
| 肺の一酸化炭素の拡散能力(DLCO)<予測値の35% | 未矯正出血素因 |
| 収縮期肺動脈圧> 50 mmHg (心エコー検査に基づく推定など) | 肺機能が低下した患者の合併症のリスクの増加による進行性および臨床的衰退。 |
| ボディマス指数>35 kg / m2 |
表1:TBLCの禁忌。 TBLCコンダクタンスの相対的および絶対的禁忌。略称:TBLC = 経気管支肺凍結生検。
2. TBLC前の準備
- HRCTと胸部放射線科医からの提案を確認して、放射線疾患の症状に応じてどの気管支セグメント(BS)組織学的サンプリングに最もアクセスしやすいかを計画します。
- TBLCのパフォーマンスの前に、システムが動作することをテストします。
- 設定パネルのガス(二酸化炭素(CO2)または亜酸化窒素(NO))タンク容量ボタンを押して、シリンダー内のガスの量を確認します。
- クライオプローブをトレイに置き、ペダルフットスイッチを5〜10秒間押しながらプローブを観察します。プローブの先端にある氷の球を探して、プローブが正常に機能していることを示します(図1)。
- 全身麻酔(GA)またはTBLC下での深い鎮静を使用し、出血のリスクを減らすために0.5〜1gのトラネキサム酸による前投薬を検討してください。
- 7.5〜8.5mmサイズの特殊な二重管腔気管内チューブ(ETT)を気管に留置します。
注:ETTには、患者が換気されている間に気管支鏡にアクセスできるメインチャネルがあり、気管支遮断カテーテルの作業チャネルとして機能するマイナーサイドチャネルがあります。- 局所麻酔で継続的にスプレーします(例:.、リドカインスプレー10%)咳を減らすために。ステップ 3.5 も参照してください。
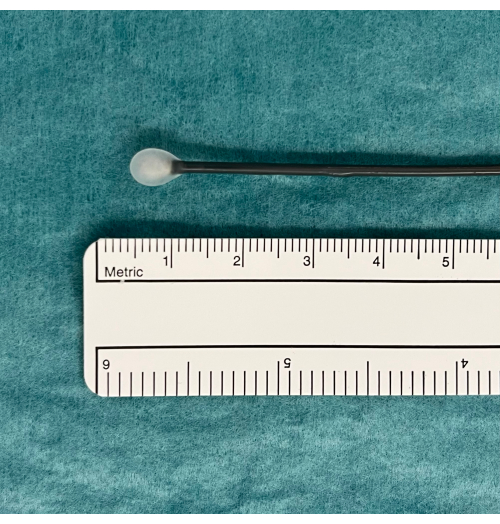
図1:使用可能なTBLC機器の目安であるアイスボール。 ペダルを踏むと、タンクからのCO2 ガス拡散が活性化され、凍結が誘発されます。これは、正常に機能している場合、クライオプローブの先端に氷の球が現れる水中でテストされます。略称:TBLC = 経気管支肺凍結生検。 この図の拡大版を表示するには、ここをクリックしてください。
3. TBLCコンダクタンス
- ETTを通じて柔軟な気管支鏡を導入し、気管支鏡検査の手順を実行します。
注:一部のTBLCセンターでは、気管挿管に硬性気管支鏡が使用されています。気管が硬性気管支鏡によって挿管されている場合、柔軟な気管支鏡を硬性気管支鏡に通すことができます。- フレキシブルクライオプローブを気管支鏡のワーキングチャネルを通じて、選択したBSに導入します。
注:クライオプローブは、シングルユースプローブ(1.1、1.7、および2.4 mm)と再利用可能なプローブ(1.9および2.4 mm)の両方として提供されます。 - 透視法を使用して、クライオプローブの先端の配置が、選択したBSに対応する胸郭壁から約10 mmの位置にあることを確認します(図2)。
- 気管支遮断カテーテル(例:.、Fogartyバルーン)を二重管腔ETTの側チャネルに導入し、選択したBS口に配置します(図3)。
- 気管支遮断カテーテルを膨らませて、バルーンに対して遠位に発生する可能性のある出血の配置と閉塞の適切性を評価します(図4)。
- バルーンが適切に配置されている場合は、気管支遮断カテーテルを収縮させます。
- 気管支ブロッカーカテーテルをピーンで固定することにより、バルーンの配置を固定します。
- それぞれのETTとそのサイドチャネルに少量のリドカインスプレーまたは生理食塩水を使用して、ETTのクライオプローブとETTのサイドチャネルにバルーンカテーテルを導入することによって発生する摩擦を減らします。
- ステップ3.1.1-3.1.3が十分に実行されたら、凍結プローブのサイズに応じて凍結ペダルを3〜6秒間踏み、ジュールトンプソンの法則を利用して肺実質組織をCO2 の約-45-79°C、NOの-89°Cに凍結します。
- 凍結ペダルを押しながら、凍結プローブを含む柔軟な気管支鏡を1回の素早い動きで引っ込めると、凍結が続けられ、収縮中に生検が脱落するのを防ぎます。
- ステップ3.1.5で説明されている操作中、気管支鏡専門医以外の人にバルーンを膨らませたままにして、選択したBSオスチウムの遠位の生検部位をブロックしてもらい、潜在的な出血を制御します。.
- フレキシブルクライオプローブを気管支鏡のワーキングチャネルを通じて、選択したBSに導入します。
- 同じ葉からの 2 つの BS から少なくとも 2 つの生検が得られるまで、ステップ 3.1.6 を続けます。
- 生検を生理食塩水に入れ、すべての生検が得られたら、ホルムアルデヒド(4%)に固定します(図5)。
- MDDの前に病理学的検査のために生検を送ってください。
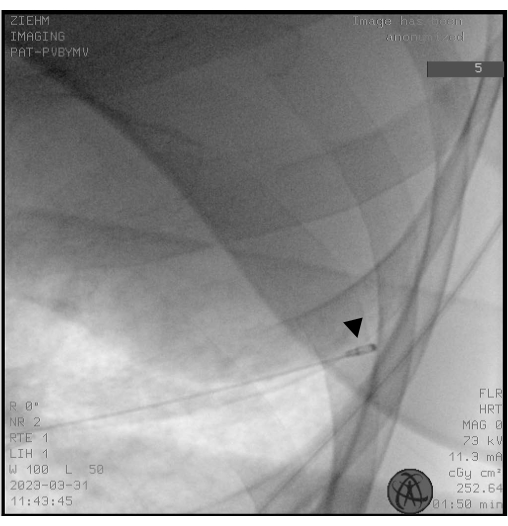
図2:透視検査。透視法は、凍結する前にクライオプローブを正しく配置するために使用されます。 クライオプローブの先端は、ドラムスティック(黒の矢印)の頭として表示されます。 この図の拡大版を表示するには、ここをクリックしてください。
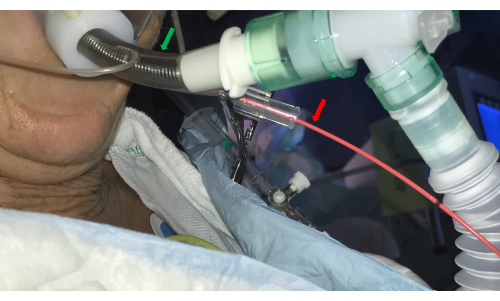
図3:気管内チューブ。 二重管腔気管内チューブ(緑の矢印)は、気管支鏡による気道へのアクセスを可能にし、同時にサイドチャネルにバルーンカテーテル(赤矢印)を導入することで出血を制御します。 この図の拡大版を表示するには、ここをクリックしてください。
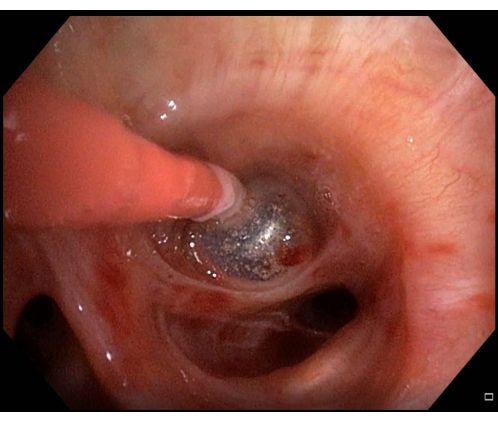
図4:バルーンカテーテルの膨張。 閉塞を確実にし、経気管支肺凍結生検を行った後にバルーンの遠位が葉の他の部分に分布する潜在的な出血を防ぐためのバルーンカテーテルの膨張。 この図の拡大版を表示するには、ここをクリックしてください。
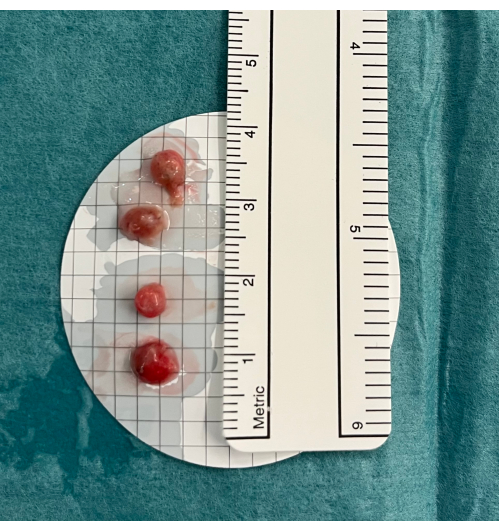
図5:生検。 経気管支肺凍結生検は、ホルムアルデヒドに固定する前に冷たい生理食塩水に入れられます。 この図の拡大版を表示するには、ここをクリックしてください。
4. TBLC後の手続き
- 各生検の後、気管支鏡をBSに再導入し、バルーンを収縮させて出血が発生するかどうかを観察します。
- 出血が観察された場合は、バルーンを再度膨らませます(図6)。バルーンが適切な位置にあり、BSをブロックしている場合は、出血が止まるまで数分待ってから、TBLC手順を続行します。
- ステップ4.1.1の後も出血が見られる場合は、バルーンの遠位に氷冷生理食塩水を設置します。
- ステップ4.1.2の後に出血が続いている場合。または、血液が他のBSにこぼれるバルーン失敗は、吸引、アドレナリンの有無にかかわらず気管支内投与される氷冷生理食塩水、およびトラネキサム酸の組み合わせを使用します。
- 凝固した血液が気道を塞いでいる場合は、クライオプローブを使用して、クライオプローブの先端を血栓に凍結し、ETTを介して引っ込めることにより、気道を再び開きます。
- 出血が制御されない場合は、ETTを非生検肺の換気と出血性肺の主気管支の閉塞の両方を可能にするETTに変更し、患者を集中治療室に移します。.
- TBLCの後に集束肺超音波(FLUS)を実行しますが、患者はまだ鎮静剤を投与して医原性気胸(PTX)の指標を特定します。
- FLUS 観察で PTX の可能性が高いことが示されている場合は、ピッグテール カテーテル (Fr 7-16) を使用した FLUS ガイド下胸膜ドレーンの挿入を検討してください。胸膜ドレナージは、FLUS が PTX のサイズが急速に増加していることを示し、特に患者の臨床状態が悪化している場合は適応となります。
- FLUS が小さな PTX を明らかにし、患者が臨床的に安定している場合は、抜管を 5 〜 10 分延期します。今後PTXサイズが進行した場合、または患者が臨床的に不安定になった場合は、抜管前に胸膜ドレーンを挿入してください。
- ステップ 4.2 またはステップ 4.2.2 の後に患者を抜管します PTX の兆候や PTX サイズの進行がなく、患者が臨床的に安定したままである場合は。
- TBLC後の回復室で患者を観察します。臨床的に安定した患者が帰宅する直前に、FLUSの繰り返しまたは胸部X線のいずれかによって、遅発性PTXが存在しないことを確認します。.
- 次のMDDでの生検の組織学的特徴の提示について、呼吸器科医、放射線科医、および病理学者と他の詳細と併せて話し合い、診断確率の高いILDサブタイプを結論付けます。
- 外来診療所でステップ4.5からのMDDの結論を患者に通知し、潜在的な治療とフォローアップを計画します。
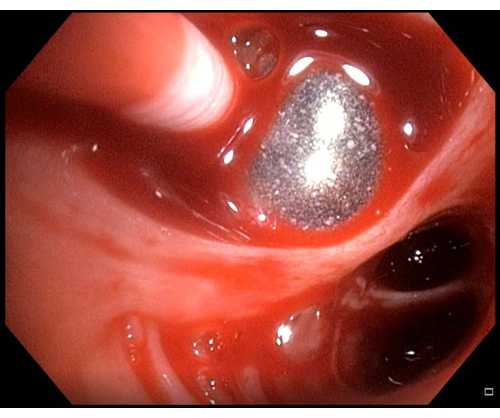
図6:軽度の出血。 経気管支肺凍結生検を行った後に出血が観察された場合、この場合は軽度の出血であるため、バルーンカテーテルを数分膨張させたままにしてから、収縮を再試行する必要があります。. この図の拡大版を表示するには、ここをクリックしてください。
5. PPL診断のためのR-EBUSおよびENBと組み合わせたTBLC
- 末梢肺病変の位置をナビゲートして確認します。
- 1.1 mmクライオプローブを、透視法の指導の下で拡張作業チャネルに挿入します。
- 凍結プローブの先端をラジアルEBUSプローブの位置に合わせます。
- 凍結ペダルを4〜8秒間踏みます。
- 凍結ペダルを押しながら、拡張された作業チャネルを介して凍結プローブを1回の素早い動きで引き込み、凍結を継続し、収縮中に生検が脱落するのを防ぎます。
- 気管支鏡と拡張された作業チャネルを所定の位置に保ち、クライオプローブを引っ込めます。
- 十分な数の生検が得られるまで、手順5.2〜5.4を繰り返します。
- 手順3.3および3.4で説明されているように生検を処理します。
結果
2 つの TBLC センターの著者からの観察に基づいて、柔軟な気管支鏡を使用した TBLC の段階的手順により、MDD が先行しているにもかかわらず、まだ診断されていない ILD サブタイプを持つ厳選されたデンマークの患者で組織学的サンプリングが可能になりました。これらのコホートからの詳細な観察結果は、最近発表された2つの研究23,25
ディスカッション
TBLCの適応症に関係なく、その診断特性は、手技の性能の質と手技を受けるための選択された基準に依存しています。これは、標準化されたTBLC手順を実行するために必要な能力を習得するために、正式な認定トレーニングプログラムを実施することを推奨していることを強調しています。現在、公式のTBLC教育は受けられていないという事実にもかかわらず、ILDのTBLC?...
開示事項
著者には、開示すべき利益相反はありません。
謝辞
著者は、この記事の図の作成に協力してくれたデンマークのオーデンセ大学病院の気管支鏡病棟の胸部外科および麻酔科の職員に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| "Chimney" for tube | |||
| CO2 gas bottle adapter | |||
| CO2 gas tank | Erbe | ||
| Endoscopy column | |||
| Endotracheal tube, size 7.5-8.5 mm | Erbe | ||
| Erbecryo pedal footswitch | Erbe | ||
| Erbecryo2 workstation | Erbe | ||
| Flexible bronchoscope | |||
| Flexible gas hose | Mediland | ||
| Flexible single use cryoprobe, OD 1.1 mm | Erbe | ||
| Flexible single use cryoprobe, OD 1.7 mm | Erbe | ||
| Flexible single use cryoprobe, OD 2.4 mm | |||
| Fluoroscope | |||
| Fogarty balloon catheter | |||
| Formalin glasses in closed system | |||
| NaCl incl. cold NaCl | |||
| Pean for fixating Fogarty balloon | |||
| Sterile disposable cup | |||
| Sterile suction tube | |||
| Sterile tweesers | |||
| Syringe for Fogarty balloon inflation/deflation | |||
| Table bag for flouroscope | |||
| Three way tap for Fogarty balloon syringe | |||
| Tracheal suction | |||
| Ultrasound machine | Erbe | ||
| Valve for biopsy chanel | |||
| Valve to suction duct |
参考文献
- Travis, W. D., et al. An official American Thoracic Society/European Respiratory Society statement: Update of the international multidisciplinary classification of the idiopathic interstitial pneumonias. American Journal of Respiratory and Critical Care Medicine. 188 (6), 733-748 (2013).
- Ruaro, B., et al. Editorial: Pulmonary fibrosis: One manifestation, various diseases. Frontiers in Pharmacology. 13, 1027332 (2022).
- Lamas, D. J., et al. Delayed access and survival in idiopathic pulmonary fibrosis: a cohort study. American Journal of Respiratory and Critical Care Medicine. 184 (7), 842-847 (2011).
- Tomassetti, S., Piciucchi, S., Tantalocco, P., Dubini, A., Poletti, V. The multidisciplinary approach in the diagnosis of idiopathic pulmonary fibrosis: a patient case-based review. European Respiratory Review. 24 (135), 69-77 (2015).
- Walsh, S. L. F., et al. Multicentre evaluation of multidisciplinary team meeting agreement on diagnosis in diffuse parenchymal lung disease: a case-cohort study. Lancet Respiratory Medicine. 4 (7), 557-565 (2016).
- Ryerson, C. J., et al. A standardized diagnostic ontology for fibrotic interstitial lung disease. An International Working Group perspective. American Journal of Respiratory and Critical Care Medicine. 196 (10), 1249-1254 (2017).
- Cottin, V., et al. Integrating clinical probability into the diagnostic approach to idiopathic pulmonary fibrosis: An International Working Group perspective. American Journal of Respiratory and Critical Care Medicine. 206 (3), 247-259 (2022).
- Rodrigues, I., et al. Diagnostic yield and safety of transbronchial lung cryobiopsy and surgical lung biopsy in interstitial lung diseases: a systematic review and meta-analysis. European Respiratory Review. 31 (166), 210280 (2022).
- Korevaar, D. A., et al. European Respiratory Society guidelines on transbronchial lung cryobiopsy in the diagnosis of interstitial lung diseases. European Respiratory Journal. 60 (5), 2200425 (2022).
- Colella, S., Haentschel, M., Shah, P., Poletti, V., Hetzel, J. Transbronchial lung cryobiopsy in interstitial lung diseases: best practice. Respiration. 95 (6), 383-391 (2018).
- Hetzel, J., et al. Transbronchial cryobiopsies for the diagnosis of diffuse parenchymal lung diseases: expert statement from the Cryobiopsy Working Group on safety and utility and a call for standardization of the procedure. Respiration. 95 (3), 188-200 (2018).
- Ravaglia, C., Poletti, V. Transbronchial lung cryobiopsy for the diagnosis of interstitial lung diseases. Current Opinion in Pulmonary Medicine. 28 (1), 9-16 (2022).
- Troy, L. K., et al. Diagnostic accuracy of transbronchial lung cryobiopsy for interstitial lung disease diagnosis (COLDICE): a prospective, comparative study. Lancet Respiratory Medicine. 8 (2), 171-181 (2020).
- Ruaro, B., et al. Transbronchial lung cryobiopsy and pulmonary fibrosis: A never-ending story. Heliyon. 9 (4), e14768 (2023).
- Lentz, R. J., Argento, A. C., Colby, T. V., Rickman, O. B., Maldonado, F. Transbronchial cryobiopsy for diffuse parenchymal lung disease: a state-of-the-art review of procedural techniques, current evidence, and future challenges. Journal of Thoracis Disease. 9 (7), 2186-2203 (2017).
- Maldonado, F., et al. Transbronchial cryobiopsy for the diagnosis of interstitial lung diseases: CHEST Guideline and Expert Panel Report. Chest. 157 (4), 1030-1042 (2020).
- Avasarala, S. K., Wells, A. U., Colby, T. V., Maldonado, F. Transbronchial cryobiopsy in interstitial lung diseases: State-of-the-art review for the interventional pulmonologist. Journal of Bronchology Interventional Pulmonology. 28 (1), 81-92 (2021).
- Abdelghani, R., Thakore, S., Kaphle, U., Lasky, J. A., Kheir, F. Radial Endobronchial Ultrasound-guided Transbronchial Cryobiopsy. Journal of Bronchology Interventional Pulmonology. 26 (4), 245-249 (2019).
- Inomata, M., et al. Utility of radial endobronchial ultrasonography combined with transbronchial lung cryobiopsy in patients with diffuse parenchymal lung diseases: a multicentre prospective study. BMJ Open Respiratory Research. 8 (1), e000826 (2021).
- Benn, B. S., Gmehlin, C. G., Kurman, J. S., Doan, J. Does transbronchial lung cryobiopsy improve diagnostic yield of digital tomosynthesis-assisted electromagnetic navigation guided bronchoscopic biopsy of pulmonary nodules? A pilot study. Respiratory Medicine. 202, 106966 (2022).
- Ankudavicius, V., Miliauskas, S., Poskiene, L., Vajauskas, D., Zemaitis, M. Diagnostic yield of transbronchial cryobiopsy guided by radial endobronchial ultrasound and fluoroscopy in the radiologically suspected lung cancer: A single institution prospective study. Cancers. 14 (6), 1563 (2022).
- Ravaglia, C., et al. Transbronchial lung cryobiopsy in diffuse parenchymal lung disease: Comparison between biopsy from 1 segment and biopsy from 2 segments - diagnostic yield and complications. Respiration. 93 (4), 285-292 (2017).
- Davidsen, J. R., Skov, I. R., Louw, I. G., Laursen, C. B. Implementation of transbronchial lung cryobiopsy in a tertiary referral center for interstitial lung diseases: a cohort study on diagnostic yield, complications, and learning curves. BMC Pulmonary Medicine. 21 (1), 67 (2021).
- Laursen, C. B., et al. Lung ultrasound assessment for pneumothorax following transbronchial lung cryobiopsy. ERJ Open Research. 7 (3), 00045-2021 (2021).
- Kronborg-White, S., et al. Integration of cryobiopsies for interstitial lung disease diagnosis is a valid and safe diagnostic strategy-experiences based on 250 biopsy procedures. Journal of Thoracic Disease. 13 (3), 1455-1465 (2021).
- Barisione, E., et al. Competence in transbronchial cryobiopsy. Panminerva Medica. 61 (3), 290-297 (2019).
- Raghu, G., et al. Idiopathic pulmonary fibrosis (an update) and progressive pulmonary fibrosis in adults: An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline. American Journal of Respiratory and Critical Care Medicine. 205 (9), e18-e47 (2022).
- Ravaglia, C., et al. Diagnostic yield and risk/benefit analysis of trans-bronchial lung cryobiopsy in diffuse parenchymal lung diseases: a large cohort of 699 patients. BMC Pulmonary Medicine. 19 (1), 16 (2019).
- Hernandez-Gonzalez, F., et al. Cryobiopsy in the diagnosis of diffuse interstitial lung disease: yield and cost-effectiveness analysis. Archivos de Bronconeumología. 51 (6), 261-267 (2015).
- Cooley, J., et al. Safety of performing transbronchial lung cryobiopsy on hospitalized patients with interstitial lung disease. Respiratory Medicine. 140, 71-76 (2018).
- Hetzel, J., et al. Transbronchial cryobiopsy increases diagnostic confidence in interstitial lung disease: a prospective multicenter trial. European Respiratory Journal. 56 (6), 1901520 (2020).
- Kheir, F., et al. Transbronchial lung cryobiopsy in patients with interstitial lung disease: a systematic review. Annals of the American Thoracic Society. 19 (7), 1193-1202 (2022).
- Walscher, J., et al. Transbronchial cryobiopsies for diagnosing interstitial lung disease: real-life experience from a tertiary referral center for interstitial lung disease. Respiration. 97 (4), 348-354 (2019).
- Gnass, M., et al. Transbronchial lung cryobiopsy guided by radial mini-probe endobronchial ultrasound in interstitial lung diseases - a multicenter prospective study. Advances in Respiratory Medicine. 88 (2), 123-128 (2020).
- Ma, X., et al. Global and regional burden of interstitial lung disease and pulmonary sarcoidosis from 1990 to 2019: results from the Global Burden of Disease study 2019. Thorax. 77 (6), 596-605 (2022).
- Kronborg-White, S., et al. A pilot study on the use of the super dimension navigation system for optimal cryobiopsy location in interstitial lung disease diagnostics. Pulmonology. 29 (2), 119-123 (2021).
- Wijmans, L., et al. Confocal laser endomicroscopy as a guidance tool for transbronchial lung cryobiopsies in interstitial lung disorder. Respiration. 97 (3), 259-263 (2019).
- Kheir, F., et al. Using bronchoscopic lung cryobiopsy and a genomic classifier in the multidisciplinary diagnosis of diffuse interstitial lung diseases. Chest. 158 (5), 2015-2025 (2020).
- Renzoni, E. A., Poletti, V., Mackintosh, J. A. Disease pathology in fibrotic interstitial lung disease: is it all about usual interstitial pneumonia. Lancet. 398 (10309), 1437-1449 (2021).
- Chaudhary, S., et al. Interstitial lung disease progression after genomic usual interstitial pneumonia testing. European Respiratory Journal. 61 (4), 2201245 (2023).
- Raghu, G., et al. Use of a molecular classifier to identify usual interstitial pneumonia in conventional transbronchial lung biopsy samples: a prospective validation study. Lancet Respiratory Medicine. 7 (6), 487-496 (2019).
- Kheir, F., et al. Use of a genomic classifier in patients with interstitial lung disease: a systematic review and meta-analysis. Annals of American Thoracic Society. 19 (5), 827-832 (2022).
- Glenn, L. M., Troy, L. K., Corte, T. J. Novel diagnostic techniques in interstitial lung disease. Frontiers in Medicine. 10, 1174443 (2023).
- Kim, S. H., et al. The additive impact of transbronchial cryobiopsy using a 1.1-mm diameter cryoprobe on conventional biopsy for peripheral lung nodules. Cancer Research and Treatment. 55 (2), 506-512 (2023).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved