生細胞およびモデル膜における原形質膜修復研究のための熱プラズモニックアプローチ
要約
サーモプラズモニック穿刺法は、共焦点顕微鏡、光ピンセット、金ナノ粒子を統合して、細胞や巨大な単層小胞の原形質膜修復中のタンパク質応答を研究します。この技術により、迅速かつ局所的な膜穿刺が可能になり、複雑な原形質膜修復機構における重要なタンパク質とその機能的役割を同定することができます。
要約
細胞膜は細胞の生存に不可欠であり、細胞はライフサイクル全体を通じて損傷を経験するため、その完全性を確保することが不可欠です。膜の損傷を防ぐために、細胞は効率的な原形質膜修復メカニズムを発達させてきました。これらの修復メカニズムは、共焦点顕微鏡とナノスケールのサーモプラズモニクスを組み合わせて、生細胞や膜モデルシステムの表面修復に関与するアネキシンなどの重要なタンパク質の役割を同定および調査することで研究できます。
穿刺法は、ナノ粒子の照射時にレーザーを用いて局所的な加熱を誘導します。近赤外光の使用により、生体試料の光毒性が最小限に抑えられますが、吸収の大部分は近赤外共鳴プラズモニックナノ粒子で行われます。この熱プラズモニック法は、小胞や細胞融合の研究を通じて、細胞内メカニズムや細胞応答の理解を深めるための光熱研究や生物物理学的研究に利用されています。このアプローチは、機械的、化学的、または光学的に誘発された損傷など、膜破壊の既存の方法を補完することが示されており、非常に局所的な損傷を与えることによって高レベルの制御を提供します。損傷の程度は球状ナノ粒子の近傍に限定され、異なる波長を使用するパルスレーザーとは対照的に、ビーム経路に沿って有害な損傷は発生しません。ナノバブルの形成などの一定の制限はあるものの、サーモプラズモニック法は、細胞の生存率を損なうことなく、ほぼ天然の環境で細胞膜修復における細胞応答を調査するためのユニークなツールを提供します。
共焦点顕微鏡と統合すると、穿刺法は、モデル膜システムにおける膜ダイナミクスの機構的理解や、タンパク質の動員や生物物理学的機能など、膜損傷に対するタンパク質応答に関する定量的な情報を提供することができます。全体として、この方法を縮小モデルシステムに適用することで、生細胞内の複雑な原形質膜修復機構の理解を深めることができます。
概要
細胞膜は、物理的な障壁とシグナル伝達プラットフォームの両方として機能し、細胞の生存に不可欠です1。細胞膜(PM)は、細胞周期全体を通して、機械的2,3,4,5や化学的6ストレスによる損傷などの損傷を受けます。膜の完全性を維持し、細胞の生存を確実にするために、細胞は堅牢な原形質膜修復(PMR)メカニズムを開発しました。これらのメカニズムは、細胞骨格の再編成、膜融合、膜置換戦略7、8、9、10、11などのさまざまな戦略に依存しており、これらはすべて特定のタンパク質の動員に依存しています。特に、アネキシンタンパク質ファミリーのメンバーは、PMR 1,9,12,13,14,15,16のプロセスに関連する重要なタンパク質として同定されています。PM損傷後、細胞はカルシウムイオン(Ca2+)の流入を経験し、細胞の生存に差し迫った脅威をもたらします17。Ca2+の流入に応答して、主に細胞質に位置するアネキシンタンパク質は、PMR戦略の一部として損傷した原形質膜の内側のリーフレットに結合する18。アネキシンA2(ANXA2)は、ジスフェリン欠乏型筋ジストロフィーのPMRと関連したアネキシンファミリーの最初のメンバーの1つであり、損傷部位近くのPMに細胞内小胞を融合させることにより修復を媒介することが示唆されました5,19,20,21。その後、いくつかの機能がアネキシン22に起因し、PMRにおけるそれらの役割は過去20年間でますます注目を集めています。しかし、PMRにおけるアネキシンの正確な役割は完全には理解されていません15,18,21,22。
本稿では、共焦点顕微鏡、光ピンセット、金ナノ粒子(AuNP)を組み合わせて、タンパク質-膜相互作用と膜ダイナミクスを制御された高度に局在的に調べる方法を提案します。この方法により、膜損傷とCa2+ 流入に応答するタンパク質、脂質、および低分子の相互作用を定量的に研究できます。膜修復のプロセスに関与する構成要素の複雑さと多様性にもかかわらず、原形質膜を模倣する単純化された膜システムは、膜のダイナミクスと膜破壊に対するアネキシンタンパク質の応答のより深い機構的理解を得るために採用されてきました16。巨大単層脂質小胞(GUV)は、特定の脂質組成を持つモデル膜システムとして選択されました。GUVは、Weinbergerらによって記述されているように、ゲルアシスト水和法、特にポリビニルアルコールゲル水和法を使用して生成され23、これにより、アネキシンのGUVへの効率的なカプセル化が可能になりました。
金属ナノ粒子(NP)への近赤外線(NIR)レーザー照射の利用は、NPの著しい加熱を誘発し、生物医学的用途で利用される局所的な熱源を確立するための効果的な方法となる24。この分析法は当初、2Dおよび3Dの生体模倣アッセイで単一のAuNPの周囲の温度を直接測定するために使用されていました。これらのアッセイ25,26では、プラズモニックナノ粒子を支持脂質二重層に照射するか、局所加熱時に局所的な熱相転移を起こすGUVの近くに光学的にトラップし、粒子周辺の正確な温度プロファイルの定量化と制御を可能にしました。この基準温度プロファイルは、生体試料の調査や操作に利用されています。この方法のさらなる進歩により、膜27のナノスケール細孔の誘導が促進され、小胞と細胞融合が可能になった28,29。他の研究では、新しいハイブリッド小胞を作成することにより、GUVs29および膜貫通タンパク質30の末梢膜タンパク質の挙動を調査し、細胞応答または遺伝子発現を制御および研究するために細胞特異的な薬物送達も調査されています28,29,31,32,33。最近、この方法は膜損傷に対するタンパク質応答を調査するために使用されています32,34,35。
細胞の応答と膜修復を調べるために、原形質膜を破壊する方法はいくつか存在します。これらには、マイクロニードルの穿刺、マイクロビーズの振とう、および細胞の掻き取りが含まれ、これらはすべて細胞膜を機械的に破壊する可能性があります14,36,37。化学的に誘発された損傷は、脂質二重層を不安定にし、原形質膜を横切って膜孔を生成する界面活性剤5,38または細菌毒素39,40を添加することによって達成することができる。さらに、連続波およびパルスレーザーによる光学的傷害は、アネキシンタンパク質5,14,21,41などのPMR成分をプラズモニックナノ粒子42,43,44,45と組み合わせて研究するために使用されています.高出力パルスレーザーの効率にもかかわらず、ビーム経路に沿って細胞の内部に重大な損傷や損傷を引き起こす可能性があります。さらに、パルスレーザー照射時に生体物質に起こる詳細な変化や、それが明確に定義された細孔を作るかどうかは、さらに調査する必要があります。本稿では、サーモプラズモニクスを用いて、内部構造に重大な害を及ぼすことなく、制御された方法でPMにナノスコピックな穴を誘導する別の方法を紹介します34,35。これは、プラズモニックNPを高度に集束された近赤外レーザーに曝露することによって達成され、その結果、200°Cを超える温度に容易に達する可能性のある非常に局所的な温度上昇が発生し、小さなナノスコピック爆発につながる可能性があります25,46,47。このプロセスは、レーザー強度、ならびにNP48のサイズ、形状、および組成を調整することによって制御することができる。この技術を採用することで、研究者は生細胞におけるPM修復におけるタンパク質の役割を探ることができ、細胞の生存率を損なうことなく、膜修復におけるアネキシンタンパク質の関与に関する未解決の問題のいくつかに対処するのに役立つ可能性があります。
プラズモニックナノ粒子の光学的捕捉は、以前の研究によって十分に確立されています25,49,50,51,52;しかし、ナノ粒子53,54,55の熱プラズモニック特性に関する追加の洞察は、補足資料(補足ファイル1)で得ることができる。サーモプラズモニック法は、細胞の応答と修復メカニズムを研究する目的で、PMにナノスコープの穴を開けるために使用できます。より正確には、図1AおよびBに示すように、膜に近接したAuNPの光学加熱によって穿刺を達成できます。この局所的な穿刺により、カルシウムセンサーによって検証されたCa2+の流入が可能になり、PMR機構が作動します。生細胞実験では、直径200 nmのAuNPを細胞下の表面に固定し、共焦点顕微鏡でPMRにおけるANXA2の役割をモニターしました。波長1064nmの近赤外レーザー(図1A、B)は、AuNPを照射し、そのプラズモニック特性(図1C)を利用して、細胞自体への損傷を最小限に抑えながら、生物学的透明ウィンドウ49で実質的な局所加熱(図1D)をもたらします。図1Eに示すように、AuNPを取り巻く高温領域は、NPの半径に対応する距離で30〜40%急速に減少し、3次元すべてで非常に限定された損傷を可能にします。
補足ファイル 1. このファイルをダウンロードするには、ここをクリックしてください。
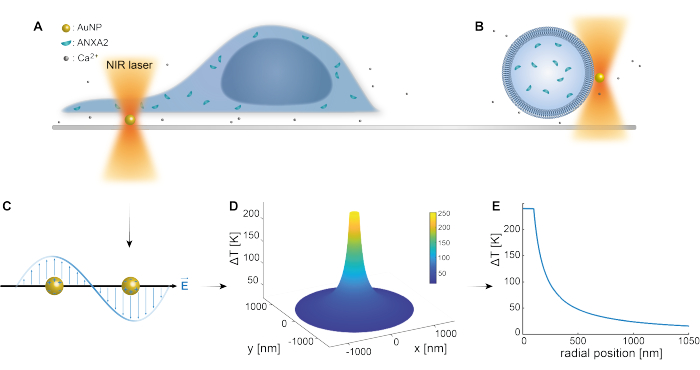
図1:実験方法の概略図。 (A)ANXAをトランスフェクトした細胞を表面の固定化金ナノ粒子(AuNP)の上に配置、または(B)ANXAをカプセル化した巨大単層小胞(GUV)をAuNPを含む培地に懸濁させる。(C)単一のAuNPが近赤外光トラップによって照射され、入射電磁場と伝導電子との相互作用により、NP内の電子の集団振動が引き起こされます。(D)このプロセスにより、非常に閉じ込められた温度が有意に上昇します。NP表面の温度を推定するために、ミー理論を用い、直径200 nm、レーザー強度I=6.36 x 108 W/cm2のAuNPについて(E)温度プロファイルを算出した。この図の拡大版をご覧になるには、ここをクリックしてください。
細胞膜への熱的影響を最小限に抑えるために、AuNPは~1秒間しか照射されません。これにより、一過性で局所的な加熱が起こり、通常、展開に時間がかかるタンパク質への損傷が軽減されます。膜穿刺時には、アネキシンタンパク質がほんの一瞬で動員され、数秒以内に、損傷部位の周囲にアネキシンリング状の足場が形成されます(図2)。このアプローチは、修復プロセスの完全なスキームに光を当てるために、生細胞とモデル膜の両方におけるANXA5の関与を調査するためにも適用されています16 。主な焦点は、さまざまなアネキシンタンパク質の相関的な動員でしたが、修復メカニズムの生物物理学的側面はまだ解明されていません。
提案手法を本格的に実装するためには、共焦点顕微鏡、光ピンセット、金属ナノ粒子の3つの主要コンポーネントが必要です。光ピンセットはAuNPを捕捉するために使用され、その構築はNeumanらによって概説された手順に従うことによって達成することができる49。しかし、光ピンセットの構築が難しすぎる場合は、細胞の下に固定されたAuNPを照射するために、焦点を絞った近赤外レーザーを使用することができます。このプロトコルでは球状のAuNPが選択されたが、吸収スペクトルを調整できるさまざまなプラズモニック粒子を利用して、近赤外領域内の高度に局在した温度勾配を達成することもできた48。
蛍光イメージングは、蛍光標識されたタンパク質の役割を観察するために必要であり、したがって、全反射顕微鏡(TIRF)56 は共焦点イメージングの代替として検討できます。しかし、この手法では表面イメージングしかできず、モデル膜小胞実験とは互換性がありません。したがって、光ピンセットと共焦点顕微鏡の両方が、ナノ粒子の正確な局在化と細胞損傷の周囲の局所的な詳細な調査に不可欠です。回折限界レーザー焦点でナノ粒子を効果的に照射するためには、ナノ粒子を可視化する必要があります。これは、ライカの共焦点顕微鏡の標準的なイメージング機能である反射顕微鏡によって最適に実現できます。ただし、反射または散乱イメージングが利用できない場合は、効率の低い蛍光AuNP標識などの代替方法を検討できます。
要約すると、この研究で提示された高度に制御可能で局在的なサーモプラズモニック法は、生細胞の細胞応答とPM修復メカニズムに関与する分子成分を調査するための優れたプラットフォームとして機能する可能性があります。このアプローチは、PM損傷時のタンパク質応答の研究に加えて、局所的な小胞の穿刺にも利用することができ、それによってタンパク質-タンパク質およびタンパク質-膜ダイナミクスの両方におけるタンパク質応答の調査を可能にします。さらに、この方法により、膜が破壊されたときのタンパク質、脂質、および低分子間の相互作用を定量的に分析できます。まとめると、これらの進歩は、複雑で複雑な原形質膜修復装置に関する未解決の問題のいくつかに光を当てる可能性を秘めています。
プロトコル
1. 細胞膜穿刺の準備
- 細胞播種(1日目)
- ヒト胚性腎臓(HEK293T)細胞を培地中で、5%CO2 加湿器インキュベーターで37°Cの培養液中で、70%のコンフルエントに達するまで培養します。
- 500 μLのトリプシンを使用して細胞を表面から剥離し、200,000 HEK293T細胞をカウントし、総容量3 mLの培地を入れた培養皿に播種します。細胞を37°Cの5%CO2 加湿器インキュベーターで24時間インキュベートします。
注:ディッシュの中心での細胞のクラスタリングを防ぐには、トランスフェクション効率を低下させる可能性があるため、細胞を均等に広げ、ディッシュを渦巻かせないようにしてください。
- 細胞トランスフェクション(2日目)
注:トランスフェクションした細胞は、トランスフェクション後48時間まで使用できます。- 使用前に、目的のプラスミドとトランスフェクション試薬を5秒間ピペットでつなぎます。
- 滅菌済み 2 mL チューブ中で、500 μL の還元血清培地、5 μL のトランスフェクション試薬(プラスミドの 4 倍)、プラスミド 1.25 μL(1 μg/μL)を特定の順序で混合します。
注:膜破裂時のカルシウム流入を調べるには、同じ手順に従いますが、膜結合型カルシウムセンサープローブGCaMP6-CAAX(1 μg/μL)を使用します。 - トランスフェクション混合物を静かに、しかし完全にピペッティングし、室温(RT)で30分間インキュベートしてから、細胞に滴下します。
- トランスフェクション混合物を添加する前に、培地を培養皿から取り出し、2 mLのリン酸緩衝生理食塩水で細胞を静かに洗浄し、2000 μLの還元血清培地を皿に加えます。
- 5% CO2 加湿器インキュベーター中で37°Cのトランスフェクション混合物とともに細胞を2時間45分間インキュベートしてから、培地を3 mLの培地に交換します。
- 金ナノ粒子(AuNP)溶液の調製(2日目)
- 200 nm AuNP ストック溶液をレベル 10 で 10 秒間ボルテックスし(装置の詳細な仕様については 、材料表 を参照)、5 分間超音波処理し(最大振幅)、再度 10 秒間ボルテックスします。
- 150 μL の AuNP と 850 μL の蒸留水を混合して、総量 1 mL にします。
注:希釈したAuNP溶液は冷蔵庫で保存し、最大1か月間再利用できます。
- 実験皿の準備(2日目)
- マイクロウェルディッシュを150 μLの0.01%-0.1%細胞接着溶液でコーティングし、室温で15分間インキュベートします。
- ガラス表面を500μLの蒸留水で2回洗浄し、~10分間風乾させます。
- 80 μLのAuNP溶液を乾燥表面に滴下します。
注:AuNP凝集物を最小限に抑えるために、希釈したAuNP溶液をコーティングされたガラス表面に添加する前に、ボルテックス(10秒)、超音波処理(5分)、およびボルテックス(10秒)します。 - ~10分待ってから、1.5 mLの培地を導入します。皿を37°Cで一晩インキュベートします。
- 実験室の準備(3日目)
注:実験チャンバーは、3日目または4日目のいずれかに準備できます。ただし、以下の準備は実験当日に行うようにしてください。- 培養皿内の細胞から培地を取り出し、2 mLのリン酸緩衝生理食塩水で細胞を洗浄します。
注意: この手順は、後続の手順を妨げる可能性のある残留媒体や破片を取り除くために不可欠です。 - 500 μLの酵素ベースの細胞剥離溶液をウェルに加え、細胞が培養皿から剥離するまで1〜3分間インキュベートします。
- 1.5 mLの新鮮な培地を加え、細胞溶液をピペットで移して均質な細胞溶液を得ることで、細胞クラスターの可能性を最小限に抑えます。
- 実験用マイクロウェルのAuNPから培地を慎重に除去します。
- 細胞溶液(2 mL)をマイクロウェルに加え、実験を行う前に少なくとも5時間インキュベートします。
注:最適な実験条件を得るには、チャンバーの中央に細胞が集まる可能性があるため、チャンバーを旋回させないでください。
- 培養皿内の細胞から培地を取り出し、2 mLのリン酸緩衝生理食塩水で細胞を洗浄します。
2. 細胞膜穿刺実験
- 実験の光学的設定
- 共焦点走査型顕微鏡と1064nmのトラッピングレーザー57を組み合わせて実験を行う。
- 開口数(NA)1.2の63倍の水浸対物レンズを使用して、焦点面での光学トラッピングを実行します。
- 焦点がエアリーディスクのサイズであり、照射レーザーの焦点ビーム幅が半径が~540nmであると仮定します。
- 面積あたりのレーザー出力(W / cm2)を計算して、レーザー出力(P)を対応するレーザー強度(I)に変換します。
- 光電子増倍管で検出した複数の蛍光シグナルと、散乱シグナルによる金属NPの同時検出を、音響光ビームスプリッター(AOBS)を用いて可視化します。
注:すべての共焦点システムに、金属NPの反射イメージングを可能にするAOBSが装備されているわけではありません。ここでは、他の形式の検出を実装するか、セルの下の領域でNIRレーザーの連続スキャンを試みることができます。 - 実験セッション中は、細胞、分子蛍光プローブ、および金ナノ粒子を含むガラス底のオープンチャンバーを顕微鏡に取り付けます。
- 圧電ステージに取り付けられたサンプルを並進させることにより、細胞に対してトラップを移動させ、ナノメートル精度の横方向の動きを可能にします16。
注意: オプティカルトラップは静止したままです。
- 細胞膜穿刺の実験設定
- アネキシンプラスミドと蛍光タンパク質を結合させたHEK293T細胞を、ガラス表面に固定化された単離されたAuNPの上に置きます(図1A)。
- GFP蛍光シグナルの可視化にはアルゴン488nmレーザーを、走査型共焦点顕微鏡でのAuNP反射の観察にはHeNe 633nmレーザーを使用します。
- 1064 nmの近赤外レーザーで動作する光ピンセットを使用して、単一のAuNPを~1秒間照射し、原形質膜を破壊する大幅な局所的な温度上昇を誘発します。
- 集光した粒子に200〜295mWの照射を施すと、実質的に温度が上昇します。
注意: 光学系内では電力が大幅に低下し、焦点でのレーザー出力は、特定の設定に応じて、記載されているミリワットの約20%に達します。比強度(W/cm2で測定)は、システムの正確なアライメント、特に焦点サイズによって異なります。さらに、ガラスの熱伝導はセルや水の熱伝導よりも高いため、原形質膜に放出される熱量がわずかに減少します48,58。 - 近赤外レーザーの焦点スポットの局在を適切に校正することにより、効果的で局所的なPM損傷とその後のタンパク質修復応答を達成します。これは、同じイメージング媒体に懸濁した単一のAuNPを捕捉し、照射前に選択したAuNPに焦点が合っていることを確認することによって達成されます。
注:ナノ粒子は、共焦点顕微鏡で観察した場合に、その散乱信号が最も鋭く見える場合、つまり、粒子の周囲に明確なエッジとハローがない場合に焦点が合っていると見なされます(図2C(ii))。
- 細胞とAuNPの密度条件
- 細胞膜の重なりを防ぐために、細胞クラスターではなく単一細胞を選択します。
注:細胞は表面に接着し、平坦な形態(補足図1)を示し、核膜の損傷を防ぎながら細胞周辺に穴を開けることができます(補足図2)。 - プロトコルに従って、または細胞が沈殿して平らになるまで細胞をインキュベートし、AuNP細胞の取り込みを防ぎます。過度のインキュベーション時間を避け、PEG化AuNPを使用してAuNPエンドサイトーシスの可能性を低減します。
- 固定化されたAuNPが単一の粒子として存在し、凝集を防ぐために互いに十分な間隔を空けて存在することを確認します。凝集体は温度勾配の大幅な増加につながり、その結果、温度が上昇し、細胞のかなりの部分が破壊される可能性があります。
- 細胞の健康を維持するために、1〜2時間ごとにサンプルを交換してください。
注:長時間の曝露は細胞の健康状態の悪化につながり、膜修復の観点から損傷に正確に反応する能力を損なう可能性があります。この細胞の健康状態の低下は、通常、細胞がより球状で硬く見えるため、細胞の形状の変化によって観察され、最終的には細胞死に達します。
- 細胞膜の重なりを防ぐために、細胞クラスターではなく単一細胞を選択します。
補足情報。このファイルをダウンロードするには、ここをクリックしてください。
3. 巨大単層小胞(GUV)の調製
- 脂質混合物の調製
- 1,2-ジオレオイル-sn-グリセロ-3-ホスホコリン(DOPC)と1,2-ジオレオイル-sn-グリセロ-3-ホスホ-L-セリン(DOPS)脂質を4:1のモル比で組み合わせてGUV脂質組成物を作成します( 表1を参照)。実験の必要性に応じて脂質ストックを1.5 mLガラスバイアルに分注し、-20°Cで保存します。
注:脂質を長期間保存し、不飽和脂質の酸化を防ぐために、分注されたバイアル内の空気をアルゴンと交換してください。 - 脂質を混合する前に、50 μLおよび500 μLのガラスまたは金属シリンジをクロロホルムで5回完全に洗浄し、クロロホルムに溶解した脂質の汚染物質がないことを確認します。
注意: クロロホルムは毒性があるため、ドラフト内で取り扱ってください。- 計算された量のクロロホルムを清潔な琥珀色のガラスバイアルに移し、続いて指定された量の各脂質を移します( 表1を参照)。
注:脂質ストック間のクロスコンタミネーションを避けるため、シリンジは必ずクロロホルムで洗浄してください。 - 最後に、メンブレン色素を添加し、ピペッティングで脂質を完全に混合します。調製した脂質混合物を-20°Cで保存し、さらに使用してください。混合物は、かなりの脂質損傷なしに2〜3週間生存可能です。
注意: 混合は、金属またはガラスのシリンジで行う必要があります。脂質が冷凍庫から出るときは、常に氷の上に保管してください。
- 計算された量のクロロホルムを清潔な琥珀色のガラスバイアルに移し、続いて指定された量の各脂質を移します( 表1を参照)。
- 1,2-ジオレオイル-sn-グリセロ-3-ホスホコリン(DOPC)と1,2-ジオレオイル-sn-グリセロ-3-ホスホ-L-セリン(DOPS)脂質を4:1のモル比で組み合わせてGUV脂質組成物を作成します( 表1を参照)。実験の必要性に応じて脂質ストックを1.5 mLガラスバイアルに分注し、-20°Cで保存します。
- ポリビニルアルコール(PVA)ゲルの調製
- Weinberger et al.23によって記述されたゲルアシスト水和法を使用して、わずかな変更を加えて GUV を調製します。
- 50 mM スクロース、25 mM NaCl、25 mM Tris(pH 7.4)を含むバッファー100 mLにPVA5 gを溶解して、PVAゲルを調製します。
- PVA溶液を85°Cに加熱し、透明になるまで攪拌します。RTまで冷まし、冷蔵庫に保管してさらに使用してください。
注:PVAは緩衝液に適切に溶解していないため、85°Cまで加熱する必要があります。
- Weinberger et al.23によって記述されたゲルアシスト水和法を使用して、わずかな変更を加えて GUV を調製します。
- スライドガラスの作製
- スライドガラスをエタノールで洗浄し、風乾させます。次に、スライドをエアプラズマクリーナーで処理して、ガラス表面に残っている汚染を取り除きます。
- PVAコーティングされたスライドガラスの作製
- PVAゲル(5%)を60°Cで30分間温めると、流動性が高まります。90 μLの温かいPVAをスライドガラスに塗布し、均一に広げ、50°Cの加熱キャビネットで50分間乾燥させます。
- PVAスライドガラスの準備ができたら、ガラスまたは金属のシリンジを使用して調製した脂質混合物30 μLを加え、針の端を使用して薄膜に広げます。
- 穏やかな窒素圧力下でクロロホルム含有量を蒸発させて、脂質混合物を乾燥させます。さらに、スライドガラスを真空下で1.5〜2時間乾燥させます。
- チャンバー内でのGUVの栽培
- 以前に公開されたレポート59と同様の設計の社内チャンバーを、準備したスライドガラスを使用して組み立てます。
- 別の 2 mL チューブで、目的の組換えタンパク質(この場合は ANXA5 または ANXA4)を、80 mM スクロース、70 mM NaCl、および 25 mM Tris-HCl(pH 7.4)からなる増殖バッファー(GB)で最終濃度 500 nM に希釈します。
- 希釈した組換えタンパク質溶液400 μLをチャンバーに加えます。チャンバーを室温で1時間インキュベートし、堆積した脂質コートからGUVを増殖させます。タンパク質を除いた同じバッファーをネガティブコントロールとして使用します。
注:バッファーの蒸発を防ぐために、チャンバーをポリオレフィンフィルムで包んでください。 - チャンバー内容物 400 μL を 2 mL チューブに移して GUV を回収します。
- 採取した溶液に 55 mM グルコース、70 mM NaCl、50 mM Tris-HCl(pH 7.4)を含む観察バッファー(OB)1 mL を添加して、GUV の外側にカプセル化されていないタンパク質を除去します。次に、溶液を600 x g で13°Cで10分間遠心分離します。
- 遠心分離後、上清1 mLを等量の観察バッファーと交換します。GUVを穏やかなピペッティングで分散させ、GUV実験で使用するまで冷蔵庫で保管してください。
4. GUV穿刺実験
- チャンバーの準備
- 実験には35mmのガラス底のディッシュを使用します。GUVが表面に付着して破裂するのを防ぐために、表面にβ-カゼイン(5 mg / mL)を15〜30分間コーティングします。
- β-カゼイン溶液の場合、タンパク質 0.1 g を 20 mM Tris(PH 7.5)および 100 mM NaCl の 20 mL バッファーに溶解します。タンパク質溶液をろ過し、小さなバイアルに分注し、さらに使用するために凍結します。
- チャンバーを観察バッファーで2回洗浄し、表面に余分な遊離βカゼインを除去し、室温で乾燥させます。
- 別の2 mLチューブで、採取したGUVをOBと混合し、CaCl2 を所望の最終濃度(この場合は200 μM)になるように混合物に添加します。
- 150 nmの金ナノシェル(AuN)を1:100の比率で混合物に導入します。最終混合物は、250 μL の GUV、225 μL の OB、20 μL の CaCl2 (5 mM)、および 5 μL の指定された AuN で構成されます。
- 実験には35mmのガラス底のディッシュを使用します。GUVが表面に付着して破裂するのを防ぐために、表面にβ-カゼイン(5 mg / mL)を15〜30分間コーティングします。
- 実験装置
- 混合物をチャンバーに移し、顕微鏡ステージに取り付けます。チャンバーのサイズに応じて、混合物全体または混合物の一部を追加します。
注:カルシウムイオンはメンブレンを通過し、メンブレンの内部リーフレットへのアネキシンの結合を媒介するため、タイミングが重要です。 - 細胞穿刺実験に使用したのと同じ光学セットアップを採用します。
- 光ピンセットを使用して、~125 mWのレーザー出力を印加することにより、GUVに近接またはGUVの表面に個々のAuNSを捕捉します。
- 続いて、レーザー出力を~300mWに増やします。これにより、非常に局所的な温度上昇が発生し、標的部位のメンブレンが破壊されて穴が開けられます。
注:AuNSは、固体AuNPと比較してサイズを小さく保ちながら、より高い過渡温度上昇を生成することができるため、GUV実験に適しています。
- 混合物をチャンバーに移し、顕微鏡ステージに取り付けます。チャンバーのサイズに応じて、混合物全体または混合物の一部を追加します。
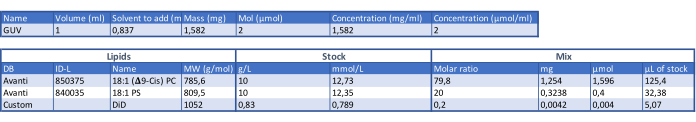
表1:GUV組成を決定するための表。この表をダウンロードするには、ここをクリックしてください。
5. 細胞穿刺実験におけるANXA応答の測定とデータ解析
- MATLAB を使用してイメージを解析し、Mie の式60、61 に基づいて AuNP 温度プロファイル (図 1D、E) を計算してプロットします。
- さらに、FIJI ImageJ分布62,63を使用してすべての共焦点画像を処理します。
- ANXAリング半径の計算
- 膜損傷分析の前に、生データから穿刺領域を含む関心領域を切り取ります。
- ANXAリングの中心とその外周を手動でマークすることにより、各画像を処理するための社内MATLABワークフローを採用します。
- これらのマーキングを使用して、関心領域の処理制限を設定します。
注:その後、領域は設定された制限内で放射状に処理され、中心から特定の距離での蛍光強度は、同じ中心距離で全円の平均になります。この番号は、半径ステップごとに格納されます。 - このワークフローを使用して、スキャン範囲全体にわたって平均化された強度を1次元ガウス曲線に当てはめ、図3Aに示すように、RextとRintにそれぞれ対応する最大値(R、p)と半値全幅(FWHM)を特定します。
- これらのマーキングを使用して、関心領域の処理制限を設定します。
- 最後に、ANXA リングの半径は、MATLAB ワークフローによって生成されたプロットによって与えられるリングの中心から Rext までの距離によって決定されます。
- 3次元ANXAリング半径の計算
- ステップ 5.1 と同じ MATLAB 解析ワークフローを使用して、z 方向の ANXA リング半径の変化を追跡します。このワークフローを、 図3C、Eに示すように、膜巻線を横切るいくつかの共焦点zセクションに適用します。
- 図3Fに示すように、z断面の半径の変化に基づいて、各創傷の傾きを計算します。
- ANXAリング半径の時間発展
- 同様に、ステップ 5.1 の MATLAB 解析ワークフローを使用して、熱プラズモニック膜穿刺後の ANXA リングの ANXA リングの進化を追跡します。連続する時点を解析して、 図3D、G、Hに示すように、時間の経過に伴う変化を監視します。
代表的な結果
本研究では、サーモプラズモニック法を使用して、原形質膜破壊に対するアネキシンタンパク質応答を調査します。ただし、膜損傷時にリクルートされる可能性のあるタンパク質は、それぞれのタンパク質が蛍光標識されていることを考えると、このアッセイを使用して調査できます。タンパク質の動員と機能は、ヒト胚性腎臓(HEK293T)細胞と巨大単層小胞(GUV)の両方における共焦点イメージングによって監視されます。 図2 は、1064 nmの集束近赤外レーザービームを使用して単一のAuNPを照射し(図2A)、膜損傷と細胞内へのCa2+ の流入を引き起こし、PMR機構を活性化させる実験条件を示しています。その後、アネキシンが損傷部位に急速に動員され、創傷周囲で負に帯電したリン脂質に結合し、数秒以内にリング状の構造を形成します(図2B、i-iv)。GUVを使用したモデル膜実験では、 図2Cに示すように、ANXAの非存在下で膜穿刺が迅速に再密封されることが実証されました。しかし、ANXAの存在下では、膜穿刺後の損傷部位にANXAの急速な蓄積が観察されました(図2D)。特に、ANXAは露出したエッジを転がし続け、最終的にGUVの破裂につながりました。この圧延機構は、ANXAが湾曲を誘導し、脂質膜を曲げる能力から生じると考えられている20。
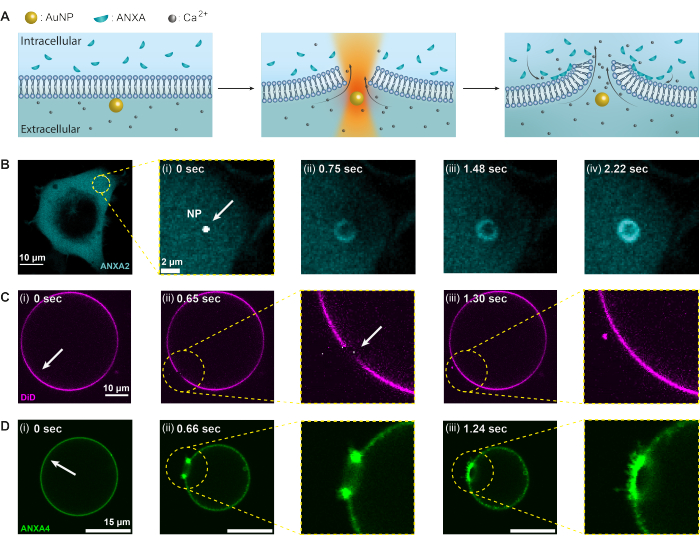
図2:サーモプラズモニックによる膜破壊に対するアネキシン(ANXA)の応答。最初に、(A)原形質膜は、高レベルのCa2+イオンを含む細胞外環境とカプセル化されたANXAを持つ細胞内環境との間の障壁として機能します。近赤外(NIR)レーザーを照射すると、AuNPはかなりの熱を発生し、膜を破裂させ、Ca2+イオンの流入を引き起こします。その結果、原形質膜修復(PMR)機構が活性化され、損傷部位にANXAが動員され、負に帯電したリン脂質に結合します。(B-D)ANXA2を含む細胞とANXA4を含むGUVの共焦点顕微鏡画像は、このプロセスを示しています。(i)照射前の画像は、無傷の細胞(GUV)を示しており、照射部位は白矢印で示されています。(ii)ナノ粒子を照射すると、(B)ANXAが損傷部位に急速に動員され、膜巻の周囲にリング状の構造を形成します(B[ii-iv])。パネル(C)は、ANXAを伴わない膜染色GUVを示しており、穿刺すると、観察可能な膜リモデリングなしに急速に再シールされます。一方、パネル(D)は組換えANXA4を含むGUVを示しており、これは膜を横切るCa2+漏洩により、(i)照射前にすでに膜に結合している。(ii)穿刺すると、ANXA4が自由縁に結合し、膜が縁から離れるにつれてGUVが崩壊します。スケールバーのサイズは、図(B)が10μm、B(i)が2μm、(C)が10μm、(D)が15μmです。この図は、Moreno-Pescador et から再現されています。王立化学会の許可を得て16個掲載。この図の拡大版をご覧になるには、ここをクリックしてください。
完全なANXAリング状構造(図2Bおよび補足図1)の分析は、創傷のサイズと形態に関する有用な洞察を提供します。ANXAリング構造の半径は、セクション5で説明するように、時間と空間にわたって決定することができる。Morenoら16は、ANXA5リング構造の解析が図3に示されている生細胞における135以上の原形質膜損傷を分析しました。半径は、折りたたまれた強度プロファイルの全幅半値に基づいて、リングの中心から曲線の外側半径までの距離を測定することによって決定されました(図3A)。この知見は、ANXA5のリングサイズ(図3B)の不均一な分布を示しており、経時変化(図3D、G、H)と空間(図3C、E、F)が経過しても一定に保たれています。これらの結果は、損傷部位の周囲にANXA5が蓄積していることを示唆しており、損傷した膜の漏斗状の内向きの出芽が仮定されていることに対する、生細胞におけるANXA5を介したPMR戦略の代替を示している5。
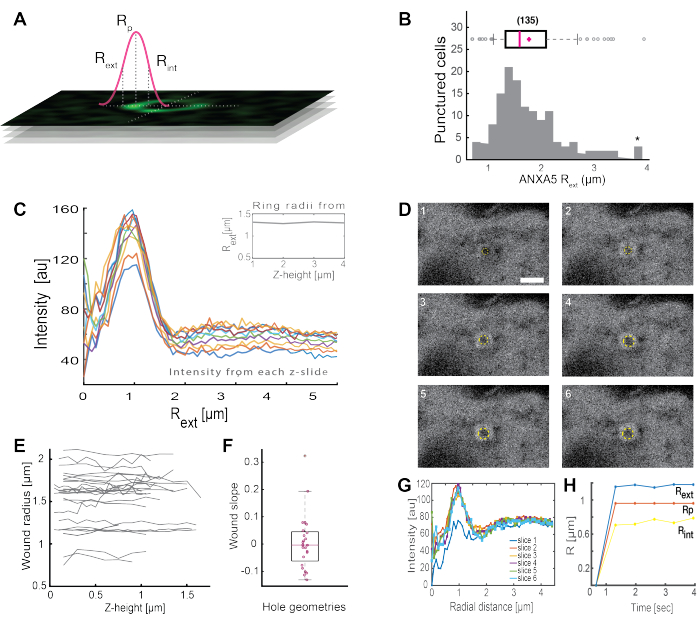
図3:生細胞の損傷部位を取り巻くANXA5リング構造の解析。 (A)概略図は、ANXA強度線プロファイルの全幅半値に基づく分析アプローチを示しています。(B)ヒストグラムは、135個のANXA5リング半径を測定したものである。(C)zスタックの各zセクションのANXA5-GFPリング全体の蛍光強度ラインプロファイル。(D)共焦点画像は、ANXA5-GFPが創傷直後に創傷周囲に蓄積し、その後創傷が安定化する創傷の時間発展を示しています。1 から 6 のラベルが付いたタイム フレームは、フレームあたり 0.66 秒間隔でキャプチャされました。スケールバーは2μmです。(E)創傷の半径は、パネルAに提示された方法に基づいて、創傷の深さの関数として決定された。 (F)創傷の傾きは、パネルEから抽出されたデータに基づいて、z高さの関数としてANXA5リング半径として分析された。 (G)蛍光強度ラインプロファイルは、パネルDからANXA5-GFPリングを横切って測定され、 ここで、各時間間隔 1 〜 6 はスライス 1 〜 6 と表されます。最後に、(H)ANXA5-GFPリング半径の時間発展は、パネルGのデータから計算された時間の関数として表されます。この図は、Moreno-Pescador et から再現されています。王立化学会の許可を得て16個掲載。 この図の拡大版をご覧になるには、ここをクリックしてください。
PMのみを破壊して形成されるリング状構造(補足図1)と比較して、核に近接した損傷(補足図2A)は、創傷の進化と形状に影響を与える可能性があります。時折、ANXAリングの一部しか明らかにならなかったが(補足図2B、C)、これは社内のMATLAB解析ワークフロー(セクション5を参照)を使用して解析することもできるが、追加のデータが失われる可能性はある。典型的には、非接着性細胞(補足図2C)で観察されるANXAリング形成は、核と細胞の周辺部の両方に近接して位置する。その結果、より細長い環構造が観察される可能性があり、これは提示されたデータ分析には最適ではありません。さらに、非接着細胞は、PM損傷後の細胞死の影響を受けやすいようでした。さらに、AuNP凝集体の照射に起因する傷害を考慮する場合、これらの傷害はより重篤で制御しにくい可能性があることに注意することが重要です。これは、プラズモニック加熱が大幅に増加し、細胞の大部分に損傷を与える可能性があるためです。その結果、そのような傷害はANXA5リング分析に組み込まれていません。
さらに、予備的な知見は、サーモプラズモニクスを用いた原形質膜の破壊が細胞内Ca2+レベルの上昇をもたらすことを示している。これは、単一のAuNPを低強度照射しても観察され、図4に示すように、PM透過化35を示唆しています。Ca2+の流入は、膜結合型カルシウムプローブGCaMP6s-CAAXを発現する細胞で観察され、Ca2+の流入時に立体構造変化を起こし、したがって、その強度の増加が観察される64。カルシウム強度は、細胞のフットプリント全体について経時的に定量化されました。バックグラウンドノイズを除去するために、膜破壊および膜修復後のバックグラウンドCa2+レベルを差し引いた。最大強度は、セル内の平均Ca2+強度を正規化することによって決定され、図4Bに示されているように、最初のCa2+強度が急激に増加し、その後ゆっくりと減少する強度曲線が得られました。
細胞は~6.6秒で最大カルシウム強度に達し、これはカルシウム強度のピークの時間(t = tc)が創傷閉鎖に必要な時間に対応することを示唆したKlenowらの発見と一致している64。それにもかかわらず、膜修復と創傷治癒の根本的なメカニズムを確立するにはさらなる研究が必要ですが、予備的な知見は、このCa2+プロセスが損傷細胞でのみ観察され、ポジティブコントロールとして使用された損傷していない細胞では観察されないことを示しました。このことは、細胞内カルシウムレベルがもはやCa2+流入と競合しなくなり、最終的に細胞ホメオスタシスを達成するため、PMRが成功した後に過剰な細胞内カルシウムが活発に排出されるサーモプラズモニック膜破壊時に細胞がCa2+流入を経験したことを裏付けている64。
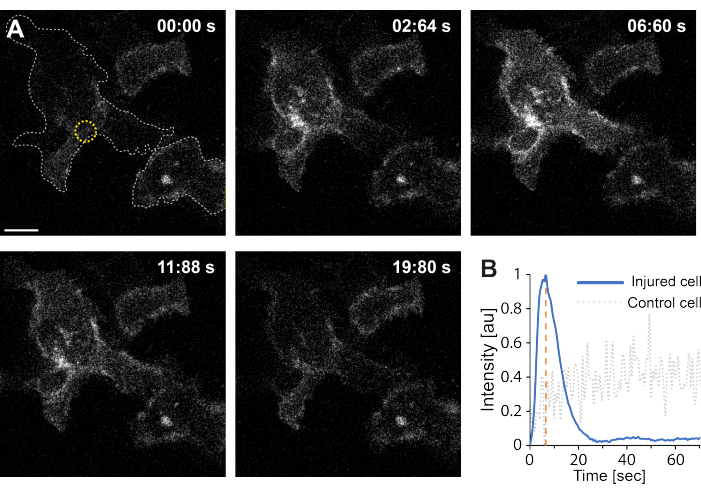
図4:カルシウムの流入は、HEK293T細胞の原形質膜がサーモプラズモニクスによって破裂することで発生します。 一連の共焦点画像は、膜結合型カルシウムプローブGCaMP6s-CAAXを発現する2つの細胞(目的の細胞とポジティブコントロールとして使用された無傷の細胞)を示しています。スケールバーのサイズは10μmです。(A)照射前の00:00秒に、2つの細胞のフットプリントを灰色の点線で可視化し、照射部位を黄色の円で示す。レーザー照射時に、Ca2+ の急速な流入が観察され、橙色の破線で示される~6.6秒で最大強度に達し、その時点は創傷閉鎖の時点に対応すると推定される64。(B)損傷細胞(青線)のGCaMP6s-CAAXプローブから得られたカルシウム強度プロファイルを、損傷していない隣接する細胞(灰色の点線)のCa2+ 強度と比較したところ、PM破壊時にのみCa2+ が流入していることが分かりました。 この図の拡大版をご覧になるには、ここをクリックしてください。
ディスカッション
この研究は、サーモプラズモニック法が、膜破壊後の生細胞およびモデル膜におけるタンパク質応答を調査するための有望な手法であることを強調している。この方法は、タンパク質の動員だけでなく、タンパク質膜のダイナミクスに関与するタンパク質の生物物理学的機能に関する広範な情報も提供します。その結果、表面修復に関与する分子成分の同定が容易になり、原形質膜修復の複雑かつ重要な機構の理解が進みます。膜破壊を誘導する方法には、機械的、化学的、光学的手法などさまざまな方法がありますが、これらの方法は、細胞に非特異的である、細胞膜に複数の損傷を与える、または膜に重大な損傷を与え、高出力パルスレーザーを使用する場合、レーザー経路に沿って内部細胞物質を切除するなどの制限に悩まされています。共焦点顕微鏡と光ピンセットの統合は、最も包括的な情報を提供しますが、別のイメージングモダリティを使用することもできます。例えば、プラズモニックナノ粒子のイメージングは、ライカの共焦点顕微鏡に内蔵されているイメージングモードである反射顕微鏡を用いて行われるため、暗視野顕微鏡65,66、iSCAT 67,68などの他の散乱法、ナノ粒子の蛍光標識などの追加のイメージング技術をAuNPの可視化に採用することができますが、これはこの方法の適用性を制限する可能性があります。
提示された方法は、モデル膜にナノスコープの穴を誘導することも可能であり、異なるアネキシン間の相乗効果を調べることができます。これは、RFPやGFPなど、異なる標識の組換えアネキシンをカプセル化し、その後にサーモプラズモニック穿刺を行うことで達成されます。このモデルシステムは、 図2Dに示すように、アネキシンが自由縁付近の膜とどのように相互作用するかについての洞察を提供します。しかし、細胞とは異なり、GUVに与えられた穴は拡大し続け、その後、小胞が不安定になります。共焦点顕微鏡を用いた穴の進展のイメージングは、穴の直径が急激に拡大するため困難な場合がありますが、時間の経過とともに複数のzスタックを捕捉することで達成できます。別の方法は、より高速なイメージングのために回転するディスク共焦点を使用することです。さらに、サーモプラズモニックアプローチは、20°C〜30°Cのサンプル温度で、シングルセルまたはGUV実験(通常は2〜3回)に適用した場合、通常、1時間あたりの最適な結果の数が限られています。 タンパク質膜動態を最も正確に観察するには、細胞をHEPES含有バッファーに保持し、1時間ごとにサンプルを交換することをお勧めします。あるいは、細胞インキュベートチャンバー、すなわち5%CO2で37°Cの一定温度で実験を行うことにより、実験ウィンドウを拡張することもできます。さらに、このアプローチを確率的光学再構成顕微鏡(STORM)などの他のイメージング技術と組み合わせることで、膜修復に関与する主要なタンパク質の生物物理学的機能と相互作用を1分子レベルでより深く理解することができます。これにより、創傷の形状やアネキシンタンパク質の位置など、損傷部位に関する詳細な情報が得られるだけでなく、膜表面の修復に関与する他の主要なプレーヤーを特定できます。
膜損傷の誘発に最大限の効果と精度を達成するためには、各実験の前にレーザー焦点の位置を確認し、レーザー焦点の軸方向位置が共焦点焦点と一致することを確認することが不可欠です。このアライメントにより、AuNPイメージング中の強度が最適化され、より低いレーザー出力で局所的な温度上昇が最大になり、その結果、膜損傷が発生します。このプロセスは手動で実行されるため、焦点が粒子の位置と一致する位置に手動で変換されるため、膜破裂効率のばらつきの影響を受けやすくなります。一部の市販システムのように反射モードがない顕微鏡では、レーザーの焦点と粒子の共局在化が困難な場合があります。そのような場合、代替のイメージングモード(例えば、明視野)を採用することができ、予想される粒子位置の周りで低速ラスタースキャンを実行することができる。レーザー出力が低いと膜透過のみを誘発する可能性が高く、レーザー出力が高いと、ガラス表面に冷却効果があっても、水の沸点を超えるNP周辺の温度が発生する可能性があることに注意してください。NPを取り巻くナノバブルの形成は、200°Cから300°Cの間で起こると推定され25,48、爆発的な熱は、レーザー焦点からの粒子の変位または粒子の断片化のいずれかをもたらす可能性がある。さらに、加熱中にナノまたはマイクロバブルが形成されることは、この方法に課題をもたらします。空気は膜を脱湿し、タンパク質の不安定化を引き起こす可能性があるため、膜修復を調査する際には加熱を制限することが不可欠です。特に、金ナノシェルは高温に耐えられず、高解像度顕微鏡58によって実証されているように、これらの条件下で劣化します。
本稿では、サーモプラズモニクスを使用して、細胞膜とモデル膜の両方に適用できる、膜に高度に局所的な穿刺を行うための詳細なプロトコルを提供します。加熱の程度をさらに減らすために、近赤外光と共鳴するより小さなナノ粒子を利用することができ、エンドソーム、小胞体、および核膜の細胞内穿刺を可能にします。桿体およびナノマトリョーシカ48を含むこのようなナノ粒子は、細胞表面で容易に取り込まれ、核69に向かって輸送されるエンドサイトーシスされた金ナノ粒子を標的とすることによって、核外皮修復を研究するために用いることができる。全体として、この技術により、PMRに関与する主要な分子成分の同定と検査が可能になり、細胞の生存率を維持しながら、それらの生物物理学的機能と役割を解明できます。
開示事項
著者は何も開示していません。
謝辞
組換えアネキシンタンパク質とアネキシンをコードするプラスミドを提供してくれたJesper Nylandstedに感謝します。この研究は、デンマーク独立研究自然科学評議会(DFF-4181-00196)、ノボ ノルディスク財団学際的シナジープログラム2018(NNF18OC0034936)、デンマーク癌学会科学委員会(R90-A5847-14-S2)、ルンドベック財団(R218-2016-534)、ルンドベック財団センターオブエクセレンス(ナノメディシンにおける生体膜)によって財政的に支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 1064 nm trapping laser | Spectra Physics | N/A | Spectra Physics J201-BL-106C, Nd: YVO4 NIR laser |
| 160 nm Gold Nanoshells | NanoComposix | NCXGSIR150 | |
| 200 nm Gold Nanoparticles | BBI Solutions | EM.GC200/7 | |
| 35 mm glass surface MatTex microwell | MATTEK | P35G-1.5-14-C | |
| Amber-glass vials | Supelco Sigma Aldrich | 243438 | |
| Annexin A2 plasmids | N/A | N/A | Received from our collaborator at the Danish Cancer Research Center |
| Annexin A4 recombinant-protein | N/A | N/A | N-terminal GFP tagged ANXA4 received from our collaborator at the Danish Cancer Research Center |
| Annexin A5 recombinant-protein | N/A | N/A | N-terminal GFP tagged ANXA5 received from our collaborator at the Danish Cancer Research Center |
| beta-casein | Sigma Life Science | C6905-1G | |
| CaCl2 | Suprlco (sigma Aldrich) | 10035-04-8 | |
| Centrifuge 5702 | Eppendorf | 5702 | |
| Chloroform | VWR Chemicals | 67-66-3 | |
| Culture dish (Nunclon Delta Surface) | Thermo scientific | 150460 | |
| DID cell-labelling Solution | Invitrogen | 7757 | |
| Distilled water | Gibco | 15230-089 | |
| DOPC | Avanti Polar Lipids | 850375C | Dissolved in chloroform |
| DOPS | Avanti Polar Lipids | 840035C | Dissolved in chloroform |
| Dulbecco's Modified Eage's Medium | Thermo Fisher Scientific | 11995065 | |
| FIJI ImageJ distribution | ImageJ2 | N/A | |
| GCaMP6s-CAAX | N/A | Received from our collaborator at the Danish Cancer Research Center | |
| Gibco Fetal Bovine Serum | Fisher Scientific | 11573397 | 10% of the culture medium |
| Glucose | PROLABO | 24 374.297 | |
| Hamilton syringes | Hamilton Company | N/A | 50 and 500 microliters |
| Harrick Plasma Cleaner PDG-002 | Harrick Plasma | N/A | |
| HEK293T cells | N/A | Received from our collaborator at the Danish Cancer Research Center | |
| Leica Acousto-Optical Beam Splitter (AOBS) | Leica | N/A | |
| Leica PL APO 63x water immersion objective, NA = 1.2 | Leica | N/A | |
| Leica SP5 confocal scanning microscope | Leica | N/A | |
| Lipofectamine | Fisher Scientific | 15338030 | |
| MatLab | The Mathworks, Inc., Natick, Massachusetts, United States | N/A | |
| NaCl | VWR Chemicals | 7647-14-5 | |
| Opti-MEM Reduced-Serum Medium | Thermo Fisher Scientific | 11058021 | |
| Parafilm | Bemis | PM-992 | |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | 1% of the culture medium |
| Phosphate Buffered Saline (PBS) | Thermo Fisher Scientific | 10010023 | |
| Piezoelectric stage (PI 731.20) | Physik Instrumente (Germany) | N/A | |
| Poly-L-Lysine | Sigma-Aldrich | P8920-100ML | 0.01-0.1% for coating |
| Polyvinyl alcohol | Sigma-Aldrich | 363065-25G | |
| round glass slide 25 mm Ø | VWR | 631-1584 | |
| Sonicator Brandson 2800 | Brandson | N/A | |
| sucrose | Sigma Life Science | 57-50-1 | |
| T25 tissue culture flask | Falcon | 353108 | Blue Vented cap |
| Tris-HCl | Invitrogen | 15567-027 | |
| TrypLE | Thermo Fisher Scientific | A1285901 | |
| Trypsin-EDTA | Fisher Scientific | 11590626 | |
| VWR Mixer mini vortex 230V EU | VWR | 12620-84 | ECN: 444-2790, SN: 150713022 |
参考文献
- Bendix, P. M., et al. Interdisciplinary synergy to reveal mechanisms of annexin-mediated plasma membrane shaping and repair. Cells. 9 (4), 1029 (2020).
- Gajic, O., Lee, J., Doerr, C. H., Berrios, J. C., Myers, J. L., Hubmayr, R. D. Ventilator-induced Cell Wounding and Repair in the Intact Lung. American Journal of Respiratory and Critical Care Medicine. 167, 1057-1063 (2003).
- McNeil, P. L., Khakee, R. Disruptions of muscle fiber plasma membranes. Role in exercise-induced damage. The American Journal of Pathology. 140 (5), 1097-1109 (1992).
- Yu, Q. C., McNeil, P. L. Transient disruptions of aortic endothelial cell plasma membranes. The American Journal of Pathology. 141 (6), 1349-1360 (1992).
- Boye, T. L., et al. Annexin A4 and A6 induce membrane curvature and constriction during cell membrane repair. Nature Communications. 8, 1623 (2017).
- Bischofberger, M., Gonzalez, M. R., van der Goot, F. G. Membrane injury by pore-forming proteins. Current Opinion in Cell Biology. 21, 589-595 (2009).
- Tang, S. K. Y., Marshall, W. F. Self-repairing cells. Science (New York, N.Y.). 356, 1022-1025 (2017).
- Abreu-Blanco, M. T., Verboon, J. M., Parkhurst, S. M. Single cell wound repair: Dealing with life's little traumas. Bioarchitecture. 1, 114-121 (2011).
- Sønder, S. L., et al. Annexin A7 is required for ESCRT III-mediated plasma membrane repair. Scientific Reports. 9, 6726 (2019).
- Andrews, N. W., Almeida, P. E., Corrotte, M. Damage control: cellular mechanisms of plasma membrane repair. Trends in Cell Biology. 24 (12), 734-742 (2014).
- Idone, V., Tam, C., Goss, J. W., Toomre, D., Pypaert, M., Andrews, N. W. Repair of injured plasma membrane by rapid Ca2+-dependent endocytosis. The Journal of Cell Biology. 180 (5), 905-914 (2008).
- Lauritzen, S. P., Boye, T. L., Nylandsted, J. Annexins are instrumental for efficient plasma membrane repair in cancer cells. Seminars in Cell & Developmental Biology. 45, 32-38 (2015).
- Häger, S. C., Nylandsted, J. Annexins: players of single cell wound healing and regeneration. Communicative & Integrative Biology. 12 (1), 162-165 (2019).
- Jaiswal, J. K., et al. S100A11 is required for efficient plasma membrane repair and survival of invasive cancer cells. Nature Communications. 5, 3795 (2014).
- Draeger, A., Monastyrskaya, K., Babiychuk, E. B. Plasma membrane repair and cellular damage control: The annexin survival kit. Biochemical Pharmacology. 81 (6), 703-712 (2011).
- Moreno-Pescador, G. S., et al. Thermoplasmonic nano-rupture of cells reveals annexin V function in plasma membrane repair. Nanoscale. 14 (21), 7778-7787 (2022).
- Zhivotovsky, B., Orrenius, S. Calcium and cell death mechanisms: A perspective from the cell death community. Cell Calcium. 50 (3), 211-221 (2011).
- Gerke, V., Moss, S. E. Annexins: From structure to function. Physiological Reviews. 82 (2), 331-371 (2002).
- Idone, V., Tam, C., Andrews, N. W. Two-way traffic on the road to plasma membrane repair. Trends in Cell Biology. 18 (11), 552-559 (2008).
- Boye, T. L., et al. Annexins induce curvature on free-edge membranes displaying distinct morphologies. Scientific Reports. 8, 10309 (2018).
- Bouter, A., et al. Annexin-A5 assembled into two-dimensional arrays promotes cell membrane repair. Nature Communications. 2, 270 (2011).
- Boye, T. L., Nylandsted, J. Annexins in plasma membrane repair. Biological Chemistry. 397 (10), 961-969 (2016).
- Weinberger, A., et al. Gel-assisted formation of giant unilamellar vesicles. Biophysical Journal. 105 (1), 154-164 (2013).
- Numata, T., Tatsuta, H., Morita, Y., Otani, Y., Umeda, N. Localized thermal processing with a laser-trapped and heated metal nanoparticle. IEEJ Transactions on Electrical and Electronic Engineering. 2, 398-401 (2007).
- Bendix, P. M., Reihani, S. N. S., Oddershede, L. B. Direct measurements of heating by electromagnetically trapped gold nanoparticles on supported lipid bilayers. ACS Nano. 4 (4), 2256-2262 (2010).
- Kyrsting, A., Bendix, P. M., Stamou, D. G., Oddershede, L. B. Heat profiling of three-dimensionally optically trapped gold nanoparticles using vesicle cargo release. Nano Letters. 11 (2), 888-892 (2011).
- Andersen, T., Kyrsting, A., Bendix, P. M. Local and transient permeation events are associated with local melting of giant liposomes. Soft Matter. 10 (24), 4268-4274 (2014).
- Bahadori, A., Oddershede, L. B., Bendix, P. M. Hot-nanoparticle-mediated fusion of selected cells. Nano Research. 10, 2034-2045 (2017).
- Rørvig-Lund, A., Bahadori, A., Semsey, S., Bendix, P. M., Oddershede, L. B. Vesicle fusion triggered by optically heated gold nanoparticles. Nano Letters. 15 (6), 4183-4188 (2015).
- Moreno-Pescador, G., Arastoo, M. R., Ruhoff, V. T., Chiantia, S., Daniels, R., Bendix, P. M. Thermoplasmonic vesicle fusion reveals membrane phase segregation of influenza spike proteins. Nano Letters. 23 (8), 3377-3384 (2023).
- Bahadori, A., Lund, A. R., Semsey, S., Oddershede, L. B., Bendix, P. M. Controlled cellular fusion using optically trapped plasmonic nano-heaters. SPIE Proceedings. SPIE 9922, Optical Trapping and Optical Micromanipulation XIII. 992211, (2016).
- Bahadori, A., Moreno-Pescador, G., Oddershede, L. B., Bendix, P. M. Remotely controlled fusion of selected vesicles and living cells: a key issue review. Reports on Progress in Physics. 81 (3), 32602 (2018).
- Moreno-Pescador, G., Arastoo, M. R., Chiantia, S., Daniels, R., Bendix, P. M. Thermoplasmonic induced vesicle fusion for investigating membrane protein phase affinity. bioRxiv. , (2022).
- Pescador, G. S. M., et al. Investigating plasma-membrane repair employing thermoplasmonics. Biophysical Journal. 120 (3), 45A (2021).
- Moreno-Pescador, G. S., Qoqaj, I., Thusgaard Ruhoff, V., Iversen, J., Nylandsted, J., Bendix, P. M. Effect of local thermoplasmonic heating on biological membranes. SPIE 11083, Optical Trapping and Optical Micromanipulation XVI. 110830M, (2019).
- Bement, W. M., Mandato, C. A., Kirsch, M. N. Wound-induced assembly and closure of an actomyosin purse string in Xenopus oocytes. Current Biology. 9 (11), 579-587 (1999).
- Weisleder, N., et al. Recombinant MG53 protein modulates therapeutic cell membrane repair in treatment of muscular dystrophy. Science Translational Medicine. 4 (139), 139ra85 (2012).
- Sudji, I. R., Subburaj, Y., Frenkel, N., García-Sáez, A. J., Wink, M. Membrane disintegration caused by the steroid saponin digitonin is related to the presence of cholesterol. Molecules. 20 (11), 20146-20160 (2015).
- Babiychuk, E. B., Monastyrskaya, K., Potez, S., Draeger, A. Intracellular Ca2+ operates a switch between repair and lysis of streptolysin O-perforated cells. Cell Death & Differentiation. 16, 1126-1134 (2009).
- Nygård Skalman, L., Holst, M. R., Larsson, E., Lundmark, R. Plasma membrane damage caused by listeriolysin O is not repaired through endocytosis of the membrane pore. Biology Open. 7 (10), bio035287 (2018).
- Swaggart, K. A., et al. Annexin A6 modifies muscular dystrophy by mediating sarcolemmal repair. Proceedings of the National Academy of Sciences of the United States of America. 111, 6004-6009 (2014).
- Yeheskely-Hayon, D., Minai, L., Golan, L., Dann, E. J., Yelin, D. Optically induced cell fusion using bispecific nanoparticles. Small. 9 (22), 3771-3777 (2013).
- Minai, L., Yeheskely-Hayon, D., Golan, L., Bisker, G., Dann, E. J., Yelin, D. Optical nanomanipulations of malignant cells: Controlled cell damage and fusion. Small. 8 (11), 1732-1739 (2012).
- Lukianova-Hleb, E., et al. Plasmonic nanobubbles as transient vapor nanobubbles generated around plasmonic nanoparticles. ACS Nano. 4 (4), 2109-2123 (2010).
- Vogel, A., Noack, J., Hüttman, G., Paltauf, G. Mechanisms of femtosecond laser nanosurgery of cells and tissues. Applied Physics B. 81, 1015-1047 (2005).
- Baffou, G., Polleux, J., Rigneault, H., Monneret, S. Super-heating and micro-bubble generation around plasmonic nanoparticles under cw illumination. Journal of Physical Chemistry C. 118 (9), 4890-4898 (2014).
- Sasikumar, K., Liang, Z., Cahill, D. G., Keblinski, P. Curvature induced phase stability of an intensely heated liquid. Journal of Chemical Physics. 140 (23), 234506 (2014).
- Jauffred, L., Samadi, A., Klingberg, H., Bendix, P. M., Oddershede, L. B. Plasmonic heating of nanostructures. Chemical Reviews. 119 (13), 8087-8130 (2019).
- Neuman, K. C., Nagy, A. Single-molecule force spectroscopy: optical tweezers, magnetic tweezers and atomic force microscopy. Nature Methods. 5 (6), 491-505 (2008).
- Bendix, P. M., Jauffred, L., Norregaard, K., Oddershede, L. B. Optical trapping of nanoparticles and quantum dots. IEEE Journal of Selected Topics in Quantum Electronics. 20, 15-26 (2014).
- Samadi, A., Bendix, P. M., Oddershede, L. B. Optical manipulation of individual strongly absorbing platinum nanoparticles. Nanoscale. 46, 18449-18455 (2017).
- Jørgensen, J. T., Norregaard, K., Tian, P., Bendix, P. M., Kjaer, A., Oddershede, L. B. Single particle and PET-based platform for identifying optimal plasmonic nano-heaters for photothermal cancer therapy. Scientific Reports. 6, 30076 (2016).
- Goldenberg, H., Tranter, C. J. Heat flow in an infinite medium heated by a sphere. British Journal of Applied Physics. 3 (9), 296-298 (1952).
- Eustis, S., El-Sayed, M. A. Why gold nanoparticles are more precious than pretty gold: Noble metal surface plasmon resonance and its enhancement of the radiative and nonradiative properties of nanocrystals of different shapes. Chemical Society Reviews. 35, 209-217 (2006).
- Landau, L. D., Lifshitz, E. M. . Fluid Mechanics: Landau and Lifshitz: Course of Theoretical Physics. 6, (2013).
- Niederauer, C., Seynen, M., Zomerdijk, J., Kamp, M., Ganzinger, K. A. The K2: Open-source simultaneous triple-color TIRF microscope for live-cell and single-molecule imaging. HardwareX. 13, e00404 (2023).
- Richardson, A. C., Reihani, N., Oddershede, L. B. Combining confocal microscopy with precise force-scope optical tweezers. SPIE Proceedings:SPIE 6326, Optical Trapping and Optical Micromanipulation III. 632628, (2006).
- Samadi, A., Klingberg, H., Jauffred, L., Kjær, A., Bendix, P. M., Oddershede, L. B. Platinum nanoparticles: a non-toxic, effective and thermally stable alternative plasmonic material for cancer therapy and bioengineering. Nanoscale. 10 (19), 9097-9107 (2018).
- . Available from: https://www.thermofisher.com/order/catalog/product/A7816 (2023)
- Kreibig, U., Vollmer, M. Theoretical considerations. In: Optical Properties of Metal Clusters. 25, (1995).
- Mie, G. Beiträge zur Optik trüber Medien, speziell kolloidaler Metallösungen. Annalen der Physik. 330 (3), 377-445 (1908).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529 (2017).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Klenow, M. B., Heitmann, A. S. B., Nylandsted, J., Simonsen, A. C. Timescale of hole closure during plasma membrane repair estimated by calcium imaging and numerical modeling. Scientific Reports. 11, 4226 (2021).
- Li, T., Wu, X., Liu, F., Li, N. Analytical methods based on the light-scattering of plasmonic nanoparticles at the single particle level with dark-field microscopy imaging. Analyst. 142 (2), 248-256 (2017).
- Gibbs-Flournoy, E. A., Bromberg, P. A., Hofer, T. P. J., Samet, J. M., Zucker, R. M. Darkfield-Confocal Microscopy detection of nanoscale particle internalization by human lung cells. Particle and Fibre Toxicology. 8 (1), 2 (2011).
- Taylor, R. W., Sandoghdar, V. Interferometric scattering microscopy: Seeing single nanoparticles and molecules via Rayleigh scattering. Nano Letters. 19 (8), 4827-4835 (2019).
- Wu, Y., Ali, M. R. K., Chen, K., Fang, N., El-Sayed, M. A. Gold nanoparticles in biological optical imaging. Nano Today. 24, 120-140 (2019).
- Klingberg, H., Oddershede, L. B., Loeschner, K., Larsen, E. H., Loft, S., Møller, P. Uptake of gold nanoparticles in primary human endothelial cells. Toxicology Research. 4 (3), 566-666 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
JoVEについて
Copyright © 2023 MyJoVE Corporation. All rights reserved