このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
腱における遺伝子発現量の空間的高分解能解析
要約
この記事では、腱の最適化された in situ プロトコルを実行する方法について説明します。この方法では、組織調製、切片透過化、プローブ設計、およびシグナル増幅法について説明します。
要約
近年、高分解能トランスクリプトミクスのための多くのプロトコルが、さまざまな医学・生物学分野で開発されています。しかし、マトリックスに富む組織、特に腱は、細胞数が少ない、細胞あたりのRNA量が少ない、マトリックス含有量が高いなどの理由で取り残され、解析が困難になっていました。最近の最も重要なシングルセルツールの1つは、腱の遺伝子発現レベルの空間解析です。これらのRNA空間ツールは、新規および未知の集団の特定の細胞を特定し、シングルセルRNA-seqの結果を検証し、シングルセルRNA-seqデータに組織学的コンテキストを追加するために、腱において特に非常に重要です。これらの新しい方法により、細胞内のRNAを優れた感度で解析し、単一細胞レベルでの単一分子RNA標的の検出が可能になり、腱の分子特性評価と腱研究の促進に役立ちます。
この手法論文では、新規の in situ ハイブリダイゼーションアッセイを使用して、インタクト細胞内の標的RNAを単一細胞レベルで検出することにより、組織切片上の空間的遺伝子発現レベルを解析するための利用可能な方法に焦点を当てます。まず、利用可能なさまざまなアッセイのために腱組織を調製する方法と、バックグラウンドノイズなしで高感度かつ高い特異性でターゲット特異的なシグナルを増幅する方法に焦点を当てます。次に、この論文では、特定の透過化方法、さまざまなプローブ設計、および現在利用可能な信号増幅戦略について説明します。さまざまな遺伝子の転写レベルをシングルセル分解能で解析するこれらのユニークな方法により、さまざまな動物モデルやヒト腱組織の若年集団および高齢集団における腱組織細胞の同定と特性評価が可能になります。この方法は、骨、軟骨、靭帯など、マトリックスが豊富な他の組織における遺伝子発現レベルの解析にも役立ちます。
概要
腱は、筋肉と骨の間の力の伝達を可能にする結合組織です1。発生的には、軸性腱細胞は体節の菌核内の間葉系細胞に由来します2;四肢腱は側板中胚葉に由来します。そして、頭蓋腱は脳神経堤系統3,4から生じます。腱は、強膜転写因子5の発現によって特徴付けることができますが、テノモジュリン、モヒカン刈り、初期成長応答1/2 6,7,8,9など、いくつかのマーカーも腱の発達に重要な役割を果たします。
腱の既知のマーカーは少ないにもかかわらず、一般に、腱には生体力学的特性の勾配にまたがる細胞が含まれているため、より詳細な特性評価は依然として困難です。筋腱接合部、腱中央部、およびより石灰化した腱部から、腱細胞は引張特性の範囲の細胞外マトリックスに存在します。腱は、軟組織と硬組織の間の機械的強度の違いによって課せられる引張応力に耐えなければならないため、腱内の細胞の空間的構成は、その機能にとって特に重要です。しかし、これらの腱の亜集団についてはほとんど知られていません。
多くの高分解能空間トランスクリプトームツールを使用して、単一細胞RNA Seqや in situ ハイブリダイゼーションなどの細胞亜集団の解明を開始できます。しかし、これらの空間プロファイリングアッセイは、マイクロダイセクションまたは切片化後に組織全体でのRNA発現を明らかにするのに役立ちますが、これらの方法を腱組織で実施すると困難な場合があります。腱は、乾燥質量10のコラーゲンの約86%で構成されるマトリックスに富む組織であり、シーケンシングのために細胞を抽出することは困難です。マトリックスから細胞を単離する際の合併症、腱11の低細胞性、および比較的少ないRNA数の両方のために、腱は分析が難しい組織です。
この論文では、組織調製、透過化、およびプローブ設計の方法を提供することにより、新しい in situ ハイブリダイゼーションアッセイを最適化して腱に活用する方法を紹介します。既存のシーケンシング技術と組み合わせることで、研究者は、アッセイの感度と特異性を高めて、発達中の腱、成人腱、または損傷した腱全体の腱亜集団を空間的に特徴付けるのに役立つ可能性があります。
Access restricted. Please log in or start a trial to view this content.
プロトコル
すべての動物実験は、IACUC(Institutional Animal Care and Use Committee)およびAAALACのガイドラインに従って実施されました。実験は、承認されたプロトコル #2013N000062 の下でマサチューセッツ総合病院で行われました。本研究では、C57BL/J6マウス(5週齢、P0)を用いた。このプロトコールで使用されるすべての材料、試薬、および機器に関する詳細については、 材料表 を参照してください。
1. サンプルの調製と固定
- マウスをCO2 チャンバーで安楽死させ、続いて安楽死の二次的方法として子宮頸部脱臼を行います。次に、ハサミを使用して、股関節12に沿ってマウスの後肢を切断します。シンチレーションバイアルに、マウスの後肢を十分な4%パラホルムアルデヒド(PFA)溶液に浸し、サンプルを完全に覆い、組織を24時間固定します。
注:4%PFAの代わりに、10%ホルマリンを固定にも使用できます。固定後、サンプルは、さらなる処理までリン酸緩衝生理食塩水(PBS)に保存できます。後肢全体を固定することで、腱の張力を維持し、腱、腱中体、または筋腱接合部を調べる機会を得ることができます。 - シンチレーションバイアルからPFAを取り出した後、サンプルを覆うのに十分なPBSを添加して、1x PBSで3 x 10分間サンプルを洗浄します。次に、後肢を4°Cの0.5M EDTAに浸し、1〜2週間攪拌し、2〜3日ごとに新しいEDTAと交換します。
- EDTAを取り出した後、サンプルを1x PBSで3 x 10分間洗浄し、サンプルを70% EtOHで脱水し、パラフィンに目的の向きで埋め込みます。従来のFFPE切片化技術を使用して、組織を3 μmの厚さで切片化し、処理した荷電顕微鏡スライドに切片を移します( 材料の表を参照)13。
注:切片は、次の手順に進む前に4°Cで保存できます。 - 脱パラフィン
- スライドをホットプレートで60°Cで1時間焼き、スライドを室温(RT)に戻します。スライドからパラフィンワックスを取り除くには、スライドをスライドラックに置き、キシレンで満たされた染色皿にスライドを下げます。新鮮なキシレンで3 x 5分間繰り返します。
注意: キシレンは危険です。取り扱いには注意してください。 - 切片を再水和するには、スライドを1回の洗浄につき5分間、すべてRTで以下に浸します:100%EtOHで2回、dH2Oで希釈した75%EtOHで1回、PBSで希釈した50%EtOHで1回、PBSで希釈した25%EtOHで1回、PBSで2回洗浄します。
注:すべての水分補給ステップは、スライドラック上のスライドと染色皿のさまざまなEtOH溶液を使用して行われます。
- スライドをホットプレートで60°Cで1時間焼き、スライドを室温(RT)に戻します。スライドからパラフィンワックスを取り除くには、スライドをスライドラックに置き、キシレンで満たされた染色皿にスライドを下げます。新鮮なキシレンで3 x 5分間繰り返します。
2. RNAscope(商品化ISH)プロトコル14 適応
- 溶液とプローブの調製
- 切片化したサンプルの前処理用に、pH 8 で 25 mM の Tris-HCl、10 mM の EDTA、および 50 mM のグルコースを組み合わせて TEG 溶液を調製します。すべてのサンプルを処理するのに十分な量を作るか、過剰に調製します。フィルター滅菌し、RTで保管します。溶液を適切に混合してから使用してください。
- すべての洗浄に十分な量の1x Wash Buffer( 材料表を参照)を準備し、RTで保管してください。
- 40°Cのウォーターバスまたはインキュベーターで、目的のプローブを10分間温めます。次に、ISHプロトコル14に従ってプローブを準備します。
- サンプルの前処理
- 推奨される前処理溶液を使用するのではなく、TEGバッファーを含む染色皿にスライドを60°Cで4時間浸漬します。
注:組織が特に密集している場合、または目的のRNA結合モチーフの抗原賦活化が困難な場合、TEGバッファーインキュベーションは最大6時間延長できます。その場合、ここにストップポイントを追加し、スライドを乾燥させて4°Cの冷蔵庫で一晩保管することができます。 - サンプルをバッファーから取り出し、乾燥させます。次に、疎水性バリアペンでサンプルを描き、プロテアーゼIVを含む別の染色皿に浸し、オーブンで40°Cで45分間インキュベートします。
注:成体マウスにはプロテアーゼIVを推奨します。P0などの若いマウスを使用する場合は、プロテアーゼIIIなどの穏やかな酵素を30分間使用することをお勧めします。さまざまな年齢でトラブルシューティングを行う場合は、腱の完全性を観察し、劣化がないか確認してください。組織が解離または分解している場合は、インキュベーション時間を短縮するか、使用するプロテアーゼを変更してください。 - サンプルをTEGバッファーで再度30分間洗浄し、ISHプロトコル14に従ってプローブをハイブリダイズします。
- サンプルの上に50-100μLのマウント試薬を加えます。顕微鏡観察のためにサンプルの上にカバースリップを置きます。イメージングするときは、高倍率(40倍以上の対物レンズ)を使用して信号を表示します。
- 推奨される前処理溶液を使用するのではなく、TEGバッファーを含む染色皿にスライドを60°Cで4時間浸漬します。
3. HCR ISHプロトコル15 適応
- 後固定
- 4% PFA(PBS中)、PBT溶液(0.1% Tween-20 in PBS)、およびPBS中のプロテイナーゼK(ストック濃度10 mg/mL、最終濃度5 μg/mL)を調製します。
- 最初のポストフィックスステップを開始するには、スライドを4% PFAを含む染色皿に5分間浸します。次に、4% PFA 溶液を取り出し、後のステップで使用するために保管します。スライドをPBT溶液で2 x 5分間すすぎ、PBT溶液を取り除きます。スライドをプロテイナーゼK溶液(5 μg/mL)を含む染色皿に5分間入れ、PBT溶液で2 x 5分間すすぎます。
- 2番目のポストフィックスステップを開始し、スライドを4%PFAに5分間浸します。
注:これは、ステップ3.1.2で節約した4%PFAと同じです。 - スライドをPBT溶液で3 x 5分間すすぎます。
注:すべての後固定ステップは、スライドラック上のスライドと、それぞれの溶液を含む染色皿で行われます。
- アセチル化
- 625 μLの無水酢酸、3.3 mLの1 Mトリエタノールアミン(TEA)緩衝液、および246 mLのddH2Oを含むアセチル化溶液を調製します。
- スライドをアセチル化溶液に10分間入れた後、PBT溶液で3 x 5分間すすぎます。スライドをddH2Oですすぎ、30分間自然乾燥させます。次に、疎水性バリアペンでサンプルの周りを描きます。
注:すべてのアセチル化ステップは、スライドラック上のスライドと、それぞれの溶液を含む染色皿で行われます
- 雑種形成
- ハイブリダイゼーションバッファーを37°Cに予熱し、加湿チャンバーを37°Cに予温します。
注意: バッファーには、危険物であるホルムアミドが含まれています。スライドが十分に乾いていない場合は、ラボラトリーワイプで端を拭き取り、余分なdH2Oを取り除きます。 - 各プローブ混合物の0.4 pmolを100 μLのハイブリダイゼーションバッファーに加えて、プローブ溶液を調製します。
注:dHCRイメージングを使用する場合は、プローブハイブリダイゼーション効率を向上させるために、高濃度のプローブを使用してください。 - 3 M NaCl (最終容量 4 L で 701.1 g の NaCl) と 0.3 M の Na3CH6H5O7•2H2O (352.8 g) を組み合わせ、HCl または 10 N NaOH を添加して最終 pH を 7 に調整して、4 L の塩化ナトリウムクエン酸ナトリウムバッファー (20x SSC) を調製します。20xSSCを5倍に希釈し、10% Tween 20を全体積の0.1%になるように添加して、5x SSCTを調製します。
- 200 μLのハイブリダイゼーションバッファーをサンプルに加え、スライドを加湿チャンバーに入れ、スライドを10分間インキュベートします。ハイブリダイゼーション溶液を取り出し、ラボラトリーワイプで端を吸い取ってスライド上の余分なバッファーを排出します。
- 調製したプローブ溶液100μLをサンプルの上に加え、サンプルにカバースリップを置きます。オーブンで一晩または約12〜16時間、5x SSCと50%ホルムアミドを含有する溶液で加湿したチャンバー内でインキュベートします。温度を37°Cに設定します。
注:インキュベーションは一晩中行われるため、カバースリップの追加は蒸発を最小限に抑えるためです。 - 5x SSCT溶液のアリコートを37°Cのウォーターバスに置き、2番目のアリコートをRTに置き、サンプル数と次のステップでの洗浄回数に基づいて、これらのアリコートの量を予測します。
- ハイブリダイゼーションバッファーを37°Cに予熱し、加湿チャンバーを37°Cに予温します。
- 洗浄
- 予熱した5x SSCT溶液を使用して、75%洗浄バッファー/25%5x SSCT、50%洗浄バッファー/50%5x SSCT、および25%洗浄バッファー/75% 5x SSCT溶液を調製します。
- 余分なプローブを除去するには、スライドを75%洗浄バッファー/25% 5x SSCT、50%洗浄バッファー/50% 5x SSCT、および25%洗浄バッファー/75% 5x SSCTに37°Cで15分間直列に沈めます。カバーガラスをサンプルから浮かせます。
- スライドを100% 5x SSCTで2 x 15分間インキュベートし、次にRTで5x SSCTに5分間浸漬します。
注:洗浄手順は、スライドラック上のスライドを使用して、それぞれの溶液を含む汚れた皿、または液滴として溶液を添加した状態で行うことができます。
- 増幅
- 3 μM ストックの 2 μL をスナップ冷却して、ヘアピン h1 の 6 pmol とヘアピン h2 の 6 pmol を準備します (95 °C で 90 秒間加熱し、RT まで冷却します)。このプロセス中は、ヘアピンを光から保護します。
注:HCRヘアピンh1およびh2は、ヘアピンストレージバッファで提供され、スナップ冷却の準備ができています。クールなh1ヘアピンとh2ヘアピンを別々のチューブにスナップします。 - スライドの端を実験室のワイプで吸い取り、スライドを乾かします。次に、サンプルの上に200 μLの増幅バッファーを加え、RTで30分間加湿チャンバーに入れます。RTで100 μLの増幅バッファーにスナップ冷却されたh1ヘアピンとスナップ冷却されたh2ヘアピンを追加して、ヘアピン混合物を準備します。
- 増幅バッファーを取り外し、ラボラトリーワイプで端を吸い取ってスライド上の余分な液体を排出します。あらかじめ調製したヘアピン混合物100μLを加え、サンプルの上にパラフィルムを敷きます。スライドをRTの暗い加湿チャンバーで最低4時間または一晩インキュベートします。
- 余分なヘアピンを除去するには、スライドを染色皿に5x SSCTに浸し、室温で30分間インキュベートします。新しい5x SSCTで30分間、3回目で5分間洗浄を繰り返します。
- ラボラトリーワイプで端を吸い取り、スライドを乾燥させ、サンプルの上に50〜100μLの封入試薬を加えます。顕微鏡観察のためにサンプルの上にカバースリップを置きます。イメージングするときは、高倍率(40倍以上の対物レンズ)を使用して信号を表示します。
- 3 μM ストックの 2 μL をスナップ冷却して、ヘアピン h1 の 6 pmol とヘアピン h2 の 6 pmol を準備します (95 °C で 90 秒間加熱し、RT まで冷却します)。このプロセス中は、ヘアピンを光から保護します。
Access restricted. Please log in or start a trial to view this content.
結果
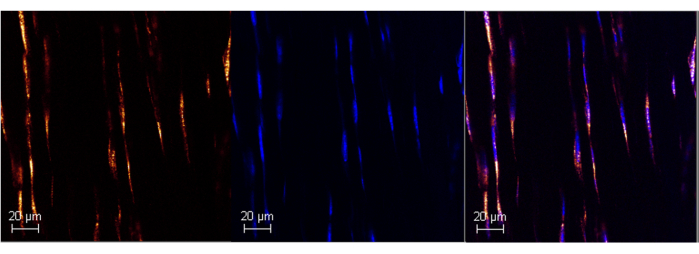
図1:RNAScopeを使用した成体マウスアキレス腱のポリA RNA発現。 市販のISHアッセイを用いたマウスアキレス腱(左パネル)のPoly A標識成功の代表画像。DAPIとの共局在化により、プローブ(中央パネルと右パネル)の特異性が確認され、バックグ?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
この論文では、既存のISHツールを活用して、高度な特異性と感度で腱組織に使用できるようにするために行われた変更について説明します。腱は非常にマトリックス密度の高い組織であるため、プローブの浸透性と特異性を同程度にするためには、多くの場合、プロトコールの調整を行う必要があります。これらの特定の透過化方法と腱組織のシグナル増幅戦略は、...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者には、開示すべき利益相反はありません。
謝辞
著者は、これらのプロトコルの開発とトラブルシューティングにおける支援と励ましについて、Jenna GallowayとGalloway Labのメンバーに感謝します。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 1 M triethanolamine buffer | |||
| 10% Formalin solution | |||
| 10% Tween-20 | |||
| 20x Saline Sodium Citrate buffer | |||
| 4% PFA | |||
| ACD RNAscope Fluorescent Multiplex Fluorescent Reagent Kit V2 | ACD | 323100 | |
| Acetic Anhydride | |||
| Axio Imager Microscope | ZEISS | ||
| C57BL/J6 mice | JAX ID: 000664 | ||
| Coverslips | Fisher | 12-541-042 | |
| ddH2O | |||
| ETDA | Thermofisher | AM9262 | |
| EtOH | |||
| Glucose | VWR Chemicals BDH | BDH9230-500G | |
| HCR RNA-FISH Bundle | Molecular Instruments Inc. | ||
| HybEZ II Hybridization System | ACD | ||
| Immedge Barrier Pen | Vector Laboratories | H4000 | |
| Leica SPE Confocal Microscope | Leica | ||
| Parafilm | Fisher | ||
| Phosphate-buffered saline (PBS, 1x) | Invitrogen | AM9625 | Dilute 10x PBS in milli-Q water to get 1x solution |
| Protease IV | |||
| Proteinase K | Roche | 3115836001 | |
| RNAscope H2O2 and Protease Reagents | ACD | PN 322381 | Included in ACD RNAscope Fluorescent Multiplex Fluorescent Reagent Kit V3 |
| RNAscope Multiplex Fluorescent Detection Kit | ACD | PN 323110 | Included in ACD RNAscope Fluorescent Multiplex Fluorescent Reagent Kit V2 |
| RNAscope Target Retrieval reagents | ACD | 322000 | Included in ACD RNAscope Fluorescent Multiplex Fluorescent Reagent Kit V4 |
| RNAscope Wash Buffer | ACD | PN 310091 | Included in ACD RNAscope Fluorescent Multiplex Fluorescent Reagent Kit V5 |
| RNAscope Probe Diluent | ACD | 300041 | |
| Slide holder | StatLab | 4465A | |
| Staining Dish with Lid | StatLab | LWS20WH | |
| Superfrost Plus Microscope slides | Fisher | 1255015 | treated, charged slides |
| Tris-HCl | |||
| Xylene | Sigma-Aldrich | 534056-4L |
参考文献
- Sharma, P., Maffulli, N. Tendon injury and tendinopathy: healing and repair. Journal of Bone and Joint Surgery. 87 (1), 187-202 (2005).
- Brent, A. E., Schweitzer, R., Tabin, C. J. A somitic compartment of tendon progenitors. Cell. 113 (2), 235-248 (2003).
- Noden, D. M. The role of the neural crest in patterning of avian cranial skeletal, connective, and muscle tissues. Developmental Biology. 96 (1), 144-165 (1983).
- Chen, J. W., Galloway, J. L. The development of zebrafish tendon and ligament progenitors. Development. 141 (10), 2035-2045 (2014).
- Schweitzer, R., et al. Analysis of the tendon cell fate using Scleraxis, a specific marker for tendons and ligaments. Development. 128 (19), 3855-3866 (2001).
- Tsai, S., Nödl, M., Galloway, J. Bringing tendon biology to heel: Leveraging mechanisms of tendon development, healing, and regeneration to advance therapeutic strategies. Developmental Dynamics. 250 (3), 393-413 (2021).
- Kannus, P., et al. Location and distribution of non-collagenous matrix proteins in musculoskeletal tissues of rat. The Histochemical Journal. 30 (11), 799-810 (1998).
- Kannus, P. Structure of the tendon connective tissue. Scandinavian Journal of Medicine & Science in Sports. 10 (6), 312-320 (2000).
- Thorpe, C. T., Birch, H. L., Clegg, P. D., Screen, H. R. C. The role of the non-collagenous matrix in tendon function. International Journal of Experimental Pathology. 94 (4), 248-259 (2013).
- Lin, T. W., Cardenas, L., Soslowsky, L. J. Biomechanics of tendon injury and repair. Journal of Biomechanics. 37 (6), 865-877 (2004).
- Grinstein, M., et al. A distinct transition from cell growth to physiological homeostasis in the tendon. eLife. 8, e48689(2019).
- Villaseñor, S., Grinstein, M. Two-photon microscopy for the study of tendons. Journal of Visualized Experiments. , e65853(2023).
- Qin, C., et al. The cutting and floating method for paraffin-embedded tissue for sectioning. Journal of Visualized Experiments. (139), e58288(2018).
- Wang, F., et al. RNAscope®: A Novel In Situ RNA Analysis Platform for Formalin-Fixed Paraffin-Embedded Tissues. Journal of Molecular Diagnostics. 14 (1), 22-29 (2012).
- Choi, H. M. T., et al. Third-generation situ hybridization chain reaction: multiplexed, quantitative, sensitive, versatile, robust. Development. 145 (12), 165753(2018).
- Jackson, D. J., Herlitze, I., Hohagen, J. A whole mount in situ hybridization method for the gastropod mollusc Lymnaea stagnalis. Journal of Visualized Experiments. (109), e53968(2016).
- Young, A. P., Jackson, D. J., Wyeth, R. C. A technical review and guide to RNA fluorescence in situ hybridization. PeerJ. 8, e8806(2020).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved