マウスの循環黄体形成ホルモンを誘導および測定するための自動採血と組み合わせた遠隔ニューロン活性化
要約
黄体形成ホルモン(LH)の拍動は、生殖機能の特徴です。我々は、連続自動採血に関連する特定のニューロン集団の遠隔活性化のためのプロトコルについて述べる。この技術により、時限ホルモンの調節、多重化、および意識的で自由に動く動物のLHレベルに対する操作効果の最小化が可能になります。
要約
循環黄体形成ホルモン(LH)レベルは、視床下部-下垂体生殖制御の機能の重要な指標です。LH放出の調節における多数の入力とニューロン集団の役割はまだ不明です。マウスのLHレベルの変化を測定することは、環境ストレスによって簡単に破壊されるため、しばしば困難になります。LHの放出と拍動を測定する現在の技術では、マウスが操作ストレス、一定の拘束、研究者の存在、および個々の動物での作業に適応するための長期的なトレーニングが必要であり、多くの研究課題に対する有用性が低下します。
この論文では、意識があり、自由に動いている、邪魔されていないマウスにおいて、デザイナードラッグによって排他的に活性化されたデザイナー受容体(DREADDs)技術と自動逐次血液サンプリングを組み合わせて、特定の神経集団をリモートで活性化する技術を紹介します。まず、DREADDを発現するアデノ随伴ウイルス(AAV)ベクターを特定の神経集団に送達するための定位固定手術プロトコルについて説明します。次に、頸動脈と頸静脈のカニューレ挿入と、CULEX自動採血システムへの術後接続のプロトコルについて説明します。最後に、遠隔ニューロンの活性化と自動採血のためのクロザピン-N-オキシド静脈内注射のプロトコルについて説明します。この技術により、所望の時点または期間での静脈内物質注入と相まって、特定の期間、5分ごとまたはそれ以上のプログラムされた自動サンプリングが可能になります。全体として、この手法は神経内分泌制御の研究にとって強力なアプローチであることがわかりました。
概要
視床下部-下垂体-性腺(HPG)軸は、下垂体門脈系へのゴナドトロピン放出ホルモン(GnRH)の拍動性放出によって中央に調節されています。下垂体では、GnRHはゴナドトロピン、黄体形成ホルモン(LH)、および卵胞刺激ホルモン(FSH)の循環器系への拍動性放出を制御します。LH拍動性放出は、1,2,3,4機能している中央HPG軸の特徴として機能します。例えば、遺伝子の変化やホルモンや環境要因の変化が軸5,6,7の神経部分に及ぼす影響を表示します。最近まで、LHの拍動パターンの測定は、パルスの同定に必要なサンプリングの頻度が高く、血液量が多いため、大型哺乳類8とラット9に限られていました。
マウスのLHパルスの検出は、この種に利用可能な広範な遺伝子モデルがあり、ゲノム工学技術を使用して特定の遺伝子および細胞集団をさらに研究するために容易に操作できるため、望ましいです。過去10年間で、サンドイッチLH酵素結合免疫吸着アッセイ(ELISA)を用いたマウスのLH濃度の分析の大きな進歩により、微量の血液中のLHの検出が可能になった10。頻繁な尾端採血技術の開発により、マウスにおけるLHパルスの周波数および振幅を検出するために必要な頻繁なサンプリングが可能になった10,11。ただし、尾端採血は、意識のある覚醒動物での使用に限定されています。マウスがサンプリング中の取り扱いと指定された研究者の存在に適応するには、長い訓練期間が必要です。その成功は環境ストレス要因の影響を非常に受けやすく、高レベルの不安を示すマウス系統での使用には適していない可能性があります。心房内カニューレ挿入は、自由に動く意識のあるマウスにおける頻繁な採血にも用いられている12。しかし、このセットアップでは、手動採血を繰り返す必要があり、動物の移動スペースが制限され、心房カニューレ挿入は心機能の動的な変化につながる可能性があります。したがって、事前の訓練や人間の取り扱いや立ち会いを必要とせずに、意識があり、自由に動き、邪魔されないマウスでストレスのない条件下で採血する方法を確立することが望ましい。
自動血液または透析液サンプリングは、拘束されていないげっ歯類におけるさまざまなホルモンレベル(メラトニン13,14など)とその拍動性分泌物(成長ホルモンなど)を測定するために以前に使用されてきました15。ここでは、意識のある動物や拘束されていない動物における自動化された長期頻繁な血液サンプリングのプロトコルを提示し、化学遺伝学的技術を使用して特定のニューロン集団をタイムリーに遠隔活性化します。アデノ随伴ウイルス(AAV)ベクターの定位固定装置送達と、クロザピン-N-オキシド(CNO)の自動静脈内(IV)送達による遠隔活性化について説明します16,17。このプロトコルは多数の動物のLHのpulsatilityの基底レベルのそして誘発された変更の順次検出を同時に可能にする。採血と化合物のIV送達は、コンピュータープログラムを介して時間制御された方法で実施され、研究者の物理的な存在や事前のマウストレーニングの必要性を排除します。この方法は、手動採血の主な制限を克服します。ストレスのない状態での採血、遠隔操作による神経活動制御による化合物の同時輸液が可能です。自動採血を単独で、または遠隔ニューロン活性化と組み合わせて使用した場合の代表的な結果を示し、その利点、制限、および追加の用途について説明します。
プロトコル
すべての動物処置は、National Research Council Guide for the Care and Use of Laboratory Animals18 、ならびに連邦法、州法、および地方法に従って実施されます。成体雌マウス(生後3〜6ヶ月)をこのプロトコルのデモンストレーションに使用し、4匹のC57BL/6J雌マウスと4匹のKiss1-Creを含みました。ChR2-eYFP(Kiss1-eYFP)メス。マウスを12:12の明暗サイクルで飼育し、22°Cで温度制御し、低植物性エストロゲン食で 自由給 餌した。手順とプロトコルは、ミシガン大学動物実験委員会(IACUC、動物プロトコル:PRO00010420およびPRO00010138)によって承認されました。
1. 特定の細胞集団へのAAVの定位導入
- 手術の準備
- すべてのツールを滅菌します。手術器具のパッケージを複数用意して、各パッケージが5匹以下の動物に使用されるようにします。滅菌手袋、動物ごとに最低1組を準備します。
- ゆっくりと着実に注入し、目詰まりしにくい細長いマイクロピペットの場合は、次の設定( 材料表を参照)を使用して、注入用のガラス製マイクロピペットをプルします: ヒート1:915、ヒート2:630、プル:630。これらの設定をプーラーごとに最適化します。
- 指定された手術スペースで手術を行います。手術面を70%エタノールで消毒します。
- 手術野の無菌性を維持するために、滅菌ドレープを使用してください。清潔な白衣または使い捨てガウンとマスクを着用してください。
- 吸入麻酔システムを準備します。酸素供給を開き、流量を0.8 L/minに調整します。
- 手術
- マウスを麻酔ボックスに入れ、イソフルランを2.5%まで開きます。最初の誘導後、イソフルランの流量を2%に減らします。手順全体を通して流れを維持します。麻酔の代替方法については、動物プロトコルおよび地域の倫理委員会のガイドラインを参照してください。
- 動物使用委員会の勧告および地域の規制に従って、先制的な鎮痛薬(カルプロフェン5 mg / kg s.c.)を注射します。.
- バリカンを使用してマウスの頭を剃ります。
- 動物を脳定位固定装置台に設置し、イヤーバーを配置し、頭が正しく固定され、安定していることを確認します。マウスの口をマウスピースに固定し、窒息を防ぐために舌を口の外側に置きます。
- 手術を開始する前に、動物がつま先をつまんで深く麻酔されていることを確認し、処置中、マウスの呼吸と色を監視します。
- マウスの下にエレベーションサポートを配置して、胴体と頭を水平に保ちます。紙で覆われた暖かいパッドで動物を暖かく保ちます。乾燥を防ぐために両目に軟膏を塗ります。
- 手術部位をできるだけ清潔に保ちます。滅菌手袋を着用してください。皮膚を開く前に、マウスの頭をヨウ素とアルコールで消毒します。メスで、頭の皮膚を正中線に沿って、おおよそ目の後ろからラムダ縫合糸の後ろまで切ります。頭蓋骨を露出させたまま、滅菌の0.9%NaClに埋め込まれた綿棒で洗浄します。
- 吻側鼻静脈(RRV)を見つけ、滅菌鉛筆で印をつけます。残りの手順ではステレオスコープを使用します。
注:RRVを前後の基準として使用すると、より良い結果が得られますが、ブレグマを基準として使用するのが標準です。 - 滅菌針を基準として使用し、脳の向きが正しいことを確認してから、脳定位固定装置の測定に進みます。また、RRVとラムダの頭蓋骨表面の高さ、および横方向の傾斜が同じ(±0.02 mm)であることを確認してください。
注:横方向の傾斜は、より外側の脳構造への注射に関連しています。 - 滅菌ガラスピペットに注入するウイルス溶液をロードします。参照 0 前後 (AP) の RRV 参照に持っていきます。矢状縫合糸に沿って、選択したAP座標まで前進します。この位置に滅菌鉛筆で印を付け、針を持ち上げて開頭術に進みます。
- 上矢状洞が壊れないように、マークされた位置の周りに小さな円を慎重にドリルで開けます。ドリルを垂直ではなく傾斜位置に配置して、穴あけ中の圧力を減らします。小さな鉗子で頭蓋骨の一部を取り除きます。
- 血管系が露出したら、上矢状洞の中央を使用して、内側(ML)基準(ポイント0)として使用します。これは、矢状縫合糸を使用するよりも正確です。選択したML位置に移動します。ピペットを下げて、背腹(DV)基準(ポイント0)として硬膜に触れます。硬膜を少し壊し、ピペットを選択したDV位置まで下げます。
- 所望の量のAAV(50〜200 nL)を注入し、カニューレを3分間そのままにして、適切な液体分散を可能にします。ピペットを脳から慎重に取り外します。
- マウスをイヤーバーから外します。外科用クリップまたは任意の方法を使用して皮膚を閉じます。回復のために動物を別の温かいケージに入れます。マウスが目覚めた後の回復、反応性、および活動を監視します。完全に回復したら、マウスを元のケージに戻します。
- 手順の2番目の部分に進む前に、ウイルスの発現を最低3〜4週間待ちます。
2.頸静脈および頸動脈カヌレーション
- 手術の準備
- 指定された手術スペースで手術を行います。手術を開始する前に、手術面を70%エタノールで消毒してください。手術器具のパッケージを複数用意して、各パッケージが5匹以下の動物に使用されるようにします。
- すべての手術器具をオートクレーブします。次に、滅菌水または生理食塩水で洗浄し、手術の合間に少なくとも15秒間(製造元の指示に従って)ホットビーズ滅菌器でツールを消毒します。
- 手術野の無菌性を維持するために、滅菌ドレープを使用してください。清潔な白衣または使い捨てガウンとマスクを着用してください。
- 頸動脈と頸静脈のカニューレ挿入用のマイクロカテーテルを準備します。マイクロレタンチューブの小さなセグメント(外径0.025インチ[OD]x内径[ID]0.012インチ)とシラスティックチューブ(0.025インチOD x 0.012インチID)を結合して動脈カテーテルを構築します。静脈カテーテルは、シラスティックチューブ (外径 0.025 インチ x 内径 0.012 インチ) のみを使用して構築します。手術前にすべてのカテーテルを70%エタノールに一晩浸します。
- 両方のカテーテルの切断された先端を、動物の体重と長さに基づいて事前に推定された長さまで45°で面取りします。
- 手術
- 卓上低流量イソフルランシステムを使用して、2%イソフルラン下で動物を麻酔し、手術中の麻酔ステージと平面を正確に制御します。
- 鎮痛薬(カルプロフェン5 mg / kg s.c.)を先制投与し、乾燥と角膜損傷を防ぐために眼科用軟膏を塗布します。.
- 首の腹側と背中の部分を剃り、70%エタノールと交互に3つのヨウ素スクラブで皮膚をきれいにします。肩甲骨の間に垂直の皮膚切開(12 mm)を切り取り、後で使用するために外科用ガーゼで覆います。動物を仰臥位に置き、頭を外科医に向けます。
- ステレオ解剖スコープは、以下で説明する手順のほとんどの部分に使用します。
- 鎖骨よりも上、首の右側に小さな垂直切開(~10mm)を行い、右頸動脈と頸静脈を露出させます。はさみで皮膚を切断し、鈍い解剖を行って、先端が細い歯のないマイクロ鉗子を使用して皮下組織を分離し、右外頸静脈と右総頸動脈を露出させます。
- 頸静脈の遠位端を結んで血流を止め、マイクロ鉗子とハサミを使用して崩壊した静脈に小さな穴を開けます。静脈カテーテルを斜めに挿入し、一対のマイクロ鉗子を使用して上大静脈を通って右心房のレベルに達するまで近位に挿入します。挿入される長さは、30gのリーンマウスで10~12mmです。カテーテルを結び、7-0のシルク縫合糸を使用して血管に固定します。
注:カテーテルを適切な場所に配置すれば、血液を簡単に抜くことができます。そうしないと、カテーテルが外側胸部静脈に誤って配置される可能性があり、再挿入する必要があります。 - 結合組織を慎重に解剖して、胸骨舌骨筋、胸骨腫筋、および二腹筋に囲まれた三角形の領域にある右総頸動脈を露出させます。必要に応じて、ワイヤーリトラクターを使用してこれらの筋肉を分離します。7-0の絹糸を使用して、内頸動脈と外頸動脈の分岐のレベルで動脈を結びます。2つのほどかれた縫合糸ループを近位に前もって配置します。
- 交換された縫合糸ループを引っ張って血流を一時的に停止し、マイクロハサミまたは27Gの針を使用して血管壁に小さな穴を開けるかパンチします。動脈カテーテルを斜角下に挿入し、大動脈弓に達するが、大動脈弁に触れることなく、事前に推定された長さまで近位に挿入します。挿入される長さは、30gのリーンマウスで~9-10mmです。カテーテルを結び、2つの縫合糸を使用して血管に固定します。
- すべてのカテーテルを皮下にトンネルし、プレカット切開を介して首の後ろで外部化し、25 Gのニードルチューブで作られたシリコンコーティングされたチューブコネクタの静脈または動脈ポートに結合します:2つの25 Gニードルチューブと2つの4.0 cmのPE-20チューブを使用して修正されたMASA19 、小さな金属ワイヤー製のリングで取り付けられた2.0 cmの0.062インチIDのシラスティックチューブでスリーブ付き。コネクタを含む各カテーテルの総内腔容積は6〜8μLです(図1A)。
- 腹側切開部を閉じ、縫合糸で背中の皮膚を閉鎖した時点でコネクタを皮下に固定します。両方のカテーテルにヘパリン処理生理食塩水(200 U/mL)を入れ、先端をステンレス製の外科用ワイヤーでしっかりと塞ぎます。
- マウスはイソフルラン麻酔から数分以内に回復し、手術から5日以内に完全に回復します。手術後24時間後に動物を自動採血収容室に入れ、首の後ろに埋め込まれたチューブコネクタに取り付けられた金属リングにシステムのテザーフックを結合してシステムに接続します。サンプリング開始の24時間前に、動脈カテーテルと静脈カテーテルをそれぞれ注射ラインとサンプリングラインに接続します(図1B)。サンプリングラインの全長は、長さ55cmまたはルーメン容量で40μLです。
注:注射ラインとサンプリングラインのセットアップ、収集方法のプログラミング、および自動採血システムのケージバランスメカニズムは、詳細に説明されています20,21。このシステムは、20分ごとに10μLのヘパリン化生理食塩水を自動的に送達することにより、カテーテルを開いたままにします。 - システムのコンピュータプログラムを使用して、プレジェクションサンプリング、インジェクション、およびインジェクション後のサンプリング時間と頻度を設定します。現在の設定については、以下の手順3.1を参照してください。
- このシステムにより、マウスの動きとは反対方向に飼育室を回転させながらマウスの動きを感知することにより、動物がサンプリングラインおよび/または輸液ラインを絡めることなく自由に動くことができます21 (図1)。
- 輸液または注射ラインに化合物を補充し、注入または注射が始まる少なくとも2時間前に静脈カテーテルに再接続します。.
注:手術の合併症が発生する可能性があり、動物は回復のため、および手術後の数日間を注意深く監視する必要があります。正しいモニタリング、終了要件、および手順については、動物プロトコルを参照してください。
3.自動採血と静脈内注射
- 自動採血
- このプロトコルに従うには、20.0 μL のサンプリング量を使用し、各サンプリングの間隔(つまり、7.0 分)を設定して、サンプルあたり 10.0 分ごとのサンプリング頻度を設定します。最大速度は、3.0分/サンプルで連続的にサンプリングすることです。最小サンプリング量は5.0μLです。同量の生理食塩水がシステムによって自動的に返され、サンプリングされた血液が入れ替わり、体液バランスが維持されます。
- 合計サンプリング時間を、CNOの静脈内注射の30分前(t = -30 - 0)分と30分後(t = 0 - 30)に設定します(0.5 mg / kg、図2)。
- 採取された各血液サンプル(20.0 μL)は、50 μLの生理食塩水(10 U/mLのヘパリンを含む)で自動的に希釈され、システムによって冷蔵サンプルカルーセルに保持されたマイクロチューブに個別に保存されます。
- 自動静脈注射
- 採血開始の少なくとも2時間前に、静脈ラインを静脈カテーテルから外してCNO(0.5 mg / kgで50~60μLの体積で個別に計算された用量)を補充します。.
- 注入シリンジを使用して、溶液(計算された容量よりわずかに多い)をラインから手動で引き出し、溶液とライン内の既存の生理食塩水の間に小さな気泡を残します。
- 注入ラインを静脈カテーテルに再接続し、注入速度を 500 μL/分に設定し、注入開始時間を t = 0 サンプリング終了後 2 分に設定します。各動物の総注入時間は5〜6秒です。
注:必要に応じて、化合物は手動腹腔内注射(IP)によって送達することもできますが、これには採血プロトコル中または採血プロトコルの前に動物を妨害する必要があります。この代替案も結果に示しています。
4.動物の灌流と脳の収集(オプション)
注:この手順は、脳がニューロンの活性化または下流の応答の脳部位を分析する必要がある場合にのみ従う必要があります。
- 採血プロトコルの最後に、マウスを採血システムから切り離します。静脈内注射の2時間後、好ましい方法または他の場所に記載されている22に従って、動物に10%中性緩衝ホルマリン(NBF)を灌流します。
- 脳を解剖し、10%-NBFの20%スクロースで3時間保存して固定を続けます。
- 3時間後、固定した脳をPBS中の20%スクロースに移し、切片作成の準備ができるまで4°Cで保存します。
注:cFOS抗原をマスクするため、過固定は避けてください。20%スクロース溶液では、脳は容器の底に沈むはずです。 - 凍結ミクロトームまたはクライオスタットを用いて切片を作成し、神経細胞の活性化を調べるために好ましい方法を使用します(例えば、cFOS免疫組織化学が示されています)。
注:今回の結果に使用した抗体は、 材料表に記載されています。
5. サンプル処理と分析
- 実験終了後すぐに自動サンプラーから血液サンプルを取り出し、氷上に置きます。
- サンプルを 14,000 × g で 30 秒間遠心します。
- プラズマを回収します。分析するまで-80°Cで保存してください。
- 前述したように、LH ELISAによる血液サンプルをアッセイする10,23.
代表的な結果
視床下部の弓状核に位置するキスペプチン発現ニューロン(Kiss1遺伝子)は、GnRHの強力な刺激因子であり、したがって、下垂体からのLH放出の強力な刺激因子である24,25。このプロトコルのデモンストレーションでは、キスペプチン誘導性LH分泌を使用して、自動採血技術の機能を示しました。 図2は、以前に弓状核にAAV-hM3Dq-mCherryの片側性定位固定注射を受けた成人Kiss1-eYFP雌の代表的なLHパターンを示しています(AP:-4.95、ML:-0.35、DV:-5.7)。ChR2-eYFPは、Kiss1細胞の蛍光レポーターとして使用されました。脳定位固定装置手術の1カ月後、マウスは頸動脈と頸静脈のカニューレ挿入を受け、術後4日目に自動採血装置につながれた。基礎LHレベルを決定するための採血は、翌日に10分のサンプリング頻度(サンプル間の7分間隔と3分/サンプリング)で開始され、その後、自動IV CNO注射が行われ、10分ごとに30分間採血が続けられました。腸間LHレベルは一般的に低いですが(図2A)、その拍動性放出のために通常変動が観察されます(図2B)。CNO注射(およびキスペプチンニューロンの活性化)後、LHの上昇は急激でした(10分以内)。増加のレベルとピークの持続時間は、注射部位、活性化されたニューロンの数、または標的とする集団など、多くの要因によって異なります。
図3 は、 図2Aに表される雌マウスの弓状核における注射の脳部位を示す。Kiss1-eYFPニューロンは緑色で標識されていますが、mCherry免疫反応性はCNO後のAAV注射と活性化の部位を示しています。活性化されたニューロンは、DABで標識されたcFOS免疫反応性を使用して検出されました。ほとんどのmCherryニューロンはKiss1-eYFPと共局在し、多くはcFOS免疫反応性を示し、ウイルスとニューロンの活性化が標的集団に特異的であることを示しています。
図4に、ジエストラス野生型(C57BL/6J)マウスにおける代表的なLH拍動パターンとそれに続くキスペプチン-10のIP注入に対する応答を示します。マウスは頸動脈カニューレ挿入を受け、手術の4日後に自動採血システムに接続されました。翌朝、発情周期をチェックし、26日目に採血とキスペプチン10注射を行いました。血液サンプルを 7 分ごとに 2 時間 (4 分間隔、および注射前の 120 分間 3 分/サンプリング) で収集して、ベースライン レベルと LH 拍動度を決定し、その後、キスペプチン-10 (65 μg/kg) の IP 注射を行い、さらに 30 分間 7 分ごとに採血を続けました。雌の雌に典型的な明瞭なLHパルスが観察され、低い基礎LHレベル、~2パルス/hのパルス周波数、および~1 ng/mLのパルス振幅を示した27。LHの即時かつ強力な増加は、キスペプチン投与に反応して検出されました28。LH分泌パターンと刺激後の変化は、手動採血を使用した他の研究と一致しています10,27,29,30。これらの結果は、自動採血法がストレスのない条件下で典型的および刺激されたLH分泌を捕捉することを示しています。
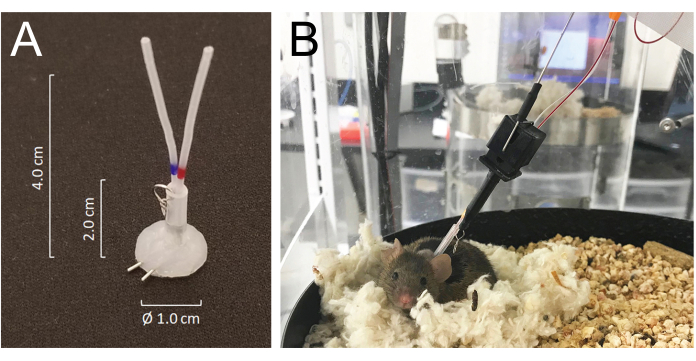
図1:コネクターシステムの詳細と、注入およびサンプリングシステムのチューブへのマウス接続。 (A)2本の25Gニードルチューブと2本のPE-20チューブを使用して構築され、小さな金属リングで取り付けられたシラストチューブでスリーブが付けられたシリコンコーティングチューブコネクタ(MASA)。(B)採血ケージ内の輸液と採血チューブに繋がれ、採血中に巣の中で休んでいるマウス。 この図の拡大版をご覧になるには、ここをクリックしてください。
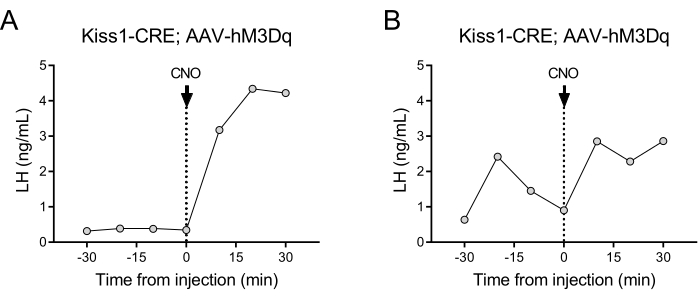
図2:弓状核にAAV-hM3Dqを注入し、CNOで遠隔操作したKiss1-Cre雌マウスのLHパルスの代表的な結果。 基礎LHレベルは、10分ごとに30分間測定されました。採血後の時間0に、女性はクロザピン-N-オキシド(0.5 mg / kg)の静脈内注射を受け、さらに30分間、10分ごとに頸動脈から血液を採取し続けました。(A)は、基礎LH値が低い雌を示しています。(B)は、LHパルスのプレインジェクションを呈している雌を示す。略語:Kiss1 =キスペプチン;AAV = アデノ随伴ウイルス;CNO = クロザピン-N-オキシド;LH = 黄体形成ホルモン。 この図の拡大版をご覧になるには、ここをクリックしてください。
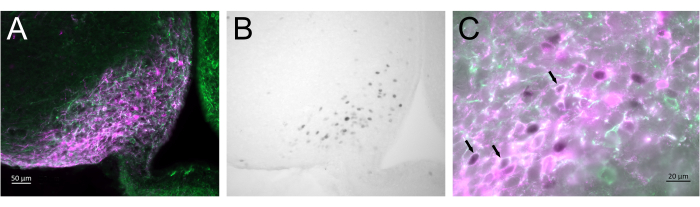
図3:Kiss1-Creの弓状核における脳の活性化。 図2Aに表されるChr2-eYFP(Kiss1-eYFP)雌。 ChR2-eYFPは、 kiss1 ニューロンを標識するためのレポーター遺伝子としてのみ使用されました。(A)弓状核におけるAAV注入部位を示す低倍率蛍光画像。緑:eYFP免疫反応性、マゼンタ:mCherry免疫反応性。(B)弓状核におけるAAV注入部位におけるcFOS免疫反応性(黒色)を示す、 図3Aに対応する領域の低倍率明視野画像。(C)高倍率蛍光と明視野画像を組み合わせた図 3A、Bのニューロンの様子。活性化されたAAV-mCherryを共発現するKiss1-eYFPニューロンは、白色の細胞質と黒い核を持つニューロンです(矢印)。スケールバー = 50 μm (A,B)、20 μm (C)。略語:Kiss1 =キスペプチン;AAV = アデノ随伴ウイルス;eYFP = 増強された黄色蛍光タンパク質。 この図の拡大版をご覧になるには、ここをクリックしてください。
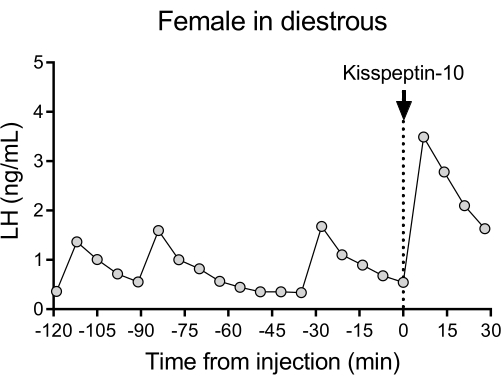
図4:2時間、7分ごとに測定された、脊椎野生型雌の基底LH拍動。 その後、女性は時間0にキスペプチン-10(65μg / kg)の腹腔内注射を受け、血液サンプルを7分ごとに30分間継続的に収集しました。略語:LH =黄体形成ホルモン。 この図の拡大版をご覧になるには、ここをクリックしてください。
ディスカッション
このプロトコルを用いて、神経細胞集団の刺激後の基礎LH拍動とLH分泌を示すことができました。このシステムの大きな利点は、採血中に人の立ち会いや取り扱いがなく、ストレスのない環境でサンプリングが行われることです。さらに、実験中の人間の存在や取り扱いに対する事前の面倒な動物訓練や適応は必要ありませんでした。手動採血を用いた以前の実験では、ストレス要因を最小限に抑えるために多大な時間と労力が必要でした7,31,32。しかし、尾を切るだけではストレッサー33となる。中断が予測できない共有動物施設でストレスのない環境とトレーニングのパラダイムを実装することも、制約となる可能性があります。一部の検査室では、採血のために動物を別の処置室に輸送する必要があることがよくあります。これらの制限により、手動の方法はLHレベルの微妙な変化の検出に適さない可能性があるため、このような状況ではハンズオフアプローチが役立ちます。自動サンプリングは、新しい環境に順応するために数日前にマウスを配置する静かな部屋に設定されます。このプロトコルに関する私たちの以前の経験は、マウスのコルチコステロンと拍動性成長ホルモンの分泌パターンを正確に検出し、自動サンプリング中にコルチコステロンレベルの上昇を示さなかった15。今回の実験では、すべての動物がサンプリングシステムに順応しており、~24時間後にサンプリングチャンバー内で巣作りが行われ、毛の色が明るく、ストレスがなく、全体的に良好な健康状態であることが示されました(図1)。
否定的な結果につながる主な困難は、おそらく必要なニューロン集団へのAAVの不適切な標的化です。脳定位固定装置注射の精度は不可欠であり、座標と注入量を確認するために事前にトレーニングを行う必要があります。トレーニングは、少量の0.5〜1%のエバンスブルーを非回復手術で目的の場所に注射し、次にマウスの脳マトリックス(例:Ted Pella)を使用して解剖したばかりの脳のスライスを採取し、ステレオスコープを使用して注射の場所とサイズを確認することによって行うことができます。
また、自動採血システムから採取された血液および血漿は、ヘパリン化生理食塩水で希釈され(例えば、本件の結果では、生理食塩水50 μLに血液20 μL)、選択した分析法の感度に合わせて希釈比を調整する必要がある場合があることも考慮に入れることが重要です。BSA-PBS(超高感度LH ELISAに推奨)10または生理食塩水で希釈した全血中のLH値を検査したところ、LH値に差は見られませんでした。Tweenは、血液系に循環して試料液20を置換して試料を抽出するため、希釈液には使用できない。私たちの経験では、希釈率が1:10未満の場合、LHレベルは良好でしたが、LHレベルは1:3.5と比較してわずかに過小評価されていました。これは、必要に応じて、採取される血液の量を減らすために希釈をさらに調整してもよいことを示しています。
自動化合物送達の代替手段は、静脈カテーテルを介して手動注射を行うことです。この場合、調査員は注射を届けるために部屋に短時間います。しかし、動物やその飼育環境や周囲との直接的な接触はなく、腹腔内注射や皮下注射とは異なり、処置全体が動物に気づかれないことがよくあります。手動注入の利点は、化合物の希釈を事前に設定する必要がないことであり、これは、大量に使用するには高価すぎる化合物や、時間の経過に伴う劣化に敏感な化合物にとって重要な場合があります。輸液ラインとカテーテルにより多くの化合物溶液を事前に充填する必要がある自動送達よりも操作量が少ないためです。
自動採血は、例えば睡眠中のLH変動を研究するユニークな機会を提供します。サンプリング時間中に巣で眠っている動物を定期的に観察しています。このサンプリングを脳波記録とリンクさせて、神経活動とLHパターン34との関係のより詳細な分析を生成することが可能である。ここに示されているように、自動採血を使用する可能性は、基礎的なLHサンプリングから、内因性または外因性化合物に対するLH応答のテスト、またはニューロン集団の活性化または抑制まで、数多くあります。ニューロン操作は、化学遺伝学またはオプトジェネティクスを用いて急性に実施することも、トランスジェニックマウスモデルやアポトーシスまたはニューロンサイレンシングツールを用いて恒久的に実施することもできます。自動採血により、拍動性の高い分泌パターンを持つ他のホルモン(成長ホルモン15など)の測定も可能になります。雌マウスでは、発情周期の特定の段階が必要な場合、膣塗抹標本は、注入およびサンプリングラインを中断することなく、プロトコル26 を開始する数時間前に注意深く収集することができる。動物はサンプリングシステムに7〜10日間接続できますが、動脈が凝固するリスクは時間とともに増加します。
ただし、この手法は単房動物での使用に限定されているため、社会的相互作用の研究には適していない可能性があります。また、侵襲性が高く、技術的に困難な手術を必要とするため、幼体動物や特定の疾患モデルでは実施できない場合があります。最後に、システムの購入コストは単一の研究所では高すぎる可能性があるため、前述の実験プロトコルをサービスとして提供するコアラボに設置することをお勧めします。
結論として、このプロトコルは、自動採血と組み合わせたAAVの定位投与を実行する方法を示しています。この技術で達成される正確な空間的および時間的制御は、さまざまなモデル、測定プロトコル、およびホルモンへの適用の柔軟性とともに、げっ歯類のホルモン調節を研究するための強力な方法になります。最も重要なことは、この方法は、注射やサンプリング、および事前の動物訓練中に人間の存在と取り扱いを排除することにより、ストレスのない環境を提供することです。これらの利点は、多重化の可能性とともに、この方法に、意識的で自由に動く、邪魔されていないマウスのホルモン変化の神経制御を研究するためのユニークなツールとなっています。
開示事項
著者には開示すべき利益相反はありません。
謝辞
さまざまな血液希釈法のテストに協力してくれたDaniel Haisenleder博士に感謝します。血清ホルモンアッセイは、Eunice Kennedy Shriver NICHD Grant R24 HD102061の支援を受けて、バージニア大学生殖研究センター、リガンドアッセイおよび分析コアで実施されました。Michigan Mouse Metabolic Phenotyping Center-Liveは、NIH Center Grant U2C DK135066の支援を受けています。JFとNQは、DK020572(MDRC)およびDK089503(MNORC)の助成金によってサポートされています。CFE と CSM は、NICHD グラント R21 HD109485 と R01 HD096324 でサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| AAV8-hSyn-hM3D(Gq)-mCherry | Addgene | 44361 | Not necessarily this virus but this was the one used for representative results |
| Alcohol | Disinfection | ||
| Anesthesia Induction box | Vetequip | ||
| Anesthesia induction machine | Kent Scientific Equipment | SomnoSuite | |
| Anesthesia masks for mice | Kent Scientific Equipment | SOMNO-0801 | |
| Autoclip applier 9 mm | Clay Adams | 427630 | |
| Autoclip remover 9 mm | Clay Adams | 427637 | |
| Autoclips 9 mm | Clay Adams | 427631 | |
| BASi Culex Controller | Culex | SN: 2151, 2152, 2156, 2158 | 4 stations |
| BASi Honey Comb Fraction Collector | Honey Comb | SN: 2105, 2106, 2107, 2108 | 4 stations |
| BASi Ratrun Rotation Control | RATURN 2 | SN: 5680, 5681, 5682, 5683 | 4 stations |
| C57BL/6J mice | JAX # 000664 | ||
| Carprofen | Zoetis | Rimadyl | Analgesic |
| Clippers | Braun | ||
| Clozapine-N-oxide | ENZO | BLM-NS105-0005 | |
| Cotton tipped applicators | |||
| CULEX Automated In Vivo Sampling System | BASi | DS000627 | with CX-4000S Replacement Tubing Sets |
| Curved forceps serrated | FST | 11151-10 | |
| Drill | Dremel | 61100 | |
| Empis control Module | EMPIS CM | SN: 174 | |
| Empis Programmable Infusion System | EMPIS | SN: 2125 , 2126, 2127, 2128 | With CX-7010S 4 BAS-2 Infusion Sets; 4 stations |
| Envigo 2016 diet | low-phytoestrogen diet | ||
| Eye ointment | Dechra | Puralube Vet Ointment | Petrolatum Ophtalmic oinment |
| Glass pipettes | World Precision Instruments | MIB100-6 | |
| Hemostats | Roboz Surgical | RS-7101 | |
| Iodine | Betadine Surgical scrub | ||
| Isoflurane | VetOne | Fluriso | Anesthetic |
| Isoflurane Vaporizer or SomnoSuite Low-Flow Anesthesia System | Surgivet or Kent Scientific Corp | SS-01 | Anesthesia Machine |
| Kiss1-Cre;ChR2-eYFP (Kiss1-eYFP) mice | JAX # 023436 and #024109 | ||
| Kisspeptin-10 | Phoenix Pharmaceuticals | 048-56 | |
| Micro-renathane tubing | Braintree Scientific | MRE025 | Surgical catheterization |
| Micro-Scissors | Roboz Surgical | RS-5606 | |
| Needle Holder | Roboz Surgical | RS-7842 | |
| Picoliter injector | Warner Instruments | PLI-100A | |
| Pipette puller | Sutter Instruments | P30 | |
| Rodent Warmer X2 | Stoelting | 53850 | |
| Scalpel | FST | 10003-12 | |
| Scissors | Roboz Surgical | RS-6808 | |
| Silicon tubing | Liveo Laboratory Tubing | NO.508-001 | 0.012 in I.D x 0.025 in O.D. |
| Stereotaxic table | RWD | E06208 | |
| Sterile 0.9% saline | Baxter | 2F7124 | |
| Sterile towel drapes | Dynarex | 4410 | |
| Surgical blades | SKLAR | 06-3011 | |
| Surgical stereoscope | Zeiss | f-160 | |
| Tweezers | Roboz Surgical | RS-4960 | |
| Tweezers | Roboz Surgical | RS-4972 | |
| Tweezers | Roboz Surgical | RS-5058 | |
| Antibodies | |||
| Anti-cFos | Millipore | ABE457 | Antigen target: N-terminus cFos; Host organism: Rabbit; Dilution used: 1:5,000; RRID: AB_2631318 |
| Anti-GFP | Aves Labs | GFP-1010 | Antigen target: recombinant GFP null; Host organism: Chicken; Dilution used: 1:10,000; RRID: AB_2307313 |
| Biotin-SP-conjugated AffiniPure Donkey Anti-Rabbit IgG | Jackson ImmunoResearch Labs | 711-065-152 | Antigen target: Rabbit IgG (H+L); Host organism: Donkey; Dilution used: 1:1,000; RRID: AB_2340593 |
| Donkey anti-Rat IgG, AlexaFluor 594 | Thermo Fisher Scientific | A-21209 | Antigen target: Rat IgG (H+L); Host organism: Donkey; Dilution used: 1:500; RRID: AB_2535795 |
| Goat anti-Chicken IgY, Alexa Fluor 488 | Thermo Fisher Scientific | A-11039 | Antigen target: Chicken, IgY (H+L); Host organism: Goat; Dilution used: 1:500; RRID: AB_2534096 |
| mCherry monoclonal (16D7) | Thermo Fisher Scientific | M11217 | Antigen target: mCherry tag; Host organism: Rat; Dilution used: 1:5,000; RRID: AB_2536611 |
参考文献
- Kokoris, G. J., Lam, N. Y., Ferin, M., Silverman, A. J., Gibson, M. J. Transplanted gonadotropin-releasing hormone neurons promote pulsatile luteinizing hormone secretion in congenitally hypogonadal (hpg) male mice. Neuroendocrinology. 48 (1), 45-52 (1988).
- Coquelin, A., Desjardins, C. Luteinizing hormone and testosterone in young and old male mice. American Journal of Physiology - Endocrinology and Metabolism. 243 (3), E257-E263 (1982).
- Carmel, P. W., Araki, S., Ferin, M. Pituitary stalk portal blood collection in rhesus monkeys: Evidence for pulsatile release of gonadotropin-releasing hormone (GnRH). Endocrinology. 99 (1), 243-248 (1976).
- Schuiling, G., Gnodde, H. Site of origin of the pulsatile secretion of luteinizing hormone in long-term ovariectomized rats. Journal of Endocrinology. 70 (1), 97-104 (1976).
- Hackwell, E. C. R., Ladyman, S. R., Brown, R. S. E., Grattan, D. R. Mechanisms of lactation-induced infertility in female mice. Endocrinology. 164 (5), 1-12 (2023).
- Bahougne, T., Kretz, M., Angelopoulou, E., Jeandidier, N., Simonneaux, V. Impact of circadian disruption on female mice reproductive function. Endocrinology. 161 (4), (2020).
- Kreisman, M. J., McCosh, R. B., Tian, K., Song, C. I., Breen, K. M. Estradiol Enables Chronic Corticosterone to Inhibit Pulsatile Luteinizing Hormone Secretion and Suppress Kiss1 Neuronal Activation in Female Mice. Neuroendocrinology. 110 (6), 501-516 (2020).
- Moenter, S. M., Evans, N. P. Gonadotropin-releasing hormone GnRH measurements in pituitary portal blood. Journal of Neuroendocrinology. 34 (5), 13065 (2022).
- Maeda, K. I., et al. The LHRH pulse generator: A mediobasal hypothalamic location. Neuroscience and Biobehavioral Reviews. 19 (3), 427-437 (1995).
- Steyn, F. J., et al. Development of a methodology for and assessment of pulsatile luteinizing hormone secretion in juvenile and adult male mice. Endocrinology. 154 (12), 4939-4945 (2013).
- Steyn, F. J., et al. Development of a method for the determination of pulsatile growth hormone secretion in mice. Endocrinology. 152 (8), 3165-3171 (2011).
- Minabe, S., Uenoyama, Y., Tsukamura, H., Maeda, K. Analysis of pulsatile and surge-like luteinizing hormone secretion with frequent blood sampling in female mice. Journal of Reproduction and Development. 57 (5), 660-664 (2011).
- Perreau-Lenz, S., Kalsbeek, A., Pévet, P., Buijs, R. M. Glutamatergic clock output stimulates melatonin synthesis at night. European Journal of Neuroscience. 19 (2), 318-324 (2004).
- Herwig, A., Pévet, P., Bothorel, B., Steinlechner, S., Saboureau, M. Trans-pineal microdialysis in the Djungarian hamster (Phodopus sungorus): A tool to study seasonal changes of circadian clock activities. Journal of Pineal Research. 40 (2), 177-183 (2006).
- Adams, J. M., Otero-Corchon, V., Hammond, G. L., Veldhuis, J. D., Qi, N., Low, M. J. Somatostatin is essential for the sexual dimorphism of GH secretion, corticosteroid-binding globulin production, and corticosterone levels in mice. Endocrinology. 156 (3), 1052-1065 (2015).
- Alexander, G. M., et al. Remote control of neuronal activity in transgenic mice expressing evolved G protein-coupled receptors. Neuron. 63 (1), 27-39 (2009).
- Krashes, M. J., et al. reversible activation of AgRP neurons drives feeding behavior in mice. Journal of Clinical Investigation. 121 (4), 1424-1428 (2011).
- National Research Council. Guide for the Care and Use of Laboratory Animals. Eighth edition. National Research Council. , (2011).
- Ayala, J. E., et al. Hyperinsulinemic-euglycemic clamps in conscious, unrestrained mice. Journal of Visualized Experiments. (57), e3188 (2011).
- Peters, S., et al. Culex ABS Part I: Introduction to automated blood sampling. Current Separations. 18 (4), 139-145 (2000).
- Bohs, C., Cregor, M., Gunaratna, G., Kissinger, C. Culex Automated blood sampler part II Managing freely-moving animals and monitoring their activity. Current Separations. 18 (4), 147-151 (2000).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Kreisman, M. J., Mccosh, R. B., Breen, K. M. A Modified ultra-sensitive ELISA for measurement of LH in mice. Endocrinology. 163 (9), (2022).
- Pielecka-Fortuna, J., Chu, Z., Moenter, S. M. Kisspeptin acts directly and indirectly to increase gonadotropin-releasing hormone neuron activity and its effects are modulated by estradiol. Endocrinology. 149 (4), 1979-1986 (2008).
- Kumar, D., et al. Specialized subpopulations of kisspeptin neurons communicate with GnRH neurons in female mice. Endocrinology. 156 (1), 32-38 (2015).
- Caligioni, C. S. Assessing reproductive status/stages in mice. Current Protocols in Neuroscience. , 1-8 (2009).
- Czieselsky, K., et al. Pulse and surge profiles of luteinizing hormone secretion in the mouse. Endocrinology. 157 (12), 4794-4802 (2016).
- Wang, L., et al. Genetic dissection of the different roles of hypothalamic kisspeptin neurons in regulating female reproduction. eLife. 8, 43999 (2019).
- McCosh, R. B., Kreisman, M. J., Breen, K. M. Frequent tail-tip blood sampling in mice for the assessment of pulsatile luteinizing hormone secretion. Journal of Visualized Experiments. (137), e57894 (2018).
- Vanacker, C., Defazio, R. A., Sykes, C. M., Moenter, S. M. A role for glial fibrillary acidic protein (Gfap)-expressing cells in the regulation of gonadotropin-releasing hormone (GnRH) but not arcuate kisspeptin neuron output in male mice. eLife. 10, e68205 (2021).
- Dulka, E. A., Defazio, R. A., Moenter, S. M. Chemogenetic suppression of GnRH neurons during pubertal development can alter adult GnRH neuron firing rate and reproductive parameters in female mice. eNeuro. 7 (3), 0223 (2020).
- Talbi, R., et al. Characterization of the Action of Tachykinin Signaling on Pulsatile LH Secretion in Male Mice. Endocrinology. 162 (8), 1-9 (2021).
- Tuli, J., Smith, J., Morton, D. Corticosterone, adrenal and spleen weight in mice after tail bleeding, and its effect on nearby animals. Laboratory Animals. 29 (1), 90-95 (1995).
- Lucien, J. N., Ortega, M. T., Shaw, N. D. Sleep and puberty. Current Opinion in Endocrine and Metabolic Research. 17, 1-7 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
JoVEについて
Copyright © 2023 MyJoVE Corporation. All rights reserved