Ex Vivo(エクス・ビボ)胎盤外植体フロー培養 - 子宮内の動的条件の模倣
要約
これは、一定のフロー条件下で胎盤外植片を培養するためのプロトコルです。このアプローチは、動的な生理学的環境の複製を可能にすることで、従来の静的な絨毛培養システムを強化します。
要約
既存の ex vivo 胎盤外植片培養モデルは、主にウェルプレートを用いた静的培養システムに基づいています。しかし、これらのモデルは、胎盤が血漿や血流によって一定のわずかなせん断応力を受ける子宮 内 環境の動態を十分に反映していない。この制限に対処するために、 ex vivo 胎盤外植片培養を母体内で経験する 子宮内 フロー条件に近づけるフロー培養システムが考案されました。このアプローチでは、胎盤外植片は、相互接続された5つのフローチャンバーのシーケンスで培養されます。この設定により、生理的な酸素濃度と一定の流量が維持されます。収集されたデータは、流動条件下で、組織形態の保存が従来の静的方法と比較して顕著な向上を示すことを明らかにしています。この革新的な技術は、 ex vivo胎盤外植片培養の簡単な方法を導入し、 in vivo 環境のダイナミックさをより忠実に表現します。さらに、本研究は、胎児と母体の界面の機能動態を研究するための新たな可能性をもたらす。実行可能な動的方法論を採用することにより、胎盤生物学のより深い理解が促進され、母体と胎児の健康との関連性が強調されます。
概要
1960年代以降、ウェルプレートの底部での胎盤外植片培養は、胎児と母体の界面の研究に利用されてきました1,2,3。この方法は確立されており、簡単で、単一細胞の培養に加えて、さまざまな研究にヒト組織を利用することができます2,3。時が経つにつれて、胎盤外植片培養の実験デザインは、酸素濃度4に関して、および組織がウェルプレートの底部に沈降するのを防ぐために変更されてきました2,5,6。しかしながら、この方法は、子宮内の生体内条件、特に一定の流量の存在には適合していない3。
妊娠の成功は、絨毛間腔に母体の血液を適切かつ一貫して灌流し、血液と血液媒介物質の継続的な流入と流出を伴う動的回路を確立することにかかっています7,8,9,10,11,12。胎盤は、母体と胎児の血液の2つの異なる血液供給システムを特徴としており、その結果、胎児系と母体システムの両方による二重灌流が行われます13。母体の血液は、妊娠初期の終わりに胎盤の絨毛間腔を灌流し始め、広がった子宮のらせん動脈をゆっくりと流れます10,11,14。その結果、胎盤絨毛樹は母体の血液を浴び、胎児に栄養と酸素を届けます。この母体の血液は、子宮胎盤静脈を介して母体の循環に戻る前に、絨毛間腔を流れます。絨毛間腔を通過する間、胎児の血液への酸素と栄養素の拡散と活発な取り込みにより、母体の血液中の酸素と栄養素のレベルが低下します12,15。しかし、絨毛空間の血液は、毎分約2〜3回、新鮮で酸素が豊富な血液に完全に置き換えられ、栄養素とガスの継続的な供給を保証します13。特に、胎盤関門の最も外側の部分である合胞体栄養膜は、母体の血液に直接さらされる胎盤絨毛樹の唯一の構成要素です15,16,17。その結果、合胞体栄養膜は、流れる母体の血液から一定の軽度のせん断応力を受ける3,14。
胎盤流動環境に関する現在の科学的知識と現代の技術的進歩により、流動条件下での胎盤外植片の培養が適応し、生理学的に近似できるようになりました。さらに、せん断力が合胞体栄養膜の生物学的機能に影響を与えることを示唆する証拠があります18,19,20,21。血流を説明する周知のアプローチは、胎盤二重葉灌流システム22である。しかし、これらの実験には相当な専門知識が必要であり、時間制限があり(数時間しか実施できない)、妊娠後期の胎盤サンプルでしか実行できない3,23。これに対し、妊娠初期と妊娠後期の両方の胎盤組織を収容し、一定の流量設定下でのex vivo胎盤絨毛外植片培養のための簡単で非侵襲的な技術を開発しました3。このセットアップでは、胎盤外植片は直列接続された5つのフローチャンバーで培養されます。絨毛の外植片は、薄い金属板の針状の隆起を使用してチャンバーの底部に固定されています。構築された流動回路は、その後、酸素濃度と流量の両方が調節されるバイオリアクターに移されます3。フロー培養の結果は、通常使用される静的な方法3と比較して、組織の完全性がよりよく保たれることを実証しています。さらに、このダイナミックなアプローチにより、組織外植片培養の新規かつ適応された実験デザインが可能になり、自然環境をより忠実に模倣したin vitro実験が可能になります3。
プロトコル
グラーツ医科大学の倫理委員会は、この研究を承認しました (31-019 ex 18/19 バージョン 1.2 および 29-319 ex 16/17)。インフォームドコンセントは、研究に関与したすべての被験者から得られました。
1. フロー実験の準備
注:実験は、蠕動ポンプを内蔵したバイオリアクターで行われます( 材料表を参照)。バイオリアクター内の湿度、温度、ガスレベルを調整できます。
- バイオリアクターの電源を入れ、バイオリアクターのマニュアルに従って、実験のすべての事前準備(ポンプの校正、事前加温、ガス条件、湿度など)を行います。実験を開始する前に、必要な設定(温度、ガス含有量、湿度)を数時間または一晩安定させる必要があります。これを行うには、バイオリアクターとソフトウェアを起動し、メニュー項目「インキュベーター」の下の「 セットポイントの変更 」をクリックします。
- PBSと必要な培地(付属のサプリメントhEGF-5、HC-500、および5%エキソソーム枯渇ウシ胎児血清、1%ペニシリン/ストレプトマイシンを添加した内皮細胞増殖培地)( 材料表を参照)を37°Cに予熱します。
2.胎盤サンプルの解剖
- 分娩後すぐに、胎盤中央部から2cm3の胎盤サンプルを3回切断し、Kupperら3に記述されているように、簡単に、サンプルをPBSに保管する。絨毛膜板、母体の脱落膜、および目に見える梗塞の領域を標本から廃棄します。
- 残りの組織標本を、断面直径約0.5cm(湿重量約7.5mg)の絨毛外植片に解剖する。それらを新鮮なPBSでペトリ皿に移します。
- PBSで外植片をピンセットで液体中で静かに振って洗浄し、血液残留物を取り除きます。
注:PBSを使用してペトリ皿でサンプルを解剖して、事前に洗浄して乾燥を防ぎ、滅菌/オートクレーブ滅菌したツールを使用して組織を処理します。
3. 流動実験
- 滅菌フードの下で、フローチャンバーのユーザーマニュアルに従って、ルアーロックを使用して5つのチャンバーをリザーバーボトルに直列に接続します( 材料表を参照)。
注意: それぞれのマニュアルに従って、使用前にすべての材料を滅菌および/またはオートクレーブしてください。リザーバーボトルにエアフィルターを使用して、滅菌ガス交換を行います。チャンバーを開閉するには、チャンバーのラグをそっと押し込みます。ステップ 3.1.また、早めに準備することもできます。 - チャンバーを逆さまにし、底を取り外して開きます。鉗子を使用して、ピンが上を向くように、チャンバーの上部の中央に金属板を移します。
- チャンバーに予熱した培地(37°C)1 mLを充填します。次に、リザーバーにさらに20 mLを入れます。この回路には、各フローチャンバー、チューブ、リザーバーボトルの容量を含めて合計25 mLが必要です。この流れでは、充填チャンバー内の培地の最終容量は2 mLです。
- 鉗子を使用して、チャンバー内の金属板の針の間に絨毛外植片を次々と移します。組織の穿刺を避けるために、針を胎盤絨毛の間をスライドさせます。4つの外植片を1つのチャンバーに移します。底部を慎重に取り付け直してチャンバーを閉じます。完全な回路には、合計20個の外植片が含まれています。チャンバーは逆さまの位置にとどまる必要があります。
注意: 鉗子で外植片をそっとつかみます。それらを絞らないようにしてください。漏れを防ぐために、チャンバーと回路が完全に密閉されていることを確認してください。チャンバーは常に逆さまに使用します。チャンバーあたりの外植片の数とチャンバー自体の数は可変です。妊娠初期組織の手順は、妊娠後期の組織の場合と似ていますが、少し追加されています:絨毛を固定するには、組織が金属プレートに移された後、外植片の上で針をわずかに曲げます(私信Bruggerら)。これにより、壊れやすい組織が金属板に固定され、サンプルが滑り落ちるのを防ぎます。 - フローアセンブリーをバイオリアクターに移します。
- ポンプチューブをポンプに接続して、バイオリアクター内の蠕動ポンプに流量回路を接続します。第4段階で修正 します(4回カチッという音が聞こえます)。
- 静電気制御が必要な場合は、ウェルプレートもバイオリアクターに入れます。
注:静的培養では、6ウェルプレートの5ウェルに、ウェルあたり4 mLの培地と、ウェルあたり4つの絨毛外植片を充填します。充填されたウェルプレートもバイオリアクターに入れられ、フロー培養外植片と同じ雰囲気で培養されます。詳細については、Kupper et al.3 を参照してください。 - メニュー項目「ポンプ」でポンプモードを 手動 に設定します。次に、ポンプ速度を 1 mL/分に設定し、[ 分析]をクリックしてチューブへの培地のポンプ送りを開始します。回路が培地で満たされている間は、チャンバーが完全に培地で満たされるように、チャンバーを斜めに保持します。
注:胎盤絨毛流動および静的培養の実験設定については、 補足表1 を参照してください。フローおよび静的システムの仕様は、 補足表2に記載されています。
注意:充填中は、試験片がニードルから滑り落ちないようにチャンバーを慎重に傾けてください。 - 充填が完了した後、チャンバーは逆さまの位置に留まります。チャンバーがしっかりと直立していることを確認し、バイオリアクターの両方の蓋を閉じます。
注:充填されたフローチャンバー内の培地の最終容量は 2 mL です。実験で使用したフローチャンバーとウェルプレートの実験設定と仕様は、Kupper et al.3 に記載されています。 - 組織を所望の時間インキュベートします。
注:温度、ガスレベル、流量は、バイオリアクターの蓋を再度開けることなく、コンピューター上で監視できます。 - 組織を所望の時間インキュベートした後、メニュー項目「ポンプ」の下の 「中止 」をクリックしてポンプを停止します。バイオリアクターの 2 つの蓋を開けてから、一度に 1 つのフローチャンバーを開きます。鉗子を使用して金属板から外植片を慎重に取り除きます。
- 選択したダウンストリーム分析に従って組織と上清を処理します。この場合、免疫組織化学的染色と電子顕微鏡検査が行われました3。免疫組織化学および免疫蛍光法に用いる抗体の詳細については、 付表3 を参照のこと。
注意: ティッシュを取り除いた後、ポンプを反時計回りに回転させて回路から培地を排出します。 - フローチャンバーとチューブの製造元の指示に従って、フロー回路を分解して清掃します。
代表的な結果
この出版物の一部とその結果は、すでに公開されています(参考文献3および23を参照)。
実験装置
実験的なセットアップを図1に示します。複合フローサイクルは、直列に相互接続された5つのフローチャンバーで構成されています(図1A)。各フローチャンバー内では、それぞれ断面直径約0.5cmの4つの外植片が培養されます(図1A、C)。静電気防除実験では、外植片を6ウェルプレートの個々のウェルで培養します(図1B)。外植片が洗い流されるのを防ぐために、細い針状の突起を特徴とする金属板に貼り付けます(図1 D、E)。外植片を培地の直接流にさらすために、チャンバーは反転し、入口と出口はヘッドセクションに配置されています(図1 F、G)。バイオリアクター内では、フローサイクルは蠕動ポンプにリンクされています。フロー培養組織と従来の静的培養組織との間の組織完全性を比較する目的で、外植片はフローサイクルに隣接する6ウェルプレートに配置されます。これにより、酸素、温度、湿度に関して一貫した培養条件を検証できます(図1A)3。
形態素解析
β-アクチン
さまざまな培養条件に関連する組織の完全性における組織学的違いを調べるために、さまざまな免疫組織化学的染色手順を実施しました(図2)。解剖後速やかに包埋された外植片は、ベースラインの基準として機能しました。絨毛外植片内のアクチン細胞骨格の解析のために、β-アクチン染色を実施しました(図2A-E)。記述的解析により、新たに得られた組織における細胞骨格のよく構造化され組織化された視覚的提示が明らかになりました(図2A)。時間が経つにつれて、培養が進むにつれて、細胞骨格構造の劣化を示すマイクロフィラメントの観察可能な凝集がありました。この現象は、静的培養を受けた絨毛外植片で一貫して観察されました3(図2C、E、アスタリスクで示しました)。
H&E染色
H&E染色は、静的培養の過程で組織の完全性が低下するという観察結果をさらに補強し、この傾向はフロー培養の文脈で改善されます(図2F-J)。新鮮な組織は、絨毛外植片の構造化された特徴的な組織学的症状を示し、密集した密集した間質を特徴としました(図2F)。さらに、合胞体栄養芽細胞は、その下にある間質にしっかりと接着していました(図2F)。流動環境で24時間培養した絨毛外植片でも同様の外観が認められました(図2G)。しかし、流下での培養の48時間後、合胞体栄養芽細胞の一部が部分的に剥離し(図2I、矢印で示)、間質内に散発的な小さな裂孔を伴うことが観察されました。組織の組織学的精査により、静的培養条件での24時間後の組織の完全性は不十分に維持されることが示されました(図2H)。さらに、この完全性は、静置培養で48時間後にさらに著しく低下しました(図2J)。間質は多孔質で凹んだ外観を示し、間質からの合胞体栄養芽細胞の有意な剥離は、より広い領域で明らかでした(図2J、矢印)3。
CD34IIの
CD34II染色は、絨毛外植片内の内皮細胞、ひいては胎児胎盤血管を可視化するために用いられました(図2K-O)。解剖直後に直接包埋された組織は、内皮細胞の独特な組織化された配置を示しました(図2K)。胎児胎盤血管の形態学的完全性は、フロー培養の24時間後も良好に維持され、48時間後も頻繁に維持されましたが、フロー条件下では血管の虚脱の事例が時折認められました(図2 L、N)。しかし、24時間の静置培養後、血管は部分的な虚脱を示し、その破壊された視覚的外観によって証明されました(図2M、矢印で示しました)。静置培養環境内での血管のこの劣化は、培養時間が長くなると悪化するように見えました。要約すると、フロー培養と静的培養の両方に続く絨毛外植片の記述的形態学的評価は、静的培養モード3と対比した場合、組織の完全性がフローシステム内でより効果的に維持されるように見えることを示しました。
培養組織の微細構造解析
透過型電子顕微鏡
絨毛外植片の形態をより詳細に調べるために、透過型電子顕微鏡(TEM)を用いて追加の超微細構造解析を行いました(図3A-E)。これらの所見は、組織学的検査の結果を裏付けるものであった。調製直後に直接包埋された組織では、形態が非常に良好に保存されていました(図3A)。微絨毛は合胞体栄養膜の表面ではっきりと識別できました。合胞体栄養芽細胞は、横方向の細胞境界のない特徴的な連続層を示し、基底膜との直接接触を確立しました。新鮮な組織の間質は、著しい穿孔や破裂を伴わずに密集したパッキングを示しました。さらに、血管の微細構造と個別化された血管内赤血球も優れた保存性を示しました(図3A)。
24時間フロー培養後も、組織サンプルの全体的な形態は比較的良好に維持されていました(図3D)。合胞体栄養芽細胞の表面の微絨毛は新鮮組織と比較してわずかに少なかったが、合胞体栄養芽細胞は主に基底膜に付着したままであった。核と時折の小さな液胞が合胞体栄養膜の内側で観察されました。胎盤絨毛内の間質は保存状態が良好で、新鮮な組織によく似ていました(図3D)。48時間のフロー培養後でも、間質細胞は、多少の穿孔はあるものの、比較的良好な保存状態を示しました(図3E)。興味深いことに、脂質滴が組織内で検出されました。合胞体栄養芽細胞は液胞と微絨毛数の減少を示しましたが、多くの領域で基底膜に付着したままであり、合胞体と細胞核がはっきりと見えました(図3E)。
フロー培養の組織とは対照的に、静的培養を行った絨毛組織の形態は、24時間という早い時間で劣化を示しました(図3B)。合胞体栄養芽細胞は複数の部位で基底膜から解離し、比較的大きな穿孔を示した。さらに、脂質滴は合胞体栄養膜と間質の両方で頻繁に明らかでした(図3B)。静置培養を48時間行うと、超微細構造の漸進的な低下が明らかになりました(図3C)。合胞体栄養膜は、かなりの程度まで多数の穿孔と基底膜からの剥離を示しました。間質内の細胞や血管を構成する内皮細胞の同定が困難になりました。さらに、静置培養の48時間後に絨毛外植片内に脂質滴が顕著に蓄積しました(図3C)。要約すると、静置培養における組織の超微細構造は、培養期間にわたって連続的な劣化を示し、この傾向は流動条件下での培養によって緩和された3。
走査型電子顕微鏡
走査型電子顕微鏡(SEM)を利用して、絨毛外植片の表面の詳細な検査が容易になりました(図4A-J)。新たに包埋された組織は、その表面全体に密集した微絨毛の配列を示しました(図4 A、B)。一部の領域では、小胞状の構造が見られました。対照的に、静的培養の組織では、24時間後に微絨毛の大幅な減少が見られ(図4C、D)、48時間後も減少が持続しました(図4E、F)。一部の領域では、放出されていない小胞状構造の凝集が見られましたが、他の領域は裸で侵食されているように見えました(図4D、F)。フロー培養を行った組織では、微絨毛は24時間後(図4G、H)および48時間後(図4I、J)後も表面に存在していましたが、その程度は新鮮組織よりも少なかった。静的培養と比較して、表面上の小胞様構造の有病率は減少しました。興味深いことに、これらの小胞状構造は、流れが減少または不在になり得る特定のくぼみに顕著に集中しており(図4H、J)、培地の流れによって流れに露出した組織表面から剥がれた可能性があることを示唆しています3。

図1:フローシステムのセットアップ。 (A)リザーバーと5つのフローチャンバーで構成される組み立てられたフローシステムは、蠕動ポンプの1つに接続されています。右側には、外植片を静的培養する6ウェルプレートがあります。(B、C)どちらの培養方法でも、胎盤サンプルを約0.5cm2の絨毛外植片に解剖し、そのうち4つの外植片をウェルまたはチャンバーごとに使用します。実験的アプローチでは、5つのチャンバーまたはウェルが使用されます。(D、E)フロー培養では、針状の高さが狭い金属板を使用して外植片を固定します。(F、G)チューブの開口部はチャンバーの頭部にあるため、組織が直接流れにさらされることを保証するために逆さまに使用されます。この図は Kupper et al.3 からの転載です。この図の拡大版をご覧になるには、ここをクリックしてください。
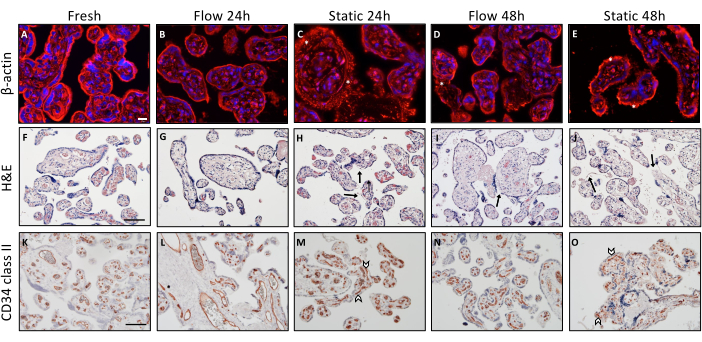
図2:胎盤絨毛外植片の流動培養および静置培養時の形態学的解析。 (A-E)培養時に外植片の細胞骨格を可視化するためのβ-アクチンの免疫蛍光染色。分析には、スライドごとに無作為に選択された6つのスポットを使用しました。代表的な画像を示します。(A)調製直後の包埋組織の細胞骨格の可視化。スケールバー:20μm。 (B-E)フロー培養および静的培養の培養外植片におけるアクチン細胞骨格の時間依存的および培養モード依存的な変性の両方の代表的な描写。(C-E)アスタリスクはアクチンマイクロフィラメントの蓄積の増加を意味し、アクチン細胞骨格の分解を示します。(F-J)絨毛外植片のヘマトキシリン-エオシン染色。スケールバー:100 μm。 (F,G) 新たに包埋した組織(F)および24時間(G)のフロー培養外植片は、絨毛外植片のよく保存された形態を示します。(I)48時間流動培養した外植片は、合胞体栄養膜の断続的な剥離領域を示す(矢印)。(H,J)静的外植片培養後の構造的完全性の経時的な劣化は、合胞体栄養芽細胞(矢印)の脱落と穿孔間質によって示されます。(K-Oさん)CD34 IIは、絨毛内皮細胞の染色に使用されました。スケールバー:100μm。 (K,L) フロー条件下で24時間培養した新鮮組織(K)および外植片(L)は、特徴的な構造的に整列した内皮細胞パターンを示します。(N)フロー培養で48時間後、血管の完全性がある程度低下する。(男性、男性)静置培養では、24時間後にはすでに潰れた血管が見えており(M)、静置培養時間が長くなるほど増加することが観察されました(O)。この図は Kupper et al.3 からの転載です。この図の拡大版をご覧になるには、ここをクリックしてください。
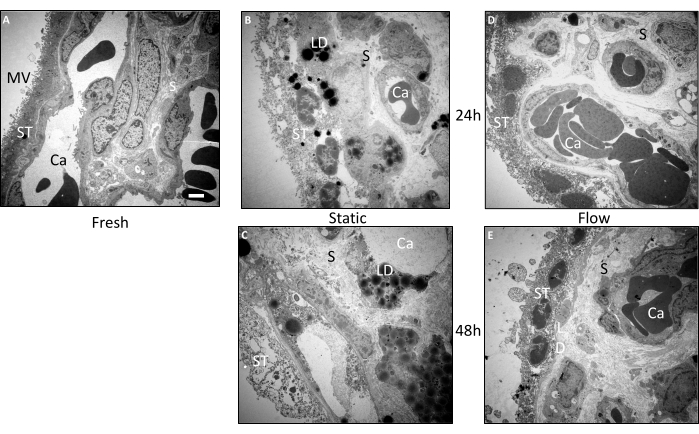
図3:透過型電子顕微鏡を用いた絨毛外植片の培養前および培養後の超微細構造検査。 3つの独立した実験の組織を使用して画像を解析しました。(A)新たに包埋された組織の代表的な画像は、合胞体栄養芽細胞(ST)の表面に大量の微絨毛(MV)を示しています。構造的に無傷の毛細血管(Ca)は、保存状態の良い間質(S)に見られます。(B)24時間静的培養した組織では、合胞体栄養膜の構造的完全性が低下しており、一部の領域で基底膜から切断されているように見えます。脂質滴(LD)の蓄積も顕著です。(C)静置培養で48時間後、重度の超微細構造劣化が認められる。間質と合胞体栄養膜には穿孔があり、脂質滴の大量の蓄積が明らかです。血管はほとんど痕跡が残っていなかった。(D、E)フロー培養による組織の超微細構造は、24時間後(D)および48時間後(E)で比較的良好に保存されました。スケールバー:2 μm。 MV:微絨毛、ST:合胞体栄養芽細胞、S:間質、Ca:毛細血管、LD:脂質滴。この図は Kupper et al.3 からの転載です。 この図の拡大版をご覧になるには、ここをクリックしてください。

図4:走査型電子顕微鏡を用いた絨毛外植片の培養前および培養後の微細構造検査。 (A、C、E、G、I) 胎盤絨毛樹木の表面の概観画像とそれぞれの詳細画像(B、D、F、H、J)。(A,B)新たに埋め込まれた組織は、微絨毛の密な継ぎ目を示します。(B)小胞状の構造が所々に見られる。(C-F)静置培養で24時間および48時間後、合胞体栄養芽細胞の表面の微絨毛の減少が見られます。印象的なのは、外植片の表面に小胞状の粒子が広範囲に蓄積していることです。(F)静置培養で48時間後に粒子が枯れるように見える。(G-J)フロー培養による組織の表面は、静的培養と比較して、24時間後(G,H)および48時間後(I,J)の方が保存状態が良好であるようです。微絨毛は表面(H、J)に見られますが、新鮮な組織ほど高密度ではありません。(B)小胞粒子は、流動が減少したニッチに散乱しているのが見られます。この図は Kupper et al.3 からの転載です。この図の拡大版をご覧になるには、ここをクリックしてください。
補足表1:胎盤絨毛流動および静置培養の実験設定。このファイルをダウンロードするには、ここをクリックしてください。
付表2:フローおよび静的システムの仕様。このファイルをダウンロードするには、ここをクリックしてください。
補足表3:この研究に使用した免疫組織化学および免疫蛍光法の抗体。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
この研究は、胎盤外植片の流動培養技術に関するユニークな視点を導入し、子宮内環境の動態を再現する3,23。この知見は、流動条件下で培養された組織の形態が、従来の静的培養法と比較してよりよく保存されることを明らかにしている3。特に、静的培養条件もフロー培養条件も胎盤血管の灌流を促進しないにもかかわらず、絨毛間質内の胎児胎盤血管の破壊は静的培養で主に観察されたのに対し、フロー培養では血管の完全性が長期間にわたってよりよく維持されるようでした3。
この観察の1つの可能な説明は、合胞体栄養膜の重要な保護および内分泌の役割に関連している可能性があり、その機能は文献12,24,25,26で十分に文書化されています。これを考えると、絨毛の外層の全体的な完全性は、血管を含む下層間質の維持に大きく寄与すると考えられる。その結果、流動条件下での血管の持続的な細胞完全性は、培地の連続的な流れに起因する可能性があります。この動きは、外植片の受動的な動きを助け、胎盤関門を越えたガス、栄養素、ナノ粒子(細胞外小胞など)の交換を促進します。これは、ひいては血管形態の保存にプラスの影響を与える可能性があります。さらに、機械感覚の現象は、さまざまな組織にわたる組織の形態形成に関与しています27,28。研究によると、機械感受性は複数のレベルで細胞プロセスに影響を与え、最終的に組織や臓器の機能に影響を与えるさまざまな生化学的応答を引き起こします29。特に、機械感受性タンパク質は、妊娠中ずっと合胞体栄養芽細胞によって発現されます28。さらに、この研究は、組織表面の微絨毛がこの文脈に関与している可能性があることを示唆しています28。
検討に値する追加の視点は、フローに対する細胞応答におけるミトコンドリアの潜在的な役割です。例えば、内皮細胞では、ミトコンドリアは環境刺激に対する細胞応答のシグナル伝達因子として機能する30。TEM3を介して静的培養組織に観察された脂質滴の蓄積の増加は、ミトコンドリア機能障害によるアポトーシス誘導と関連している31。根本的なメカニズムと重要な要因を明らかにし、それらを下流のシグナル伝達経路に結び付けるには、さらなる調査が必要です。この調査は、組織がせん断応力をどのように認識し、反応するかについての理解を深め、培養中の絨毛外植片の生存率と完全性の向上につながる可能性があります23。
いくつかの重要なプロトコルステップを繰り返し、慎重に実行する必要があります。胎盤分娩後、組織はできるだけ早く培養する必要があります。外植片の準備中は、目に見える梗塞のある領域を避けることが重要です。圧迫を防ぐために、鉗子で外植片を優しく扱うことが重要です。施術中は組織を液体で覆い、迅速に行うことをお勧めします。
この研究は、提示された流れシステム内の正確なせん断応力を特定することができないことを認識することが重要であり、これは将来の調査の限界として考慮されるべきである3,23。それにもかかわらず、特定の胎盤絨毛の正確な流速とせん断応力は、絨毛間空間の幾何学的特性、この空間内の絨毛の位置、母体の螺旋動脈と子宮静脈への近接性と角度など、多くのパラメータの影響を受けることを認識することが重要です3,19,23,32 .胎盤の幾何学的構造の複雑さは個人によって異なるため、同様に考慮に入れる必要があります23,32。絨毛間腔32内の血流を推定する数理モデルと、合胞体栄養膜19,28に対する壁せん断応力の計算は、すでに存在する。興味深いことに、ある研究では、合胞体栄養芽細胞のせん断応力は妊娠初期と比較して妊娠第3期の方が低いと予測され28、別の研究では合胞体栄養膜に対する空間的に不均一な壁せん断応力が実証されました19。特定の胎盤絨毛の正確な流速とせん断応力を決定することは、依然として課題です3,19,23,32。このような計算は、将来の調査のためにせん断応力範囲の近似値を提供しますが、継続的な解剖学的調整と最適化が必要になる場合があります23。さらに、今後の研究では、絨毛間空間の複雑な形状を説明する新しい洗練されたフロースルー培養技術と、実験あたりの検体数を増やすための戦略が開発される可能性があります3。フローシステムの継続的な進歩と開発が予想され、代替フローチャンバーを採用する可能性があります(Brugger et al.、未発表データ、2023年)。
結論として、この研究は、培養された絨毛外植片の構造的完全性を維持する、簡単に実装可能なex vivoフロー培養技術を実証することにより、堅牢な基盤を築きます。これは、胎盤機能生物学研究における動的手法の重要性を強調し、フロー培養システムのさらなる進歩と新しいアイデアや仮説の生成への道を開きます3,23。
開示事項
著者らは、利益相反がないことを宣言します。
謝辞
著者らは、ベッティーナ・アムトマンとペトラ・ウィンクラーの組織サンプリングに関する優れた技術サポートに感謝しています。この研究は、オーストリア科学基金FWF(DOC 31-B26)とオーストリアのグラーツ医科大学から、妊娠中の炎症性疾患博士課程プログラム(DP-iDP)を通じて資金提供を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 6-well plates | NUNC, ThermoFisher Scientific, Waltham, MA, USA | 140675 | |
| Alexa Fluor 555 goat-anti-mouse | ThermoFisher Scientific, Waltham, MA, USA | A21422 | Diluted in PBS, 1:200 |
| antibody diluent | Dako, Santa Clara, CA, USA | S3022 | |
| anti-β-actin (AC-15) | Abcam, Cambridge, UK | ab6276 | Stock concentration: 2.1 mg/mL, diluted in antibody diluent, 1:10,000 |
| Bioreactor TEB500 | TEB500, EBERS Medical Technology SL, Zaragoza, Spain | Serial Number: TEB505 / 1000EW/ 117 | |
| CD34 Class II (QBEnd-10) | Dako, Santa Clara, CA, USA | M7165 | Stock concentration: 12 mg/l, diluted in antibody diluent, 1:500 |
| CPD 030 critically point dryer | Bal-Tec, Balzers, Liechtenstein) | Critically point dryer | |
| DAPI | ThermoFisher Scientific, Waltham, MA, USA | D21490 | Diluted in PBS, 1:1000 |
| Ebers TEB505 Series Software | TEB500, EBERS Medical Technology SL, Zaragoza, Spain | Series Software 1.4 | |
| Endothelial Cell Growth Medium MV | PromoCell PC-C-22120, Heidelberg, Germany; | C-22120 | Used without EGCS/h and FCS, any other medium suitable for the tissue can be used |
| Excelsior AS Tissue Processor | ThermoFisher Scientific, Waltham, MA, USA | ||
| Exosome-depleted fetal bovine serum | Gibco by Life Technologies, ThermoFisher Scientific, Waltham, MA, USA | A2720803 | |
| Histolab Clear | Histolab, Askim, Sweden | 14250-TY | |
| Hydrogen Peroxide Block | ThermoFisher Scientific, Waltham, MA, USA | TA125H202Q | |
| Kaiser’s Glycerin Gelatine | Merck, Darmstadt, Germany | 1092420100 | |
| Leica DM 6000 B microscope | Leica, Wetzlar, Germany | Equipped with an Olympus DP 72 Camera | |
| Leica UC7 ultramicrotome | Leica Microsystems, Vienna, Austria) | ||
| Metal plate with needles | In-house construction | ||
| Microtome | Microtome Microm HM 355 S, ThermoFisher Scientific, Waltham, MA, USA | ||
| Microwave oven | Miele, Guetersloh, Germany | ||
| Olympus microscope (BX63) | Olympus, Hamburg, Germany | Serial Number: 1A52421 | |
| PBS | ThermoFisher Scientific, Waltham, MA, USA | 10010015 | |
| Penicillin/Streptomycin | Gibco by Life Technologies, ThermoFisher Scientific, Waltham, MA, USA | 2585627 | |
| Primary antibody enhancer | ThermoFisher Scientific, Waltham, MA, USA | TL-125-PB | |
| ProLong Gold Antifade Reagent | ThermoFisher Scientific, Waltham, MA, USA | P36934 | |
| Pumping tube | Tygon, Bartelt, Graz, Austria | 6.078 175 | 1.02 mm diameter |
| QV500 Flow chambers | Kirkstall Ltd., Quasi Vivo, North Yorkshire, UK | QV500 | Other chambers would work as well |
| SCD 500, sputter coater | Bal-Tec, Balzers, Liechtenstein | Sputter coater | |
| Substrate amino-ethyl carbazole, AEC substrate kit | Abcam, Cambridge, UK | ab64252 | |
| Superfrost Plus slides | Menzel-Glaeser, Braunschweig, Germany | J1800AMNZ | |
| Syringe Filter | Corning Incorporated, NY, USA | 431219 | 0.2 µm Pore SFCA Membrane, air filter for the reservoir bottle |
| TAAB epoxy resin | Agar Scientific, Stansted, Essex, UK | T001 | |
| UltraVision LP-Detection System HRP-Polymer | ThermoFisher Scientific, Waltham, MA, USA | TL-125-HL | |
| UltraVision Protein Block | ThermoFisher Scientific, Waltham, MA, USA | TA125BPQ | |
| Zeiss EM 900 transmission electron microscope | Zeiss, Oberkochen, Germany | ||
| Zeiss Sigma 500 field emission scanning electron microscope | Zeiss, Cambridge, UK | Used with a back-scattered electron detector at 5 kV acceleration voltage |
参考文献
- Villee, C. A. The metabolism of human placenta in vitro. Journal of Biological Chemistry. 205 (1), 113-123 (1953).
- Miller, R. K., et al. Human placental explants in culture: Approaches and assessments. Placenta. 26 (6), 439-448 (2005).
- Kupper, N., Pritz, E., Siwetz, M., Guettler, J., Huppertz, B. Placental villous explant culture 2.0: flow culture allows studies closer to the in vivo situation. International Journal of Molecular Sciences. 22 (14), 7464 (2021).
- Reti, N. G., et al. Effect of high oxygen on placental function in short-term explant cultures. Cell and Tissue Research. 328 (3), 607-616 (2007).
- Simán, C. M., Sibley, C. P., Jones, C. J. P., Turner, M. A., Greenwood, S. L. The functional regeneration of syncytiotrophoblast in cultured explants of term placenta. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 280 (4), R1116-R1122 (2001).
- Toro, A. R., et al. Leptin is an anti-apoptotic effector in placental cells involving p53 downregulation. PLoS ONE. 9 (6), e99187 (2014).
- Morley, L. C., Debant, M., Walker, J. J., Beech, D. J., Simpson, N. A. B. Placental blood flow sensing and regulation in fetal growth restriction. Placenta. 113, 23-28 (2021).
- Wang, Y. Z. S., Wang, Y., Zhao, S. Placental blood circulation. Vascular biology of the placenta. Chapter 2, (2010).
- Huppertz, B. The anatomy of the normal placenta. Journal of Clinical Pathology. 61 (12), 1296-1302 (2008).
- Weiss, G., Sundl, M., Glasner, A., Huppertz, B., Moser, G. The trophoblast plug during early pregnancy: a deeper insight. Histochemistry and Cell Biology. 146 (6), 749-756 (2016).
- Burton, G. J., Woods, A. W., Jauniaux, E., Kingdom, J. C. P. Rheological and physiological consequences of conversion of the maternal spiral arteries for uteroplacental blood flow during human pregnancy. Placenta. 30 (6), 473-482 (2009).
- Gude, N. M., Roberts, C. T., Kalionis, B., King, R. G. Growth and function of the normal human placenta. Thrombosis Research. 114 (5-6), 397-407 (2004).
- Wang, Y. Vascular biology of the placenta. Colloquium Series on Integrated Systems Physiology: From Molecule to Function. 2 (1), 1-98 (2010).
- Moser, G., Windsperger, K., Pollheimer, J., de Sousa Lopes, S. C., Huppertz, B. Human trophoblast invasion: new and unexpected routes and functions. Histochemistry and Cell Biology. 150 (4), 361-370 (2018).
- Kupper, N., Huppertz, B. The endogenous exposome of the pregnant mother: Placental extracellular vesicles and their effect on the maternal system. Molecular Aspects of Medicine. 87 (October 2020), 100955 (2022).
- Huppertz, B. IFPA award in placentology lecture: biology of the placental syncytiotrophoblast - myths and facts. Placenta. 31 (SUPPL), S75-S81 (2010).
- Gauster, M., Moser, G., Wernitznig, S., Kupper, N., Huppertz, B. Early human trophoblast development: from morphology to function. Cellular and Molecular Life Sciences. 79 (6), 345 (2022).
- Lecarpentier, E., et al. Fluid shear stress promotes placental growth factor upregulation in human syncytiotrophoblast through the cAMP-pKA signaling pathway. Hypertension. 68 (6), 1438-1446 (2016).
- Lecarpentier, E., et al. Computational fluid dynamic simulations of maternal circulation: wall shear stress in the human placenta and its biological implications. PLOS ONE. 11 (1), e0147262 (2016).
- Miura, S., Sato, K., Kato-Negishi, M., Teshima, T., Takeuchi, S. Fluid shear triggers microvilli formation via mechanosensitive activation of TRPV6. Nature Communications. 6 (1), 8871 (2015).
- Jauniaux, E., et al. Onset of maternal arterial blood flow and placental oxidative stress. The American Journal of Pathology. 157 (6), 2111-2122 (2000).
- Sodha, R. J., Proegler, M., Schneider, H. Transfer and metabolism of norepinephrine studied from maternal-to-fetal and fetal-to-maternal sides in the in vitro perfused human placental lobe. American Journal of Obstetrics and Gynecology. 148 (4), 474-481 (1984).
- Kupper, N. . Extracellular vesicles from advanced placental explant flow culture and their role in preeclampsia [Dissertation]. , (2022).
- Burton, G. J., Fowden, A. L. The placenta: a multifaceted, transient organ. Philosophical Transactions of the Royal Society B: Biological Sciences. 370 (1663), 20140066 (2015).
- Arora, N., Sadovsky, Y., Dermody, T. S., Coyne, C. B. Microbial vertical transmission during human pregnancy. Cell Host & Microbe. 21 (5), 561-567 (2017).
- Cheong, M. L., et al. A Positive feedback loop between glial cells missing 1 and human chorionic gonadotropin (hCG) regulates placental hCGβ expression and cell differentiation. Molecular and Cellular Biology. 36 (1), 197-209 (2016).
- Heisenberg, C. P., Bellaïche, Y. Forces in tissue morphogenesis and patterning. Cell. 153 (5), 948-962 (2013).
- Lee, T. C., Moulvi, A., James, J. L., Clark, A. R. Multi-scale modelling of shear stress on the syncytiotrophoblast: could maternal blood flow impact placental function across gestation. Annals of Biomedical Engineering. 51 (6), 1256-1269 (2023).
- Kluge, M. A., Fetterman, J. L., Vita, J. A. Mitochondria and endothelial function. Circulation Research. 112 (8), 1171-1188 (2013).
- Boren, J., Brindle, K. M. Apoptosis-induced mitochondrial dysfunction causes cytoplasmic lipid droplet formation. Cell Death & Differentiation. 19 (9), 1561-1570 (2012).
- Chernyavsky, I. L., Jensen, O. E., Leach, L. A Mathematical model of intervillous blood flow in the human placentone. Placenta. 31 (1), 44-52 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
JoVEについて
Copyright © 2023 MyJoVE Corporation. All rights reserved