このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
食事誘発性肥満糖尿病マウスにおける十二指腸-空腸バイパス手術
* これらの著者は同等に貢献しました
要約
十二指腸空腸バイパス術(DJB)は、グルコース代謝を改善し、インスリン抵抗性を低下させることができます。ここでは、DJBの安定した信頼性の高いマウスモデルを確立するためのプロトコルを紹介します。
要約
肥満と2型糖尿病の有病率は、世界的な深刻な健康問題です。肥満は、2型糖尿病、心血管疾患、および一部の癌の主要な病原性因子です。肥満手術は、肥満と糖尿病の両方に対して長期的かつ効果的な治療選択肢を提供します。スリーブ状胃切除術(SG)とRoux-en-Y胃バイパス術(RYGB)は、最も人気のある肥満手術として広く認識されています。さらに、いくつかの探索的肥満手術は、有望な治療効果を示しています。十二指腸空腸バイパス術 (DJB) は、ボディマス指数が低い糖尿病患者向けに特別に調整されており、有益な代謝結果を示しています。しかし、その体重に依存しない代謝の利点は、動物モデルが限られているため、完全には理解されていません。この記事では、食事誘発性肥満(DIO)糖尿病マウスでDJB手術を行うための最適化されたケアプロトコルと手術技術について説明します。マウスモデルを使用することで、DJB手術によって誘発される変化の性質をより深く理解すると同時に、関連する臨床診療を容易にすることができます。
概要
肥満と2型糖尿病は、世界で最も多い慢性疾患であり、若年者の間でその有病率が増加しています1。肥満手術は、肥満と糖尿病の最も効果的な治療法であり、長期的な血糖値の安定性を促進しながら、肥満に関連する合併症も改善します2,3。肥満手術にはいくつかの種類があり、胃の容積を減らすか腸の吸収を減らすかによって分類されます。これらには、制限的、吸収不良、および組み合わせ4,5が含まれます。
十二指腸空腸バイパス術 (DJB) は、Rubino と Marescaux によって最初に開発され、2 型糖尿病は胃の容積を減らすのではなく、十二指腸と空腸を接続することで軽減できることを実証しました 6,7。DJBは胃全体を保存し、十二指腸全体と近位空腸をバイパスします。腸は、胆道膵臓、消化器系、および総肢に分けられます6,8。DJBは、Roux-en-Y胃バイパス術(RYGB)、ミニ胃バイパス術、胆膵バイパス術、十二指腸迂回術、DJB plusスリーブ胃切除術9など、肥満手術といくつかの類似点を共有しています。RYGBと比較して、DJBは胃腸吻合を必要としないため、手術時間が短縮され、手術の成功率が向上します。DJBは、グルコース代謝の改善においてRYGBと似ていますが、体重に影響を与えません10。DJB手術後、遠位小腸への迅速な食物供給はグルカゴン様ペプチド-1(GLP-1)の分泌を刺激し、グルコース代謝を改善します11,12。
動物モデルの使用は、代謝経路、細胞経路、および分子経路を理解するために不可欠です。肥満手術の動物モデルは、肥満と糖尿病の根底にある潜在的なメカニズムの理解に貢献しています13,14。しかし、種間の生理学的な違いにより、動物モデル15でヒトの病気を完全に再現することは不可能である。研究目的として利用可能な様々な動物モデルの中で、食餌性肥満(DIO)マウスモデルは、ヒトの肥満およびメタボリックシンドロームに最も近い16。DJB手術にはマウスを選抜し、手術の実現可能性を判断し、さらなる研究のための技術を提供しました。この原稿は、DJB手術の技術的側面と実験の詳細の両方を包括的にまとめたものです。
Access restricted. Please log in or start a trial to view this content.
プロトコル
以下に説明するすべてのプロトコル手順は、承認番号2020112501の下で、南部戦域司令部総合病院の動物管理および使用委員会のガイドラインに従っています。
1. 術前準備全般
注:30匹の6週齢の雄C57BL/6マウスを購入しました。マウスは、12時間の明暗サイクルの下で特定の病原体を含まない(SPF)実験室に収容されました。温度、22±2°C;湿度、55-65%。マウスには水への自由なアクセスが与えられ、肥満を誘発するために6週間にわたって60%kcalの脂肪食が与えられました。40 mg / kgストレプトゾトシンの腹腔内注射を5日間投与して、糖尿病を誘発しました17。30匹のマウスのうち、22匹のマウスがランダムな血糖値>300 mg / dLのスクリーニングを受け、DJB(n = 15)グループと偽手術(n = 7)グループにランダムに割り当てられました。8匹のマウスは、血糖値が標準以下であるため、実験から除外されました。
- 手術の8時間前にマウスを絶食します。手術の2時間前に水を抜いてください。
- 1%ペントバルビタールナトリウム溶液(6 mL / kg)とブプレノルフィン(1 mg / kg)を腹腔内投与します。.鉗子でマウスのつま先や尾に触れ、マウスが明らかなけいれんや震えを示さないようにします。適切な麻酔下では、マウスは酸素補給なしで自由に呼吸することができます。
- マウスを滅菌ボード上の仰臥位に置き、実体顕微鏡下に置きます。目に目の軟膏を塗ります。電気毛布を使用して、手順全体を通してマウスを暖かく保ちます。手術用ガウン、滅菌手袋、オートクレーブ滅菌器具などの滅菌手順を使用してください。
- 偽対照マウスでは、幽門の 1 cm 下にある十二指腸と Treitz の 5 cm 下の空腸にそれぞれ 2 つの切開を行い、切開部を縫合します。
2. 十二指腸空腸バイパス術:外科的処置
- 剣状突起から腹部に脱毛ペーストを塗布して、この領域から毛を取り除きます。クリームを拭き取り、肌がきれいであることを確認します。ヨウ素とアルコール溶液を交互にこすり洗いして、その領域を3回こすります。
- マウスを滅菌ドレープで覆い、操作領域を露出させたままにし、剣状突起から腹部まで2 cmの切開を行います。
- 腹部リトラクターを使用して腹腔を露出させます。濡れた綿棒で腹部の脂肪を押しのけ、肝臓を頭側に移動して胃と腸を完全に露出させます。
- 胃と幽門は肝臓の下にあり、トレイツの靭帯は遠位十二指腸にあります。Treitzの靭帯から5cm遠位の空腸を6-0シルク縫合糸で二重結紮します(図1A)。2つの結紮の中間点で空腸を切断し、空腸の切り株を10-0シルク縫合糸で縫合します(図1B)。
注:腸間膜血管をねじらないでください。 - 近位空腸切開部を腸に沿って空腸まで5cm引っ張って、空腸-空腸吻合を作成します。2つの腸を水平に整列させ、次に10-0シルク縫合糸を使用して側方吻合を作成します(図1C)。
注:手術中は、水分の損失を減らすために、腸を生理食塩水で湿らせてください。これにより、腸が丸まってしまうのを防ぎ、縫合しやすくなります。 - 腸の両端を固定し、切開部を同じ長さに切ります(図1D)。後腸壁の第2層を全層連続縫合糸で縫合します。
注:切開長さは約0.5〜0.6cm、針距離は~0.5mmです。 - 腸の両端を固定し、腸の前壁を縫合します。前壁の第1層を単純な連続縫合糸で縫合し、第2層を水平内反縫合糸で縫合します(図1E-F)。
注:腹腔の感染を防ぐために、腸の内容物を綿棒で綿棒で拭きます。 - 遠位空腸切開部を幽門の1cm下にある十二指腸に引っ張って、十二指腸-空腸吻合を作成します(図1G)。ステップ2.6-2.7と同じ方法で縫合します(図1H-K)。
注:吻合部の漏れを減らすために、吻合部の角にある縫合糸を確認してください。 - マイクロ鉗子で腸を結紮し、マイクロハサミで腸を切断します。十二指腸-空腸吻合の遠位端から2 mmの6-0シルク縫合糸で十二指腸を二重結紮します。マイクロハサミで中間点を切断し、10-0シルク縫合糸で切り株を縫合します(図1L)。
注:胃十二指腸血管は膵臓の頭部に対して垂直に分岐し、幽門に隣接しているため、横断面の血管を注意深く探索する必要があります。総胆管と十二指腸の合流点は、膵臓や総胆管を傷つけないように注意しながら位置していました。 - 腹腔内を30°Cの生理食塩水ですすいでください。腸を腹腔に戻します。筋肉と皮膚を別々に6-0シルクで縫合します。その後、ヨードフォアで皮膚を消毒します。
- 手術後、脱水症状を防ぐために、背中に30°Cの生理食塩水(30mL/kg)を皮下注射します。感染を防ぐために、ペニシリン(10 mg / kg)を筋肉内に注射します。.
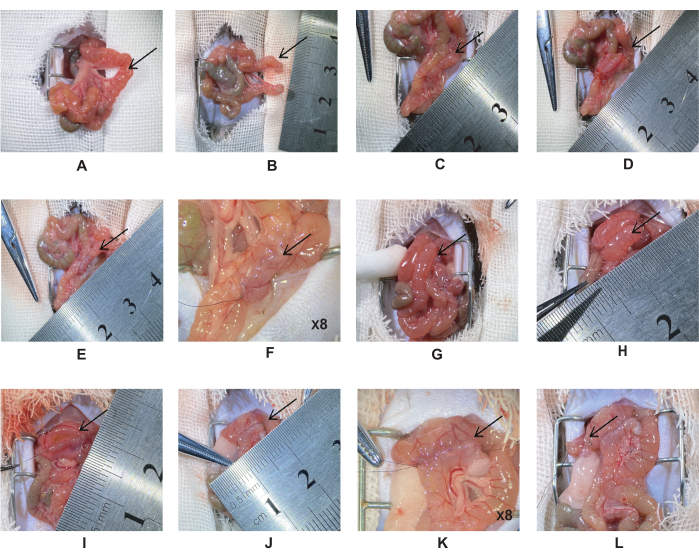
図1:十二指腸-空腸バイパス術 (A) トレイツの靭帯から5cm遠位の空腸の位置。(B)空腸を6-0シルクで二重結紮し、結紮糸の中央を切り取ります。(C)空腸-空腸吻合。(D)0.5〜0.6cmの切開を行い、後壁を縫合します。(E-F)完全な空腸-空腸吻合。(G)遠位空腸を幽門の1cm下の十二指腸に引っ張ります。(H)十二指腸-空腸吻合。(I)十二指腸-空腸吻合を0.5〜0.6cmの切開で切断し、後壁を単純な連続縫合で縫合します。(J-K)完全な十二指腸-空腸吻合。(L)遠位から十二指腸-空腸吻合まで2mmのところで、十二指腸を6-0シルクで二重結紮し、結紮糸の中央を切断します。 この図の拡大版を表示するには、ここをクリックしてください。
3. 術後ケア全般
- 手術後、低体温症を防ぐためにマウスを電気毛布の上に置きます。マウスが完全に目覚めるまで自由に這い回ってからケージに戻ります。
- 術後の日には、食事と水を制限し、マウスの背中に2mLの生理食塩水を皮下注射します。術後最初の日に、10mLの10%ブドウ糖と機能性飲料(1:1の比率)を食事なしで与え、生理食塩水1mLを皮下に注射します。
- 術後2日目と3日目に、マウスに20mLの10%グルコースと機能性飲料の混合物を与えてください。4日目以降、マウスに純水と高脂肪食を与えます。移行栄養は、術後の回復状態に応じて、溶液、半液体、または固形食品の順序で実行する必要があります。
- 術後鎮痛:ブプレノルフィン(0.1 mg / kg)を1日目から3日目まで12時間ごとに注射し、その後5日目まで1日1回注射します。.
- 手術後、マウスの摂食条件、活動、糞便、および創傷治癒を観察します。
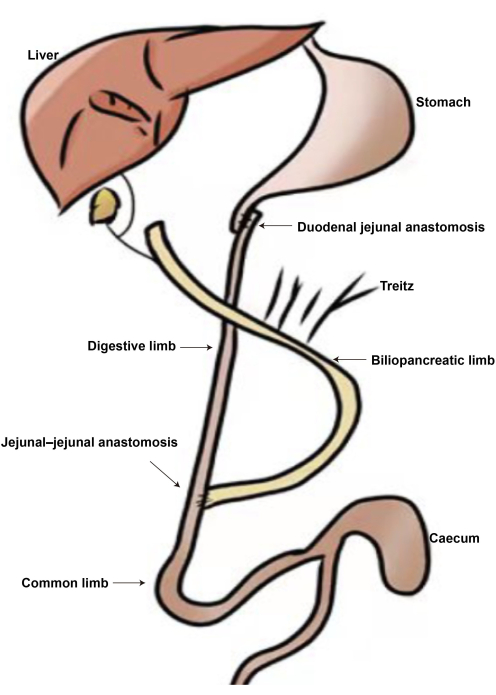
図2:DJB手術の図(A)十二指腸-空腸吻合。(B)空腸-空腸吻合。(C)胆道膵臓の四肢。(D)消化器系の肢。(E)一般的な肢。この図の拡大版を表示するには、ここをクリックしてください。
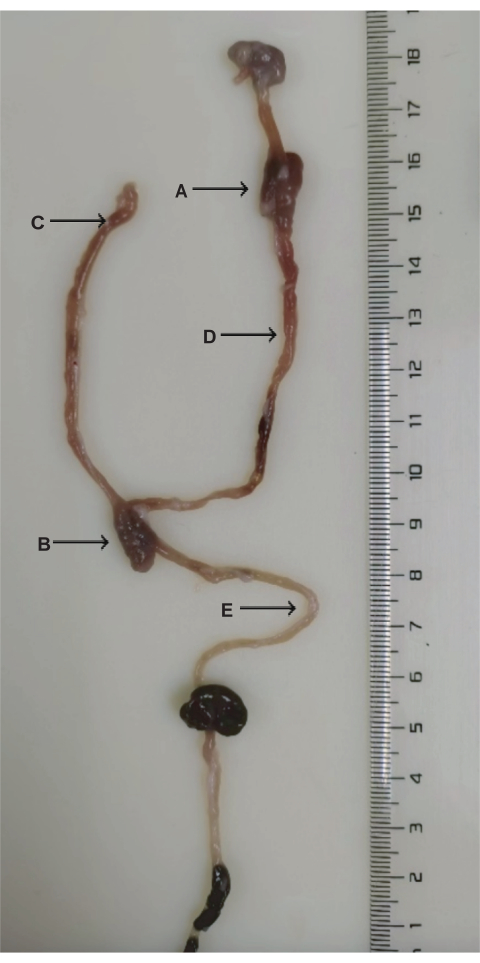
図3:DJB手術の解剖学。 (A)十二指腸-空腸吻合。(B)空腸-空腸吻合。(C)胆道膵臓の四肢。(D)消化器系の肢。(E)一般的な肢。 この図の拡大版を表示するには、ここをクリックしてください。
4. 代謝パラメータの術後評価
- 体重測定
- 測定の8時間前にマウスを絶食します。手術の前後の月曜日に、毎週8週間マウスの体重を量ります。
- 食物摂取量測定
- 各ケージに1匹のマウスを収容します。24時間の前後の各ケージ内の固形食品の量を測定します。2つの値の差は、毎日の食物摂取量を表します。
- ランダムな血糖値測定
- 測定の毎週月曜日の午前8:00に、マウスの尾の先端から一滴の血液を採取し、それを血糖値計に挿入されたグルコースストリップに適用します。
- 経口ブドウ糖負荷試験
- DJB手術の8週間後、経口ブドウ糖負荷試験の前にマウスを8時間絶食します。マウスの尾の先端から一滴の血液を採取し、それを血糖値計に挿入されたグルコースストリップの上に置きます。20%D-グルコース(2 g / kg)の経口投与を行います。.強制経口投与後0、15、30、60、90、120、150、180分後の血糖値を測定します。
Access restricted. Please log in or start a trial to view this content.
結果
一般的な条件
DJB手術の平均手術時間は84.5±2.6分でした。15匹のマウスがDJB手術を受け、9匹のマウスが生存しました。 表1に示すように、死亡の大部分は手術中またはその後の7日間に発生しました。術後死亡因は術後1日目の出血(n=2)、術後4日目の吻合部漏出(n=1)、術後7日目の吻合部閉塞(n=2)、術後3週間後の原因不明(n=1)であった。
Access restricted. Please log in or start a trial to view this content.
ディスカッション
1953 年、Varco et al.18 は、肥満手術の始まりとして最初の空腸回腸バイパス術を実施しました。それ以来、外科医によって数多くの肥満手術が行われてきました。これらの手術は、体重減少と代謝合併症の改善をもたらしました4,19,20。さらに、1967年にメイソンと伊藤2...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者は、利益相反を宣言しません。
謝辞
本研究は、中国広東省科学技術計画プロジェクト(第202002020069号)の助成を受けて行われました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Abdominal retractor | F.S.T | 17000-03 | Colibri Retractor -3cm,retractor range 1.5cm/3cm long |
| 1% sodium pentobarbital solution | Guangzhou Chemical Reagent Factory | / | Dissolved 500mg of pentobarbital sodium powder in 50ml of normal saline to obtain 1% pentobarbital sodium solution. |
| Benzylpenicillin sodium for Injection | North China Pharmaceutical Company Ltd. | F2062121 | Penicillin |
| Buprenorphine | Guangzhou Chemical Reagent Factory | / | Analgesia |
| Buprenorphine | Guangzhou Otsuka Pharmaceutical Co., Ltd | / | Analgesic |
| Citric acid-sodium citrate buffer | LEAGENE | R00522 | Buffer solution |
| Cotton buds | HaoZheng Medical | 60220610 | Cotton swabs |
| Depilatory paste | Veet | AAPR-S222 | Hair removal cream |
| Ear tag | ZEYA | SUS304 | Ear-mark |
| Electric blanket | ZOSEN | ZS-CWDRT | Heat pad |
| Electronic scale | WETTLER TOLEDO | 20060902-6 | Measure the weight |
| Enteral nutritional powder | Abbott Laboratories | / | Nutrition powder |
| Eye ointment | Guangzhou Otsuka Pharmaceutical Co., Ltd | / | Protect the eyes |
| Glucometer | Roche | 6993788001 | Assess blood glucose |
| Graphpad Prism version 9.4.1 | GraphPad Software | version 9.4.1 | Software for statistical analysis |
| High-fat diet (High Fat [60FDC] Purified Rodent Diet) | Dyets | 112252 | 60kcal% High Fat Diet |
| Micro Forceps | Jinzhong Medical | 18-1140 | Micro forceps |
| Micro needle holder | Jinzhong Medical | EMT-160-Z | Needle holder |
| Micro Scissors | Jinzhong Medical | YBC010 | Micro scissors |
| Microscope camera | LAPSUN | E 2000 | Video |
| Ophthalmic scissors | Jinzhong Medical | Y00030 | Surgical scissors |
| Pentobarbital | Guangzhou Chemical Reagent Factory | / | Narcosis |
| Sodium chloride Injection | Guangzhou Otsuka Pharmaceutical Co., Ltd | B21L0301 | NaCl 0.9% |
| Stereo microscope | ZEISS | Stemi 305 | Binocular stereomicroscope |
| Streptozotocin | Sigma | S110910-1g | STZ |
| Suture line | LINGQIAO SUTURE | ZS-LQPMRZ5/0 | Prolene 6/0,Prolene 10/0 |
| Tissue forceps | Jinzhong Medical | H1701 | Surgical forceps |
参考文献
- Lascar, N., Brown, J., Pattison, H., Barnett, A. H., Bailey, C. J., Bellary, S. Type 2 diabetes in adolescents and young adults. Lancet Diabetes Endocrinol. 6 (1), 69-80 (2018).
- Song, Y., Zhao, F. Bibliometric analysis of metabolic surgery for type 2 diabetes: current status and future prospects. Updates Surg. 74 (2), 697-707 (2022).
- Cummings, D. E., Rubino, F. Metabolic surgery for the treatment of type 2 diabetes in obese individuals. Diabetologia. 61 (2), 257-264 (2018).
- Buchwald, H. The evolution of metabolic/bariatric surgery. Obes Surg. 24 (8), 1126-1135 (2014).
- Akalestou, E., Miras, A. D., Rutter, G. A., le Roux, C. W. Mechanisms of weight loss after obesity surgery. Endocr Rev. 43 (1), 19-34 (2022).
- Rubino, F., et al. The mechanism of diabetes control after gastrointestinal bypass surgery reveals a role of the proximal small intestine in the pathophysiology of type 2 diabetes. Ann Surg. 244 (5), 741-749 (2006).
- Rubino, F., Marescaux, J. Effect of duodenal-jejunal exclusion in a non-obese animal model of type 2 diabetes: a new perspective for an old disease. Ann Surg. 239 (1), 1-11 (2004).
- Akalestou, E., et al. Establishing a successful rat model of duodenal- jejunal bypass: A detailed guide. Lab Anim. 53 (4), 362-371 (2019).
- Yu, H. H., Hsieh, M. C., Wu, S. Y., Sy, E. D., Shan, Y. S. Effects of duodenal-jejunal bypass surgery in ameliorating nonalcoholic steatohepatitis in diet-induced obese rats. Diabetes Metab Syndr Obes. 12, 149-159 (2019).
- Garciacaballero, M., Navarrete, S., Favretti, F., Celik, A., Del Castillo, D. Diabetes surgery in type 2 BMI 24-29 vs IMC 30-34 diabetic patients: is there differences among restrictive, malabsorptive and gastric bypass procedures. Nutr Hosp. 28 (2), 23-30 (2013).
- Vidal, J., Jiménez, A. Diabetes remission following metabolic surgery: is GLP-1 the culprit. Curr Atheroscler Rep. 15 (10), 357(2013).
- Speck, M., Cho, Y. M., Asadi, A., Rubino, F., Kieffer, T. J. Duodenal-jejunal bypass protects GK rats from {beta}-cell loss and aggravation of hyperglycemia and increases enteroendocrine cells coexpressing GIP and GLP-1. Am J Physiol Endocrinol Metab. 300 (5), E923-E932 (2011).
- Ashrafian, H., et al. Metabolic surgery: an evolution through bariatric animal models. Obes Rev. 11 (12), 907-920 (2010).
- Rao, R. S., Rao, V., Kini, S. Animal models in bariatric surgery--a review of the surgical techniques and postsurgical physiology. Obes Surg. 20 (9), 1293-1305 (2010).
- Im, Y. R., et al. A systematic review of animal models of NAFLD finds high-fat, high-fructose diets most closely resemble human NAFLD. Hepatology. 74 (4), 1884-1901 (2021).
- Kleinert, M., et al. Animal models of obesity and diabetes mellitus. Nat Rev Endocrinol. 14 (3), 140-162 (2018).
- Furman, B. L. Streptozotocin-induced diabetic models in mice and rats. Curr Protoc. 1 (4), e78(2021).
- Buchwald, H., Varco, R. L., Moore, R. B., Schwartz, M. Z. Intestinal bypass procedures. Partial ileal bypass for hyperlipidemia and jejunoileal bypass for obesity. Curr Probl Surg. , 1-51 (1975).
- DeMaria, E. J. Bariatric surgery for morbid obesity. N Engl J Med. 356 (21), 2176-2183 (2007).
- Bolling, C. F., Armstrong, S. C., Reichard, K. W., Michalsky, M. P. Metabolic and bariatric surgery for pediatric patients with severe obesity. Pediatrics. 144 (6), e20193224(2019).
- Mason, E. E. Gastric bypass for morbid obesity. Surg Annu. 11, 99-126 (1979).
- Cheng, Y., et al. Sleeve gastrectomy with bypass of proximal small intestine provides better diabetes control than sleeve gastrectomy alone under postoperative high-fat diet. Obes Surg. 29 (1), 84-92 (2019).
- Rubino, F., et al. The role of the small bowel in the regulation of circulating ghrelin levels and food intake in the obese Zucker rat. Endocrinology. 146 (4), 1745-1751 (2005).
- Zachariah, P. J., et al. Compared to sleeve gastrectomy, duodenal-jejunal bypass with sleeve gastrectomy gives better glycemic control in T2DM patients, with a lower β-cell response and similar appetite sensations: mixed-meal study. Obes Surg. 26 (12), 2862-2872 (2016).
- Jiang, B., et al. Role of proximal intestinal glucose sensing and metabolism in the blood glucose control in type 2 diabetic rats after duodenal jejunal bypass surgery. Obes Surg. 32 (4), 1119-1129 (2022).
- Han, H. F., et al. Duodenal-jejunal bypass increases intraduodenal bile acids and upregulates duodenal SIRT1 expression in high-fat diet and streptozotocin-induced diabetic rats. World J Gastroenterol. 28 (31), 4338-4350 (2022).
- Yan, S., et al. Reduction of intestinal electrogenic glucose absorption after duodenojejunal bypass in a mouse model. Obes Surg. 23 (9), 1361-1369 (2013).
- Arble, D. M., et al. Metabolic comparison of one-anastomosis gastric bypass, single-anastomosis duodenal-switch, Roux-en-Y gastric bypass, and vertical sleeve gastrectomy in rat. Surg Obes Relat Dis. 14 (12), 1857-1867 (2018).
- Liang, Y., et al. Duodenal-jejunal bypass surgery reverses diabetic phenotype and reduces obesity in db/db Mice. Curr Chem Genom Transl Med. 11, 41-49 (2017).
- Barataud, A., et al. Absence of role of dietary protein sensing in the metabolic benefits of duodenal-jejunal bypass in the mouse. Sci Rep. 7, 44856(2017).
- Close-up on lab animal microsurgery. Lab Anim (NY). 35 (1), 43(2006).
- Couceiro, J., Castro, R., Tien, H., Ozyurekoglu, T. Step by step: microsurgical training method combining two nonliving animal models. J Vis Exp. (99), e52625(2015).
- Nasser, K. M., Wahba, H. A., Kamal, E., El-Makhzangy, A. M., Bahaa, N. Animal model for training and improvement of the surgical skills in endolaryngeal microsurgery. J Voice. 26 (3), 351-357 (2012).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved