イオン半導体シーケンシングプラットフォームに基づく胃癌における多遺伝子一塩基多型検出
要約
このプロトコルは、イオン半導体シーケンシングプラットフォームに基づいて、胃がんサンプルの一塩基多型を検出するために必要な全体的な実験室手順を提案します。ターゲット配列、ライゲーティングアダプター、ライブラリの増幅と精製、および品質管理基準についても詳しく説明します。
要約
胃がんは一般的な不均一な腫瘍です。ほとんどの患者は診断時に進行胃がんを患っており、多くの場合、化学療法が必要です。5-フルオロウラシル(5-FU)は治療に広く使用されていますが、その治療感度と薬物耐性はまだ決定する必要があり、個別化された投与の重要性が強調されています。遺伝薬理学は、個別化治療の臨床実施を導くことができます。一塩基多型(SNP)は、遺伝子マーカーとして、適切な化学療法レジメンと投与量の選択に寄与します。一部のSNPは、5-FUの治療標的である葉酸代謝に関連しています。 メチレンテトラヒドロ葉酸レダクターゼ (MTHFR) rs1801131 および rs1801133、 ジヒドロ葉酸レダクターゼ (DHFR) rs1650697 および rs442767、 メチオニン合成酵素 (MTR) rs1805087、 γ-グルタミル加水分解酵素 (GGH) rs11545078 および 溶質キャリアファミリー 19 メンバー 1 (SLC19A1) rs1051298 は、さまざまな種類の癌および抗葉酸抗腫瘍薬で調査されています。5-FUのアプリケーション。イオントレント次世代半導体シーケンシング技術は、胃がん関連のSNPを迅速に検出することができます。DNA鎖で塩基が伸長するたびに、H+ が放出され、局所的なpH変化を引き起こします。イオンセンサーはpH変化を検出し、化学信号をデジタル信号に変換して、合成によるシーケンシングを実現します。この技術は、サンプル要件が低く、操作が簡単で、コストが低く、シーケンシング速度が速いため、SNPによる個別化化学療法の指導に役立ちます。
概要
胃がんは、世界の公衆衛生の分野で大きな負担となっています。国際がん研究機関(IARC)が発行した「Global Cancer Statistics 2020」によると、胃がんはがんと診断されるがんの第5位、がん関連死の第4位の原因となっています。世界的に見ると、東アジアにおける年齢標準化率の発生率は、男女ともに最も高くなっています1。胃がんの発生は潜行性であり、これは患者が初期段階で明白で特定の症状を持っていないことが多いことを意味します。すべての胃がん患者のうち、定期的なスクリーニングが行われていない国では、患者の80%〜90%が腫瘍が手術できない進行期に診断されるか、手術後5年以内に再発します2。
進行性または転移性胃がんの場合、化学療法が主な治療法であり、患者の生存率と生活の質を向上させることができます。転移性胃がん患者の初期治療では、プラチナ-フルオロピリミジンレジメンが第一選択化学療法レジメンの主要な選択肢です3。フルオロピリミジンには、主に5-フルオロウラシル(5-FU)と、カペシタビンやテガフールなどの経口フルオロピリミジン誘導体が含まれます。5-FUの主な標的は、DNA合成を阻害し、腫瘍組織の成長を遅らせる葉酸代謝関連酵素です。薬物の副作用はその有用性を制限し、下痢、粘膜炎、骨髄抑制、手足症候群などが最も頻繁に副作用として挙げられます。治療反応と薬物副作用は、葉酸代謝経路の因子と密接に関連していることが報告されています。.特に、rs1801131のホモ接合変異は、手足症候群の指標として同定されています(p = 4.1 x 10-6、OR = 9.99、95%CI:3.84-27.8)4。フルオロピリミジンは抗がん化学療法に広く使用されていますが、その化学療法抵抗性は一般的な緊急事態であり、胃がん治療の治療に失敗を引き起こします。たとえば、5-FUのみで治療された進行性結腸直腸癌の患者では、全体的な奏効率はわずか10%〜15%です。また、フルオロピリミジンには無視できない毒性があります。5-FUによって誘発される毒性反応には、主に下痢、手足症候群、口内炎、好中球減少症、血小板減少症、神経毒性、さらには死が含まれます6。フルオロピリミジンで治療された患者の10%〜30%に重度の治療関連毒性が発生し、これらの患者の0.5%〜1%に致命的な毒性が発生します7。
進行胃がん患者を対象としたQOL研究では、5-FUベースの化学療法を受けた患者の奏効率は50%未満であったことが明らかになった8。したがって、5-FUベースの化学療法の感受性に関連する要因を理解することは、毒性を最小限に抑えながら奏効率と有効性を最大化するための正確な治療にとって特に重要です。5-FUが葉酸塩代謝と密接に関連していることを考えると、葉酸代謝経路における酵素の遺伝的変異が要因の1つである可能性があります。ヒトの配列変動の約90%は、一塩基多型(SNP)として知られるDNAの一塩基変異に起因しています9。SNPが葉酸代謝の酵素特性を変化させると、胃がん患者におけるフルオロウラシルに対する有効性、毒性、および化学療法抵抗性に個人差が生じる可能性があります。
メチレンテトラヒドロ葉酸レダクターゼ(MTHFR)は、主に5,10-メチレンテトラヒドロ葉酸(5,10-MTHF)を5-メチルテトラヒドロ葉酸に変換するために使用されます。5-FUの代謝物である5-FdUMPは、5,10-MTHFおよびチミジル酸シンターゼ(TS)と不活性三元を形成し、TSの活性を阻害し、dTMP10の欠乏を引き起こします。5,10-MTHFの蓄積は、MTHFRの活性と相関するTSに対する5-FUの阻害効果を高めることができます。 MTHFR rs1801131およびrs1801133は最も一般的な多型であり、酵素活性の低下(rs1801133の75%の減少とrs181131の30%の減少)および5,10-MTHF11の蓄積に関連しています。
ジヒドロ葉酸レダクターゼ(DHFR)は、葉酸塩の代謝とDNA合成における重要な酵素です。DHFRは、NADPHを使用してジヒドロ葉酸をテトラヒドロ葉酸(THF)に還元し、これは1炭素単位を運ぶために使用されます。 DHFR のSNPは、その発現に影響を及ぼし、THFの活性と存在量を変化させ、さらに葉酸代謝と5-FUの感受性に影響を与える可能性があります。 DHFR rs1650697 点変異は 、DHFR 遺伝子の主要なプロモーターに発生し、DHFR 発現を増加させます12。ある研究では、rs442767 がペメトレキセドやメトトレキサートなどの抗葉酸抗腫瘍薬の有効性と毒性に関連していることがわかりました。SNP rs442767に関しては、 GT 遺伝子型は、各親からの相同染色体上の同じ遺伝子座にG対立遺伝子とT対立遺伝子が遺伝することを意味します。同様に、 遺伝子型GG および TT は、それぞれ2つのG対立遺伝子または2つのT対立遺伝子のいずれかの遺伝を示します。遺伝子型 GT+TT と比較して、 GG は無イベント生存期間の短縮とリスクの増加に関連しています13。これは、rs442767が5-FUに特定の潜在的な影響を与える可能性があることを示唆しています。
メチオニン合成酵素(MTR)は、葉酸代謝に重要な役割を果たすホモシステインのメチオニンへの再メチル化を触媒します。 MTR rs1805087は、 MTR 遺伝子の最も一般的な多型です。 MTR rs1805087は、タンパク質の潜在的に機能的な部位でアスパラギン酸をグリシンに置き換え、MTRの活性を低下させる可能性があります。G対立遺伝子の被験者は、血漿葉酸レベルが上昇し、血漿ホモシステインレベルが14減少しました。それどころか、ある研究では、rs1805087は5-FUの有効性と統計的に有意な関連がないことが示されました。しかし、この研究は結腸直腸癌に焦点を当てており、サンプルサイズは小さかった。rs1805087 と胃がん患者における 5-FU の有効性との関係は、まだ調査されていません15。
Γ-グルタミル加水分解酵素(GGH)は、細胞内の葉酸濃度を調節するリソソーム酵素です。プテロイルグルタミン酸は、プテリン、p-アミノメチル安息香酸、グルタミン酸からなる葉酸の同義語です。生物には、モノグルタミン酸葉酸とポリグルタミン酸葉酸の2つの形態の葉酸があります。THF-ポリグルタミン酸は、GGHによって酵素的にモノグルタミン酸葉酸に変換され、モノグルタミン酸(mono-Glu)またはジ-グルタミン酸(di-Glu)のいずれかを連続的に放出します16。局所進行胃がん患者におけるGGH発現に関する研究では、GGH発現が高いと5,10-MTHFおよびTSが減少する可能性があることが示されました。これは、これらの患者でTS阻害効果を達成するために必要なのは少量の5-FUであることを意味します17。GGは、5-FUのプロドラッグであるS-1による術後補助化学療法で治療された局所進行胃癌患者の予後バイオマーカーであり、葉酸18の細胞内恒常性を維持する上で重要な役割を果たしています。 GGH rs11545078 はミスセンスバリアントであり、Thr-127 を Ile-127 に変更します。GGHの基質特異性に焦点を当てた研究は、rs11545078が野生型と比較して、メトトレキサートのより高いKmと低い触媒効率をもたらし、その構造が葉酸に類似していることを示唆しています19。rs11545078 と 5-FU の臨床転帰との関係を一緒に探ることは、薬剤耐性を理解するための有望な戦略です。
溶質キャリアファミリー19メンバー1(SLC19A1)は、還元型葉酸トランスポーターとも呼ばれ、哺乳動物細胞がde novo合成する能力を欠いている還元葉酸を輸入する典型的な促進膜貫通タンパク質であり、5-FUに対する腫瘍の応答を推定することが認められています20。しかし、5-FUとSLC19A1多型との関連については、いくつかの研究しか行われていない21。葉酸類似体であるペメトレキセドを投与された非小細胞肺がんの患者では、SLC19A1遺伝子上のrs1051298がすべての副作用のリスクを高め、全生存期間を短縮する一因となりました22,23。SLC19A1 rs1051298 は、葉酸代謝に関する 3' 非翻訳領域変異体であり、5-FU 療法に関する個人差の一部を説明するのに役立つ可能性があります。ここでの目的は、rs1051298と5-FU耐性との関連を評価することです 胃がん患者の間で。
半導体シーケンシングに基づくキットは、 in vitro での定性的遺伝子検出に使用され(図1)、5つの遺伝子、 MTHFR 遺伝子のrs1801131およびrs1801133変異、 DHFR 遺伝子のrs1650697およびrs442767変異、 MTR 遺伝子のrs1805087変異、 GGH 遺伝子のrs11545078変異、 およびSLC19A1 のrs1051298の5つの遺伝子で7つの選択されたSNPを検出できます胃がん患者の腫瘍組織サンプル中の遺伝子。まず、サンプルの核酸を抽出し、標的フラグメントをPCRによって特異的に増幅しました。ユニバーサルシーケンシングアダプターをDNA断片の両端に追加して、シーケンシングに使用できるライブラリを構築しました。次に、PCRによるシーケンシングライブラリの増幅を行い、シーケンシングテンプレートを形成しました。ポジティブテンプレートは、シーケンシング要件を満たすように濃縮されました。半導体シーケンシングシステムを使用して、DNA鎖を半導体チップの小さな穴に固定します。DNAポリメラーゼは、一本鎖DNAをテンプレートとして、相補的塩基対の原理に従って相補的DNA鎖を合成します。DNA鎖で塩基が伸長するたびに、プロトンが放出され、局所的なpH変化を引き起こします。イオンセンサーがpH変化を検出し、化学信号をデジタル信号に変換することで、塩基をリアルタイムで解釈し、最終的に各DNAセグメントの塩基配列を取得することができます。バイオインフォマティクス解析を使用して、これらの配列をヒトゲノムの参照マップと一致させました。胃がん関連遺伝子が変異すると、それに対応するDNA塩基配列が変化し、関連遺伝子の変異情報を取得します。
この結果により、遺伝子の突然変異状態が表示され、臨床医が適切な化学療法薬の種類と投与量を選択し、胃がん患者の薬剤耐性を予測するための参考資料となります。ただし、検査結果は臨床参照のみを目的としており、患者の個別化治療の唯一の根拠となることは推奨されません。臨床医は、患者の状態、薬物適応症、治療反応、その他の臨床検査指標に基づいて包括的な判断を下す必要があります。
プロトコル
この研究で使用された上部消化管内視鏡検査または手術から得られた胃がんのすべてのプロトコルと組織サンプル (ステップ 1) は、2023 年 7 月 24 日に医療倫理委員会によってレビューされ、承認されました (NFEC-2023-298)。さらに、このプロトコルは、コホート比較を行わずに胃がんの多重遺伝子検出を説明するためだけに設計されているため、患者を含めるか除外するかについて特定の基準を課すことはありません。患者/参加者は、この研究に参加するための書面によるインフォームドコンセントを提供しました。
1. 胃がんの埋め込みブロックの作製
- パラフィンリザーバーとディスペンサー、ウォームプレートとコールドプレートで構成される組織包埋システムを、所定の運用ガイドラインに従って構成します。
- 埋込用に調製した組織を脱水機から抽出し、埋込センターの保管スロットに沈殿させます。
- 組織のサイズに基づいてフィッティング埋め込み型を選択し、組織を覆うのに十分な量の溶融パラフィンを注ぎ、型を温かいプレートに配置します。
- カセットから組織を取り出し、胃粘膜を埋め込み型の基部に対して垂直に配置して、断面面がすべての組織層を切断するようにします。ティッシュを型に位置合わせします。
- カセットを型の上部にセットし、続いてパラフィンを二次的に注ぎ、型を満たします。
- 埋め込まれた型をコールドプレートに置き、パラフィンが固まったら、型から埋め込まれたブロックをはがします。
2. サンプルからの核酸の抽出
- 核酸抽出および精製キットを使用して、パラフィン包埋組織サンプルから核酸を抽出します。
- 核酸定量器を使用して、抽出した核酸を定量します。核酸濃度は2 ng/μLより大きくすることをお勧めします。
注:ここで使用されている材料は、 材料の表に記載されています。
3. シーケンシングライブラリーの調製
- 実験前の準備
- 超清潔な作業台でUVランプをONにし、30分間滅菌します。次に、UVランプをオフにし、ファンをオンにして10分間換気します。
- -20°C±5°Cの冷蔵庫から核酸を取り出し、サンプルID、核酸バーコード、およびサンプルに割り当てられた特定のラベルタグ番号を確認して記録します。検証後、遠心分離管ラックに載せて室温(RT)で溶解し、2,500 x g を固定して待機させた状態で10秒間遠心分離します。
- 標的フラグメントのPCR増幅
- カスタムメイドの胃がん多遺伝子関節検出キットから、胃がんのフラグメントキャプチャ反応溶液、増幅プライマー、融合増幅プライマーを取り、氷の上に置いて溶かします。溶融後に振とうして混合し、10秒間遠心分離し、ヌクレアーゼフリーの水を調製します。詳細なプライマー情報を 表1に示します。
注:キットはまだ市販されていませんので、詳細については認証業者にお問い合わせください。 - 0.2 mL PCR反応チューブを調製し、 補足表1に従って試薬を順番にチューブに加え、ボルテックスして5秒間混合し、2,500 x gを固定して10秒間瞬時に遠心分離します。RNAサンプルはcDNAに逆転写され、その後のライブラリ構築に使用されます。cDNA産物は、 補足表2に従って順番にチューブに添加する必要があります。
- 各反応チューブをサーマルサイクラーに置きます。DNAサンプルについては、 表2に詳述されているように増幅プログラムを実行します。cDNA製品の場合は、 表3に詳述されているように増幅プログラムを実行します。
- カスタムメイドの胃がん多遺伝子関節検出キットから、胃がんのフラグメントキャプチャ反応溶液、増幅プライマー、融合増幅プライマーを取り、氷の上に置いて溶かします。溶融後に振とうして混合し、10秒間遠心分離し、ヌクレアーゼフリーの水を調製します。詳細なプライマー情報を 表1に示します。
- プライマー配列の消化
- プライマー消化酵素を取り出し、氷の上に置いて溶かします。増幅後、上記の反応チューブを取り出し、各チューブに2μLのプライマー消化酵素を加え、総容量が22μLであることを確認します。
- PCRチューブ内で反応溶液をボルテックスして混合し、固定2,500 x gで10秒間瞬時に遠心分離します。
- 各反応チューブをサーマルサイクラーに取り付け、 表4に詳述されているようにプログラムを実行します。
- アダプターの結紮
- アダプター接続試薬を氷の上に置いて溶解します。1.5 mLの微量遠心チューブを調製し、 表5に従って各成分を混合し、アダプター混合物Xとしてマークします。
注:アダプター接続試薬には、P1アダプターと特定のアダプターXが含まれ、1〜48の番号が付けられています。これらは、さまざまなサンプルに一意にタグを付けるように設計されています。特定のアダプターを追加するときは、特定のアダプターの相互汚染を防ぐために、一度に1つのチューブのみを開いてください。希釈した特定のアダプター混合物は、スタンバイ時に-20±5°Cで保存できます。シーケンシングワークフローでは、サンプルは個別に処理されるのではなく、複数のサンプルに特定のアダプターでタグ付けされた複数のサンプルが統合ライブラリに結合され、シーケンシングが行われます。この方法により、特定のアダプター配列に基づいてサンプルをその後に区別することができます。 - 消化したプライマー製品(22μL)をサーマルサイクラーから取り出します。 表6に従って順番に試薬をチューブに加え、ボルテックスし、5秒間混合します。2,500 x gを固定した状態で低速で10秒間遠心分離し、チューブの壁やカバーに明らかな落下がないようにします。
- 反応チューブをサーマルサイクラーに置きます。DNAサンプルについては、 表7に詳述されているように増幅プログラムを実行します。cDNA製品の場合は、 表8に詳述されているように増幅プログラムを実行します。
- アダプター接続試薬を氷の上に置いて溶解します。1.5 mLの微量遠心チューブを調製し、 表5に従って各成分を混合し、アダプター混合物Xとしてマークします。
- ライゲーション産物の精製と増幅
- DNA精製磁気ビーズをあらかじめ2-8°Cの冷蔵庫から取り出し、均等にボルテックスし、2,500 x gを固定して10秒間瞬時に遠心分離します。磁気ビーズを室温で30分間平衡化します。
- 1.5 mLの低吸着微量遠心チューブを調製し、ライゲーション反応の生成物を対応するチューブに移します。
- 45 μLのDNA精製磁気ビーズを各チューブに加え、ボルテックスしてよく混合し、10秒間瞬時に遠心分離し、室温で5分間インキュベートします。
- チューブを磁気ラックに3分間置きます。上清を捨て、ビーズをピペッティングしないようにしてください。
- 新たに調製した75%エタノール300μLを微量遠心チューブに移し、チューブを180°で4回静かに回転させます。溶液が透明になったら、上清をすぐに捨てます。ビーズをピペッティングすることは避けてください。洗濯手順を1回以上繰り返します。
- 1.5 mL 微量遠心チューブをマグネットラックから取り出し、短時間遠心分離します (10 秒、固定 2,500 x g で)。チューブをマグネットラックに戻し、残りの液体をピペットで取り出します。チューブの壁に液体が残っていないことを確認してください。
- 各1.5 mL微量遠心チューブのキャップを開け、ビーズを室温で5分間乾燥させます。ビーズのドライウェット状態に注意してください。磁気ビーズが乾燥した後、表面に水坑がないことを確認してください。磁気ビーズが濡れすぎている場合は、乾燥時間を適切に延長してください。ビーズに亀裂が生じた場合はすぐに蓋を閉め、次のステップに進んでライブラリを増幅および精製します。
- ライブラリーの増幅と精製
- PCR関連試薬をあらかじめ氷上に載せて溶解させ、ボルテックスして10秒間遠心分離します。1.5 mLの微量遠心チューブをマグネットラックから取り出し、 表9 に従ってPCR試薬をチューブにピペットで入れ、キャップを閉じてボルテックスを5秒間閉じます。短時間(10秒)遠心分離して、チューブの壁とカバーに明らかな液体の滴が落ちないようにします。
- 上記の製品を新しいPCRチューブに移します。サーマルサイクラーでサンプルをインキュベートします。DNAサンプルについては、 表10に詳述されているように増幅プログラムを実行します。cDNA製品の場合は、 表11に詳述されている増幅プログラムを実行します。
- 新しい1.5mLの低吸着マイクロ遠心チューブを準備します。インキュベーション後、PCRチューブを10秒間遠心分離します。PCRチューブからEPチューブに製品を移します。
- 各チューブに25 μLのDNA精製磁気ビーズを加えます。ボルテックスしてよく混合し、低速で遠心分離し、室温で5分間インキュベートします。
- チューブを磁気ラックに3分間置き、溶液が透明になるまで待ちます。上清を新しい微量遠心チューブに移します。ビーズをピペッティングすることは避けてください。
- 各チューブに60 μLのDNA精製磁気ビーズを加えます。ボルテックスしてよく混合し、低速で遠心分離し、室温で5分間インキュベートします。
- チューブを磁気ラックに3分間置き、溶液が透明になるまで待ちます。上清を捨てます。ビーズをピペッティングすることは避けてください。
- 新しく調製した75%エタノール300μLをチューブに移し、チューブを180°で4回静かに回転させます。溶液が透明になったら、すぐにピペットで上清を捨てます。ビーズをピペッティングすることは避けてください。洗浄手順を1回繰り返します。
- 1.5 mL の微量遠心チューブをマグネティックラックから取り出し、短時間(10 秒)遠心分離します。チューブを磁気ラックに戻し、残りの液体をピペットで取り出します。チューブの壁に液体が残っていないことを確認してください。
- 1.5 mLチューブのキャップを開け、ビーズをRTで5分間乾燥させます。ビーズのドライウェット状態に注意してください。磁気ビーズが乾燥した後、表面に水垢はありません。磁気ビーズが濡れすぎている場合は、乾燥時間を適切に延長してください。ビーズに亀裂が生じた場合は、すぐに蓋を閉めてください。
- 50μLの溶離液をチューブにピペットで入れ、ボルテックスしてよく混ぜます。短時間(5秒、固定2,500 x g)遠心分離し、チューブを室温で5分間置きます。
- チューブを磁気ラックに3分間置き、溶液が透明になるまで待ちます。液体を新しいチューブに慎重に取り出し、ライブラリ名に印を付けます。
- ライブラリを2〜8°Cの冷蔵庫に一時的に保管して定量測定を待つか、ライブラリを-20±〜5°Cの冷蔵庫に保管して長期保存します。
4. 構築したライブラリーの定量化
- 核酸定量子を使用して、ライブラリを定量します。ライブラリー濃度が0.2 ng/μL≥場合、適格です。それ以外の場合は、ライブラリを再構築します。
- 等量のDNA(またはRNA)を混合し、溶液を定量します。定量結果に従って、次の式を使用して混合溶液を100 pmol / Lに希釈します。
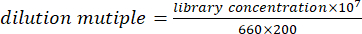
注:別の方法として、式に従ってライブラリを100 pmol/Lに希釈し、蛍光定量PCRで定量することもできます。PCR装置の定量結果に従って、DNA(またはRNA)ライブラリを均等に混合します。 - 100 pmol/L DNAライブラリーとRNAライブラリーを4:1の比率で混合します。DNAとRNAライブラリの混合溶液をコンピュータシーケンシングに使用します。
5. シーケンシング
- シーケンシングは、シーケンシング反応24,25(半導体シーケンシング法)のユニバーサルキットのマニュアルを参照してシーケンシングを行う。
6.サンプルの品質管理
- 胃がんDNAのポジティブ品質管理:胃がんのDNAポジティブコントロールを取り、キットの指示に従ってテストを実施します。コントロールはキットに付属しています。その結果、MTHFR、DHFR、MTR、GGH、SLC19A1遺伝子変異体が検出されることがわかりました。
- 胃がんDNAのネガティブ品質管理:胃がんのDNAネガティブコントロールを取り、キットの指示に従ってテストを実施します。コントロールはキットに付属しています。その結果、野生型のMTHFR、DHFR、MTR、GGH、およびSLC19A1遺伝子が検出されることがわかりました。
注:両方のケースで基準が満たされていることを確認し、そうでない場合は再検出が必要です。
7. データ分析
- 対応するプラグイン(Variant Caller、Coverage Analysis、および Ion Reporter ソフトウェア)を Torrent Suite ソフトウェアで実行して、サンプルの分析結果を取得します。サンプル検出結果は、プラグインの解析結果から判断してください。
代表的な結果
テスト結果の決定は、正の判定値に依存し、これは参照間隔としても認識されます。半導体シーケンシング法を使用して、収集された臨床サンプルを検出します。MTHFR、DHFR、MTR、GGH、SLC19A1遺伝子の突然変異頻度の値が5%≥とき、検出結果は対応する遺伝子の突然変異体となります。突然変異頻度の値が5%<とき、検出結果は対応する遺伝子26の野生型となる。
次の基準を使用して、検出結果が信頼できるかどうかを判断できます。まず、DNAシーケンシング結果の平均カバレッジが500≥、RNAシーケンシング結果のマッピングリードが20000≥場合、テスト結果は信頼できるものです27。それ以外の場合は、再テストすることをお勧めします。第二に、胃がんのDNA陽性品質管理の平均カバレッジは≥500であり、検査結果は MTHFR 遺伝子のrs1801131およびrs1801133変異、 DHFR 遺伝子のrs1650697およびrs442767変異、 MTR 遺伝子のrs1805087変異、 GGH 遺伝子のrs11545078変異、および SLC19A1 のrs1051298変異に準拠する必要があります遺伝子は陽性です。それ以外の場合は、再テストすることをお勧めします。第三に、胃がんのDNAネガティブ品質管理の平均カバレッジは≥500であり、検出結果は、このキットの検出範囲内のすべてのサイトが野生型であることを示しているはずです。それ以外の場合は、再テストすることをお勧めします。最後に、ライブラリー濃度が0.2 ng/μL未満であるのは、サンプル中のDNAまたはRNAの分解、または実験プロセスに厳密に従わなかったこと、または実験中に期限切れの試薬を使用したことが原因である可能性があります。上記の条件により、シーケンシングの品質が低下したり、失敗したりする可能性があります。ライブラリを再構築することをお勧めします。
このキットでは、一連の手順に従って、臨床サンプルからシーケンシングライブラリを構築します。その後、ライブラリはイオン半導体シーケンシングプラットフォーム上でシーケンシングされ、ANNOVARを使用して結果のアノテーションが行われます。シーケンシング後、ドキュメントを使用して各サンプルの変異体タイプを要約します。変異型が存在しないことは、サンプルがその特定の変異を受けていないことを示しました。 補足表3 は、この典型的な例を示しています。 表 12 に、ここで検出された SNP に関する基本情報を示します。1000ゲノムプロジェクト(1000g2015aug; https://www.internationalgenome.org/;表13)Exome Aggregation Consortium (ExAC; https://gnomad.broadinstitute.org/;Table 14)は、異なる集団において異なるSNPが有意に存在することを明らかにできる。
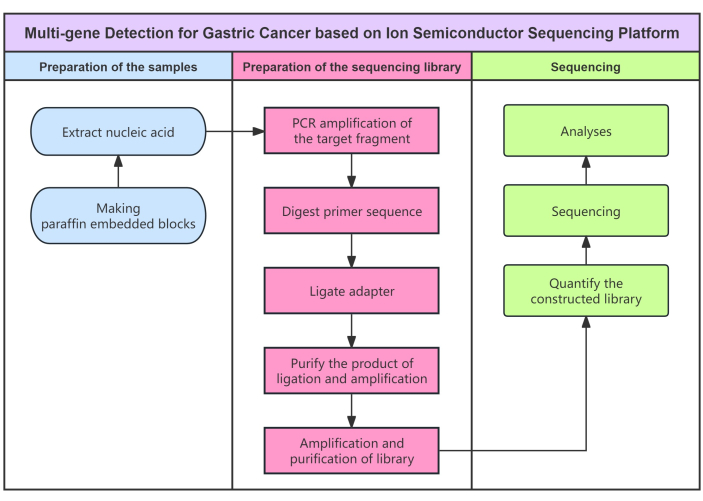
図1:プロトコルのフロー図 半導体シーケンシング法を用いた胃がんの多重遺伝子検出のフローチャート。 この図の拡大版を表示するには、ここをクリックしてください。
| 染色体 | 場所 | プライマー設計間隔 | 左プライマー | 右プライマー | |
| CHR1の | 11854475 | CHR1:11854175-11854775 | アカガッガッグル GAAGTCACAG | AAACCGGAAT(アーアックガート) GGTCACAAAG(グッチャカァァグ) | |
| 11856377 | CHR1:11856077-11856677 | CTTCAGGTCAの GCCTCAAAGCの | TCCCTGTGGTの CTCTTCATCC (英語) | ||
| CHR5の | 79950780 | CHR5:79950480-79951080 | CGCCGCATの アグタグGTTCT | CTTCCTCTC CAGCCCTATC | |
| 79951495 | CHR5:79951195-79951795 | CTTGGGTCACの CTGCACAGTAの | アットガーグ ACCCAAGCTGの | ||
| CHR1の | 237048499 | CHR1:237048199-237048799 | GTCAAAGGCC AGTCCCTTCT | CTCCCTTCAC CAACTGTGCT | |
| CHR8 | 63938763 | CHR8:63938463-63939063 | カグトガーグット CAGCGGCATの | タットッティークッティー GTGGGGCACの | |
| CHR21 | 46934825 | chr21:46934525-46935125 | CCAACCTGAGの ATGGCTTTTC(アトグクトット) | TCCTTGGTGC TCTTGCTTTT | |
表1:5つの遺伝子の7つの選択されたSNPに使用されたプライマー。 このシートには、胃がんにおける5-FU耐性に関連するSNPのプライマーの位置に関する情報が表示されます。
| 温度 | 時間 | いいえ。サイクル数 |
| 99°C | 2分間 | 1サイクル |
| 99°C | 15秒 | 22サイクル |
| 60°C | 4分間 | |
| 10°C | 持つ | 1サイクル |
表2:DNA増幅のためのサーマルサイクルプログラム。 温度、時間、サイクルなどの熱反応条件が表示されます。
| 歩 | 温度 | 時間 | いいえ。サイクル数 |
| 酵素を活性化する | 99°C | 2分間 | 1サイクル |
| 変性 | 99°C | 15秒 | 30サイクル |
| アニールと拡張 | 60°C | 4分間 | |
| 保つ | 10°C | 持つ | 1サイクル |
表3:cDNA増幅のためのサーマルサイクルプログラム。 温度、時間、サイクルなどの熱反応条件が表示されます。
| 温度 | 時間 | いいえ。サイクル数 |
| 50°C | 10分間 | 1サイクル |
| 55°C | 10分間 | 1サイクル |
| 60°C | 20分 | 1サイクル |
| 10°C | 持つ | 1サイクル |
表4:プライマー配列の消化のためのサーマルサイクルプログラム。 温度、時間、サイクルなどの熱反応条件が表示されます。
| コンポーネント | 容積 |
| P1アダプター | 1.5 μL |
| 特定のアダプターX | 1.5 μL |
| ヌクレアーゼフリー水 | 3 μL |
| 反応系の総容積 | 6 μL |
| X:特定のアダプター番号を示します |
表5:アダプター混合物の調製のための試薬の添加順序。 ここで提供されている順序でチューブに試薬を追加します。
| コンポーネント | 容積 |
| バッファの接続 | 4 μL |
| アダプターの混合 X | 2 μL |
| DNAリガーゼ | 2 μL |
| 反応系の総容積 | 30μL |
表6:消化されたプライマー製造に試薬を添加する順序。 ここで提供されている順序でチューブに試薬を追加します。
| 温度 | 時間 | いいえ。サイクル数 |
| 22°C | 30分 | 1サイクル |
| 72°C | 10分間 | 1サイクル |
| 10°C | 持つ | 1サイクル |
表7:アダプターをDNAに接続するためのサーマルサイクルプログラム。 温度、時間、サイクルなどの熱反応条件が表示されます。
| 温度 | 時間 | いいえ。サイクル数 |
| 22°C | 30分 | 1サイクル |
| 68°C | 5分間 | 1サイクル |
| 72°C | 5分間 | 1サイクル |
| 10°C | 持つ | 1サイクル |
表8:アダプターをcDNAに接続するためのサーマルサイクルプログラム。 温度、時間、サイクルなどの熱反応条件が表示されます。
| コンポーネント | 容積 |
| ライブラリー増幅の反応液 | 50 μL |
| ライブラリープライマー混合物 | 2 μL |
| 反応系の総容積 | 52μL |
表9:増幅試薬の添加順序。 ここで提供されている順序でチューブに試薬を追加します。
| 温度 | 時間 | いいえ。サイクル数 |
| 98°C | 2分間 | 1サイクル |
| 98°C | 15秒 | 5サイクル |
| 60°C | 1分間 | |
| 10°C | 持つ | 1サイクル |
表10:DNAライブラリーを増幅するためのサーマルサイクルプログラム。 温度、時間、サイクルなどの熱反応条件が表示されます。
| 温度 | 時間 | いいえ。サイクル数 |
| 98°C | 2分間 | 1サイクル |
| 98°C | 15秒 | 5サイクル |
| 64°C | 1分間 | |
| 10°C | 持つ | 1サイクル |
表11:cDNAライブラリーを増幅するためのサーマルサイクルプログラム。 温度、時間、サイクルなどの熱反応条件が表示されます。
| RS1801131 | RS1801133 | RS1650697 | RS442767 | RS1805087 | RS11545078 | RS1051298 | |
| 参照 | T | G | ある | G | ある | G | G |
| Altキー | G | ある | G | T | G | ある | ある |
| Func.ref (英語) GeneWithVer(ジーンウィズバー) | エクソニック | エクソニック | UTR5 | 川上 | エクソニック | エクソニック | UTR3の |
| ジーン.ref GeneWithVer(ジーンウィズバー) | MTHFRの | MTHFRの | DHFRの | DHFRの | MTRの | GGHの | SLC19A1 |
| 遺伝子詳細 .refGeneWithVer | . | . | NG_023304.1: g.5020T>G | . | . | . | NM_001205206.1: c.*64C>T; NM_001205207.1: c.*746C>T; NM_194255.2:c. *746C>T |
| エクソニックファンク .refGeneWithVer | 非同義語。 SNVの | 非同義語。 SNVの | . | . | 非同義語。 SNVの | 非同義語。 SNVの | . |
| AAChange.ref GeneWithVer(ジーンウィズバー) | MTHFR:NM_00 1330358.1:エクソ n8:c.A1409C:p. E470A;MTHFRの NM_005957.4: エクソン8:c.A1286 C:p.E429A | MTHFR:NM_00 1330358.1:エクソ n5:c.C788T:p. A263V;MTHFR:N M_005957.4:e xon5:c.C665T: A222V | . | . | MTR:NM_0012 91939.1:エクソン2 5:c.A2603G:p. D868G;MTR:N M_001291940。 1:エクソン25:c.A1 535G:p.D512G; MTR:NM_0002 54.2:エクソン26:c。 A2756G:p.D91 9Gの | GGH:NM_003878 .2:エクソン5:c.C452T: p.T151I | 晋 |
| cytoBand(サイトバンド) | 1ページ36.22 | 1ページ36.22 | 5Q14.1 | 5Q14.1 | 1Q43 | 8Q12.3 | 21のQ22.3 |
表12:SNPの関連情報。 ANNOVAR を使用してサンプルに注釈を付けます。
| MTHFRの | DHFRの | MTRの | GGHの | SLC19A1 | ||||
| RS1801131 | RS1801133 | RS1650697 | RS442767 | RS1805087 | RS11545078 | RS1051298 | ||
| 1000g2015aug_all | 0.249401 | 0.245407 | 0.76857 | 0.290136 | 0.218251 | 0.085463 | 0.524361 | |
| 1000g2015aug_afr | 0.1513 | 0.09 | 0.9349 | 0.0318 | 0.2844 | 0.056 | 0.5772 | |
| 1000g2015aug_amr | 0.1513 | 0.4741 | 0.755 | 0.3991 | 0.1772 | 0.0403 | 0.4323 | |
| 1000g2015aug_eas | 0.2192 | 0.2956 | 0.6607 | 0.5853 | 0.1052 | 0.0873 | 0.5635 | |
| 1000g2015aug_eur | 0.3131 | 0.3648 | 0.7555 | 0.3191 | 0.173 | 0.0924 | 0.4493 | |
| 1000g2015aug_sas | 0.4172 | 0.1186 | 0.6779 | 0.228 | 0.3211 | 0.1483 | 0.5552 | |
表13:1000ゲノムプロジェクトにおけるSNPのフィルターベースのアノテーション。
| MTHFRの | DHFRの | MTRの | GGHの | SLC19A1 | |||
| RS1801131 | RS1801133 | RS1650697 | RS442767 | RS1805087 | RS11545078 | RS1051298 | |
| ExAC_ALL | 0.295 | 0.3037 | . | . | 0.2091 | 0.0936 | . |
| ExAC_AFR | 0.1588 | 0.1124 | . | . | 0.2666 | 0.0545 | . |
| ExAC_AMR | 0.1555 | 0.5141 | . | . | 0.1864 | 0.0361 | . |
| ExAC_EAS | 0.2148 | 0.3052 | . | . | 0.1132 | 0.0824 | . |
| ExAC_FIN | 0.3128 | 0.2227 | . | . | 0.1892 | 0.0581 | . |
| ExAC_NFE | 0.3191 | 0.345 | . | . | 0.1919 | 0.0969 | . |
| ExAC_OTH | 0.304 | 0.3062 | . | . | 0.2108 | 0.0973 | . |
| ExAC_SAS | 0.4153 | 0.1409 | . | . | 0.316 | 0.165 | . |
表14:Exome Aggregation ConsortiumにおけるSNPのフィルターベースのアノテーション。
補足表1:DNA増幅用の試薬の添加順序。 ここで提供されている順序でチューブに試薬を追加します。 このファイルをダウンロードするには、ここをクリックしてください。
補足表2:cDNA増幅用の試薬の添加順序。ここで提供されている順序でチューブに試薬を追加します。 このファイルをダウンロードするには、ここをクリックしてください。
補足表3:臨床検体のシーケンシング結果の例。 標本に存在する突然変異のみが文書に記録されます。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
臨床専門家は、胃がんの種類と病期が同じであっても、同じ治療アプローチに対して著しく異なる反応を示す可能性があるという点で、全会一致で同意しています。長年の研究により、科学者たちは、個々の変異は主に胃がんが不均一で多型で多様に分化した細胞集団としての性質に起因し、治療反応に大きな個人差をもたらしていることを明らかにしました28。その結果、上部消化管内視鏡検査や手術による胃がんサンプルの採取や血液サンプルの採取、遺伝子解析のためのハイスループットシーケンシングと相まって、個別化された胃がん治療が可能になります。この戦略は、臨床治療の有効性を高め、重篤な毒性副作用のリスクを減らすように設計されています。イオン半導体シーケンシング技術の進歩により、個別化治療が実用化されました29。
このテスト方法には、次のような制限があります。ここで使用するキットは主に 体外 診断用であるため、 MTHFR 遺伝子のrs1801131およびrs1801133、 DHFR 遺伝子のrs1650697およびrs442767、 MTR 遺伝子のrs1805087、 GGH 遺伝子のrs11545078、 およびSLC19A1のrs1051298の突然変異の検出に限定されます。他のセクションの突然変異は検出できません。腫瘍組織には著しい不均一性があるため、サンプリング場所が異なると検出結果に影響を与える可能性があります。パラフィン包埋組織サンプルを長期間保存すると、DNAやRNAがある程度分解され、試験結果に影響を与える可能性があります。不当なサンプルの収集、輸送、処理、および不適切な実験操作と実験環境は、偽陰性または偽陽性の結果につながる可能性があります。核酸濃度が2 ng/μL未満の場合、検出結果は保証されません。キットの試験結果は臨床参照用です。患者のための個別化された治療の選択は、彼らの症状/徴候、病歴、他の臨床検査および治療反応と組み合わせて考慮されるべきです。陰性の結果は、標的遺伝子変異の存在を完全に排除することはできません。陰性の結果は、サンプル中の腫瘍細胞が少なすぎる、核酸が過度に分解される、または増幅反応システム内の標的遺伝子の濃度が検出限界を下回っていることが原因であることもあります。
使用されるキットの一部の性能指標は、説明されているとおりです。分析感度:DNAサンプルの場合、このキットに含まれる全核酸の最小検出可能量は10 ngで、5%の突然変異率を検出できます。RNAサンプルの場合、このキットに含まれる全核酸の最小検出量は10 ngです。正と負の一致率: 正と負の一致率は 100% に達します。検出限界(LOD):L1-L14の番号が付けられた合計14のLOD参照を使用できます。L1-L11は、MTHFR、DHFR、MTR、GGH、SLC19A1遺伝子のLODリファレンスであり、それらの検出結果は、対応する遺伝子部位の変異タイプが陽性であり、一致率が100%であることが望ましいです。再現性:R1-R5の番号が付けられた合計5つの反復標準物質を使用できます。R1は、強力なポジティブ反復標準物質(rs67376798 DPYD遺伝子の変異)です。この変異を数で含まないR2は、弱いポジティブ反復標準物質(rs67376798 DPYD遺伝子の変異)、R3はネガティブ反復標準物質(DPYD、MTHFR、ABCB1遺伝子の6つの部位が野生型として検出される)です。各参照サンプルは、これらの繰り返し評価の結果が事前定義された分類と一致することを確認するために、10回テストする必要があります。データ量:DNAおよびRNAサンプルの有効データ量は、0.05 M以上に制御する必要があります。DNAサンプルのシーケンシング深度は500以上に制御し、RNAサンプルのMapped Readsは20000以上に制御する必要があります。干渉試験:このキットは、内因性干渉物質(トリグリセリドおよびアルブミン)および外因性干渉物質(ホルマリンおよび脱水アルコール)の影響を受けません。
実験中は、いくつかの注意事項を遵守する必要があります。ここで使用するキットは、in vitro試験にのみ使用できます。実験前にこのマニュアルをよくお読みになり、有効期間内にご使用ください。キットの異なるバッチのコンポーネントを同じように使用することはできません。このキットには、汚染を防ぐために使い捨ての消耗品を使用することをお勧めします。このキットの使用中は、フィルターエレメント付きの吸引ヘッドを使用することをお勧めします。サンプルの潜在的な生物学的危険を回避するために、テストサンプルは、皮膚や粘膜との接触を避けるために感染性物質と見なす必要があります。サンプルは、エアロゾルの流出を防ぐことができるバイオセーフティキャビネットで取り扱うことをお勧めします。手術に使用する試験管と吸盤は、廃棄する前に滅菌する必要があります。サンプルの操作と廃棄は、関連する法律および規制の要件を満たす必要があります:微生物生物医学研究所のバイオセーフティに関する一般ガイドラインおよび保健省の医療廃棄物管理規則30,31。実験要員は、専門的なトレーニングを受け、指示に厳密に従って操作し、実験プロセスに従って領域を厳密に分離する必要があります。実験運転の各段階では、特別な機器および機器を使用するものとし、各エリアの各段階の物品を同じ意味で使用してはならない。実験要員は、実験プロセスに従ってエリアを厳密に分離する必要があります。実験操作の各段階では、特別な機器および機器を使用するものとする。必要に応じて、手袋、作業服などの保護対策を講じてください。廃棄物処理は、関連する国内規制を遵守するものとします。
本稿では、胃がんに関連する5つの遺伝子のうち7つのSNPに焦点を当てていますが、実用化におけるシーケンシングは、この5つの遺伝子だけにとどまりません。この論文は、胃がんにおける7つのSNPと5-FU化学療法に対する感受性との間に有意な相関関係を明確に確立します。
開示事項
著者は何も開示していません。
謝辞
この研究は、Exploring the Mechanism and Role of the ERK2/Snai1/AGPS/PUFA-PL Pathway in Gastric Cancer Cell's Resistance to Apatinib-Induced Ferroptosis (品目番号:82172814)、中国国立自然科学財団の支援を受けています。アパチニブが多価不飽和エーテルリン脂質経路(品目番号:2022A1515010267)を介して誘発するフェロトーシスに対する胃がん細胞耐性の調節におけるジンクフィンガー転写因子1の役割とメカニズムの調査、広東省基礎研究および応用研究資金委員会の支援。胃がんの5-FU化学感受性診断のための試薬の研究と応用(品目番号:201903010072)、広州の科学技術プロジェクト。
資料
| Name | Company | Catalog Number | Comments |
| 1.5 mL DNA LoBind Tubes | Eppendorf | 30108051 | |
| 50 mL tubes | Greiner Bio-One | 227261 | |
| Amplification primer of gastric cancer | Thermo Fisher | The primers are sythesized by Thermo Fshier according to the sequence in Table 1. | |
| Deparaffinization | Qiagen | 19093 | |
| DNA purification magnetic beads | Bechkman | A63881 | |
| Ethyl alcohol | Guangzhou Chemical Reagent Factory Thermo Fisher Scientific | http://www.chemicalreagent.com/ | |
| Ion AmpliSeq Library Kit 2.0 | Thermo Fisher | 4480441 | |
| Nuclease-Free Water | Life Technologies | AM9932 | |
| PCR tubes | Axygen | PCR-02D-C | |
| PCR tubes | Axygen | PCR-02D-C | |
| Pipette tips | Quality Scientific Products | https://www.qsptips.com/products/standard_pipette_tips.aspx | |
| PureLink RNA Mini Columns | Thermo Fisher | A29839 | |
| RecoverAll Total Nucleic Acid Isolation Kit | Thermo Fisher | AM1975 | |
| Tabletop mini centrifuge | SCILOGES | S1010E | |
| Thermal Cycler | Life Technologies | 4375786 | |
| Ultramicro nucleic acid analyzer | BEIJING ORIENTAL SCIENCE & TECHNOLOGY DEVELOPMENT LTD. | BD-1000 |
参考文献
- Sung, H., et al. Global cancer statistics 2020: Globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 71 (3), 209-249 (2021).
- Wagner, A. D., et al. Chemotherapy for advanced gastric cancer. Cochrane Database Syst Rev. 8, (2017).
- Shah, M. A., et al. Immunotherapy and targeted therapy for advanced gastroesophageal cancer: Asco guideline. J Clin Oncol. 41 (7), 1470-1491 (2023).
- Loganayagam, A., et al. Pharmacogenetic variants in the dpyd, tyms, cda and mthfr genes are clinically significant predictors of fluoropyrimidine toxicity. Br J Cancer. 108 (12), 2505-2515 (2013).
- Giacchetti, S., et al. Phase iii multicenter randomized trial of oxaliplatin added to chronomodulated fluorouracil-leucovorin as first-line treatment of metastatic colorectal cancer. J Clin Oncol. 18 (1), 136-147 (2000).
- Hoff, P. M., et al. Comparison of oral capecitabine versus intravenous fluorouracil plus leucovorin as first-line treatment in 605 patients with metastatic colorectal cancer: Results of a randomized phase iii study. J Clin Oncol. 19 (8), 2282-2292 (2001).
- Meulendijks, D., et al. Clinical relevance of dpyd variants c.1679t>g, c.1236g>a/hapb3, and c.1601g>a as predictors of severe fluoropyrimidine-associated toxicity: A systematic review and meta-analysis of individual patient data. Lancet Oncol. 16 (16), 1639-1650 (2015).
- Sadighi, S., Mohagheghi, M. A., Montazeri, A., Sadighi, Z. Quality of life in patients with advanced gastric cancer: A randomized trial comparing docetaxel, cisplatin, 5-fu (tcf) with epirubicin, cisplatin, 5-fu (ecf). BMC Cancer. 6, 274 (2006).
- Collins, F. S., Brooks, L. D., Chakravarti, A. A DNA polymorphism discovery resource for research on human genetic variation. Genome Res. 8 (12), 1229-1231 (1998).
- Ladner, R. D. The role of dutpase and uracil-DNA repair in cancer chemotherapy. Curr Protein Pept Sci. 2 (4), 361-370 (2001).
- Capitain, O., et al. The influence of fluorouracil outcome parameters on tolerance and efficacy in patients with advanced colorectal cancer. Pharmacogenomics J. 8 (4), 256-267 (2008).
- Askari, B. S., Krajinovic, M. Dihydrofolate reductase gene variations in susceptibility to disease and treatment outcomes. Curr Genomics. 11 (8), 578-583 (2010).
- Ceppi, F., et al. DNA variants in dhfr gene and response to treatment in children with childhood b all: Revisited in aieop-bfm protocol. Pharmacogenomics. 19 (2), 105-112 (2018).
- Sharp, L., Little, J. Polymorphisms in genes involved in folate metabolism and colorectal neoplasia: A huge review. Am J Epidemiol. 159 (5), 423-443 (2004).
- Yousef, A. M., et al. The association of polymorphisms in folate-metabolizing genes with response to adjuvant chemotherapy of colorectal cancer. Cancer Chemother Pharmacol. 82 (2), 237-243 (2018).
- Schneider, E., Ryan, T. J. Gamma-glutamyl hydrolase and drug resistance. Clin Chim Acta. 374 (1-2), 25-32 (2006).
- Moran, R. G. Roles of folylpoly-gamma-glutamate synthetase in therapeutics with tetrahydrofolate antimetabolites: An overview. Semin Oncol. 26 (2), 24-32 (1999).
- Maezawa, Y., et al. High gamma-glutamyl hydrolase and low folylpolyglutamate synthetase expression as prognostic biomarkers in patients with locally advanced gastric cancer who were administrated postoperative adjuvant chemotherapy with s-1. J Cancer Res Clin Oncol. 146 (1), 75-86 (2020).
- Cheng, Q., et al. A substrate specific functional polymorphism of human gamma-glutamyl hydrolase alters catalytic activity and methotrexate polyglutamate accumulation in acute lymphoblastic leukaemia cells. Pharmacogenetics. 14 (8), 557-567 (2004).
- Zhang, Q., et al. Recognition of cyclic dinucleotides and folates by human slc19a1. Nature. 612 (7938), 170-176 (2022).
- Ulrich, C. M., et al. Polymorphisms in folate-metabolizing enzymes and response to 5-fluorouracil among patients with stage ii or iii rectal cancer (int-0144; swog 9304). Cancer. 120 (21), 3329-3337 (2014).
- Zhang, X., et al. Discovery of novel biomarkers of therapeutic responses in han chinese pemetrexed-based treated advanced nsclc patients. Front Pharmacol. 10, 944 (2019).
- Corrigan, A., et al. Pharmacogenetics of pemetrexed combination therapy in lung cancer: Pathway analysis reveals novel toxicity associations. Pharmacogenomics J. 14 (5), 411-417 (2014).
- Ion 520 & ion 530 ext kit - chef user guide. Thermofisherscientific Available from: https://www.thermofisher.com/document-connect/document-connect.html?url=https://assets.thermofisher.com/TFS-Assets%2FLSG%2Fmanuals%2FMAN0015805_Ion520_530ExTKit_UG.pdf (2023)
- Ion genestudio s5 instrument user guide. Thermofisherscientific Available from: https://www.thermofisher.com/document-connect/document-connect.html?url=https://assets.thermofisher.com/TFS-Assets%2FLSG%2Fmanuals%2FMAN0017528_Ion_GeneStudio_S5_Instrument_UG.pdf (2023)
- Parkin, N. T., et al. Multi-laboratory comparison of next-generation to sanger-based sequencing for hiv-1 drug resistance genotyping. Viruses. 12 (7), 694 (2020).
- Ziller, M. J., Hansen, K. D., Meissner, A., Aryee, M. J. Coverage recommendations for methylation analysis by whole-genome bisulfite sequencing. Nat Methods. 12 (3), 230-232 (2015).
- Lordick, F., et al. Unmet needs and challenges in gastric cancer: The way forward. Cancer Treat Rev. 40 (6), 692-700 (2014).
- Kumar, K. R., Cowley, M. J., Davis, R. L. Next-generation sequencing and emerging technologies. Semin Thromb Hemost. 45 (7), 661-673 (2019).
- Chinese Centres for Disease Control and Prevention. Ministry of Health of the People's Republic of China. WS 233-2002. Chinese Centres for Disease Control and Prevention. , 1-64 (2002).
- China Environmental Protection Industry. Medical waste management regulations. China Environmental Protection Industry. (1), 6-10 (2004).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
JoVEについて
Copyright © 2023 MyJoVE Corporation. All rights reserved