Method Article
内視鏡的骨形成術の技術
要約
排他的な内視鏡的骨形成術(EEO)は、耳小骨鎖の切断と関連する中耳の病状による伝音難聴の治療に有望で低侵襲なアプローチです。ここでは、さまざまな内視鏡的骨形成術の段階的な説明と議論が提示されます。
要約
現代の耳鼻咽喉科における内視鏡の利用は、診断目的から排他的な内視鏡的耳手術の開発へと進化しました。この技術は、中耳のパノラマビューを提供し、楕円形の窓領域、アブミ骨の上構造、およびフットプレートの最適な倍率を提供し、骨形成術(OPL)中の補綴物の位置を非常に正確に行うことができます。耳小骨鎖再建のためのさまざまな技術が文献に記載されています。自家材料または合成材料のいずれかを再構築に使用できます。患者自身の組織を使用することで、インプラントの拒絶反応や鼓膜を介したプロテーゼの押し出しのリスクを最小限に抑えることができます。一方、チタンのような合成素材は軽くて剛性が高く、手間のかかる補綴物の改造は必要ありません。この記事の主な目的は、排他的な内視鏡的OPLの手術マニュアルとして機能する包括的なステップバイステップガイドを提示することです。このガイドでは、合成材料と自家材料を使用したさまざまな形態のOPLについて説明します。目標は、さまざまな外科技術を包括的に理解し、臨床診療への統合をサポートすることです。
概要
内視鏡の使用は、現代の耳鼻咽喉科で普及しています。もともと診断目的で使用されていた内視鏡技術は、時間の経過とともに人気を博し、排他的な内視鏡的耳手術アプローチにつながっています。内視鏡技術は耳道を介して行われ、技術を片手で行わなければならないため、正確で繊細な操作が必要です。中耳のパノラマビューを提供し、手の届きにくい領域へのアクセスを可能にし、角度付き内視鏡1,2を使用して病気の排除を促進します。耳小骨鎖の修復では、最新の高解像度(HD)または4k内視鏡検査は、アブミ骨やそのフットプレートなどの特定の対象構造に向けられたその照明能力とともに、解剖学的および病理学的差異の認識に大いに役立ちます3,4,5。
耳小骨鎖の破壊は、一般的に慢性中耳炎(COM)に起因しますが、外傷や新生物は正常な中耳を変化させる可能性があり、したがって、その音伝達能力を低下させます6,7。正常な鼓膜(TM)と耳小骨鎖機能の回復は、1950年代にそのルーツがあります8。中耳のさまざまな病状を治療するために使用される外科的技術は、根本的な疾患のプロセスを排除するだけでなく、正常な聴覚機能を回復することも目的としています9。過去70年間で、さまざまな骨形成術(OPL)技術とプロテーゼが研究され、文献で報告されてきました7,10,11。チタンのようなバイオイナート材料は、軽量で剛性が高く、手術中に遠位端がよく見えるため、人気を博しました。それにもかかわらず、これらの補綴物は非常に高価であり、報告された押し出し率(1%-5%)は無視できません12。自家材料は、合成補綴物に匹敵する有効性を示しています。しかしながら、それらは、リモデリングプロセスに必要なより長い外科的期間、真珠腫を保持する可能性、および耳小骨鎖13,14の状態による利用可能性の制限など、特定の欠点を提示する。
Tsetsos et al. によると、排他的内視鏡的骨形成術 (EEO) は、従来の顕微鏡的アプローチと比較して、術後の聴力結果と同様のものと関連しています15。内視鏡的アプローチでは、罹患率の低下と手術時間の短縮の傾向が観察されています。したがって、EEO は、機能している耳小骨鎖を再確立するための有効な外科的選択肢と見なすことができます 子供と大人の聴力回復を伴う16。
この調査は、EEOのさまざまな技術的改良と最新の開発に関する包括的な洞察を提供することを目的としています。さまざまなOPL手法と代表的な結果データを示します。
プロトコル
この研究プロトコルは、インゼルシュピタール・ベルンのヒト研究倫理委員会のガイドラインに準拠し、地元の審査委員会(KEK-BE 2019-00555)によって承認されました。インフォームド 書面による同意は、研究に関与するすべての人間の被験者から得られました。すべての外科的処置は、全身麻酔下(施設で承認されたプロトコルに従う)で、標準的な耳科の器具と適切な止血を使用して、低血圧を制御して行われました17,18。手術部位の準備、排他的な経管アクセス、中耳検査、およびTMの欠損閉鎖は、BeckmannらおよびAnschuetzらによる以前に発表された記事で説明されています19,20。追加の再建措置、最も頻繁には鼓膜形成術が必要とされることがよくあります19.通常、OPLは、鼓膜形成術または胚盤再建のために移植片を配置した後、最終的に実行されます。ただし、これらの手法は、このプロトコルではカバーされません。さらに、他の多くのOPL技術が文献21,22に記載されている。この記事では、私たちが強力で前向きな経験をするための方法について説明します。図1は耳小骨部分置換術の技術を示し、図2は耳小骨全置換術の技術を示しています。手術器具と必要な機器は、材料の表に記載されています。
1. Incusの介入
- 針の解剖器を使用して、インカスの長いプロセスから弦鼓膜を解剖して切り離し、骨のキュレットで胚盤をわずかに切除します。
注:胚盤の切除は、後部中膜への広範なアクセスを提供し、堤歯の長い突起とアブミ骨頭部との間の内茎状突起関節を特定するのに役立つ20。 - インキュドステープの関節を特定し、マイクロフックまたは小さな丸いナイフを使用して、アブミ骨の頭からレンチキュラープロセスを慎重に離します。次に、インカスをゆっくりと上に押し上げて、くるぶしの頭から外します。長いプロセスを下方向に引っ張ってから横方向に引っ張って、インカスを取り外します。分離されたインカスは、介在手順での使用を目的として保存します。
- 侵食の兆候がないかインカスを徹底的に調査し、今後の再建に適切であることを確認します。
- 次の手順23を使用してグラフトを粉砕します。
- 握る鉗子を使用してインカスを保持します。
- ダイヤモンドバリを使用して、インカス本体のレベルに達するまで、インカスの長いプロセスと短いプロセスの両方を慎重にドリルで穴を開けます。
- 前の長いプロセスの反対側で、アブミ骨の頭を収容するために幅約1mmの寛骨臼をドリルで開けます。
- 介在の長さが、患者の解剖学的構造に応じて、2〜2.5mmの範囲と一致することを確認します。
- マイクロサクションチップおよび/または針を使用して、改造されたインカスを鼓室腔内に配置し、寛骨臼をアブミ骨の頭部に正確に配置し、必要に応じて、くるぶしのハンドルと接触する前面に配置します。
2.マレウスヘッドインターポジション
- インカスを除去した後(ステップ1)、くるぶしを特定し、鼓膜の脊索を首から離剖します。
- くるぶしニッパーを使用してくるぶしの首を横切り、介在手順での使用を目的として頭を取り除きます。
- くるぶしの頭に侵食の兆候がないか徹底的に調べ、今後の再建に適切であることを確認してください。
- 次の手順24を使用してグラフトを粉砕します。
- つかむ鉗子を使用してくるぶしの頭を保持します。
- くるぶし全体を使用する場合は、ダイヤモンドバリを使用して、くるぶしの首の高さに達するまで、マヌブリウム、外側、および前方の突起の両方を慎重に穴を開けます。
- くるぶしの頭に、アブミ骨の頭を収容するために幅約1mmの寛骨臼をドリルで開けます。
- 移植片の長さが、患者の解剖学的構造に応じて約2〜2.5mmであることを確認します。
- 移植片を鼓室腔に向かって運んだ後、マイクロサクションチップおよび/またはマイクロフック/針を使用して、くるぶしの頭の介在位置をアブミ骨の頭に正確に配置します。
注:根底にある中耳の病状の適切な治療には、多くの場合、歯茎とくるぶしの切除が必要です。インカス本体が無傷のままである限り、介在グラフトに適しています。くるぶしの頭の介在は、incusが存在しないか侵食されていて、くるぶしの頭がまだ無傷である場合に使用します。
3. 部分耳小骨置換プロテーゼ(PORP)
- アブミ骨の超構造の完全性を確認し、くるぶしの頭とインカスの両方が欠落しているか、介在骨形成術での使用に適していないことを確認します。
- 欠損部のサイズを評価し、インプラントのサイズを決定します。多くの異なる製品が市販されています。ここでは、チタンベースのインプラントの使用が例示的に示されています。インプラントの適切なサイズを選択するか、チタンシャフトを希望の長さにトリミングします。環状靭帯の伸張を避けるために、アブミ骨上構造に圧力をかけないでください。
- プロテーゼを鼓室に向かって運んだ後、マイクロサクションチップおよび/またはマイクロフック/針を使用して、PORPの足をアブミ骨の頭に正確に配置します。
- PORPの頭をマニュブリウム(存在する場合)に当てます。プロテーゼの頭部を軟骨で覆い、インプラントがTMをわずかにテントで覆うようにします。
4. ダブル軟骨ブロック(DCB)PORP
- アブミ骨の超構造の完全性を確認し、くるぶしの頭とインカスの両方が欠落しているか、介在OPLに適していないことを確認します。
- 次の手順25を使用して、二重軟骨ブロック(DCB)グラフトを準備します。
- トラガル軟骨または軟骨軟骨の長方形のブロックを入手し、片側のみの軟骨周囲を取り除きます。
- メスを使って軟骨を半分に切ります。反対側の軟骨周囲を横切ることは避けてください。
- 幅約1mmの浅い寛骨臼を作成して、軟骨膜のないブロック上のアブミ骨を受け入れます。
- 無傷の軟骨膜に軟骨ブロックを折ります。
- マイクロサクションチップおよび/またはマイクロフック/針を使用して、DCBをアブミ骨の頭部に正確に位置決めします。該当する場合は、ハンマーの材料への連絡を確立します。
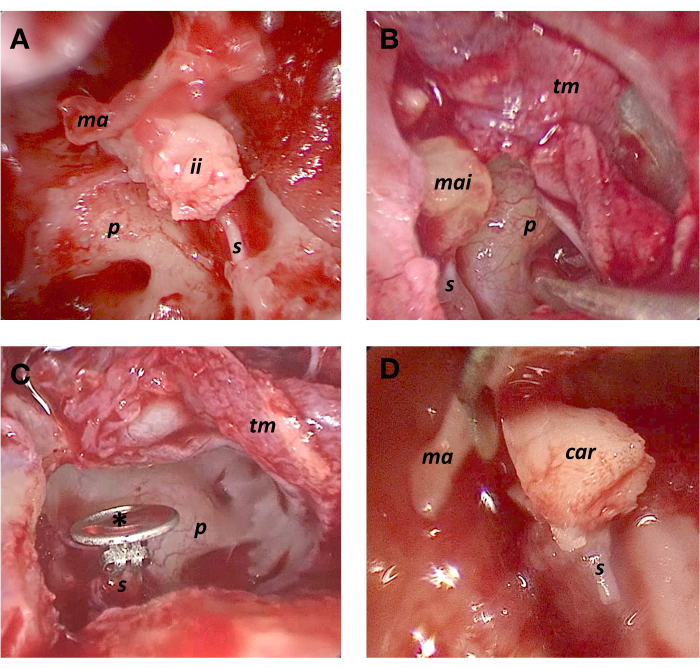
図1:小骨部分置換術の技術 (A)インカス介在 (ii).(B)マレウスヘッドインターポジション(mai)。(C)PORP(*)。(D)DCB PORP(車)。略語:くるぶし(ma)、岬(p)、アブミ骨(s)、鼓膜(tm)。 この図の拡大版を表示するには、ここをクリックしてください。
5. 全耳小骨置換プロテーゼ(TORP)
- アブミ骨のフットプレートの完全性を確認し、病気、癒着、または傷跡からそれをきれいにします。
- TMとフットプレートの間の欠損のサイズを評価し、インプラントのサイズを決定します。多くの異なる製品が市販されています。ここでは、チタンベースのインプラントの使用が例示的に示されています。インプラントの適切なサイズを選択するか、チタンシャフトを希望の長さにトリミングします。インプラントがフットプレートに過度の圧力をかけずにTMをわずかにテントで固定していることを確認します。
- マイクロサクションチップおよび/または針を使用して、TORPを鼓室腔内に配置し、TORPの足をアブミ骨フットプレートに正確に配置します。
- TORPの頭を手足に当て(存在する場合)、頭を軟骨で覆います。
6. 半合成全耳小骨置換プロテーゼ(ssyTORP)
- アブミ骨のフットプレートの完全性を確認し、病気、癒着、または傷跡からそれをきれいにします。
- 半合成プロテーゼ26を準備します。
- 再建の意図されたサイズに応じて、プラチナ/ポリテトラフルオロエチレン(PTFE)のアブミ骨切開術プロテーゼを選択してください。
- フックの付け根でプラチナ線をカットします。
- トラガル軟骨またはコンチャル軟骨から軟骨ブロックを取得します。TMとフットプレートの間の距離に応じて、長さ5mmのssyTORPを作成します。
- 両側に軟骨周囲を残した背骨軟骨の正方形のブロックを1つ作成します。
- インスリン針を使用して、ブロックの中央にある軟骨周囲に小さな穴を開けます。
- シャフトの鈍い先端を軟骨膜の穴に挿入し、軟骨を貫通するようにそっと押し込みます。
- 6mmまたは7mmのssyTORPを作成するには、長方形(2〜5mm)を、好ましくはトラガル軟骨から、両側に軟骨周囲を残したまま、それぞれ二重または三重の軟骨ブロックを得る。
- 軟骨を半分に切ります。反対側の軟骨膜の切断を避けてください。
- ブロックの中央にある軟骨周囲に小さな穴を開けます。
- シャフトの鈍い先端を軟骨ブロックに挿入します。2つまたは3つの軟骨ブロックの間に無傷の軟骨膜層を2倍にして、軟骨を折り返します。
注:上記のすべての技術では、適切と思われる場合は、介在グラフトの周囲に吸収性ゼラチンスポンジを使用して再建の安定性を確保します。
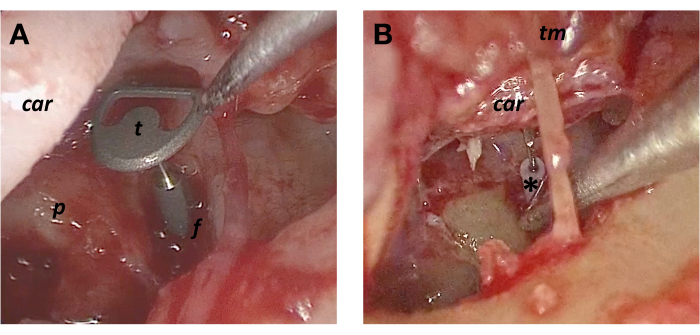
図2:全耳小骨置換術の技術(A)TORP(t)。(B)ssyTORP(*)。略語:軟骨(車)、フットプレート(f)、岬(p)、鼓膜(tm)。この図の拡大版を表示するには、ここをクリックしてください。
7. 術後ケア
- 術後の期間に適切な疼痛管理を確保します。臨床的に適応がない限り、予防的抗生物質を投与しないでください。.
- 患者に鼻をかまないようにアドバイスし、手術部位への損傷を避けるために、術後2週間は水から厳重に保護することを強調します。
- 手術当日または翌日に患者を退院させますが、これは術後の回復と臨床評価によって異なります。
- 術後 2 週間でフォローアップをスケジュールし、完全なドレッシングの除去と手術部位の評価を行います。
注:これは標準的な術後ケアプロトコルです。個々の患者のニーズと臨床シナリオにより、変更が必要になる場合があります。
結果
この研究では、EEOの60例を包括的に分析しました。本明細書で提示された各技術について、少なくとも3ヶ月の追跡(FU)期間を持つ最後の10の連続した症例が含まれていた。すべての手術は、2019年4月から2023年6月にかけて、ベルン・ボローニャ大学病院の耳鼻咽喉科で経験豊富な外科医によって行われました。手術日の平均年齢(標準偏差(SD)±)は39.28歳(±19.04歳)でした。全症例のうち、30例(50.0%)が再手術でした。手術を受けた左右の分布はほぼ同数で、左側が31例(51.7%)、右側が29例(48.3%)でした。55例(91.7%)で基礎疾患はCOMであり、38例(63.3%)が真珠腫であった。
手術結果
移植片摂取率(GIR)は、最後のFUまでに98.3%の成功率を示し、TM再穿孔を示したのは1例のみでした。平均FU期間は11.15か月(SD±9.38か月)でした。プロテーゼの押し出しは、術後19か月の1例(2.1%)で発生しました。さらに、一部の症例(合計7例(11.7%))は、持続性伝音難聴(3例)または再発性真珠腫(4例)のために再手術を必要としました。
聴覚学的結果
各患者は術前および術後の純音聴力検査を受け、0.5 kHz、1 kHz、2 kHz、および 4 kHz の周波数で聴力閾値 (dB HL) として表される純音平均 (PTA) として報告されました。術前、平均気骨ギャップ (ABG) は 30.46 dB ± 13.23 dB でした。手術後、術後のABGが平均21.41dB±10.64dBに減少し、大幅な改善が観察されました。この改善は、対応のある t検定 (p < 0.01)によって決定されたように、統計的に有意であった。手術結果の包括的な概要は、 表1に記載されています。
表1:患者の疾患特性と手術結果。 略語:エアボーンギャップ(ABG)、平均(M)、範囲(R)、標準偏差(SD)。 この表をダウンロードするには、ここをクリックしてください。
ディスカッション
この記事では、EEO の手順を順を追って説明します。耳小骨鎖10,11を再構築するための様々な技術、グラフトの種類、および補綴物がある。アブミ骨の超構造の有無に応じて、PORPまたはTORPが必要です。内視鏡を使用することで、耳小骨鎖とその機能の詳細な視覚化と評価が可能になります。困難な解剖学的条件でも、内視鏡は楕円形の窓の最適なビューを提供し、アブミ骨の超構造またはフットプレートを非常に正確に配置します。耳介後切開と乳様突起切除術はしばしば避けることができます27。さらに、それは解剖学的側面と外科的側面の両方で経験の浅い外科医を教育するための優れたツールです28。
最近発表された文献では、内視鏡的OPLと顕微鏡的OPL2 7,29の間で同等の聴覚学的結果が示されています。Das et al. は、内視鏡的 PORP OPL を使用して 1 か月後に ABG の閉鎖が大幅に改善されたと報告しましたが、長期的な聴覚結果では、顕微鏡技術と統計的に有意な差は示されませんでした4。Tsetsos et al.によって発表された系統的レビューでも、顕微鏡技術と内視鏡技術の両方で同等の聴覚学的結果が示されました15。彼らはまた、内視鏡法により、術後の痛みや創傷感染症など、手術時間が短くなり、罹患率が低くなる傾向を観察しました。術前と術後の聴力評価のデータ分析では、平均 ABG がそれぞれ 30.46 dB と 21.41 dB であることが示されました。ABG 完了には、術前と術後の ABG の間で 9.05 dB ± 14.72 dB の統計的に有意な改善が見られました (p < 0.01)。Soloperto らによる発表では、自家移植片再建を受けている患者における平均 ABG 閉鎖が 7.85 dB HL (p < 0.01) と同等の結果を示しました16。
何人かの著者は、人工補綴物、特にチタン製補綴物と自家移植片を、聴力の結果と合併症の観点から比較しました。Aminth らは、インカス自家移植片とチタン PORP を比較する前向き研究を実施し、インカス グループ30 で有意に優れた聴力転帰と移植片の取り込みを発見しました。さらに、プロテーゼの押し出しや残存TM穿孔などの術後合併症は、チタンPORPグループでより頻繁に発生しました。
DCBグラフトを用いて実施されたOPLは、インカス自家移植片31の使用と比較して、プロテーゼの変位または固定のリスクを低減する上でさらに大きな利点を提供することがわかった。自家移植片の分野では、DCBグラフトやマレウス同種移植片などのさまざまなオプションが、同等の聴覚学的結果を示しています。どちらのオプションでも、患者の 81% で ABG が 20 dB 未満に回復しました2 5,32。患者自身の組織を使用することで、インプラントの拒絶反応やTMを介したプロテーゼの押し出しのリスクが最小限に抑えられ、生体適合性が向上し、術後合併症が減少します15。ただし、自家材料には特定の欠点があります。これらには、リモデリングプロセスに必要なより長い手術期間、真珠腫の顕微鏡片を保持する可能性、および耳小骨鎖13,14の状態による利用可能性の制限が含まれる。プロテーゼの押し出しの1例(5%)は、20の合成プロテーゼのコホートで記録されました。自家材料を使用した場合、押し出しのケースは発生しませんでした。
COMは、真珠腫の有無にかかわらず、耳小骨鎖の破綻の最も頻繁な原因です。全60例のうち、COMは55例(91.7%)を占め、組織学的に真珠腫と確認された患者様は計38例(63.3%)でした。耳小骨鎖の再建に最も適した時期については、まだ議論の余地があります。シングルステージOPLの場合、耳小骨鎖の内視鏡的再建はCOM手術と同時に行われます。残存病変が潜在的な問題である場合、耳小骨鎖の再建は、通常、最初の手術の12〜18か月後に予定され、2回目のOPLと呼ばれる後の手順に延期される場合があります。この研究では、早期の聴力回復を達成するために、コホート全体で単一段階の手術による統一的なアプローチが採用されました。ただし、病気がアブミ骨のフットプレートに影響を与えるシナリオでは、第 2 段階の OPL を検討することが適切な場合があります。単段階のOPLと第2段階のOPLは、どちらも同様の聴力結果を達成しているようです16。
インカスの長いプロセスは、外傷と感染症の両方に続発する壊死にとって最も脆弱な部分です33。インカスロングプロセスが排他的に侵食される場合、骨セメントで耳小骨ギャップを埋めることは、この記事で紹介したOPL手順の有効な代替手段を提供します。何人かの著者は、この手法に関連する同等の長期的な聴覚学的結果を報告しました34,35。
この研究のサンプル サイズが限られており、FU 期間が比較的短いため、堅牢な統計結果と個々の OPL 手法の長期結果の包括的な評価が妨げられています。さらに、小さなサブグループのパラメトリック統計分析は、過大評価や誤解を招く結論につながる可能性があります。COM の症例に重点が置かれているため、結果の一般化可能性は他の中耳の病状に限定されます。複数の再手術症例を含めることは、特定の課題を提示し、主要な外科的転帰を完全に表していない可能性があります。
結論として、EEOは、自家材料または合成材料による耳小骨鎖再建のための有効な外科的選択肢です。これは、安全で低侵襲の手順であり、許容できる聴覚回復を備えています。
開示事項
LAはStryker ENTのコンサルタントです。
謝辞
何一つ。
資料
| Name | Company | Catalog Number | Comments |
| Antifog Solution | Karl Storz | 15006H | |
| Endoscopes 3 mm diameter, 15 cm length 0°, 30°, 45°and 70° | Karl Storz | 7220AA/ 7220BA/ 7220FA/ 7220CA | |
| Epinephrine 1 mg/mL | Dr. Bichsel AG | 2824248 | |
| Gelatinous sponge (Gelfoam) | Pfizer | GTIN 00300090315085 | |
| Image 1S 4K | Karl Storz | TH120 | |
| ME 102 | KLS Martin | 80-010-02-04 | |
| Microsuction tubes | Spiggle&Theis | 301004 - 301014 | |
| Monitor 32" 4K/3D | Monitor 32" 4K/3D | TM350 | |
| NIM-Neuro 3.0 | Medtronic | 8253402 | |
| OsseoDuo | Bien Air | 1700524-001 | |
| Otosporin (polymyxin, neomycin, hydrocortison) | GlaxoSmithKline | 2262911000001100.00 | |
| Piezosurgery device | Mectron | N/A | |
| PM2 Line Drill | Bien Air | 1600765-001 | |
| PORP mCLIP ARC Partial Prosthesis | MED-EL | 58502 - 58520 | |
| Povidone-iodine (Betadine) | Mundi-Pharma | 7680342821377 | |
| Ringer Solution | B. Braun | 3570000 | |
| Standard otological instruments (otologic dissectors, needle dissector, round knifes, hooks, curette, microscissors (Bellucci) and microforceps (Hartmann) | Karl Storz | N/A | |
| Stapes Prosthesis Platin/PTFE | Spiggle&Theis | 1054040600/10560600 | |
| Steel and diamond burrs | Bien Air | 1100290-001 - 1100303-001/ 1100247-001 - 1100260-001 | |
| Syringe Injekt Solo 10 mL | Syringe Injekt Solo 10 mL | 4606108N | |
| TORP Implant for shortening | Spiggle&Theis | 11830 - 11870 |
参考文献
- Bonali, M., et al. The variants of the retro- and hypotympanum: an endoscopic anatomical study. European Archives of Oto-Rhino-Laryngology. 274 (5), 2141-2148 (2017).
- Anschuetz, L., et al. Novel Surgical and Radiologic Classification of the Subtympanic Sinus: Implications for Endoscopic Ear Surgery. Otolaryngology-Head and Neck Surgery. 159 (6), 1945998187180(2018).
- Marchioni, D., Molteni, G., Presutti, L. Endoscopic anatomy of the middle ear. Indian Journal of Otolaryngology and Head & Neck Surgery. 63 (2), 101-113 (2011).
- Das, A., Mitra, S., Ghosh, D., Sengupta, A. Endoscopic ossiculoplasty: Is there any edge over the microscopic technique. The Laryngoscope. 130 (3), 797-802 (2020).
- Molinari, G., et al. Surgical implications of 3D vs 2D endoscopic ear surgery: A case-control study. European Archives of Oto-Rhino-Laryngology. 277 (12), 3323-3330 (2020).
- Kamrava, B., Roehm, P. C. Systematic review of ossicular chain anatomy: Strategic planning for development of novel middle ear prostheses. Otolaryngology-Head and Neck Surgery. 157 (2), 190-200 (2017).
- Mudhol, R. S., Naragund, A. I., Shruthi, V. S. Ossiculoplasty: Revisited. Indian Journal of Otolaryngology and Head and Neck Surgery. 65, 451-454 (2013).
- Wullstein, H. Die Eingriffe zur Gehörverbesserung [Surgery for hearing improvement]. Uffenorde W. Anzeige und Ausführung der Eingriffe an Ohr, Nase und Hals. 2nd ed. Thieme, O. hr,N. aseundH. als.2nded.S. tuttgart: , Stuttgart, Thieme. 227-258 (1952).
- Marchioni, D., et al. Selective epitympanic dysventilation syndrome. The Laryngoscope. 120 (5), 1028-1033 (2010).
- Yu, H., et al. PORP vs. TORP: A meta-analysis. European Archives of Oto-Rhino-Laryngology. 270 (12), 3005-3017 (2013).
- McGee, M., Hough, J. V. Ossiculoplasty. Otolaryngologic Clinics of North America. 32 (3), 471-488 (1999).
- Javia, L. R., Ruckenstein, M. J. Ossiculoplasty. Otolaryngologic Clinics of North America. 39 (6), 1177-1189 (2006).
- Woods, O., Fata, F. E., Saliba, I. Ossicular reconstruction: Incus versus universal titanium prosthesis. Auris Nasus Larynx. 36 (4), 387-392 (2009).
- Bartel, R., et al. Hearing results after type III tympanoplasty: incus transposition versus PORP. A systematic review. Acta Oto-Laryngologica. 138 (7), 617-620 (2018).
- Tsetsos, N., Vlachtsis, K., Stavrakas, M., Fyrmpas, G. Endoscopic versus microscopic ossiculoplasty in chronic otitis media: A systematic review of the literature. European Archives of Oto-Rhino-Laryngology. 278 (4), 917-923 (2021).
- Soloperto, D., et al. Exclusive endoscopic ossiculoplasty with autologous material: step-by-step procedure and functional results. European Archives of Oto-Rhino-Laryngology. 280 (11), 4869-4878 (2023).
- Alicandri-Ciufelli, M., et al. Epinephrine use in endoscopic ear surgery: Quantitative Safety assessment. ORL; Journal for Oto-Rhino-Laryngology and its Related Specialties. 82 (1), 1-7 (2020).
- Anschuetz, L., et al. Management of bleeding in exclusive endoscopic ear surgery: Pilot clinical experience. Otolaryngology-Head and Neck Surgery. 157 (4), 700-706 (2017).
- Beckmann, S., et al. Endoscopic cholesteatoma surgery. Journal of Visualized Experiments. (179), e63315(2022).
- Anschuetz, L., et al. Discovering middle ear anatomy by transcanal endoscopic ear surgery: A dissection manual. Journal of Visualized Experiments. (131), e56390(2018).
- Young, A., Ng, M. Ossiculoplasty. StatPearls. , Available from: http://www.ncbi.nlm.nih.gov/books/NBK563162/ (2023).
- Kim, H. H., Wiet, R. J. Preferred technique in ossiculoplasty. Operative Techniques in Otolaryngology-Head and Neck Surgery. 14 (4), 243-246 (2003).
- Springer. Comparative atlas of endoscopic ear surgery: training techniques based on an ovine model. , Springer. Cham, Switzerland. (2021).
- Dornhoffer, J. L., et al. 28 autograft ossicular reconstruction. The chronic ear. , Verlag. Thieme. (2016).
- Malafronte, G., Filosa, B., Mercone, F. A new double-cartilage block ossiculoplasty: long-term results. Otology & Neurotology. 29 (4), 531-533 (2008).
- Malafronte, G. Early results with semi-synthetic total ossicular replacement prosthesis. Otolaryngology-Head and Neck Surgery. 143 (2), 307-308 (2010).
- Caloway, C. L., et al. Pediatric endoscopic ossiculoplasty following surgery for chronic ear disease. The Laryngoscope. 130 (12), 2896-2899 (2020).
- Niederhauser, L., Fink, R. D., Mast, F. W., Caversaccio, M., Anschuetz, L. Video learning of surgical procedures: A randomized comparison of microscopic, 2- and 3-dimensional endoscopic ear surgery techniques. Otology & Neurotology. 43 (7), e746-e752 (2022).
- Coleman, H., Tikka, T., Curran, J., Iyer, A. Comparison of endoscopic vs microscopic ossiculoplasty: A study of 157 consecutive cases. European Archives of Oto-Rhino-Laryngology. 280 (1), 89-96 (2023).
- Amith, N., Rs, M. Autologous incus versus titanium partial ossicular replacement prosthesis in reconstruction of Austin type A ossicular defects: a prospective randomised clinical trial. The Journal of Laryngology and Otology. 131 (5), 391-398 (2017).
- Filosa, B., Previtero, G., Novia, G., Trusio, A., Malafronte, G. Partial Ossiculoplasty: Malafronte's double cartilage block versus incus. Otology & Neurotology. 40 (3), 344-350 (2019).
- Vercruysse, J. P., Offeciers, F. E., Somers, T., Schatteman, I., Govaerts, P. J. The use of malleus allografts in ossiculoplasty. The Laryngoscope. 112 (10), 1782-1784 (2002).
- Ráth, G., et al. Ionomer cement for reconstruction of the long process of the incus: The Pécs experience. Clinical Otolaryngology. 33 (2), 116-120 (2008).
- Katar, O., Kılıç, S., Bajin, M. D., Sennaroğlu, L. Long term results of glass ionomer ossiculoplasty. European Archives of Oto-Rhino-Laryngology. 281 (1), 171-179 (2023).
- Moneir, W., Salem, M. A., Hemdan, A. Endoscopic transcanal management of incus long process defects: rebridging with bone cement versus incus interposition. European Archives of Oto-Rhino-Laryngology. 280 (2), 557-563 (2023).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved