培養哺乳類細胞における オルト -フタルアルデヒドを用いたグルタチオンの酸化型および還元型グルタチオンの迅速な定量(英語)
要約
グルタチオンの酸化型と還元型の両方の定量化(それぞれGSSGとGSH)は、 オルトフタルアルデヒド(OPA)を使用して達成されています。OPAは、GSHに結合すると高蛍光になりますが、還元されるまでGSSGを結合することはできません。ここでは、ノーマライゼーションのためのタンパク質定量を使用して両方を定量するマルチパラメトリックアッセイについて説明します。
要約
グルタチオンは、細胞の抗酸化反応を決定するための重要なバイオマーカーと長い間考えられてきました。したがって、活性酸素種研究の主要なマーカーです。この方法では、 オルトフタルアルデヒド(OPA)を利用して、グルタチオンの細胞濃度を定量化します。OPAは、スルフヒドリル結合を介して還元型グルタチオン(GSH)と結合し、その後イソインドールを形成し、高蛍光のコンジュゲートを生成します。酸化グルタチオン(GSSG)とGSHの両方の正確な結果を得るには、このプロトコルで実装されているマスキング剤と還元剤の組み合わせが必要です。治療は細胞の生存率にも影響を与える可能性があります。したがって、タンパク質アッセイによる標準化は、このマルチパラメトリックアッセイで提示されます。このアッセイは、GSHに特異的な0.234 - 30μM(R2=0.9932±0.007(N=12))の疑似線形検出範囲を示しています。提案されたアッセイはまた、還元型グルタチオンに結合するためにマスキング剤N-エチルマレイミドを添加して酸化型グルタチオンを測定することを可能にし、還元剤トリス(2-カルボキシエチル)ホスフィンを導入してGSSGのジスルフィド結合を切断し、GSHの2分子を生成する。このアッセイは、タンパク質定量のための検証済みビシンコニン酸アッセイおよび細胞毒性評価のためのアデニル酸キナーゼアッセイと組み合わせて使用されます。
概要
活性酸素種(ROS)は、酸化ストレスの主要な誘導物質です。酸化ストレスは、DNA突然変異の生成、細胞の老化/死、さまざまな癌、糖尿病、神経疾患(パーキンソン病やアルツハイマー病など)、およびその他のいくつかの生命を衰弱させる状態において十分に確立されています1,2,3,4,5。ROSに対する主要な防御は、プロトンドナーとして作用することにより酸化剤またはラジカルを減少させることができるチオリック、非酵素的抗酸化物質である6,7。グルタチオン(GSH)とシステインは、哺乳類に見られる最も一般的な2つのチオール8ですが、他のさまざまな低分子量チオール(エルゴチオネインなど)が存在しますが、GSHとシステインは、文献9,10,11で最も一般的に測定される非酵素的抗酸化物質であり、ROS8,12,13,14との闘いに最も関連性があります。
GSHを抗酸化剤として利用すると、GSHの2つの分子がジスルフィド結合を介して共有結合してグルタチオンジスルフィド(GSSG)を生成します。GSHの枯渇は、酸化ストレスの指標としてよく使用されます15,16。この評価は、GSSGの検出と組み合わせることもできますが、GSSGは細胞内で比較的反応性が高く、他のタンパク質チオールとのジスルフィド結合形成につながる可能性があるため、細胞内のGSSGの増加は積極的な輸出プロセスによって制限されることがよくあります16。
GSHおよびGSSGを測定するための従来の方法は単純なプロセスではなく、溶解試薬17,18を用いた細胞抽出を含む多数のステップを必要とする。ここで概説するプロトコールは、これらの方法を簡素化し、非酵素的チオールの正確な測定と、細胞タンパク質含有量またはアデニル酸キナーゼ放出を用いた標準化を可能にします。さらに、GSH/GSSG抽出前に細胞生存率を測定することが可能です。還元および酸化された非酵素チオールを効率的に標的化および定量するためのいくつかの方法がこれまでに試みられてきました。HPLCの使用を含む方法19,20,21、プレートアッセイ(生化学的)22,23,24,25、およびチオール結合のための一般的な試薬を使用する方法、例えば5,5-ジチオ-ビス-(2-ニトロ安息香酸)(DTNB/エルマン試薬)19、モノクロロビマン(mBCI)26,27,28.いくつかの企業は、グルタチオンを検出するための独自のキットも準備しています。しかし、彼らは試薬の不適合を公表しておらず、これは使用される治療に依存する問題を提示する29。
このプロトコルは、 オルトフタルアルデヒド(OPA)結合を介して還元チオール(GSHなど)を検出し、それぞれ340/450 Ex/Emで検出可能な蛍光シグナルを生成するマルチパラメトリックアッセイの概要を示しています。このアッセイは、マスキング剤(N-エチルマレイミド)とGSSG還元剤(トリス(2-カルボキシエチル)ホスフィン)を使用することで、GSHとGSSGの両方を(プレート内)同時に検出することを容易にします。このマルチバイオマーカープロトコルは、細胞溶解段階で、最終測定完了時のサンプルの標準化のためのビシンコニン酸アッセイ、または細胞培地からのアデニル酸キナーゼアッセイを介してタンパク質を定量する機会も提供します。このアッセイは、ほとんどのラボですぐに入手できるいくつかの試薬を使用して実施でき、実施に必要な珍しい化学物質はわずかです。このプロセスはシンプルでアクセスしやすく、面倒な段階を経ずに2時間以内に実行できます。
このプロトコルでは、以前にROSを誘導することが示されていたか、または酸化ストレスを誘発することが疑われていた種々のナノ材料が選ばれた30,31。これらのナノマテリアルがさまざまな細胞株に曝露した場合の影響と、抗酸化チオールの定量におけるアッセイの有効性を確認するために、濃度範囲を調査しました。
プロトコル
注:次のプロトコルは、ビシンコニン酸(BCA)タンパク質アッセイおよびアデニル酸キナーゼ(AK)アッセイと組み合わせて使用 され、サンプルを治療に正規化するために利用できる能力で設計されています。材料の準備と使用を通じて、オペレーターが適切な服装と必要な安全装置(Howieラボコート、ニトリル手袋、クラスI安全メガネなど)を着用していることを確認してください。プロトコルはいくつかの段階に分かれています。
1. ストックとワーキングソリューションの準備
- 1 mM HCl 中に 100 mM GSH 標準試料のストック溶液を調製します(37% HCl を二重蒸留水(ddH2O)で調製)。
注:37%HClなどの高濃度の酸から希釈する場合は、クラスIのヒュームフードで水に酸を添加する正しいプロセスを確認してください。 - 無水エタノール中に22.35 mM OPAのストックを調製します。この手順は、クラスIのヒュームフードで実行します。ddH2O中に25 mM N-エチルマレイミド(NEM)を調製します。このステップはクラスIのヒュームフードで行ってください。
注:これら3つの溶液は、-20°Cで最大3か月間保存できます。 - 0.01 Mトリス(2-カルボキシエチル)ホスフィン(TCEP)を、100ウェルに必要な総容量500 μLまで調製します。100 mM GSH標準試料100 μLを調製し、ddH2Oを使用して100 mMストックから希釈します。
- 免疫沈降(IP)溶解バッファーを使用するか、次の製剤を使用します:394 mgのTris-HCl(最終濃度25 mM)、877 mgのNaCl(最終濃度150 mM)、29 mgのEDTA(最終濃度1 mM)、1 mLの100%NP-40またはIGEPAL CA-630(最終濃度1% V / V)、5 mLのグリセロール(最終濃度5%V / V)、 84 mLのddH2Oを穏やかに攪拌しながら成分を混合し、pHを7.4に調整します。100 mLメスフラスコにデカンタし、残りの容量のddH2Oを加えて最終容量100 mLにします。滅菌フィルターを0.22μmフィルターに通し、2〜8°Cで最大6ヶ月間保存します。
注:溶解溶液は、このアッセイで汚染物質/干渉物として機能します。したがって、上記の定式化が指定されています。 - エチレンジアミン四酢酸(PBS-EDTA)を添加した0.1 Mリン酸緩衝生理食塩水を1 L、具体的には7.2、8.5、9.0の3種類のpH値で調製します。市販の0.1 M PBS緩衝液に1 mM EDTA(292.24 mg/L)または以下の10x(1 L)製剤を添加してください:80 g NaCl、2.0 g KCl、14.4 g Na2HPO4、2.4 g KH2PO4、800 mLのddH2Oを添加して混合します。1 Lまで補充し、無菌状態のために溶液をオートクレーブし、室温で12ヶ月間保存します。10倍ストック溶液からPBSの作業溶液を作り、EDTA(前述の濃度)を添加します。
注:pHは非常に重要です。プロトコールを開始する前に、pHが正確であることを確認してください。 - ddH2O (1 mM、500 μM、250 μM、125 μM、62.5 μM、31.25 μM、15.625 μM、および 7.8125 μM) を使用して、1 mM GSH の 1:2 段階希釈を実行します。各濃度の10 μLを標準ウェルに加えます(2回に分けて行います)。サンプルは溶解バッファーでさらに希釈されます。したがって、濃度はその後、元の濃度(200、100、50、25、12.5、6.25、3.125、1.5625μM)の1/5thになります。
注:キャリブレーションの最終濃度は、30 μm、15 μm、7.5 μm、3.75 μm、1.875 μm、937.5 nm、468.8 nm、および234.4 nmです。
2. アッセイ調製
注:このプロトコルは、ATCCから市販されたヒト細胞株HepG2、A549、およびJ774を使用します。これらの細胞株は、本学の動物・組織培養法および規則で概説されている承認されたガイドラインに基づいて利用されました。
- アッセイ開始の24時間前に、 表1に示す濃度のシード細胞;ただし、使用する細胞株/種類や治療方法によっては、必要に応じて密度を調整してください。完全増殖培地(Eagles modified essentials medium(EMEM))と10%熱不活化ウシ胎児血清(HIFS)、1%ペンストレップ(10,000U/mLペニシリン/10mg/mLストレプトマイシン)、および1%非必須アミノ酸を含む細胞を増殖させます。
- 従来の細胞播種方法を用いた播種細胞32.アッセイ後の顕微鏡を使用しない場合は、完全に黒いプレートで細胞を播種します。T75フラスコの細胞の密度と一般的な健康状態を、使用前に顕微鏡で評価します。
- 清潔で無菌のクラスII生物学的安全キャビネットで、厳格な無菌技術に従って、細胞培地を廃棄し、~15mLの滅菌室温(RT)PBSで細胞を穏やかに洗浄し、廃棄します。
- 細胞フラスコに滅菌済みの1xトリプシン5 mLを加え、細胞単層が覆うように穏やかに揺さぶり、細胞の剥離を促進するために37°Cのインキュベーターに5分間入れます。
- 熱不活化ウシ胎児血清(10%)を含む増殖培地、約10mLを添加してトリプシン化を停止します。
- 細胞を50 mLの遠心チューブに移し、200 x g のペレットで5分間移します。メディアを廃棄し、同じメディア5mLと交換します。細胞が均一になり、凝集が観察されなくなるまで、チューブ内に細胞を再懸濁します。
- 20 μLの細胞懸濁液を取り出し、血球計算盤に入れてカウントします。必要な細胞数を計算したら、希釈を行って正しい細胞密度の溶液を作ります。
- 96ウェルプレート(容量350μL)に細胞を含む培地をピペットで、ウェルあたり最大容量は200μLです。細胞を5% CO2 を入れた37°Cインキュベーターに24時間置き、プレート表面に接着します。
- 総グルタチオンとGSSGの両方を評価するには、両方の条件のサンプルを処理します。6つのウェルを播種して処理し、GSHとGSSGをそれぞれ2セットずつ提供し、3つのテクニカルリピートを行います(図1 はレイアウトを示しています)。
- アッセイを開始する前に、すべての試薬が適切に調製されていることを確認してください。pH 7.4 PBS(EDTAなし)を除き、バッファーの構築またはアッセイでの使用を開始する前に、すべてのバッファー成分と試薬がRTであることを確認してください。ただし、pH 7.4 PBS(EDTAなし)は、使用するまで氷上または冷蔵保存する必要があります。
注:アッセイ内で所望の反応が発生し、プレートリーダーによる正確な定量を可能にするために、気泡形成を最小限に抑えることが非常に重要です。
| 細胞株 | 播種密度(96ウェルプレート) |
| ヘップG2 | 10,000細胞/ウェル |
| A549 | 5,000細胞/ウェル |
| J774の | 10,000細胞/ウェル |
表1:選択した細胞株の推奨播種密度。 示されたのは、表現されたデータで使用されている3つの異なる細胞株、具体的にはA549、J774、およびHepG2の異なる播種密度です。
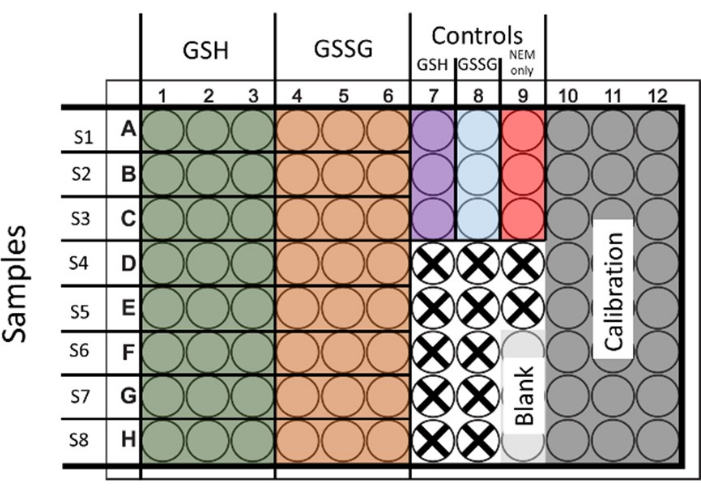
図1:総グルタチオンとグルタチオンジスルフィドの同時測定のための96ウェルプレートの播種のための提案されたレイアウト。 キャリブレーションと制御用のウェルも実演されています。利用されていない井戸は十字で表されます。 この図の拡大版を表示するには、ここをクリックしてください。
3. ナノマテリアル処理
- ナノ材料(特にZnO、TiO2、CuO、およびAg)をμg対応の重量スケールで秤量します。ナノ材料あたり1 mg/mLの初期濃度を達成するための計算を実行します。
- ナノ材料溶液をソニケーターに移し、ソニケーションバス(38W)を使用して16分間ソニケーションし、均質な溶液を生成します。各ナノ材料について、125、62.5、31.25、15.625μg/mLで一連の希釈を行います。
- インキュベーターから細胞を取り出し、RT PBSで軽く洗浄します。すべてのPBSが除去されたことを確認した後、コントロール(HIFSを含まない培地)を使用して、プレートに100μLの処理を追加します。細胞に処理を適用した後、37°Cのインキュベーター(5%CO2)でナノ材料と4時間インキュベートします。その後、以下のプロトコルを使用してGSH(GSSG、タンパク質濃度、およびAK放出)を定量化します。
4. アッセイプロトコール
- 治療への曝露後(図2A)、アデニル酸キナーゼ(AK)活性(オプション)を介して生存率を評価します。このアッセイには、製造元の指示に従って市販のキットを使用してください。
- 200 x g の遠心分離機でプレートを5分間回転させ、処理と細胞破片を軽くペレット化します(図2B)。
- 各サンプルとコントロールウェルから20 μLの培地上清を静かに取り除き(上記で指定)、同じレイアウト形式で隣接する96ウェルの白色プレートにピペットで移します(図2C)。
- AKキットから各ウェルに100 μLの作業溶液を加え、プレートを光から遮蔽し、室温で10分間現像します。プレートリーダーを使用して1000カウント/秒で発光を記録します。
- GSH標準試料については、各ウェルに40 μLの総グルタチオンバッファーを添加します(図2D;オプション、定量に必要)。
- プレートから残った媒体を吸引し、氷冷した0.1 M PBS、pH 7.2で3回洗浄し、標準試料を除き、各洗浄(図2E)を廃棄します。GSHキャリブレーションがプレートにロードされるまで、最終洗浄をプレートに残しておきます。
- 各グルタチオン濃度とブランク(ddH2O)を各10 μLをウェルに3回加えます。
- 最終的なPBS洗浄液を取り出し、表2に従って混合物を各ウェルに加えて、目的のターゲット定量を行います(図2E)。この手順を開始する前に、完全なバッファーでは時間的制約のあるアクティビティーの損失のため、必要なボリュームを計算してください。アッセイプロセスを開始する前に、これらの試薬ミックスが作成されていることを確認してくださいが、使用前に30分以上放置しないでください。
- オービタルプレートシェーカーに置き、プレートを300RPMで2分間振とうします(図2F)。
- シェーカーから取り出し、NEMコントロールウェルを除く各ウェルに5μLの0.01M TCEP溶液を加えます。プレートをシェーカーに戻し、10分間インキュベートします(図2F)。
- プレートを遠心分離機に移し、200 x g で5分間遠心します。各サンプルウェルから25 μLを別の96ウェルプレート(透明)に移します。これは、タンパク質の濃縮に利用されます(ステップ4.15を参照。 図2G)。標準物質やアッセイコントロールを移管しないでください。
- 各ウェルの最終容量が30μLであることを確認してください。この要件を満たすために、コントロールと標準からボリュームを削除します(図2H)。
- 170 μLの作業用OPA溶液を各ウェルに加え、プレートを光から遮蔽し、シェーカーに15分間置きます(図2I)。
- プレートリーダーを使用して、Ex340/Em450で蛍光を読み取ります(図2J)。測定段階で気泡が存在しないことを確認します。これらは、プレートリーダーによる反応と定量の両方に悪影響を及ぼします。
- 溶解した細胞のタンパク質含有量を定量するには、市販のBCAアッセイキットを使用します。ステップ 4.12 で採取したサンプルを、新しい 96 ウェルプレート (透明) にウェルあたり 25 μL で移します。
- IP溶解バッファーで希釈したウシ血清アルブミン(BSA)標準試料を使用し、ウェルあたり25 μLでプレートに3回添加します。正確な濃度は、BCAキットのプロトコルで定義されています。
- BCAキットから50:1の比率の試薬AとBからなるワーキング溶液を調製し、サンプル、標準、およびコントロールを含む各ウェルに200μLを加えます。プレートを光から遮蔽し、37°Cで30分間 インキュベートします(図2K)。
- インキュベーターからサンプルを取り出し、室温で5分間平衡化した後、562 nmのプレートリーダーで吸光度を読み取ります(図2L)。
| 総グルタチオン濃度溶解試薬ミックス | |
| コンポーネント | 容積 |
| 溶解バッファー | 50μL |
| 総容量/井戸 | 50μL |
| 酸化グルタチオン濃度溶解試薬ミックス | |
| コンポーネント | 容積 |
| 溶解バッファー | 49.5μL |
| NEM(25mM) | 0.5μL |
| 総容量/井戸 | 50μL |
| 混合物の組成から30分以内に両方の溶液を使用してください | |
| OPA検出ソリューションコンポーネント | 容積 |
| OPA 3mg/mL | 5μL |
| PBS(pH 9.0) | 165μL |
| 総容量/井戸 | 170μL |
表2:プロトコールを実行するために必要な試薬の量。 総グルタチオン、グルタチオンジスルフィド、および必要な作業試薬の測定にウェルごとに必要な量。必要なボリュームが計算され、転送によるボリューム損失を考慮して超過分が含まれていることを確認します。
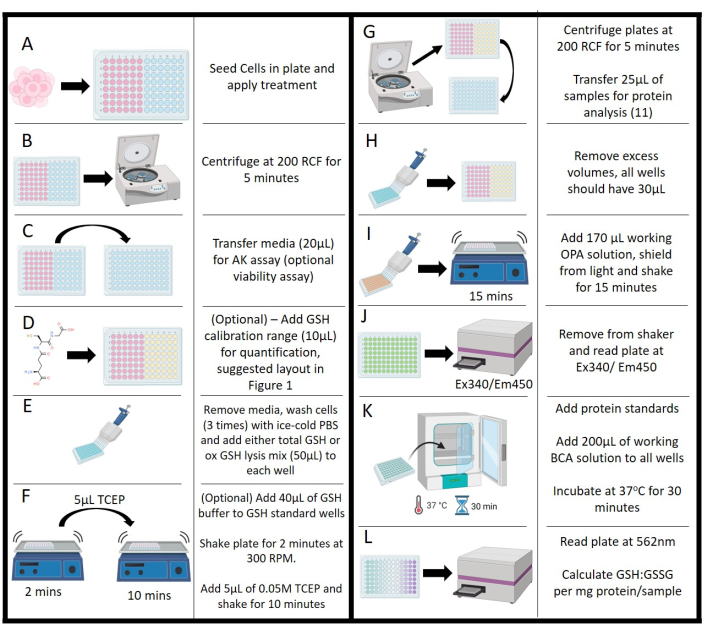
図2:プロトコールの概略図(A)細胞の初期播種、インキュベーションおよび処理。(B)懸濁物質から媒体を分離するための遠心分離。(C)アデニル酸キナーゼアッセイのための培地移入。(D)キャリブレーション範囲のためのグルタチオン濃度の添加。(E)洗浄段階と溶解試薬の添加。(F)バッファー添加およびトリス(2-カルボキシエチル)ホスフィン添加、振とうステップ。(G)タンパク質分析のための培地除去のための溶解細胞の遠心分離。(H)プレート全体のボリュームを均等にするためのメディアの除去。(I)オルト-フタルアルデヒド作業溶液の添加と振とうインキュベーション。(J)プレートリーダーによるオルトフタルアルデヒド蛍光の測定。(K)タンパク質測定のためのビシンコニン酸アッセイのインキュベーションステージ。(L)グルタチオンの正常化を可能にするタンパク質濃度の測定:グルタチオンジスルフィド値。この図の拡大版を表示するには、ここをクリックしてください。
代表的な結果
このプロトコールに従って、A549およびJ774細胞株をそれぞれ5,000細胞/ウェルおよび10,000細胞/ウェルの密度で播種し、5%CO2 中で37°Cで48時間培養しました。ナノマテリアル処理後のAK分析を 補足表1に、タンパク質濃度を 補足表2に示します。
キャリブレーショングラフ
図3に示されているのは、3つの異なる細胞タイプの3つの別々のプレート(ただし、キャリブレーションに影響を与えないはずです)から、記載された濃度範囲(0.234〜30 μMの最終濃度)を使用して、3つの異なる連続しない日に3回のキャリブレーションを行ったものです。3つのサンプルが示されていますが、Nは12で観察され、平均R2値が0.9932±0.007と同様の線形回帰を示しました。
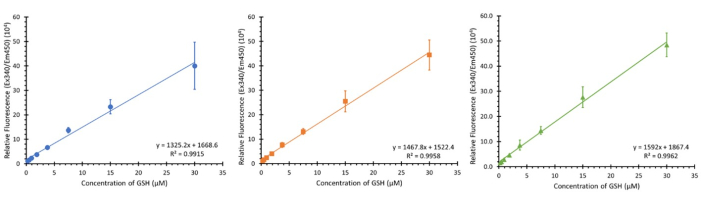
図3:アッセイ用のグルタチオンキャリブレーショングラフ。 別々のインプレートグルタチオンキャリブレーション範囲からの3つのキャリブレーショングラフ、それぞれ1週間間隔で実行。エラーバー ± SD (n=3, N=12) n=技術複製、N=生物学的複製。 この図の拡大版を表示するには、ここをクリックしてください。
サンプル結果
HepG2、A549、およびJ774細胞は、酸化ストレスを介して細胞メカニズムの変化を誘発すると疑われるさまざまなナノマテリアルの評価に利用されました。記載されている検出および定量プロトコルを利用しました。
3つの測定(AK、BCA、GSH/GSSG)から受け取ったデータは、以下のように扱われました。AKおよびBCAアッセイは、標準化のために実装されました。推奨キットを使用したAKアッセイは、細胞培地に放出されるAKの量について、最も速く、最も単純なデータを提供します。AK値の増加は、細胞死の増加につながると予想されます。したがって、-ve (Alive) と +ve (Dead) の制御が必要です。これにより、パーセンテージに基づく正規化が可能になります。
BCAアッセイは長いプロセスですが、タンパク質定量(mg / mL)を介して定量可能な結果を取得できます。これには、AK のように -ve または +ve 制御は必要ありませんが、値の正規化を達成するためには、一般的な -ve 制御 (未処理のセル) が必要です。
この代表的な結果セクションでは、処理(ナノマテリアル)がAKアッセイに干渉を引き起こす可能性があることがわかりました。したがって、すべての正規化はBCAデータを使用して実行されました。したがって、情報は、タンパク質のmg / mL(BCAアッセイによる)あたりの検出された分子種の濃度(GSHまたはGSH+GSSG(ただし、GSH+GSSG濃度を求めるために総GSH+GSSG濃度からGSH濃度を差し引く)として表されます。所望であれば、これを次いで、所望の治療からのGSH:GSSGの変化を評価するための比率に変換することができる。
図4に示されているのは、OPAプロトコルを使用して取得され、BCA(μg/mL)を介してタンパク質発現に正規化された3つの異なる細胞株(A549、J774、およびHepG2)からのGSH:GSSG比データであり、追加のGSHおよびGSSG値を指定するさらなるデータは、補足図1にあります。
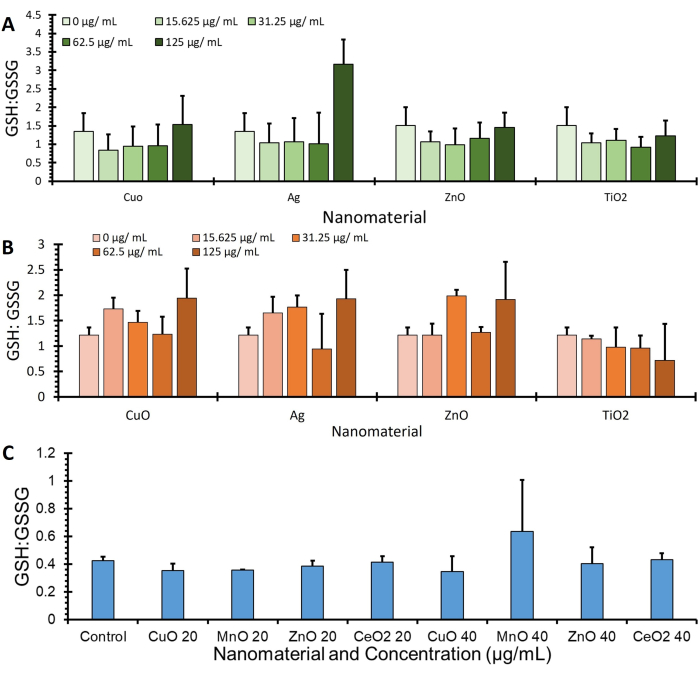
図4:グルタチオン:アッセイの実施によるグルタチオンジスルフィド比。 示されているのはグルタチオンです:3つの細胞株、すなわち(A)A549、(B)J774、および(C)HepG2のグルタチオンジスルフィド比。細胞を処理剤(無血清培地中の種々のナノマテリアル)と4時間インキュベートした。細胞は、グルタチオンおよびグルタチオンジスルフィドの変化を定量化するためにこのプロトコルを使用して処理され、タンパク質定量、エラーバー±SE(n = 3、N = 3)によって正規化されました この図の拡大版を表示するには、ここをクリックしてください。
プレートには、アッセイが正しく実行されたことを確認するための一連のコントロールも含まれています。NEMは、OPA検出媒体との相互作用の欠如を示すために、個別のコンポーネントとして追加されます。このキャリブレーション標準試料は、GSH濃度の増加とともに直線的に増加することを示しており、これは、OPA検出試薬がGSHの濃度の増加に効果的に結合する有効能力を示しています。
このアッセイは、チオールに一般的に見られる遊離スルフヒドリル基(一般に抗酸化物質と考えられているGSHなど)を特異的に標的としていることに注意する必要があります。相互作用の可能性の1つは、OPAのタンパク質チオールへの結合であり、これによりデータ収集が不正確になります。したがって、BCAアッセイは、データをタンパク質に正規化し、遊離GSHを正確に反映できるようにするための重要な段階です。
補足図1: グルタチオン、グルタチオンジスルフィド、およびグルタチオン:(A)A549、(B)J774、(C)HepG2の3つの細胞株からのグルタチオンジスルフィド比を示す図。細胞を処理剤(無血清培地中の種々のナノマテリアル)と4時間インキュベートした。細胞は、グルタチオンおよびグルタチオンジスルフィドの変化を定量化するためにこのプロトコルを使用して処理され、タンパク質定量、エラーバー±SE(n = 3、N = 3)によって正規化されましたこの ファイルをダウンロードするには、ここをクリックしてください。
補足表1: A549およびJ774細胞のアデニル酸キナーゼ値のメタデータ。 このファイルをダウンロードするには、ここをクリックしてください。
補足表2: A549、J774、およびHepG2細胞のキャリブレーションによるビシンコニン酸値のメタデータ。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
前述のように、細胞の酸化還元を理解し、酸化ストレスの状態を監視し、抗酸化応答を監視する必要性は、癌や神経変性などの無数の疾患を理解し予防するために常に重要でした33,34。ここで示すのは、正確なGSHのアクセシビリティを向上させることにより、トランスレーショナルランドスケープを改善する手段です:GSSG検出を迅速で最小限の準備で。
このプロトコルは、細胞内グルタチオン/チオール種(還元および酸化)を測定するためのアッセイのマルチパラメトリックシーケンスを、BCAタンパク質アッセイおよび/またはAKアッセイによる標準化の2つの手段で実証しています。このアッセイは、最初のメディエーター抽出ステップを通じて他のさまざまなマーカーを検出するように変更することもでき、キャリブレーション範囲を除外して酸化/減少したチオール比を単純に得る方法で簡略化できます。
分析種の評価を検討する際には、mBCI と OPA の両方を調査し、使用について比較しました。mBClは当初、良好なシグナル電位を示しましたが、使用には大きな制限があることが発見されました。主に、生細胞の使用はmBClの最良の使用を示しています。しかし、細胞溶解後、シグナルは消光されることがわかり、OPA35と比較してマルチウェルフォーマットでは一般的に減少します。もう一つの問題は、mBClによるGSSGの測定であり、これに関する文献はまばらであり、プロトコルの最適化/探索を通じて、mBClによるGSSGの正確な検出は達成されませんでした。
OPAアッセイは、0.234〜30μMのGSH濃度範囲で平均0.9932±0.007(N = 12)のR2 で、非常に信頼性の高いキャリブレーション範囲を示すことを実証しました。この範囲は、文献35に見られる以前の参照範囲のために選択された。理論的には、これらの範囲外でグルタチオンを検出することは可能ですが、試薬の濃度、インキュベーション時間、および場合によっては検出に使用される機器を変更する必要があります。各プレートには、定量のために独自の標準範囲が必要であることに注意する必要があります。異なる日に実行されるプレート間の時間のわずかな変動は、測定中に得られる値に大きな影響を与える可能性があります。
このプロトコルから正確で信頼性の高いデータを得るには、いくつかの重要なステップを厳守する必要があります。プロトコールに必要なさまざまなバッファーを構築する際には、pHが正確であることが重要です。したがって、pH 9 を必要とするバッファーは、この値の 0.1 ±を超える偏差を持つべきではありません。これは、緩衝液成分が間違ったpHで溶液から沈殿する可能性があるためです。このプロトコルに正確に従うと、この問題を回避できます。
また、プレート読み取り段階でのアーチファクトや不正確なデータ取得を防ぐためには、処理を完全に除去し、溶解前に正確に洗浄することが重要です。細胞が溶解されると(ステップ4.8)、処理の除去は不可能であり、プレートは回収できません。プロトコル全体を通じて追加されるバッファー/試薬の量はサンプルや標準によって異なるため、ステップ4.12および4.13でユーザーがさまざまな容量を認識していることが重要です。また、アッセイオペレーターは、これらのさまざまな容量を認識し、正確な測定が達成できるように、すべての容量が同じであることを確認するように指示されます。サンプルとスタンダードの間の体積は目に見えて重要ではないため、サンプルウェルに過剰な溶液があることに関して、間違いを犯しやすい可能性があります。
このプロトコルには、正確で信頼性の高いデータを取得するために重要なステップに依存する制限があります。このアッセイを行うユーザーは、気泡形成などの望ましくない問題を防ぐために、妥当なレベルの実験室スキルを持っている必要があります。気泡形成は、マイクロプレート内での反応能力と蛍光測定の両方に劇的な影響を与えます。このプロトコルで使用される溶解剤には洗剤が含まれているため、初心者の研究者にとっては気泡形成を防ぐのが難しい場合があります。即時の遠心分離により、このエラーを補うことができます。このプロトコルは、細胞タイプに関しても潜在的に制限されています。細胞株A549、J774、およびHepG2を使用して、このプロトコルのデータを最適化し、生成しました。他の細胞株では、正確なデータを得るために、異なる播種密度とプロトコールの最適化が必要になる場合があります。
このプロトコルには、いくつかの既存のアッセイに比べて多くの利点があります。フタルアルデヒドを用いたチオールの検出は新しい概念ではありませんが、このような組み合わせアッセイ形式で、必要な材料と機器が限られているマイクロプレートで利用することで、すべてのラボがこのプロトコルにアクセスできる大きな可能性を秘めています。商用サプライヤーのほとんどのチオール/GSHキットは、試薬の組成を開示していません。したがって、非互換性/干渉の可能性を予測するのは難しい場合があります。ここでは、その可能性を制限するために利用されたすべての試薬の各成分を示します。
このプロトコルは、初期治療期間の完了時にもかなり迅速に実行されます。インキュベーション段階間のユーザープロセッシングを考慮すると、このプロトコルのチオール定量化の側面は1時間未満で実行できます。サンプルは同時に溶解および結合されるため、これらの反応種に最適なサンプルの自己酸化が防止されます。プロトコールでは指定されていませんが、技術的にはサンプルをプレートで溶解して密封し、将来の分析のために凍結することができます。しかし、このプロトコルの変更は、まだ検討されていません。
開示事項
著者は、利益相反を宣言しません。
謝辞
この研究は、ヨーロッパのプロジェクトGRACIOUS(GA760840)とSUNSHINE(GA952924)によって資金提供されました。著者はまた、何らかの形でこの議定書の開発を支援したすべての人々の努力に感謝したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| 0.22µm filter (optional-For lysis buffer) | Fisher scientific | 12561259 | |
| 100mL volumetric flask | Fisher scientific | 15290866 | |
| 1L Volumetric flask | Fisher scientific | 15230876 | |
| 250mL beaker (optional-For lysis buffer) | Fisher scientific | 15409083 | |
| 8-Channel micropipette (20-200µL) | SLS | FA10011D2 | |
| 8-Channel micropipette (2-20µL) | SLS | B2B06492 | |
| 96 well plates - black with clear bottom, TC treated | Fisher scientific | 10000631 | Preferred plate for seeding and fluoresence, use TC treated clear if unavailable |
| 96 well plates - clear (TC treated and untreated) | Fisher scientific | 10141161 | If black plates with clear bottom is not available/ suitable use TC treated clear |
| 96 well plates - white, Not TC treated | Fisher scientific | 11457009 | |
| A549 (lung carcinoma) cell line | ATCC | CCL-185 | |
| Absolute ethanol | Merck (Sigma-Aldrich) | 1.08543 | |
| Aluminium foil | Fisher scientific | 11779408 | For protecting plates from light |
| BCA Assay Kit | Thermo | 23225 | |
| Benchtop Centrifuge (with 96 plate rotor) | Eppendorf | 5804 | |
| Ethylenediaminetetraacetic acid (EDTA) | Merck (Sigma-Aldrich) | E9884 | |
| Glutathione (GSH) | Merck (Sigma-Aldrich) | G6013 | |
| Glutathione disulfide (GSSG) | Merck (Sigma-Aldrich) | G4501 | |
| Glycerol | Merck (Sigma-Aldrich) | G5516 | |
| HCl, 37% | Merck (Sigma-Aldrich) | 258148 | Dilute to 1mM for GSH stock, pH adjustment also |
| HepG2 (Hepatocarcinoma) cell line | ATCC | HB-8065 | |
| IGEPAL CA-630 | Merck (Sigma-Aldrich) | 18896 | Use either IGEPAL CA-630 or NP-40 for solution, not both |
| IP lysis buffer | Fisher scientific | 11825135 | |
| J774 (monocyte, macrophage) cell line | ATCC | TIB-67 | |
| KCl | Merck (Sigma-Aldrich) | P3911 | |
| KH2PO4 | Merck (Sigma-Aldrich) | P0662 | |
| Micropipette (20-200µL) | SLS | B2B06482 | |
| Micropipette (2-20µL) | SLS | B2B06478 | |
| Microplate shaker | VWR | 444-0041 | |
| Na2HPO4 | Merck (Sigma-Aldrich) | S9763 | |
| NaCl | Merck (Sigma-Aldrich) | S9888 | |
| NaOH, 10M | Merck (Sigma-Aldrich) | 72068 | For pH adjustment only |
| N-Ethylmaleimide (NEM) | Merck (Sigma-Aldrich) | E3876 | |
| NP-40 | Merck (Sigma-Aldrich) | 492016 | Use either IGEPAL CA-630 or NP-40 for solution, not both. NP-40 alternative suggested |
| Ortho -Phthaldialdehyde (OPA) | Merck (Sigma-Aldrich) | P1378 | |
| PBS 0.1M | Merck (Sigma-Aldrich) | P2272 | PBS can either be acquired pre-made or made in house, see notes |
| Plate reader (with fluoresence capacity) | Tecan | SPARK | |
| Stir bar (optional-For lysis buffer) | Fisher scientific | 16265731 | |
| Toxilight bioassay kit (AK assay) | Lonza | LT17-217 | |
| Tris(2-carboxyethyl)phosphine hydrochloride (TCEP) 0.5M in H2O | Alfa Aesar | H51864 | Can also be purchased crystalised and suspended |
| TRIS-HCl | Merck (Sigma-Aldrich) | 93363 | |
| X100 phosphatase and protease cocktail | Fisher scientific | 10025743 |
参考文献
- Barnham, K. J., Masters, C. L., Bush, A. I. Neurodegenerative diseases and oxidative stress. Nat Rev Drug Discov. 3 (3), 205-214 (2004).
- Arfin, S., et al. Oxidative stress in cancer cell metabolism. Antioxidants. 10 (5), 642 (2021).
- Cooke, M. S., Evans, M. D., Dizdaroglu, M., Lunec, J. Oxidative DNA damage: mechanisms, mutation, and disease. The FASEB Journal. 17 (10), 1195-1214 (2003).
- Ghezzi, P., Jaquet, V., Marcucci, F., Schmidt, H. H. H. W. The oxidative stress theory of disease: levels of evidence and epistemological aspects. Br J Pharmacol. 174 (12), 1784-1796 (2017).
- Bhattacharyya, A., Chattopadhyay, R., Mitra, S., Crowe, S. E. Oxidative stress: An essential factor in the pathogenesis of gastrointestinal mucosal diseases. Physiol Rev. 94 (2), 329-354 (2014).
- Yin, F., Sancheti, H., Cadenas, E. Mitochondrial thiols in the regulation of cell death pathways. Antioxi Redox Sig. 17 (12), 1714-1727 (2012).
- Balcerczyk, A., Bartosz, G. Thiols are main determinants of total antioxidant capacity of cellular homogenates. Free Rad Res. 37 (5), 537-541 (2003).
- McBean, G. J. Cysteine, glutathione, and thiol redox balance in astrocytes. Antioxidants. 6 (3), 62 (2017).
- Nimse, S. B., Pal, D. Free radicals, natural antioxidants, and their reaction mechanisms. RSC Adv. 5 (35), 27986-28006 (2015).
- Nordberg, J., Arnér, E. S. J. Reactive oxygen species, antioxidants, and the mammalian thioredoxin system1. Free Rad Biol Med. 31 (11), 1287-1312 (2001).
- Pham-Huy, L. A., He, H., Pham-Huy, C. Free radicals, antioxidants in disease and health. Int J Biomed Sci. 4 (2), 89 (2008).
- Harris, I. S., DeNicola, G. M. The complex interplay between antioxidants and ROS in cancer. Trend Cell Biol. 30 (6), 440-451 (2020).
- Traverso, N., et al. Role of glutathione in cancer progression and chemoresistance. Oxid Med Cell Longev. 2013, 972913 (2013).
- Day, R. M., Suzuki, Y. J. Cell proliferation, reactive oxygen and cellular glutathione. Dose-Resp. 3 (3), 425-442 (2005).
- Aquilano, K., Baldelli, S., Ciriolo, M. R. Glutathione: new roles in redox signaling for an old antioxidant. Front Pharmacol. 5, 196 (2014).
- Zitka, O., et al. Redox status expressed as GSH: GSSG ratio as a marker for oxidative stress in paediatric tumour patients. Onco Lett. 4 (6), 1247-1253 (2012).
- Childs, S., Haroune, N., Williams, L., Gronow, M. Determination of cellular glutathione: glutathione disulfide ratio in prostate cancer cells by high performance liquid chromatography with electrochemical detection. J Chrom A. 1437, 67-73 (2016).
- Giustarini, D., et al. glutathione disulfide, and S-glutathionylated proteins in cell cultures. Free Rad Biol Med. 89, 972-981 (2015).
- Özyürek, M., et al. Determination of biothiols by a novel on-line HPLC-DTNB assay with post-column detection. Analytica Chimica Acta. 750, 173-181 (2012).
- Zhang, L., Lu, B., Lu, C., Lin, J. Determination of cysteine, homocysteine, cystine, and homocystine in biological fluids by HPLC using fluorosurfactant-capped gold nanoparticles as postcolumn colorimetric reagents. J Sep Sci. 37 (1-2), 30-36 (2014).
- Tsiasioti, A., Georgiadou, E., Zacharis, C. K., Tzanavaras, P. D. Development and validation of a direct HPLC method for the determination of salivary glutathione disulphide using a core shell column and post column derivatization with o-phthalaldehyde. J Chromat B. 1197, 123216 (2022).
- Huang, D., Ou, B., Prior, R. L. The chemistry behind antioxidant capacity assays. J Agri Food Chem. 53 (6), 1841-1856 (2005).
- Berker, K. I., Güçlü, K., Tor, &. #. 3. 0. 4. ;., Demirata, B., Apak, R. Total antioxidant capacity assay using optimized ferricyanide/prussian blue method. Food Anal Meth. 3 (3), 154-168 (2010).
- Rahman, I., Kode, A., Biswas, S. K. Assay for quantitative determination of glutathione and glutathione disulfide levels using enzymatic recycling method. Nat Prot. 1 (6), 3159-3165 (2007).
- Kampa, M., et al. A new automated method for the determination of the Total Antioxidant Capacity (TAC) of human plasma, based on the crocin bleaching assay. BMC Clin Pathol. 2 (1), 3 (2002).
- Fernández-Checa, J. C., Kaplowitz, N. The use of monochlorobimane to determine hepatic GSH levels and synthesis. Anal Biochem. 190 (2), 212-219 (1990).
- Nauen, R., Stumpf, N. Fluorometric microplate assay to measure glutathione S-transferase activity in insects and mites using monochlorobimane. Anal Biochem. 303 (2), 194-198 (2002).
- Stevenson, D., Wokosin, D., Girkin, J., Grant, M. H. Measurement of the intracellular distribution of reduced glutathione in cultured rat hepatocytes using monochlorobimane and confocal laser scanning microscopy. Toxicol in vitro. 16 (5), 609-619 (2002).
- McBeth, C., Stott-Marshall, R. J. Interference of reversible redox compounds in enzyme catalysed assays–Electrochemical limitations. Anal Biochem. 662, 114972 (2023).
- Yu, Z., et al. Reactive oxygen species-related nanoparticle toxicity in the biomedical field. Nanoscale Res Lett. 15 (1), 115 (2020).
- Boyles, M., et al. Development of a standard operating procedure for the DCFH2-DA acellular assessment of reactive oxygen species produced by nanomaterials. Toxicol Mech Meth. 32 (6), 439-452 (2022).
- Segeritz, C. P., Vallier, L. Cell culture: Growing cells as model systems in vitro. Basic Sci Meth Clin Res. , 151-172 (2017).
- Ma, Q. Role of nrf2 in oxidative stress and toxicity. Ann Rev Pharmacol Toxicol. 53, 401-426 (2013).
- Calabrese, V., Cornelius, C., Dinkova-Kostova, A. T., Calabrese, E. J., Mattson, M. P. Cellular stress responses, the hormesis paradigm, and vitagenes: novel targets for therapeutic intervention in neurodegenerative disorders. Antioxid redox Signal. 13 (11), 1763-1811 (2010).
- Ishkaeva, R. A., Zoughaib, M., Laikov, A. V., Angelova, P. R., Abdullin, T. I. Probing cell redox state and glutathione-modulating factors using a monochlorobimane-based microplate assay. Antioxidants. 11 (2), 391 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved