新しい注射部位修復技術によるマウスモデルにおける反復頸動脈内注射の促進
要約
マウスモデルにおける注射後の頸動脈内動脈の修復は、注入された材料の分布に悪影響を与えることなく動脈への血流を戻します。注射部位の修復は、同じ動脈を通るその後の注射を容易にし、完全なCircle of Willisを欠くマウス系統の脳虚血を予防します。
要約
神経腫瘍学における血管内選択的動脈内送達法を用いた新規抗腫瘍治療薬の送達における近年の進歩を考えると、マウスモデルにおける頸動脈内注射の方法、例えば注射後のマウスの頸動脈を修復してその後の注射を可能にする方法など、神経内注射の方法を開発することが急務となっています。私たちは、マウスモデルで頸動脈内注射を行い、2つの代替手順で内頸動脈(ICA)に治療薬を送達する方法を開発しました。
注射時には、外頸動脈(ECA)の周りに縫合糸を結んだ後、針を総頸動脈(CCA)に挿入し、注射された治療薬がICAに送達されます。注射後、総頸動脈(CCA)を結紮することができるため、頸動脈内注射の回数は1回に制限されます。この記事で説明する代替手順には、頸動脈内注射の後にCCAの注射部位修復を行う変更が含まれており、これによりCCA内の血流が回復し、一部のマウスモデルに見られる脳虚血の合併症を回避できます。
また、骨髄由来ヒト間葉系幹細胞(BM-hMSC)の頭蓋内腫瘍への送達を、注射後の注射部位修復の有無にかかわらず頸動脈内注射で送達した場合と比較しました。BM-hMSCの送達は、方法間で大きな違いはありません。私たちの結果は、CCAの注射部位修復により、同じ動脈を介した繰り返しの注射が可能になり、注入された材料の送達と分布が損なわれないことを実証しています。したがって、ヒトの頸動脈内注射をより厳密にエミュレートする柔軟性の高いモデルを提供します。
概要
脳腫瘍への治療薬の送達は、血液脳関門(BBB)と血液腫瘍関門(BTB)の不透過性のために困難です。BBBを回避するための治療薬の直接腫瘍内注射は、Ommyaリザーバーカテーテルの使用、対流増強送達のための低流量マイクロインフュージョン、または切除腔または隣接組織1への局所注射によって達成され得る。ただし、これらの方法で到達する腫瘍組織の総量は限られています 2,3,4。動脈内注射は、腫瘍5,6,7,8のより多くの腫瘍に到達することを目的として、脳腫瘍に治療薬を送達するために以前に使用されてきましたが、最近では、動脈内送達技術と新しい治療薬の両方の進歩により、脳腫瘍の治療にこのアプローチを使用することの利点が実証されています7、9.これらの進歩には、マイクロカテーテルの開発、高度なイメージングによる血管内選択的動脈内(ESIA)送達、BBBとBTBを阻害するための浸透圧剤の使用、標的生物学的療法の開発が含まれます。したがって、動脈内注射で投与される新規治療薬の前臨床試験を実施するためには、適切なトランスレーショナルリサーチモデルが必要である9,10。
脳腫瘍のマウスモデルでは、腹腔内または静脈内(尾静脈)に送達された治療薬は、それぞれ肝臓または心臓と肺を通過してから、脳を含む全身に分布します。これらの初回通過効果は、薬剤を捕捉して除去するか、または脳に到達する前に薬剤を希釈し、脳内で治療用量を達成する前に用量制限毒性を示す可能性があります。.対照的に、頸動脈内注射は、初回通過代謝をバイパスし、オフターゲット送達を制限することにより、循環前に脳への集中送達を可能にします。マウスの頸動脈内注射はより労働集約的ですが、この技術の特異性と再現性により、完全な調査11,12への動物数が減少します。
一般に、マウスにおける頸動脈内注射の前述の方法では、総頸動脈は注射後に結紮され、脳への循環は、ウィリス11,12の円を介して対側頸動脈および後脳循環によって提供されます。この方法には、内頸動脈または外頸動脈への最大1回の注射のみを可能にするという固有の制限があります。また、頸動脈が結紮される実験で使用されるマウス系統が、結紮された動脈13による脳虚血を予防するために完全なCycle of Willisを有することも重要である。頸動脈の閉塞もまた、脳血流を減少させ、注入された粒子の分布を制限することが実証されている14。さらに、注射後のマウスにおける頸動脈の閉塞は、ヒト患者における頸動脈内注射を模倣しない。
私たちのグループは以前に頸動脈内注射を使用して、間葉系幹細胞を脳にうまく送達しました10,15,16,17,18,19。この記事では、この頸動脈内注射の方法について詳しく説明します。また、動脈を閉塞せずに注射部位を修復し、注射後の頸動脈結紮による制限を回避する、開発した方法の変更が含まれています。この方法では、総頸動脈(CCA)を目的の注入部位の両端に1つずつ、合計2つの縫合糸を配置し、下部縫合糸(注入部位の下)を引き締めて注入する準備をします。外頸動脈(ECA)は、別の縫合糸を使用してシールされます。針はCCAに挿入され、治療薬は内頸動脈(ICA)に送達されます。これに続いて、CCAの上部縫合糸を締めて、ICAからの逆流を防ぎます。このステップでは、注入されたCCAをライゲーションまたは修復することができます。CCAを結紮する場合は、縫合糸を締めて所定の位置に残します。注入部位を修復すると、修復後に縫合糸を抜いて血流を回復させます。これらの代替手順の詳細については、以下で説明します。
プロトコル
以下に概説するすべての手順は、テキサス大学MDアンダーソンがんセンターの動物管理および使用委員会によって確立され、承認されたガイドラインに従う当社のプロトコルに準拠しています。
1. 手術台と手術用マウスの作製
- 外科手術のための手術台とマウスの準備(図1A、Bを参照)
- 解剖顕微鏡と光源をイソフルラン気化器の前に配置してアクティブ掃気システムを使用するか、ダウンドラフトテーブルに置きます。電気加熱パッドを解剖顕微鏡ベース(または、ベースが固体で熱を伝達できる場合はできれば顕微鏡の下)に置き、滅菌外科用ドレープで覆います。
注:すべての手術器具とドレープは、使用前にオートクレーブ滅菌し、すべての使い捨て品は滅菌して個別に包装する必要があります。滅菌手袋は、セットアップと手順全体を通して使用し、無菌性を維持するために必要に応じて交換する必要があります。 - ビニールラボテープを使用して、外科用ドレープにベッド(長さ4〜5インチx幅2インチ)を準備します。1.5インチ x 1.5インチ四方のガーゼをカットし、しっかりと巻いて、ベッドの「頭」にある3インチのビニールテープの下に巻いたガーゼを置いて枕を形成します(枕を使用して頭を傾けると、腹側の首の領域がさらに広がります)。
- ベッドの側面に沿って(ビニールテープの上に)4インチのサージカルテープを置きます。[イソフルランを使用する場合は、重り(またはテープ)を取り付けた麻酔鼻コーンをベッドの頭の近くに置きます。マウスを麻酔して拘束したら、特定の位置に調整します。 図 1A、B を参照してください。
- ニードルドライバーまたは重い鉗子を使用して、綿棒から綿の小片をはがし、直径0.5〜1 mmのさまざまなサイズのボールに転がします(マウスあたり8〜10個の綿片)。ベッドの頭の近くの外科用ドレープに綿を置いておきます。
- 滅菌器具を使用して、6-0縫合糸を1cmの小片(マウスあたり3〜4個)に切断します。準備した縫合糸の長さを滅菌ドレープの上に置きます。ブプレノルフィンまたはその他の適切な鎮痛剤を投与するための1 mLシリンジを準備します(施設動物管理および使用委員会[IACUC]プロトコルによって承認されています)。.すべての手術器具を滅菌フィールドに配置する前に、IACUC基準に従って滅菌してください。
- 解剖顕微鏡と光源をイソフルラン気化器の前に配置してアクティブ掃気システムを使用するか、ダウンドラフトテーブルに置きます。電気加熱パッドを解剖顕微鏡ベース(または、ベースが固体で熱を伝達できる場合はできれば顕微鏡の下)に置き、滅菌外科用ドレープで覆います。
- 外科的処置のためのマウスの調製(図1C-Fを参照)
- 主要な生存手術のためにIACUCによって承認された方法に従って、1匹のマウスを麻酔します(個々のマウスの感度に基づいてイソフルラン1%〜4%を使用するか、体重100〜200mg / kg(ケタミン)で10 mg / mLケタミン、1 mg / mLキシラジンのカクテルを使用します)。必要に応じて毛皮をクリップするか、脱毛します。0.5-1.0 mg / kgブプレノルフィンER(徐放性)を、外科的処置の開始30分前に皮下注射で投与します。.
- 麻酔をかけたマウスを、枕が首の下にくるように配置します(図1C)。枕は、麻酔鼻コーンと一緒に使用すると、首を伸ばして支えるのに役立ちます。ケタミン/キシラジンカクテルを使用する場合は、切歯の後ろの口に加重歯バーまたは同様のツールを置き、頭を傾けて首を伸ばします。.
- 手術ベッドの側面に沿って以前に配置されたサージカルテープを使用して前肢を拘束します(図1D)。首の腹面が見えるように顕微鏡下でマウスの位置を調整し、手術部位を快適に観察できるように倍率を調整します(図1E)。
注:解剖顕微鏡の倍率は、外科医が各ステップで快適なレベルに調整する必要があります。 - 滅菌綿棒を使用して人工涙液を塗布します。消毒剤ごとにベタジンまたはクロルヘキシジンとアルコールの円形スワブを交互に3回行って、手術部位を消毒します(図1F)。
- つま先をつまむことにマウスが足を引っ込めないようにして、麻酔の深さを確認します。呼吸数を監視し、マウスがあえいでいないことを確認してください、これはイソフルランを使用するときに過度の麻酔の兆候です。必要に応じて、酸素とイソフルランの流量を調整して、適切な麻酔の深さと呼吸に到達します。
2. 外科的処置(図2、 図3、 図4、 図5、 図6、 図7)
- 一次切開と解剖
- まず、頭蓋骨(胸骨の頭蓋端に突き出たしこり)まで開始し、滅菌メスブレードまたは同様の器具を使用して気管を横切って、縦1cmの正中線切開を行います(図2A)。
- 閉じたハサミの先端を切開部に挿入し、そっと開いて皮下結合組織の鈍的解剖を行い、2つの唾液腺を分離します。細い鉗子を使用して、切開部から右の唾液腺をそっと引っ張って、無菌的に準備された皮膚表面に置くか、鈍いフックリトラクターを使用して唾液腺を横方向に引っ込めます(図2B、C)。外部の腺が乾燥または粘着性があるように見える場合は、滅菌生理食塩水で湿らせます。
- 胸鎖乳突筋と二腹部筋が見えるまで、結合組織の鈍的解剖を続けます(図2D)。
注: 気管/胸骨舌骨 (sh) 筋、胸鎖乳突筋 (sm) 筋、および二腹部 (dg) 筋 (尾腹) によって形成される筋肉の三角形は、プロトコル内の正しい CCA と頸動脈分岐部を見つけるために使用されます。一般に、小さい方の舌骨(oh)筋は、CCAを横切って横たわっているのも見ることができます(図2D)。ただし、この筋肉のサイズはさまざまであり、若いマウスや小さなマウスでは舌骨筋が完全に存在しないことは珍しくありません。
- CCA アイソレーション
- 角度のある先端鉗子を使用して、筋肉の三角形の尾側端近くの結合組織の慎重な解剖を続けます(鉗子の先端を開くことにより)総頸動脈、頸静脈、および迷走神経を露出させます。
注:総頸動脈は、気管に隣接する最大の血管であり、一般に筋肉の三角形の基部で簡単に識別できます(図2E、矢印)。血管の周りの細かい鉗子は、先端が血管を傷つけやすく、過剰で致命的な出血を引き起こす可能性があるため、細心の注意を払ってください。 - 筋肉の三角形の基部から腱舌骨筋まで、総頸動脈の部分の周りの結合組織を注意深く解剖し続けます。小さな滅菌コットンボールを使用して、軽度の出血を制御し、必要に応じて唾液腺から分泌された液体を吸収します。
- 結合組織を慎重に解剖して、迷走神経からCCAを分離します。迷走神経の取り扱いと損傷を最小限に抑えるために特別な注意を払い、CCAに隣接する厚い白い神経束として簡単に識別できます(図2F)。
- 角度のある先端鉗子を使用して、筋肉の三角形の尾側端近くの結合組織の慎重な解剖を続けます(鉗子の先端を開くことにより)総頸動脈、頸静脈、および迷走神経を露出させます。
- CCAの準備
- CCAが胸鎖乳突筋から完全に動員されたら、そして見える場合は腿舌骨筋まで、マウスの胸骨の無菌的に準備された皮膚に1cmの6-0縫合糸を配置し(簡単に取得できるように)、角度のある先端鉗子をCCAの下に通過させます(迷走神経と頸静脈からCCAを分離するように注意してください)(図3A)).舌骨筋が存在しない場合は、CCAの周囲を十分にクリアして、CCAに縫合糸を配置し、提案された注射部位の頭蓋と尾側に縫合糸を配置し、針を挿入できるようにします。
- 細い鉗子を左手に持って、縫合糸を角度のついた先端の鉗子に通し、縫合糸の端近くをつかみます。角度のついた先端鉗子で縫合糸の長さの半分をCCAの下にそっと引っ張ります(図3B)。
- このプロセスを、最初の縫合糸と平行に2番目の縫合糸で繰り返します(図3C)。
- 各縫合糸をCCAの周りに緩く結びますが、結び目を締めたり、血流を制限したりしないでください(図3D)。
- 外部頸動脈の分離と準備
- 角度のある先端鉗子を使用して、筋肉の三角形の頭蓋端、頭蓋から舌骨筋の結合組織を慎重に取り除き、CCAとECAとICAへの分岐を見つけます(図4A)。
注:ECAは正中線に向かって角度がかかり、わずかに表面的ですが、ICAは横方向に角度がついて首の奥深くに移動します。分岐部のすぐ上のICAを横切る舌下神経(HN)の損傷を防ぐために、特別な注意を払ってください。 - 分岐部付近のECAのすべての側面から結合組織を慎重に取り除きます。ECAから十分な結合組織が取り除かれたら、マウスの胸骨の無菌的に準備された皮膚に縫合糸を留置し、ECAの下に角度のある先端の鉗子を通します。細い鉗子を左手に持って、ICAとECAの間のスペースにある角度のある先端鉗子に縫合糸を通し、縫合糸の長さの半分をそっと引き抜きます(図4B)。ECAの周りに縫合糸を緩く結びますが、結び目を締めないでください。
注:ECAから十分な結合組織を取り除き、斜めの先端鉗子で縫合糸をつかむことができ、動脈の周囲の結合組織を誤ってつかむことなく、縫合糸を回収するときに動脈に損傷を与えることが重要です。
- 角度のある先端鉗子を使用して、筋肉の三角形の頭蓋端、頭蓋から舌骨筋の結合組織を慎重に取り除き、CCAとECAとICAへの分岐を見つけます(図4A)。
- 針と注射器の準備
注:このステップでは、注射はまっすぐな針で行うことができ、これによりシリンジをマウスの体に当てて安定させることができます(図5A)。あるいは、先端近くで曲げられた針を使用して注射を行うことができ、手を手術台に置いた状態でシリンジを鉛筆のように保持することができます(図5B)。どちらの手法もうまく機能し、手法の選択は個人の好みです。- 曲がった針を準備するには、ベベルを上に向けて33 G、1/2インチの針を持ち、滅菌針ドライバーで先端をつかみます(図5C)。針を斜角に向かって直接約30〜40°曲げます(図5D)。
- 注射器に注射する溶液の適切な量を充填します(注射用の溶液が注射針を通して引き上げられてシリンジを装填しない場合は、針の空洞スペースを必ず考慮してください)。針を取り付け、気泡を取り除きます。溶液の半月板が針の斜角に見えることを確認します。.
- 頸動脈内注射。
- ECAの周りの縫合糸の結び目を締めます。次に、CCAの下部縫合糸を胸鎖乳突筋に向かってできるだけ下にスライドさせ、結び目を引き締めます。CCAの上部縫合糸が注射後まで緩んでいることを確認してください。滅菌コットンボールを空洞の端に置き、注射中に分泌された液体と血液を吸収します。
- 右手に注射器、左手に細い鉗子を持ち、CCAの下部縫合糸のすぐ上の動脈に針を運びます。細い鉗子を使用して、下部縫合糸の緩い端を尾側方向にそっと引っ張り、CCAに低レベルの張力をかけます(図6A)。
- 針を斜角のすぐ後ろのCCAに挿入し、縫合糸からゆっくりと張力を解放します(図6B)。
注:動脈にはかなりの血流があり、針が挿入されると手術腔に出血する可能性があります。ただし、針が斜角を越えて挿入されると、動脈は針の周りにシールを形成し、出血は止まります。針を所定の位置に固定したままの継続的な出血は、針が動脈に十分に進んでいない(斜角からの隙間が血液の流れを可能にする)か、針が動脈の後ろに押し込まれていることを示します。動脈を引き裂いたり、針が滑り落ちたりしないように、針を極端に静止させることが重要です。出血イベントのある動物を継続的に監視し、出血が著しい場合(動物が色を失った場合、チアノーゼ性に見える場合、触ると冷たくなる場合、または動物使用プロトコルに記載されているその他の人道的なエンドポイントの場合)、人道的なエンドポイントを適用する必要があります。 - 左手でシリンジプランジャーを押して、溶液を非常にゆっくりと注入します(図5B、100μLの溶液を注入するのに15秒以上)。溶液の注入が終了したら、針を取り外さないでください。.逆流を防ぐために、左手の細い鉗子で、CCAの上部縫合糸(まだ緩く結ばれている)を結び目でつかみ、持ち上げて動脈をねじります(図6C)。
- 針を取り外し、注射器を脇に置き、右手で先端の角度のついた鉗子を拾います。動脈のねじれを維持したまま、CCAの上部縫合糸の結び目を締めます(図6D)。
注:この時点では、手術腔への追加の出血はないはずです。この手順に続いて、以下の手順 2.7 と 2.8 で説明する 2 つの代替手順があります。CCAをライゲーションする場合は、ステップ2.7に従ってください。CCAを注入部位で修復する場合は、手順2.8に記載されている変更に従ってください。
- CCAのライゲーション
- 循環をCCAに回復する必要がない場合は、動脈を結紮したままにし、両方の縫合糸をCCAで締め付けたままにします。.縫合糸の端をトリミングし、縫合糸の結び目が完全に締まっていることを確認します。
- ステップ2.9で説明されている終了および鎮痛手順に進みます。
- CCAインジェクション部位の修復と循環の回復のためのライゲーションの代替
- 滅菌コットンボールを使用して、手術腔内に残っている血液を吸収します。CCA(図7A)の注射部位を特定し、閉じるために必要な縫合糸の数を決定します。CCAの孤立した領域の注射部位と内腔を徹底的に洗浄して、凝固した血液を取り除きます。.
- 先端の角度のついた鉗子を使用して、スエージに近い針本体で9-0縫合針をつかみます。細い鉗子を使用して反対側から動脈を支えながら、注射部位の横方向、動脈に垂直に約1〜1.5mmの動脈壁を貫通することにより、CCAに単一の縫合糸を配置します。細い鉗子で動脈をホールドし、注射部位を開き、針と縫合糸を右側と左側に個別に通します。あるいは、動脈を保持し、細い鉗子で側面をそっと押し付け、針を通し、動脈の両側に一口で縫合します。
注:どちらの技術でも、針と縫合糸が動脈の内側の後壁を貫通しないように注意してください。 - 外科医の結び目で注射部位を閉じ、細い鉗子と角度のある先端の鉗子で器具を結び、最低4回のスローを使用します(図7B)。一般に、33 G 針の注入部位を閉じるには、1 つの単純な断続縫合糸を使用します。
- 細い鉗子を使用して循環を回復するには、ECAの周りの縫合糸をほどいて取り外し、続いてCCAの上部縫合糸を取り除きます(図7C、D)。次に、CCAの下部縫合糸をゆっくりと緩めますが、すぐにほどかないでください。注射部位が十分に閉じていて、血圧と血流が回復して大出血を防ぐことを確認します(図7D)。
注:注射部位で大出血が発生した場合は、CCAの下部縫合糸を迅速に締め直し、必要に応じて注射部位を調整または再縫合することができます。 - 上部と下部のCCA縫合糸を取り外します(図7E)。手順 2.9 に進みます。
- クロージングと鎮痛
- 唾液腺を空洞に再配置し、滅菌縫合パックを使用して3つの単純な中断縫合糸で切開部を閉じます。サージカルテープの拘束具を取り外し、マウスが加熱パッドの上で麻酔から回復するのを待ちます。
注: 鎮痛薬のフォローアップ用量は、ユーザーの承認された IACUC プロトコルで指定された頻度と用量に従って投与する必要があります。注射の間に1週間の治癒期間をお勧めします。.繰り返しの注射が必要な場合は、最初の注射後に注射部位の修復を行うことができ、その後の注射についても同じ外科的手順に従うことができます。その後の注射は、同じ注射部位を修復するために縫合を繰り返すと瘢痕化や血栓を引き起こす可能性が高いため、修復された注射部位に対してCCA頭蓋骨に投与することができます。
- 唾液腺を空洞に再配置し、滅菌縫合パックを使用して3つの単純な中断縫合糸で切開部を閉じます。サージカルテープの拘束具を取り外し、マウスが加熱パッドの上で麻酔から回復するのを待ちます。
代表的な結果
これまでの報告では、頸動脈内注射によって送達された骨髄由来ヒト間葉系幹細胞(BM-hMSC)がマウスの頭蓋内神経膠腫にうまくホーム化されることが示されている19。このモデルを使用して、神経膠腫担持マウスにおける BM-hMSC の頸動脈内注射後の循環回復による CCA ライゲーションと CCA 修復の効果を比較しました。無痛ヌードマウスにU87神経膠腫細胞を移植した後、GFP標識BM-hMSCを注入し、その後CCAライゲーションを行うか、循環が回復したCCA修復を行いました。3日後、マウスを屠殺し、脳を採取し、固定し、免疫組織化学を行ってGFPを検出し、GFP陽性細胞をカウントしました(図8A-D)。
GFP-BM-hMSCの頭蓋内神経膠腫への全体的なホーミングは、同じ標本の2つの異なるスライド(切片>75μm離れている)上の腫瘍境界内のGFP陽性細胞の総数によって評価されました。対応のない t検定による平均の比較では、2つの手順間で観察された平均ホーミング(P = 0.6858)の間に有意差はないことが示されました(図8E)。腫瘍全体へのGFP-BM-hMSCの分散は、腫瘍内の10の高検出能フィールドにわたるGFP陽性細胞をカウントすることによって評価されました。高検出能フィールド内の細胞数の増加は、手技のばらつきに起因する腫瘍全体への細胞分散の変化を示している可能性があります。Wilcoxon Signed Rank検定を用いた中央値の比較では、CCAライゲーション群とCCA修復群との間の高検出電場におけるGFP陽性細胞の中央値との間に有意差はないことが示されました(図8F)。

図1:手術用テーブルとマウスの準備 (A,B) 手術用ベッド(ラベル A.ベッドを形成するビニールテープ、B.手術用テープ前肢拘束具、C.枕、D.体重、E.麻酔鼻円錐、F.鈍いフックリトラクター、G.70%エタノール1cm縫合糸、H.細い鉗子、I.先端の角度付き鉗子、J.細いはさみ、K.滅菌綿球)。(C,D)マウスの位置。(E,F)手術部位と手術部位の消毒。 この図の拡大版を表示するには、ここをクリックしてください。
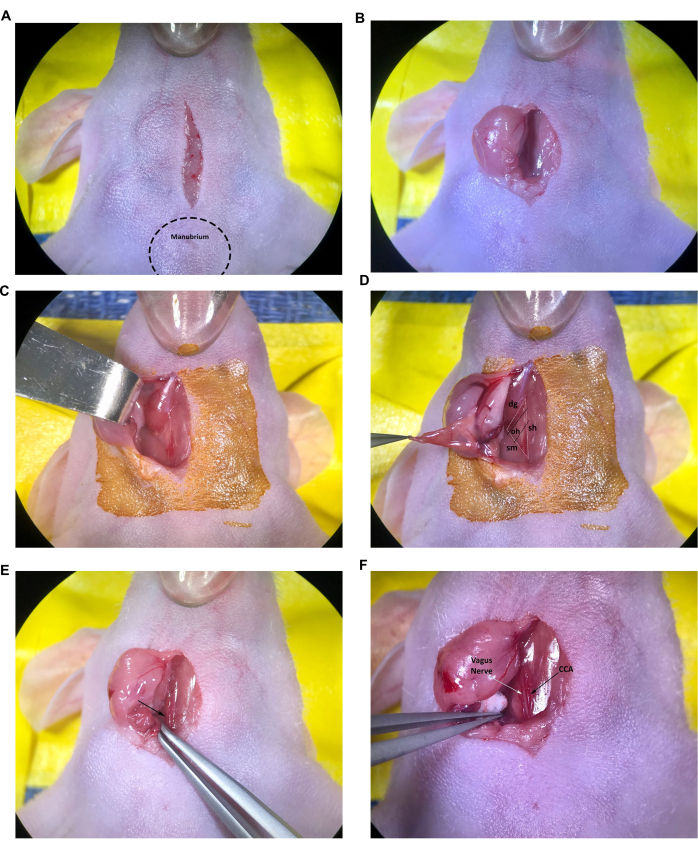
図2:注入部位の切開と構造物の露出(A)正中線切開。(B,C)右唾液腺の収縮。(D)気管・胸骨舌骨筋、胸鎖乳突筋、二胃筋・舌骨筋が形成する筋三角形も見える。(E)矢印で示されている総頸動脈。(F)迷走神経と総頸動脈、矢印で示されています。略語:sh =気管/胸骨舌骨筋;sm = 胸鎖乳突筋;dg =二腹筋;OH =舌骨筋;CCA = 総頸動脈。この図の拡大版を表示するには、ここをクリックしてください。
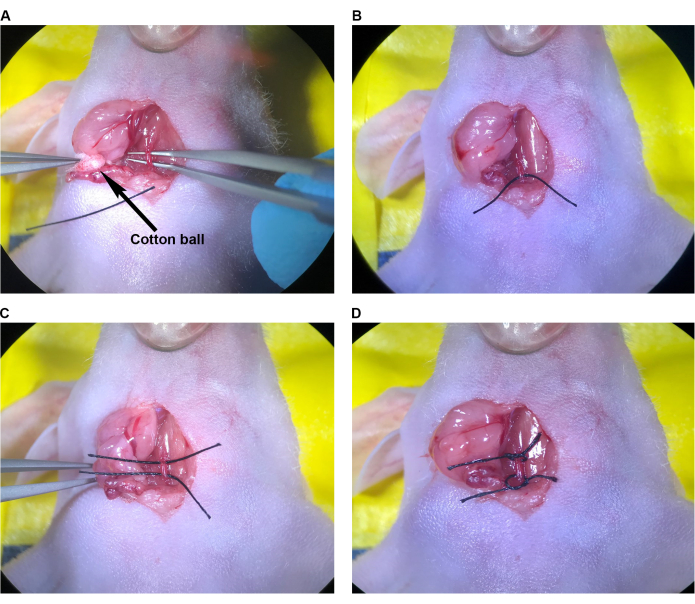
図3:CCAを注入するための準備(A)CCAの下を通過した先端の角度のある鉗子。(B)縫合糸は、角度付き先端鉗子を使用してCCAの半分まで引っ張られました。(C)2番目の縫合糸はCCAの半分まで引っ張られました。(D)縫合はCCAの周りにゆるく結ばれています。略語:CCA=総頸動脈。この図の拡大版を表示するには、ここをクリックしてください。
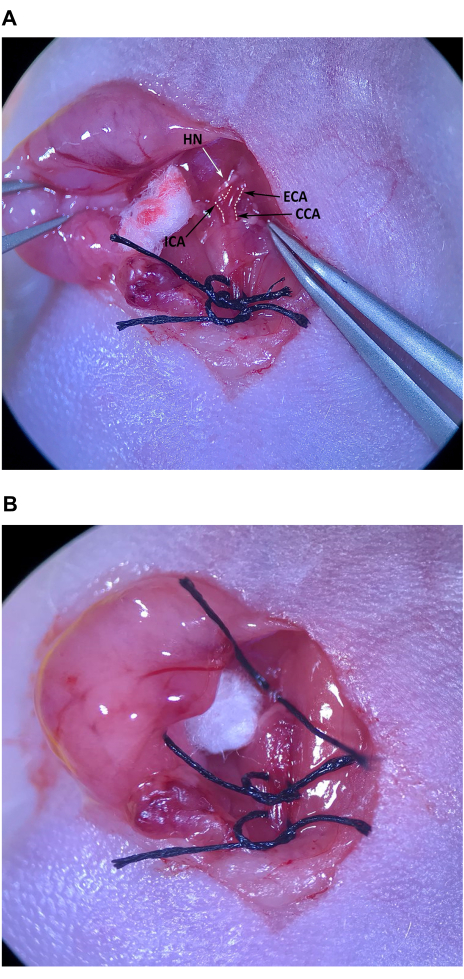
図4:外部頸動脈の分離と準備 (A)CCA、外部頸動脈、および内部頸動脈。(B)ECAの下の半分まで引っ張られた縫合糸。略語:CCA総頸動脈;ECA =外部頸動脈;ICA = 内頸動脈。 この図の拡大版を表示するには、ここをクリックしてください。
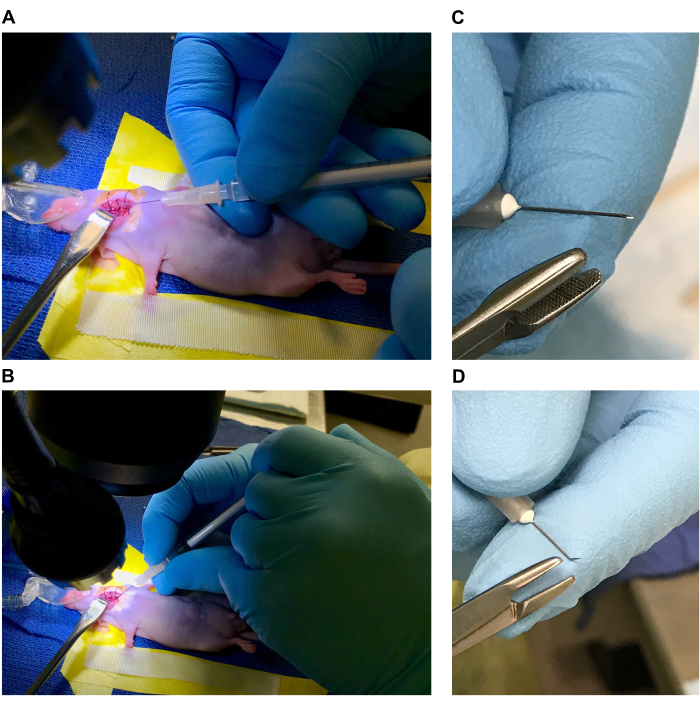
図5:針と注射器の準備 (A)マウスの体に注射器を当てたまっすぐな針による注射。(B)針を曲げて、手を手術台に置いて注射します。(C,D)曲がった針を準備します。 この図の拡大版を表示するには、ここをクリックしてください。
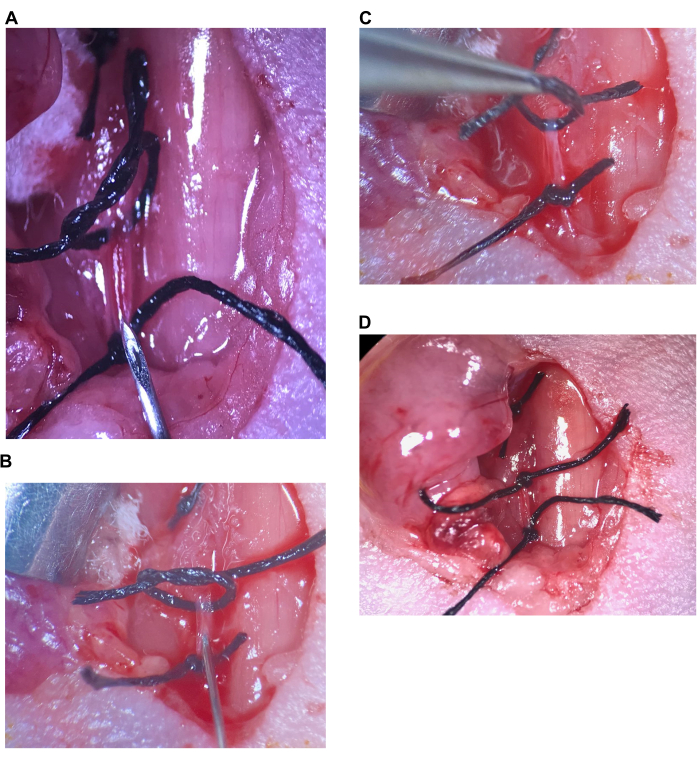
(A)上部縫合糸が緩んでおり、下部縫合糸がCCAで締め付けられ、針が下部縫合糸の上に配置されている。(B)針は斜角のすぐ後ろに挿入され、動脈は針の周りに密閉されます。(C)上部縫合糸を持ち上げて動脈を上向きにねじり、逆流を防ぎます。(D)CCAの上部縫合糸が締められています。略語:CCA=総頸動脈。この図の拡大版を表示するには、ここをクリックしてください。
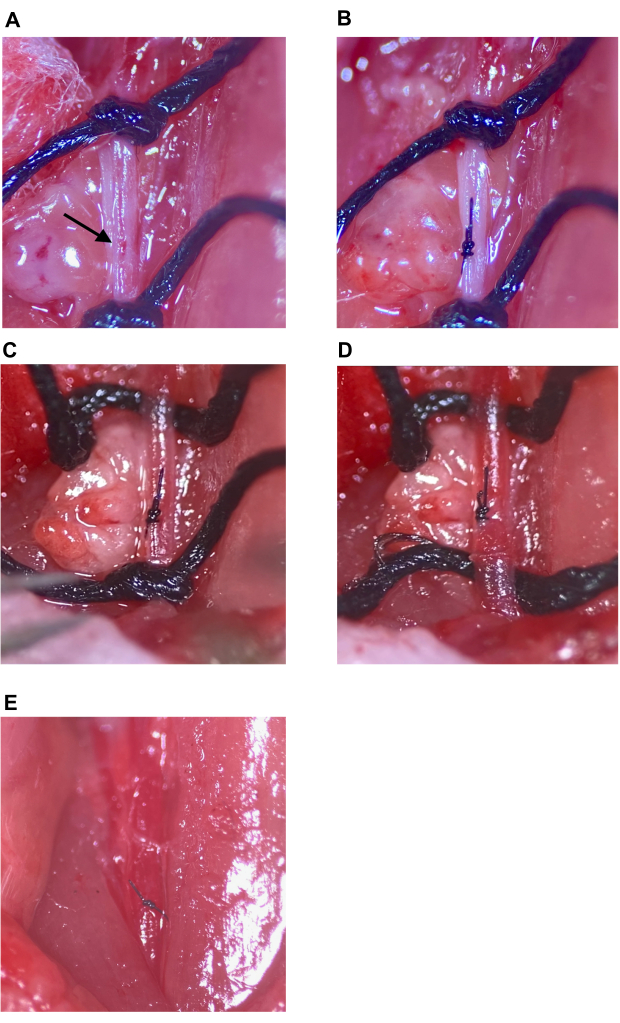
図7:注射部位の修復と循環の回復 (A)矢印で示された注射部位。(B)注射部位は、外科医の結び目で、最低4回のスローで閉じました。(C,D)注射部位の修復後のCCAの上部および下部縫合糸の緩み;縫合糸の緩み後に出血は見られません。(E)縫合糸は、注射部位が十分に修復されたと判断された後に除去されます。略語:CCA=総頸動脈。 この図の拡大版を表示するには、ここをクリックしてください。
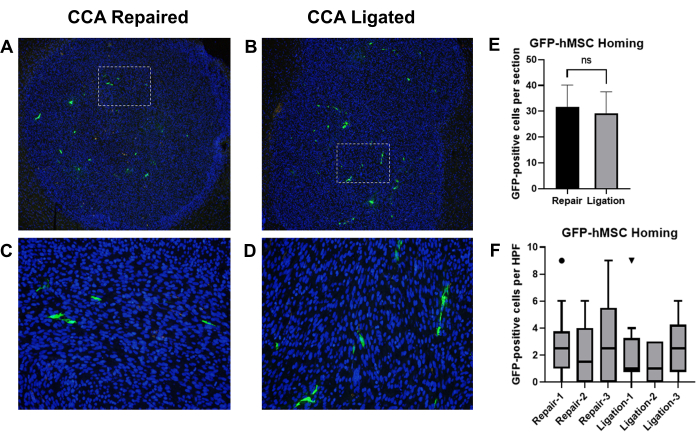
図8:GFP-BM-hMSCの頸動脈内注射と、CCA結紮または循環が回復したCCA修復後の頭蓋内神経膠腫腫瘍へのホーミングの比較。 担がんマウスの脳組織切片を抗GFP一次抗体およびAlexa Fluor 488二次抗体で染色し、GFP-BM-hMSCs(緑)を標識しました。核をHoechst 33342(青)で染色しました。腫瘍への全体的なホーミングを示す標識切片の代表的な低出力電界と、(A,C)CCA修復または(B,D)CCAライゲーション後のGFP陽性細胞分布を示す高電界。(E)GFP-BM-hMSCの腫瘍への全体的なホーミングは、2つの異なるスライド上の腫瘍境界内のGFP陽性細胞の総数によって評価され、 平均はt検定によって比較されました。代替手順間で全体的なホーミングに有意差は観察されませんでした(P = 0.6858)。(F)腫瘍全体へのGFP-BM-hMSCの分散は、腫瘍内の10の高検出能フィールドにわたるGFP陽性細胞をカウントすることによって評価した。Wilcoxon Signed Rank検定による中央値の比較では、手順に関係なく、個人間に有意差は見られません(P = 0.1914、0.5000、0.1641、0.9512、0.8828、0.2207)。略語:GFP =緑色蛍光タンパク質;GFP-BM-hMSCs = GFP標識骨髄由来のヒト間葉系幹細胞;CCA = 総頸動脈。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
頸動脈内注射は、近年、脳腫瘍に治療薬を送達するためにますます使用されています。そのため、ヒトの頸動脈内注射を模倣したマウスモデルを研究目的に確立することが重要です。以前は、マウスにおける頸動脈内注射は、その後の動脈の結紮とともに行われ、これにより動脈への注射回数が制限されていた11,12。さらに、マウスの頸動脈の閉塞は、完全なCircle of Willis13を持たない特定のマウス系統で脳虚血を引き起こす可能性があります。私たちは、注入した頸動脈を修復する方法を開発し、従来の方法の限界を克服しました。注射部位を修復すると、注射された動脈への血流が再確立され、脳虚血の可能性が減少し、同じ内部頸動脈へのその後の注射が容易になります。
成功に重要ないくつかのステップは、手術器具や組織の慎重な取り扱いを必要とします。針挿入前の注射部位からの結合組織の慎重な解剖;注射前にシリンジと針のすべての塊と気泡を取り除く。また、修復中に動脈の内腔が閉じないように、注射部位を正しく閉じます。針を挿入した後の出血を防ぐために、針が斜角を過ぎた動脈に挿入され、針軸の周りにシールが形成されていることを確認してください。動脈の後壁の裂け目を避けるために、針を浅い角度で挿入し、シリンジと針を微妙に揺らして、針先を動脈後壁から遠ざけます。注射中に注入された溶液が漏れ出た場合、これは針が動脈の周囲の結合組織にのみ挿入されたことを示唆しています。注射前に注射部位から余分な結合組織を注意深く解剖することで、この問題を防ぐことができます。
縫合糸と閉鎖技術の選択については、最初の注射で33Gの針を使用して動脈にきれいに挿入した場合、動脈を修復するには9-0縫合糸の簡単な縫合糸が1回あれば十分です。注射に大きめの針(30Gなど)を使用したり、針の挿入時に裂け目が発生した場合(例:針の中心から外れていたり、マウスが呼吸しているため動脈が動いている場合)、穴が少し大きくなり、修復が必要になります。通常、このタイプの大きな穴を修復するには、2つの単純な縫合糸または8の字で十分です。これら2つの技術のどちらを選択するかは、この状況での外科医の好みに基づいています。この修復技術は、注入部位の穴が上記の状況よりも大幅に大きい状況では評価されていないことに注意することが重要です。注入部位の裂傷が横方向に広がる(動脈の円周の3分の1を超える広い穴が開く)場合、この方法で修復すると動脈が収縮し、血栓症のリスクが高まる可能性があります。
縫合糸が抜去されるときに修復された注射部位からの出血がある場合は、正常な循環が再開するにつれて修復された部位が伸びたことが原因である可能性があります。これは、修復した注射部位を滅菌綿で優しく覆い、30秒間軽い圧力を加えることで修正できます。.あるいは、修復された注射部位からの出血があり、目に見える血流がなく、動脈が近位に膨張している場合は、修復中に縫合針が動脈の後壁を通過したことを示しています。この場合、修復時には注入部位の端をそっと開き、浅い角度で動脈に縫合針を通し、縫合糸が後壁を通過していないことを目視で確認してから縫合結びを結びます。
これらの対策を講じることで、注射部位の修復方法は、遺伝的背景や年齢に関係なく、動物のコホート間で正確かつ再現性のあるものとなります。私たちの経験では、3人の異なる外科医が手術を行い、成功率は100%でした。十分な経験を持ち、慎重に提供されたプロトコルに従うことで、他の外科医がこの手順を行うことに困難はないと予測しています。練習すれば、熟練した外科医は15〜20分で手順を完了することができます。実験でそれが許せば、上部と下部のCCA縫合糸をそのままにして、注射部位の修復を省略することで、動物1匹あたりの時間も短縮することができます。しかし、上述したように、脳血管の解剖学的構造における系統特異的な違いが文書化されており、実験を開始する前に、この手順で使用したマウスの系統がこれに耐えられることを確認することが重要です。
これは外科的処置であるため、マウスの回復を考慮する必要があります。ストレス耐性と創傷回復は重要な考慮事項であり、マウスの系統によって異なります。さらに、手術部位の炎症と瘢痕組織の形成により、手術を繰り返した後の回復時間が長くなる可能性があります。7日間隔で複数回の注射を行うことに成功していますが、より頻繁な注射が必要な場合は、使用する特定のマウス系統で慎重に評価する必要があります。CCAへの強い取り扱いとストレス(隔離、縫合糸の結束と取り外し、注射中)は、動脈壁を損傷して弱め、繰り返しの注射中に裂傷を引き起こす可能性があります。CCAや分岐部の周りの支持結合組織の解離を最小限に抑え、動脈に過度の張力を加えないようにすることが重要です。
私たちの結果は、この特定のモデルでは、CCA結紮または注射後の循環回復を伴うCCA修復は、頭蓋内腫瘍全体で注射されたBM-hMSCの全体的なホーミング頻度または分布に差がないことを示唆しています。これはマウス系統によって異なる場合がありますが、注射部位修復の使用には、注入された動脈に血流を戻すという利点があり、その後の同じ動脈への注射が可能になり、さらに重要なことに、ヒト患者の頸動脈内注射に類似しています。注入した動脈を結紮するか修復するかは、実験の種類と使用するマウスモデルに基づいて決まります。2回目の注入が必要な場合、またはマウスモデルに完全なCircle of Willisがない場合は、注入部位の修復を使用する必要があります。マウスモデルにCCAを再注入する能力は、追加の実験操作を容易にすることができます。例えば、経時的に投与される可能性のある治療法の複数回投与をテストするには、注入された動脈の修復がその後の注射を行うために不可欠です。この方法は、異なる時間に注射する必要がある治療薬の組み合わせを注射する実験にも有用です。注射された動脈の修復によってもたらされる頸動脈内注射の柔軟性の向上は、マウス脳腫瘍モデルの翻訳有用性を改善します。
開示事項
著者には、関連する開示/利益相反はありません。
謝辞
この研究は、国立がん研究所(R01CA115729、R01CA214749、および1P50 CA127001)からの助成金と、テキサス大学MDアンダーソンがんセンターのムーンショットプログラム™、ブローチ脳腫瘍研究財団、脳腫瘍研究のためのエリアスファミリー基金、プリシラ・ハイリーがん研究基金、バウマンファミリーキュアゲスト脳腫瘍研究基金、 Chuanwei Lu Fund、The Sweet Family Brain Cancer Research Fund、The Ira Schneider Memorial Cancer Research Foundation、The Jim & Pam Harris Fund、The Gene Pennebaker Fund for Brain Cancer Research、The Sorenson Fund for Brain Tumor Research、The Brian McCulloch Memorial Fund、TLC Foundation from the Heart and the Mary Harris Pappas Endowed Fund for Glioblastoma Research、 すべてはF.F.L.に
資料
| Name | Company | Catalog Number | Comments |
| 1 mL syringes (low dead space) | Air-tite Products Co. | A1 | |
| 26 G; 1/2" needle | Air-tite Products Co. | N2612 | |
| 33 G; 1/2" needle | JBP, Air-tite Products Co. | JBP3313B | |
| 3 cm Petri dish | Falcon, Fisher Scientific | 08-772A | |
| 3M durapore surgical tape | Fisher Scientific | 19-071-152 | |
| 6-0 suture thread | Fine Science Tools | 18020-60 | |
| 70% Ethanol | Fisher Scientific | 04-355-122 | |
| 9-0 microsurgical suture with needle | Fine Science Tools | 12052-09 | |
| Analgesic for major surgery | |||
| Artificial tears/ophthalmic ointment | Covetrus | 8897 | |
| Bead Sterilizer | Fisher Scientific | 14-955-341 | |
| Betadine/Chlorhexidine | McKesson, Fisher Scientific | NC1696484 | |
| Blunt hook retractor | Fine Science Tools | 17022-13 | |
| Dissecting microscope | Zeiss Microscopy, LLC | 491903-0010-000 | |
| Electric heating pad | Insource, Fisher Scientific | NC0667724 | |
| Extra narrow scissors | Fine Science Tools | 14088-10 | |
| Fine forceps - Dumont #5 forceps with micro-blunted tips | Fine Science Tools | 11253-20 | |
| Fine forceps - Dumont #5/45 angled tip forceps with micro-blunted tips | Fine Science Tools | 11253-25 | |
| Isoflurane vaporizer (or Ketamine/Xylazine cocktail) | Kent Scientific | VetFlo-1231 | |
| Light source | Laxco, Fisher Scientific | AMPSILED21 | |
| Mouse anesthesia nose cone | Braintree Scientific, Inc | XENO- M | |
| Needle driver | Fine Science Tools | 12002-12 | |
| Sterile cotton swabs | Texwipe, Fisher Scientific | 18-366-472 | |
| Sterile gauze pads | Covidien, Fisher Scientific | 22-037-907 | |
| Sterile saline (0.9%) | KD Medical, Fisher Scientific | 50-103-1363 | |
| Sterile surgical drapes | Fisher Scientific | 50-129-6666 | |
| Sterile surgical/downdraft table | |||
| Sterile suture pack (any suitable diameter for mouse wound closure) | Ethicon, Fisher Scientific | 50-209-2811 | |
| Surgical tools | |||
| Vinyl lab tape | Fisher Scientific | 15-901 |
参考文献
- Loya, J., Zhang, C., Cox, E., Achrol, A. S., Kesari, S. Biological intratumoral therapy for the high-grade glioma part i: Intratumoral delivery and immunotoxins. CNS Oncol. 8 (3), (2019).
- Garfield, J., Dayan, A. D. Postoperative intracavitary chemotherapy of malignant gliomas. A preliminary study using methotrexate. J Neurosurg. 39 (3), 315-322 (1973).
- Kroin, J. S., Penn, R. D. Intracerebral chemotherapy: Chronic microinfusion of cisplatin. Neurosurgery. 10 (3), 349-354 (1982).
- Sendelbeck, S. L., Urquhart, J. Spatial distribution of dopamine, methotrexate and antipyrine during continuous intracerebral microperfusion. Brain Res. 328 (2), 251-258 (1985).
- Alter, R. A., et al. Long-term benefit of intra-arterial bevacizumab for recurrent glioblastoma. J Exp Ther Oncol. 12 (1), 67-71 (2017).
- Angelov, L., et al. Blood-brain barrier disruption and intra-arterial methotrexate-based therapy for newly diagnosed primary cns lymphoma: A multi-institutional experience. J Clin Oncol. 27 (21), 3503-3509 (2009).
- Chen, S. R., Chen, M. M., Ene, C., Lang, F. F., Kan, P. Perfusion-guided endovascular super-selective intra-arterial infusion for treatment of malignant brain tumors. J Neurointerv Surg. 14 (6), 533-538 (2022).
- Faltings, L., et al. Rechallenging recurrent glioblastoma with intra-arterial bevacizumab with blood brain-barrier disruption results in radiographic response. World Neurosurg. 131, 234-241 (2019).
- Srinivasan, V. M., et al. Advances in endovascular neuro-oncology: Endovascular selective intra-arterial (esia) infusion of targeted biologic therapy for brain tumors. J Neurointerv Surg. 12 (2), 197-203 (2020).
- Shinojima, N., et al. Tgf-β mediates homing of bone marrow-derived human mesenchymal stem cells to glioma stem cells. Cancer Res. 73 (7), 2333-2344 (2013).
- Liu, Z., et al. Improving orthotopic mouse models of patient-derived breast cancer brain metastases by a modified intracarotid injection method. Scientific Reports. 9 (1), 622 (2019).
- Zhang, C., Lowery, F. J., Yu, D. Intracarotid cancer cell injection to produce mouse models of brain metastasis. Journal of visualized experiments : JoVE. (120), e55085 (2017).
- Barone, F. C., Knudsen, D. J., Nelson, A. H., Feuerstein, G. Z., Willette, R. N. Mouse strain differences in susceptibility to cerebral ischemia are related to cerebral vascular anatomy. J Cereb Blood Flow Metab. 13 (4), 683-692 (1993).
- Benbenishty, A., et al. Maintaining unperturbed cerebral blood flow is key in the study of brain metastasis and its interactions with stress and inflammatory responses. Brain, behavior, and immunity. 62, 265-276 (2017).
- Doucette, T., et al. Mesenchymal stem cells display tumor-specific tropism in an rcas/ntv-a glioma model. Neoplasia. 13 (8), 716-725 (2011).
- Hata, N., et al. Platelet-derived growth factor bb mediates the tropism of human mesenchymal stem cells for malignant gliomas. Neurosurgery. 66 (1), 144-156 (2010).
- Nakamizo, A., et al. Human bone marrow-derived mesenchymal stem cells in the treatment of gliomas. Cancer Res. 65 (8), 3307-3318 (2005).
- Qiao, Y., et al. Magnetic resonance and photoacoustic imaging of brain tumor mediated by mesenchymal stem cell labeled with multifunctional nanoparticle introduced via carotid artery injection. Nanotechnology. 29 (16), 165101 (2018).
- Yong, R. L., et al. Human bone marrow-derived mesenchymal stem cells for intravascular delivery of oncolytic adenovirus delta24-rgd to human gliomas. Cancer Res. 69 (23), 8932-8940 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
JoVEについて
Copyright © 2023 MyJoVE Corporation. All rights reserved