このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
赤痢菌による上皮細胞感染解析
要約
現在のプロトコルはin vitroの上皮細胞ラインを使用して赤痢菌の付着、侵入および細胞内複製を調査する伝染の試金を記述する。
要約
ヒトに適応した腸内細菌性病原体である赤痢菌は、毎年何百万人もの感染症を引き起こし、小児患者に長期的な増殖効果をもたらし、世界中で下痢による死亡の主な原因となっています。感染は、病原体が消化管を通過し、結腸を覆う上皮細胞に感染する結果として、水様または血性の下痢を誘発します。抗生物質耐性菌の驚異的な増加と承認されたワクチンの不足により、この手ごわい病原体を研究するには、標準化された研究プロトコルが不可欠です。ここでは、結腸上皮細胞における細菌の付着、浸潤、および細胞内複製のin vitro分析を使用して、赤痢菌の分子病因を調べるための方法論を紹介します。感染分析に先立ち、赤痢菌コロニーの病原性表現型は、寒天プレート上のコンゴ赤色色素の取り込みによって検証されました。また、バクテリア培養中にin vivo条件を模倣するために、サプリメントを添加した実験用培地を検討することもできます。次に、細菌細胞を標準化されたプロトコルで使用し、感染の各段階を分析するための適応を伴う感染の確立された多様性で、組織培養プレート内の結腸上皮細胞に感染します。アドヒアランスアッセイでは、赤痢菌細胞を培地レベルを下げてインキュベートし、細菌と上皮細胞との接触を促進します。浸潤アッセイと細胞内複製アッセイの両方で、ゲンタマイシンをさまざまな時間間隔で適用して細胞外細菌を排除し、浸潤の評価および/または細胞内複製速度の定量化を可能にします。すべての感染プロトコルは、感染した上皮細胞溶解物を段階的に希釈し、コンゴ赤寒天プレート上の感染力価と比較して細菌コロニー形成単位をめっきすることにより、付着細菌、侵入細菌、および/または細胞内細菌を列挙します。これらのプロトコルを組み合わせることで、上皮細胞の赤痢菌感染の各段階について、独立した特性評価と比較が可能になり、この病原体の研究に成功します。
概要
腸内細菌性病原体によって引き起こされる下痢性疾患は、世界的な健康上の重大な負担です。2016年、下痢性疾患は世界で130万人の死亡の原因となり、5歳未満の子供の死因の第4位でした1,2。グラム陰性腸内細菌性病原体である赤痢菌は、世界中で下痢による死亡の主な原因である赤痢症の原因物質です3。赤痢症は、低・中所得国の子どもに毎年重大な罹患率と死亡率を引き起こし4,5、高所得国での感染は、保育所、食品媒介、水媒介の発生に関連しています6,7,8,9。効果のないワクチン開発10と薬剤耐性(AMR)11,12の上昇により、大規模な赤痢菌の集団発生の管理が複雑になっています。米国疾病管理予防センター(CDC)の最近のデータによると、2020年には米国における赤痢菌感染症の約46%が薬剤耐性を示しており13,14、世界保健機関(WHO)は赤痢菌をAMRの優先病原体として宣言しており、新しい治療法が緊急に必要とされています15。
赤痢菌感染症は、汚染された食品や水を摂取すると、糞便-経口経路を介して、または直接の人間との接触を介して容易に伝染します。赤痢菌は、効率的なヒト適応病原体に進化し、10〜100個の細菌の感染量で病気を引き起こすのに十分です16。小腸の通過中、赤痢菌は高温や胆汁などの環境信号にさらされます17。これらのシグナルを検出すると、転写変化が誘発され、細菌がヒト結腸に感染する能力を高める病原性因子が発現します17,18,19。赤痢菌は頂端表面から結腸上皮に侵入するのではなく、卵胞関連上皮内の特殊な抗原提示微小蕾細胞(M細胞)への取り込みに続いて上皮層を横切って通過します20,21,22。トランスサイトーシス後、赤痢菌細胞は常在マクロファージによって貪食されます。赤痢菌は急速にファゴソームから脱出し、マクロファージ細胞死を引き起こし、炎症誘発性サイトカインを放出します5,23,24。次に、赤痢菌は基底側から結腸上皮細胞に侵入し、マクロピノサイト液胞を溶解し、細胞質に複製ニッチを確立します5,25。炎症誘発性サイトカイン、特にインターロイキン-8(IL-8)は、多形核好中球白血球(PMN)を感染部位に動員し、上皮のタイトジャンクションを弱め、上皮内膜への細菌浸潤を可能にして基底側感染を悪化させます5。PMNは感染を封じ込めるために感染した上皮内膜を破壊し、その結果、細菌性(血性)赤痢の特徴的な症状が現れる5。浸潤と細胞内複製のメカニズムは徹底的に特徴付けられていますが、新しい研究は、消化管(GI)通過中の病原性調節17、アドヒアランス19、バリア透過性による基底側アクセスの改善26、栄養失調の小児における無症候性輸送27など、赤痢菌感染における重要な新しい概念を実証しています。
赤痢菌が下痢性疾患を引き起こす能力は、ヒトおよびヒト以外の霊長類(NHP)に限定されています28。赤痢菌の腸管感染モデルは、ゼブラフィッシュ29、マウス30、モルモット31、ウサギ21、32、33、ブタ34、35について開発されています。しかし、これらのモデルシステムのどれも、ヒト感染中に観察された疾患特性を正確に再現することはできない36。赤痢症のNHPモデルは赤痢菌の病因を研究するために確立されていますが、これらのモデルシステムは実装に費用がかかり、人為的に高い感染線量を必要とし、ヒトの感染線量よりも最大9桁高い37、38、39、40、41、42。したがって、ヒト宿主の感染に対する赤痢菌の顕著な適応は、赤痢菌の病因を正確に調べるための生理学的に適切なモデルを再現するために、ヒト由来の細胞培養の使用を必要とします。
ここでは、HT-29結腸上皮細胞への 赤痢菌 の付着、浸潤、および複製の速度を測定するための詳細な手順について説明します。これらの標準化されたプロトコルを使用して、細菌の病原性遺伝子と環境シグナルが 赤痢菌 感染の各ステップに影響を与える分子メカニズムを調べて、動的な宿主と病原体の相互作用関係をよりよく理解することができます。
プロトコル
1. 試薬・材料の調製
注:すべての容量は、2 枚の 6 ウェルプレートを使用したアッセイと一致しています。
- TSB培地:0.5 Lの脱イオン(DI)水を15 gのトリプシン大豆ブロス(TSB、 材料表を参照)培地とオートクレーブに加えます。室温で保存してください。
- 胆汁塩培地(TSB + BS):0.4%(w/v)胆汁塩を含むTSBを調製するには、0.06 gの胆汁塩(BS、 材料表を参照)を15 mLのオートクレーブ滅菌したTSBに再懸濁します。0.22μmのPESフィルターを使用してフィルター滅菌します。
注:胆汁塩は、コール酸ナトリウムとデオキシコール酸ナトリウムの1:1混合物で構成されています。使用直前に新しいメディアを準備してください。 - DMEM + 10% (v/v) FBS: 5 mL のウシ胎児血清 (FBS) を 45 mL の Dulbecco Modified Eagle Medium (DMEM) に加えます。4°Cで保存してください。
- DMEM + ゲンタマイシン:50 mL チューブに 50 mL の DMEM と 50 μL の 50 mg/mL ゲンタマイシンを加えます( 材料表を参照)。
注:各実験の前に、新鮮なアリコートを作り、37°Cの水浴で温めてください。 - PBS + 1% (v/v) Triton X-100:150 μL の Triton X-100 を 15 mL のリン酸緩衝生理食塩水(PBS)に加えます。
注:各実験の前に、新鮮なアリコートを作り、37°Cの水浴で温めてください。 - TSB + コンゴレッドインジケータープレート:1 LボトルにTSB15 g、厳選寒天7.5 g、コンゴレッド染料0.125 g( 材料表を参照)を加えます。0.5Lの脱イオン水とオートクレーブを加えます。10〜20 mLの培地を個々の滅菌ペトリ皿(100 mm x 15 mm)に注ぎ、固化させます。
注意:コンゴレッドは発がん性があり、生殖毒素です。コンゴレッドの取り扱いは、適切な個人用保護具を使用して行われるようにしてください。詳細については、製品安全データシートを参照してください。
注:約20枚のプレートは、0.5Lのコンゴレッド培地から作られています。プレートは2〜3日前に準備し、使用するまで室温で反転させておくことができます。長期保存の場合は、逆さにしたプレートをプラスチックスリーブに入れ、4°Cで最大3か月間保管します。 - DMEM + 10% (v/v) FBS および 5% (v/v) ジメチルスルホキシド (DMSO): 42.5 mL の DMEM、5 mL の FBS、2.5 mL の DMSO を 50 mL のチューブに加えます。4°Cで保存してください。
2.バクテリアの準備
注:すべての 赤痢菌 実験室の培養および保管プロトコルは、Payne、SM43から適合しています。
注意: 赤痢菌 はリスクグループ2の病原体44です。 赤痢菌 属菌の感染性が低いため、偶発的な曝露を制限するために追加の安全対策を講じて、すべての実験室作業をBSL-2環境で実施します。
- 冷凍株からの 赤痢菌 の増殖
- 滅菌アプリケーターを使用して、少量の凍結培養を極低温バイアルからTSB + Congo Red寒天プレートに移します。
- 接種ループを火炎滅菌し、冷まします。プレートの1つの象限を横切って前後に縞模様の接種を行います。ループを炎で燃やし、冷ましてから、プレートの第1象限から第2象限に縞模様を描きます。繰り返して、プレートの第3象限と第4象限に接種を縞模様にします。
注:または、各象限の間に新しい滅菌アプリケーターを使用して接種をストリークします。 - プレートを反転させ、37°Cで一晩インキュベートします。
注:コンゴ赤色陽性(CR+)表現型45の観察に必要な赤痢菌病原性因子の発現には、≥37°Cでのインキュベーションが必要です。病原性コロニーは白い外観をしており、侵襲的ではありません。 - プレートをパラフィンフィルムで密封し、4°Cで冷蔵保存します。
注:細菌コロニーは寒天プレート上で1〜2週間生存可能です。
- 液体培養における 赤痢菌 の一晩増殖
- 3 mL の TSB 培地を滅菌 14 mL 培養チューブに分注します。
- 滅菌アプリケーターを使用して、十分に単離された赤色(CR+)コロニーを1つ選び、液体培地に再懸濁します。
- 培養物を37°Cで一晩(16〜18時間)インキュベートし、毎分250回転(rpm)で振とうします。
3. HT-29真核細胞の調製
注:すべての容量は、2 枚の 6 ウェルプレートを使用したアッセイと一致しています。HT-29細胞株は、American Type Culture Collection(ATCC)から入手しました。HT-29のメンテナンスプロトコルは、ATCC勧告46から採用されています。すべての培地は、使用前に37°Cのウォーターバスで予熱する必要があります。すべてのHT-29メンテナンスプロトコルは、バイオセーフティキャビネットで実行する必要があります。培地中のHT-29細胞と混合/作業する際には、pHの劇的な変化を避けるために気泡の発生を控えてください。
- 凍結ストックからのHT-29細胞の融解
- HT-29細胞のバイアルを37°Cのウォーターバスで解凍します。
注意: 汚染を避けるために、キャップが水面から完全に浮かんでいることを確認してください。解凍には2分もかかりません。 - 培養物が完全に解凍された直後にバイアルを水から取り出し、70%エタノールで除染します。この時点からすべてのステップが無菌技術を使用して実行されていることを確認してください。
- バイアルのすべての内容物を、9 mL の DMEM + 10% FBS を含む 15 mL 遠心チューブに加えます。室温で125 x g で5分間遠心分離します。
- 上清を廃液容器にデカントし、ペレットを10 mLの温かいDMEM + 10% FBSに再懸濁します。再懸濁した細胞を、10 mLの温かいDMEM + 10% FBS(総容量20 mL)を含む75 cm2 の組織培養フラスコ(T75)に移します。
- 細胞が90%のコンフルエント度に達するまで、5%CO2 で37°Cで細胞をインキュベートします(約6〜7日)。
注:コンフルエンシーは、視覚的な近似によって推定されます。
- HT-29細胞のバイアルを37°Cのウォーターバスで解凍します。
- HT-29細胞の播種
- 20 mL の PBS と 50 mL の DMEM + 10% FBS を 37 °C のウォーターバスで予熱し、3 mL の 0.25% (w/v) トリプシン-EDTA を室温に予熱します。
- HT-29細胞(ステップ3.1から)が90%のコンフルエントに達したら、HT-29細胞培養培地をT75フラスコから廃液容器にデカントします。~10 mLの温かいPBSをフラスコに注ぎ、静かに渦巻かせて洗浄します。PBSを廃液容器にデカントします。再び温かいPBSで洗浄し、デカントします。
- 2〜3 mLの0.25%(w / v)トリプシン-EDTAを加え、表面積全体を静かに渦巻きさせます。37°C、5%CO2 で4分間インキュベートします。
- インキュベーターからフラスコを取り出し、トリプシン-EDTAを静かに渦巻きさせ、すべての細胞が表面から剥離することを視覚的に確認します。
- 直ちに6 mLのウォームDMEM + 10% FBSを加えて、トリプシンを不活性化します。ピペットで上下に動かして、完全に混ぜます。
- すべての内容物を15 mLの遠心チューブに移し、室温で500 x g で5分間回転させます。
- 上清を廃液容器に静かにデカントし、ペレットを6 mLの温かいDMEM + 10% FBSに再懸濁します。
- 再懸濁後すぐに、懸濁したHT-29細胞10 μLを培養の途中から0.2 mLのPCRチューブに移します。10 μLのトリパンブルー色素をPCRチューブに加え、混合します。
- 10 μL の HT-29 細胞/トリパンブルーミックスを、使い捨ての Countess 細胞カウンターチャンバースライドに加えます( 材料表を参照)。生細胞の数を列挙し、細胞生存率を計算します。
注:サンプル中の細胞数を文書化する場合は、総細胞数ではなく、「生」細胞数の下の数値を読み取ります。あるいは、血球計算盤を用いて細胞の列挙を手動で行うこともできます。 - 再懸濁したHT-29細胞を新しいT75フラスコまたは6ウェルプレートに播種します。
- T75フラスコの場合:
- ピペットで静かに混合し、以下の式に従って2.5 x 106 細胞を新しいT75フラスコに移します。
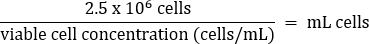
- ウォームDMEM + 10% FBS培地を最終容量20 mL(最終濃度1.25 x 105 細胞/mL)に添加します。
- 前後に静かに揺らして、フラスコ全体に細胞を均等に分散させます。
- 細胞のコンフルエント度が80%に達するまで、5%CO2 で37°Cでインキュベートします。
注:最適な増殖のために、DMEM + 10% FBS培地をT75フラスコに~3日ごとに交換してください。培地を廃液容器にデカントし、10 mLの温かいPBSをフラスコに加えます。PBSを静かに回し、廃液容器にデカントします。次に、20 mLの新鮮で温かいDMEM + 10% FBSをフラスコに加え、37°C、5% CO2 インキュベーターに戻します。
- ピペットで静かに混合し、以下の式に従って2.5 x 106 細胞を新しいT75フラスコに移します。
- 6ウェルプレートの場合:
- ピペットで静かに混合し、以下の式に従って 5.85 x 106 個の細胞を新しい 50 mL コニカルチューブに移します。
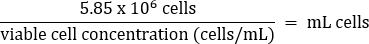
- ウォームDMEM + 10% FBS培地を最終容量26 mL(最終濃度2.25 x 105 細胞/mL)に添加します。
- ピペットで静かに混合し、2 mL(4.5 x 105 セル)を 6 ウェルプレートの個々のウェルに分注します。
- 上下左右に2〜3回静かに揺らして、ウェル全体に細胞を均等に分散させます。
- 細胞が80%〜95%のコンフルエントに達するまで、37°Cで5%CO2 でインキュベートします(約3〜4日)。
注:浸潤および細胞内複製アッセイには85%のコンフルエンシーが推奨され、アドヒアランスアッセイには90%〜95%のコンフルエンシーが推奨されます。細胞は、48時間のインキュベーション後に~85%のコンフルエントに達し、最終濃度は約1 x 106 細胞/ウェルになります。播種する細胞の数とインキュベーションの長さの調整が必要な場合があります。
- ピペットで静かに混合し、以下の式に従って 5.85 x 106 個の細胞を新しい 50 mL コニカルチューブに移します。
- T75フラスコの場合:
- 冷凍HT-29ストックの製造
- 1 mL の DMEM + 10% FBS + 5% DMSO 培地を個々の極低温バイアルに分注します。
- ステップ3.2.7のHT-29細胞1×10を6個各バイアルに加えます。以下の式に従ってセルの体積を計算します。
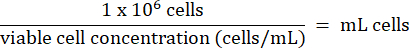
- HT-29細胞は、液体窒素蒸気貯蔵冷凍庫で-130°C以下で長期間保管してください。
4. アドヒアランスアッセイ
注:すべての容量は、2 枚の 6 ウェルプレートを使用したアッセイと一致しています。
- 赤痢菌を一晩継代培養し、1:50に希釈して新鮮な培地に培養します。
- ボルテックスし、適切なサイズの培養チューブに入れた5 mLの新鮮なTSBまたはTSB + BSに、各100 μLの一晩培養液を加えます。
注:適切な曝気を確保するために、培養液の容量を培養フラスコまたはチューブの容量の<20%に制限してください。 - 細胞が光学密度(OD600)0.7( 赤痢菌 増殖の対数中期)に達するまで、250rpmで振とうしながら37°Cでインキュベートします。約2〜2.5時間。
注:継代培養中に、50 mLのDMEMとすべての洗浄ステップに十分な量のPBSを分注し、37°Cのウォーターバスに入れます。使用前に培地を37°Cにしてください。
- ボルテックスし、適切なサイズの培養チューブに入れた5 mLの新鮮なTSBまたはTSB + BSに、各100 μLの一晩培養液を加えます。
- 2 x 108 コロニー形成ユニット(CFU)を継代培養した 赤痢菌 を個々の2 mL微量遠心チューブに移します。
注:2 x 108 CFUは、OD600 0.7で約1 mLの細菌細胞に相当します。OD600 の測定値を使用して、個々の分光光度計の校正に従ってCFU/mLを概算します。 - 赤痢菌サンプルをPBSで2回洗浄します。
- 室温で2分間、17,000 x g で遠心分離することにより、細胞をペレット化します。上清を吸引し、1 mLの温かいPBSを加えてペレットをよく再懸濁し、混合物が完全に均一になるまで(8〜10倍)サンプルを静かに上下にピペッティングします。
- 手順4.3.1をさらに1回繰り返します。
- 室温で17,000 x g で2分間遠心分離して細胞をペレット化し、上清を吸引し、ペレットを2 mLの温かいDMEMに再懸濁します。
注:再懸濁された細菌の最終濃度は、1 x 108 CFU/mLです。
- ボルテックスし、次に1 mL(1 x 108 CFU)の再懸濁赤 痢 菌を、6ウェルプレートで調製したHT-29結腸上皮単層の各ウェルに加えます(ステップ3.2.10.2から)。
注:感染は通常、感染の多様性(MOI:細菌細胞と上皮細胞の比率)が100の場合に行われます。さまざまなMOIを試験するには、赤 痢菌 を温かいDMEMで所望の濃度に希釈し、希釈した細菌1 mLをHT-29単分子膜に加えます。例えば、MOIが10の場合、150 μLの1 x 108 CFU/mLのバクテリアを1.35 mLのウォームDMEMに添加してバクテリアを1:10に希釈し、1 mL(1 x 107 CFU)をHT-29細胞に塗布します。 - 6ウェルプレートを37°C、5%CO2 で3時間インキュベートします。
- インキュベーション中に、細菌感染力価を決定します。
- 再懸濁した 赤痢菌 細胞(ステップ4.3.3から)をPBSに10倍段階希釈液を調製します。
- 希釈液1 x 10-5 および1 x 10-6 希釈液100 μLをTSB + Congo Redプレートに播種し、37°Cで一晩インキュベートします。
注:1 x 10-5 および 1 x 10-6 希釈液から 100 μL をめっきすると、それぞれ 1 x 10-6 および 1 x 10-7 の最終希釈係数に相当します。
- インキュベーション後、単層をPBSで4〜5回洗浄します。
- 各ウェルから培地を吸引します。
注:6ウェルプレートから培地を吸引する場合は、HT-29細胞との接触を避けながら、アスピレーターの先端をウェルの底面に沿ってガイドします。 - 各ウェルに温かいPBS1 mLを加え、穏やかに洗浄します。
メモ:PBSで6ウェル単層を優しく洗浄するには、ベンチトップでプレートを上下左右に動かします。プレートを円を描くように洗浄したり、ベンチトップの表面からプレートを取り外したりすると、プラスチックから細胞が機械的に除去される可能性があります。 - 手順4.7.1と4.7.2をさらに4回繰り返します。
- 各ウェルから培地を吸引します。
- 吸引によりPBSを除去し、各ウェルにPBS + 1% Triton X-100 1 mLを添加してHT-29細胞を溶解します。
- 6ウェルプレートを37°Cで5分間インキュベートします。
- 細胞スクレーパーまたは曲がったピペットチップを使用して、溶解した細胞をウェルの底からこすり落とし、1 mL全体を新しい1.7 mLの微量遠心チューブに移します。
- 細胞関連細菌の数を決定します。
- 各チューブ(ステップ4.10から)を少なくとも30秒間ボルテックスして、溶解した真核細胞から 赤痢菌 をさらに置換します。
- ライセートを PBS に 10 倍段階希釈して調製します。
- 希釈液1 x 10-2、1 x 10-3、1 x 10-4 希釈液100 μLをTSB + Congo Redプレートに播種し、37°Cで一晩インキュベートします。
注:1 x 10-2、1 x 10-3、1 x 10-4 希釈液から 100 μL をめっきすると、それぞれ 1 x 10-3、1 x 10-4、1 x 10-5 の最終希釈率に相当します。
5. 浸潤アッセイ
注:すべての容量は、2 枚の 6 ウェルプレートを使用したアッセイと一致しています。
- 赤痢菌を一晩継代培養し、1:50に希釈して新鮮な培地に培養します。
- ボルテックスし、適切なサイズの培養チューブに入れた5 mLの新鮮なTSBまたはTSB + BSに、各100 μLの一晩培養液を加えます。
注:適切な曝気を確保するために、培養液の容量を培養フラスコまたはチューブの容量の<20%に制限してください。 - 細胞がOD600 0.7( 赤痢菌 増殖の対数中期)に達するまで、250 rpmで振とうしながら37°Cでインキュベートします。約2〜2.5時間。
注:継代培養中に、50 mL の DMEM + 50 mg/mL ゲンタマイシンと、すべての洗浄ステップに十分な量の PBS を分注し、37 °C のウォーターバスに入れます。使用前に培地を37°Cにしてください。
- ボルテックスし、適切なサイズの培養チューブに入れた5 mLの新鮮なTSBまたはTSB + BSに、各100 μLの一晩培養液を加えます。
- 2 x 108 CFUsの継代培養赤 痢 菌を個々の2 mL微量遠心チューブに移します。
注:2 x 108 CFUは、OD600 0.7で約1 mLの細菌細胞に相当します。OD600 の測定値を使用して、個々の分光光度計の校正に従ってCFU/mLを概算します。 - 赤痢菌サンプルをPBSで1回洗浄します。
- 室温で2分間、17,000 x g で遠心分離することにより、細胞をペレット化します。上清を吸引し、1 mLの温かいPBSを加えてペレットをよく再懸濁し、混合物が完全に均一になるまで(8〜10倍)サンプルを静かに上下にピペッティングします。
- 手順5.3.1を繰り返します。アディショナルタイム1倍。
- 室温で17,000 x g で2分間遠心分離して細胞をペレット化し、上清を吸引し、ペレットを2 mLの温かいDMEMに再懸濁します。
注:再懸濁された細菌の最終濃度は、1 x 108 CFU/mLです。
- ボルテックスし、1 mL(1 x 108 CFU)の再懸濁赤 痢 液と1 mLのDMEMを、6ウェルプレートで調製したHT-29結腸上皮単層の各ウェルに加えます(ステップ3.2.10.2から)。
注:感染は通常、感染の多様性(MOI:細菌細胞と上皮細胞の比率)が100の場合に行われます。さまざまなMOIを試験するには、 赤痢菌 をDMEMで再懸濁して所望の濃度に希釈し、希釈した細菌1 mLをHT-29単分子膜に加えます。例えば、MOIが10の場合、150 μLの1 x 108 CFU/mLの細菌を1.35 mLのDMEMに添加して細菌を1:10に希釈し、次にHT-29細胞に1 mL(1 x 107 CFU)を加えます。 - HT-29細胞との細菌接触を促進するために、6ウェルプレートを2,000 x g で室温で10分間、または温度設定を調整できる場合は37°Cで遠心分離します。
注:遠心分離は、細菌とHT-29細胞との接触を促進し、接着因子の必要性を回避し、細菌が細胞に迅速に侵入することを可能にします。 - 6ウェルプレートを37°C、5%CO2 で45分間インキュベートします。
- インキュベーション中に、細菌感染力価を決定します。
- 再懸濁した 赤痢菌 細胞(ステップ5.3.3から)をPBSに10倍段階希釈液を調製します。
- 希釈液1 x 10-5 および1 x 10-6 希釈液100 μLをTSB + Congo Redプレートに播種し、37°Cで一晩インキュベートします。
注:1 x 10-5 および 1 x 10-6 希釈液から 100 μL をめっきすると、それぞれ 1 x 10-6 および 1 x 10-7 の最終希釈係数に相当します。
- 感染したHT-29細胞を1mLのPBSで3回徹底的に洗浄します。
- 各ウェルから培地を吸引します。
注:6ウェルプレートから培地を吸引する場合は、HT-29細胞との接触を避けながら、アスピレーターの先端をウェルの底面に沿ってガイドします。 - 各ウェルに温かいPBS1 mLを加え、穏やかに洗浄します。
メモ:PBSで6ウェル単層を優しく洗浄するには、ベンチトップでプレートを上下左右に動かします。プレートを円を描くように洗浄したり、ベンチトップの表面からプレートを取り外したりすると、プラスチックから細胞が機械的に除去される可能性があります。 - 手順5.8.1と5.8.2をさらに2回繰り返します。
- 各ウェルから培地を吸引します。
- PBSを吸引して除去し、50 μg/mLのゲンタマイシンを添加した2 mLの温かいDMEMを各ウェルに加え、5% CO2と37°Cで30分間インキュベートします。
- 感染したHT-29細胞を1mLのPBSで3回徹底的に洗浄します。
- 洗浄手順5.8を繰り返します。
- PBS を吸引して除去し、50 μg/mL のゲンタマイシンを添加した 2 mL の温かい DMEM を各ウェルに加え、5% CO2 と 37 °C で 60 分間インキュベートします。
- 感染したHT-29細胞を1mLのPBSで3回徹底的に洗浄します。
- 洗浄手順5.8を繰り返します。
- 吸引によりPBSを除去し、各ウェルにPBS + 1% Triton X-100 1 mLを添加してHT-29細胞を溶解します。
- 6ウェルプレートを37°Cで5分間インキュベートします。
- 細胞スクレーパーまたは曲がったピペットチップを使用して、溶解した細胞をウェルの底からこすり落とし、1 mL全体を新しい1.7 mLの微量遠心チューブに移します。
- 細胞内細菌の数を決定します。
- 各チューブ(ステップ5.15から)を少なくとも30秒間ボルテックスして、溶解した真核細胞から 赤痢菌 をさらに置換します。
- ライセートを PBS に 10 倍段階希釈して調製します。
- 希釈液1 x 10-2および希釈液1 x 10-3 100 μLをTSB + Congo Redプレートに播種し、37°Cで一晩インキュベートします。
注:1 x 10-2 および 1 x 10-3 希釈液から 100 μL をめっきすると、それぞれ 1 x 10-3 および 1 x 10-4 の最終希釈係数に相当します。
6. 細胞内複製アッセイ
注:すべての容量は、2 枚の 6 ウェルプレートを使用したアッセイと一致しています。
- 赤痢菌を一晩継代培養し、1:50に希釈して新鮮な培地に培養します。
- ボルテックスし、適切なサイズの培養チューブに入れた5 mLの新鮮なTSBまたはTSB + BSに、各100 μLの一晩培養液を加えます。
注:適切な曝気を確保するために、培養液の容量を培養フラスコまたはチューブの容量の<20%に制限してください。 - 細胞がOD600 0.7( 赤痢菌 増殖の対数中期)に達するまで、250 rpmで振とうしながら37°Cでインキュベートします。約2〜2.5時間。
注:継代培養中に、50 mL の DMEM + 50 mg/mL ゲンタマイシンと、すべての洗浄ステップに十分な量の PBS を分注し、37 °C のウォーターバスに入れます。使用前に培地を37°Cにしてください。
- ボルテックスし、適切なサイズの培養チューブに入れた5 mLの新鮮なTSBまたはTSB + BSに、各100 μLの一晩培養液を加えます。
- 2 x 108 CFUsの継代培養赤 痢 菌を個々の2 mL微量遠心チューブに移します。
注:2 x 108 CFUは、OD600 0.7で約1 mLの細菌細胞に相当します。OD600 の測定値を使用して、個々の分光光度計の校正に従ってCFU/mLを概算します。 - 赤痢菌サンプルをPBSで1回洗浄します。
- 室温で2分間、17,000 x g で遠心分離することにより、細胞をペレット化します。上清を吸引し、1 mLの温かいPBSを加えてペレットをよく再懸濁し、混合物が完全に均一になるまで(8〜10倍)サンプルを静かに上下にピペッティングします。
- 手順6.3.1を繰り返します。アディショナルタイム1倍。
- 室温で17,000 x g で2分間遠心分離して細胞をペレット化し、上清を吸引し、ペレットを2 mLの温かいDMEMに再懸濁します。
注:再懸濁された細菌の最終濃度は、1 x 108 CFU/mLです。
- ボルテックスし、1 mL(1 x 108 CFU)の再懸濁赤 痢 菌と1 mLのDMEMを、6ウェルプレート(ステップ3.2.10.2から)で調製したHT-29結腸上皮単層の各ウェルに加えます。
注:感染は通常、感染の多様性(MOI:細菌細胞と上皮細胞の比率)が100の場合に行われます。さまざまなMOIを試験するには、 赤痢菌 をDMEMで再懸濁して所望の濃度に希釈し、希釈した細菌1 mLをHT-29単分子膜に加えます。例えば、MOI 10 をテストするには、150 μL の 1 x 108 CFU/mL 細菌を 1.35 mL の DMEM に添加して細菌を 1:10 希釈し、次に 1 mL(1 x 107 CFU)を HT-29 細胞に適用します。 - HT-29細胞との細菌接触を促進するために、6ウェルプレートを2,000 x g で室温で10分間、または温度設定を調整できる場合は37°Cで遠心分離します。
注:遠心分離は、細菌とHT-29細胞との接触を促進し、接着因子の必要性を回避し、細菌が細胞に迅速に侵入することを可能にします。 - 6ウェルプレートを37°C、5%CO2 で45分間インキュベートします。
- インキュベーション中に、細菌感染力価を決定します。
- 再懸濁した 赤痢菌 細胞(ステップ6.3.3から)をPBSに10倍段階希釈液を調製します。
- 希釈液1 x 10-5 および1 x 10-6 希釈液100 μLをTSB + Congo Redプレートに播種し、37°Cで一晩インキュベートします。
注:1 x 10-5 および 1 x 10-6 希釈液から 100 μL をめっきすると、それぞれ 1 x 10-6 および 1 x 10-7 の最終希釈係数に相当します。
- 感染したHT-29細胞を1mLのPBSで3回徹底的に洗浄します。
- 各ウェルから培地を吸引します。
注:6ウェルプレートから培地を吸引する場合は、HT-29細胞との接触を避けながら、アスピレーターの先端をウェルの底面に沿ってガイドします。 - 各ウェルに温かいPBS1 mLを加え、穏やかに洗浄します。
メモ:PBSで6ウェル単層を優しく洗浄するには、ベンチトップでプレートを上下左右に動かします。プレートを円を描くように洗浄したり、ベンチトップの表面からプレートを取り外したりすると、プラスチックから細胞が機械的に除去される可能性があります。 - 手順6.8.1と6.8.2をさらに2回繰り返します。
- 各ウェルから培地を吸引します。
- PBSを吸引して除去し、50 μg/mLのゲンタマイシンを添加した2 mLの温かいDMEMを各ウェルに加え、5% CO2と37°Cで30分間インキュベートします。
- 感染したHT-29細胞を1mLのPBSで3回徹底的に洗浄します。
- 洗浄手順6.8を繰り返します。
- PBS を吸引して除去し、2 mL の温かい DMEM と 50 μg/mL のゲンタマイシンを 6 ウェルプレートの各ウェルに加え、37 °C で 5% CO2 と所望の時間インキュベートし、細胞内複製を可能にします(最大 24 時間)。
- 細胞を1 mLのPBSで2回徹底的に洗浄します。
- 洗浄手順6.8を繰り返します。
- 吸引によりPBSを除去し、各ウェルにPBS + 1% Triton X-100 1 mLを添加してHT-29細胞を溶解します。
- 6ウェルプレートを37°Cで5分間インキュベートします。
- 細胞スクレーパーまたは曲がったピペットチップを使用して、溶解した細胞をウェルの底からこすり落とし、1 mL全体を新しい1.7 mL微量遠心チューブに移します。
- 細胞内細菌の数を決定します。
- 各チューブ(ステップ6.15から)を少なくとも30秒間ボルテックスして、溶解した真核細胞から 赤痢菌 をさらに置換します。
- ライセートを PBS に 10 倍段階希釈して調製します。
- 希釈液1 x 10-2、1 x 10-3、1 x 10-4 希釈液100 μLをTSB + Congo Redプレートに播種し、37°Cで一晩インキュベートします。
注:1 x 10-2、1 x 10-3、1 x 10-4 希釈液から 100 μL をめっきすると、それぞれ 1 x 10-3、1 x 10-4、1 x 10-5 の最終希釈率に相当します。
結果
S. flexneri 2457T野生型(WT)と、赤痢菌の病原性を負に制御すると仮定された変異体であるS. flexneri ΔVF(ΔVF)を比較して、アドヒアランス、浸潤、および細胞内複製アッセイを実施しました。赤痢菌は胆汁塩を病原性調節のシグナルとして使用するため17,18,47、実験は、TSB培地での細菌継代培養後、および0.4%(w / v)?...
ディスカッション
このプロトコルは一組の腸の上皮セルの赤痢菌の付着、侵入および細胞内の複製を調査する3つの標準化された試金を記述する。これらの方法は、宿主細胞内のさまざまな細菌性病原体の侵入および細胞内複製を研究するために使用される古典的なゲンタマイシンアッセイの単なる修正版ですが49,50,51、赤痢菌を研究する際には...
開示事項
著者は利益相反がないことを宣言します。
謝辞
著者への支援には、マサチューセッツ総合病院の小児科、研究暫定支援資金(ISF)に関する執行委員会賞2022A009041、国立アレルギー感染症研究所の助成金R21AI146405、国立糖尿病・消化器・腎臓病研究所の助成金ハーバード大学栄養肥満研究センター(NORCH)2P30DK040561-26が含まれる。資金提供者は、研究デザイン、データ収集と分析、出版の決定、または原稿の準備に関与していませんでした。
資料
| Name | Company | Catalog Number | Comments |
| 0.22 μm PES filter | Millipore-Sigma | SCGP00525 | Sterile, polyethersulfone filter for sterilizing up to 50 mL media |
| 14 mL culture tubes | Corning | 352059 | 17 mm x 100 mm polypropylene test tubes with cap |
| 50 mL conical tubes | Corning | 430829 | 50 mL clear polypropylene conical bottom centrifuge tubes with leak-proof cap |
| 6-well tissue culture plates | Corning | 3516 | Plates are treated for optimal cell attachment |
| Bile salts | Sigma-Aldrich | B8756 | 1:1 ratio of cholate to deoxycholate |
| Congo red dye | Sigma-Aldrich | C6277 | A benzidine-based anionic diazo dye, >85% purity |
| Countess cell counting chamber slide | Invitrogen | C10283 | To be used with the Countess Automated Cell Counter |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D8418 | A a highly polar organic reagent |
| Dulbecco’s Modified Eagle Medium (DMEM) | Gibco | 10569-010 | DMEM is supplemented with high glucose, sodium pyruvate, GlutaMAX, and Phenol Red |
| Fetal Bovine Serum (FBS) | Sigma-Aldrich | F4135 | Heat-inactivated, sterile |
| Gentamicin | Sigma-Aldrich | G3632 | Stock concentration is 50 mg/mL |
| HT-29 cell line | ATCC | HTB-38 | Adenocarcinoma cell line; colorectal in origin |
| Paraffin film | Bemis | PM999 | Laboratory sealing film |
| Petri dishes | Thermo Fisher Scientific | FB0875713 | 100 mm x 15 mm Petri dishes for solid media |
| Phosphate-buffered saline (PBS) | Thermo Fisher Scientific | 10010049 | 1x concentration; pH 7.4 |
| Select agar | Invitrogen | 30391023 | A mixture of polysaccharides extracted from red seaweed cell walls to make bacterial plating media |
| T75 flasks | Corning | 430641U | Tissue culture flasks |
| Triton X-100 | Sigma-Aldrich | T8787 | A common non-ionic surfactant and emulsifier |
| Trypan blue stain | Invitrogen | T10282 | A dye to detect dead tissue culture cells; only live cells can exclude the dye |
| Trypsin-EDTA | Gibco | 25200-056 | Reagent for cell dissociation for cell line maintenance and passaging |
| Tryptic Soy Broth (TSB) | Sigma-Aldrich | T8907 | Bacterial growth media |
参考文献
- Karambizi, N. U., McMahan, C. S., Blue, C. N., Temesvari, L. A. Global estimated Disability-Adjusted Life-Years (DALYs) of diarrheal diseases: A systematic analysis of data from 28 years of the global burden of disease study. PloS one. 16 (10), e0259077 (2021).
- WHO. WHO methods and data sources for country-level causes of death 2000-2016. World Health Organization. , (2018).
- Kotloff, K. L. Shigella infection in children and adults: a formidable foe. Lancet Glob Health. 5 (12), e1166-e1167 (2017).
- Kotloff, K. L., et al. Burden and aetiology of diarrhoeal disease in infants and young children in developing countries (the Global Enteric Multicenter Study, GEMS): A prospective, case-control study. Lancet. 382 (9888), 209-222 (2013).
- Schroeder, G. N., Hilbi, H. Molecular pathogenesis of Shigella spp.: Controlling host cell signaling, invasion, and death by type III secretion. Clin Microbiol Rev. 21 (1), 134-156 (2008).
- Arvelo, W., et al. Transmission risk factors and treatment of pediatric shigellosis during a large daycare center-associated outbreak of multidrug resistant shigella sonnei: Implications for the management of shigellosis outbreaks among children. Pediatr Infect Dis J. 28 (11), 976-980 (2009).
- Kozyreva, V. K., et al. Recent outbreaks of Shigellosis in California caused by two distinct populations of Shigella sonnei with either increased virulence or fluoroquinolone resistance. mSphere. 1 (6), 1-18 (2016).
- Bowen, A., et al. Importation and domestic transmission of Shigella sonnei resistant to ciprofloxacin - United States, May 2014-February 2015. MMWR Morb Mortal Wkly Rep. 64 (12), 318-320 (2015).
- Tansarli, G. S., et al. Genomic reconstruction and directed interventions in a multidrug-resistant Shigellosis outbreak in Seattle, WA, USA: a genomic surveillance study. Lancet. 3099 (22), 1-11 (2023).
- Barry, E. M., et al. Progress and pitfalls in Shigella vaccine research. Nat Rev Gastroenterol Hepatol. 10 (4), 245-255 (2013).
- Increase in Extensively Drug-Resistant Shigellosis in the United States. CDC Health Alert Network. Centers for Disease Control and Prevention Available from: https://emergency.cdc.gov/han/2023/han00486.asp?ACSTrackingID=USCDC_511-DM100260&ACSTrackingLabel=HAN%20486%20-%20General%20Public&deliveryName=USCDC_511-DM100260 (2023)
- Shiferaw, B., et al. Antimicrobial susceptibility patterns of Shigella isolates in Foodborne Diseases Active Surveillance Network (FoodNet) sites, 2000-2010. Clin Infect Dis. 54, S458-S463 (2012).
- Centers for Disease Control and Prevention. COVID-19: U.S. Impact on Antimicrobial Resistance, Special Report 2022. Atlanta, GA: U.S. Department of Health and Human Services. CDC. , (2022).
- Centers for Disease Control and Prevention. Antibiotic resistance threats in the United States, 2019. CDC. 10 (1), (2019).
- WHO. Prioritization of pathogens to guide discovery, research and development of new antibiotics for drug-resistant bacterial infections, including tuberculosis. WHO. , (2017).
- DuPont, H. L., Levine, M. M., Hornick, R. B., Formal, S. B. Inoculum size in shigellosis and implications for expected mode of transmission. J Infect Dis. 159 (6), 1126-1128 (1989).
- Nickerson, K. P., et al. Analysis of Shigella flexneri resistance, biofilm formation, and transcriptional profile in response to bile salts. Infect Immun. 85 (6), 1-18 (2017).
- Faherty, C. S., Redman, J. C., Rasko, D. A. Shigella flexneri effectors OspE1 and OspE2 mediate induced adherence to the colonic epithelium following bile salts exposure. Mol Microbiol. 85 (1), 107-121 (2012).
- Chanin, R. B., et al. Shigella flexneri adherence factor expression in in vivo-like conditions. mSphere. 4 (6), e00751 (2019).
- Baranov, V., Hammarström, S. Carcinoembryonic antigen (CEA) and CEA-related cell adhesion molecule 1 (CEACAM1), apically expressed on human colonic M cells, are potential receptors for microbial adhesion. Histochem Cell Biol. 121 (2), 83-89 (2004).
- Wassef, J. S., Keren, D. F., Mailloux, J. L. Role of M cells in initial antigen uptake and in ulcer formation in the rabbit intestinal loop model of shigellosis. Infect Immun. 57 (3), 858-863 (1989).
- Sansonetti, P. J., Arondel, J., Cantey, J. R., Prévost, M. C., Huerre, M. Infection of rabbit Peyer's patches by Shigella flexneri: Effect of adhesive or invasive bacterial phenotypes on follicle-associated epithelium. Infect Immun. 64 (7), 2752-2764 (1996).
- Sansonetti, P. J., et al. Caspase-1 activation of IL-1beta and IL-18 are essential for Shigella flexneri-induced inflammation. Immunity. 12 (5), 581-590 (2000).
- Zychlinsky, A., Fitting, C., Cavaillon, J. M., Sansonetti, P. J. Interleukin 1 is released by murine macrophages during apoptosis induced by Shigella flexneri. J Clin Invest. 94 (3), 1328-1332 (1994).
- Sansonetti, P. J., Ryter, A., Clerc, P., Maurelli, A. T., Mounier, J. Multiplication of Shigella flexneri within HeLa cells: lysis of the phagocytic vacuole and plasmid-mediated contact hemolysis. Infect Immun. 51 (2), 461-469 (1986).
- Maldonado-Contreras, A., et al. Shigella depends on SepA to destabilize the intestinal epithelial integrity via cofilin activation. Gut Microbes. 8 (6), 544-560 (2017).
- Collard, J. -. M., et al. High prevalence of small intestine bacteria overgrowth and asymptomatic carriage of enteric pathogens in stunted children in Antananarivo, Madagascar. PLoS Negl Trop Dis. 16 (5), e0009849 (2022).
- Mattock, E., Blocker, A. J. How do the virulence factors of shigella work together to cause disease. Front Cell Infect Microbiol. 7, 1-24 (2017).
- Mostowy, S., et al. The zebrafish as a new model for the in vivo study of Shigella flexneri interaction with phagocytes and bacterial autophagy. PLoS Pathog. 9 (9), e1003588 (2013).
- Martinez-Becerra, F. J., et al. Parenteral immunization with IpaB/IpaD protects mice against lethal pulmonary infection by Shigella. Vaccine. 31 (24), 2667-2672 (2013).
- Shim, D. -. H., et al. New animal model of shigellosis in the Guinea pig: its usefulness for protective efficacy studies. J Immunol. 178 (4), 2476-2482 (2007).
- Marteyn, B., et al. Modulation of Shigella virulence in response to available oxygen in vivo. Nature. 465 (7296), 355-358 (2010).
- West, N. P., et al. Optimization of virulence functions through glucosylation of Shigella LPS. Science. 307 (5713), 1313-1317 (2005).
- Maurelli, A. T., et al. Shigella infection as observed in the experimentally inoculated domestic pig, Sus scrofa domestica. Microbial Pathog. 25 (4), 189-196 (1998).
- Jeong, K. -. I., Zhang, Q., Nunnari, J., Tzipori, S. A piglet model of acute gastroenteritis induced by Shigella dysenteriae Type 1. J Infect Dis. 201 (6), 903-911 (2010).
- Kim, Y. -. J., Yeo, S. -. G., Park, J. -. H., Ko, H. -. J. Shigella vaccine development: prospective animal models and current status. Curr Pharm Biotechnol. 14 (10), 903-912 (2013).
- Kent, T. H., Formal, S. B., LaBrec, E. H., Sprinz, H., Maenza, R. M. Gastric shigellosis in rhesus monkeys. Am J Pathol. 51 (2), 259-267 (1967).
- Shipley, S. T., et al. A challenge model for Shigella dysenteriae 1 in cynomolgus monkeys (Macaca fascicularis). Comp Med. 60 (1), 54-61 (2010).
- Higgins, R., Sauvageau, R., Bonin, P. Shigella flexneri Type 2 Infection in captive nonhuman primates. Can Vet J. 26 (12), 402-403 (1985).
- Oaks, E. V., Hale, T. L., Formal, S. B. Serum immune response to Shigella protein antigens in rhesus monkeys and humans infected with Shigella spp. Infect Immun. 53 (1), 57-63 (1986).
- Formal, S. B., et al. Protection of monkeys against experimental shigellosis with a living attenuated oral polyvalent dysentery vaccine. J Bacteriol. 92 (1), 17-22 (1966).
- Levine, M. M., Kotloff, K. L., Barry, E. M., Pasetti, M. F., Sztein, M. B. Clinical trials of Shigella vaccines: two steps forward and one step back on a long, hard road. Nat Rev Microbiol. 5 (7), 540-553 (2007).
- Payne, S. M. Laboratory cultivation and storage of Shigella. Curr Protoc Microbiol. 55 (1), 93 (2019).
- NIH Guidelines. NIH guidelines for research involving recombinant or synthetic nucleic acid molecules. NIH Guidelines. 2, 142 (2019).
- Maurelli, A. T., Blackmon, B., Curtiss, R. Loss of pigmentation in Shigella flexneri 2a is correlated with loss of virulence and virulence-associated plasmid. Infect Immun. 43 (1), 397-401 (1984).
- HT-29 cell line product sheet. ATCC Available from: https://www.atcc.org/products/htb-38 (2023)
- Sistrunk, J. R., Nickerson, K. P., Chanin, R. B., Rasko, D. A., Faherty, C. S. Survival of the fittest: How bacterial pathogens utilize bile to enhance infection. Clin Microbiol Rev. 29 (4), 819-836 (2016).
- Stensrud, K. F., et al. Deoxycholate interacts with IpaD of Shigella flexneri in inducing the recruitment of IpaB to the type III secretion apparatus needle tip. J Biol Chem. 283 (27), 18646-18654 (2008).
- Mandell, G. L. Interaction of intraleukocytic bacteria and antibiotics. J Clin Invest. 52 (7), 1673-1679 (1973).
- Elsinghorst, E. A. Measurement of invasion by gentamicin resistance. Methods Enzymo. 236 (1979), 405-420 (1994).
- Elsinghorst, E. A., Weitz, J. A. Epithelial cell invasion and adherence directed by the enterotoxigenic Escherichia coli tib locus is associated with a 104-kilodalton outer membrane protein. Infect Immun. 62 (8), 3463-3471 (1994).
- Dorman, C. J., McKenna, S., Beloin, C. Regulation of virulence gene expression in Shigella flexneri, a facultative intracellular pathogen. Int J Med Microbiol. 291 (2), 89-96 (2001).
- Porter, M. E., Dorman, C. J. Positive regulation of Shigella flexneri virulence genes by integration host factor. J Bacteriol. 179 (21), 6537-6550 (1997).
- Maurelli, A. T., Blackmon, B., Curtiss, R. Temperature-dependent expression of virulence genes in Shigella species. Infect Immun. 43 (1), 195-201 (1984).
- Schuch, R., Maurelli, A. T. Virulence plasmid instability in Shigella flexneri 2a is induced by virulence gene expression. Infect Immun. 65 (9), 3686-3692 (1997).
- Formal, S. B., Hale, T. L., Sansonetti, P. J. Invasive enteric pathogens. Rev Infect Dis. 5, S702-S707 (1983).
- Pál, T., Hale, T. L. Plasmid-associated adherence of Shigella flexneri in a HeLa cell model. Infect Immun. 57 (8), 2580-2582 (1989).
- Noben, M., et al. Human intestinal epithelium in a dish: Current models for research into gastrointestinal pathophysiology. United European Gastroenterol J. 5 (8), 1073-1081 (2017).
- Liévin-Le Moal, V., Servin, A. L. Pathogenesis of human enterovirulent bacteria: lessons from cultured, fully differentiated human colon cancer cell lines. Microbiol Mol Biol Rev R. 77 (3), 380-439 (2013).
- Mitchell, D. M., Ball, J. M. Characterization of a spontaneously polarizing HT-29 cell line, HT-29/cl.f8. In Vitro Cell Dev Biol - Anim. 40 (10), 297-302 (2004).
- Gagnon, M., Zihler Berner, A., Chervet, N., Chassard, C., Lacroix, C. Comparison of the Caco-2, HT-29 and the mucus-secreting HT29-MTX intestinal cell models to investigate Salmonella adhesion and invasion. J Microbiol Methods. 94 (3), 274-279 (2013).
- Koestler, B. J., et al. Human intestinal enteroids as a model system of Shigella pathogenesis. Infect Immun. 87 (4), 00733 (2019).
- Ranganathan, S., et al. Evaluating Shigella flexneri pathogenesis in the human enteroid model. Infect Immun. 87 (4), (2019).
- Nickerson, K. P., et al. A versatile human intestinal organoid-derived epithelial monolayer model for the study of enteric pathogens. Microbiol Spectr. 9 (1), 1-17 (2021).
- Perlman, M., Senger, S., Verma, S., Carey, J., Faherty, C. S. A foundational approach to culture and analyze malnourished organoids. Gut Microbes. 15 (2), 2248713 (2023).
- Pope, L. M., Reed, K. E., Payne, S. M. Increased protein secretion and adherence to HeLa cells by Shigella spp. following growth in the presence of bile salts. Infect Immun. 63 (9), 3642-3648 (1995).
- Faherty, C. S., et al. The synthesis of OspD3 (ShET2) in Shigella flexneri is independent of OspC1. Gut Microbes. 7 (6), 486-502 (2016).
- Ridlon, J. M., Kang, D. -. J., Hylemon, P. B. Bile salt biotransformations by human intestinal bacteria. J Lipid Res. 47 (2), 241-259 (2006).
- Köseoğlu, V. K., Hall, C. P., Rodríguez-López, E. M., Agaisse, H. The Autotransporter IcsA promotes Shigella flexneri biofilm formation in the presence of bile salts. Infect Immun. 87 (7), 1-14 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved