Method Article
ラットにおける髄腔内カテーテル法の改良法
要約
ここでは、ラットの髄腔内カテーテル法の改良方法を紹介します。これは、髄腔内薬物の反復投与に対するシンプルで便利で信頼性の高いアプローチを表しています。
要約
髄腔内カテーテル法は、動物実験、特に神経因性疼痛の実験に広く適用されています。ただし、従来の方法にはまだいくつかの制限があります。一部の研究者は従来の方法を改善しようと試みていますが、利用可能な方法はまだ修正する必要があります。ここでは、ラットにおける髄腔内カテーテル法の改良方法を紹介します。
この方法では、長さ20cmのステンレス鋼線(直径0.2mm)、長さ15cmのプラスチックPE10チューブ、自作のシーリングキャップ、0.3cm×0.5cmの抗アレルギーバンドを使用します。髄腔内カテーテル法の改良方法には、いくつかの利点があります。まず、PE10チューブにステンレスワイヤーを導入することで、チューブの弾力性が増し、髄腔内カテーテル法の成功率が向上し、手術に必要なスペースが減り、腰椎周辺の組織へのダメージが最小限に抑えられます。次に、PE10チューブの長さは手術前に決定され、カテーテル留置時間は1週間以上になる場合があります。第三に、PE10チューブは8の字縫合糸で4回固定され、動物が動くときのチューブの動きと収縮を防ぎます。第四に、自作のシーリングキャップを使用してPE10チューブをシールし、脳脊髄液の漏れを防ぐだけでなく、PE10チューブを繰り返し切断する必要性を減らします。最後に、PE10チューブの体外端はバンドで結ばれており、動物が動いたときにチューブが引っ込められるのを防ぎます。
この方法は、手術後28日でもPE10チューブの約80%が所定の位置に留まっているため、ラットのカテーテル挿入成功率を高めることができます。したがって、この修正された方法は、反復的な髄腔内薬物投与のためのシンプルで便利で信頼性の高いアプローチを表している可能性があります。
概要
ラットにおける髄腔内カテーテル法(くも膜下カテーテル法とも呼ばれる)は、椎間腔1を通じてくも膜下腔にカテーテルを挿入する方法である。薬物はカテーテルを介してくも膜下腔に直接注入されるため、研究者は血液脳関門を貫通する薬物の影響を考慮せずに、脊髄に対する薬物の影響を調査するのに役立ちます2,3。さらに、髄腔内カテーテル法の後に脳脊髄液を採取して、中枢神経系の微小環境を調べることができます4,5。現在、髄腔内カテーテル法として用いられている方法は、1976年にYakshとRudy6によって初めて確立され、それ以来、神経科学、麻酔・鎮痛、脊髄を介した心血管調節、特に神経障害性疼痛などの動物実験に広く応用されてきました2,7。しかし、この方法には、脊髄損傷の発生率が高い、くも膜下出血、術後の感覚および運動機能障害、術後死亡率が高い、神経障害のリスクが高いなど、いくつかの制限があります 4,5,8,9,10 .これらの制限を克服するために、腰椎間隙を介したくも膜下腔のカテーテル挿入が 1996 年に Størkson らによって提案され11、より高い術後成功率が報告されました。特に、この方法では留置カテーテルの固定が依然として課題であり、動物の動きによるカテーテルの収縮が一般的であるため、髄腔内薬物投与が不便になります。
上記の制限のために、一部の研究者12、13、14、15 は、穿刺のためのツール、カテーテル法、およびカテーテル固定法の改善を試みましたが、利用可能な方法はまだ変更する必要があります 使用されるビーズの直径を定量化することの難しさ、繰り返しの穿刺の必要性、およびカテーテルの長さが短いため、 など11
髄腔内カテーテル法1 の腰椎法と中心静脈カテーテル法のセルディンガー法16 に基づき、既存の方法を簡略化するために、ステンレス鋼線と自作のシールキャップ、抗アレルギーバンドを用いたラットの髄腔内カテーテル法を開発しました。この方法により、くも膜下腔にカテーテルを容易に挿入し、ラットの背中に安定して固定することができ、髄腔内薬物の反復投与のための繰り返しの穿刺の必要性を回避することができます。
ここでは、ラットにおける髄腔内カテーテル法の成功率を改善し、薬物の反復髄腔内投与のためのシンプルで便利で信頼性の高いアプローチを表す可能性のある修正方法を紹介します。
プロトコル
髄腔内カテーテル法は、国立衛生研究所の実験動物のケアと使用に関するガイドラインの推奨事項に厳密に従って実施され、プロトコルは中国の実験動物倫理委員会によって承認されました(No.TJBH15523201)。実験には、雄のSprague-Dawley(SD)ラットを使用しました。動物の痛みや不快感を最小限に抑えるように注意が払われました。
1. 材料と器具の準備
注:材料と器具の準備は、髄腔内カテーテル法を成功させるために非常に重要です。
- 長さ15 cmのPE10チューブを準備し(長さはラットの頭と尾の端の間の距離に応じて決定されます)、長さ20 cmのステンレス鋼線(直径0.2 mm)を2つの研磨された端でPE10チューブをサポートとして挿入し、チューブの一方の端から2 cmに印を付けて挿入深さを示します(図1Aの黒い十字でマークされています。B)です。
- 22 G針の鋭い先端を切断し、遠位端を密封します(図1C)。
- 硬膜外カテーテル(外径1.0mm)を1cmの断片に切ります。次に、先端が鋭利な22G針(図1D)にフラグメントを挿入し、フラグメントの遠位端を加熱したストレート鉗子でシールします。この装置は、チューブシーリングキャップと呼ばれます(図1E)。
- はさみでシルクテープ(1.25cm×9.1m)を切って、0.3cm×0.5cmの抗アレルギーバンドを準備します(図1F)。
2. 手術の準備
- 髄腔内カテーテル法のための器具を手術前に滅菌して準備します。手術に使用する器具は、歯付き鉗子、ハサミ、強制装置、メスの柄、#10ブレードです。(図2)。
- PE10チューブとガイドワイヤーを75%エタノールに浸して、約2時間滅菌します。
3. 手術
- ラットに3%イソフルランを3 L / minの流速で麻酔します。
- ラットを手術台に置き、鉗子で後足をつまむときの離脱反射を観察します。刺激に反応して後足が動かないことで、麻酔が成功したことが確認されました。髄腔内カテーテル法の前に、1 mg / kgメロキシカムの筋肉内注射により適切な鎮痛を投与します。.
- 背中の腰椎領域と2つの耳の間の領域からシェーバーで髪を取り除きます。
- ラットの腹部の腰と腰の接合部に遠心分離管(直径3 cm)を配置して、腰椎の屈曲を増やし、針とカテーテルが通過するスペースを増やします。.
- 手術部位(腰椎領域と2つの耳の間の領域)をポビドンヨード溶液で滅菌し、次にエタノール溶液で3回滅菌します。ラットを無菌包帯で覆い、手術部位を露出させます。その後、手術前にPE10チューブとガイドワイヤーを生理食塩水で洗います。
注:髄腔内カテーテル法中に尾の動きを観察できるように、尾部は覆われていませんでした。 - L5とL6の間の椎間腔の位置を決定するには、L6の棘突起を左右の両側腸骨稜の中点に位置させます。オペレーターの左手の親指と左の人差し指で皮膚を固定し、L4とS1の間の棘突起のすぐ上に3〜4cmの長さの正中線切開を行います。
- はさみで皮下組織を鈍く分離します。L5とL6の間の椎間腔を再度見つけ、L5とL6の背側突起の両側に小さな切開(0.3〜0.5cm)を行います。
- L5背側突起を一対の歯付き鉗子でクランプして持ち上げ、椎間腔を拡張します。次に、L6背突起の上部が完全に露出するまで、はさみで椎体の周りの筋肉を鈍く分離します。
注:周囲の組織への損傷を最小限に抑えることを目的として、椎体や筋肉の任意の部分の除去は避けるべきです。 - L5背側突起を一対の歯付き鉗子で持ち上げ、椎間腔を別の一対の鉗子で拡張するときは、逆さの「V」領域が完全に露出するまで、L5-6の椎間腔を綿球で清掃します。
- L6背突起のすぐ下にある逆V字領域に23Gの針で脊椎を穿刺します。
注:テールフリックが観察され、および/または無色の透明な流体がくも膜下腔から流れ出し、くも膜下腔への穿刺が成功したことを示します。 - ステンレス鋼線を含むPE10チューブを、尾部に向かって30°傾けながら、穿刺部位の脊柱管に慎重に挿入します。PE10チューブが抵抗なく正常に挿入できるようになるまで、挿入角度を調整します(このプロセス中にテールフリックが観察されました)。
- PE10チューブのマークされた領域が後部筋に達すると、カテーテル挿入は停止します。
- PE10チューブからステンレスワイヤーをゆっくりと取り外します。テールフリックが観察される場合があります。
注意: テールフリックが観察される場合があり、ワイヤーを取り外した後、透明な液体(または薄い赤色の液体)がチューブから流れ出る場合があります。 - 次に、PE10チューブを1mLシリンジに接続し、20μLの生理食塩水を注入します。シリンジを取り外すと、生理食塩水がPE10チューブから連続的に流れ出し、くも膜下腔に正常に挿入されたことを示します。
- PE10チューブが詰まっていないことを確認したら、椎体の片側の筋肉を4-0縫合糸で縫合し、結び目を作ります。次に、PE10チューブの周りに縫合糸を結び、別の結び目を作ります。縫合糸を切らないでください。反対側の筋肉を縫合します。縫合糸を再びPE10チューブに結び、3つ目の結び目を作り、縫合糸を切断します。
注:このプロセスでは、PE10チューブを8の字縫合糸で固定し、チューブの変位と収縮の可能性を減らします。 - 耳の間の中点から1cm下に0.5cmの長さの切開を行います。皮下組織をハサミで鈍く分離し、金属製の強制チューブを尾に向かって挿入し、腰椎切開部に先端が見えるようにします。
- PE10チューブの遠位端を、PE10チューブが強制チューブのもう一方の端から出るまで強制チューブに挿入します。その後、強制品を静かに引き抜きます。
- PE10チューブが再び詰まっていないことを確認したら、腰椎切開部周辺の残りの筋肉を4-0縫合糸で縫合し、PE10チューブの周りに縫合糸を結び、再度結び目を作ってPE10チューブを固定します。
- PE10チューブの損傷を避けて、皮膚を縫合します。次に、4-0縫合糸で首の皮膚を縫合し、PE10チューブの周りに縫合糸を結び、PE10チューブを固定するための結び目を作ります。
- PE10チューブが再び遮られていないことが確認されたら、PE10チューブの体外端をシーリングキャップでシールします。
- PE10チューブをティッシュで乾燥させ、次に抗アレルギーバンドをPE10チューブの周りに数回結び、ラットの移動中にPE10チューブが収縮するのを防ぎます。
4. リドカイン検証実験
- 手術後、ラットをケージ(ケージごとに1つ)に戻し、麻酔からの回復中にラットが意識を取り戻すまで注意深く監視します。.
- ラットが完全に覚醒した後、シーリングキャップを取り外し、ハミルトンシリンジを介して20μLの2%リドカインをPE10チューブに0.02mL / sの速度で注入し、続いて10μLの生理食塩水を注射します。.
- PE10チューブをシーリングキャップで密封します。
- ネズミをテーブルの上に置き、注意深く観察します。リドカインの髄腔内注射(PE10チューブから)後の後肢麻痺の存在は、カテーテル挿入が成功したことを示しています(図3)。後肢麻痺は通常約30分続きます10。
注:次の実験の前に、ラットを5〜7日間回復させます。 - 四肢の機能が完全に回復するまでの回復期間中、ラットを注意深く監視します。.
結果
髄腔内注射では、PE10チューブの体外先端を切り取り、PE10チューブを2つの薬物注射の間にシーリングキャップで密封しました。私たちのパイロット研究では、髄腔内カテーテル法の成功率は約95%でした(20匹中19匹のラット)。成功は、手順中にテールフリックおよび/または無色透明の液体が放出されることで示されました。手術後7日でチューブの約85%が所定の位置に留まり、手術後28日で約80%が所定の位置に留まりました。ラットは手術後すぐに回復し、手術後7日以内に合併症は観察されませんでした。日々の動きは正常で、行動異常は認められませんでした。これらの結果から、本手法は成功率と長期留置率において、これまでに報告されたものよりも優れていることが示された。
カテーテルによるリドカイン注射による下肢の完全な麻痺は、髄腔内カテーテル法が成功したことを示しています15。髄腔内カテーテル法の成功率は、ラットの総数をカテーテル法が成功したラットの数で割ることによって計算されます。修正された方法では、成功率は95%であり、Houらによって報告された方法で達成された率(88%)よりも高かった15。これを 図 4 に示します。
髄腔内カテーテル法の2日後、5日後、7日後に髄腔内チューブをモニターし、留置カテーテル成功率を留置成功ラット数/ラット総数100%×として算出した。StØrkson et al.11 の研究では、髄腔内カテーテル挿入の 2、5、および 7 日後、留置カテーテルの成功率はそれぞれ 94%、81%、および 65% でした。髄腔内カテーテル法の2日後、5日後、7日後の留置カテーテル成功率は、本手法でそれぞれ95%、90%、85%であった(図5)。

図 1.髄腔内カテーテル法に使用される材料と器具。 (A)長さ15cmのPE10チューブを用意し、チューブの一端から2cmのところに挿入深さを示す印をつけました。(B)PE10チューブに2つの端を研磨した長さ20cmのステンレス鋼線を支持体として挿入しました。(C)22G針の尖った先端をハサミで切断し、遠位端を一対の鉗子でシールした。(D)硬膜外カテーテル(外径1.0mm)を1cmの断片に切断し、先端のない鋭利な22G針に挿入した。(E)硬膜外カテーテルの遠位端は、一対の加熱されたまっすぐな鉗子で密封されていました。この装置はチューブシーリングキャップと呼ばれていました。(F)0.3cm×0.5cmの抗アレルギーバンド(シルクテープ、1.25cm×9.1m)をハサミで作製しました。 この図の拡大版を表示するには、ここをクリックしてください。
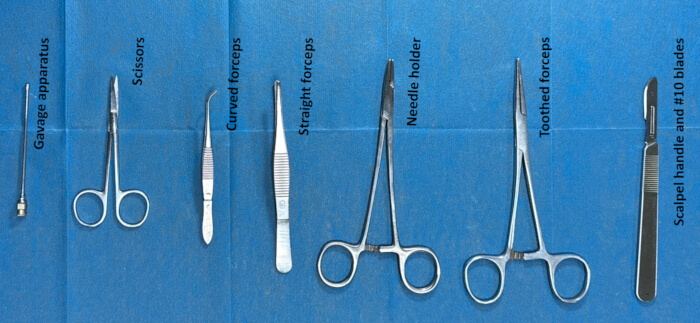
図 2.髄腔内カテーテル法のための器具の準備。 器具(歯付き鉗子、はさみ、強制装置、メスの柄、#10刃物など)をエタノールで約2時間滅菌した後、手術の約30分前に生理食塩水で洗浄しました。 この図の拡大版を表示するには、ここをクリックしてください。
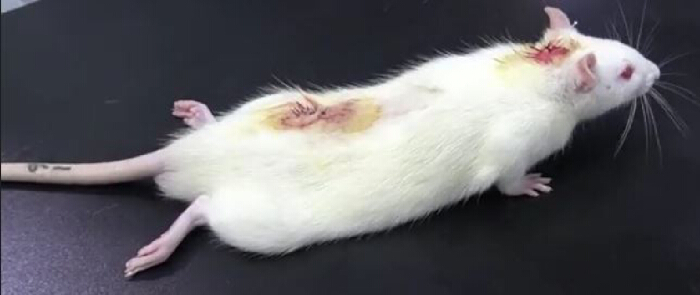
図 3.髄腔内カテーテル法後のリドカイン検証実験の結果。 2%リドカインを20μLの髄腔内注射に続いて生理食塩水を10μL注射した後、ラットは一時的に麻痺しました:下肢麻痺は30秒以内に発生し、30分後には消失し、髄腔内カテーテル法が成功したことを示しています。 この図の拡大版を表示するには、ここをクリックしてください。
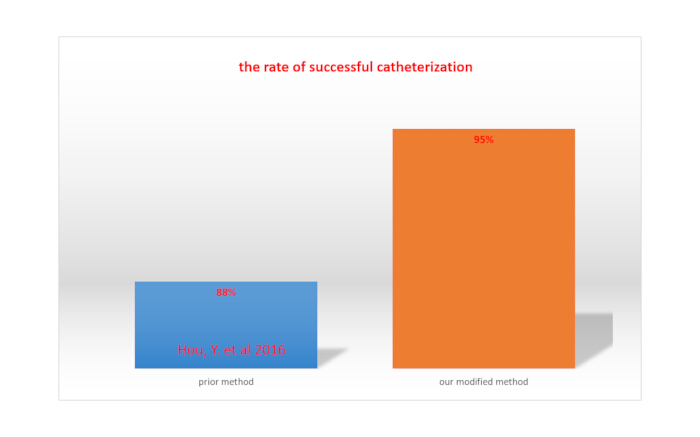
図 4.私たちの修正された方法と以前に報告された方法とのカテーテル挿入の成功率の比較。この図の拡大版を表示するには、ここをクリックしてください。
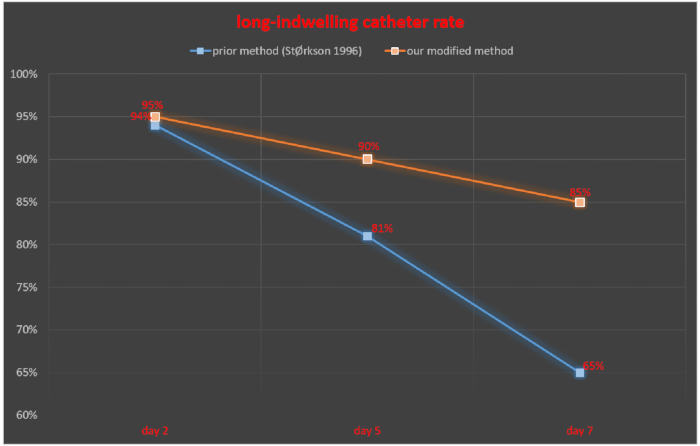
図 5.私たちの修正された方法と以前に報告された方法との長期留置カテーテル率の比較。この図の拡大版を表示するには、ここをクリックしてください。
| 変更された方法 | 以前の方法 | 修正方法の利点 | 従来の方法のデメリット | |
| 挿入のガイド方法 | ステンレス鋼線 | ガイドカニューレ(20G 0.9× 38 mm) | チューブの弾力性を高めます。 | 抵抗感が感じにくく、操作の難易度が上がります |
| 髄腔内カテーテル法の成功率を向上させます | 繰り返しの穿刺による組織の損傷 | |||
| 手術スペースの必要性を削減 | チューブの一端を元の長さの1.5倍に伸ばすため、両端の直径が異なります | |||
| 腰椎周辺の組織へのダメージを最小限に抑えます | 20Gガイドカニューレの直径がストレッチPE10チューブの2倍以上であるため、脳脊髄液漏れの影響を受けやすい | |||
| PE10チューブの長さ | 15センチメートル | 14 cm または 28 cm | カテーテル留置の持続時間に関係なく、PE10チューブの長さを簡単に決定できます | カテーテル留置の持続時間は、PE10チューブが短いほど短くなります。長いPE10チューブで体外に落ちやすい |
| 固定方法 | 「8」縫合糸と4回縫合 | 1つまたは2つのビーズ | 動物の活動中のチューブの動きと収縮を避けます | 両端のチューブの直径の違い、およびビーズ製造中のPE10チューブの変位に対する感受性 |
| チューブシールの方法 | 自作キャップ | いいえ | 脳脊髄液の漏れを防ぎます | PE10チューブの繰り返し切断の要件 |
| PE10チューブの繰り返し切断を回避 | ||||
| 後退防止の方法 | 抗アレルギーバンド | 1つまたは2つのビーズ | 動物の活動中にチューブが引っ込むのを防ぎます | 引っ込みに対する感受性 |
テーブル 1. 修正された方法と以前に報告された方法の長所と短所。
ディスカッション
髄腔内カテーテル法の成功率を最大化するために、この変更された方法にはいくつかの重要なヒントがあります。まず、両端が研磨された長さ20cmのステンレス鋼線を準備し、サポートとしてPE10チューブに挿入します。次に、オペレーターは、L5-6の椎間腔を綿球で洗浄した後、逆V字領域を完全に露出させ、歯付き鉗子でL5背側突起を持ち上げながら、椎間腔を別の鉗子で拡張する必要があります。第三に、PE10チューブを8の字縫合糸で4回固定する必要があります。最後に、PE10チューブの体外端をバンドで結び、自作のキャップで密封する必要があります。
髄腔内カテーテル法の成功率と椎体周囲の組織への損傷は、実験結果の信頼性に大きく影響する可能性があります15。したがって、成功率を可能な限り向上させ、周辺組織への損傷を減らすことは、動物モデルと関連する実験を確立する上で重要です1。この修正された方法では、PE10チューブにステンレス鋼線を挿入してガイダンスすることで、チューブの弾力性を高め、髄腔内カテーテル法の成功率を向上させます。さらに、この修正された方法により、手術に必要なスペースの量が減少し、周囲の組織が鈍く分離されますが、切断されないため、腰椎の周囲の組織への損傷が最小限に抑えられます。これに対し、先に報告した方法11では、穿刺中の抵抗を減らすために20Gのガイドカニューレが使用されており、穿刺を繰り返す必要があることが多く、組織を損傷する可能性があります。また、先に報告した方法では、PE10チューブの径を小さくするために、温水(60°C)に浸漬した後、一端を元の長さの約150%まで伸ばすと、20Gガイドカニューレの直径が引き伸ばされたPE10チューブの約2倍であるため、チューブ径の一貫性が確保されず、脳脊髄液の漏出を生じる可能性があります。さらに、私たちの方法では、腰椎機能が最大限に保存されるため、手術がその後の実験結果に影響を与えることを回避できます。これらの結果は、Xu et al2によって報告された結果と一致しています。
以前に報告された方法11では、PE10チューブが穿刺部位の周囲の部位に固定されている場合、PE10チューブの長さは約14cmですが、これらの条件下ではカテーテル留置時間が7日未満であることがよくあります(または、ラットによってチューブが体から取り出されます)。PE10チューブの長さは、ネックの後ろに固定した場合で約28cmとなり、本法で用いたPE10チューブ(15cm)よりも大幅に長くなります。Størksonら11によって報告されたプロトコルに従ってビーズが形成されましたが、一部のチューブは体から取り除かれ、手術後7日目にチューブの約65%しか所定の位置に固定されておらず、その後の実験の結果に大きな影響を与えました。私たちの方法では、PE10チューブを8の字縫合糸で4回固定し、PE10チューブの体外端をバンドで結んで、変位と収縮の可能性を減らします。私たちの方法では、手術後7日で約85%、手術後28日で約80%のチューブが所定の位置に留まりました。
以前に報告された方法11では、薬物投与ごとに髄腔内カテーテルの体外先端を切り落とす必要があります。しかし、薬物の髄腔内投与を繰り返すと、カテーテル留置時間が短縮され、薬物の髄腔内投与が不便になる場合があります。そこで、私たちの方法では、自作のキャップを使用してPE10チューブを密封し、1日1回エタノールで滅菌します。これにより、脳脊髄液の漏出を防ぐだけでなく、薬物の髄腔内投与のためにPE10チューブを繰り返し切断する必要性が減り、薬物の効果的な送達が保証されます。
修正された方法と以前に報告された方法の長所と短所を 表1にまとめます。まず、修正された方法では、PE10チューブにステンレス鋼線を使用すると、チューブの弾力性が高まり、髄腔内カテーテル法の成功率が向上し、手術に必要なスペースの量が減少し、腰椎周辺の組織への損傷が最小限に抑えられます。これまでに報告された方法では、抵抗を感じるまで20Gのガイドカニューレを挿入し、穿刺を繰り返すことが多く、組織に損傷を与える可能性があります。また、PE10チューブの一端は元の長さの約150%に達するまで引き伸ばされ、20Gガイドカニューレの直径が引き伸ばされたPE10チューブの2倍以上であるため、脳脊髄液漏れを引き起こす可能性があります。第二に、修正された方法では、PE10チューブの長さが手術前に決定され、カテーテルの留置時間は1週間より長くなることがあります。以前に報告された方法では、PE10チューブを穿刺部位に固定した場合、PE10チューブの長さは約14cmですが、チューブはラットによって体外に引き抜かれやすいため、カテーテル留置時間は7日未満であることがよくあります。PE10のチューブの長さは、首の後ろに固定すると約28cmで、私たちの方法で使用したチューブの長さよりも大幅に長くなります。第三に、変更された方法では、PE10チューブを8の字縫合糸で4回固定して、チューブの動きと収縮を防ぎます。PE10チューブのシールには自作のキャップを採用しており、脳脊髄液の漏れを防ぐだけでなく、PE10チューブを繰り返し切断する手間も防ぎます。先に報告した方法では、一定の直径のビーズを得ることが難しく、ビーズが形成されるとPE10チューブの変位が一般的であり、PE10チューブの繰り返し切断が必要になることが多い。最後に、修正された方法では、PE10チューブの体外端がバンドで結ばれており、これにより移動中にチューブが引っ込められるのを防ぎます。しかし、従来の方法では、一定の直径のビーズを得ることが難しいため、PE10チューブの収縮を確実に防ぐことができませんでした。
全体として、この変更された髄腔内カテーテル法には、次の利点があります。まず、PE10チューブにステンレス鋼線を使用すると、チューブの弾力性が高まり、髄腔内カテーテル法の成功率が向上し、手術に必要なスペースが減少し、腰椎周囲の組織への損傷が最小限に抑えられるため、腰椎の機能が最大限に維持され、手術がその後の実験結果に与える影響を回避できます。次に、PE10チューブは8の字縫合糸で4回固定されているため、チューブの動きと移動中の収縮を防ぎます。第三に、自作のシーリングキャップを使用してPE10チューブをシールし、脳脊髄液の漏れを防ぐだけでなく、PE10チューブを繰り返し切断する必要性を防ぎます。カテーテルの切断を繰り返すと、カテーテルが短くなり、薬の送達が不便になる場合があります。最後に、PE10チューブの体外端は抗アレルギーバンドで結ばれており、移動中にチューブが引っ込めるのを防ぎます。
ただし、この修正された髄腔内カテーテル法にはいくつかの制限があります。まず、手術後、PE10チューブの体外端の損傷を避けるために、ラットを別々に(ケージごとに1匹)飼育する必要があります。第二に、リドカインの髄腔内注射後5〜7日間の回復が必要です その後の実験の前に。
結論として、髄腔内カテーテル法のためのこの修正された方法は、薬物の反復髄腔内投与のための有用なツールとして機能し、実験の期間を短縮するためのシンプルで便利で信頼性の高い方法を表す可能性があります。
開示事項
この原稿の著者は、利益相反がないことを宣言しています。
謝辞
この研究は、国立自然科学基金会(第81971042号)と上海虹口区衛生委員会の重点支援専門プロジェクト(No.HKZK2020A06)。
資料
| Name | Company | Catalog Number | Comments |
| 1 cc syringe | Jiangxi Hongda Medical Equipment Co., Ltd | 1 cc | |
| 22 gauge × 1” needles | Jiangxi Hongda Medical Equipment Co., Ltd | 22G | |
| 23 gauge × 1” needles | Jiangxi Hongda Medical Equipment Co., Ltd | 23G | |
| 25 μL Hamilton Syringes | Shanghai Bolige Co.,Ltd | 0.31mm 25 μL | |
| 4-O MERSILK NON-ABSORBABLE SUTURE | ETHICON | SA83G | |
| 50 mL corning centrifuge tubes 3 cm diameter | 430820 | CORNING | |
| Epidural catheter and connector | Henan Tuoren Medical Device Co., Ltd | regular type | |
| Gavage apparatus | Shanghai Bolige Co.,Ltd | 8# | |
| PE-10 Mirco Medical Tubing | BB31695-PE/1 | Scientific Commodities, Inc | |
| Scalpel handle and #10 blades | Jiangsu Songxin Medical Equipment Co., Ltd | 125mm | |
| Scissors | Jiangsu Songxin Medical Equipment Co., Ltd | 100mm | |
| Sprague-Dawley (SD) rats | Shanghai BK/KY Biotechnology Co., Ltd | Male | |
| Stainless steel wire 0.2 mm diameter | Dongguan Jiazhi Metal Products Technology Co., Ltd. | 0.2mm × 1m | |
| Toothed forceps | Jiangsu Songxin Medical Equipment Co., Ltd | 18cm | |
| URGO silk tape | URGO | 1.25cm × 9.1m |
参考文献
- Kong, G., Huang, Z., Zhu, Q., Wan, Y. Comparison of two modified methods of intrathecal catheterization in rats. Exp Anim. 69 (2), 219-223 (2020).
- Xu, C. S., Sun, P., Lin, C. a new design puncture needle and a device of microcatheter protection for lumbar intrathecal catheterization in rats. Zhongguo Ying Yong Sheng Li Xue Za Zhi. 36 (3), 283-288 (2020).
- Yamamoto, G., et al. Neurosteroid dehydroepiandrosterone sulphate enhances pain transmission in rat spinal cord dorsal horn. Br J Anaesth. 123 (2), e215-e225 (2019).
- Mattioli, T. A., Sutak, M., Milne, B., Jhamandas, K., Cahill, C. M. Intrathecal catheterization influences tolerance to chronic morphine in rats. Anesth Analg. 114 (3), 690-693 (2012).
- Wang, B. C., Hillman, D. E., Li, D., Turndorf, H. Lumbar subarachnoid catheterization in rats. Pharmacol Biochem Behav. 38 (3), 685-688 (1991).
- Yaksh, T. L., Rudy, T. A. Chronic catheterization of the spinal subarachnoid space. Physiol Behav. 17 (6), 1031-1036 (1976).
- Martin, H., Kocher, L., Chery-Croze, S. Chronic lumbar intrathecal catheterization in the rat with reduced-length spinal compression. Physiol Behav. 33 (1), 159-161 (1984).
- Mazur, C., et al. Development of a simple, rapid, and robust intrathecal catheterization method in the rat. J Neurosci Methods. 280, 36-46 (2017).
- Zhang, S. X., Huang, F., Gates, M., White, J., Holmberg, E. G. Extensive scarring induced by chronic intrathecal tubing augmented cord tissue damage and worsened functional recovery after rat spinal cord injury. J Neurosci Methods. 191 (2), 201-207 (2010).
- Ohara, P. T. Long-term intrathecal catheterization in the rat. J Neurosci Methods. 110 (1-2), 81-89 (2001).
- StØrkson, R. V., KjØrsvik, A., TjØlsen, A., Hole, K. Lumbar catheterization of the spinal subarachnoid space in the rat. J Neurosci Methods. 65 (2), 167-172 (1996).
- Poon, Y. Y., Chang, A. Y., Ko, S. F., Chan, S. H. An improved procedure for catheterization of the thoracic spinal subarachnoid space in the rat. Anesth Analg. 101 (1), table of contents 155-160 (2005).
- Xu, F., Li, T., Zhang, B. An improved method for protecting and fixing the lumbar catheters placed in the spinal subarachnoid space of rats. J Neurosci Methods. 183 (2), 114-118 (2009).
- Igawa, Y., Andersson, K. E., Post, C., Uvelius, B., Mattiasson, A. A rat model for investigation of spinal mechanisms in detrusor instability associated with infravesical outflow obstruction. Urol Res. 21 (4), 239-244 (1993).
- Hou, Y., et al. A modified procedure for lumbar intrathecal catheterization in rats. Neurol Res. 38 (8), 725-732 (2016).
- Farhadi, E., et al. Comparison of open and ultrasound-guided placement of central venous catheter in children weighing less than five kilograms; a randomized clinical trial. Acad Radiol. 30 (7), 1419-1425 (2023).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved