個々の多機能細胞の同時および逐次サイトカイン分泌を解明するためのマイクロ流体アプローチ
* これらの著者は同等に貢献しました
要約
このプロトコルは、個々のヒト末梢血単核細胞のサイトカイン分泌動態を定量的に測定するための高度なマイクロ流体プラットフォームを説明しています。このプラットフォームは、例としてリポ多糖で刺激された個々の細胞ごとに最大3つのサイトカイン(IL-6、TNFα、およびIL-1β)を並行して測定します。
要約
感染症、自己免疫疾患、治療に対する望ましい免疫学的反応および有害な免疫学的反応は、 in vivoで複雑で動的なサイトカイン応答を引き起こす可能性があります。この応答には、免疫反応を調整するためにさまざまなサイトカインを分泌する多数の免疫細胞が含まれます。しかし、さまざまな細胞サブタイプによるさまざまなサイトカインの分泌動態、量、および共起は、それらを研究するための適切なツールが不足しているため、まだ十分に理解されていません。ここでは、マイクロ流体液滴プラットフォームを使用して、単一細胞レベルで並行して複数のサイトカインの分泌動態を時間分解して定量的に測定できるプロトコールについて説明します。これは、個々の細胞をマイクロ流体液滴にカプセル化し、サイトカイン濃度を並行して定量するためのマルチプレックスイムノアッセイ、動的蛍光イメージングのための固定化、および分泌量とダイナミクスを導き出すためのそれぞれの画像の解析によって可能になります。このプロトコルは、官能基化磁性ナノ粒子の調製、キャリブレーション実験、細胞調製、およびリポ多糖刺激ヒト末梢血単核細胞の例を使用した蛍光イメージングおよびその後の画像およびデータ解析のための液滴への細胞およびナノ粒子のカプセル化について説明しています。提示されたプラットフォームは、単一細胞と共分泌細胞の異なるサイトカイン分泌挙動を同定し、測定された細胞サンプルで予想される表現型の不均一性を特徴付けました。さらに、このアッセイのモジュール性により、さまざまなタンパク質、サイトカイン、細胞サンプルの研究に適応し、応用することができ、異なる免疫細胞タイプ間の相互作用や、厳密に制御された免疫応答を形成するために動的に分泌される異なるサイトカインの役割について、より深い理解につながる可能性があります。これらの新たな知見は、免疫調節不全の研究や、治療や医薬品開発における標的集団の特定において、特に興味深いものとなる可能性があります。
概要
感染症は、自然免疫系と適応免疫系が関与する複雑な宿主反応を引き起こすことがよくあります1,2。感染性病原体が感染または認識されると、宿主細胞は、重要なコミュニケーターとして知られ、免疫系の調節因子として知られる小さなタンパク質である多様なケモカインおよびサイトカインを産生することができる3。炎症誘発性サイトカインは、感染すると早期に放出されて免疫応答を開始し、その後、組織の損傷やその後の慢性疾患または自己炎症性疾患を予防するために重要な抗炎症性サイトカインが放出されます。脅威の排除と組織保護との間のこのバランスは、感染中に異なる機能を発揮するサイトカインの広範なレパートリーとして現れ、応答の微調整を可能にする4,5。この混合物内では、病原体とそれらが誘導するシグナル、組織の位置、およびそれらが由来する免疫細胞に応じて、独自のシグネチャーが観察されます。しかし、サイトカインの放出は、各細胞集団に特有の多機能な生物学的プロセスを構成し、分泌動態や個々の応答が多様であるようにも考えられます。この不均一性は、例えば、T細胞亜集団6,7において、自己炎症性疾患および重度のCOVID-19感染の調査において、患者内および患者間で炎症マーカーの大きな機能的多様性が示された8,9という文献で長年にわたって説明されてきた.最近、シングルセルシーケンシングの出現により、以前は明らかではなかった免疫微小環境内の亜集団間の高い可塑性とクロストークが浮き彫りになり、この不均一性を捕捉するためにシングルセル法が必要であることが示されています10,11。トランスクリプトームを解析するための新しい方法が開発されていますが、表現型解析には、単一細胞レベルでのタンパク質分泌の同時、定量的、および時間分解的な測定が必要であるため、依然として困難です。このような測定により、レパートリーまたはサイトカインのパネルについて、分泌細胞の同一性、ダイナミクス、および分泌パターン(遅発性/速性、初期性/後期性、同時性/逐次性)を調査することができます。免疫応答中のサイトカイン放出の動態を定量的かつ時間的な分解能で研究できるようにすることで、得られた洞察により、細胞集団と誘導された応答の理解が可能になるかもしれません。
標準的なプロトコルでは、サイトカインは通常、酵素結合免疫吸着アッセイ(ELISA)を使用して細胞懸濁液および血清の上清で検出され、バルク分泌量が得られます。バルク測定では、各細胞が産生するサイトカイン量を定量化することはできませんが、これは特に不均一な細胞サンプルで強調される問題です。細胞内サイトカイン染色、酵素結合免疫スポット(ELISpot)アッセイ、またはマイクロ刻印アッセイ(Isoplexisなど)などの代替法は、個々の細胞によって発現されるサイトカインを検出しますが、エンドポイント測定は12,13にとどまります。これは、インキュベーション時間中に細胞分泌パターンで発生する可能性のある分泌動態と変化が無視されることを意味します。さらに、エンドポイント測定では、同時サイトカイン分泌と連続サイトカイン分泌を区別することができないため、これらの方法を使用しても、サイトカイン分泌における免疫細胞の同時多機能性の真の程度は不明のままです。
単一細胞の分解能は、液滴マイクロ流体工学を使用してピコリットルサイズの物理コンパートメントを生成および処理し、免疫細胞のユニークなサイトカイン分泌表現型を単一細胞レベルで研究するために達成できます14,15。これらのコンパートメントは、油中水型エマルジョンからなり、マイクロ流体チップ16,17を用いて生成することができる。実際、液滴ベースのマイクロ流体アッセイは、シングルセルレベルでのさまざまな生物学的サンプルおよびレパートリーの分析を可能にし、それらをアップストリーム(細胞および試薬処理)およびダウンストリームプロセス(シングルセルソーティング、プロテオミクス、またはシーケンシング)と統合する上で非常に汎用性が高いことを実証しています18,19,20,21,22.特に、液滴固定化を可能にするセットアップは、単一細胞の機能を経時的に測定することを可能にし、これはタンパク質分泌の分析に有用です18。さらに、マルチプレックス化された定量アッセイを統合することで、共分泌や多機能免疫細胞の同定などのプロセスにおいて、以前はアクセスできなかった次元でのさらなる研究が容易になります23,24。
このプロトコルでは、個々の細胞17,23から並行して最大3つのサイトカインの分泌を検出、定量化、および時間的に測定するための固定化液滴ベースのシングルセルワークフローについて説明します。この技術は、20,000を超える細胞からのサイトカイン応答を並行して監視する機能を提供します。
提示されたワークフローは、単一の免疫細胞と官能基化されたナノ粒子を60 pLの油中水滴にマイクロ流体カプセル化することで構成されています。観察チャンバー内で>100,000個の液滴を固定化し、時間分解蛍光顕微鏡法により、各液滴および各サイトカイン内のサイトカイン分泌動態を測定できます(図1A)。液滴内の個々の細胞ごとに、サイトカイン分泌はサンドイッチイムノアッセイによって測定され、特異的捕捉抗体で官能基化された磁性ナノ粒子が分泌されたサイトカインに結合し、その後の蛍光標識検出抗体の再配置と結合につながります(図1B、C)。ビーズラインは、磁性ナノ粒子を整列させることによって形成され、サイトカインの存在下で蛍光再配置を定量化できます。ここで、蛍光再配置は、ビーズライン上に見られる平均蛍光強度を残りの液滴の平均蛍光強度で割ったものとして定義されます。このアッセイは、異なる官能基化されたナノ粒子バッチと、異なる蛍光チャネル23で標識されたそれぞれの検出抗体を混合することにより、いくつかのサイトカインについてマルチプレックス化することができ、その結果、異なるチャネルにおける特異的な蛍光再配置がもたらされる。カスタマイズされた解析スクリプトの助けを借りて、蛍光転位値を抽出し、その画像を個々の細胞およびサイトカインの分泌動的プロファイルに変換することができます。したがって、結果として得られるデータセットは、経時的な分泌測定、共分泌亜集団の同定、分泌量、速度、サイトカインの組み合わせに応じた細胞の分布など、多数の読み取り結果をもたらします。
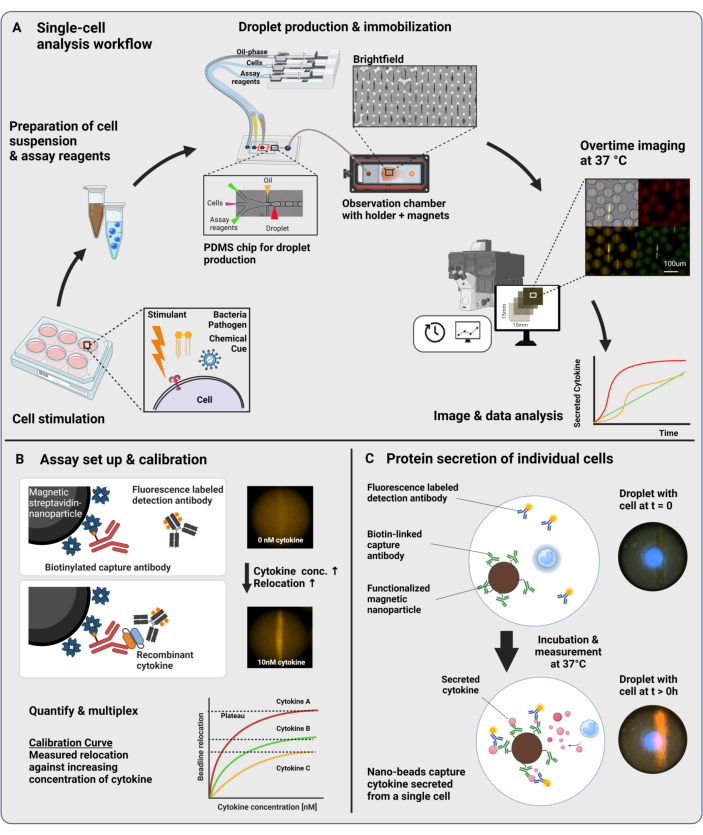
図1:ワークフローとアッセイの原理 (A)刺激後のサイトカイン分泌細胞を解析するためのワークフローの概要。シングルセル懸濁液および磁性ナノ粒子を調製し、容量の油/水エマルジョン(液滴)中で60pLにカプセル化します。液滴は固定化され、ナノ粒子は磁場内で整列し、30分ごとに最大4時間測定されます。最後に、画像が分析され、すべての液滴、時点、および蛍光チャネルのパラメーターが抽出されます。この数値は17から修正されています。(B)液滴サンドイッチバイオアッセイの原理。官能基化されたナノ粒子は分泌されたサイトカインに結合し、その結果、蛍光標識された検出抗体がナノ粒子に再移動します。この蛍光の再配置は、組換えサイトカインを用いて実施されたキャリブレーション実験により定量化され、検証されます。異なる官能基ナノ粒子を混合することで、最大3つのサイトカインを同時にマルチプレックス測定することができます。(C)細胞ベースの実験では、測定時間にわたって液滴を追跡し、ナノ粒子上の蛍光再配置の経時的な増加によって分泌細胞を同定します。回路図は縮尺に追いついていません。BioRender.com で作成したフィギュア。 この図の拡大版を表示するには、ここをクリックしてください。
プロトコル
すべての実験は、倫理契約EK202-N-56に基づいて実施され、ETHチューリッヒの倫理委員会によって承認されました。ヒト細胞の取り扱いは、バイオセーフティレベル2の実験室に含まれる層流キャビネットで行われました。
注:次のセクションでは、単一細胞レベルで時間分解サイトカイン分泌を測定するためのプロトコルについて詳しく説明します。ここで概説する手順は、リポ多糖類(LPS)による末梢血単核細胞(PBMC)の刺激と、サイトカインIL-6、TNFα、およびIL-1βの並行測定に適用されます。ただし、必要に応じて、プロトコルを他の細胞タイプ、刺激剤、およびサイトカインに適合させることができます。
1. 観察室の製作
注:イメージング中の液滴の動きを避けるために、液滴の直径よりも約10%小さい高さの観察チャンバーが準備されています。
- カッティング両面テープとトップスライドガラスの準備
- 切断ソフトウェアの[設計]タブで、チャンバーの切り欠きの目的のデザインを描画またはロードします。ここで使用する特定のディメンションについては、 図 2E を参照してください。
- 厚さ32μmの両面粘着テープを粘着カッティングマットにテープで固定し、カッティングマットを自動カッティングマシンに置きます。
- ステップ1.3で取り外しを容易にするために、チャンバーの長辺を同じ方向にカットするように注意しながら、テープからチャンバーデザインを切り取ります。
- テープの切り欠きは室温で保管し、長期保存してください。短期保存の場合は、-20°Cで保存し、ステップ1.3の直前にのみ取り出します。取り扱いが簡単です。
- 1つの標準的な顕微鏡スライド(76 mm x 26 mm x 1 mm)の中央に直径約1 mmの2つの穴を開け、2つの穴の間の距離は約3.5 cmです。
- スライドガラスの洗浄とプラズマ活性化
- 穴の開いたスライドガラスと穴のないスライドガラスを石鹸で清掃します。蒸留水でよくすすぎ、糸くずの出ない精密ワイプで乾かします。
- スライドガラスをプラズマクリーナーに入れ、上面を55Wで10分間プラズマ処理します。スライドガラスを取り外し、手順1.3に進みます。
- チャンバー組立
- 穴の開いたスライドガラスを、プラズマで活性化された面を上に向けて、活性化された表面に触れないように、きれいな表面に置きます。
- 両面粘着テープの片面から、切断と同じ方向に保護層をはがします。テープの切り欠きをスライドガラスの端とドリルで開けた穴に触れずに合わせ、テープを短辺から始めてゆっくりとスライドガラスに接触させます。
注意: テープに伸びや折り目が生じないように注意してください。これにより、チャンバーの高さが正しくなくなります。このステップはエラーが発生しやすく、ある程度の実務経験が必要なため、複数のスライドガラスを並行して準備することをお勧めします。 - テープから2番目の保護層を再び切断方向に取り除き、アクティブ化された表面を下に向けて穴のない2番目のスライドガラスを置きます。平らな板を上に置き、上半身の力で約10秒間押し下げて、2つのスライドガラスの全面を一緒に押します。
- 2つのスライドガラスを組み立てた後、2つの穴が手前を向くようにチャンバーを反転させます。ポートの下のリングに少量のUV硬化型接着剤を入れ、スライドガラスの穴の上にポートを配置して、ナノポートを2つの穴に接着します。ポートの周りにUV硬化性接着剤のリングを追加し、UVランプで接着剤を硬化させます。チャンバーは 図2Eのようになります。すぐに手順 1.4 に進みます。
注意: 紫外線は目や肌に損傷を与える可能性があります。適切な保護具を着用してください。
- チャンバー表面の親蛍光コーティング
注:このステップは、良好なコーティング効率を確保するために、スライドガラスのプラズマ処理(ステップ1.2.2)後1時間以内に行う必要があります。- フッ素系油(HFE-7500)に1%フルオロシラン溶液(1H,1H,2H,2H-パーフルオロデシルトリクロロシラン)を1mL新たに調製し、シリンジに充填します。コーティング溶液をPTFEシリンジフィルターと0.3 mm x 0.76 mm PTFEマイクロチューブに接続された27G x 0.75インチの針に通して観察チャンバーに押し込みます。
- 1分間のインキュベーション後、ヒュームフードの下で窒素圧を使用してコーティング溶液をチャンバーから洗い流します。別のシリンジアセンブリを使用して、チャンバーをフッ素化オイル(HFE-7500のみ)ですすいでください。
- フッ素系オイルを充填したチャンバーを、入口を閉じた状態で室温(RT)で保管してください。各実験の後、細胞と液滴を直接洗い流して、コーティングが良好に保存されるようにします。
注:プロトコールはここで一時停止でき、チャンバーは数ヶ月間保管して再利用できます。
- マグネット付きチャンバーホルダー
- 磁性ナノ粒子の整列のために、液滴のカプセル化およびイメージング中に観察チャンバーに静磁場を印加します。このためには、チャンバーをカスタム3Dプリント顕微鏡ホルダー( 図2D、およびBounab et al.17 補足データ4にあるファイルを参照)に入れ、チャンバーの長辺に沿って2つのネオジム磁石を保持します。
2. ナノ粒子の機能化
注:ナノ粒子の機能化のプロセスは、各サイトカインで類似していますが、唯一の違いは、サイトカイン特異的な捕捉抗体の添加です。各サイトカインの機能化は、異なる個々の反応チューブで並行して行われます。このプロトコールに先立ち、TNFα捕捉抗体とIL-1β検出抗体は、それぞれビオチンとAlexa Fluor 647で社内で標識されていました。標識は、ベンダーのウェブサイト( 材料表のリンクを参照)に記載されているメーカーのプロトコールに従って行い、抗体を分注して-20°Cで保存しました。
- TNFα検出用のチューブにストレプトアビジン官能基化ナノ粒子50μL(直径(Ø)300nm)、IL-1β用50μL、IL-6用100μLを添加します。ナノ粒子溶液をリン酸緩衝生理食塩水(PBS)で1:1(v / v)に希釈します。
- 各チューブに、それぞれの容量のビオチン化捕捉抗体(ストック濃度0.5 mg/mL)を1/20(v/v)加え、室温で30分間インキュベートします。
注:ナノ粒子溶液に少量を添加する場合は、チューブの上部にボリュームを堆積させ、溶液の大部分で複数回洗い流します。これにより、適切な混合が保証され、骨材の形成が防止されます。 - 1 mM D-ビオチン溶液の1/100(v/v)をチューブに加え、室温で5分間インキュベートします。これにより、最終的なビオチン濃度は10 μMになります。
注:過剰なビオチンは、ナノ粒子上の自由結合面をブロックし、不要な凝集体の形成を減少させます。 - ネオジム磁石をチューブに近づけて粒子を収集します。上清が透明になるまで待ってから、上清を捨てます。
注:アッセイ全体で使用される磁石は非常に強い引力を示し、2つの磁石が誤って一緒に折れると物理的な害を及ぼす可能性があります。 - ナノ粒子表面への非特異的吸着を低減するために、ナノ粒子をPluronic F-127のステップ2.1の最終体積の0.5倍(10%)およびPBSの0.5倍に直ちに再懸濁します。溶液をRTで30分間インキュベートします。
- 磁石を使用して粒子を収集し、上清を捨て、保存バッファーの1倍の量に再懸濁します(RPMI 1640、5%ノックアウト血清置換、1%ペン/連鎖球菌、1%組換えヒト血清アルブミン(HSA)、25 mM HEPES、0.1%プルロンF-127)。溶液をRTで30分間インキュベートします。
注:ここでプロトコールを一時停止することができ、粒子は4°Cで最大1週間保存することができます。 - カプセル化の直前に、ピペッティングで粒子を再懸濁し、結合したナノ粒子をIL-6:TNFα:IL-1βに対してそれぞれ2:1:1(v / v)の比率で混合します。
注:官能基化ナノ粒子の異なる比率は、各サイトカインに使用される抗体ペアに依存し、最適なダイナミックレンジを得るためにキャリブレーションサンプルを通じて実験的に決定されています。 - 磁石で粒子を収集し、上清を捨てて再懸濁することにより、完全な培地(RPMI 1640、10%FBS、1%ペン/溶連菌、25 mM HEPES)で洗浄します。この手順を繰り返しますが、手順 2.7 の完全なメディアの 0.5 倍のボリュームでのみ再サスペンドします。
- 異なる標識をしたIL-6、TNFα、およびIL-1β検出抗体を溶液に添加して、それぞれ最終濃度が10 nMになるようにします。これで、溶液を液滴実験に使用する準備が整いました。
3. 細胞調製
注:PBMCは、チューリッヒ血液銀行から受け取ったバフィーコートから分離されました。細胞を凍結し、液体窒素中のクライオバイアル(1 x 107 細胞/バイアル)に数ヶ月間保存した。
- 細胞の解凍
- 実験開始の1時間前に、完全な培地とMACSバッファー(2 mM EDTA、0.5% BSAのDPBS、滅菌ろ過済み)を室温でウォームアップします。9 mLの完全培地を15 mLのチューブに加え、37°Cのウォーターバスに保持して、細胞を含むチューブを準備します。
- PBMC クライオバイアル (~1 x 107 細胞を含む) を液体窒素で保存します。クライオチューブを37°Cのウォーターバスで渦巻かせ、氷が少量になるまで渦巻かせます。
- チューブを70%EtOHで拭き取り、層流キャビネットに移します。1 mLの予熱済み完全培地をクライオバイアルに加え、穏やかに混合し、すべての細胞を温かい完全培地が入ったチューブに移します。クライオバイアルは、1 mLの温かい完全培地で洗浄して、最大数の細胞を回収できます。
- 細胞を500 x g で5分間室温で回転させ、上清を捨て、ピペットで細胞ペレットを1 mLの完全培地で穏やかに再懸濁します。9 mLの完全培地を加えます。
- 細胞を500 x g で5分間室温で回転させ、上清を捨て、前と同様に1 mLの完全培地に再懸濁します。
- 使用可能なセルカウンターを使用してセルをカウントします。この場合、自動セルカウンターが使用されました。細胞は、10 μL の細胞懸濁液と 10 μL のトリパンブルーを混合し、10 μL の混合物を細胞計数スライドに移すことにより、細胞をカウントしました。
- 染色とFcRブロッキング
- 細胞の総数と、細胞を 2 x 106 生細胞/mL で再懸濁するために必要な量を計算します。細胞染色液(CellTrace Violet)をストック(5 mM)をPBS(使用濃度5 μM)で1000倍に希釈して調製します。
- 細胞を500 x g で5分間室温で回転させ、上清を捨て、ステップ3.2.1で調製した計算量の細胞染色溶液に細胞を再懸濁します。細胞を37°Cで5分間インキュベートします。
- インキュベーションの終わりに、溶液中の残りの色素を完全な培地(染料溶液の少なくとも2倍の量)に加えて急冷します。細胞を500 x g で5分間、室温で回転させます。
- 上清を捨て、細胞ペレットを60 μLのMACSバッファーに再懸濁し、1 x 107 細胞あたり20 μLのヒトFcRブロックを添加します。細胞を室温で10分間インキュベートします。
- チューブにMACS Bufferを10 mL充填し、細胞を500 x g で室温で5分間遠心します。
- 上清を捨て、細胞を1mLの完全培地に再懸濁しますステップ3.1.6で説明したように細胞をカウントします。
- LPSによる細胞刺激
- 細胞数を使用して、細胞を1 x 106 細胞/mLで希釈し、超低結合の6ウェルプレートで2 mLの細胞を各ウェルに移します。
- LPSを完全な培地で希釈し、細胞を含むウェルに添加して、LPSの最終濃度を1 μg/mLにします。細胞を37°Cで6時間インキュベートします。
- カプセル化の準備
- 刺激時間の終わりに、細胞懸濁液を新しい15 mLチューブに移します。
- 1 mLの完全培地を空のウェルに加えます。セルスクレーパーで、残りのセルを取り外してください。細胞を新しい15 mLチューブに移します。ウェルを1 mLの完全培地で洗浄し、別の15 mLチューブに移します。
- 2つのチューブを500 x g で5分間室温で回転させ、1 mLの原液の上清溶液(洗浄していない細胞を含む最初のチューブから)を新しいチューブに移し、必要に応じてさらに分析します(例:ELISA)。
- 残りの上清を捨てます。
- ペレットを0.5 mLの完全培地に再懸濁し、同じウェルの細胞を結合し、遠心チューブに移します。ステップ 3.1.6 で説明したようにセルを数えます。
- 細胞を500 x g で5分間室温で回転させ、上清の大部分を廃棄します(約100 μLを残します)。ペレットを再懸濁せずに、200 μLの完全培地を非常に慎重に加えます。
- 上清を捨てます。ステップ8.6で定義したように、6.6〜13.3×106 細胞/mLの濃度で細胞を完全培地に再懸濁し、カプセル化のための液滴当たりの平均細胞数λ=0.2〜0.4を達成します。
注:ステップ3.4.6および3.4.7は、上清へのサイトカイン分泌を避けるために、カプセル化の直前に実行する必要があります。液滴あたりの細胞数はポアソン分布に従います: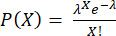 、PはX個の細胞を含む液滴の割合を示し、λは液滴あたりの平均細胞数です。
、PはX個の細胞を含む液滴の割合を示し、λは液滴あたりの平均細胞数です。
4. カプセル化と液滴生成
注:液滴中の細胞のカプセル化は、マイクロ流体液滴発生器チップによって可能になるが、その製造は他の場所で非常に詳細に説明されている17。代替品は市販されています( 資料の表の例を参照)。適切な液滴発生器チップ設計には、水相用の2つの入口、油相用の1つの入口、および生成された液滴用の1つの出口があります。さらに、適切な商用液滴発生チップは、40〜60pLの体積のフッ素化油滴中の水の生成を可能にする必要があります。ここで説明するプロトコルは、直径50μmの水/油エマルジョン(液滴)をもたらします。プロトコルを変更するためにさまざまなオプションを使用すると、液滴が大きくなったり小さくなったりする可能性があります。
- シリンジポンプの準備(図2A)
- 1 mLシリンジに、HFE-7500フッ素系オイル中の2% 008-フッ素系界面活性剤からなる500 μLの連続相を入れます。27G x 0.75インチの針を0.30 mm x 0.76 mm PTFEマイクロチューブに接続し、アセンブリをシリンジに取り付け、続いてシリンジポンプに取り付けます。
注意: シリンジまたはカニューレに空気が残っていないことを確認すると、流量が一定にならないため、注意してください。 - 水相用の2つのカスタムメイドピペットチップコネクタを準備します(図2B):Ø0.75mmの生検パンチで、Ø6mmの~5mmの高さのPDMSカットアウトの中央に穴を開けます。PDMSの切り欠きの穴から~3cmのPTFEチューブ(内径0.56mm、外径1.07mm)を引っ張り、アセンブリを200μLのピペットチップの上部に押し込みます。チューブの反対側を23Gx1.25インチの針に接続します。ピペットの上部にUV硬化型接着剤を広げてコネクタを密閉し、UV光で硬化させます。
注意: 紫外線は目に有害であるため、保護のためにUVカットゴーグルを着用してください。 - 2つの1mLシリンジに500μLの軽質鉱物油を充填し、2本の23G針をカスタムメイドのアタッチメントで取り付け、両方をシリンジポンプに取り付けます。
- シリンジポンプ制御ソフトウェアを使用して、30 μLのナノ粒子と30 μLの細胞溶液を水相のピペットチップに吸引します。
- 表面を水で洗浄して汚れやホコリを落とし、精密ワイプで乾燥させて観察室を用意します。2つのネオジム磁石を備えた印刷されたチャンバーホルダーにチャンバーをクランプします。
注意: 磁石が正しい方向を向いている(互いに引き合う)ことを確認して、細長い骨材を形成してください。 - チャンバーをわずかに傾けます(30°)。両方のポートを開き、上部ポートにペーパータオルを差し込んで、充填中に余分な外相を吸収します。
- 1 mLシリンジに、HFE-7500フッ素系オイル中の2% 008-フッ素系界面活性剤からなる500 μLの連続相を入れます。27G x 0.75インチの針を0.30 mm x 0.76 mm PTFEマイクロチューブに接続し、アセンブリをシリンジに取り付け、続いてシリンジポンプに取り付けます。
- 液滴製造とチャンバー充填
- 連続相ビアチューブをマイクロ流体チップの上部インレットに接続します(図2A、C、F)。1800 μL/h の流量を使用して、連続相でチップを約 30 秒間フラッシュします。
- 水溶液のピペットチップを2つの中央の入口に接続します(図2A、C、F)。
- それぞれ200μL / hで水溶液の流れを開始し、チャネルと出口を液体で満たします。磁性ナノ粒子を使用する場合、均質な茶赤色の溶液がチップ出口から流出するはずです。
- 液体が出口に現れたら、800 μL/hでフッ素化油相の流れを開始し、出口で均質な灰色の光沢のある溶液が流出することで確認され、安定した液滴生成が確立されるまで待ちます。
- 液滴の安定した生産が確立されたら、PTFEマイクロチューブ(内径0.3 mm x 外径0.76 mm)を出口ポートに接続して生成した液滴を回収し、マイクロチューブを指で締まったワンピース継手のフェルールモジュールに通して観察チャンバーに送ります(図2A)。
- 適切な液滴生成が発生した場合、均質で光沢のある液体がチャンバーを下から上にまっすぐに満たす必要があります。
- チャンバーが満たされたら、流れを止め、指で締める圧力を使用してポートプラグでポートを閉じます。
注意: チャンバーをきつく閉じすぎないように注意してください。空気のトラップや流入は、液滴の動きにつながり、測定中の追跡を損なう可能性があります。 - 液滴が生成された後、チップをフッ素化オイルで洗い流し、液体のリマインダーを窒素で吹き飛ばして、その機能を維持します。チップは何度も再利用でき、目詰まりしない限り数か月間保存できます。
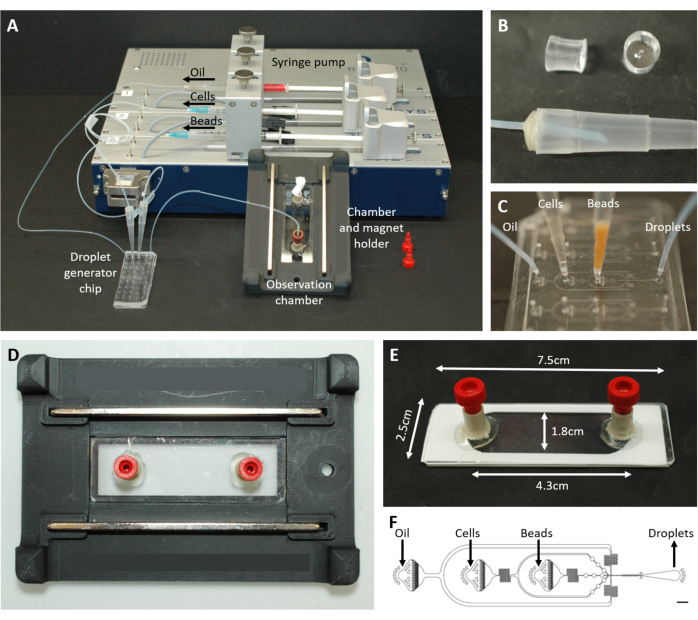
図2:マイクロ流体セットアップの概要。 (A)シリンジポンプ、液滴発生チップ、観察室、顕微鏡ホルダーによる液滴封入のためのセットアップ。(B)プロトコールステップ4.1.2で説明されているように、200 μLピペットチップ(下)へのコネクタを形成するためのパンチングPDMSプラグ(上)の写真。(C)チューブとピペットチップの液滴発生チップへの接続の画像。(D)カスタム3Dプリント顕微鏡ホルダーの中に置かれたチャンバーの写真で、上部と下部に2つの磁石があります。(E)観察室の写真(図解用の白いテープ付き)。(F)液滴生成用マイクロ流体チップのレイアウト(スケールバー:750μm)。この数値は17から修正されています。 この図の拡大版を表示するには、ここをクリックしてください。
5. 画像の取得と測定
注:画像取得は、インキュベーターに封入された標準的な倒立型落射蛍光顕微鏡で行われ、37°Cでの測定が可能です。 ここで説明する設定は、Orca Fusionカメラを搭載したNIS Elementsソフトウェア(V.5.30.04)で動作するNikon Eclipse Ti2顕微鏡に固有のものですが、一般的には他の蛍光顕微鏡やカメラにも適応できます。
- 測定パラメータの設定
- 画像のサイズを設定するには、配列サイズとして 10 x 10 の画像を選択します。このアレイには、約50,000〜70,000個の液滴が含まれます。1%のオーバーラップを使用して、画像のステッチングのブレンドをアクティブにします。
- 測定チャンネル数を設定するには、細胞検出用のDAPIチャンネル、サイトカイン検出用のFITC、TRITC、Cy5チャンネル(ビーズライン)、液滴検出用のBFチャンネルを選択します。ビット深度には、2 x 2 ビットと 16 ビットのピクセル ビニングを使用します。カメラの設定を調整して、すべての蛍光チャネルでカメラの最大値に達しない液滴内強度ピクセル値を達成します。
注:各チャンネルの正確な露光時間とランプ強度は、使用するモデルと試薬によって異なり、検量線を生成する前に確立されます(ステップ7)。キャリブレーションとセル測定で同じ取得設定を使用することは、正確な定量化にとって重要です。 - 時間分解測定を設定するには、30分ごとに合計9回の測定を行います。
注:測定パラメータは、使用済み細胞、刺激剤、試薬、測定されたサイトカイン、インキュベーション温度、および顕微鏡モデルによって異なる場合があります。
- 測定の開始
- チャンバーホルダーをウェルプレートフォーマットステージ(図2D)で顕微鏡に取り付け、10倍対物レンズを使用して明視野(BF)チャンネルに切り替えます。
- BFの固定化された液滴に焦点を当て、必要に応じてパンして調整することにより、アセンブリが完全な平面に取り付けられていることを確認します。後続の手順のためにチャンバーの中央に移動します。
- オートフォーカスシステム(PFS)を作動させ、BFチャンネル上の最適な測定面に設定すると、液滴の端が油相や背景と簡単に区別できる黒く鋭い円として現れます。
注:自動集光システムがなくても測定も可能ですが、顕微鏡に自動集光システムが装備されている場合は、それを使用することを強くお勧めします。これにより、大きくてステッチが多かった画像の測定品質が向上します。 - すべての蛍光チャネルを通過し、それぞれに最適な測定面を設定します。FITC、TRITC、Cy5チャネルでの再配置測定では、ナノ粒子凝集体が完全に焦点を合わせていることを確認し、DAPIチャネルでは、細胞に焦点が合っていることを確認します。
注:最適な焦点面とz値は、測定されたすべてのチャンネルで異なる場合があります。各チャンネルのPFSオフセットは必ず保存してください。 - 測定を開始する前に、すべてのチャネルを通過して個々の焦点を再確認し、溶液がウォームアップしている間に最初に動きが発生する可能性があるため、平衡化するために5分間待ちます。
- 測定を開始します。最初の画像を生成した後、不規則性(フォーカス、動く液滴、間違ったチャンネルなど)がないか確認します。必要に応じて取得を再開するか、空気の場合はチャンバーを補充します(ステップ4.1.4から開始します)。アセンブリを放置して、4時間にわたって液滴をイメージングします。
6. 画像解析
- 画像解析ソフトウェア(DropMap Analyzer App v 4.023)をMatLab(https://github.com/ESPCI-LCMD/MiMB)にインストールし、生成された.nd2ファイルを実験から解析コンピュータに転送します。
- アプリケーションを開きます。指定された設定を選択し、それ以外の場合はデフォルト値のままにします:CH1:DAPI、WD(全液滴)が選択されています。CH2:FITC、BL(ビーズライン)が選択されています。CH3:TRITC、BLを選択。CH4:Cy5、BLが選択されました。最大液滴径(μm):70;落下検出:フル。追跡:はい。 [スタート ]ボタン(フルーツのアイコン)を押して.nd2ファイルの場所を選択し、解析を開始します。
- 数分後、プログラムは画像のサンプル セクションを表示します (図 3A)。飛沫検出に適したものが見つかるまで スペース を押し、 Enterキーを押します。同じ画像セクションで、液滴を検出するための閾値パラメーターを見つけるための代表的な領域に四角形を描画します。
- 数分後、DAPIチャネルの強度分布を示す別のウィンドウが開きます。スライダをドラッグ&ドロップして、染色した細胞からのシグナルのみを検出し、右上の 「Done 」をクリックします。
- 画像を [Max. Drop Diameter (μm)] (最大液滴径 (μm) よりも小さい直径の 1 つの液滴にセグメント化した後、プログラムはユーザー入力なしで各液滴、タイムポイント、および蛍光チャネルに対して次の手順を実行します ( 図 3 を参照)。
- ソフトウェアは、時間点間で移動した液滴のピクセルを計算します(40ピクセルを超えて移動する液滴は自動的に除外されます)。
- このソフトウェアは、液滴全体の平均蛍光値を測定し、水平線上の最も明るいピクセルを見つけ、液滴の上から下までの垂直線上のすべてのピクセル強度を平均することにより、平均ビーズライン強度を検出および測定します。これは自動的に行われ、次の式に従って平均ビードライン再配置値(図3B)を計算するために使用されます(図3B)。
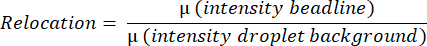
- ソフトウェアは、DAPIチャネルで設定されたしきい値を超える液滴領域の合計ピクセルの割合を計算します。
- 結果の .xslx ファイルには、さらに分析するための次の列が含まれます: DropIdX (経時的に追跡された液滴の ID)、TrueCentroid_ t*2-1 および t+2 (それぞれ、時間点 t の液滴中心の x 座標と y 座標)、DiameterMicrons (液滴の直径 (μm)、TrackingMove (測定時間全体で移動したピクセル数)、FluoChannel_BL_Ratio_t (時間点 t での FluoChannel の再配置値)、 DAPI_WD_PosPxlCount_t(時点tにおけるDAPIチャネルの液滴全体の中でしきい値を超えるピクセル数)。
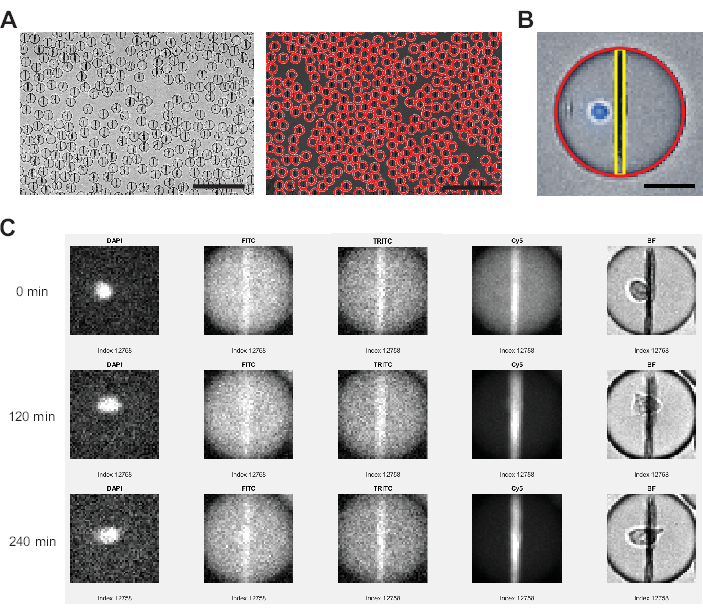
図3:画像解析ソフトウェアによって実行される画像解析 (A)液滴は、ハフ変換を使用して明視野(BF)チャネルで検出され、各液滴に赤い円でマークされます。スケールバー:200μm.(B)各液滴内では、水平面内の最も明るいピクセルと、液滴の上から下まで広がるすべてのピクセルの平均蛍光強度を通じて、ナノ粒子ビーズラインが識別されます。さらに、セルは、液滴領域全体に対してしきい値を超えるピクセルパーセンテージ>0によって識別されます。スケールバー:20 μm. (C) 分析ソフトウェアは、個々の液滴について、測定されたすべての時間点について、ナノ粒子の蛍光強度をFITC、TRITC、Cy5チャンネルの液滴バックグラウンドと比較します。表示されているのは、タイムポイント0、4(120分)、9(240分)です。正しいドロップレットとセルの検出を手動で確認するために、DAPIチャネルとBFチャネルも表示されます。 この図の拡大版を表示するには、ここをクリックしてください。
7. キャリブレーション
注:定量的な読み出しのためには、異なる実験設定間で違いが生じる可能性があるため、サイトカイン濃度と蛍光再配置値へのキャリブレーションを一度実行する必要があります。必要なすべての手順については、参照された前のプロトコル セクションで詳しく説明しています。
- ステップ2で説明したようにナノ粒子を調製します。
- ヒトIL-6、TNFα、IL-1β組換えタンパク質をメーカーの指示に従って再構成します。
注意: 冷凍アリコートは一度だけ解凍し、すぐに使用するようにしてください。 - 開始濃度が 80 nM から 0.625 nM までの完全な培地(10% FBS、1% Pen/Strep、25 mM HEPES)を使用して、3 つのタンパク質すべての 2 倍希釈シリーズを一緒に調製します。
- ステップ4で説明したように、第1の官能基ナノ粒子を、第2の水相のみをRPMIでカプセル化します。この測定値はブランクとして機能し、測定された標準偏差は後でデータ分析に使用されます。
- 5 分間待ってから、手順 5 の説明に従って液滴を画像化します。アレイサイズが2 x 2のそれぞれの蛍光チャンネルで3枚の画像を撮影します。
- 準備したすべてのキャリブレーション溶液について、ステップ7.4と7.5を、最も低い濃度から最高濃度まで繰り返します。
- ステップ 6 の説明に従ってイメージを分析します。DAPIチャネルにWDオプションを使用せず、[トラッキング]を[いいえ]に設定してください。
- この解析では、1つの画像で測定されたすべての液滴の蛍光再配置値が出力されます。すべての蛍光チャネルの中央値と標準偏差を抽出します。濃度ごとに測定されたすべての画像の中央値と標準偏差を平均化します。
- 各組換えタンパク質の測定濃度に対して平均中央値再配置をプロットすることにより、検量線を生成します。
- 1 相の関連付けを使用して曲線をフィットします:
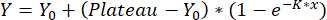 、
、
Y = x での再配置、Y0 = ブランク測定値の再配置、x は使用濃度です。得られた検量線は、ステップ8で説明したように、再配置値を定量化するために使用されます。
注意: 測定された最高移動までの値のみに適合し、測定された移動が少ない高濃度からの値を除外します。高濃度での測定された再配置値の減少が予想され、フック効果とナノ粒子の結合能力の制限により発生します。
8. データ分析
- TrackingMove 値が 10 より大きい、つまり測定の時間経過で 10 ピクセル以上移動した液滴を除外します。
- 最初の時点で染色細胞を含む液滴(DAPIチャネル)を同定するには、列DAPI_WD_PosPxlPercent_1で0より大きい値の液滴をソーティングします。
- 各蛍光チャネル(FluoChannel_BL_Ratio_tカラム)の蛍光再配置に以下の3つの基準を適用することにより、分泌細胞を含む液滴を同定します。
- リロケーション値が増加する液滴を、測定時間にわたって正の傾きでソートすることにより、特定します。
- 再配置値が検出限界(LOD)に達している液滴を特定します。液滴は、測定時間にわたる最大蛍光再配置がLODよりも優れている場合に選択され、他の場所で説明したように計算されます25:
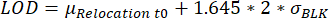 、ここで、μ再配置t0は、時間点0およびσBLK におけるすべての再配置値の中央値であり、BLKはキャリブレーション中に測定されたブランクの標準偏差であり、それぞれがサイトカイン特異的です。
、ここで、μ再配置t0は、時間点0およびσBLK におけるすべての再配置値の中央値であり、BLKはキャリブレーション中に測定されたブランクの標準偏差であり、それぞれがサイトカイン特異的です。 - 測定時間中の最大測定蛍光再配置と最小蛍光再配置の間の変化が以下よりも優れていることを確認することにより、再配置値の増加が有意であることを確認する
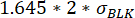 。
。
- ステップ8.3で説明した基準を満たすことにより、共分泌細胞を同定します。同時に複数の蛍光チャネル用。
- 手順8.3を繰り返します。セルを含まないすべての液滴 (DAPI_WD_PosPxlPercent_1 = 0) に対して。これらのドロップレットを使用して、誤検出の割合を計算します。
- 200〜500個の液滴をランダムに選択し、画像解析ソフトウェアの検証およびソート機能でそれらを検査することにより、測定値の正確なλ値を決定します。これらの液滴中の細胞の数を数え、次のように計算します。
λ = カウントされた細胞の数 / 解析された液滴の数 - 測定用のカプセル化されたセルの総数を次のように計算します。
総細胞数 = λ × 解析した液滴の数 - 決定された細胞数を使用して、分泌細胞の割合を計算します。さらに、各サイトカインの偽陽性率(通常、チャネルあたりの実際の陽性数に対して3%〜5%未満)を計算し、実験の一貫性と再現性の内部コントロールとして使用します。
- 分泌サイトカイン濃度を計算するには、ステップ7.10で確立されたキャリブレーション方程式を使用して、再配置値を濃度に変換します。
- 次の式を使用して、時点間の分泌率(SR)を計算します。
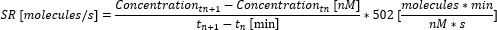
- 時間ポイント間の個々の分泌速度を平均することにより、測定値全体の平均分泌速度を計算します。測定が終了する前に最大測定可能再配置に達した場合は、濃度を最大測定可能濃度(この値はサイトカイン固有であり、ステップ6.10の検量線で測定および使用された最大濃度に対応します)に設定し、それ以上の濃度を計算しないでください。分泌率を計算し、この時点までの平均のみを計算します。
注:1つの蛍光チャネルで検出される分泌細胞が50個未満の場合、液滴は検証およびソート機能を通じて視覚的に検査する必要があり、蛍光またはナノ粒子凝集体を有する液滴は分析から除外できます。 - 各単一細胞の分泌曲線からさらにパラメーターを抽出するには、カスタムPythonスクリプト(ご要望に応じて利用可能)を使用して、各細胞およびサイトカインの時間-濃度曲線に最小二乗近似を実行します。フィット関数は、以下で説明する式に従うシグモイド曲線です(R2<0.95のフィットは次の手順から除外されます)。
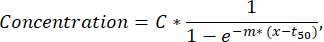
ここで、Cは濃度プラトー[nM]、t50 は半値[s]のシフト、mはヒルスロープ[min-1]に対応します。これらのパラメータから、以下で説明するように、次のカーブ記述子が抽出されます。- Cmax [nM]:最大測定濃度。
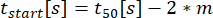 :分泌開始の時間、フィット感はCの10%に達する。
:分泌開始の時間、フィット感はCの10%に達する。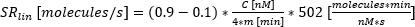 :時間-濃度曲線の10%から90%の間の曲線の近似線形傾きとしての分泌率。
:時間-濃度曲線の10%から90%の間の曲線の近似線形傾きとしての分泌率。
代表的な結果
提示された機能的なシングルセルプラットフォームにより、いくつかのパラメータの測定が可能になりました。まず、標準的な手法と同様に、細胞を分泌する頻度を測定の最後に示します(図4A)。1 μg/mLのリポ多糖(LPS)を6時間の末梢血単核細胞(PBMC)で刺激した後、細胞の5.81%がIL-6(n = 1270)、4.55%TNFα(n = 995)、および6.06%IL-1β(n = 1326)を分泌しました。
サイトカイン分泌を定量するために、既知の濃度の組換えサイトカインを用いて検量線を作成しました(図 4B)。これらの検量線により、液滴内サイトカイン濃度を経時的に定量することができます。例示的に、LPS刺激PBMCでは、平均液滴内IL-6濃度は90分後にプラトーに達しましたが、平均液滴内IL-1βは90分からより急速に増加し、プラットフォームの動的分解能と特定のサイトカインを分泌する細胞亜集団を抽出する可能性を示しました(図4C)。測定ポイント間で濃度が変化するため、サイトカインあたりの動的分泌速度を計算できます。各サイトカインの平均分泌速度(図4D)を考慮すると、IL-6分泌細胞は平均分泌速度の一定の減少を示し、一方、TNFαおよびIL-1β分泌細胞はいずれも90分測定時間後に分泌速度の増加を示し、150分後には2回目の減少を示しました。
さらに、分泌されたサイトカインと共分泌されたサイトカインに応じて、細胞を亜集団にクラスター化することが可能です(図4E)。ここで、IL-6とTNFαは、IL-6またはTNFαを分泌する細胞の30.2%と26.4%が単分泌しているのに対し、単一分泌IL-1β細胞は全IL-1β分泌細胞の68.8%を占めています。さらに、分泌濃度および分泌速度に対する共分泌の影響を解決できる(図4F)。IL-6を分泌する細胞を見ると、細胞がTNFαまたはIL-1βを追加で産生した場合、異なる量のIL-6が分泌されました。同様に、測定値に対する平均分泌速度の分布は、IL-6のみを分泌する細胞とIL-6のみを分泌する細胞と、TNFα(高い分泌速度)とIL-1β(低いIL-6分泌速度)と並んで統計的に異なっていました。
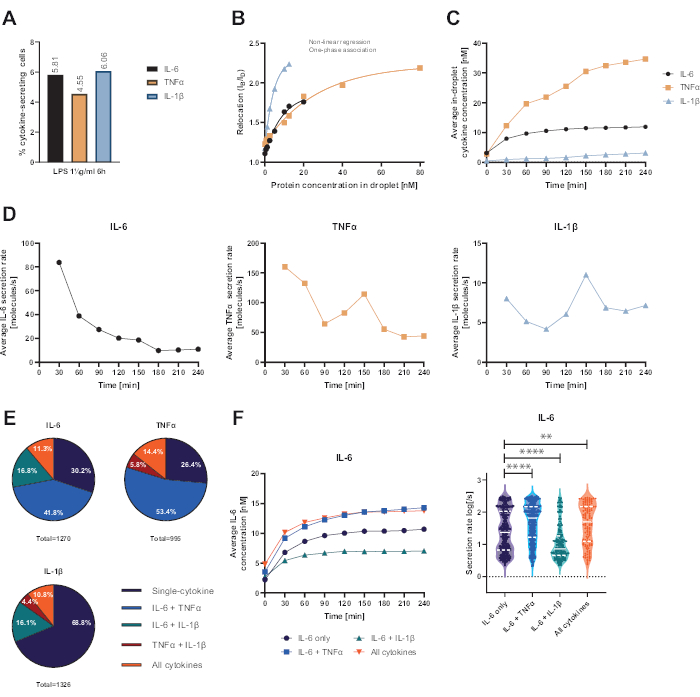
図4:1μg/mL LPSによる6時間刺激後のPBMCを分泌するIL-6、TNFα、IL-1βの代表的な結果 (A)4時間測定終了時のIL-6、TNFα、IL-1βを分泌するPBMCの割合。(B)マルチプレックスサイトカイン検量線は、既知の濃度の組換えサイトカインで生成されます。これにより、リロケーション値から液滴内のサイトカイン濃度を計算することにより、細胞実験を定量化することができます。ポイントは、非線形一相関連曲線フィット、r2 = 0.9926 (IL-6)、0.9901 (TNFα)、0.9990 (IL-1β) を使用してフィットしました。(C)4時間測定時間にわたってPBMCを分泌することにより放出されるIL-6、TNFα、およびIL-1βの平均分泌濃度。(D)4時間測定時間におけるIL-6、TNFα、IL-1βの平均分泌速度。(E)IL−6、TNFαまたはIL−1βおよびそれらの組み合わせを分泌する共分泌細胞の相対的割合。各サイトカインで検出されたすべての分泌細胞に正規化されます。(F)共分泌分解能(IL-6のみのn=383、IL-6 + TNFαのn=531、IL-6 + IL-1βのn=213、IL-6+TNFα+IL-1βのn=213)の測定時間および平均分泌速度(log)分布にわたるIL-6濃度の平均。分泌速度分布の統計的な差は、95%の信頼度で両側、不対応、ノンパラメトリックKolmogorov-Smirnov検定を使用して評価され、p値が表されます。** (p <0.002) および **** (p <0.0001)。完全な線は中央値を表し、点線は四分位数を表します。n合計セル = 21 866。 この図の拡大版を表示するには、ここをクリックしてください。
シングルセルレベルでの追加情報を抽出するために、各細胞およびサイトカインの濃度-時間点にS状結腸機能を適合させることができます(図5)。1つの細胞と対応するシグモイド近似の経時的な濃度データセットの例示を図 5Aに示します。ここで、最小二乗フィッティング手順では、曲線の上部プラトー値に対応するC、ゼロからの曲線の時間的シフトを定量化するt50 、測定全体で10%と90%の濃度値に達したシグモイド曲線の上昇部分の急勾配を表すヒルスロープmのパラメータが得られます。これらのフィットパラメータから、手順7.12で説明したように、一部の曲線記述子を抽出できます。Cmax、データの最高濃度値、t開始、上部プラトー濃度値の10%に達すると定義される分泌開始時間、およびSRlin、曲線の上昇部分の間の分泌率。
細胞亜集団を分類するために、すべてのシングルセルフィットから得られた曲線記述子をそれぞれ3つのカテゴリーに分類しました:Cの最大値は、t開始から初期、中、および遅いSRリンへの低、中、および高にグループ化されました。この分類を説明するために、4つの例示的なシングルセル分泌曲線およびそれらに対応する曲線記述子が示され(図5A−D)、ここで、曲線Aは中速の早期低分泌因子の特性を示し、曲線Bは早期、低速、および高分泌物、曲線Cは早期の高速高分泌物、および曲線Dは後期低分泌物を示す。これらの基準のカットオフは、細胞、サイトカイン、およびアッセイのパラメータ固有であり、各研究課題に適合させる必要があることに注意することが重要です。さらに、ここでは、1 μg/mL LPS刺激後のPBMCのIL-6分泌のみが考慮されており、ほとんどの細胞がそれぞれ80%と79%の早期分泌物質と高分泌物質であったことを意味します(図5E-F)。分泌率に関しては、IL-6分泌細胞の55%が遅い分泌細胞であり、39%が速い分泌細胞であるという双極応答が観察されました(図5G)。
分泌挙動をさらに特徴付けるために、各細胞の曲線記述子を互いにプロットし、異なるクラスターを抽出しました(図5H-J)。t開始とCmaxとの間に明確な相関関係は与えられていない(図5H):最大の2つの集団は、分泌開始とは無関係に初期の低分泌者と高分泌者であった。tstartとSRlin(図5I)の関係を考慮すると、ほとんどの細胞は初期の遅い分泌物であり、初期の高分泌物の明確な集団と、遅い/中程度から遅い分泌物はほとんどありませんでした。SRlin と Cmax の相関関係に関しては、高速低分泌分泌物から中分泌分泌物はほとんど存在せず、高速低分泌分泌物の集団が多かっただけです。さらに、最大測定濃度に依存しない高速分泌物の大規模な集団と、低速または高速分泌の2つの高分泌物集団がありました。要約すると、個々の細胞の曲線記述子間の関係を調査すると、はるかに詳細な分析が得られ、単一細胞分泌測定から新しい生物学的知見を抽出できる可能性があると結論付けることができます。
上記で紹介した解析により、共分泌細胞の分泌動態を抽出しました(図6)。2つの例の曲線は、両方のサイトカインが同時に開始する(図6A)か、またはIL-6が最初に分泌される(図6B)逐次分泌開始を持つ2つの単一細胞からのIL-6およびTNFαの共分泌の異なるダイナミクスを示しています。すべての共分泌細胞を分類するために、60分の分泌遅延が定義され、この範囲内で分泌を開始するすべての細胞は同時分泌因子と見なされ、遅延が長いすべての細胞は逐次分泌因子と見なされます。この分析により、どのサイトカインが最初に分泌されたかを観察することも可能になりました。IL-6とTNFαでは、主に同時共分泌が細胞の76%で観察され(図6C)、IL-6とIL-1βでは、細胞の86%で連続的な共分泌が観察され、IL-6はほとんどの場合最初に分泌されるサイトカインでした(図6D)。
すべての個々の共分泌細胞の異なるサイトカインの分泌開始時間を見ると、実施された実験では分泌開始時間の間に明確な相関関係は観察されませんでした。IL-6とTNFαの共分泌(図6E)では、0分前後のより大きな垂直クラスターが存在し、これはIL-6から始まる共分泌細胞に対応していました。IL-6とIL-1βの共分泌(図6F)では、ほとんどの細胞が測定開始前後にIL-6を分泌し始め、IL-1βは主に後で分泌されました。要約すると、ここで紹介した解析により、異なる分泌因子亜集団と複雑なサイトカイン共分泌動態の同定が可能になりました。
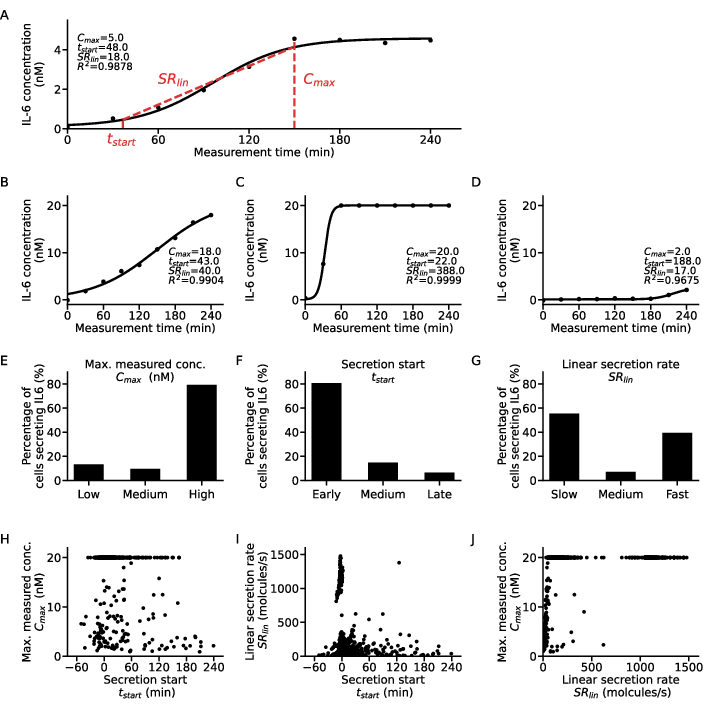
図5:単一のIL-6分泌細胞曲線のさまざまな分泌動的パターンの詳細な分析(A)適合したS状結腸曲線と抽出されたパラメータを使用した測定時間にわたる代表的な単一細胞サイトカイン濃度データ。(B-D)LPS刺激後のIL−6分泌について見出される異なるサイトカイン分泌型についての3つの例示的な単一細胞サイトカイン濃度曲線。(E-G)IL-6分泌細胞の割合は、以下の基準で異なる分泌型に分類される:E.C最大:低<5nM、高>19.5nM、F.t開始:早<30分、遅>120分、G.SRリン:遅い<250分子/秒、速い>750分子/秒)(H-J)3つの分泌曲線記述子間の関係Cmax、 t開始と SRlin は個々のセルごとに (n=633)。Cmax=20nMの大きな集団は、アッセイの検出上限に達した結果です。この図の拡大版を表示するには、ここをクリックしてください。
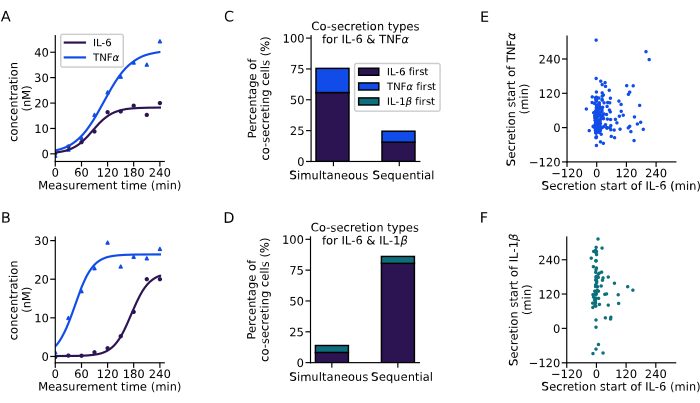
図6:単一細胞濃度曲線からの共分泌パターンの抽出 (A-B) IL-6およびTNFαをそれぞれ同時に、(B)連続して共分泌する単一細胞の代表的な濃度曲線。(C-D)IL-6とTNFα(n = 249)、またはIL-6とIL-1β(n = 72)の同時および連続的な共分泌を示す細胞の割合。逐次分泌は、サイトカイン分泌開始間の遅延が60分を超えることで定義されます。色は、どのサイトカインが最初に分泌を開始したかを示します。(E-F)各分泌細胞の異なるサイトカインの分泌開始時間との関係(nIL6-TNFα=249、nIL6-IL1β=72)。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
サイトカインの放出と分泌は、免疫学や臨床医学で頻繁に研究されています3。サイトカイン分泌の不均衡は、感染症に苦しむ患者だけでなく、神経疾患、炎症、または癌にも有害な影響を与える可能性があります26,27,28。サイトカインが健康や疾患において重要であるにもかかわらず、現在の方法論では、単一細胞に由来するサイトカインを時間分解的に正確に検出および定量することができないため、サイトカインとその分泌細胞の研究は依然として困難です。ここで紹介するワークフローでは、PBMCによる確立された刺激プロトコルを使用し、IL-6、TNF-α、およびIL-1βの分泌を測定しました。個々の精製された亜集団の代わりにPBMCを使用するという選択は、IL-6、TNF-α、IL-1β29などの炎症誘発性サイトカインの血漿濃度が高いことを特徴とする状態であるサイトカイン放出症候群(CRS)23を調査するための以前のアプリケーションから生じました。CRSは通常、1つの集団だけに関連しているわけではないため、PBMCはin vivoに存在するため、PBMCを使用しました。しかし、科学的な問題がこのステップを必要とする場合、細胞の亜集団を個別に精製して評価することができます。インキュベーション時間、刺激条件、および動的アッセイ範囲は、目的の3つのサイトカインの分泌を測定するために最適化されました。ここで紹介するワークフローとデータは、複数のサイトカインの時間分解シングルセル分泌を設定、キャリブレーション、定量、測定、および解析する方法を示しています。このプロトコールは、サイトカイン分泌の多機能解析により、患者に分泌されるサイトカインの大きな機能的および動的多様性をどのように可能にするかについての青写真を提供します。
記載されているアッセイプロトコルのいくつかの重要な側面により、独自の生物学的読み出しが可能になります。まず、マイクロ流体液滴にシングルセルをカプセル化することで、個々の細胞のデータを抽出することができました。複数の細胞カプセル化のイベントを検出し、研究課題に応じて画像解析によって分類または分類することができます。第二に、いくつかの独立した液滴内蛍光免疫測定法を組み込み、官能基化されたナノ粒子を整列させることで、最大3つのサイトカイン濃度を並行して定量的に測定することが可能になりました。このマルチプレックス化により、単一細胞レベルでのサイトカイン共分泌パターンの解析が可能になりました。第三に、液滴の固定化により、各分泌細胞のサイトカイン分泌の時間的な測定と相関が可能になり、同時分泌と逐次分泌を区別することができました。時間分解能は、さまざまな分泌型タイプの分泌パターンと亜集団に関するデータを独自に提供しました。最後に、並列化された画像解析により、20,000を超える個々の細胞を使用した測定値から大量のデータを効率的に抽出および追跡することが可能になりました。単一分泌曲線からの抽出により、表現型の亜集団および機能の発見がさらに可能になった。
そのユニークな読み出しに加えて、このアッセイには標準的なサイトカイン分析よりも技術的な利点があります。カプセル化コンパートメントのサイズが約60 pLと小さいため、分泌されたサイトカインの絶対量を生物学的ソースから直接検出でき、検出限界は細胞分泌に適合します。また、アッセイの小型化では、高価なバイオ試薬を少量使用します。さらに、このセットアップには特殊な機器がほとんど必要なく、多くの場合、生物学や生物工学の研究室ですでに利用可能です。蛍光顕微鏡は広く利用可能であり、シリンジポンプはバイオエンジニアリング研究所で頻繁に使用されるか、比較的低コストで購入できます。細胞培養が存在する場合、実験の実行に必要な全装置の費用は約148,000ユーロで、その大部分は全自動落射蛍光顕微鏡(130,000ユーロ)によるものです。ただし、このような機器は生物学研究所でよく見られ、残りの費用はシリンジポンプ(13,000ユーロですが、より安価な代替品が利用可能です)とより小さな機器に分配されます。液滴チップと観察チャンバーの製造は非常によく説明されており17 、ほとんどのバイオエンジニアリングラボに存在するオーブンやプラズマクリーナーなどの必要なインフラストラクチャを備えたクリーンルーム環境の外で実行できます。あるいは、関心のあるラボに液滴発生器チップを供給するために、さまざまなサプライヤーが利用可能です。必要な量が小さいため、アッセイは費用対効果が高く、セットアップも簡単です。
最高度の再現性を確保するために、プロトコルの成功のためのいくつかの重要なステップを特定しました。初めてのユーザーにとって一般的な問題は、測定中の液滴の動きです。解析ソフトウェアは個々の液滴をある程度追跡できますが、過度の動きは単一細胞の分解能の低下と不正確な結果につながります。動きは、適切な気密測定チャンバーを使用し、液滴サイズとチャンバーサイズを修正し、測定を開始する前に短い平衡化期間を設け、界面活性剤を適切な濃度にすることで回避できます。もう1つの重要なステップは、測定を開始する前に正確なピントを合わせることです。焦点が適切でないと、蛍光再配置値が大幅に低下し、分泌されるサイトカインの量が過小評価されます。最後に、手元にある問題とプロトコルにもよりますが、再現性のためには、異なるステップ間の正しいタイミングが最も重要です。特に、チャンバーへの充填から測定開始までの待ち時間は一定である必要があり、そうしないと、分泌されたサイトカインの測定ウィンドウを逃す可能性があります。
提示された技術の限界には、カプセル化後に細胞をさらに操作する能力が制限されることが含まれる。したがって、現在、覚醒剤、抗体、または追加の試薬を追加または除去することはできません。さらに、細胞は単離されたバイオリアクターにカプセル化されているため、測定中に細胞間の相互作用(接触ベースまたはパラクリンシグナル伝達)は起こりません。この制限は、事前にバルクインキュベーションを行うことで部分的に克服できます。さらに、分泌されたサイトカインによる自己分泌効果の増強も可能であり、抗体が検出した分泌サイトカインのみが測定されるため、これらの影響を確実に定量化または排除することはできません。したがって、サイトカイン分泌に関する孤立した見解は、常に対応する問題とアプリケーションの文脈で説明する必要があります。ただし、この制限は、カプセル化された倍数、ダブレット、および関心のある場合は 3 倍子の詳細な研究にも使用できます。これは、細胞間接触やパラクリンベースの問題を調査するのに役立つ興味深い設定を提供します。最後に、アッセイのダイナミックレンジも限られており、特定のアプリケーションに適応する必要があります。ここでは、アッセイのダイナミックレンジを、測定されたサイトカインの予想される分泌量に適合させました。
アッセイの能力と適用性をさらに向上させるために、将来的には、生物学的、技術的、およびデータ分析の面でいくつかの開発に取り組むことができます。生物学的な側面では、アッセイを適応させることにより、追加のサイトカイン、他の分泌タンパク質、代謝マーカーまたは細胞表面マーカーの測定を統合できます。さらに、このアッセイは、他の細胞ベースのアッセイと並行してワークフローに統合し、リードアウトの幅を広げることができます(例:フローサイトメトリー染色やシーケンシング)。さらに、液滴の生成と観察のための統合マイクロ流体チップを作成するなど、アッセイの使いやすさを簡素化できるため、臨床現場のバイオエンジニアリング研究室の外部でより広範なアプリケーションを実現できる可能性があります。データ解析に関しては、自動化を強化し、機械学習アプローチを使用して、蛍光標識なしで各液滴中の細胞とビーズラインの存在と位置を検出することにより、画像からの情報の抽出と追跡を拡張することができます。そうすることで、イムノアッセイに使用できる追加の蛍光チャンネルが開き、さらに多くのサイトカインを並行して測定できるようになります。
提示されたアッセイおよび関連するプロトコルおよび分析は、サイトカイン分泌ダイナミクスに関連する多様な潜在的なユースケースに適用できます。具体的には、このアッセイは、細胞タイプおよび活性化特異的なサイトカイン分泌プロファイルの同定、サイトカイン分泌細胞の多機能性、サイトカインバランスの時間性および維持メカニズムなどの基本的な免疫学的問題に対処できる可能性があります。さらに、臨床応用では、このプラットフォームは、COVID-19で観察されたように、活動的または慢性的な炎症反応中のサイトカインの役割を解明することを可能にしたり、自己炎症31などのユニークなシグネチャに基づいて患者を層別化し、治療を個別化するためのツールを提供する可能性があります。結論として、単一細胞からのサイトカイン分泌の定量的な時間分解評価は、特定の薬物、感染、遺伝子改変、またはex vivo刺激が特定の応答をどのように誘導するかを解明するため、非常に必要な方法です。
開示事項
細胞のビーズライン測定などの特定の側面が特許を取得しています。
謝辞
このプロジェクトは、ETHドメイン(スイス連邦工科大学)の戦略的重点領域個別化健康および関連技術(PHRT)の助成金#2021-349、欧州研究会議の開始助成金(助成金#803,336)、およびスイス国立科学財団(助成金#310030_197619)の支援を受けました。さらに、最初のDropMapアナライザーの開発と開発を行ったGuilhem Chenon氏とJean Baudry氏に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 008-FluoroSurfactant | RAN Biotechnologies | 008-FluoroSurfactant-10G | |
| 2-Stream flow-focusing droplet maker, 30 µm nozzle, PFOS hydrophobic surface treatment | Wunderli chips | ||
| Alexa Fluor 647 NHS Ester | ThermoFisher | A20006 | https://www.thermofisher.com/ch/en/home/references/protocols/cell-and-tissue-analysis/labeling-chemistry-protocols/fluorescent-amine-reactive-alexa-fluor-dye-labeling-of-igm-antibodies.html |
| Anti-Human IL-1β (Monoclonal Mouse), AF647 labelled in-house | PeproTech | 500-M01B | |
| ARcare92524 double-sided adhesive tape | Adhesvies Reasearch | ARcare92524 | |
| Bio-Adembeads Streptavidin plus 300nm | Ademtech | Cat#03233 | |
| Biotinylated Goat Anti-Human IL-1β | PeproTech | 500-P21BGBT | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A3059 | |
| Cell Scraper | TPP | 99002 | |
| CellTrace Violet Cell Proliferation Kit | Invitrogen | C34557 | Cell staining solution |
| Chromafil Xtra PTFE-45/25 syringe filters | Macherey-Nagel | 729205 | |
| Costar 6-well Clear Flat Bottom Ultra-Low Attachment | Corning | 3471 | |
| Countess Cell Counting Chamber Slides | Invitrogen | C10283 | |
| D-Biotin | Fluorochem | M02926 | |
| DPBS, no calcium, no magnesium | Gibco | 14196-094 | |
| epT.I.P.S. Standard 2-200 µl | Eppendorf | 30000889 | |
| Ethylenediaminetetraacetic acid disodium salt solution | Sigma-Aldrich | 3690 | |
| EZ-LINK-NHS-PEG4-Biotin | ThermoFisher | A39259 | https://www.thermofisher.com/order/catalog/product/20217 |
| FcR Blocking Reagent, human | Miltenyi Biotec | 130-059-901 | |
| Fetal Bovine Serum | Gibco | 10270-106 | |
| Handy dish soap | Migros | 5.01002E+11 | |
| HEPES (1 M) | Gibco | 15630-080 | |
| HFE-7500 Oil 3M TM Novec | Fluorochem | B40045191 | |
| Idex F-120 Fingertight One-Piece Fitting, Standard Knurl, Natural PEEK, 1/16" OD Tubing, 10-32 Coned | Cole-Parmer | GZ-02014-15 | |
| IL-6 Monoclonal Antibody (MQ2-13A5 - Rat), FITC | ThermoFisher | 11-7069-81 | |
| IL-6 Monoclonal Antibody (MQ2-39C3), Biotin | ThermoFisher | 13-7068-85 | |
| KnockOut Serum Replacement | ThermoFisher | 10828-010 | |
| Loctite AA 3491 curable UV glue | Henkel AG & Co | 3491 | |
| Microscope slides (76x26x1mm, clear white) | Menzel Gläser | ||
| Mineral oil light | Sigma-Aldrich | 330779 | |
| NanoPort Assembly Headless, 10-32 Coned, for 1/16" OD | Idex | N-333 | |
| Neodymium block magnet | K&J Magnetics | BZX082 | |
| Omnifix-F Spritze, 1 ml, LS | Braun | 9161406V | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140-122 | |
| Phosphate buffered saline | Sigma-Aldrich | P4417 | |
| Pluronic F-127, 0.2 µm filtered (10% Solution in Water) | ThermoFisher | P6866 | |
| Precision wipes | Kimtech Science | 5511 | |
| PTFE microtubing 0.30 × 0.76 mm | FisherScientific | 1191-9445 | |
| PTFE microtubing 0.56 × 1.07 mm | FisherScientific | 1192-9445 | |
| Recombinant Human IL-1β | Peprotech | Cat#200-01B | |
| Recombinant Human IL-6 | Peprotech | Cat#200-06 | |
| Recombinant human serum albumine (HSA) | Sigma-Aldrich | A9731 | |
| Recombinant Human TNF-α | Peprotech | Cat#300-01A | |
| Reusable biopsy punch diameter 0.75 mm and 6 mm | Stiefel | 504529 and 504532 | |
| RPMI 1640 Medium, no phenol red | Gibco | 11835-030 | |
| Standard LPS, E. coli K12 | InvivoGen | tlrl-eklps | |
| Sterican needles 23 G for 0.56 mm diameter microtubing | FisherScientific | 15351547 | |
| Sterican needles 27 G for 0.30mm diameter microtubing | FisherScientific | 15341557 | |
| TNF alpha Monoclonal Antibody (MAb11), PE | ThermoFisher | 12-7349-81 | |
| TNF-alpha Monoclonal Antibody (MAb1), biotinylated in-house | ThermoFisher | 14-7348-85 | |
| Trypan Blue Stain (0.4%) for use with the Countess Automated Cell Counter | Invitrogen | T10282 | |
| Vacuum Filtration "rapid"-Filtermax | TPP | 99500 | |
| Devices | |||
| Cameo 4 automatic cutting machine | Silhouette | ||
| Cetoni Base 120 + 3x NEMESYS Low Pressure Syringe Pumps | Cetoni | NEM-B101-03 A | |
| Countess II Automated Cell Counter | ThermoFisher | ||
| Inverted Epi-fluorescence microscope Ti2 | Nikon | ECLIPSE Ti2-E, Ti2-E/B*1 | |
| OKO Lab Cage Incubator, dark panels | OKO Lab | ||
| ORCA-Fusion Digital CMOS camera | Hammatsu | C14440 | |
| SOLA Light Engine | Lumencor | sola 80-10247 |
参考文献
- Chen, L., et al. Inflammatory responses and inflammation-associated diseases in organs. Oncotarget. 9 (6), 7204-7218 (2017).
- Cicchese, J. M., et al. Dynamic balance of pro- and anti-inflammatory signals controls disease and limits pathology. Immunol Rev. 285 (1), 147-167 (2018).
- Liu, C., et al. Cytokines: From clinical significance to quantification. Adv Sci. 8 (15), e2004433 (2021).
- Rojas, J. M., Avia, M., Martín, V., Sevilla, N. IL-10: A multifunctional cytokine in viral infections. J Immunol Res. 2017, 6104054 (2017).
- Kohanawa, Y. M. A regulatory effect of the balance between TNF-α and IL-6 in the granulomatous and inflammatory response to Rhodococcus aurantiacus infection in mice. J Immunol. 177 (1), 642-650 (2006).
- Geginat, J., et al. Plasticity of human CD4 T cell subsets. Front Immunol. 5, 630 (2014).
- Sallusto, F. Heterogeneity of human CD4+ T cells against microbes. Ann Rev Immunol. 34 (1), 317-334 (2016).
- Chetaille Nézondet, A. L., Poubelle, P. E., Pelletier, M. The evaluation of cytokines to help establish diagnosis and guide treatment of autoinflammatory and autoimmune diseases. J Leukocyte Biol. 108 (2), 647-657 (2020).
- Sims, J. T., et al. Characterization of the cytokine storm reflects hyperinflammatory endothelial dysfunction in COVID-19. J Allergy Clin Immunol. 147 (1), 107-111 (2021).
- Yasen, A., et al. Single-cell RNA sequencing reveals the heterogeneity of infiltrating immune cell profiles in the hepatic cystic echinococcosis microenvironment. Infection and Immunity. 89 (12), (2021).
- Jiang, Y., et al. Single-cell RNA sequencing highlights intratumor heterogeneity and intercellular network featured in adamantinomatous craniopharyngioma. Sci Adv. 9 (15), (2023).
- Tanguay, S., Killion, J. J. Direct comparison of ELISPOT and ELISA-based assays for detection of individual cytokine-secreting cells. Lymphokine Cytokine Res. 13 (4), 259-263 (1994).
- Bucheli, O. T. M., Sigvaldadóttir, I., Eyer, K. Measuring single-cell protein secretion in immunology: Technologies, advances, and applications. Eur J Immunol. 51 (6), 1334-1347 (2021).
- Brower, K. K., et al. Double emulsion flow cytometry with high-throughput single droplet isolation and nucleic acid recovery. Lab Chip. 20 (12), 2062-2074 (2020).
- Brower, K. K., et al. Double emulsion picoreactors for high-throughput single-cell encapsulation and phenotyping via FACS. Anal Chem. 92 (19), 13262-13270 (2020).
- Luo, X., Chen, J. Y., Ataei, M., Lee, A. Microfluidic compartmentalization platforms for single cell analysis. Biosensors. 12 (2), 58 (2022).
- Bounab, Y., et al. Dynamic single-cell phenotyping of immune cells using the microfluidic platform DropMap. Nat Protoc. 15 (9), 2920-2955 (2020).
- Eyer, K., et al. Single-cell deep phenotyping of IgG-secreting cells for high-resolution immune monitoring. Nat Biotechnol. 35 (10), 977-982 (2017).
- Gaa, R., et al. Versatile and rapid microfluidics-assisted antibody discovery. mAbs. 13 (1), 198130 (2021).
- Gerard, A., et al. High-throughput single-cell activity-based screening and sequencing of antibodies using droplet microfluidics. Nat Biotechnol. 38 (6), 715-721 (2020).
- De Jonghe, J., et al. spinDrop: a droplet microfluidic platform to maximise single-cell sequencing information content. Nat Comm. 14 (1), 4788 (2023).
- Wheeler, M. A., et al. Droplet-based forward genetic screening of astrocyte-microglia cross-talk. Science. 379 (6636), 1023-1030 (2023).
- Portmann, K., Linder, A., Oelgarth, N., Eyer, K. Single-cell deep phenotyping of cytokine release unmasks stimulation-specific biological signatures and distinct secretion dynamics. Cell Rep Meth. 3 (7), 100502 (2023).
- Portmann, K., Linder, A., Eyer, K. Stimulation-induced cytokine polyfunctionality as a dynamic concept. eLife. 12, 89781 (2023).
- Armbruster, D. A., Pry, T. Limit of blank, limit of detection and limit of quantitation. Clin Biochem Rev. 29, S49-S52 (2008).
- Yang, J., et al. New insight into neurological degeneration: Inflammatory cytokines and blood-brain barrier. Front Mol Neurosci. 15, 1013933 (2022).
- Kim, P. S., Ahmed, R. Features of responding T cells in cancer and chronic infection. Curr Opin Immunol. 22 (2), 223-230 (2010).
- Becher, B., Spath, S., Goverman, J. Cytokine networks in neuroinflammation. Nat Rev Immunol. 17 (1), 49-59 (2017).
- Cosenza, M., Sacchi, S., Pozzi, S. Cytokine release syndrome associated with T-cell-based therapies for hematological malignancies: Pathophysiology, clinical presentation, and treatment. Int J Mol Sci. 22 (14), 7652 (2021).
- Hu, B., Huang, S., Yin, L. The cytokine storm and COVID-19. J Med Virol. 93 (1), 250-256 (2021).
- Marcuzzi, A., et al. Autoinflammatory diseases and cytokine storms-Imbalances of innate and adaptative immunity. Int J Mol Sci. 22 (20), 11241 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved