Method Article
薬剤耐性てんかん小児の術前評価における電磁源イメージング
要約
脳磁図法(MEG)と高密度脳波法(HD-EEG)が同時に記録されることはめったにありませんが、確認的で補完的な情報が得られます。ここでは、MEGとHD-EEGを同時に記録するための実験設定と、薬剤耐性てんかんの小児のてんかん原性および雄弁な脳領域の局在化を目指したこれらのデータの解析方法を紹介します。
要約
薬剤耐性てんかん(DRE)の小児の場合、てんかんの発症領域(EZ)の描写と切除(またはアブレーション/切断)が、雄弁な脳領域を温存することで、発作がなくなるかどうかが重要です。したがって、EZのローカリゼーションに臨床的に有用な情報を提供する、信頼性が高く非侵襲的なローカリゼーション法の開発は、成功した手術結果を達成するために重要です。電気および磁気源イメージング (ESI および MSI) は、これらの患者の術前評価でますます利用されており、てんかん原性および雄弁な脳領域の描写において有望な所見を示しています。さらに、ESIとMSIを1つのソリューション、つまり電磁源イメージング(EMSI)に組み合わせて、高密度脳波記録(HD-EEG)と脳磁図(MEG)の同時記録で実行すると、どちらのモダリティも単独で行うよりも高いソースローカリゼーション精度が示されています。これらの有望な知見にもかかわらず、このような技術は少数の三次てんかんセンターでしか実施されておらず、同時に記録されることはめったになく、小児コホートでは十分に活用されていません。この研究は、MEGとHD-EEGの同時データを記録するための実験設定と、DREの子供の刺激性ゾーン、発作発症ゾーン、および雄弁な脳領域を特定することを目的としたこれらのデータを分析するための方法論的フレームワークを示しています。具体的には、(i)睡眠中の発作間欠性および発作性てんかん様活動の記録と位置特定、および(ii)視覚、運動、聴覚、および体性感覚誘発反応の記録、および視覚運動課題中の関連する雄弁な脳領域(すなわち、視覚、運動、聴覚、および体性感覚)のマッピング、および聴覚および体性感覚刺激のための実験セットアップが提示されます。データ解析パイプラインの詳細な手順については、等価電流ダイポール(ECD)と動的統計パラメトリックマッピング(dSPM)を使用して、EMSIだけでなく、個々のESIおよびMSIも実行するための詳細な手順がさらに示されています。
概要
てんかんは、最も一般的で障害のある神経障害の1つであり、本質的に限局性または全身性の発作を特徴とする再発性および誘発性発作を特徴としています。いくつかの効果的な薬理学的療法(抗てんかん薬[ASM]など)が利用可能であるにもかかわらず、これらの患者の約20〜30%は発作を制御できず、薬剤耐性てんかん(DRE)に苦しんでいます1。これらの患者にとって、てんかん手術は発作を排除するための最も効果的な治療法です。手術の成功は、てんかんの原因となる領域(EZ)を完全切除(またはアブレーション/切断)することで達成でき、これは発作の発生に不可欠な最小領域と定義されています2。雄弁な皮質を維持しながらEZの正確な描写と切除(またはアブレーション/切断)は、発作の自由を確保するための重要な要素です。外科的候補者を確立するために、いくつかの非侵襲的診断ツールが学際的なチームによって使用され、さまざまな皮質領域 (すなわち、刺激性ゾーン、発作発症ゾーン [SOZ]、機能欠損ゾーン、およびてんかん原性病変) を定義します。これらは、EZ3 の間接的な近似因子として機能します。頭蓋内EEG(iEEG)による術外モニタリングは、これらの方法のいずれもEZを明確に特定しない場合に必要です。iEEGの役割は、SOZ(つまり、臨床発作が発生する脳領域)を特定し、雄弁な脳領域をマッピングすることにより、EZを正確に定義することです。しかし、侵襲性4,5,6のために深刻な制限があり、空間的なカバレッジが限られており、明確な術前局在化仮説7が必要である。その結果、SOZの実際の焦点と範囲が見落とされ、手術が失敗する可能性があります。また、その解釈には、入院中の数日間の複数の常同的な臨床発作の記録が必要であり、これにより合併症(感染症や出血など)の可能性が高まります5。したがって、臨床的に有用な情報を提供し、DREの子供の術前評価を全体的に改善できる、信頼性が高く非侵襲的なローカリゼーション方法を開発するという満たされていないニーズがあります。
過去数十年にわたり、電気および磁気源イメージング(ESIおよびMSI)は、てんかん原性および機能的な脳領域の描写のためのDRE患者の術前評価にますます利用されてきました。特に、ESIとMSIは、高密度脳波(HD-EEG)や脳磁図(MEG)などの非侵襲的記録から神経源を再構築し、手術計画やiEEG電極の配置をガイドするのに役立ちます。ESIおよびMSIは、スパイクや鋭い波などの発作間欠性てんかん様放電(IED)、または発作性(発作性)活動のいずれかを局在化するために適用できます。さらに、感覚機能、運動機能、聴覚機能、および認知機能に関与するさまざまな機能的な脳領域の局在化にも使用できます。IEDや発作などの電気生理学的事象の再構築により、刺激性ゾーン(すなわち、IEDが発生する脳領域)とSOZをそれぞれ特定することができ、これらはEZ局在化の有効な代理と考えられている。雄弁な皮質(すなわち、定義された皮質機能に不可欠な脳領域)3の局在化は、計画された切除に対する雄弁な領域の位置と範囲をマッピングすることを可能にし、したがって、てんかん手術から予想される可能性のある潜在的な機能障害を事前に減らすことができる8,9,10,11 .いくつかの研究では、てんかんの術前評価におけるESIおよび/またはMSIの臨床的有用性を調査し、EZ12,13,14,15,16,17,18,19の描写において有望な結果を示しました。例えば、Mouthaan et al.14 は、11 の前向きおよび後ろ向きてんかん研究の非侵襲的データを使用して広範なメタアナリシスを実施し、これらのソースローカリゼーション技術により、高感度 (82%) と低特異性 (53%) で EZ を全体的に特定できることを報告しました。他の研究も、MSIとESIが、正常な磁気共鳴画像法(MRI)19,20,21を有するてんかん患者の切除領域内のてんかんの焦点を正しく局在化できることを示しました。これらのローカリゼーション結果は、臨床所見または画像所見が決定的でないためにてんかん手術に不適格な患者にとって特に重要です。要約すると、ESI と MSI は、DRE 患者のてんかん原性および機能的な脳領域の術前マッピングに大きく貢献できます。
これらの有望な知見にもかかわらず、このような技術は現在、定期的に実施されている三次てんかんセンターはごくわずかであり、小児集団では十分に活用されていないことが多い。さらに、HD-EEGとMEGが同時に記録されることはめったにありませんが、確認情報と補完情報の両方を提供します。MEGは、接線方向の表面的なソースを検出するために敏感ですが、脳の回またはより深い領域にある放射状に配向されたソースには盲目です22,23,24,25,26。さらに、MEGはEEG 16,22,25と比較して、より優れた空間分解能(ミリメートル)を提供します。EEG信号とは異なり、MEG信号は参照フリーであり、脳組織(すなわち、髄膜、脳脊髄液、頭蓋骨、および頭皮)の異なる伝導性によって本質的に影響を受けず、脳によって生成される磁場の歪みのない測定を提供する25,27。一方、EEGはすべての方向の発生源を検出できますが、MEGよりも空間分解能が低く、アーティファクトの影響を受けやすくなります26,28。源の向きと深さに対するこれらの相補的な感受性により、てんかん様活動の約30%(例:IED)はMEGにのみ記録でき、EEGには記録できず、その逆も同様です26,29,30,31,32。長時間の録画を可能にするEEGとは対照的に、MEGによる臨床発作のキャプチャは、ほとんどの患者の発作イベントを記録するには通常不十分な記録時間が限られているため、困難です。さらに、発作に関連する頭部の動きによって引き起こされるアーチファクトは、しばしばMEG録音の品質を妨げる可能性がある29,33,34,35。一方、MEG記録は、EEGと比較して、特に小児において、子供の頭部35にセンサーを取り付ける必要がないため、より速く、容易である。
ハードウェアの進歩により、MEGとHD-EEGのデータを同時に記録することが可能になり、頭全体を覆う多数のセンサー(550個以上)で記録できるようになりました。さらに、EEG技術の最新の発達により、HD-EEGの準備時間は15分未満に最小限に抑えられています36。これは、長時間じっとしていられない挑戦的な行動をとる小児集団にとって特に重要です。さらに、ソフトウェア技術の進歩により、ESIとMSIを1つのソリューション、つまりHD-EEGとMEGの同時記録に対して実行する電磁源イメージング(EMSI)にすることが可能になりました。いくつかの理論的および実証的研究は、EMSIによるソースローカリゼーションの精度が、いずれかのモダリティ単独よりも高いと報告しました13,30,31,37,38,39,40,41。さまざまなソースローカリゼーションアプローチを使用して、感覚刺激に応答した活動を再構築する、Sharonら。37は、EMSIがESIまたはMSI単独の場合よりも一貫して良好なローカリゼーション結果を示したことを発見しました。これは、正確なローカリゼーション精度の非侵襲的ベンチマークとして機能する機能的MRI(fMRI)と比較してです。著者らは、この改善された局在化は、逆解を解くためのセンサーの数の増加と、2つのイメージングモダリティの異なる感度パターンによるものであると示唆した37。同様に、Yoshinaga et al.図31は、難治性局在化関連てんかん患者のEEGとMEGの同時データに対して双極子解析を行い、EMSIが1つのモダリティだけでは得られない情報を提供し、解析された患者の1人におけるてんかん手術の成功につながったことを示した。前向き盲検研究では、Duezら。図13は、EMSIがESIおよびMSIと比較して有意に高いオッズ比(すなわち、発作がなくなる確率)を達成したこと、局在化精度≥52%、および刺激性およびSOZとの一致がそれぞれ≥53%および≥36%であることを示した。私たちのグループ42 によるより最近の研究では、EMSI は ESI または MSI 単独よりも優れたローカリゼーション推定と優れた結果予測パフォーマンスを提供し、切除によるローカリゼーション エラーと SOZ はそれぞれ ~8 mm と ~15 mm であることが示されています。これらの有望な発見にもかかわらず、DREの子供のEMSIに関する方法論的枠組みを提供する研究が不足しています。
この研究は、MEGとHD-EEGの同時記録を実行するための実験設定と、DREの子供の刺激性ゾーン、SOZ、および雄弁な脳領域を特定することを目的としたこれらのデータを分析するための方法論的フレームワークを示しています。具体的には、(i)睡眠中の発作間欠性および発作性てんかん様活動の記録と位置特定、および(ii)視覚、運動、聴覚、および体性感覚誘発反応の記録、および視覚運動課題中の関連する雄弁な脳領域(すなわち、視覚、運動、聴覚、体性感覚)のマッピング、および聴覚および体性感覚刺激のための実験セットアップが提示されます。データ解析パイプラインの詳細な手順については、等価電流ダイポール(ECD)と動的統計パラメトリックマッピング(dSPM)を使用して、EMSIだけでなく、個々のESIおよびMSIも実行するための詳細な手順がさらに示されています。
プロトコル
ここで適用された実験的手順は、North Texas Regional Institutional Review Board(2019-166;研究代表者:Christos Papadelis)。次のセクションでは、IEDの非侵襲的な発生源局在化、発作発症、およびイベント誘発応答(すなわち、視覚、運動、聴覚、体性感覚)の実験プロトコルについて、当研究室で追跡しているMEGとHD-EEGの同時記録を使用して説明します。International Federation of Clinical Neurophysiology43 と American Clinical MEG Society44 は、自発的な MEG および EEG データの日常的な臨床記録と分析のための「最低基準」を提供してきました。ここで説明するHD-EEG記録の手順は、スポンジベースのEEG電極システムにのみ適用されます。各被験者の全体的な準備プロセスは約2〜3時間で、実際の記録は~1.5時間で構成されます。
1. MEGシステムの準備
- 被験者が到着する前に、数分間の空の部屋でのMEG録音を実行して、バックグラウンドノイズレベルと磁気アーティファクトをキャプチャし、すべてのMEGセンサーが適切に機能していることを確認します。
- MEGセンサーチューニングプログラムを使用して、すべてのMEGセンサーの平均ホワイトノイズ値が2〜5 fT/√Hz(グラディオメーターの場合はfT/cm√Hz)であることを確認します。
2. 被験者の準備
- 被験者が環境に快適であることを確認してください。幼児の場合は、記録室(磁気シールド室[MSR]を含む)を探索し、データ集録に使用される試験装置を確認できるようにします。
- スクリーニング同意書を使用して、被験者の指示をスクリーニングし、提供します。必要に応じて、各年齢層向けに開発された特別な単語、おもちゃ、ゲームを使用して、幼児に手順を説明します。被験者 (または被験者の両親) に、訪問前の過去 ~ 2 時間以内に発作を起こしたかどうかを尋ねてください。
注: スクリーニング同意書には、テストの説明、その安全性、テストが実施される理由、および研究の全体的な説明が含まれています。
- スクリーニング同意書を使用して、被験者の指示をスクリーニングし、提供します。必要に応じて、各年齢層向けに開発された特別な単語、おもちゃ、ゲームを使用して、幼児に手順を説明します。被験者 (または被験者の両親) に、訪問前の過去 ~ 2 時間以内に発作を起こしたかどうかを尋ねてください。
- 被験者から金属および/または磁性材料を取り除き、適切な病院支給の衣服 (病院のガウン、スクラブなど) を被験者に提供します。また、MSR内に磁性粉塵が入らないように、被験者に靴を脱いでもらってください。歯科技工作物や埋め込み型医療機器など、他の強磁性体を除去できない場合は、消磁器(消磁器)を使用して、MEG記録中に干渉や高ノイズレベルを引き起こす可能性のある残留磁気アーチファクトを除去します。磁気ノイズの発生源がすべて除去されたことを確認した後、被験者に次の測定手順が適用される木製の椅子に座ってくつろいでもらいます。
注意: 消磁器は、埋め込まれた電子機器(ペースメーカー、ニューロモデュレーションデバイスなど)に直接適用しないでください。 - 被験者の頭囲を測定して、適切なEEGネットサイズ(通常は32〜34 cmから58〜61 cm)を選択します。測定テープのセンチメートル側を使用して、被験者の鼻からテープをイオンの~1 cm上に保持し、次に鼻に戻して頭囲を測定します。
注:鼻腔は目の間の頭蓋測定点であり、陰イオンは外部後頭部突起の先端です。- 被験者の頭囲に適したネットサイズを選択し、1クォートの温かい水道水、大さじ1の電解質(つまり、塩化カリウム)、および大さじ1のベビーシャンプーで構成される液体混合溶液に少なくとも5分間(最大10分間)浸します。この浸漬プロセスでは、スポンジを外側に向けてネットを裏返しにし、留め金を完全に緩めて、溶液が入ったプラスチックバケツ内にセンサーを完全に浸すことを確認します。
注意: ネットのアンプが溶液に近づかず、常に乾いた状態を保つようにするには、選択したネットのプラグにタオルを巻き付け、必要に応じて、プラスチック製のバケツがあるシンクの近くの椅子またはサポートに置きます。
- 被験者の頭囲に適したネットサイズを選択し、1クォートの温かい水道水、大さじ1の電解質(つまり、塩化カリウム)、および大さじ1のベビーシャンプーで構成される液体混合溶液に少なくとも5分間(最大10分間)浸します。この浸漬プロセスでは、スポンジを外側に向けてネットを裏返しにし、留め金を完全に緩めて、溶液が入ったプラスチックバケツ内にセンサーを完全に浸すことを確認します。
- 頭部位置インジケーター (HPI) コイルとして機能する 5 つの磁気コイルを、マイクロポア紙テープを使用して、被験者の頭皮の既知の場所に直接配置します: 髪の生え際近くの額の両側に 1 つずつ、各乳様突起骨に 1 つずつ、頭のてっぺんに 1 つずつ。
注:HPIコイルは、スキャン中に局在化できる既知の磁場を放出することにより、MEGシステム内に配置された超伝導量子干渉デバイス(SQUID)に対するヘッドの位置を定義します。HPIコイルの数はMEGシステムによって異なりますが、通常は3〜5個のHPIコイルの範囲です。 - テープを使用して追加の電極を配置し、心拍数(心電図、ECG)、眼球運動またはまばたき(眼電図、EOG)、および筋肉活動(筋電図、EMG)を測定します。これらの電極の配置により、被験者の健康状態を監視することもできます。
- 胸の右側と鎖骨の下の左側にそれぞれ 2 つの ECG 電極を配置して被験者の心拍を記録し、右目の上側と下側にそれぞれ 2 つの EOG 電極を配置して、垂直方向の眼球運動やまばたきを記録します。
- 視覚運動課題中の筋肉活動を測定するには、さらに、被験者の指をアルコールパッドで拭いて、皮膚へのテープの接着を改善し、各手に合計 2 対の非使い捨てカップ電極をテープで固定します: 1 つは第 1 背側骨間 (FDI) に、もう 1 つは外転筋花粉体 (APB)。
- これらすべての電極をテーピングする前に、導電性ペーストを電極カップの内側に少し過剰に充填するまで置き、皮膚のインピーダンスを減らし、接着性と導電性の最適なブレンドを確保します。
- 触覚刺激としては、両手の3本の指(親指[D1]、中指[D3]、小指[D5])の遠位掌部に直接、薄い弾性膜を貼り付けます。エアパフ刺激装置を使用して、硬質プラスチックチューブを介して圧縮空気パルスでメンブレンを膨らませます。圧縮空気パルスを、疑似ランダム順序に従って 1.5 秒± 0.5 秒の刺激間間隔で放出します。触覚刺激装置の圧力を50psiに調整します。
- 胸の右側と鎖骨の下の左側にそれぞれ 2 つの ECG 電極を配置して被験者の心拍を記録し、右目の上側と下側にそれぞれ 2 つの EOG 電極を配置して、垂直方向の眼球運動やまばたきを記録します。
- 被験者がまだ金属物体から離れた木製の椅子に座っている間に、デジタイザーを使用して、基準の解剖学的ランドマーク、5つのHPIコイル、およびその他の頭の形状ポイントの3次元(3D)位置を決定します。このヘッドのデジタル化プロセスでは、小さな動きが位置推定の精度に影響を与える可能性があるため、被験者に快適に座り、まっすぐ前を見て、ほとんど動かないように依頼します。
- 基準受信機をプラスチックゴーグル(つまり、基準キューブが片側に取り付けられた眼鏡)を通して被験者の頭に置き、留め金を調整して、測定全体を通して比較的静止している必要がある被験者への固定基準フレームを確保します。
- プライマリスタイラスレシーバーを介して、基準解剖学的ランドマーク(すなわち、鼻腔および左右の耳前点)とHPIコイルの位置を特定し、追加の頭皮ポイント(少なくとも100、できれば~500に近い)を均一にサンプリングして、頭部表面の高品質な再構成を強化します。
注:フィデューシャル解剖学的ランドマークは、対象の座標系を定義します。デジタイザーは、1 つの送信機 (通常は木製の椅子の背もたれの被写体の後ろに取り付けられる) と 2 つの受信機 (つまり、スタイラスと参照受信機) を使用して、3D 空間内のセンサーの座標を生成します。 - デジタル化が完了したら、スタイラスレシーバーを被写体と送信機から~15cm離して置き、ランダムなポイントをデジタル化してデジタル化プロセスを終了します。
注:デジタル化プロセスのこの最終ステップは、他の商用製品とは異なる場合があります。
- EEGネットを適用する前に、被験者にEEGアンプの近くの椅子に座ってもらい、胸と肩にタオルを置いて、ネットの適用による最終的な滴りを吸収します。プラスチックバケツからEEGネットを取り外し、スポンジを内側に向けて回し、タオルに優しく巻き付けて、混合溶液を過剰に吸収します。
- 被験者を椅子に座らせ、このステップで目を閉じたままにするように指示した状態で、両手をネットの中に入れ、指で広げ、最後に被験者の頭の上に置きます。
- HPIコイルの位置を動かさずに、指で被験者の頭に張ったネットを調整し、基準チャネルと鼻チャネルがそれぞれ頭皮の中央と被験者の目の間に正しく配置されるようにし、ネットが正しい位置に来たらチンストラップを固定します。
- EEGインピーダンスメーターを使用して、信号の歪みを防ぐために、すべての頭皮電極インピーダンスが0〜50kΩの範囲(値˂5kΩを推奨)にあることを確認します。頭皮-電極インピーダンスを減らすには、木製の綿棒を使用して電極と頭皮の間の被験者の毛を取り除くか、使い捨てのプラスチックピペットを使用して、各電極が頭皮と機械的および電気的に良好に接触していることを確認します必要に応じて、より導電性の高い混合溶液を電極のスポンジに移します。
- すべてのインピーダンスが理想的には最大50kΩになったら、アンプを切断し、EEG電極のデジタル化のために対象を準備します。
注意: MSRの外部でEEG電極のデジタル化を実行し、スキャンプロセスを管理するために被験者の周囲に十分なスペースを確保します。
- すべてのインピーダンスが理想的には最大50kΩになったら、アンプを切断し、EEG電極のデジタル化のために対象を準備します。
- ハンドヘルド光学スキャナーを使用して、EEG電極の3D位置を決定します。このプロセスでは、特に指示がない限り、被験者に快適に座り、まっすぐ前を見るように依頼してください。
- まず、光学スキャナーソフトウェアを開き、記録中に使用されるEEGセンサーのレイアウトに一致するセンサーテンプレートを選択してから、スキャンプロセスを開始します。
- スキャン中は、スキャナーをEEGネットから一定の距離(通常は~45cm)に保持し、スキャン開口部をセンサーの表面に対して垂直にし、上(頭の中央)から下(首に沿って最後のセンサーの列)にアーチ状の帯をたどって被験者の頭の周りをゆっくりと動かして、すべてのセンサーの物理的な位置を記録します。
注:光学スキャナーは、被験者の頭部上のEEG電極の位置をデジタル化し、それらを3D座標ファイルとして変換します。通常、赤外線(IR)光源を放射する2つの光学センサーによって特徴付けられます。スキャンされた各位置は、通常、3D センサー クラウド上に表示されます。3D センサー クラウドは、センサー位置のスキャン、プローブ、位置合わせに関するフィードバックを提供し、2D センサー マップは、これらのセンサー位置のラベル付けに関するフィードバックを提供します。EEG電極位置のスキャンプロセスには、基準点のプローブを含めて合計5〜10分かかります。ただし、スキャン時間は、電極位置を検出する際の光学スキャナーの性能に依存する場合があります。
- すべてのEEG電極がスキャンされたら(少なくとも95%)、基準点(すなわち、鼻および左右の耳前点)と4つのアライメントセンサー(すなわち、前方、左、右のアライメントノード、およびREFノード)をワイヤレス光学プローブを使用してプローブし、3Dセンサーの雲を選択したセンサーテンプレートに位置合わせします。
注意: アライメントセンサーには、EEGセンサーのネット構成に基づいて番号が付けられています。- 基準点をプローブするには、スキャナーのスキャン開口部がプローブの反射ディスクを指していることを確認して、光学プローブの先端を対象の基準点の中心にある被験者の皮膚に置きます。同様に、光学プローブの先端を対象のアライメントセンサーの中央に配置して、アライメントセンサーをプローブします。
- すべてのセンサーがスキャンされ、プローブされたら、実際のEEGネットに対する3Dセンサークラウドと2Dセンサーマップ上の位置とラベルを確認して、発生する可能性のあるエラーを確認し、最終的に修正します。スキャンプロセス中にエラーが発生しなかった場合は、3D座標の.txtファイルをエクスポートし、適切な形式に変換します。
注:3D電極座標は通常、.txt形式で保存され、光学スキャナーソフトウェアを介していくつかの形式(.xml、.sfp、.elp、.nsiなど)で変換できます。 - EEG 電極のデジタル化プロセス (ステップ 2.9-2.11) が完了したら、MSR 内で転送する被験者を準備して、安静/睡眠データ (ステップ 2.13)、視覚運動課題 (ステップ 2.14)、聴覚刺激 (ステップ 2.15)、および体性感覚刺激 (ステップ 2.16) を実行します。
- 安静時/睡眠データについては、MEGシステムのガントリーを仰臥位に設定し(図1A)、取り外し可能なヘッドレストがデュワーの下部にあるヘルメット型の開口部と一致するように、非磁性で互換性のあるベッドを配置します。ベッドを正しい位置に調整した後、ベッドのブレーキバルブをオフロック位置にセットします。ベッドの上にシーツまたは毛布を置き、取り外し可能なヘッドレストに小さなフォームパッドの枕を置いて、録音中に頭を固定して快適にします。
注:デュワーは、液体ヘリウムで満たされた極低温貯蔵容器であり、センサーアレイは、被験者の頭を囲むように設計されたヘルメット型の開口部を介して底部に空間的に配置されています。ヘルメットは頭囲59〜61cmまでフィットします。ガントリーは、デュワーを支える機械システムであり、測定位置(座っているか仰向けか)に基づいてデュワーの仰角と角度を変更できます。- 被験者をMSR内に移し、ベッドの端に座って横になるようにします。被験者の体に毛布を数枚敷いて、電極のケーブルに簡単にアクセスできるようにして記録中に彼/彼女を暖かく保ち、安全ベルトを軽く固定します(または手すりがある場合は手すりを引き上げます)このステップが被験者に説明してください。必要に応じて、首の下に追加の丸めたタオルを置き、被験者の首と肩をサポートします。
- ベッドのブレーキバルブのロックを解除して被験者の頭をそっと動かし、デュワーのヘルメット型の開口部の下にある取り外し可能なヘッドレストに置かれ、ヘルメットの内側に触れるまで動かします。信号対雑音比(SNR)を上げるには、被験者の頭をできるだけヘルメットに近づけます。
- HPIコイル、ECG、およびEOG電極をMEGシステムの対応するパネルに差し込み、EEGネットをMSR内の増幅器ユニットに接続し、MSR外部の取得ワークステーションから頭部の座標の測定値を確認して、被験者の頭部がデュワーの下に適切に配置されているかどうかを評価します。
- 被験者の同意を得て、MSR内の光の強度を下げて、リラクゼーションと睡眠を刺激します。被験者がリラックスして快適だと感じたら、被験者に目を閉じて休むか、録音中に眠るように指示します。被験者は、MSRの壁に取り付けられた無線周波数シールドカラーカメラを介して、MSRの外側のモニターで記録全体にわたって観察されることを安心させます。
- 視覚運動課題では、MEG システムのガントリーを直立位置 (図 1B) に設定し、被験者の頭がガントリーの下にくるように MEG チェアを配置し、デュワーの下部にあるヘルメット型の開口部に近づけます。椅子を正しい位置に調整した後、椅子のブレーキバルブをオフロック位置(「0」)に設定します。
- MSR内で被写体を転送します。彼/彼女が非磁性で互換性のある椅子に座り、快適でリラックスした位置を見つけるのを手伝ってください。電極のケーブルに簡単にアクセスできるようにして、記録中に被験者を暖かく保つために被験者の体にいくつかの毛布を置き、被験者がタスク中に手を置くことができるように取り外し可能なテーブルを配置します。必要に応じて、座った姿勢を維持するために被験者の膝の下にタオルを置き、滑り落ちないようにします。
注: 被験者は視覚運動課題中にリラックスする可能性があるため、最初の位置よりも低い位置を仮定します。各タスク セッションの終了時に昇降ペダル (存在する場合) を使用して椅子を慎重に持ち上げるか、タオルまたは毛布を椅子に置いて、被験者の頭が再びヘルメットの内側に触れるようにします。必要に応じて、追加のタオルや毛布を被験者の頭の後ろに置くと、快適さが向上するだけでなく、被験者が頭をできるだけまっすぐに保つのを助けます。視覚運動刺激は、録音セッションの途中でデュワーを動かさないように、仰臥位で代替的に行うことができます。 - 被験者が正しい位置になったら、HPIコイル、ECG、EOG、FDI、およびAPB電極をMEGマシンの右側パネルに差し込み、EEGネットをMSR内のアンプユニットに接続し、エレベーションペダル(存在する場合)を介して椅子を少し動かすか、被験者の頭がヘルメットの内側に軽く触れるまで椅子に追加のタオルまたは毛布を置きます(の測定値を確認してください。MSR の外部の Acquisition Workstation からの head's 座標)。
- MSRの外側に配置されたプロジェクターミラーシステムを介して視覚刺激が投影される投影スクリーンを被験者の前(図1B)に配置し、記録中に実行する視覚運動タスクを説明します。特に、被験者に人差し指でテーブルを叩くように指示するのは、視覚刺激(画像など)が画面上にそれぞれ右手と左手に表示されるときだけです。被験者がタスクを理解しているか、一人で快適に実行できることを確認してください。必要に応じて、被験者と一緒にタスクを数回練習して、被験者がそれに慣れるのを助けます。
注: 視運動刺激セッションを仰臥位で行う場合、プロジェクターからの視覚刺激を反射するために、被験者の顔から離れた場所に鏡を置きます。 - MSRのドアを閉める前に、被験者に部屋の中で一人でいることに抵抗がないかどうか尋ねてください。そうでない場合は、チームから1人またはその両親が録音セッション中にMSR内に残ります。さらに、記録全体にわたってMSRの外側のモニターで観察されることを被験者に安心させます。
- MSR内で被写体を転送します。彼/彼女が非磁性で互換性のある椅子に座り、快適でリラックスした位置を見つけるのを手伝ってください。電極のケーブルに簡単にアクセスできるようにして、記録中に被験者を暖かく保つために被験者の体にいくつかの毛布を置き、被験者がタスク中に手を置くことができるように取り外し可能なテーブルを配置します。必要に応じて、座った姿勢を維持するために被験者の膝の下にタオルを置き、滑り落ちないようにします。
- 聴覚刺激には、ステップ2.14で説明されているセットアップを使用して、着座している被験者の前に投影スクリーンを使用します。被験者がサウンドトリガー(変調されたチャープ音など)を配信するヘッドフォン(またはイヤホン)を着用するのを手伝ってください。
- 被験者に、音のトリガーを聞きながら、画面に投影された刺激(例:黒い背景の上の緑色の点)を固定するように指示します。必要に応じて、被験者が手順をよりよく理解できるように、トレーニングセッションを実施します。MSRのドアを閉じる前に、前述の安全手順を繰り返してください。
- 体性感覚刺激には、ステップ2.14で説明されているセットアップを使用します。被験者に、目の前のプロジェクタースクリーンで見たいビデオ(または映画)を尋ねます。
- 被験者に目を開けてリラックスし、選択したビデオを見て、できるだけ静止し、録画中に指に伝わる触覚刺激を無視するように指示します。彼/彼女がそれぞれの手の指先で皮膚を優しく叩くのを感じることを被験者に説明します。被験者が不快に感じる場合は、トレーニングセッションを実施して彼/彼女を安心させます。
注:視覚ターゲットへの視線固定は、記録の品質に影響を与え、データ取得中に提供される触覚刺激から被験者の注意をそらす可能性のある生物学的アーティファクトを最小限に抑えるための確立された手法です。
- 被験者に目を開けてリラックスし、選択したビデオを見て、できるだけ静止し、録画中に指に伝わる触覚刺激を無視するように指示します。彼/彼女がそれぞれの手の指先で皮膚を優しく叩くのを感じることを被験者に説明します。被験者が不快に感じる場合は、トレーニングセッションを実施して彼/彼女を安心させます。
3. データ取得
注:MEGとEEGの同時データの取得は、Cook Children's Medical Center(CCMC)のMEG施設で行われます。てんかんの小児に対するMEGの臨床使用に関する詳細は、他の場所で見つけることができる8,27,45。
- 102個の同一トリプルセンサー素子にグループ化された306チャンネルと1つの磁力計と2つの直交平面グラディオンを備えた全頭部MEGシステム(センサーカバレッジ:1,220cm2)を使用してMEG信号を記録します。サンプリング周波数を1kHz以上に設定してください。
注:シングルコイル磁力計は、MEGヘルメットの表面に垂直な磁場の成分を測定します。平面グラディオメータは、磁力計のペアが互いにわずかな距離に配置されたことを特徴とする「8の字」コイル構成で構成され、それらの位置間の磁場の差(つまり、2つのループ間の「8」の差)を測定し、空間勾配とも呼ばれます。磁力計と比較して、平面グラディオメータは脳深部源に対する感度は低いですが、環境ノイズを抑制することにより、表面源の検出においてより堅牢です。この306チャンネルを-296°C(4.2K)の液体ヘリウムに浸して冷却し、超伝導体にします。 - 頭皮、頬、首の後ろに等間隔に配置されたAg/AgCl電極センサーを備えた非磁性256チャンネルのEEGネットを使用して、EEG信号を同時に記録します。サンプリング周波数を1kHz以上に設定してください。
- MSRのドアを閉じて録音を開始します。音声インターホンシステムを通じて、被験者とコミュニケーションを取り、MSR内で一人でいることに抵抗がないかどうかを確認します。ビデオで被写体を常に監視し、緊急時はすぐにMSRに入ります。
注:彼/彼女が快適に感じない場合、または巨大なMSRドアが彼/彼女を脅かしている場合は、チームの1人またはその両親が、被験者の近くの木製の椅子に座って録音セッション中にMSR内に留まることができます。部屋に入る前に、すべての金属物が取り除かれていることを確認してください。 - 各録音の前に、音声インターホンシステムを通じて、タスクを開始する前に被験者の位置を~30秒間静止させるように被験者に指示します。視覚運動課題については、さらにインターホンを介して、最初の記録セッションに人差し指(右または左)を使用する人差し指を通信します。
- 被験者が静止しているこの期間中に、MEGデータ収集システムのHPI測定ダイアログから測定ボタンを押して、HPIコイルに供給される電流によって生成される磁場を測定し、MEGセンサーアレイに対するヘッド測定位置を決定します。したがって、被験者が適切な位置にあることを確認し(ヘッド|Z座標| ˂ 75 mm)、各セッションの3D測定値を書き留めます。
- 被験者の頭とヘルメットの間にまだスペースがある場合は、MSR内に再度入り、エレベーションペダル(存在する場合)で椅子の高さを調整するか、椅子にタオルまたは毛布を置くか、インターホンを介して被験者に頭をヘルメットに近い位置に移動する方法(被験者が座っている場合)を指示します。 そして最後に、ヘッドの測定位置を再度確認します。休息/睡眠録音の場合は、MSRに再度入り、ベッドをヘルメットに近づけて、頭とヘルメットの空間的ギャップを減らします。
- 被験者がMEGヘルメットに対して適切な位置に配置され、開始する準備ができたら、正確なMEGとEEGの同期(ステップ3.12を参照)のための正確な順序(ステップ3.5.1を参照)に従って、最初の記録セッション(持続時間~10分)を開始します。
注:高品質の録音を確保するには、最初の録音セッションは、被験者の動きや外部環境によって引き起こされたデータに存在するアーティファクトをキャプチャするために重要です。必要に応じて、MSR内に再度入り、最終的なチャネル接続またはMEGチェア上の被験者の位置を調整します。録音中に異常なアーティファクトやイベントを記録し、必要に応じて後で確認できるようにしておくことをお勧めします。- EEGデータ収集ソフトウェアの記録ボタンを押して、EEG記録を開始します。MEGデータ集録ソフトウェアの録音ボタンを押して、MEG録音を開始します。最後に、刺激コンピューターのソフトウェアからスタートボタンを押して、視覚刺激を表示するか、聴覚刺激を配信します。
注意: 視覚(または聴覚)刺激ソフトウェアを実行している刺激コンピューターは、MSRの外部にあるプロジェクターミラーシステムに接続されており、実行される録音の種類に応じてオンまたはオフにすることができます。休息/睡眠の録音中は、被験者が休んでいるか眠っているため、システムはオフになりますが、刺激コンピューターで視覚刺激ソフトウェアを実行すると、各録音セッションのタイミングを計るのに役立ちます。視覚運動課題中、および聴覚および体性感覚刺激中、ソフトウェアの実行中に被験者が目の前に置かれたスクリーンに投影された刺激またはビデオを観察できるようにすることで、システムがオンになります。この研究では、(i) 合計 107 の刺激 (つまり、市松模様の背景に 85 枚の画像と 22 枚の市松模様の背景に重ね合わせる) を選択し、視覚運動課題の各刺激の間に ~4 秒の間隔を空けました。(ii)聴覚刺激のための3秒の刺激間間隔を持つ200の変調チャープ音。(iii)体性感覚刺激のための~1.5秒の刺激間間隔を持つ半ランダムなシーケンスに続く各指(すなわち、D1、D3、およびD5)のための200の触覚刺激。
- EEGデータ収集ソフトウェアの記録ボタンを押して、EEG記録を開始します。MEGデータ集録ソフトウェアの録音ボタンを押して、MEG録音を開始します。最後に、刺激コンピューターのソフトウェアからスタートボタンを押して、視覚刺激を表示するか、聴覚刺激を配信します。
- 記録を停止するには、MEGデータ収集ソフトウェアの停止ボタンを押してから、EEGデータ収集ソフトウェアの停止ボタンを押します。各録音セッションの終了時に、インターホンを介して被験者と連絡を取り、被験者を安心させ、MSR内のチャンネル接続や位置調整が必要ない場合は、次のセッションに進みます。
- 視覚運動課題では、セッションごとに異なる視覚刺激を選択して、記録中に被験者のモチベーションを維持し、楽しませます。
- 視覚運動データまたは安静/睡眠データのいずれかについて、5-6 セッションを特徴とする合計 ~1 時間の MEG および EEG 同時記録を記録します。ただし、セッション数は科目ごとに異なる場合があります。さらに、聴覚刺激データと体性感覚刺激データについて、合計 ~20 分 (各 ~10 分の 1-2 セッション) と ~14 分 (~7 分ずつの 1-2 セッション) の同時 MEG 記録と EEG 記録をそれぞれ記録します。
注:この研究では、MEGデータとEEGデータは、CCMCのITストレージシステムにそれぞれ.fif形式と.mff形式で記録の最後に自動的に保存されます。 - 録音が終了したら、MSRを入力して被験者が椅子またはベッドから立ち上がるのを助け、MSRの外側の椅子に座ってEEGネットと電極の両方を取り外すように依頼します。
- 被験者に指示があるまで目を閉じるように指示し、あごのストラップを完全に緩め、両手で(額から被験者の後頭部に向かって)ネットを完全に剥がすまで軽く引き抜くことにより、EEGネットを取り外すのを手伝ってください。このステップでは、ネットを取り外すときに被写体の髪を引っ張らないように注意してください。さらに、被験者が以前に皮膚にテープで留められていた残りの電極 (つまり、視覚運動課題の場合は ECG、EOG、および EMG) を優しく取り外すのを助けます。
- EEGネットと電極を取り外した後、すべての手順が最終的に完了したことを被験者(および彼/彼女の両親)に伝えてください。
- 被験者が部屋を出た後、光学スキャナーを慎重に清掃し(ユーザーマニュアルに記載されているように)、保護ケース内に保管してください。
- 録音中に使用された機器(椅子、ベッド、机など)の表面を、病院が承認した過酸化水素ワイプまたは消毒スプレーとペーパータオルで清掃および消毒し、使用済みの毛布とタオルを病院が提供する容器に入れ、使用済みのテープを捨てます。
- 測定ツールは収納キャビネット内に保管し、導電性ペーストを充填した電極カップの内部は、水道水が流れている木製の綿棒を使用して清掃します。
- EEGネットをすすぐには、シンクのプラスチックバケツに清潔で温かい水道水を入れ、次の手順を合計4回繰り返します。
- EEGネットを水に浸し、EEGネットを10〜20秒間静かに攪拌します(またはバケツの内側と外側に~25回浸します)。
- バケツから水を抜き、バケツに清潔で温かい水道水を補充します。
- 脳波ネットを消毒するには、流しのプラスチックバケツに2クォートのぬるま湯と大さじ1の消毒液からなる消毒液を入れ、その中に脳波ネットを10分間浸します。消毒液からバケツをすすぎ、すすぎと排出のプロセスを3回繰り返して、EEGネットから残留溶液を取り除きます。
- すすぎまたは消毒プロセスのいずれかで、浸したEEGネットをバケツから取り外し、清潔で乾いたタオルを使用して余分な水分を取り除いて乾燥させ、シンクの近くに吊るして保管します。
- MEG データの内部および外部の磁気干渉と測定/移動アーティファクトを抑制するには、信号空間分離 (tSSS) 法の時間拡張を生データの MEG .fif ファイルに適用します。
注:時空間マクスウェルフィルタリング(tSSS)は、MEGセンサーアレイの内部または非常に近い場所にある干渉源、つまり内部干渉を抑制するのに理想的です。 - MEGとEEGの同時記録を実行する場合は、被験者の頭部の解剖学的ランドマークに対して2つの取得デバイスの座標系を空間的に位置合わせし(図2A)、サンプリングレートが異なる可能性があるために発生する信号間の線形クロックドリフトを修正します(図2B)。
注:記録中、MEG信号とEEG信号は、開始ボタンと終了ボタンの押下が遅れる可能性があるため、時間の経過とともにゆっくりとシフトする可能性や、トリガーがMEGおよびEEGデータ収集ソフトウェアに送信されるときに発生する内部クロックドリフトによっても影響を受ける可能性があります。これらの信号間の正確な同期を確保するために、データ集録中に両方のシステムで送信されたトリガイベントを共通のトリガ信号として使用するPythonの社内コードが開発されました。このコードには、MNE-Pythonソフトウェアライブラリで利用可能な3つの関数が含まれています:MEGおよびEEG信号を読み取る2つの関数と、チャネル名やタイムスタンプ(イベント発生の日時)などの信号からトリガーイベントの情報を抽出する1つの関数。各信号のトリガイベントの発生時間差(デルタ)は、時間の経過に伴う線形クロックドリフトを定義します(図2B)。開発されたコードの詳細な説明は、次の手順で提供されます(3.12.1-3.12.4を参照)。- 各信号で発生する最初のトリガー・イベントの差をオフセット値(つまり、2つの信号の1つからトリミングする部分)として使用して、録音を位置合わせします。
注: mne.io.read_raw_fif 関数と mne.io.read_raw_egi 関数はMEGとEEGの記録を2D配列形式に変換しますが、 mne.find_events 関数は生の信号からイベント情報を抽出します。 - これらの最初のトリガーが整列したら、ピアソンの相関係数を計算して、信号間の相関の程度を評価します。完全な位置合わせを確保するために、1 x 10-6 < p 値をお勧めします。
注:scipyライブラリのpearsonr関数は、MEG信号とEEG信号の間のピアソンの相関係数と、この相関のp値を推定します。 - この相関精度を検証するには、1次多項式近似を実行して2つの信号間のドリフト率を推定し、多項式関数の係数で表される視差の結果の程度を使用して、多項式近似のx軸上で信号をリサンプリングします(図2B)。
注:numpyライブラリのpolyfit関数は、多項式関数内のMEG信号とEEG信号を適合させます。この関数は、2 つの信号間の不均衡の程度を表す係数を返します。関数 mne.resample は、多項式関数の係数に従って MEG 信号と EEG 信号を再サンプリングします。 - リサンプリングが完了したら、各信号で発生した最後のトリガー イベントのタイムスタンプを比較し、MEG 信号と EEG 信号の両方で一般的でないタイム ウィンドウを削除します。最後に、同期したMEG信号とEEG信号をマージして、MEGセンサーとEEGセンサーの両方を特徴とする1つの記録を作成し、さらに分析に使用できます。
メモ: mne.add_channels 機能は、2つの信号をマージして1つの録音を作成します。
- 各信号で発生する最初のトリガー・イベントの差をオフセット値(つまり、2つの信号の1つからトリミングする部分)として使用して、録音を位置合わせします。
- 各 ~1.5 時間の記録の終了時に、視覚運動 (および安静/睡眠)、聴覚、および体性感覚刺激データについて、それぞれ 5-6 (各 ~10 分)、1-2 (各 ~10 分)、および 1-2 (各 ~7 分) の同期 MEG および EEG 記録のセッションを合計 5-6 (~10 分) セッションで使用します。
注: 理想的には、被験者は 3 つの視覚運動記録に対して右指のタッピングを行い、残りの 3 つの視覚運動記録に対して左指のタッピングを行う必要があります。
4. データ分析
- 刺激性ゾーンのマッピング
- ヒトの脳MR画像を処理、分析、および視覚化するためのオープンソースのニューロイメージングツールである FreeSurferの皮質再構成プロセスを使用して、被験者のMRIから3D皮質表面を生成する46。
- MEGおよびEEGデータの視覚化と処理47に特化したMATLABのオープンソースアプリケーションであるBrainstormで再構成された解剖学をインポートし、皮質再構成の結果を視覚化する。Brainstormから、被験者の座標系を定義する基準点(つまり、鼻、左/右前耳介、前/後交連、および半球間)をインポートされたMRIに設定します。
- MEGとHD-EEGの同時信号を Brainstorm にインポートし、MRI登録プロセスを使用してMEGセンサーとEEGセンサーをMRIに登録し、デジタル化された基準点へのアライメントを調整します。必要に応じて、EEGセンサーを皮質表面に投影します。
- MEGとHD-EEGの同時記録を開き、生データを目視検査して不良チャネルを削除します。さらに、 Brainstorm で利用可能な Signal-Space Projection (SSP) アーティファクト補正手法を適用して、録音から生物学的アーティファクト (心拍、まばたきなど) を排除します。
- ノッチ(電力線の干渉に応じて50Hzまたは60Hz)とバンドパス(1-70Hz)フィルターをMEGとHD-EEGの同時データに適用します。
- スパイクや鋭い波など、頻繁な IED を特徴とする発作間欠活動を含み、運動アーチファクトが最小限に抑えられている (可能な場合) データの一部を選択します。
注:IEDは、<70msの時間的発展、>50μVの振幅、および1〜70Hzの周波数帯域48のバックグラウンドアクティビティと明確に区別できるシャープな形状を特徴とする過渡波形です。 図3A は、MEG信号とHD-EEG信号の同時発生部分の例であり、両方の録音で頻繁にIEDが見られます。 - ページあたり10秒の標準表示設定を使用して、MEGとEEGの両方の記録(図3A)で発生する各IEDの負のピークをマークし、各モダリティのみでマークします。各IEDをマーキングする前に、MEGとEEGのトポグラフィーフィールドとポテンシャルマップをそれぞれ確認してください。
注:各IEDの立ち上がりフェーズ中の追加の時点の電圧分布も、そのピークではなく、てんかん活動49の伝播の可能性を説明するためにチェックしなければならない。 Brainstorm を使用して発作間欠性スパイク イベントをマークする方法の詳細については、他の場所 (https://neuroimage.usc.edu/brainstorm/Tutorials/Epilepsy) を参照してください。 - Brainstormで利用可能なOpenMEEG BEM(対称境界要素法)ソフトウェアを使用して、3層(頭皮、頭蓋骨の内側、外側の頭蓋骨)の幾何学モデル(図3B)として定義される現実的な頭部モデルを計算します。MRIボリュームをソース空間(空間分解能5mmのソースポイントグリッド)として使用します。
注:OpenMEEG BEMソフトウェアは、対称境界要素法を使用して、頭皮(つまり、空気-頭皮界面)、外側の頭蓋骨(つまり、頭皮-頭蓋骨界面)、および内側の頭蓋骨(頭蓋骨-脳界面)によって特徴付けられる現実的な前方モデルを計算します。別の解決策として、有限要素法(FEM)を使用すると、ヘッドボリューム導体の現実的な主題固有の表現が可能になるため、順方向の問題を解決するために使用できます。頭部組織の伝導性の値は、文献から仮定されることが多く、被験者の年齢によって異なる場合があります50。FEMを使用して前方モデルを解くには、Brainstorm 47,50,51で利用可能なDUNEuro FEMソフトウェアを使用して、3層から5層(白質、灰白質、脳脊髄液、頭蓋骨、皮膚)の幾何学モデルとして定義される現実的な頭部モデルを計算します。FEMを使用したフォワードモデルの推定の詳細については、他の場所(https://neuroimage.usc.edu/brainstorm/Tutorials/Duneuro)を参照してください。 - 選択した発作間欠スパイクの基礎となるジェネレーターを、制約なしの ECD 法を使用して、MEG、EEG、および組み合わせた MEG センサー アレイで個別に位置を特定します。これらのダイポール ソースをローカライズするには、空の部屋の MEG 記録からノイズ共分散を計算するか、それを単位行列として設定します。
注:IEDのSNRが低い場合の代替アプローチとして、同様の電圧分布を持つ平均化されたIEDでソースローカリゼーションを実行することを検討してください12。 - 以前にマークされた各IEDのピークで Brainstorm で使用可能なダイポールスキャン方法を実行して、ブレインボリューム全体で最も重要なソースダイポールを選択します。適合度が >60% のソース双極子のみを選択し、各双極子に対して定義されたクラスター性を、中心から 15 mm の位置にある双極子の数として推定します (図 3C)。
注:ECDのクラスタ性についての詳細は、他の場所52で見つけることができる。
- SOZのマッピング
- FreeSurfer46の皮質再構成プロセスを使用して、被験者のMRIから3D皮質表面を生成します。
- 再構築された解剖学的構造を Brainstorm47 にインポートして、皮質の再構築結果を視覚化します。インポートした MRI 上に、被験者の座標系を定義する基準点を設定します。
- MEGとHD-EEGの同時信号(発作イベントを含む)を Brainstorm にインポートし、MRI登録プロセスを使用してMEGセンサーとEEGセンサーをMRIに登録し、デジタル化された基準点へのアライメントを調整します。必要に応じて、EEGセンサーを皮質表面に投影します。
注:被験者が録音中に発作を起こした場合は、録音中に取られたメモを確認して、発作イベントが記録されたセッションを評価してください。 - MEGとHD-EEGの同時記録を開き、生データを目視検査して不良チャネルを削除します。 Brainstorm47 で利用可能なSSPアーティファクト補正技術を適用して、録音から生物学的アーティファクト(心拍、まばたきなど)を拒否します。
- ノッチ(電力線の干渉に応じて50Hzまたは60Hz)とバンドパス(1〜70Hz)フィルターをMEGとHD-EEGの同時データに適用します。
- 記録ノートに従って、発作の開始とその終了(注意された場合)を特定し、これらのイベントを信号にマークして、発作性てんかん様分泌物を含むデータの正しい部分を特定します。発作の発症例を 図4 にMEGとHD-EEGでそれぞれ示しています。
注: MEG の取得中に被験者が発作を起こした場合、医療従事者は直ちに被験者を支援し、救急医療を提供する必要があります。したがって、黄疸イベントを含むデータ部分の期間は短くなる可能性があります。 - ページあたり 10 秒の標準表示設定を使用して、発作イベント中に発生するてんかん様放電の各バースト (反復スパイク、鋭い波、またはスパイク波複合体など) の負のピークを MEG と EEG でマークします。各ピークマーキングの前に、MEGとEEGのトポグラフィーフィールドとポテンシャルマップをそれぞれ確認してください(図4A)。
注:発作は、発症が始まる場所に応じて、全身性または限局性に分類されます。てんかん症候群にもよりますが、発作は少なくとも10秒の現象であり、周波数、振幅、および形態が異なる可能性のある反復的な放電を特徴としています。 - Brainstorm で利用可能な OpenMEEG BEM ソフトウェアを使用して、MEG センサーと EEG センサーの 3 層 (頭皮、頭蓋骨の内側、外側の頭蓋骨) のリアルな頭部モデルを計算します。MRIボリュームをソース空間(空間分解能5mmのソースポイントグリッド)として使用します。
注:FEMを使用して前方モデルを解くには、Brainstorm 47,50,51で利用可能なDUNEuro FEMソフトウェアを使用して、3層から5層(つまり、白質、灰白質、脳脊髄液、頭蓋骨、皮膚)の幾何学モデルとして定義される現実的な頭部モデルを計算します。FEMを使用したフォワードモデルの推定の詳細については、他の場所(https://neuroimage.usc.edu/brainstorm/Tutorials/Duneuro)を参照してください。 - 選択した発作放電の基礎となるジェネレーターを、MEG、EEG、およびMEGとEEGを組み合わせたセンサーアレイで制約のないECD法を使用して個別に位置を特定します。これらのダイポール ソースをローカライズするには、空の部屋の MEG 記録からノイズ共分散を計算するか、それを単位行列として設定します。
- Brainstorm で使用可能な双極子スキャン法を、以前にマークした各黄角波形のピークで実行し、ブレインボリューム全体で最も重要なソース双極子を選択します。適合度が >60% のソース双極子のみを選択し、そのクラスター性を推定します (各双極子の中心からの双極子の距離を 15 mm に設定)52。
- 雄弁な皮質のマッピング
- 視覚運動課題中、ならびに聴覚および体性感覚刺激中に記録された信号を使用して、前述のステップ4.2.1-4.2.3を実行します。
- MEGとHD-EEGの同時記録を開き、生データを視覚的に検査して不良チャネルを削除します。これとは別に、セッションごとに、 Brainstorm47 で利用可能なSSPアーティファクト補正技術を適用して、録音から生物学的アーティファクト(心拍、まばたきなど)を排除します。さらに、アーティファクトによって汚染されたすべてのデータ セグメントを破棄するか、"Bad interval" としてマークし、さらに分析に使用できません。
- ノッチ(電力線の干渉に応じて50Hzまたは60Hz)とバンドパス(1〜100Hz)フィルターをMEGとHD-EEGの同時データに適用します。
- 運動皮質をマッピングするには、FDI電極とAPB電極から記録されたEMG信号を開き、被験者が行ったタッピングイベントを手動でマークします。FDIペア電極のベースラインとは異なる筋肉活性化の最初のピークを選択することにより、右手と左手で別々になります。この手順は、 Brainstorm47 を使用してセッションごとに個別に実行します。
注意: [フィルター ]タブは 、Brainstorm でのみ視覚化し、タップ中にEMGアクティビティのピークを正しくマークするのに役立つ周波数範囲(ハイパス:30 Hz、ローパス:300 Hz、ノッチ:60 Hzなど)を選択します。イベントの名前は、セッション間で同じである必要があります。たとえば、被験者が右指 (または左指) でタッピングを実行したときのイベントには、"Tap_right" (または "Tap_left") という名前を付けることができます。この手順により、すべてのセッションで発生した同じタイプのイベントに対して独自の分析を実行できます。 - 各セッションから、次のパラメータを選択して、アーティファクトのないセグメントで発生するイベントをインポートします:視覚刺激:[-200; +500] msの時間枠、刺激開始前の[-200; 0]ミリ秒のベースラインを含む。タッピングイベント: [-1500; +1000] ミリ秒の時間枠 (視覚刺激の開始前の [-1500; -1000] ミリ秒のベースラインを含む)。変調チャープ音:[-500; +1000] ミリ秒の時間枠(刺激開始前の[-500; 0] ミリ秒のベースラインを含む)。触覚刺激:[-100; +500] msの時間枠(刺激開始前の[-100; 0] msのベースラインを含む)。
- 特定のタスクのイベントがすべてのセッションからインポートされたら、平均参照モンタージュを適用してEEGデータのSNRを増加させ、刺激全体の平均を推定して、イベント誘発フィールドと電位を取得します。運動課題(すなわち、タッピング)と触覚刺激の場合、この最後のステップはそれぞれ右手と左手に対して行われます。
注:図5、図6、図7、および図8のパネルAおよびBは、それぞれ、MEGおよびEEGおよびそれらの相対的なトポグラフィーフィールドおよび電位マップに対する視覚、運動、聴覚、および体性感覚誘発反応の例を示している。特定のタスクに対する刺激の総数は、完了したセッションの数に厳密に依存します。モータータスクの場合、この数値は正しく実行されたタッピングタスクにも依存します。 - 視覚、運動、聴覚、または体性感覚誘発のフィールドと電位のいずれかについて、 Brainstorm で利用可能な OpenMEEG BEM ソフトウェアを使用して、MEG センサーと EEG センサーの 3 層 (つまり、頭皮、頭蓋骨の内側、外側の頭蓋骨) のリアルな頭部モデルを計算します。3D皮質表面をソーススペースとして使用します。
注:FEMを使用して前方モデルを解くには、Brainstorm 47,50,51で利用可能なDUNEuro FEMソフトウェアを使用して、3層から5層(つまり、白質、灰白質、脳脊髄液、頭蓋骨、皮膚)の幾何学モデルとして定義される現実的な頭部モデルを計算します。FEMを使用したフォワードモデルの推定の詳細については、他の場所(https://neuroimage.usc.edu/brainstorm/Tutorials/Duneuro)を参照してください。 - イベントによって誘発されるフィールドと電位ごとに、 Brainstorm ツールボックスに実装された dSPM を使用して、MEG、EEG、および結合された MEG センサーと EEG センサー アレイを個別に使用して、平均化されたイベントの皮質源を計算します。各タスクに固有の事前刺激ベースライン期間を使用して、ノイズ共分散行列を設定します(ステップ4.3.5を参照)。
- タスクに応じて、アトラスを使用するか、その場所の仮想センサー(つまり、関心領域、ROI)の再構築を通じて定義できる、関与する雄弁な脳領域[一次視覚野(V1)、一次運動皮質(M1)、一次聴覚皮質(A1)、または一次体性感覚皮質(S1)]で観察される最大の皮質源を抽出します(図5C、 図 6C、 図 7C、および 図 8C)。
- イベント誘発場と、関与する雄弁な脳領域 (V1、M1、A1、または S1) の潜在的なソースに対して、線形スケール (周波数範囲: 1:1:100 Hz) で Morlet ウェーブレットの時間-周波数分解を実行します。
注:刺激の開始に時間ロックおよび位相ロックされた誘発振動を推定するために、MEG/EEG信号は最初にイベント全体で平均化され、次に時間周波数分析53,54の対象となる。 - Brainstorm で使用可能なイベント関連の摂動法を使用して皮質ソース マップの標準化を実行し、ベースライン (ステップ 4.3.5 を参照) に対して、イベントごとに個別に正規化します (図 5D、図 6D、図 7D、図 8D)。
注: イベント関連の摂動を使用したソース マップの標準化は、ベースライン上の平均からの偏差をパーセントで推定する時間-周波数パワー マップの正規化尺度です。この標準化プロセスの詳細については、他の場所(https://neuroimage.usc.edu/brainstorm/Tutorials/TimeFrequency#Normalized_time-frequency_maps)を参照してください。
- 検証
- 硬膜下グリッドおよび/または深部電極の埋め込みを通じて、術外 iEEG 記録を取得します。頭蓋内電極の数、種類、配置は、術前評価の非侵襲的診断テストから得られた情報の総和から得られた臨床仮説に基づいて、集学的てんかんチームによって決定されます。
注: 術前評価の一環として、術外 iEEG は、1,024 Hz のサンプリング レートを使用してデジタル EEG システムを介して数日間にわたって記録されます。 - 各被験者で利用可能な臨床情報に基づいて、専門のてんかん専門医によって定義されたSOZを特定します。
注: SOZ は、最初の明確な発作性電気写真放電を示す脳領域として定義され、臨床的に定義された発作期の発症前またはそれと同時に発生する可能性のあるバックグラウンド活動とは異なります。この発作電位放電に関与するすべてのチャネルは、異なる脳領域から発生する発作を捕捉する場合でも、SOZ接点と見なされます。 - iEEG に記録された発作イベント中に、各頭蓋内電極で発生するてんかん様放電の各バーストのピークをマークし、ステップ 4.1.7-4.1.10 で前述したように ECD 法を使用して、これらの発作イベントで発生源の特定を行います。
- iEEG ローカリゼーション結果を、臨床的に定義された SOZ をソースローカリゼーション結果のゴールド スタンダードと比較します。
- 硬膜下グリッドおよび/または深部電極の埋め込みを通じて、術外 iEEG 記録を取得します。頭蓋内電極の数、種類、配置は、術前評価の非侵襲的診断テストから得られた情報の総和から得られた臨床仮説に基づいて、集学的てんかんチームによって決定されます。
結果
DREの小児患者は、ジェーン・アンド・ジョン・ジャスティン・インスティテュート・フォー・マインド・ヘルス、クック・チルドレンズ・ヘルスケア・システム(CCHCS)のてんかんクリニックから募集されました。ここでは、(i)10歳の女性、(ii)13歳の男性、(iii)10歳の女性の3人の代表的な患者のデータを示します。
ケース1: 10歳の女性は、3歳から発作を起こして入院しました。患者は、8つのASMの投与後も毎日発作に苦しんでいました。初期発作は、眼の逸脱(不明瞭な側面)と行動停止によって特徴付けられました。その後、患者は、発作性のふくれっ面 (「chapeau de gendarme」の兆候)、頭の左への偏位、および両側の強直性腕の硬化 (右優位) を特徴とする ~30 秒の毎日の発作を経験しました。長期のビデオ脳波では、頭部が左にずれ、続いて左腕が浮き上がる非対称性強直性発作の2つのクラスターが明らかになりました。睡眠中にも3回の強直性発作が観察され、全身性の速いポリスパイクと、断続的に目を開ける、上向きの視線、左腕または右腕の挙上を伴う遅い波が頻繁に発生しました。これらのポリスパイクと低速睡眠波は、主に左中側頭葉から顕著でした。脳MRIでは、(i)左頭頂葉(中心回後)の限局性皮質異形成(FCD)と経マントル徴候(II型FCD)、(ii)右頭頂後頭接合部FCD、(iii)左側頭極FCDの多巣性異形成が明らかになった。陽電子放出断層撮影法(PET)は、MRI検査で信号異常(すなわちFCD)の病巣に対応する左頭頂葉、左側頭葉、および右頭頂後頭接合部に低代謝を示しました。患者は難治性てんかんと診断され、シャポーのステレオタイプな記号学とそれに続く強直性腕の硬直があり、近心前頭または島/時間的発症の可能性を示唆しています。広範な両側ステレオEEG(sEEG)探査は、前頭葉、帯状回、島、およびそれらの形成異常領域を対象として推奨されました。iEEG モニタリング中、患者は「chapeau de gendarme」を伴う典型的な発作を起こし、その後、びまん性脳波の発症を特徴とする右または左上肢の強直性挙上/屈曲が、両側の前島で最大になりました。多焦点IEDは、主に左右の前側頭葉と背外側前頭皮質(両側島を含む)で観察されました。iEEG記録で実施されたESIは、左右の背外側前頭皮質と前島で臨床的に定義されたSOZの位置を確認しました。
術前評価の一環として、MEG と HD-EEG の同時データに対するソースの特定が行われました。MEGおよびHD-EEGの記録は、両方の前頭側頭領域で頻繁なIEDを示しました。 図3A は、MEGデータとHD-EEGデータの両方におけるIEDの代表的な例を示しています。両方のモダリティからのトポグラフィーフィールドと潜在的なマッピングは、右前頭側頭領域に根底にある可能性のあるソースを示しました。ESIは、左右の前頭側頭葉と頭頂葉の領域を覆う双極子の散在するクラスターを示しました。MSIは、右島の近くに位置する右前頭側頭葉に双極子の焦点クラスターを示しました。EMSIは、iEEGゴールドスタンダードで実施されたESIに沿って、両側前頭側頭領域における双極子の焦点クラスターを示し、臨床観察を確認しました(図3C)。EMSIを通じて推定されたこれらの双極子は、iEEGで定義されたSOZからの平均距離が9.81mm(中央値:11.18、標準:2.37)であることを示しました。
ケース2: 難治性てんかんを患う13歳の男性が、9歳から発作を発症して入院しました。発作は前兆から始まり、その後、意識が保たれた状態で頭と目の左への偏位が続き、頭の焦点間が左に傾くと、~30秒間続き、週に数回発生しました。処方されたASMはいずれも発作制御を達成しませんでした。長期のビデオ脳波から、右半球では中側頭皮質、前頭側頭皮質、側頭皮質、および中心頭頂葉皮質を含む右後方側頭スパイクと頻繁なスパイク波放電が観察されました。患者は、行動の変化、左腕の伸展による頭/目の左への偏位、および時には左腕のクローン活動を特徴とする6回の電気臨床発作、および二次的な両側のけいれん活動を伴う3回の発作を特徴としていました。最大発症は右中側頭葉で、右前頭側頭葉で進化しました。脳MRIでは、右大脳半球の皮質の広範な奇形(シルビウス周囲が優勢)と、右側脳室のex真空拡張を伴う右大脳半球の軽度の体積減少が明らかになりました。患者は、右半球に発症する難治性てんかんと診断され、びまん性皮質奇形の領域での側頭およびシルビウス周囲発症を支持しました。ステレオEEGは、関与の程度を描くために実行され、電極を右側の側頭皮質、シルビアン周囲皮質、島皮質、および頭頂後頭皮質に配置しました。iEEG モニタリング中に、右前頭側頭葉の広い領域で最大の発症を示すいくつかの電気臨床的な限局性発作が捕捉されました。ESI は iEEG データで実施され、これらの発作を右側頭 (右中側頭回の近く) とシルビウス周囲領域の両方を含むより焦点の領域に特定しました。
術前評価の一環として、MEGとHD-EEGが同時に実施され、その間に患者は2回の発作を経験しました:1つはデジタル化プロセス中に木製の椅子に座っているとき、もう1つは実際の記録中にキャプチャされ、発症はMEGとHD-EEGの両方で見えました(図4A)。黄礁発症時のトポグラフィーフィールドとポテンシャルマップは、 図4Aに示すように、発作発症の根底にあるジェネレーターが右中側頭葉にある可能性があることを示しました。発作イベントに関するソースローカリゼーションは、ESIとMSIで異なる所見を示しました:ESIは右前頭側頭葉と中心頭葉に局在する双極子を示したのに対し、MSIは主に右側頭葉に高いクラスター性を示す双極子を示し(図4B)、前頭側頭皮質に追加の散在する双極子を示しました。これらのソリューションを組み合わせることにより、EMSIは、iEEGゴールドスタンダードのESIと一致する側頭葉内の発作発症の局在を明らかにしました(図4B)。特に、EMSIは、iEEGモニタリングで定義されたSOZからの平均距離12.21mm(中央値:13.62、標準:2.37)でローカリゼーション結果を示しました。
症例3:局在化関連特発性てんかんを患う15歳の女性が、13歳から発作を発症しましたが、振り返ってみると8歳から9歳まで、首の動きを繰り返すことによるチックと診断されました。患者は頭を少し左に傾け、時には運動亢進行動を伴う限局性認知障害発作(すなわち、全身性強直間代発作)や夜間のけいれん発作に進行しました。.いくつかのASMは、完全な発作制御を達成せずに投与されました。長期のビデオ脳波モニタリング中に、患者は、左後側頭葉で発症する二次的な全身化を伴う限局性電気臨床発作、頭を左に傾ける多数の短時間の焦点運動発作、および左頭頂葉で発症する微妙な電気検査発作を示しました。脳MRIでは急性頭蓋内異常は認められず、キアリI奇形を認めた。頭部の陽電子放出断層撮影-コンピューター断層撮影(PET-CT)検査は陰性でした。発作性単一光子放射CT(SPECT)、MEGとHD-EEGの同時検査、頸椎X線、頭頸部の磁気共鳴血管造影法(MRA)、そして最終的には左半球のsEEG探索などの追加の検査が推奨されました。
評価の一環として、患者は、一次視覚皮質、運動皮質、聴覚皮質、体性感覚皮質などの雄弁な脳領域をマッピングするためのMEGとHD-EEGの同時記録に参加しました。最初に、患者は視覚運動課題を実行し、続いて聴覚刺激と体性感覚刺激を行いました。視覚刺激に対する最初の皮質反応は、MEG と HD-EEG の両方で刺激開始後 ~70 ミリ秒で発生しました (図5A). 図5B は、MEGとHD-EEGの視覚刺激に関与する皮質位置のトポグラフィーフィールドと潜在的なマップをそれぞれ報告します。HD-EEGでは、脳後頭部領域を覆うチャネルの極性の変化が観察されましたが、MEGでは同じ領域でより複雑なフィールド分布が見られました(図5B).dSPMを使用したソースローカリゼーションにより、この時点でDesikan-Killianyアトラスの次の脳領域内の焦点皮質活動が明らかになりました:(i)MSIの楔;(ii)ESIの外側後頭皮質;(iii)EMSIの楔頭および外側後頭皮質(図5C).視覚皮質反応の時間-周波数解析により、MSI(おおよその範囲:30-50 Hz)、ESI(おおよその範囲:40-50 Hz)、およびEMSI(おおよその範囲:30-50 Hz)(図5D).運動誘発反応については、運動開始時に対側M1でミューリズム活動の抑制が観察されました(図6A).で 図6Bでは、運動課題中に活性化される脳領域のトポグラフィーフィールドと電位マップを、それぞれMEGとHD-EEGについて報告しました。MEGフィールドマップは、反対側の中枢脳領域における磁気流入と磁気流出の明確な変化を示しており、これは反対側のM1(図6B).HD-EEG電位マップは、同じ領域で焦点極性の変化を示し、電位は磁場に対して垂直でした(図6B).最大ソース活性化のピークは、MSI、ESI、および EMSI の Desikan-Killiany アトラスの対側前中心回でタッピングタスクを実行しているときに観察されました。 図6C.今後のタッピング動作の予測中に発生する運動関連の皮質反応は、MSI(おおよその範囲:20-30 Hz)とEMSI(おおよその範囲:20-40 Hz)のベータバンドとガンマバンド、およびESI(おおよそのレンジ:30-50 Hz)のガンマバンドのERSを示しました。 mu rhythm suppression (図6D).55,56 聴覚刺激に応答した聴覚誘発野と電位は、MEGとHD-EEGの刺激開始送達後~80 msおよび~120 msで最大の正のピークを示しました(図7A).で 図7Bでは、MEGとHD-EEGの聴覚刺激に関与する皮質位置のトポグラフィーフィールドと潜在的なマップをそれぞれ報告しました。MEGとHD-EEGの両方で、左の側頭脳領域を覆うセンサーで明確に定義された負の極と正の極性による明らかな極性変化が観察されました。これらの垂直磁場と電位マップは、V1(図7B).平均的な聴覚誘発場と電位で音源局在化を実行すると、MSI、ESI、およびEMSIのDesikan-Killianyアトラスの横側頭回と上側頭回の後部でそれぞれ最大の皮質活性化が観察されました(図7C).聴覚誘発反応の時間周波数解析により、MSIはガンマバンド(約範囲:40-60Hz)、EMSI(約レンジ:35-50Hz)、ESI(約35-50Hz)はベータバンドとガンマ周波数バンド(約25-60Hz)のERSが明らかになりました。図7D).最後に、MEGとHD-EEGについて、それぞれ刺激開始後~60ミリ秒と~50ミリ秒で触覚刺激に応答した最初の皮質活動を観察しました(図8A).で 図8Bでは、体性感覚刺激中に活性化された脳領域のトポグラフィーフィールドと、MEGとHD-EEGのポテンシャルマップをそれぞれ報告しました。MEGフィールドマップでは、反対側の頭頂部を覆うセンサーで磁束が明確に変化し、明確な極性変化が見られましたが、HD-EEG電位マップでは、同じ領域で極性の変化があまり目立たず、正極が負極よりも強いことが示されました。これらの垂直磁場および電位マップは、S1に焦点性皮質発生器があることを示している可能性があります。平均体性感覚誘発応答でdSPMを使用すると、この時点での最大皮質源活動は、MSI、ESI、およびEMSIのDesikan-Killianyアトラスの対側中心後回内で観察されました(図8C).触覚刺激に応答して、MSI(近似範囲:15-40Hz)およびEMSI(近似範囲:20-40Hz)のベータ周波数帯およびガンマ周波数帯のERS、およびESI(近似範囲:30-40Hz)のガンマ周波数帯(図8D)も観察された。
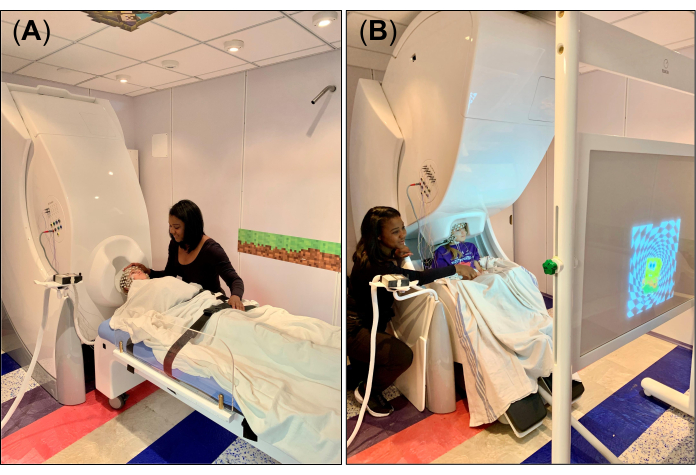
図1:CCHCSでのMEGとHD-EEGの同時実験セットアップ (A)HD-EEG(256チャンネル)およびMEG(306センサー)システムで、MEGのガントリーを仰臥位(90°、水平位置)に設定して、非磁性MEG対応ベッドを使用して安静/睡眠状態を記録します。技術者は、安全性と快適性を確保しながら、被験者(9歳の女の子)を録音用に準備しています。(B)非磁性MEG対応椅子を使用して座位で録画するように設定されたHD-EEG、MEGシステム。技術者は、視覚運動課題中に視覚刺激が投影される画面の前の被験者の正しい位置を確保しながら、記録のために被験者を準備しています。 この図の拡大版を表示するには、ここをクリックしてください。
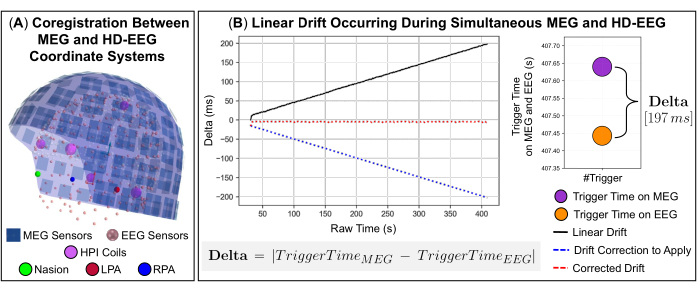
図2:異なる取得システムを使用して、MEGとHD-EEGの同時記録からのデータを組み合わせる技術的側面(A)代表的な被験者(9歳の少女)のMEGセンサーとHD-EEGセンサーの同じ座標系(被験者の頭部座標によって定義される)への空間アライメント(共レジストレーション)。被験者の頭部座標は、鼻(緑色)と左右の耳介前点(それぞれ赤色と青色)の基準点で表されます。306 MEGセンサー(青色)-102の磁力計と204の平面グラディオメーター-とヘッドポジションインジケーター(HPI)コイル(マゼンタ色)が表示されます。同じ座標系に整列すると、256のHD-EEGチャンネルも表示されます(ピンク色)。(B)左パネル:代表被験者(9歳の女の子)について、MEGシステムとHD-EEGシステム間で発生するデータサンプルの線形ドリフト(デルタ、黒線で表示)。デルタは、同じトリガーが MEG システムと EEG システムの両方に送信され、時間の経過とともに低値 (デルタ = 0 ミリ秒) から高値 (デルタ = 197 ミリ秒) まで連続的に増加する時間の差の絶対値として定義されます。信号に適用される多項式関数を使用して推定された線形ドリフトの補正は、青い破線で表示されます。MEGシステムとEEGシステム間の同期時間を表す補正ドリフト(時間経過によるデルタ~0ミリ秒)は、赤い破線で表示されます。右パネル:MEGシステムとEEGシステムの両方に送信された最後のトリガーで推定されたタイムシフト(デルタ= 197ミリ秒)のグラフ表現が表示されます。この図の拡大版を表示するには、ここをクリックしてください。
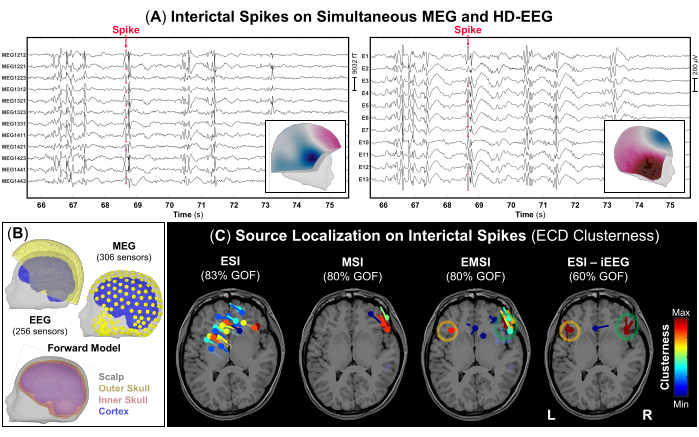
図3:MEGおよびHD-EEGデータ上の発作間欠性てんかん様放電(IED) (A)頻繁なIEDを持つ10歳の女性(ケース1)からの同時MEGおよびHD-EEG記録(10秒)の時間部分。306個のMEGセンサーと256個のEEG電極のサブグループは、視覚化の目的で選択されています。IEDのピークにあるトポグラフィーフィールドとポテンシャルマップは、それぞれMEGとHD-EEGの内部パネルとして表示されます。(B) 被験者の 3D 頭部と皮質 (青色) の表面に同時登録された MEG および HD-EEG センサー (黄色) の位置。被験者の術前MRIから再構築された3つの層[すなわち、頭皮(灰色)、外側頭蓋骨(黄色)、内側頭蓋骨(ピンク色)]からなる現実的な境界要素法(BEM)頭部モデル。(C) 等価電流双極子 (ECD) を使用して IED で実行されたソース位置特定クラスターネスの結果は、被験者の ESI、MSI、EMSI、および iEEG (ゴールド スタンダード) の ESI の術前 MRI で示されています (ゴールド スタンダード)52。適合度が >60% の双極子クラスターのヒート マップは、低い値 (青) から高い (赤) 値まで表示されます。iEEGデータに対して実施されたESIによって定義された発作発症ゾーンは、ゴールドスタンダードと見なされました(オレンジと緑の円)。 この図の拡大版を表示するには、ここをクリックしてください。
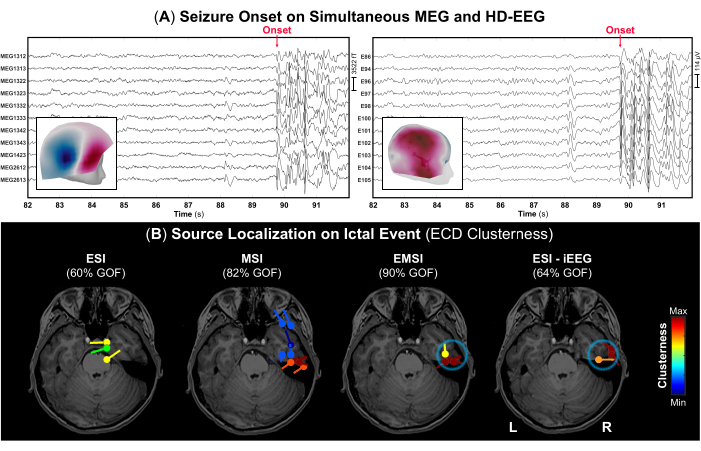
図4:MEGおよびHD-EEGデータによる発作発症 (A)13歳男性(ケース2)の発作発症時(赤矢印)のMEGとHD-EEGの同時記録(10秒)の時間部分。306個のMEGセンサーと256個のEEG電極のサブグループは、視覚化の目的で選択されています。黄疸発症時のトポグラフィーフィールドとポテンシャルマップは、それぞれMEGとHD-EEGの内部パネルとして表示されます。(B)等価電流双極子(ECD)法を使用して発作イベントの開始時に実施されたソースローカリゼーションクラスターネスの結果は、ESI、MSI、EMSI、およびiEEG(ゴールドスタンダード)52のESIの被験者の術前MRIに示されています。適合度が >60% の双極子クラスターのヒート マップは、低い値 (青) から高い (赤) 値まで表示されます。iEEGデータに対して実施されたESIによって定義された発作発症ゾーンは、ゴールドスタンダードと見なされました(青い丸)。 この図の拡大版を表示するには、ここをクリックしてください。
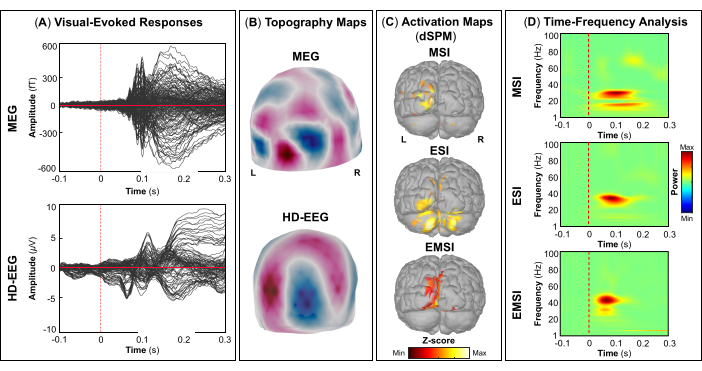
図5:MEGおよびHD-EEGデータからの視覚誘発フィールドと電位 (A)-100ミリ秒から300ミリ秒の時間間隔で、MEG(上パネル)とHD-EEG(下パネル)に対する15歳女性の平均視覚誘発反応が表示されます。 (B)MEGとHD-EEGについて、主要な視覚野のトポグラフィーフィールドと電位マップが表示されます。 それぞれ。(C)MSI、ESI、およびEMSIの動的統計的パラメトリックマッピング(dSPM)法を使用して推定されたDesikan-Killianyアトラスの脳領域(すなわち、楔および外側後頭皮質)における皮質活性化の最大振幅を持つソース活性化マップ。ソースアクティベーション(dSPM正規化zスコア)のヒートマップが表示されます。(D)一次視覚野の視覚誘発応答に対するMorletウェーブレット時間-周波数分解を用いて得られた時間周波数マップを-100msから300msの時間ウィンドウで表示する。時間-周波数電力のヒート マップは、ベースライン [-200; 0] ミリ秒上の平均からの正規化データの偏差に基づいてパーセンテージで表されます。 この図の拡大版を表示するには、ここをクリックしてください。
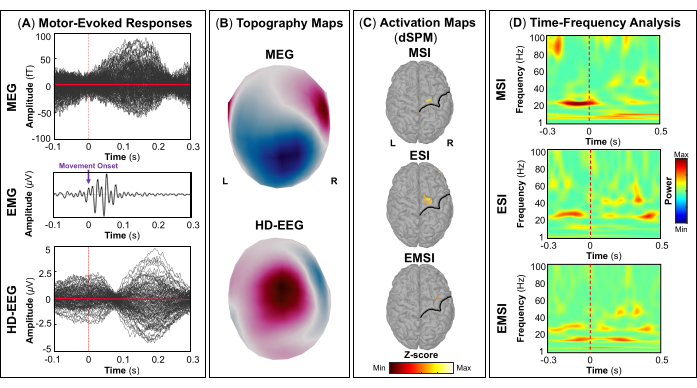
図6:MEGおよびHD-EEGデータからの運動誘発電界と電位 (A)15歳女性のMEG(上面)およびHD-EEG(下面)に対する平均運動誘発反応は、-100〜300ミリ秒の時間間隔で左のインデックスタッピングタスクに対して表示されます。筋電図(EMG)信号(中央パネル)と動きの開始(紫色の矢印)は、-100ミリ秒から300ミリ秒の時間間隔で表示されます。信号は30〜300Hzの周波数帯域でフィルタリングされます(ノッチフィルター:60Hz)。(B)MEGとHD-EEGについて、一次運動野のトポグラフィーフィールドとポテンシャルマップをそれぞれ表示します。(C)MSI、ESI、およびEMSIの動的統計的パラメトリックマッピング(dSPM)法を使用して推定されたDesikan-Killianyアトラスの反対側前中心回における皮質活性化の最大振幅を持つソース活性化マップ。ソース活性化のヒートマップ(dSPM正規化zスコア)が、中央溝(黒線)とともに表示されます。(D)-300 msから500 msの時間ウィンドウにおける一次運動皮質での運動誘発応答に対するMorletウェーブレット時間-周波数分解を使用して得られた時間-周波数マップ。時間-周波数電力のヒート マップは、ベースライン [-1500; -1000] ミリ秒上の平均からの正規化データの偏差に基づいてパーセンテージで表されます。 この図の拡大版を表示するには、ここをクリックしてください。
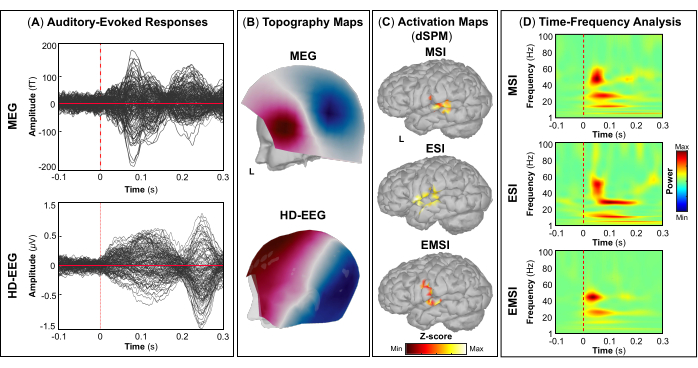
図7:MEGおよびHD-EEGデータからの聴覚誘発フィールドと電位。 (A)15歳女性のMEG(上面)とHD-EEG(下面)の聴力誘発反応の平均を-100msから300msの時間間隔で表示。(C)MSI、ESI、およびEMSIの動的統計パラメトリックマッピング(dSPM)法を使用して推定されたDesikan-Killianyアトラスの横側頭回および上側頭回の後部における皮質活性化の最大振幅を持つソース活性化マップ。ソースアクティベーション(dSPM正規化zスコア)のヒートマップが表示されます。(D)-100〜300ミリ秒の時間ウィンドウにおける一次聴覚皮質での聴覚誘発応答に対するモーレットウェーブレット時間-周波数分解を使用して取得された時間周波数マップ。時間-周波数電力のヒート マップは、ベースライン [-500; 0] ミリ秒上の平均からの正規化データの偏差に基づいてパーセンテージで表されます。この図の拡大版を表示するには、ここをクリックしてください。
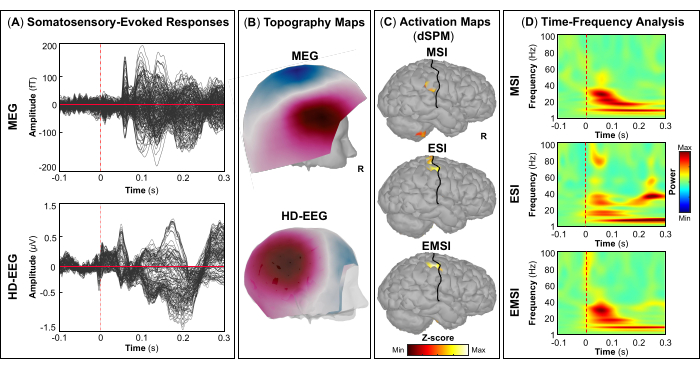
図8:MEGおよびHD-EEGデータからの体性感覚誘発フィールドと電位 (A)-100〜300ミリ秒の時間間隔での左指の刺激について、15歳女性のMEG(上面)およびHD-EEG(下面パネル)の平均体性感覚誘発反応が表示されます。 (B)MEGおよびHD-EEGについては、トポグラフィーフィールドと一次体性感覚皮質の電位マップが表示されます。 それぞれ。(C)MSI、ESI、およびEMSIの動的統計パラメトリックマッピング(dSPM)法を使用して推定されたDesikan-Killianyアトラスの反対側中央回における皮質活性化の最大振幅を持つソース活性化マップ。ソース活性化のヒートマップ(dSPM正規化zスコア)が、中央溝(黒線)とともに表示されます。(D)-100 msから300 msの時間枠における一次体性感覚皮質における体性感覚誘発応答に対するMorletウェーブレット時間-周波数分解を用いて得られた時間周波数マップ。時間-周波数電力のヒートマップは、ベースライン[-100; 0]ミリ秒上の平均からの正規化データの偏差に基づいてパーセンテージで表されます。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
本研究では、DREの小児において、安静時/就寝時、タスク実行時、または刺激を受けているときに、MEGとHD-EEGを同時に記録する実験設定を示し、EMSIおよび個々のMSIおよびESIを使用して、刺激性ゾーン、SOZ、および雄弁な脳領域を特定するための方法論的フレームワークを提案します。さらに、独自の機能を持つさまざまな市販製品からのMEGデータとHD-EEGデータを統合するための技術的な推奨事項を提供します。てんかん原性および雄弁な脳領域の局在化におけるEMSIの臨床的有用性を強化するために、3つの症例からのデータを提示します。ここでの知見は、EMSIの結果が、いずれかのモダリティのみで得られた結果よりも優れていることを示しています。これは、おそらく、結合されたソリューションにおけるMEG信号とEEG信号の相補的な特性の相加的な値によるものと、データの記録に使用されるセンサーの数の増加(>550個のセンサー)によるものです。特に、EMSI は、iEEG ゴールド スタンダードで ESI と一致する所見を持つ刺激性および SOZ を非侵襲的に局在化し、臨床観察を確認しました。
提案された方法論には、次の重要なステップが含まれます:(i)脳全体をカバーするセンサー(>550センサー)の高空間サンプリングによるMEGおよびHD-EEG(つまり、高SNR)記録の高品質取得 発作間欠性および発作性活動、ならびに視覚、運動、聴覚、および体性感覚誘発フィールドと電位、DREの子供からの(ステップ3.1-3.2)。(ii)異なる取得システムで記録されたMEG信号とHD-EEG信号の時間的同期と空間的同時登録(ステップ3.12)。(iii)発作間欠性活動(ステップ4.1.1-4.1.7)、発作性発症活動(ステップ4.2.1-4.2.7)、およびイベント関連の応答(ステップ4.3.1-4.3.6)をそれぞれ含むデータ部分の慎重な前処理と選択。(iv)信頼性の高いソースローカリゼーション方法(例:クラスタリングとdSPMを備えたECD)を使用して、刺激性ゾーン、SOZ、および雄弁な脳の関心のある領域の正確なソースローカリゼーション(ステップ4.1.8-4.1.9、4.2.8-4.2.9、および4.3.7-4.3.9、それぞれ)。
MEGとHD-EEGの同時記録を実行する際の最も重要なステップは、2つの取得システムによって記録されたデータを空間的(座標空間間の位置合わせ)と時間的(線形クロックドリフトの補正)に同期させることです。このような同期は、MEG信号とHD-EEG信号で同時に発生する発作間欠性、発作時、視覚/運動/聴覚/触覚のイベントを正しく識別するために重要です。これらのイベントのタイムポイント選択の誤りは、ソースローカリゼーションの結果に影響を与え、これらのイベントの生成に必ずしも関与していない脳の領域を特定する可能性があります。
MEGシステムは、多くの場合、MEGとEEGの同時測定を実行するために、互換性のある32、64、および128チャネルのEEGシステムを製品に組み込んでいます。このような場合、共通のトリガー信号を送信してデータを一時的に同期する必要はありません。同様に、ほとんどの脳波システムは、今日ではすべてのMEGシステムと互換性があります。このようなハードウェアの進歩にもかかわらず、術前評価の一環としてMEGとHD-EEGの同時記録を行っているてんかんセンターはごくわずかです。ここでは、このような積分性を活かして、306チャンネルの脳磁図と256チャンネルの脳波計を組み合わせて、被験者の頭部を覆う>550センサーで脳活動を同時に記録しました。これまでのところ、MEG、HD-EEG、およびiEEGデータの高度な分析のためのソフトウェア(Brainstorm、CURRY、EEGLab、FieldTrip、MNE、NUTMEGなど)はほとんど利用できません。したがって、提案された方法論を新しいニューロイメージング解析ソフトウェアで検証するには、将来の研究が必要です。最後に、MSIとESIを独自のソリューション(EMSI)に組み合わせた結果、データ分析の計算の複雑さが増しました。
説明されている方法は、将来の研究で対処すべきいくつかの制限を示しています。2 つの代表的な患者の MEG データと HD-EEG データの両方で発生する IED を手動で選択し、2 つの信号 (MEG または EEG) の 1 つだけで発生した発作間欠スパイクは無視しました。スパイクの手動選択は、時間がかかり主観的なアプローチになる可能性がありますが、過去数十年間に開発されたIEDを検出するための自動化されたアプローチを使用して簡素化できます57,58,59.ただし、各IEDの慎重な分析と精密な検出のためには、常に目視検査が推奨されます。さらに、EZの近似値としてSOZを使用しました。しかし、SOZは必ずしも手術の結果を予測するわけではありません60,61,62,63.したがって、将来の研究では、手術結果をEZのより正確な描写のためのグラウンドトゥルースとして使用できます13,14,15,16,17,19,20.ただし、発作はMEGとEEGを同時に使用して成功裏に捕捉し、適切なソースローカリゼーション技術を使用してローカライズできます44,64、臨床診療、特にASMの外来患者からこのような発作イベントを記録することは比較的まれです。これは主に、MEG記録の期間が限られていることや、発作中に発生する過度の体の動き(例:患者の頭がデュワーから滑り落ちる)によるもので、生物学的アーチファクトを引き起こし、ソースの局在所見に深刻な影響を与える可能性があります。最近のレビューでは、Stefanらが. 患者の 7% から 24% で MEG 記録中に発作が発生し、さまざまな研究で平均記録時間は 30 分から 5.7 時間でした65.CCMCでは、89人中18人(20.2%)の患者が、過去~2年以内にMEGとHD-EEGの同時記録中に発作イベントがキャプチャされました。しかし、18人の患者のうち8人(44.4%)のみが成功裏に分析されました。発作間欠MEG記録が正常または決定的でない所見を示している場合、発作性MEGまたはHD-EEGを使用してEZを高精度で位置特定できます。しかし、これらの録音の技術的および物流上の要件に対処する必要があります。さらに、EMSI による雄弁な皮質局在の代表的なデータは、非侵襲的 fMRI や術中皮質刺激など、これらの機能的な脳領域の局在化に関するゴールド スタンダードと比較されませんでした。したがって、さらなる研究により、EMSIとfMRIをマルチモーダル非侵襲的イメージングツールに統合して、DREの子供におけるこれらの雄弁な脳領域の局在化精度を向上させる可能性があります。この作業は、言語雄弁領域などの他の機能的な脳領域をローカライズするために拡張することもできます。言語機能のローカリゼーションは、DRE患者の手術前評価において、外科的候補を決定し、外科的切除の範囲を計画し、術後の永続的な機能障害を予防するために非常に重要です66.いくつかの非侵襲的研究は、MEGを使用した言語マッピングが、主要な言語半球を識別するためのゴールドスタンダードと見なされることが多い侵襲的な和田テストと同様に、一致する結果を提供できることを示しています67,68,69,70.最近の研究では、さまざまな技術の組み合わせ (つまり、皮質刺激マッピング、高ガンマ線電気皮質検査、fMRI、および経頭蓋磁気刺激) が、術前の言語マッピングのための相互、確認、および補完的な情報を提供できるマルチモーダル アプローチが提案されています71.これらの利点にもかかわらず、年齢による認知、知的、言語の障壁を持つ小児患者にとって、言語領域のマッピングは依然として困難です。したがって、近い将来、より年齢に特化したタスクと子供に優しいセットアップが開発されるはずです。本研究では、臨床目的で認定されていないソフトウェアを用いて、MEGおよびHD-EEGのデータを解析しました。これらのツールは価値があり効果的であることが証明されていますが、臨床使用のために術前評価結果を報告する際に考慮すべき責任の問題があります。ここでは、スポンジベースの脳波電極システムのみを使用したHD-EEG記録の手順について説明します。ゲルベースのEEG電極を使用する代替システムは、臨床と研究の両方の環境で広く使用されています。より高いSNR脳波記録を提供しますが、より長い準備時間(40~60分)を必要とするため、小児での使用にはあまり適していません。あるいは、いくつかの研究室では、MEG記録中に低密度ゲルベースのEEGシステムを使用しており、これは準備時間の点で(HD-EEGシステムと比較して)有利ですが、頭皮全体をカバーする電極の数が減少するため、空間分解能が大幅に低下します12,16,72,73.
現在、てんかん患者におけるてんかん原性脳領域の局在化は、主に iEEG モニタリングによって達成されています。さらに、雄弁な脳領域の正確な位置を特定するための方法論は十分に定義されておらず、現在MEGラボで使用されている実験セットアップは小児患者には不適切であり、この目的でのHD-EEGの使用は非常に限られています。これらの領域の正確なローカリゼーションは、術前評価を容易にし、切除または iEEG 電極留置のための手術計画を増強する可能性があります。これまでのところ、いくつかの研究では、EZ 12,13,14,15,16,17,18,19 および体性感覚皮質の雄弁な領域41 の同定のための、DRE および限局性てんかん患者の術前評価における ESI または MSI の寄与を調査しましたそれぞれ。EMSI を使用した場合、MSI または ESI 単独と比較して、より優れたソースローカリゼーション結果と結果予測パフォーマンスを示した研究はほとんどありません 13,31,42。これらの知見にもかかわらず、脳磁図と脳波の記録が同時に行われることはほとんどなく、MSIとESIが実施されているのは世界中のごく一部のてんかんセンターに限られています。私たちの知る限り、これは、MEG と HD-EEG の同時データを収集および分析するための提案を提供する最初の研究であり、刺激性ゾーン、SOZ、および雄弁な脳領域、すなわち一次視覚、運動、聴覚、および体性感覚皮質の非侵襲的同定のために小児てんかんで EMSI を実行します。
ここでは、DREの2人の患者(症例1および2)からの同時非侵襲的データで検出された発作間欠スパイクおよび発作時イベントに対してEMSIを実行し、以前の研究42に沿って、SOZからそれぞれ~9mmおよび~12mmのソース局在誤差を達成しました。驚くべきことに、このような方法は、頭蓋内所見(すなわち、iEEGデータ上のESI)に匹敵する局在精度を達成し、脳領域に局在するクラスター化された双極子は、臨床観察によっててんかん原性として特定されました(図3Cおよび図4B)。DREの3番目の代表的な患者(ケース3)からの非侵襲的データを使用して、視覚、運動、聴覚、および体性感覚誘発活動に対してEMSIも実施し、対応する雄弁な脳領域(すなわち、視覚、運動、聴覚、および体性感覚皮質)で顕著なソース活性化パターンを見つけました(図5C、図6C、図7C、および図8C)。
私たちの結果は、MEGモダリティとEEGモダリティから取得された補完的な情報の融合から導き出され、ローカリゼーションの精度を向上させる可能性があります。脳波はすべての頭蓋内電流を反映することがよく知られているが、脳磁図は主に接線源に敏感で、脳深部源には盲目である29,74。したがって、この研究で示されたように、MEGとEEGを組み合わせると、各モダリティの限界を克服し、優れたローカリゼーション結果を提供し、ESIまたはMSIが単独で使用すると見逃した可能性のあるてんかん原性で雄弁な脳領域を特定できます。さらに、術前評価中にfMRIを受けなかった患者でEMSIを使用して雄弁な脳領域をマッピングするための代替の非侵襲的アプローチを提示します。
MEGとEEGの同時技術などの非侵襲的技術を使用しててんかん原性および雄弁な脳領域を局在化することは、雄弁な皮質領域を維持しながらEZを完全に除去または切断するためのDREの子供の術前評価における重要なステップです。提案手法は、脳磁図と脳波の同時データの取得と解析を詳細に説明しており、術前てんかんの評価だけでなく、認知神経科学への応用を支え、定型発達の小児と健常成人の健康な脳の生理機能、てんかんなどの神経疾患に伴う脳の形態学的・機能的変化を探究することを可能にします。てんかん原性脳ネットワークを調査する将来の研究では、MEGおよびHD-EEGの同時データに対してEMSIを使用して非侵襲的に推定されたネットワークハブ(すなわち、高度に接続された脳領域)が、MSIおよび/またはESIのみを使用して推定されたものよりもDREの子供のEZをより正確に位置特定できるかどうかも評価できる可能性があります75,76,77.さらに、EMSIを通じて推定されたスパイクとリップルの時空間伝播(つまり、高周波振動、>80Hz)の非侵襲的マッピングは、てんかん様活動の伝播の病態生理学的メカニズムをよりよく理解し、EZ78,79の正確なバイオマーカーであるこれらの伝播の開始ジェネレーターを非侵襲的に評価するのに役立ちます.提示されたプロトコルは、異なる向きのソースに対するMEGおよびEEGセンサーアレイの感度を調べることにより、MEGおよびEEGシステムの相補性をさらに調査するのに役立つ可能性があります。このような分析は、MEGとHD-EEGを同時に実行しながら、脳の電気生理学的特性に関する洞察を提供する可能性があります。
開示事項
著者らは開示を報告していません。
謝辞
この研究は、国立神経疾患および脳卒中研究所(R01NS104116;R01NS134944;研究代表者:Christos Papadelis)。
資料
| Name | Company | Catalog Number | Comments |
| AIRSTIM unit | SD Instruments | N/A | The SDI AIRSTIM system is an alternative unconditioned stimulus to shock |
| Baby Shampoo | Johnson's | N/A | Baby Shampoo is as gentle to the eyes as pure water and is specially designed to gently cleanse baby’s delicate hair and scalp. |
| Control III disinfectant cleaning solution | Maril Products, Inc. | http://www.controlthree.com/ | Disinfectant and germicide solution formulated for hospitals |
| Elekta Neuromag | TRIUX | NM24132A | Comprehensive bioelectromagnetic measurement system characterized by 306-channel neuromagnetometer for functional brain studies |
| FASTRAK | Polhemus technology | NS-7806 | Using A/C electromagnetic technology, FASTRAK delivers accurate position and orientation data, with virtually no latency. With a single magnetic source, FASTRAK delivers data for up to four sensors. The source emits an electromagnetic field, sensors within the field of range are tracked in full 6DOF (6 Degrees-Of-Freedom). Setup is simple and intuitive, with no user calibration required. |
| Genuine Grass Reusable Cup EEG Electrodes | Natus Medical, Inc. | N/A | Each Genuine Grass EEG Electrode undergoes rigorous mechanical and electrical testing to assure long life for unsurpassed recording clarity and dependability. |
| Geodesic Sensor Net | Electrical Geodesics, Inc. | S-MAN-200-GSNR-001 | 32 to 256 electrodes to place on the human head to aquire dense-array electroencephalography data |
| GeoScan Sensor Digitization System | Electrical Geodesics, Inc. | 8100550-03 | Handheld Scanner and Software for 3D electrode position registration |
| Natus Xltek NeuroWorks | Natus Medical, Inc. | https://natus.com/ | The Natus NeuroWorks platform simplifies the process of collecting, monitoring and managing data for routine EEG testing, ambulatory EEG, long-term monitoring, ICU monitoring, and research studies. |
| Natus NeuroWorks EEG Software | Natus Medical, Inc. | https://natus.com/neuro/neuroworks-eeg-software/ | NeuroWorks EEG software simplifies the process of collecting, monitoring, trending and managing EEG testing data, allowing care providers to save time and focus on delivering the best care. |
| ROSA ONE Brain | Zimmer Biomet | https://www.zimmerbiomet.com/en/products-and-solutions/zb-edge/robotics/rosa-brain.html | ROSA ONE Brain is a robotic solution to assist surgeons in planning and performing complex neurosurgical procedures through a small drill hole in the skull. |
| Ten20 Conductive Paste | Weaver and company | N/A | Ten20 contains the right balance of adhesiveness and conductivity, enabling the electrodes to remain in place while allowing the transmittance of electrical signals. |
参考文献
- Oldham, M. S., Horn, P. S., Tsevat, J., Standridge, S. Costs and clinical outcomes of epilepsy surgery in children with drug-resistant epilepsy. Pediatr Neurol. 53 (3), 216-220 (2015).
- Willie, J. T., et al. Real-time magnetic resonance-guided stereotactic laser amygdalohippocampotomy for mesial temporal lobe epilepsy. Neurosurgery. 74 (6), 569-584 (2014).
- Rosenow, F., Lüders, H. Presurgical evaluation of epilepsy. Brain. 124, Pt 9 1683-1700 (2001).
- Önal, Ç, et al. Complications of invasive subdural grid monitoring in children with epilepsy). J Neurosurg. 98 (5), 1017-1026 (2003).
- Hader, W. J., et al. Complications of epilepsy surgery-a systematic review of focal surgical resections and invasive EEG monitoring. Epilepsia. 54 (5), 840-847 (2013).
- Meng, Y., et al. Risk factors for surgical site infection after intracranial electroencephalography monitoring for epilepsy in the pediatric population. J Neurosurg Pediatr. 22 (1), 31-36 (2018).
- Jobst, B. C., et al. Intracranial EEG in the 21st Century. Epilepsy Curr. 20 (4), 180-188 (2020).
- Schwartz, E. S., et al. Magnetoencephalography for pediatric epilepsy: how we do it. AJNR Am J Neuroradiol. 29 (5), 832-837 (2008).
- Michel, C. M., et al. Electric source imaging of human brain functions. Brain Res Rev. 36 (2-3), 108-118 (2001).
- Michel, C. M., He, B. EEG source localization. Handb Clin Neurol. 160, 85-101 (2019).
- Michel, C. M., Brunet, D. EEG source imaging: A practical review of the analysis steps. Front Neurol. 10, 325(2019).
- Plummer, C., et al. Interictal and ictal source localization for epilepsy surgery using high-density EEG with MEG: a prospective long-term study. Brain. 142 (4), 932-951 (2019).
- Duez, L., et al. Electromagnetic source imaging in presurgical workup of patients with epilepsy: A prospective study. Neurology. 92 (6), e576-e586 (2019).
- Mouthaan, B. E., et al. Diagnostic accuracy of interictal source imaging in presurgical epilepsy evaluation: A systematic review from the E-PILEPSY consortium. Clin Neurophysiol. 130 (5), 845-855 (2019).
- Pellegrino, G., et al. Clinical yield of magnetoencephalography distributed source imaging in epilepsy: A comparison with equivalent current dipole method. Hum Brain Mapp. 39 (1), 218-231 (2018).
- Tamilia, E., et al. Assessing the localization accuracy and clinical utility of electric and magnetic source imaging in children with epilepsy. Clin Neurophysiol. 130 (4), 491-504 (2019).
- Coito, A., et al. Interictal epileptogenic zone localization in patients with focal epilepsy using electric source imaging and directed functional connectivity from low-density EEG. Epilepsia Open. 4 (2), 281-292 (2019).
- Singh, J., Ebersole, J. S., Brinkmann, B. H. From theory to practical fundamentals of electroencephalographic source imaging in localizing the epileptogenic zone. Epilepsia. 63 (10), 2476-2490 (2022).
- Brodbeck, V., et al. Electrical source imaging for presurgical focus localization in epilepsy patients with normal MRI. Epilepsia. 51 (4), 583-591 (2010).
- Santalucia, R., et al. Clinical added value of interictal automated electrical source imaging in the presurgical evaluation of MRI-negative epilepsy: A real-life experience in 29 consecutive patients. Epilepsy Behav. 143, 109229(2023).
- Schneider, F., et al. Magnetic source imaging in non-lesional neocortical epilepsy: additional value and comparison with ICEEG. Epilepsy Behav. 24 (2), 234-240 (2012).
- Hämäläinen, M., Hari, R., Ilmoniemi, R. J., Knuutila, J., Lounasmaa, O. V. Magnetoencephalography-theory, instrumentation, and applications to noninvasive studies of the working human brain. Rev Mod Phys. 65, 413-497 (1993).
- Baillet, S., Mosher, J. C., Leahy, R. M. Electromagnetic brain mapping. IEEE Signal Process Mag. 18 (6), 14-30 (2001).
- Fuchs, M., Kastner, J., Tech, R., Wagner, M., Gasca, F. MEG and EEG dipole clusters from extended cortical sources. Biomed Eng Lett. 7 (3), 185-191 (2017).
- Singh, S. P. Magnetoencephalography: Basic principles. Ann Indian Acad Neurol. 17, Suppl 1 S107-S112 (2014).
- Ahlfors, S. P., Han, J., Belliveau, J. W., Hämäläinen, M. S. Sensitivity of MEG and EEG to source orientation. Brain Topogr. 23, 227-232 (2010).
- Kim, H., Chung, C. K., Hwang, H. Magnetoencephalography in pediatric epilepsy. Korean J Pediatr. 56 (10), 431-438 (2013).
- Gorjan, D., Gramann, K., De Pauw, K., Marusic, U. Removal of movement-induced EEG artifacts: Current state of the art and guidelines. J Neural Eng. , (2022).
- Barkley, G. L., Baumgartner, C. MEG and EEG in epilepsy. J Clin Neurophysiol. 20 (3), 163-178 (2003).
- Ebersole, J. S., Ebersole, S. M. Combining MEG and EEG source modeling in epilepsy evaluations. J Clin Neurophysiol. 27 (6), 360-371 (2010).
- Yoshinaga, H., et al. Benefit of simultaneous recording of EEG and MEG in dipole localization. Epilepsia. 43 (8), 924-928 (2002).
- Baumgartner, C. Controversies in clinical neurophysiology. MEG is superior to EEG in the localization of interictal epileptiform activity: Con. Clin Neurophysiol. 115 (5), 1010-1020 (2004).
- Barkley, G. L. Controversies in neurophysiology. MEG is superior to EEG in localization of interictal epileptiform activity: Pro. Clin Neurophysiol. 115 (5), 1001-1009 (2004).
- Braeutigam, S. Magnetoencephalography: Fundamentals and established and emerging clinical applications in radiology. ISRN Radiol. 2013, 529463(2013).
- Papadelis, C., et al. Current and emerging potential for magnetoencephalography in pediatric epilepsy. J Pediatr Epilepsy. 2 (1), 73-85 (2013).
- Fiedler, P., Fonseca, C., Supriyanto, E., Zanow, F., Haueisen, J. A high-density 256-channel cap for dry electroencephalography. Hum Brain Mapp. 43 (4), 1295(2022).
- Sharon, D., Hämäläinen, M. S., Tootell, R. B. H., Halgren, E., Belliveau, J. W. The advantage of combining MEG and EEG: comparison to fMRI in focally-stimulated visual cortex. Neuroimage. 36 (4), 1225(2007).
- Pataraia, E., Lindinger, G., Deecke, L., Mayer, D., Baumgartner, C. Combined MEG/EEG analysis of the interictal spike complex in mesial temporal lobe epilepsy. Neuroimage. 24 (3), 607-614 (2005).
- Ahmed Mahmutoglu, M., Rupp, A., Baumgärtner, U. Simultaneous EEG/MEG yields complementary information of nociceptive evoked responses. Clin Neurophysiol. 143, 21-35 (2022).
- Aydin, Ü, et al. Combined EEG/MEG can outperform single modality EEG or MEG source reconstruction in presurgical epilepsy diagnosis. PLoS One. 10 (3), e0118753(2015).
- Bast, T., et al. Combined EEG and MEG analysis of early somatosensory evoked activity in children and adolescents with focal epilepsies. Clin Neurophysiol. 118 (8), 1721-1735 (2007).
- Chikara, R. K., et al. Electromagnetic source imaging predicts surgical outcome in children with focal cortical dysplasia. Clin Neurophysiol. 153, 88-101 (2023).
- Hari, R., et al. IFCN-endorsed practical guidelines for clinical magnetoencephalography (MEG). Clin Neurophysiol. 129 (8), 1720-1747 (2018).
- Bagić, A. I., Knowlton, R. C., Rose, D. F., Ebersole, J. S. American Clinical Magnetoencephalography Society Clinical Practice Guideline 1: Recording and analysis of spontaneous cerebral activity. J Clin Neurophysiol. 28 (4), 348-354 (2011).
- Papadelis, C., Chen, Y. H. Pediatric magnetoencephalography in clinical practice and research. Neuroimaging Clin N Am. 30 (2), 239-248 (2020).
- De Macedo Rodrigues, K., et al. A FreeSurfer-compliant consistent manual segmentation of infant brains spanning the 0-2 year age range. Front Hum Neurosci. 9, 21(2015).
- Tadel, F., Baillet, S., Mosher, J. C., Pantazis, D., Leahy, R. M. Brainstorm: A user-friendly application for MEG/EEG analysis. Comput Intell Neurosci. 2011, 879716(2011).
- Kane, N., et al. A revised glossary of terms most commonly used by clinical electroencephalographers and updated proposal for the report format of the EEG findings. Revision 2017. Clin Neurophysiol Pract. 2, 170-185 (2017).
- Lantz, G., et al. Propagation of interictal epileptiform activity can lead to erroneous source localizations: a 128-channel EEG mapping study. J Clin Neurophysiol. 20 (5), 311-319 (2003).
- Vorwerk, J., et al. A guideline for head volume conductor modeling in EEG and MEG. Neuroimage. 100, 590-607 (2014).
- Schrader, S., et al. DUNEuro-A software toolbox for forward modeling in bioelectromagnetism. PLoS One. 16 (6), e0252431(2021).
- Ntolkeras, G., et al. Presurgical accuracy of dipole clustering in MRI-negative pediatric patients with epilepsy: Validation against intracranial EEG and resection. Clin Neurophysiol. 141, 126-138 (2022).
- David, O., Kilner, J. M., Friston, K. J. Mechanisms of evoked and induced responses in MEG/EEG. Neuroimage. 31, 1580-1591 (2006).
- Pantev, C. Evoked and induced gamma-band activity of the human cortex. Brain Topogr. 7 (4), 321-330 (1995).
- Fox, N. A., et al. Assessing human mirror activity with EEG mu rhythm: A meta-analysis. Psychol Bull. 142 (3), 291-313 (2016).
- Genzer, S., Ong, D. C., Zaki, J., Perry, A. Mu rhythm suppression over sensorimotor regions is associated with greater empathic accuracy. Soc Cogn Affect Neurosci. 17 (9), 788-801 (2022).
- Janmohamed, M., et al. Moving the field forward: detection of epileptiform abnormalities on scalp electroencephalography using deep learning-clinical application perspectives. Brain Commun. 4 (5), 218(2022).
- Bagheri, E., Jin, J., Dauwels, J., Cash, S., Westover, M. B. A fast machine learning approach to facilitate the detection of interictal epileptiform discharges in the scalp electroencephalogram. J Neurosci Methods. 326, 108362(2019).
- Thomas, J., et al. Automated detection of interictal epileptiform discharges from scalp electroencephalograms by convolutional neural networks. Int J Neural Syst. 30 (11), 2050030(2020).
- Zijlmans, M., Zweiphenning, W., van Klink, N. Changing concepts in presurgical assessment for epilepsy surgery. Nat Rev Neurol. 15 (10), 594-606 (2019).
- Akiyama, T., et al. Focal resection of fast ripples on extraoperative intracranial EEG improves seizure outcome in pediatric epilepsy. Epilepsia. 52 (10), 1802-1811 (2011).
- Duncan, J. S., Winston, G. P., Koepp, M. J., Ourselin, S. Brain imaging in the assessment for epilepsy surgery. Lancet Neurol. 15 (4), 420(2016).
- Jacobs, J., et al. High-frequency electroencephalographic oscillations correlate with outcome of epilepsy surgery. Ann Neurol. 67 (2), 209-220 (2010).
- Ricci, L., et al. Virtual implantation using conventional scalp EEG delineates seizure onset and predicts surgical outcome in children with epilepsy. Clin Neurophysiol. 139, 49-57 (2022).
- Stefan, H., Rampp, S. Interictal and Ictal MEG in presurgical evaluation for epilepsy surgery. Acta Epileptologica. 2, 11(2020).
- Jahangiri, F. R., Chima, G. S., Pearson, M., Jackson, J., Siddiqui, A. A. Mapping of the language cortex. Cureus. 13 (5), e14960(2021).
- Merrifield, W. S., Simos, P. G., Papanicolaou, A. C., Philpott, L. M., Sutherling, W. W. Hemispheric language dominance in magnetoencephalography: sensitivity, specificity, and data reduction techniques. Epilepsy Behav. 10 (1), 120-128 (2007).
- Wheless, J. W., et al. Magnetoencephalography (MEG) and magnetic source imaging (MSI). Neurologist. 10 (3), 138-153 (2004).
- Breier, J. I., Simos, P. G., Zouridakis, G., Papanicolaou, A. C. Lateralization of activity associated with language function using magnetoencephalography: a reliability study. J Clin Neurophysiol. 17 (5), 503-510 (2000).
- Pataraia, E., Baumgartner, C., Lindinger, G., Deecke, L. Magnetoencephalography in presurgical epilepsy evaluation. Neurosurg Rev. 25 (3), 141-159 (2002).
- Babajani-Feremi, A., et al. Language mapping using high gamma electrocorticography, fMRI, and TMS versus electrocortical stimulation. Clin Neurophysiol. 127 (3), 1822-1836 (2016).
- Brodbeck, V., et al. Electroencephalographic source imaging: a prospective study of 152 operated epileptic patients. Brain. 134, Pt 10 2887-2897 (2011).
- Sohrabpour, A., et al. Effect of EEG electrode number on epileptic source localization in pediatric patients. Clin Neurophysiol. 126 (3), 472-480 (2015).
- Laohathai, C., et al. Practical fundamentals of clinical MEG interpretation in epilepsy. Front Neurol. 12, 722986(2021).
- Corona, L., et al. Mapping functional connectivity of epileptogenic networks through virtual implantation. Proceedings of the Annu Int Conf IEEE Eng Med Biol Soc. 2021, 408-411 (2021).
- Corona, L., et al. Non-invasive mapping of epileptogenic networks predicts surgical outcome. Brain. 146 (5), 1916-1931 (2023).
- Rijal, S., et al. Functional connectivity discriminates epileptogenic states and predicts surgical outcome in children with drug resistant epilepsy. Sci Rep. 13 (1), 9622(2023).
- Tamilia, E., et al. Noninvasive mapping of ripple onset predicts outcome in epilepsy surgery. Ann Neurol. 89 (5), 911-925 (2021).
- Matarrese, M. A. G., et al. Spike propagation mapping reveals effective connectivity and predicts surgical outcome in epilepsy. Brain. 146 (9), 3898-3912 (2023).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved