ゼブラフィッシュ胚におけるミクログリア動態のライブイメージングとキャラクタリゼーション
要約
私たちは、高速走査型共焦点顕微鏡法を利用して、発生中のゼブラフィッシュの視蓋でミクログリア細胞のライブイメージングを行い、これらの細胞のin vivoでのダイナミクスの解析を可能にする方法を実証します。
要約
ミクログリアは非常に動的な細胞であり、脳実質の移動とコロニー形成は、適切な脳の発達と機能にとって重要なステップです。外部から発生するゼブラフィッシュの胚は光透過性を有しており、この透過性は、ミクログリアを蛍光標識する十分に特徴付けられたトランスジェニックレポーター株とともに、ゼブラフィッシュをそのような研究に理想的な脊椎動物モデルにしています。本論文では、ゼブラフィッシュモデルのユニークな特徴を活かして、 生体内 および生理条件下でのミクログリア細胞の動態を可視化します。共焦点顕微鏡を使用して、ゼブラフィッシュ胚の視蓋内のミクログリア細胞のタイムラプスを記録し、IMARIS 10.0ソフトウェアを使用して追跡データを抽出し、さまざまな発生段階での細胞の移動経路、平均速度、および視蓋内の分布を取得します。このプロトコールは、さまざまな状況でのミクログリアの挙動の生理学的意義を解明するための有用なツールとなり、これらの高運動性細胞のより深い特性評価に貢献します。
概要
ミクログリアは、中枢神経系(CNS)に常在するマクロファージとして、成人の脳の全グリア細胞の最大15%を占める明確な非ニューロン集団を表しています。ミクログリア生物学の研究は、発生、生理学、疾患における重要性が確立されていることから、近年ますます注目されています1。生理学的条件下では、ミクログリア細胞は非常に動的であり、脳実質2,3を連続的に調査します。この振る舞いにより、ミクログリアは脳にコロニーを形成し、ニューロン回路の形成4、シナプスの剪定5、血管形成6など、脳の発生において極めて重要な役割を果たすことができる。さらに、この固有の動的性質により、ミクログリアは感染、損傷、または恒常性からの逸脱の兆候がないかCNSを常に監視することができる7。これらの複雑な細胞動態を解剖するためには、時空を超えたミクログリアのライブイメージングが不可欠です。幸いなことに、ゼブラフィッシュの外部発生胚の光学的透明性と、ミクログリアを蛍光標識する十分に特徴付けられたトランスジェニックレポーター株の利用可能性が相まって、ゼブラフィッシュはそのような研究のための理想的な脊椎動物モデルとして位置付けられています。ゼブラフィッシュの胚におけるライブイメージングは、手術や広範な組織操作を必要としない非侵襲的なアプローチを提供し、CNSステータスへの潜在的な摂動を最小限に抑えます。これは、ミクログリア細胞を研究する際に重要な考慮事項であり、細胞外環境の微妙な変化に対しても非常に敏感であるためです8。
ここでは、ゼブラフィッシュの胚における3Dミクログリア細胞の動きを成功裏に追跡するためのガイドラインを提供し、発達中の脳実質の無傷のアーキテクチャ内でのミクログリアの挙動を前例のない視点で見ることを可能にします(プロトコルのグラフィカルな概要については 、図1を参照)。このステップバイステップのプロトコルでは、ゼブラフィッシュのミクログリアをさまざまな発生段階で設定および画像化する方法、およびミクログリア細胞の運動性に関する高解像度データを抽出して、ミクログリアの回遊パターンと環境手がかりに対する応答に関する貴重な洞察を提供する方法を詳しく説明しています。また、このプロトコルは、ライブマルチカラーイメージングを実行するように適応できることを実証し、ニューロン3、オリゴデンドロサイト9、および内皮細胞10を含む隣接する細胞をマークするトランスジェニックラインと組み合わせてミクログリアの研究に適用性を拡張します( 図2に示すように)。このプロトコルは、ミクログリアの挙動のダイナミクスをリアルタイムで、そして自然環境で直接観察し、特徴づけることができるツールボックスに加えることで、生理学と疾患の両方において、初期発生期のミクログリアの機能をより明確に解明することに貢献すると思われます。
プロトコル
ゼブラフィッシュは、FELASA42および機関(Université Libre de Bruxelles、ブリュッセル、ベルギー;ULB)のガイドラインと規制。すべての実験手順は、ULBの動物福祉倫理委員会(CEBEA)によってULBから承認されました。
1. ゼブラフィッシュの飼育と胚の準備
注:ミクログリアを含むマクロファージで蛍光eGFPタンパク質を発現するゼブラフィッシュトランスジェニック系統 Tg(mpeg1:eGFP)gl22 を使用して、このプロトコルに示されている追跡データを生成しました。他のマクロファージレポーターラインはZIRCから入手でき、これも使用できます。トランスジェニック株を選択する際には、シグナル強度が高いと画像取得と細胞分節が容易になることを考慮することが重要です。
- ゼブラフィッシュ(Danio rerio)を28°Cの温度に維持し、確立されたプロトコル11に従って管理します。
- 目的の胚の生年月日の前の午後遅くに、メスとオスの魚をメッシュの底とセパレーターを備えた繁殖タンクに一緒に配置することにより、交配を刺激します。翌朝、魚の交尾のタイミングを計るためにセパレーターを取り外します。
- メッシュを使用して受精卵を収集し、E3培地(5 mM NaCl、0.17 mM KCl、0.33 mM CaCl2、0.33 mM MgSO4)と0.01%メチレンブルーを含む100 mmシャーレに移します。使用したゼブラフィッシュトランスジェニック系統の遺伝的背景にもよりますが、イメージングを容易にするために色素形成を阻害する場合は、受精後6時間(hpf)から開始し、目的の発生段階に達するまで2日ごとに溶液をリフレッシュして、胚が発生しているE3バッファーに N-フェニルチオ尿素(PTU)の0.003%を追加します。
注:胚発生12に影響を及ぼし得るPTUへの長時間の曝露を避けるために、可能であれば、Casperw2のような色素欠損の背景上のトランスジェニックラインを使用することが推奨される。これにより、胚を長期間PTUに曝露することなく明確なイメージングが可能になる13。 - 画像化する胚が受精後3日未満(dpf)の場合は、24 hpfでデコリオネートします。実体顕微鏡を使用して、すべての胚がデコレーションされ、酵素処理による損傷を受けていないことを確認します(ステップ1.4.2を参照)。
- 卵の数が限られている場合は、細かい解剖鉗子を使用して絨毛膜をつまんで外側に引き抜き、各胚を絨毛膜から慎重に解放することにより、これを手動で行います。
- 卵の数が多い場合は、E3培地の1 mg / mLプロナーゼ溶液に卵を大量に室温(RT)で短時間(通常は5〜10分、穏やかに振って絨毛膜が開くまで)卵をインキュベートすることにより、酵素的にデコレーションを行います。.次に、プロナーゼ溶液を廃棄し、胚を新鮮なE3で3回徹底的にすすぎ、残っている絨毛膜と残留酵素を取り除きます。
2.ゼブラフィッシュの取り付け
- E3バッファーに1%低融点アガロース溶液を調製します。ベンチトップの加熱ブロックでアガロースを37°Cに冷却し、作りたてのトリカインメタンスルホン酸溶液(160 mg/L)を加えると、イメージング中に胚に麻酔をかけ続けることができます。溶液をボルテックスして、完全に均質化します。
- E3バッファーに胚を含むペトリ皿に160 mg / Lのトリカインメタンスルホン酸を加えて胚を麻酔します。動きが止まったことを確認し、目的の蛍光を持つゼブラフィッシュの胚を選択します。胚の健康状態を、明視野実体顕微鏡で心拍を可視化して確認します。先端の広いトランスファーピペットを使用して、選択した胚の1つまたは最大3つを引き出し、底面のガラスイメージングプレートに移します。
- 実体顕微鏡下で、ピペットを使用してできるだけ多くの培地を取り出し、胚に触れたり損傷したりしないように注意してください。次に、培地を以前に調製した1%低融点アガロース溶液と交換します。次に、ティーリング針の端に固定されたプラスチック製の細い先細りの先端を使用して、各胚をイメージングプレートの底に優しく押し込み、背側がガラスに向くように向きを変えて、視眼蓋がよく見え、胚とガラスの間に低融点のアガロースが最小限に抑えられます。
- 高品質のPlan Apo対物レンズ(ここでは10x/0.45 Plan Apoまたは20x/0.75 Plan Apoを使用)を備えた倒立共焦点顕微鏡を使用して、マウントされた胚を迅速にイメージングします。タイムラプスが長時間(1時間以上)実行される場合は、下部のガラスイメージングプレートにトリカインメタンスルホン酸(160 mg / L)を含むE3バッファーを1〜2滴追加して、低融点のアガロースが過度に乾燥しないようにします。
注:アガロースが完全に固化するのを待ってから、E3バッファーとトリカインメタンスルホン酸培地をイメージングディスクに追加することが重要です。そうしないと、魚がゆっくりと横方向および軸方向に移動し、タイムラプスでサンプルドリフトが発生する可能性があります。 - 希望の時間でのタイムラプス撮影の設定に進みます:画像解像度を1,024 x 1,024、ピクセルサイズを0.49μmに設定します。光学スライスを2〜3μm刻みで収集して、z軸上の許容可能な解像度を確保します。ゼブラフィッシュの胚では、使用する発生段階に応じて、視蓋を100〜150μmのzスタックに閉じ込めます。セルの追跡を成功させるには、フレーム間の時間間隔を 30 秒から 60 秒の間に保ちます。
3. トラッキング分析とデータエクスポート
- Imarisファイルコンバータソフトウェアを使用して、タイムラプスファイルをIMS形式に変換します( 資料の表を参照)。ソフトウェアを起動したら、ファイルを入力領域にドラッグアンドドロップするか、 ファイルの追加... 手動で選択するためのボタン。[ 出力 ]メニューで、変換されたファイルの場所を指定し、入力ファイルと同じフォルダを選択するか、特定のフォルダを指定します。[ Set Voxel Size ]ボタンをクリックして、表示されるボクセル サイズの寸法が正しいことを確認し、ボクセル サイズを確認したら、[ Start All ]ボタンを押してファイル変換を開始します(すべてのデータ分析のステップバイステップ ガイドについては 、補足ファイル 1 を参照してください)。
注:タイムラプスが2つ以上の胚で並行して行われた場合、ファイルは自動的に1つの位置に分割され、各胚は異なるファイルに分割されます。ソフトウェアをバッチモードで使用し、複数のファイルを同時にアップロードおよび変換することが可能です。IMSファイルは、選択した宛先フォルダまたは入力ファイルが配置されているフォルダに作成され、保存されます。 - 起動したら、アリーナで分析ソフトウェアを起動します。「Observe Folder」をクリックして、以前に変換したファイルを開きます。ファイルがソフトウェアにロードされたら、スライスビューを使用して、ビューエリアの左側にあるスライスツールバーのスライダーを使用してzスタックをスクロールし、ポインターを使用して選択したセルの直径を描画してセルの直径を測定します。マウスをクリックしてドラッグし、セル コアにまたがるセグメントを描画します。表示領域の右側にあるメジャーツールバーに描かれたセグメントの長さを観察します。
注:ステップ2.5のイメージング設定を使用すると、細胞本体の直径は6μmから8μmの間であると予想できます。 - セルを自動的に検出するには、3Dビューに戻り、オブジェクトツールバーのスポットアイコンをクリックして、オブジェクトリストに新しいスポットオブジェクトを追加し、自動スポット作成ウィザードを開きます。ウィザードの最初のステップで、関心のある領域のみをセグメント化するオプションにチェックを入れます。次に、トラッキング データを計算するための Track Spots (over time) オプションと、スポット間の比較を可能にし、分析の後半で使用できるデータの範囲を拡大するための Object-Object Statistics を有効にします。最後に、ウィザードウィンドウの右下にある[次へ]ボタンをクリックして、ウィザードを続行します。
- 第2ステップでは、胚の視蓋を囲む関心領域(ROI)領域の指定に進みます。ROIのサイズを変更するには、ROIの各面にある小さな白い矢印をクリックしてドラッグします。ROIサイズを定義したら、時間間隔を調整して、記録されたすべてのフレームにROIサイズを拡張します。
- 次に、セルの検出に使用したチャンネルを Source Channel として選択し、ステップ3.2で取得したセル直径測定値を Estimated XY Diameterとして設定します。 [バックグラウンド減算 ]オプションを有効にして、[ 次へ]をクリックします。
- スポット作成ウィザードのこの時点で、ソフトウェアには、各スポットの中心で測定された信号強度によってスポットがフィルタリングされる品質フィルタリングステップが組み込まれています。スポットが検出されたチャネルで。強度の閾値を調整するには、下限閾値と上限閾値ボックスのデータフィールドに値を直接入力するか、作成ウィザードの下部に表示されるヒストグラムの対応する色の線をドラッグして、組織の深部に局在する細胞(通常はシグナル強度が低い細胞を含む)をすべて検出します。これらの変更はすべて、ビューエリアに同時に表示されます。
注:この時点で、1つのセルにラベル付けする複数のスポットが観察される可能性がありますが、これは分析の後半で修正できます。
長時間のタイムラプスで、光退色が見られる場合は、しきい値を設定する前に複数のフレーム の表示領域 をチェックして、すべてのセルが最新のフレーム、したがって暗いフレームでも検出されていることを確認してください。 - 問題がなければ、[ 次へ ]をクリックして、選択した品質しきい値を検証します。品質しきい値パラメータを満たし、直径が推定XY直径と一致するすべてのスポットは、スポットとしてラベル付けされます。 これを View Area でプレビューとして視覚化すると、これら 2 つのパラメーターを満たすスポットが Source Channel に重ねられます。
- 次のステップでは、トラッキングアルゴリズムとして 「自己回帰運動 」を選択し、多かれ少なかれ連続的な運動を持つ細胞を追跡します。2 つのフレーム間のスポットの動きを注意深く観察して、セルが 2 つの時点間を移動する最長距離を判断し、[ 最大距離 ] フィールドに推定値を入力します。これは、スポットが予測された将来の位置から逸脱できる距離です。
- [最大ギャップ サイズ] を、トラックを中断せずにスポットが消える最小のタイム ポイント数に設定します。フレーム間の間隔が 60 秒未満の場合は、サイズ 3 を使用します。フレーム間の時間間隔が長い場合は、トラックの断片化を減らすために許容される最大ギャップサイズを大きくします。
- [ 検出されたすべてのオブジェクトでギャップを埋め る] を有効にすると、検出しきい値をトラッキング アルゴリズムによって予測された予想位置に近づけ、スポット検出の失敗によって中断されたトラックが接続されます。最後に、[ 次へ ]をクリックして、ソフトウェアが以前に生成されたすべてのスポットのトラックを自動的に生成します。
- 取得したトラックが多すぎたり断片化されていると思われる場合は、 作成ウィザードに戻り、[ 前へ ]ボタンをクリックして、以前に定義した最大距離を調整し、取得したトラックのほとんどがセルの動きを表すようになるまで数を増やすか減らします。
注:トラックの数は、ミクログリア細胞の数とほぼ一致させる必要があるため、胚の年齢に応じて 30〜50の範囲です。ただし、解析が完了する前に、誤ったトラックのために、より多くの数値が予想されます。 - トラックが計算されると、ソフトウェアはフィルタリングステップを組み込んで、不正確または情報量が少ないことが多いため、非常に短いトラックをすべてフィルタリングします。3 分から 8 分未満のトラックを除外するには、トラック期間フィルター の下限 のデータ フィールドに値を直接入力するか、 作成ウィザードの下部に表示されるヒストグラムで対応する色の線をドラッグします。[ 次へ ]をクリックしてフィルターを検証し、作成ウィザードに進みます。
注:前述のように、トラックの最大(最大)および最小(最小)のしきい値を変更することで、フィルタリングされて分析から除外されるトラックをプレビューできます。フィルタリングされたトラックは、さらに分析するために新しいオブジェクトに複製できます。フィルタリングの正確な時間しきい値は、前の 作成ウィザード 手順の結果によって異なる場合があります。これらのフィルター設定を微調整するには、 表示領域 のプレビューを確認して最適な結果を得ることをお勧めします。 - Tg(mpeg1:eGFP)トランスジェニックラインはすべての単核食細胞を標識するため、タイムラプス動画ではミクログリアに加えて皮膚マクロファージも検出されます。皮膚マクロファージから生成されたトラックを解析から手動で削除し、脳実質ミクログリアに焦点を当てます(図3)。
- トラックエディタでトラック内の他の潜在的な間違いを手動で修正します。各データポイントはトラック内のオブジェクトとして表示されます。ビューエリアの右側にあるサークルセレクトモードボタンをアクティブにして、変更や調整が必要なトラックをハイライトします。問題のあるトラックを選択したら、接続ボタンと切断ボタンを使用して、セルの動きを正しく表すように編集します。トラックエディタを使用して、重複した単一のスポットや、同じセルを誤って表す小さなトラックフラグメントも選択および削除します。それらを円選択モードで選択し、Canc または Delete を押して削除します。
注: 追跡の設定が正しい場合、この手順は追跡されるセルのごく一部にのみ必要です。 - ミクログリアレポーター株を、実質内の他の細胞種を標識する蛍光トランスジェニックと組み合わせて使用する場合は、新しい表面オブジェクトまたはスポットオブジェクトとしてセグメンテーションを行い、それらを視覚化します。これを行うには、上記の手順(手順3.2から3.14)を繰り返し、手順3.5の ソースチャネル 入力を変更して、2番目の細胞集団のイメージングに使用するものに変更し、 推定XY直径 (ステップ3.5)、 最大距離 (ステップ3.8)など、目的の細胞に固有の記述パラメーターを新しい細胞集団に適合させます。他の手順は変更せずに繰り返すことができます。
注: 新しいサーフェスを作成する場合、[推定 XY 直径] は、オブジェクトに収まる最大の球の直径が入力される [背景の減算] に基づくしきい値オプションに置き換えられます。この値は、ステップ 3.2 で説明したように、Measure ツールバーを使用して Slice ビューから推定できます。 - 取得したトラックに満足したら、[ 統計 ]タブから目的のトラッキング統計を抽出します。 設定 ボタンをクリックして、以前に作成した各スポットオブジェクトまたはサーフェスオブジェクトに対して計算する統計を選択します。同じ解析でさらにオブジェクトが作成された場合、2つのスポットオブジェクト、またはスポットとサーフェスオブジェクトの場合、2つのオブジェクト間の最短距離など、1つのオブジェクトと他のオブジェクトの相対位置を示す統計もエクスポートできます。
注:必要なすべての値は、特定の値または平均値のいずれかであり、すべての生データは、[ 統計 ]タブの下部にあるボタンを使用してカンマ区切り値(CSV)ファイルとしてダウンロードできます。解析に他のセルタイプも含まれる場合、1つのオブジェクトと他のオブジェクトとの相対距離に関する追加の統計も利用可能になります。
代表的な結果
緑色蛍光タンパク質(eGFP)を発現するミクログリア細胞およびTg(mpeg1:eGFPgl22; KDRL:CREのS898; actb2:loxP-STOP-loxP-DsRedexpress,sd5)のトリプルトランスジェニック胚14 を、記載されたプロトコルに従って3dpfで画像化した。ゼブラフィッシュの胚1個を1%低融点アガロースに底面ガラス板にマウントし、イメージングプロセスは取得期間中の胚の成長を妨げませんでした。タイムラプスは、10x 0.45 NA乾式対物レンズを備えた市販の点走査型共焦点顕微鏡システムを使用して記録し、488 nmと561 nmの励起レーザーをそれぞれミクログリアと内皮細胞のイメージングに使用しました。また、時間間隔、画像解像度、ピクセルサイズ、zステップは、それぞれ30秒(s)、1024x1024、0.49μm、2.5μmでした。タイムラプス録画は3.5時間続きました(h)。
獲得視野は胚の頭部全体を覆っていましたが、分析は特に視蓋に焦点を当てており、発生の最初の週には、ミクログリアは主に背側中脳のこの領域のニューロン体細胞層に限定されており、研究者は全集団を同時に視覚化することができます15。3Dトラッキング解析は、上記で説明したように、Imaris 10.0を使用して実行されました。 図4に示すように、追跡は成功し、25のトラックが得られ、3 dpf16で視眼蓋に存在するミクログリア細胞の予想数と一致しました。最小限の手動トラック修正が必要でした。 図 5 は、成功した追跡実験から抽出できるデータの例を示しています。マクロファージと内皮細胞を同時に標識することで、ミクログリアの相対的な位置を定量化できるため、研究者は各細胞から最も近い内皮細胞までの相対距離を時間的に視覚化し、潜在的な相互作用の頻度と数を調べることができます(図5)。
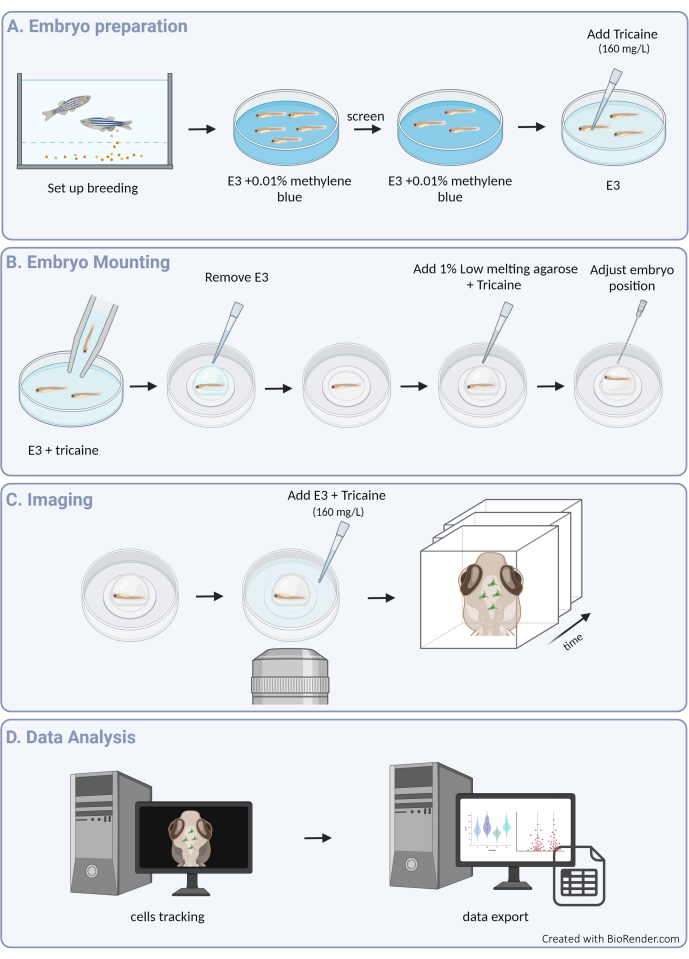
図1:実験手順の概要(A)ゼブラフィッシュの胚調製と麻酔。(B)サンプルの取り付けと位置決め。(C)画像取得。(D)運動データの画像処理と抽出。この図の拡大版を表示するには、ここをクリックしてください。
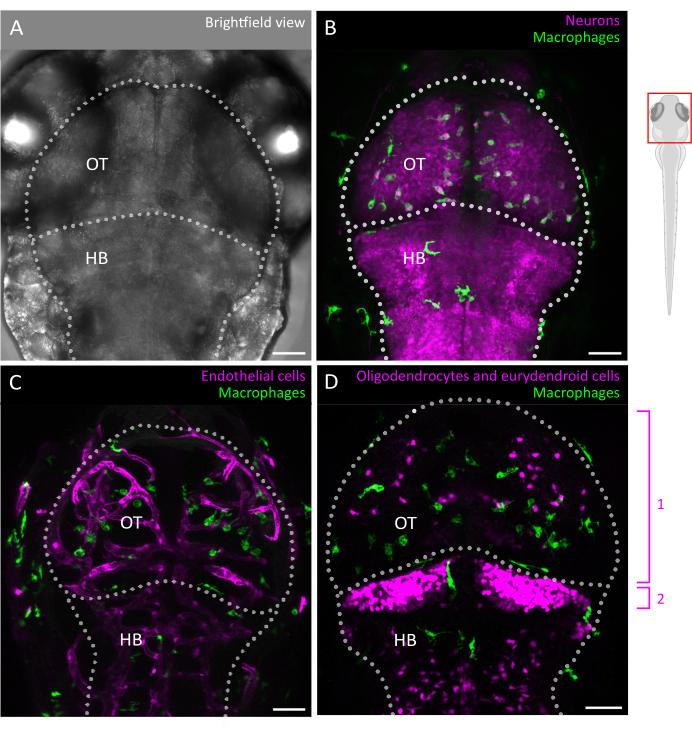
図2:ゼブラフィッシュ胚におけるミクログリアのイメージングと脳細胞環境との相互作用。 (A)視蓋と後脳を標識した3dpfの胚性ゼブラフィッシュの頭部と脳の明視野画像(背側図)。ゼブラフィッシュの胚の脳は、その小さなサイズと光学的透明性により、この段階で全体像を画像化することができます。(B-D)ミクログリアの位置と挙動は、(B,C) Tg(mpeg1:eGFP)gl22 や(D) Tg(mpeg1:mcherry)gl23などのトランスジェニック系統を使用し、OTに焦点を当てることで可視化できます。(B)レポーターライン Tg(XlTubb:D sRed)zf148 を使用してニューロンとその細胞体を同定でき、両方の導入遺伝子を共発現するラインで2つのチャネルをマージすることにより、ミクログリアニューロンの相互作用を視覚化できます。緑(ミクログリア)と赤(ニューロン、マゼンタ)の信号の融合が見られます。(C,D)レポーターラインは、ミクログリア(緑色)と内皮細胞との相互作用にも光を当てることができます(ここでは(C)double Tg(kdrl:cres898; actb2:LOXP-STOP-LOXP-DsredEXPRESS, SD5) トランスジェニック、またはオリゴデンドロサイトやその前駆体などのグリア細胞を用いて、(D) double Tg(olig2:EGFP; MPEG1:MChery)トランスジェニックライン。1:OTのオリゴデンドロサイトと前駆細胞、2:小脳のユーリデンドロイドニューロン。スケールバー = 50 μm。略語:dpf =受精後日;OT = 視蓋;HB = 後脳。 この図の拡大版を表示するには、ここをクリックしてください。
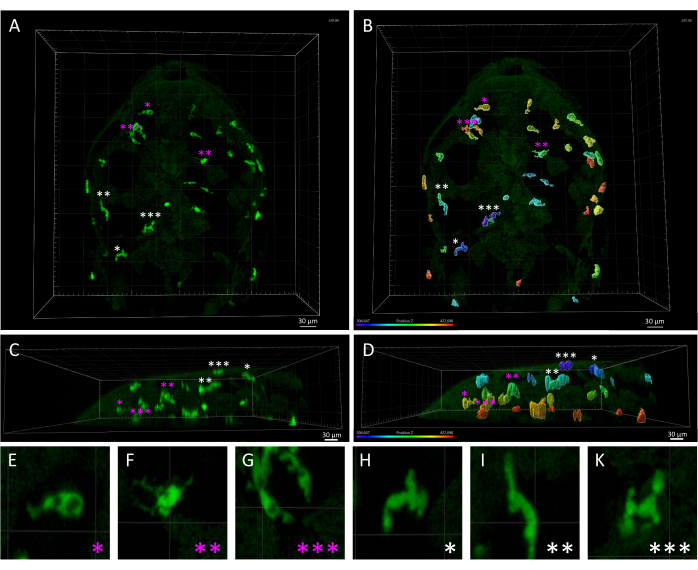
図3:3 dpfゼブラフィッシュ胚における皮膚マクロファージとミクログリアの形態学的および空間的格差 (A,B) Tg(mpeg1:eGFP)gl22 ゼブラフィッシュ胚の3 dpfでの背側図、(A)実質ミクログリア細胞(マゼンタのアスタリスクでマーク)と皮膚マクロファージ(白いアスタリスク)を描写し、(B)で見られるように、z軸に沿った相対的な位置に基づいて識別された。) は、Z 軸の色分けでレンダリングされたモノクロ 3D 画像を示しています。(C,D)(C)Aと(D)Bの側面図は、胚の頭部内の mpeg1:eGFP+ 細胞のz深さを示し、ミクログリア細胞と比較した皮膚マクロファージの表面局在を強調しています。(E-K) A と Bにアスタリスクで示される各細胞の高倍率により、(E-G)アメーバミクログリアと(H-K)細長い皮膚マクロファージの間の明確な形態を詳細に視覚化できます。スケールバー= 30 μm。略語:dpf =受精後日数。 この図の拡大版を表示するには、ここをクリックしてください。
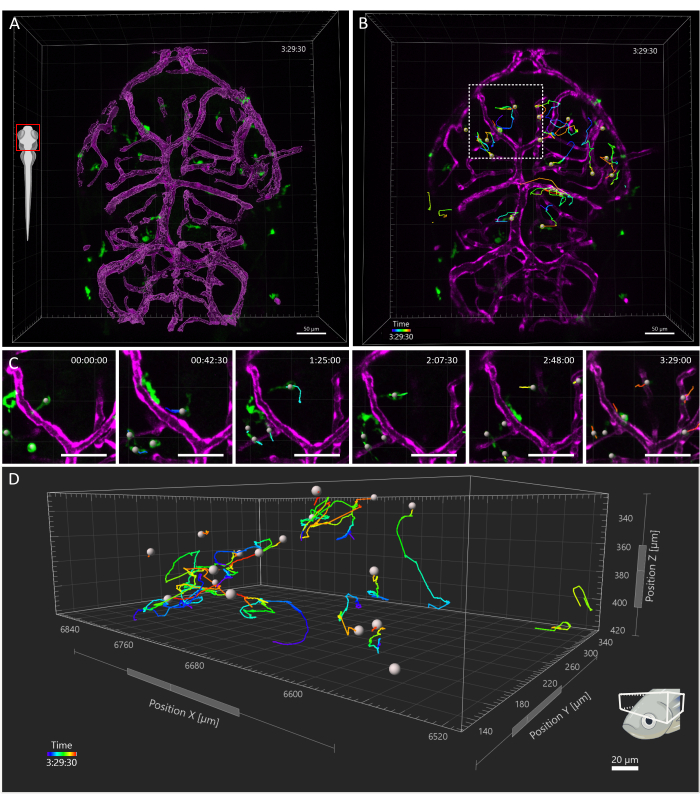
図4:3 dpfゼブラフィッシュ胚におけるミクログリア細胞の追跡 (A) 3 dpf Tgの頭部背側図(kdrl:cres898; actb2:LOXP-STOP-LOXP-DsredEXPRESS、SD5;mpeg1:eGFPgl22) トリプルトランスジェニック胚、ミクログリア (緑) と血管の表面レンダリング (マゼンタ) を示しています。(B-D)(B)3.5時間の時間枠にわたるミクログリアの動きの代表的な追跡。個々の細胞は複雑な軌道をたどることが見られます。(C)タイムラプスからの詳細、破線の正方形で囲まれた B の領域の拡大図を示しています。映画の6つのフレーム(45分間隔)が提示され、ミクログリアが微小環境内の内皮細胞と一過性の接触を確立する様子が記録されています。(D)視蓋内の個々のミクログリア細胞の移動の軌跡、X、Y、Z軸は空間寸法を表します。スケールバー = 50 μm。略語:dpf =受精後日数。 この図の拡大版を表示するには、ここをクリックしてください。
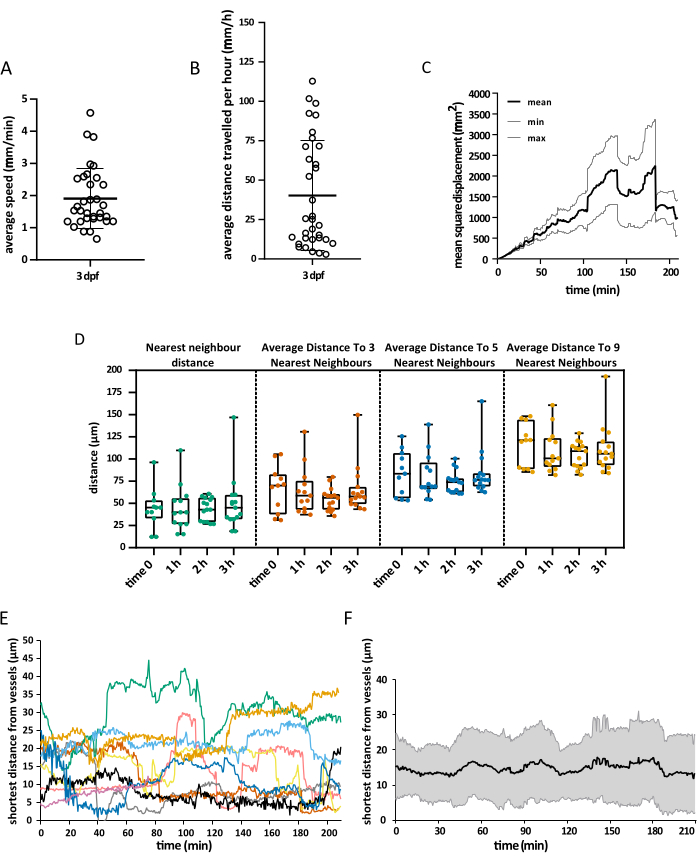
図5:取得したデータの視覚化。 説明されているプロトコルを使用して取得できる空間データの例。グラフは、(A)ミクログリア細胞の平均速度、(B)ミクログリア細胞が1時間でカバーする平均距離、(C)平均二乗変位、および(D)異なる時間における空間内の分布を示しています。また、血管の表面レンダリングにより、ミクログリアと内皮細胞の間の最短距離を、(E)シングルセルレベルと(F)全球平均の両方で、任意の時点で測定することもできました。 A、B、 および D の場合、各ドットは個々のセルを表します。N = 1つの胚。 この図の拡大版を表示するには、ここをクリックしてください。
補足ファイル1:このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
現在のプロトコルでは、脊椎動物の胚におけるミクログリアの動態の in vivo イメージングと、取得した運動データの可視化が可能です。発達中の脳のミクログリアのコロニー形成は、胚形成の非常に早い段階で起こり、神経新生、アストリオグリオージェニゼーション、オリゴデンドロジェネシス、その他多くの細胞プロセスのピークなどの重要なイベントに先行します17。したがって、ミクログリアが脳の発達18の特定の側面、例えば、ニューロンの分化、移動、生存19、20、21、シナプスの剪定5、髄鞘形成22、23、24の調節を通じて、重要な役割を果たしていることは驚くべきことではない。
機能不全のミクログリアが神経発達障害の病因および/または進行に寄与することもますます認識されるようになっています25。実際、形成中の脳にミクログリアが早期に存在すると、これらの細胞は明確な生理学的状態26と環境変化にさらされる。ミクログリアがげっ歯類とヒトの両方で長命の細胞であり、局所的な前駆細胞27,28,29の自己更新を通じて生涯にわたって維持されることを考えると、これは大きな影響を与える可能性があります。このプロトコルは、脳の形態形成の連続的なステップでミクログリアが発達し、成熟し、ネットワークを確立する際に、これらの異なる生理学的状態におけるミクログリアの挙動をより良く特徴付けるための強力なツールとして役立つと信じています。
ここで説明したセットアップを使用して、6 dpfのゼブラフィッシュの幼生の画像化とデータの取得に成功しました。解析を後の開発段階に拡張することは成功する可能性が高いですが、特にz軸に沿ったサンプルサイズの増加を考慮してイメージングセットアップを調整する必要があります。これを試みる際には、低いS/N比と高速スキャン時間を維持することに焦点を当てることをお勧めします。これらは、分析を成功させるための重要なパラメータです。
ミクログリアの追跡を可能にするために、最小イメージング時間を1時間にすることをお勧めします。このプロトコルでテストされた最長のイメージング ウィンドウは 8 時間です。さらに、トラッキング解析では、フレーム間の時間間隔をできるだけ短く、理想的には 30 秒から 60 秒の間に保つことが重要です。これにより、ダウンストリーム解析でより正確で詳細な追跡データが得られます。したがって、特に複数の蛍光色素を検出する場合は、スペクトルのオーバーラップを避け、2つの蛍光色素発光スペクトル間で十分な分離を確保し、シグナルのブリードスルーなしに同時に取得できるようにすることが基本です。
ゼブラフィッシュの脳の高品質なタイムラプス記録のための他のプロトコルも利用可能であるが、これは、胚発生中のすべてのミクログリアの動きを長期間にわたって成功裏に追跡する方法を示す最初のものである。ここで紹介するワークフローは、生理学的な文脈でのミクログリアの追跡に焦点を当てていますが、病理学におけるミクログリアの分析にも簡単に適用できます。実際、自閉症31、てんかん32、統合失調症33などの神経発達障害のいくつかのモデルだけでなく、神経変性34や癌35もゼブラフィッシュで確立されており、疾患状態におけるミクログリアの応答と行動を決定するためのユニークな機会を提供しています。
特に、このトラッキングプロトコルは非常に汎用性が高く、ゼブラフィッシュ胚のさまざまな解剖学的領域にわたるさまざまな細胞タイプの移動パターンを明らかにするのにも役立つ可能性があり、したがって、この記事で説明したミクログリアの調査範囲を超えた追加のアプリケーションへの道を開く可能性があります。さらに、複数の蛍光トランスジェニックラインを組み合わせる能力を利用することで、ミクログリアと脳微小環境の他の細胞種との空間的な関係を識別する能力を獲得し、タイムラプス記録全体での細胞相互作用やクロストークを非侵襲的に視覚化できる可能性があります。これは、ミクログリアの挙動の生理学的意義を解明し、これらの高運動性細胞のより深い特性評価に貢献する可能性があります。
開示事項
著者は、利益相反を宣言しません。
謝辞
著者らは、この研究に不可欠な共焦点顕微鏡へのアクセスを寛大に提供してくださったNicolas Bayens教授に心から感謝の意を表します。この研究は、助成金番号F451218FおよびUG03019Fに基づく科学研究基金(FNRS)、アルツハイマー研究財団(SAO-FRA)(VWへ)によって部分的に資金提供されました。AMはFNRSからの研究フェローシップによってサポートされています。 図 1 は biorender.com で作成されました。
資料
| Name | Company | Catalog Number | Comments |
| 1 L Breeding tanks | Tecniplast | ZB10BTE | |
| 1-phenyl-2-thiourea (PTU) | Sigma-Aldrich | P7629 | Diluted to 0.2 mM in E3 to prevent embryo pigmentation |
| Bottom glass imaging dish | FluoroDish | FD3510-100 | |
| Disposable Graduated transfer pipette | avantor | 16001-188 | |
| Dry block heater | Novolab | Grant QBD4 | To keep low melting agarose at 37 °C |
| Ethyl 3-aminobenzoate methanesulfonate (Tricaine) | Sigma-Aldrich | E10521-50G | |
| Imaris 10.0 | Oxford Instruments | analysis software | |
| Imaris File Converter | Oxford Instruments | https://imaris.oxinst.com/big-data | |
| Laser-scanning confocal microscope | Nikon | Eclipse Ti2-E | |
| Methylene blue | Sigma-Aldrich | M9140-25G | |
| microloader tips | Eppendorf | 5242956003 | |
| NuSieve GTG Agarose | Lonza | 50081 | |
| Petri dishes (90 mm) | avantor | 391-0559 | |
| Pronase | Sigma-Aldrich | 11459643001 | |
| Stainless Steel Forceps Dumont No. 5 | FineScienceTools | 11254-20 | |
| Stereo microscope | Leica | Leica M80 | To mount the embryos |
| teasing needle | avantor | 76549-024 |
参考文献
- Wolf, S. A., Boddeke, H. W., Kettenmann, H. Microglia in physiology and disease. Annu Rev Physiol. 79, 619-643 (2017).
- Nimmerjahn, A., Kirchhoff, F., Helmchen, F. Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo. Sci Rep. 308 (5726), 1314-1318 (2005).
- Peri, F., Nusslein-Volhard, C. Live imaging of neuronal degradation by microglia reveals a role for v0-ATPase a1 in phagosomal fusion in vivo. Cell. 133 (5), 916-927 (2008).
- Marın-Teva, J. L., et al. Microglia promote the death of developing Purkinje cells. Neuron. 41 (4), 535-547 (2004).
- Paolicelli, R. C., et al. Synaptic pruning by microglia is necessary for normal brain development. Science. 333 (6048), 1456-1458 (2011).
- Hattori, Y. The microglia-blood vessel interactions in the developing brain. Neurosci Res. 187, 58-66 (2023).
- Colonna, M., Butovsky, O. Microglia function in the central nervous system during health and neurodegeneration. Annu Rev Immunol. 35, 441-468 (2017).
- Xu, H. -. T., Pan, F., Yang, G., Gan, W. -. B. Choice of cranial window type for in vivo imaging affects dendritic spine turnover in the cortex. Nat Neurosci. 10 (5), 549-551 (2007).
- Shin, J., Park, H. -. C., Topczewska, J. M., Mawdsley, D. J., Appel, B. Neural cell fate analysis in zebrafish using olig2 BAC transgenics. Methods Cell Sci. 25 (1), 7-14 (2003).
- Chi, N. C., et al. Foxn4 directly regulates tbx2b expression and atrioventricular canal formation. Genes Dev. 22 (6), 734-739 (2008).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: An introduction. J Vis Exp. (69), e4196 (2012).
- Bohnsack, B. L., Gallina, D., Kahana, A. Phenothiourea sensitizes zebrafish cranial neural crest and extraocular muscle development to changes in retinoic acid and IGF signaling. PLoS ONE. 6 (8), e22991 (2011).
- Ariga, J., Walker, S. L., Mumm, J. S. Multicolor time-lapse imaging of transgenic zebrafish: visualizing retinal stem cells activated by targeted neuronal cell ablation. J Vis Exp. (43), e2093 (2010).
- Ferrero, G., et al. Embryonic microglia derive from primitive macrophages and are replaced by cmyb-dependent definitive microglia in zebrafish. Cell Rep. 24 (1), 130-141 (2018).
- Xu, J., Wang, T., Wu, Y., Jin, W., Wen, Z. Microglia colonization of developing zebrafish midbrain is promoted by apoptotic neuron and lysophosphatidylcholine. Dev Cell. 38 (2), 214-222 (2016).
- Svahn, A. J., et al. Development of ramified microglia from early macrophages in the zebrafish optic tectum. Dev Neurobiol. 73 (1), 60-71 (2013).
- Thion, M. S., Garel, S. Microglial ontogeny, diversity and neurodevelopmental functions. Curr Opin Genet Dev. 65, 186-194 (2020).
- Bohlen, C. J., Friedman, B. A., Dejanovic, B., Sheng, M. Microglia in brain development, homeostasis, and neurodegeneration. Annu Rev Genet. 53, 263-288 (2019).
- Squarzoni, P., et al. Microglia modulate wiring of the embryonic forebrain. Cell Rep. 8 (5), 1271-1279 (2014).
- Schafer, D. P., et al. Microglia sculpt postnatal neural circuits in an activity and complement-dependent. Neuron. 74 (4), 691-705 (2012).
- Parkhurst, C. N., et al. Microglia promote learning-dependent synapse formation through brain-derived neurotrophic factor. Cell. 155 (7), 1596-1609 (2013).
- Green, L. A., O'Dea, M. R., Hoover, C. A., DeSantis, D. F., Smith, C. J. The embryonic zebrafish brain is seeded by a lymphatic-dependent population of mrc1+ microglia precursors. Nat. Neurosci. 25 (7), 849-864 (2022).
- Hughes, A. N., Appel, B. Microglia phagocytose myelin sheaths to modify developmental myelination. Nat Neurosci. 23 (9), 1055-1066 (2020).
- Yu, Q., et al. C1q is essential for myelination in the central nervous system (CNS). iScience. 26 (12), 108518 (2023).
- Zengeler, K. E., Lukens, J. R. Innate immunity at the crossroads of healthy brain maturation and neurodevelopmental disorders. Nat Rev Immunol. 21 (7), 454-468 (2021).
- Paolicelli, R. C., et al. Microglia states and nomenclature: A field at its crossroads. Neuron. 110 (21), 3458-3483 (2022).
- Réu, P., et al. The lifespan and turnover of microglia in the human brain. Cell Rep. 20 (4), 779-784 (2017).
- Ajami, B., Bennett, J. L., Krieger, C., Tetzlaff, W., Rossi, F. M. V. Local self-renewal can sustain CNS microglia maintenance and function throughout adult life. Nat Neurosci. 10 (12), 1538-1543 (2007).
- Mildner, A., et al. Microglia in the adult brain arise from Ly-6ChiCCR2+ monocytes only under defined host conditions. Nat Neurosci. 10 (12), 1544-1553 (2007).
- Cook, Z. T., Brockway, N. L., Weissman, T. A. Visualizing the developing brain in living zebrafish using Brainbow and time-lapse confocal imaging. J Vis Exp. (157), e60593 (2020).
- Tayanloo-Beik, A., et al. Zebrafish modeling of autism spectrum disorders, current status and future prospective. Front Psychiatry. 13, 911770 (2022).
- D'Amora, M., et al. Zebrafish as an innovative tool for epilepsy modeling: State of the art and potential future directions. Int J Mol Sci. 24 (9), 7702 (2023).
- Langova, V., Vales, K., Horacek, J. The role of zebrafish and laboratory rodents in schizophrenia research. Front Psychiatry. 11, 549232 (2020).
- Chia, K., Klingseisen, A., Sieger, D., Priller, J. Zebrafish as a model organism for neurodegenerative disease. Front Mol Neurosci. 15, 940484 (2022).
- Astell, K. R., Sieger, D. Zebrafish in vivo models of cancer and metastasis. Cold Spring Harb Perspect Med. 10 (8), 037077 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved