このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
げっ歯類口腔疾患モデルにおける歯と歯槽骨の微小硬度測定
要約
微小硬度は機械的特性であり、硬組織の病態生理を評価するための有益なパラメータです。ここでは、げっ歯類口腔疾患モデル、すなわち歯のフッ素症、および結紮誘発性歯周骨吸収における歯および歯槽骨の微小硬さ分析のための標準化されたプロトコル(サンプル調製、研磨、平坦面、およびくぼみ部位)を示します。
要約
機械的特性である微小硬度は、歯のフッ素症や歯周炎などの口腔疾患モデルの歯のエナメル質、象牙質、および骨で評価されます。マイクロCT(μCT)は3Dイメージング情報(体積と鉱物密度)を提供し、走査型電子顕微鏡(SEM)は微細構造画像(エナメル質プリズムと骨ラクナ-小管)を生成します。μCTおよびSEMによる構造解析を補完的に、微小硬度は、構造変化が機械的特性をどのように変化させるかを評価するための有益なパラメータの1つです。有用なパラメータであるにもかかわらず、口腔疾患における歯槽骨の微小硬度に関する研究は限られています。現在までに、さまざまな微小硬さ測定方法が報告されています。微小硬度の値は、サンプルの準備(研磨および平坦面)とくぼみ部位によって異なるため、プロトコルが多様であると、研究間で不一致が生じる可能性があります。微小硬さプロトコルの標準化は、口腔疾患モデルで一貫した正確な評価を行うために不可欠です。本研究では、歯と歯槽骨の微小硬さ分析のための標準化されたプロトコルを示します。使用した標本は次のとおりです:歯のフッ素症モデルの場合、フッ化物含有水の有無を6週間処理したマウスから切歯を採取しました。結紮誘発歯周骨吸収(L-PBR)モデルでは、上顎第2大臼 歯に結紮したマウスから歯根根骨吸収を伴う歯槽骨を採取した。結紮後2週間で、上顎骨を採取した。ビッカース硬さは、標準化されたプロトコルに従ってこれらの試験片で分析されました。このプロトコルは、切歯と肺胞の樹脂埋め込み、連続研磨、およびくぼみ部位の詳細な材料と方法を提供します。私たちの知る限り、これはげっ歯類の口腔疾患モデルにおける歯と歯槽骨の機械的特性を評価するための最初の標準化された微小硬度プロトコルです。
概要
硬度は、機械的特性(弾性、硬度、粘弾性、破壊挙動など)の1つであり、材料の局所領域の圧縮変形および破壊に耐える能力を特徴付けるために一般的に使用されます。静的押し込み硬さ試験は、ビッカース硬さやヌープ硬さ1など、最もよく使用される方法です。ビッカース硬さ試験は、一定の試験荷重でダイヤモンド圧子を表面に押し込むことによって実施されます。圧子はピラミッド型で、底面は正方形で、対向する面の間の角度は136°です。試験面に形成された両方の対角線の長さが測定され、平均を使用して硬度が計算され、比率F / A(Fは力、Aはくぼみの表面積)によって決定されます。ビッカース微小硬度数(HV = F / A)は通常、1 HV ≈ 0.1891 F / d2(N / mm2)で、1 mm2のくぼみあたりのキログラム力(kgf)で表されます。ヌープ硬度は、2つの等しくない反対の角度によって形成されたダイヤモンドの正方形のピラミッド圧子で構成されています。ヌープ硬度数(HK)は、投影された接触面積に対する適用荷重の比率に等しくなります。硬さ試験は、試験材料に加わる力によって、微小押し込み(微小硬度)試験とマクロ押し込み試験に分類されます。マイクロインデンテーションテストでは、通常、0.01〜2 N(約1〜203 gf)の範囲の荷重を使用します。一方、マクロインデンテーションテストでは、10 N(10119 gf)1以上を使用します。
歯や歯槽骨などの口腔疾患における歯の硬組織の特徴を評価するために、マイクロCT(μCT)と走査型電子顕微鏡(SEM)を使用して構造解析を行います。μCTは3Dイメージング情報(体積と鉱物密度)2を提供し、SEMは微細構造画像(エナメル質プリズムと骨ラクナ-小管)3を生成します。μCTやSEMによる構造解析を補完的に、微小硬度は、エナメル質奇形や歯周骨吸収などの口腔疾患において、構造変化が歯や歯槽骨の機械的特性をどのように変化させるかを評価するための有益なパラメータの1つです。ヒトエナメル質(HV = 283-374)のビッカース微小硬度値は、象牙質(HV = 53-63)の約4〜5倍です4,5。げっ歯類の歯のフッ素症モデルでは、フッ化物で処理したマウス切歯(HV = 136)では、対照エナメル質(HV = 334)と比較して、エナメル質の微小硬度が有意に低下します6,7。これは、フルオローゼエナメル質が非フルオローゼエナメル質よりも柔らかく弱く、ミネラル含有量が低く、タンパク質含有量が高いことを示唆しています。微小硬度は、骨の機械的特性を評価するために使用されます。いくつかの以前の研究では、長骨の微小硬度8,9,10を含む、さまざまな解剖学的部位からの人間の骨の機械的挙動を調べました。ヒトのフルオロ化された大腿骨の平均微小硬度は、フルオロ化されていない大腿骨(HV = 294.4)と比較して有意な減少(HV = 222.4)を示しました11。有用なパラメータであるにもかかわらず、口腔疾患における歯槽骨の微小硬さ(ビッカース12またはヌープ13,14のいずれか)を説明する文献は不足しています。
現在までに、さまざまな微小硬さ測定方法が報告されています。微小硬度値は、サンプル調製(研磨および平坦面)およびくぼみ部位によって15 異なるため、プロトコルが異なると、研究間で不一致が生じる可能性があります。微小硬さ試験プロトコルの標準化は、口腔疾患モデルで一貫した正確な評価を行うために不可欠です。本研究では、マウスの歯のフッ素症モデルと歯周骨吸収モデルにおける歯と歯槽骨の微小硬さ分析のための標準化されたプロトコルを示します。
プロトコル
この議定書に記載されているすべての手順は、オーガスタ大学および国際実験動物管理評価認定協会(AAALAC)によって認定されているノバサウスイースタン大学の動物管理委員会(IACUC)によって承認された脊椎動物の使用に関するガイドラインおよび規制に従って実行されています。鈴木博士はオーガスタ大学に雇用され、マウスの歯のフッ素症実験が完了しました。
1. マウス歯のフッ素症モデルにおける下顎切歯の抜歯
- フッ化物投与の1週間前からフッ化物処理終了まで、C57BL/6マウス(5週齢、雄)にフッ化物を含まない食餌を与える。
- 蒸留水にNaFを加え、続いて0.2μmフィルターを使用して真空ろ過することにより、フッ化物水を調製します。動物にフッ化物水をNaF(0 ppmおよび125 ppm;N = 5 /グループ)を6週間 自由に 。フッ化物水は2日ごとに作りたてのバッチと交換します。
- フッ化物水処理の6週間後、CO2 で動物を安楽死させ、続いて斬首します。
- 各マウスから切歯で下顎半球を抽出します。切歯で下顎半球を採取するには、無理な力を加えずに下顎顎の周りの筋肉を切開します。
- 下顎半球をPBSに置き、μ-CT分析(オプション)まで4°Cに保ちます。メス(#15)とハサミを使用して、標本を傷つけたり壊したりすることなく、切歯を下顎から分離します。
- 単離された切歯をPBSで洗浄し、アルコール(70%および100%エタノール)の強度を高めることに2〜3時間浸して脱水を行います。
注:組織(例えば、歯髄)が十分に脱水されていない場合、樹脂含浸が阻害される可能性が高く、その後の評価が不十分になる可能性があります。 - エタノールで脱水した後、切歯を樹脂に水平に埋め込みます。手順 3 に進みます。
2. マウス結紮糸誘発歯周骨吸収(L-PBR)モデルにおける上顎歯槽骨の抽出
- 0.8 mLのケタミン(100 mg / mL)+ 0.1 mLのキシラジン(100 mg / mL)+ 9.1 mLのPBSを腹腔内(i.p.)にマウス(C57BL / 6、8-12週齢、雄)に麻酔薬として投与します。.投与量は0.01mL/g(重量)です。麻酔下での乾燥を防ぐために、両眼に点眼軟膏を塗布します。
- 麻酔をかけたマウスを加熱パッドに5〜10分間置きます。尾/つま先のつま先つま先つまみに対する反応と眼反射の無傷性を評価します。マウスが有害な刺激に反応せず、反射がないことを確認します。
- マウスを治療台に置き、治療台の磁気ポストに結ばれた結紮糸5-0シルク縫合糸を使用して口を開いたままにします。
- 手術用顕微鏡下で、マイクロニードルホルダーを使用して、結紮糸(編組シルク縫合糸6-0)を上顎第二大臼歯(単層)の片側に巻き付けます。一方を治療側、もう一方をコントロールとして、解析の個人差を最小限にとどめます。
- 結紮糸を結び、口蓋側に結び目を作ります。結び目を作った後、余分な結紮糸が咀嚼や食事を妨げないように、残りの結紮糸をできるだけ短く切ります。これは、その後の観察期間中に結紮糸が噛んで緩まないようにするために重要です。
注:動物が胸骨の横臥を維持するのに十分な意識を取り戻すまで、動物を放置しないでください。完全に回復するまで、手術を受けた動物を他の動物の会社に戻さないでください。生存中は無菌状態を維持します。 - マウスに食事と水を2週間 自由に 与えます。結紮の2週間後、マウスをCO2 で安楽死させ、続いて斬首します。
- 各マウスから大臼歯で両側上顎(結紮側とコントロール側)を抽出します。大臼歯で上顎を集めるには、無理な力を加えずにハサミで上顎周りの筋肉や骨を切っていきます。各上顎をPBSに入れ、μCT分析まで4°Cに保ちます(オプション)。
- 標本を傷つけたり壊したりすることなく、メス(#15)とハサミを使用して、大臼歯(1〜 3番目)で歯槽骨を上顎骨から分離します。
- 分離された歯槽骨をPBSで洗浄し、アルコール(70%および100%エタノール)の強度を高めることに2〜3時間浸漬して脱水および脱脂します。
注:組織(歯髄や骨など)が十分に脱水されていない場合、樹脂含浸が阻害される可能性が高く、その後の評価が不十分になる可能性があります。 - エタノールで脱水した後、歯槽骨を樹脂に水平に埋め込みます。手順 3 に進みます。
- オプション:微小硬さ試験の前にμCT評価を実施します。
- 微小硬さ試験の前に、補完的な評価として、微小硬さ試験と同じサンプルを使用して非破壊構造分析(μCTなど)を実行します(図1)。μCTによる構造情報(3D画像、鉱物密度、体積)は、微小硬度の結果に影響を与える可能性のあるサンプルの機械的特性と品質を評価するのに役立ちます。
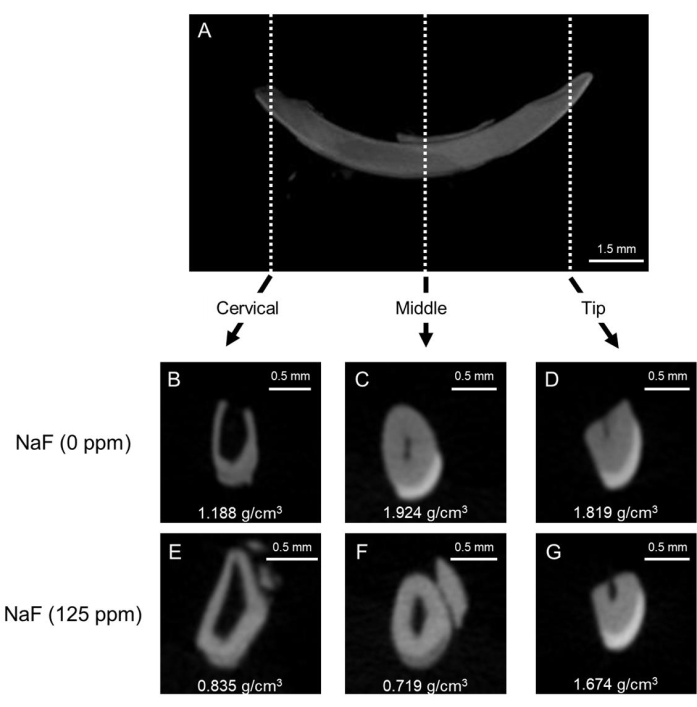
図1:コントロールおよびフッ化物処理マウス切歯におけるエナメル質の代表的なμCT画像 (A)下顎切歯の代表的なμCT矢状画像。(B-D) μCT 対照切歯の冠状画像 (NaF 0 ppm)。(E-G) μCT NaF (125 ppm) で処理された切歯の冠状画像。代表的なエナメル質鉱物密度(EMD)を示します(g / cm3)。 この図の拡大版を見るには、ここをクリックしてください。
3. 樹脂へのサンプルの埋め込み
- ステップ1.7(歯のフッ素症モデル)またはステップ2.10(L-PBRモデル)から続行します。
- 取り付けカップ(1インチ)の内面にワセリンの薄層をコーティングします。指示に従って樹脂(冷間硬化埋め込み樹脂)を混合します。付属のプラスチックカップに樹脂と硬化剤を15:2の容量比で注ぎ、木のヘラで少なくとも2分間注意深く混ぜます。気泡を避けてください。
- 脱水および脱脂した切歯(図2A)または歯槽骨(図2B)を、取り付けカップの底部に対して水平かつ平行に向けます(カップあたり1つの標本)。
- 混合した樹脂(ちょうどいい量の樹脂、約1.5mL)をマウントカップに注ぎ、試料を完全に覆います。余分な樹脂は研磨工程を妨げるため、必要以上に樹脂を添加しないでください(図2C、D)。試料の入った取り付けカップを50°Cのホットプレートに8時間以上置き、樹脂の重合を促進します。この手順は、試験片を安定した位置に保持するのに役立ちます。
注:サンプルサイズに応じて、レジンの量を調整して、サンプルを完全に覆います。レジンを充填しすぎないと、余分なレジンを取り除くのに時間がかかります。 - 硬化後、試料の入ったレジンをマウントカップから取り出します。バリを取り除き、粗い耐水性研磨紙(グリット60/P60および120/P120)を備えた高度なグラインダーポリッシャーを使用して、試験片の平面と反対側の側面を平行で平らに整えます。切歯骨と歯槽骨については、標本の高さを約3mmに保ちます(図2E、F)。
注:微小硬さ測定後にSEMで試料を分析する場合、その後のSEM観察に影響を与えないように、試料の厚さは約3mmにする必要があります。サンプルが小さいほど、グラインダーでの操作が難しくなります。微小硬度のみを目的としたサンプルの場合、試験片の高さは約10〜20mmまで増加する可能性があります。 - 精密切断のこぎりを使用して、長方形の固体樹脂ブロックと丸い角(約、幅30 mm、切歯の長さ10 mm(図2G)、歯槽骨の場合は幅10 mm、長さ5 mm(図2H))になるように外形を整えます。
- 大まかな形状の修正が完了したら、超音波洗浄機でレジンブロックの破片や粒子を取り除きます(約1分)。手順 4 に進みます。

図2:樹脂の埋め込みと研磨手順の流れ(A)脱水および脱脂切歯。(B)L-PBRの脱水および脱脂された歯槽骨。(C、D)切歯と歯槽骨を樹脂に浸します。(E、F)樹脂を切断することで、目的の組織表面を研磨しやすくなります。(G、H)研磨工程で丸みを帯びた樹脂の角。略語:L-PBR =結紮糸誘発歯周骨吸収。この図の拡大版を見るには、ここをクリックしてください。
4. 試料の研磨
注:試料の研磨は、水浸水中で高度なグラインダーポリッシャーで防水研磨紙(粗いものから細かいものまで)を使用して手動で行われます。
- 粗い耐水性研磨紙(Grit 600 / P1200)をグラインダーに置きます。トリミングしてクリーニングしたレジンブロック(手順3.7)を、耐水性の粗い研磨紙の上に置きます。
- 水を注ぎながら、樹脂ブロックを持ち、グラインダーポリッシャー(速度1-10 x g)で試料の評価面を研磨します。このとき、評価面が地面と平行になるように樹脂ブロックを持つように注意してください。評価面をそのまま保つために、肉眼または顕微鏡で表面を確認してください。
注意: グラインダーは時計回りに回転し、均一な圧力が平行でない表面につながる可能性があることに注意してください。平行な面を得るには、グライダーの回転速度を一定に保ち、試験片を数秒間慎重に押してから、試験片を180°回転させて同じ時間押します。粗い研磨紙は、樹脂だけでなく試料も除去することがあります。 - 研磨紙をGrit 800/P2400に交換し、その上にレジンブロックを置きます。手順4.2を繰り返します。
- 超音波洗浄機を使用して、レジンブロックから破片や粒子を取り除きます(約1分)。
注意: 先に進む前に、目詰まりを防ぐために超音波洗浄機を使用して表面の破片を取り除くことをお勧めします。 - 次に、より細かい研磨紙を使用して連続研磨を行います。研磨次数は、12μm、9μm、3μm、1μm、0.3μmです。
- グラッピングフィルム(12 μm)をグラインダー・ポリッシャーテーブルの上に回転させずに置き、レジンブロックをラッピングフィルムの上に置きます。
注:この実験では、グラインダーテーブルは、水が溜まった状態で平らな表面状態を得るのに適しています。あるいは、平行度を提供する大型の平面鏡(または類似の鏡)も使用できます。 - 水冷下で、ラッピングフィルム上の試験片の評価面を手で慎重に研磨します。2〜3 cm(1インチ)のストロークで水注入下で、サンプルを垂直、水平、斜めに同じ秒数だけ動かします。琢磨手順が適切に達成されると、樹脂試料がラッピングフィルムに付着します。
- 手順4.4のように破片や粒子を取り除きます。研磨紙を連続研磨順序(12μmから0.3μm)に従って次のサイズに変更し、その上に樹脂ブロックを置きます。
- 水を注ぎながら、レジンブロックを持ち、ラッピングフィルム上の試料表面を手で丁寧に研磨します。手順4.4のように破片や粒子を取り除きます。
- 手順4.5〜4.8を繰り返して、最終琢磨(0.3μm)を完了します。最終琢磨(0.3 μm)が完了すると、試験片の表面は鏡面仕上げになります(図3A)。
- 試料の表面をエタノール(100%)で洗浄し、脱脂・脱水し、微小硬さ試験まで室温でレジンブロックを保管します。保管中は、過度の湿気やほこりを避けてください。手順 5 に進みます。
5.ビッカース微小硬さ試験
注:鏡面仕上げ面の試験片のくぼみは、微小硬さ試験機を使用して行われます。試験は、ビッカースチップを使用して25gの負荷で10秒間実行されます。
- 切歯のビッカース微小硬さ試験(歯のフッ素症モデル)
注:エナメル質は、外側(口腔側)から内側(歯髄側)の3つの層に分けることができます。すなわち、表層、中間層、および深層(象牙質-エナメル接合部、DEJ)(図3B)16。このプロトコルでは、3つのエナメル層がテストされます。- 荷重を25gに、荷重持続時間を10秒に設定します。レジンブロックをステージに置きます。
- 各エナメル質層(表層、中層、DEJ)に6点、各領域(頸部、中部、先端)に象牙質をインデントします。 図3B)。
- 2つの対角線の長さを測定します(d1とd2; 図3B)ビッカース微小硬度値(HV; 図4)。
- 歯槽骨のビッカース微小硬さ試験(L-PBRモデル)
- 荷重を25gに、荷重持続時間を10秒に設定します。レジンブロックをステージに置きます。
- 歯槽骨の近心側と遠位側のそれぞれに、歯槽稜から3〜6ポイントをインデントします。第1大臼歯と第2大臼歯(白い四角)、および第2大臼歯と第3大臼歯の間の歯槽骨をへこませます。
注:このプロトコルでは、近心側と遠位側の各6ポイント(合計12ポイント)を対照(無傷の)骨について評価し、両側の3ポイント(合計6ポイント)をL-PBRについて評価しました。くぼみ点の数は、病変の状態によって異なります(たとえば、骨量が多すぎるとくぼみ領域が制限されます)。
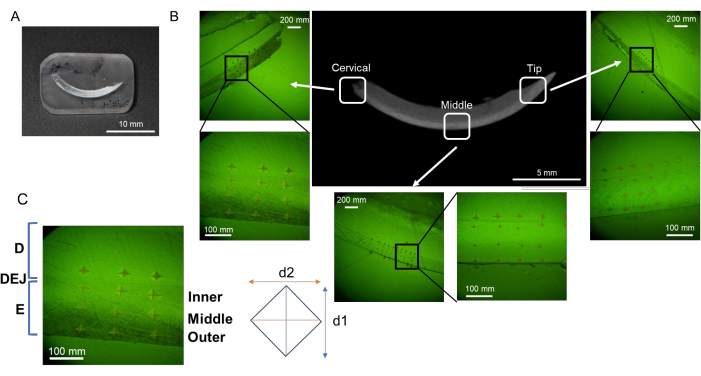
図3:下顎切歯の微小硬さの評価領域 (A)下顎切歯を含む鏡面サンプル。(B)各地域のインデント。頸部、中部、先端(NaF 0 ppm)。(C)3つのエナメル層。DEJ、インナー、ミドル、アウターエナメルから。略語:D =象牙質、E =エナメル質、DEJ =象牙質エナメル接合部 この図の拡大版を表示するには、ここをクリックしてください。
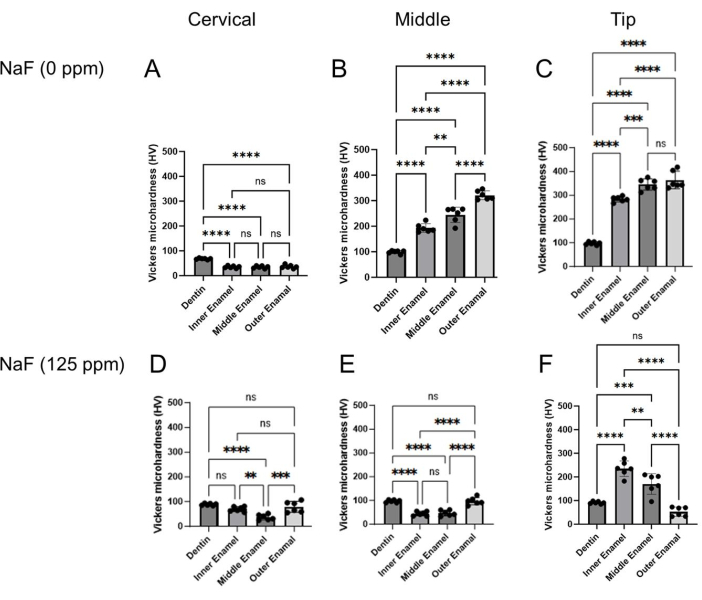
図4:NaFの有無にかかわらず処理されたエナメル質のビッカース微小硬度。 象牙質と3つのエナメル質層の微小硬度を、頸部、中部、先端部の各領域で評価した。(A-C)コントロールおよび(D-F)NaF(125 ppm)処理。データは平均 ± SD として提示され、有意差は Tukey の事後検定による一元配置 ANOVA によって評価されました。0.05< p 値は統計的に有意であると考えられた。**p < 0.005, ***p < 0.0005, ****p < 0.0001 この図の拡大版を見るには、ここをクリックしてください。
結果
歯のフッ素症モデル:図1は、対照マウスとフッ化物処理マウスの代表的なμCT画像を示しています。 対照(図1B-D)では、頸部は、中央(1.924 g / cm3)および先端(1.819 g / cm3;図1C、D)。フッ化物処理エナメル質(図1E-G)では、5つの?...
ディスカッション
微小硬度は、歯や骨などの硬組織の機械的特性を評価するために行われます。現在までに、さまざまな微小硬さ測定方法が報告されています。測定情報のほとんど、特にサンプル調製とくぼみ部位は不十分である可能性があります。この研究は、歯のフッ素症および歯周病モデルにおけるエナメル質および歯槽骨の微小硬度プロトコルに焦点を当てました。一貫性のある正確な結果を得るた?...
開示事項
著者は利益相反を宣言しません。
謝辞
本論文で報告した研究は、日本学術振興会科研費JP21K09915(MO)および国立医学総合医学研究所の支援を受けて行われました。T34GM145509(MM)および国立歯科頭蓋顔面研究所。R01DE025255とR21DE032156(XH);R01DE029709、R21DE028715、R15DE027851(TK);R01DE027648およびK02DE029531(MS)。
資料
| Name | Company | Catalog Number | Comments |
| Braided Silk Suture 6-0 | Teleflex | ||
| Canica Small Animal Surgery System | Kent Scientific Corporation | SURGI 5001 | |
| CarbiMet PSA 120/P120 | Buehler | 30080120 | |
| CarbiMet PSA 60/P60 | Buehler | 36080060 | |
| CarbiMet PSA 600/P1200 | Buehler | 36080600 | |
| Castroviejo Micro Needle hilder | F.S.T | 12060-01 | |
| Epofix cold setting embeding Resin | Electron Microscopey Science | CAT-1237 | |
| Fisherbrand 112xx Series Advanced Ultrasonic Cleaner | Fisher Brand | FB11201 | |
| Fluoride-free Rodent diet | Bio Serv | F1515 | AIN-76A, 1/2" Pellets |
| in-vivo microCT Skyscan 1176 | Bruker | ||
| Isomet 1000 Precison saw | Buehler | MA112180 | |
| Lapping film 0.3µm | Maruto instrument co, LTD. Japan | 26-4203 | Alternative A3-0.3 SHT, 3M USA |
| Lapping film 1µm | Maruto instrument co, LTD. Japan | 26-4206 | Alternative A3-1 SHT, 3M USA |
| Lapping film 12µm | Maruto instrument co, LTD. Japan | 26-4211 | Alternative A3-12 SHT, 3M USA |
| Lapping film 3µm | Maruto instrument co, LTD. Japan | 26-4204 | Alternative A3-3 SHT, 3M USA |
| Lapping film 9µm | Maruto instrument co, LTD. Japan | 26-4201 | Alternative A3-9 SHT, 3M USA |
| Leica wild microscope | Leica | LEIC M690 | |
| Metaserv 2000 Variable speed Grinder polisher | Buehler | No: 557-MG1-1160 | |
| MicroCut PSA 1200/P2500 | Buehler | 36081200 | |
| MicroCut PSA P4000 | Buehler | 36084000 | |
| Microhardness tester, ALPHA-MHT-1000Z | PACE Technologies | ||
| SamplKups 1 inch | Buehler | No: 209178 | |
| Sodium Fluoride | Fisher Scientific | S299-100 | |
| West cott Stitch Scissor | JEDMED | Cat. #25-1180 | |
| ZooMed Repti Thern Undertank heater (U.T.H) | Zoo Med Laboratories, Inc. | RH-4 |
参考文献
- Broitman, E. Indentation hardness measurements at macro-, micro-, and nanoscale: A critical overview. Tribol Lett. 65 (1), 23 (2017).
- Lee, M. J., et al. Sirt6 activation ameliorates inflammatory bone loss in ligature-induced periodontitis in mice. Int J Mol Sci. 24 (13), 10714 (2023).
- Min, J., et al. Investigation on the gradient nanomechanical behavior of dental fluorosis enamel. Nanoscale Res Lett. 13 (1), 347 (2018).
- Craig, R. G., Peyton, F. A. The micro-hardness of enamel and dentin. J Dent Res. 37 (4), 661-668 (1958).
- Chun, K., Choi, H., Lee, J. Comparison of mechanical property and role between enamel and dentin in the human teeth. J Dent Biomech. 5, (2014).
- Suzuki, M., Everett, E. T., Whitford, G. M., Bartlett, J. D. 4-phenylbutyrate mitigates fluoride-induced cytotoxicity in alc cells. Front Physiol. 8, 302 (2017).
- Sharma, R., et al. Assessment of dental fluorosis in mmp20 +/- mice. J Dent Res. 90 (6), 788-792 (2011).
- Wu, W. W., et al. Bone hardness of different anatomical regions of human radius and its impact on the pullout strength of screws. Orthop Surg. 11 (2), 270-276 (2019).
- Li, S., et al. Atlas of human skeleton hardness obtained using the micro-indentation technique. Orthop Surg. 13 (4), 1417-1422 (2021).
- Ibrahim, A., et al. Hardness an important indicator of bone quality, and the role of collagen in bone hardness. J Funct Biomater. 11 (4), 85 (2020).
- Vandana, K. L., Srishti Raj, B., Desai, R. Dental fluorosis and periodontium: An original research report of in vitro and in vivo institutional studies. Biol Trace Elem Res. 199 (10), 3579-3592 (2021).
- Xia, P. F., et al. Microcarriers containing "hypoxia-engine" for simultaneous enhanced osteogenesis and angiogenesis. Chemical Engineering Journal. 456, 141014 (2023).
- Chiu, R., et al. Effects of biglycan on physico-chemical properties of ligament-mineralized tissue attachment sites. Arch Oral Biol. 57 (2), 177-187 (2012).
- Leong, N. L., et al. Age-related adaptation of bone-pdl-tooth complex: Rattus-norvegicus as a model system. PLoS One. 7 (4), e35980 (2012).
- Johnson, W. M., Rapoff, A. J. Microindentation in bone: Hardness variation with five independent variables. J Mater Sci Mater Med. 18 (4), 591-597 (2007).
- Kweon, Y. S., et al. Effects of fam83h overexpression on enamel and dentine formation. Arch Oral Biol. 58 (9), 1148-1154 (2013).
- Boivin, G., et al. The role of mineralization and organic matrix in the microhardness of bone tissue from controls and osteoporotic patients. Bone. 43 (3), 532-538 (2008).
- Okamoto, M., et al. Microstructural evaluation of the mineralized apical barrier induced by a calcium hydroxide paste containing iodoform: A case report. J Endod. 2 (2), 243-251 (2024).
- Wang, Y., et al. B10 cells alleviate periodontal bone loss in experimental periodontitis. Infect Immun. 85 (9), e00335 (2017).
- Chen, Y., et al. Nlrp3 regulates alveolar bone loss in ligature-induced periodontitis by promoting osteoclastic differentiation. Cell Prolif. 54 (2), e12973 (2021).
- Robinson, J. W., et al. Male mice with elevated c-type natriuretic peptide-dependent guanylyl cyclase-b activity have increased osteoblasts, bone mass and bone strength. Bone. 135, 115320 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved