このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
腸粘膜免疫応答を解析するための免疫適格腸内チップモデル
* これらの著者は同等に貢献しました
要約
当社の詳細なプロトコルは、3D構造とさまざまな細胞タイプでヒトの腸粘膜をシミュレートし、微生物のコロニー形成に応答した免疫応答と細胞機能の詳細な分析を可能にする高度な腸オンチップモデルの作成と使用について概説しています。
要約
上皮の3D器官型絨毛様および陰窩様構造を再現する高度な腸オンチップモデルが開発されました。免疫適格モデルには、ヒト臍帯静脈内皮細胞(HUVEC)、Caco-2腸上皮細胞、組織常在マクロファージ、樹状細胞が含まれ、これらは組織内で自己組織化し、ヒト腸粘膜の特性を反映しています。このプラットフォームのユニークな側面は、循環するヒト初代免疫細胞を統合し、生理学的関連性を高める能力です。このモデルは、細菌や真菌のコロニー形成や感染に対する腸管免疫系の反応を調べるために設計されています。キャビティサイズが拡大しているため、このモデルは、透過アッセイ、サイトカイン放出、免疫細胞浸潤などの多様な機能的読み出しを提供し、上皮細胞層によって形成される3D構造の免疫蛍光測定に適合します。これにより、細胞の分化と機能に関する包括的な洞察が得られます。このインタインオンチッププラットフォームは、微生物叢の代理とヒト宿主組織との間の微生物叢の代理と、微生理学的灌流バイオチッププラットフォーム内での複雑な相互作用を解明する可能性を実証しています。
概要
Organ-on-Chip(OoC)システムは、従来の2D細胞培養と動物モデルとの間のギャップを埋めることができる3D細胞培養の新たな技術です。OoCプラットフォームは、典型的には、メンブレンまたはハイドロゲル1のような広範囲の足場上で増殖した組織特異的細胞を含む1つ以上のコンパートメントからなる。モデルは、1つ以上の定義された器官型機能を模倣することができます。ポンプは、細胞の老廃物を除去するための細胞培養培地の連続的なマイクロ流体灌流、細胞分化を改善するための栄養因子と成長因子の供給、および必要なin vivo条件の再現を可能にします。免疫細胞の統合により、OoCシステムはin vitroでヒトの免疫応答を模倣することができます2。これまでに、さまざまな臓器や機能単位が発表されてきました1。これらのシステムには、血管系3、肺4、肝臓2,5、および腸6のモデルが含まれ、薬物試験5,7および感染研究6,8のために容易にすることができる。
ここでは、絨毛様および陰窩様構造の器官型3Dトポグラフィーを形成するヒト上皮細胞を統合し、内皮内層および組織常在マクロファージを組み合わせたヒト腸オンチップモデルを紹介します。このモデルは、マイクロ流体灌流バイオチップで顕微鏡スライドの形式で培養されます。各バイオチップは、2つの別々のマイクロ流体キャビティで構成されています。各キャビティは、多孔質ポリエチレンテレフタレート(PET)膜によって上部と下部のチャンバーに分割されています。膜自体は、細胞が両側で成長するための足場としても機能します。メンブレンの細孔は、細胞のクロストークと細胞層間の細胞移動を可能にします。各チャンバーには、2つのメスルアーロックサイズのポートからアクセスできます。オプションで、追加のミニルアーロックサイズのポートを使用して、上部または下部のチャンバーにアクセスできます(図1)。
OoCプラットフォームは、1回の実験から得られる多数の読み出しを提供します。インセプトオンチップは、灌流3D細胞培養、廃液分析、および蛍光顕微鏡法を組み合わせて、細胞マーカーの発現、代謝率、免疫応答、微生物のコロニー形成と感染、およびバリア機能を評価するように調整されています3,6,8。このモデルには、組織に常在する免疫細胞と、生きた微生物と宿主組織との直接接触が含まれており、これは他の公開モデルと比較して利点である9。さらに、上皮細胞は、生きた微生物叢とのコロニー形成に生理学的に関連性のあるインターフェースを提供する三次元構造に自己組織化します6。
Access restricted. Please log in or start a trial to view this content.
プロトコル
このプロトコルでは、健康なドナーからバイオチップ1本あたり~20mLの新鮮な血液を摂取し、ヒトの初代単球を分離する必要があります。すべてのドナーは、この研究に参加するために書面によるインフォームドコンセントを提供し、イエナ大学病院の倫理委員会によって承認されました(許可番号2018-1052-BO)。資料の詳細については、 資料表をご参照ください。すべての溶液と培地の組成の詳細については、 表1を参照してください。
1. バイオチップの取り扱いに関する一般的な注意事項
- リザーバーのストリップを慎重に分離し、加熱されたナイフを使用して蓋を取り外して、単一のリザーバーと蓋を取得します。シリコンチューブがぴったりと収まるように、蓋の穴を広げます。
- シリコンチューブの内径は0.5mmで、非対称で、2つのチューブポンプストッパーによって長い(20cm)側と短い側(12cm)に分かれています。バイオチップごとに各対称の2本のチューブを組み立てるには、チューブをオスのルアーロックコネクタとチューブの反対側の蓋に取り付けます。また、バイオチップごとに4つのリザーバーを組み立てます。
注:チューブとリザーバーを事前に準備し、使用前にオートクレーブ滅菌してください。シリコーンチューブの寿命は限られているため、3〜5回の実験後にチューブを交換してください。薬物試験など、特定の研究対象については、実験ごとに新しいチューブを準備することをお勧めします。このプロトコルの多くのステップは並行して実行されます。 図 2 に示すように、1 日に実行されるさまざまな手順を強調した概要図を参照してください。
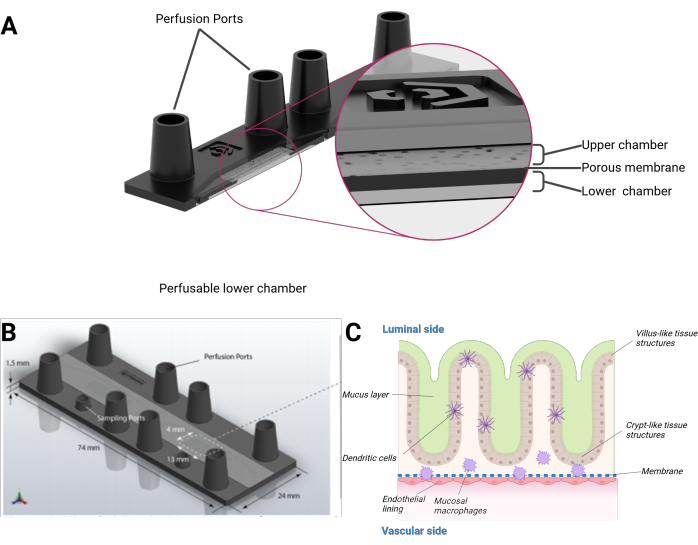
図1:intestine-on-chipモデルの概略図(A)バイオチップを断面図で示しています。(B)バイオチップ全体と、平らで取り外し可能なPETメンブレンの寸法が見えます。メスのルアーロックサイズのポートを含む上部チャンバーの総容量は、下部チャンバーでそれぞれ 290 μL と 270 μL です。(C)腸管バイオチップの概略的な組成物として、分化した免疫細胞や粘液層を含む絨毛様や陰窩状の構造に似た立体的な伸長上皮が見られる。PETメンブレンの反対側は、内皮単層で覆われています。この図の拡大版を表示するには、ここをクリックしてください。
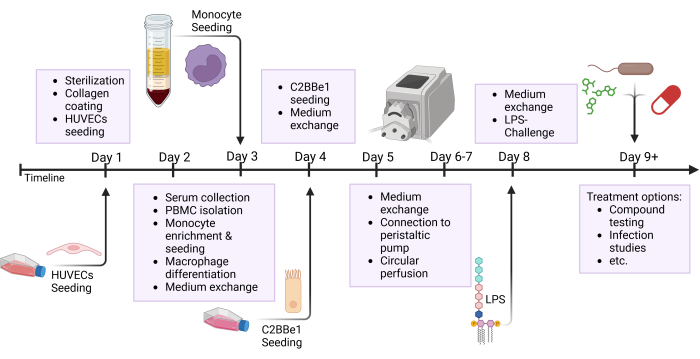
図2:モデルの構築タイムラインと実験セットアップの概略図。 次の図は、提示されたプロトコルの概略図の概要を示しています。細胞の播種やLPSによる上皮チャレンジなどの重要な手順は、矢印で示されています。略語:HUVECs =ヒト臍帯静脈内皮細胞;LPS =リポ多糖類。 この図の拡大版を表示するには、ここをクリックしてください。
2.バイオチップ滅菌
- 直径15cmの滅菌ガラスペトリ皿に、70%の非変性エタノールを入れます。バイオチップのすべてのポートがエタノール溶液で完全に覆われるように、バイオチップを内部に置きます。
- ポートごとに2回、チップのすべてのチャンバーから1 mLの70%エタノールを引き出します。室温(RT)で45〜60分間インキュベートします。
注意: バイオチップ内に空気が閉じ込められていないことを確認してください。この時点から、バイオチップシステムに空気が入ることはなく、空洞は液体で満たされたままになるはずです。 - ペトリ皿のエタノールを取り除き、すべてのポートが完全に覆われるまで滅菌二重蒸留水(ddH2O)と交換します。再度、ポートごとに2回、バイオチップキャビティを通して1mLのddH2Oを引き出します。ペトリ皿のddH2Oをリフレッシュし、手順を繰り返します。
- ペトリ皿からすべての液体を取り除きます。今後、完全に滅菌されたバイオチップは、無菌環境の外にあるときはいつでも、閉じたペトリ皿の内側に保管してください。2〜5 mL ddH2Oの小さなリザーバー(50 mLチューブの蓋など)をペトリ皿に追加して、バイオチップ内の液体の蒸発を減らします。
注:バイオチップは、使用まで無菌環境に置いておくと、最大3日前に滅菌できます。これにより、1日でワークロードを柔軟に処理できます。
3. HUVECの収穫および播種
注:ヒト臍帯静脈内皮細胞(HUVEC)は、10より前に発表されたように臍帯から単離されました。
- HUVECを播種する前に、メンブレンをヒトコラーゲンIVでコーティングします。このためには、マグネシウムとカルシウムを含むダルベッコのリン酸緩衝生理食塩水(PBS +/+)にコラーゲンストック溶液(表1)を1:100希釈して調製します。希釈したストック溶液350μLをそれぞれのチャンバーに加えます。RTで5分間インキュベートします。
注:バイオチップを滅菌フードで取り扱う場合は、その下に滅菌組織を置いて、過剰な培地を収集することをお勧めします。 - すべてのチャンバーを350 μL のPBS +/+で2回フラッシングし、残りのコラーゲンと酢酸を洗い流します。次に、各チャンバーに350 μLの内皮細胞増殖(EC)培地を加えます。
注:ここから、バイオチップは細胞播種の準備が整い、使用するまで37°Cで保存できます。 - 継代1〜3でHUVECを80〜90%の細胞密度で使用します。HUVECは、メーカーが提供する所定のサプリメントミックスを含むEC培地で培養します。HUVEC細胞培養の代表的な明視野像を 図3Aに示します。
注:ドナーによっては、より高い通路のHUVECが脱分化し始め、バイオチップ内に密集した合流性単層を確実に形成できなくなります。抗生物質、すなわち100 U/mLペニシリンと100 μg/mLストレプトマイシンの使用は任意ですが、微生物汚染を防ぐためのEC培地のサプリメントとして推奨されます。 - T25細胞培養フラスコから細胞培養培地を取り出し、マグネシウムとカルシウムを含まない3〜5mLのダルベッコリン酸緩衝生理食塩水(PBS-/-)で細胞を穏やかに洗浄します。PBS-/-を取り外し、1 mLのトリプシン解離試薬を追加します(表1)。細胞が細胞培養フラスコから分離するまで、37°Cで5分間インキュベートします。
- PBS中の9 mLの5%ウシ胎児血清(FBS)を使用して、剥離した細胞をチューブに移します-/-。室温で350 × g で5分間遠心分離し、上清を除去し、1 mLのEC培地に再懸濁し、細胞数を決定します。細胞濃度を150μLあたり0.4×10個6 個(下部チャンバーでの播種)または250μLあたり(上部チャンバーでの播種)に調整します。
- それぞれの量のセルをチャンバーに追加します。下部チャンバーで播種する場合は、すべてのポートを閉じ、すぐにバイオチップを逆さまにして、細胞がPETメンブレンに落ちるようにします。バイオチップを加湿インキュベーターで37°C、5%CO2でインキュベートします。
- 24時間後に、HUVEC含有チャンバーを350 μLのEC培地と交換します。対向するチャンバー内の媒体を交換する必要はありません。
4. ヒト血清採取と末梢血単核細胞(PBMC)由来単球の単離
注:PBMCは、Mosig et al.11に記載されているように単離されました。
- 健康なドナーからヒトの静脈血を採取します。バイオチップごとに、血清採取のためにケイ酸塩含有採血チューブで最低10mLの全血を調達します。完全に凝固した後、採血チューブを2,500 × g でRTで10分間遠心分離し、血清、分注を採取し、さらに使用するまで-20°Cで保存します。
- PBMC分離のために、同じドナーから最低10mLの全血をEDTA含有採血チューブで調達します。凝固していない血液を等緩衝液(表1)と1:1で穏やかに混合し、この混合物の35 mLを、密度1.077 g / mLの密度15 mLの密度勾配培地の上に50 mLチューブでゆっくりと重ねます。.
- RTで800 g× gで 20分間遠心分離し、得られた免疫細胞層を慎重に引き出し、密度勾配培地の上に現れ、新しい50 mLチューブに移します。50mLまで冷たくしたアイソバッファーを充填し、穏やかに反転させて細胞を洗浄します。
- 200 × g で8分間、ブレーキなしで4°Cで遠心分離します。 上清を捨て、密度勾配ごとに10 mLのアイソバッファーに再懸濁します。オプション: 複数のグラジエントが並行して実行される場合は、1 人のドナーの PBMC をプールします。
- 150 × g で4°Cで8分間遠心分離します。 上清を捨て、密度勾配ごとにペレットを10 mLのアイソバッファーに再懸濁します。遠心分離ステップ4.4を繰り返します。最後に、上清を捨て、細胞を2 mLの単球分化培地に再懸濁します(表1)。
注:M-CSFおよびGM-CSFの添加は、単離された単球の分化を単球由来マクロファージおよび単球由来樹状細胞(このプロトコルの後の時点で添加されるリポ多糖[LPS]と組み合わせて)に強制する。抗生物質、すなわち100 U/mLペニシリンおよび100 μg/mLストレプトマイシンの使用は任意ですが、微生物汚染を防ぐための培地のサプリメントとして推奨されます。 - 細胞数を決定し、2 mLの単球分化培地中の6ウェルプレートのウェルあたり10~10 ×6 個の細胞を播種します(表1)。加湿インキュベーターで37°Cで1時間インキュベートし、6ウェルプレートのプラスチックに単球を付着させます。
- 上清を慎重に廃棄し、予熱した2 mLの造血細胞培地で2回洗浄し、結合していない細胞を取り除きます。単球分化培地で37°Cでさらに24時間インキュベートします。
- 単球を採取するには、上清を慎重に捨て、予熱したPBS2 mLで一度洗浄します。この時点での単球培養の明視野像の例については、 図3B を参照してください。次に、37°Cで1 mLの予熱単球剥離試薬(表1)で細胞を7分間インキュベートし、6ウェルプレートのプラスチックからの単球の剥離を強制します。
- 剥離した単球を低結合チューブに移します。オプション:より高い細胞収量を達成するために、6ウェルプレートをPBS-/-で数回慎重に洗浄します。
- 室温で300 × g で8分間遠心分離し、上清を廃棄し、ECコンディショニング培地に再懸濁します(表1)。細胞番号を決定し、細胞濃度を150μLあたり0.1×10個6個( 下部空洞での播種)または250μLあたり(上部空洞での播種)に調整します。
注:免疫細胞の分離のすべてのステップで穏やかにし、免疫細胞の活性化を防ぐためにせん断力を減らしてください。この単離を確立する際には、PBMC由来単球の純度を確認してください(フローサイトメトリーなど)。全細胞の95%以上が、CD14などの典型的な単球マーカーに陽性であるべきです。
5.単球播種
- HUVEC含有チャンバー内で、予熱したECコンディショニング培地350μLと培地交換を行います。
- 調製した単球懸濁液(ステップ4.10を参照)の150μL(下部チャンバー)または250μL(上部チャンバー)を同じチャンバーに加えます。下部チャンバーに播種する場合は、すべてのポートを閉じ、すぐにバイオチップを逆さまにして配置し、細胞がHUVEC層に落下するようにします。バイオチップを加湿インキュベーターで37°C、5%CO2でインキュベートします。
- HUVEC + 単球含有チャンバー内で、350 μL の EC コンディショニング培地と 24 時間ごとに培地交換を行います。
6. C2BBe1の収穫と播種
注:細胞1(C2BBe1)12 を発現するCaco-2ブラシ境界は、継代35まで使用され、80〜90%の密度のフラスコから採取されます。C2BBe1培養物の代表的な明視野像を 図3Cに示します。
- C2培地でC2BBe1細胞を培養します(表1)。
注:抗生物質、すなわち20μg/mLゲンタマイシンの使用は任意ですが、微生物汚染を防ぐためのC2培地のサプリメントとして推奨されます。 - T25細胞培養フラスコの細胞培養培地を取り出し、3〜5mLのPBS-/-で細胞を穏やかに洗浄します。PBS-/-を取り外し、1 mLのトリプシン解離試薬を追加します(表1)。細胞が細胞培養フラスコから分離するまで、37°Cで5分間インキュベートします。
- PBS中の5%ウシ胎児血清(FBS)9mLを使用して、剥離した細胞をチューブに移します-/-。室温で350 × g で5分間遠心分離し、上清を取り除き、1 mLのC2培地に再懸濁して、細胞数を決定します。細胞濃度を150 μL(下部チャンバーでの播種)または250 μL(上部チャンバーでの播種)あたり0.5 × 106 細胞に調整します。
- C2BBe1を播種する前に、350μLのC2培地で各チャンバーを穏やかに洗浄してください。
- 調製したC2BBe1懸濁液(ステップ6.3を参照)の150μL(下部チャンバー)または250μL(上部チャンバー)をそれぞれのチャンバーに加えます。下部チャンバーに播種する場合は、すべてのポートを閉じ、すぐにバイオチップを逆さまにして、細胞がPETメンブレンに落ちるようにします。バイオチップを加湿インキュベーターで37°C、5%CO2でインキュベートします。

図3:バイオチップに播種する前のHUVEC、単球、およびC2BBe1の細胞形態。 この図は、プロトコル全体で使用されるさまざまな細胞源の代表的な明視野画像を示しています。画像は、10倍の倍率を使用して逆明視野顕微鏡で撮影されました。すべての細胞タイプ、(A)HUVEC、(B)単球、および(C)C2BBe1は、それぞれの特定のプロトコールセクションに記載されているように、2D単層細胞培養で培養しました。スケールバー = 200 μm。略語:HUVECs =ヒト臍帯静脈内皮細胞;PBMCs = 末梢血単核細胞。 この図の拡大版を表示するには、ここをクリックしてください。
7.蠕動ポンプと循環灌流への接続
- 蠕動ポンプを追加して空のインキュベーターを準備します。インキュベーターのすべての領域を徹底的に洗浄し、消毒剤でポンプして、準無菌環境を提供します。
注:蠕動ポンプは、作業中に大量の熱を発生することがあります。断熱性の高いインキュベーターや空調の行き届いていない実験室では、インキュベーターが過熱する傾向があるため、インキュベーターごとに使用できるポンプの数が制限される場合があります。インキュベーターごとに2つの蠕動ポンプが適切であるべきです。 - 滅菌したチューブをバイオチップに取り付ける前に、各チューブを700 μLのPBS +/+でフラッシュし、続いて500 μLのC2培地またはECコンディショニング培地でフラッシュします。媒体ごとに各対称のチューブを1本準備します(ステップ1.2を参照)。ルアーロックからペリスタルティックポンプストッパーまでの距離が短いチューブは左のキャビティに、チューブはもう一方の対称性を持つチューブを右のキャビティに使用します。
- インキュベーターからバイオチップを取り出し、各チャンバーで350μLの培地交換を行います。すべてのプラグを取り外し、すべてのポートを一番上まで埋めます。
- 左側のキャビティから始めて、ルアーロックアダプターをバイオチップのポートに挿入して、最初のチューブを上部チャンバーの右側のポートに接続します。次に、2 番目のチューブを下部チャンバーの左側のポートに接続します。この手順を右のマイクロ流体キャビティに対して繰り返します。
- リザーバーを取り、リザーバーの底に細胞培養培地を少量加えます。次に、リザーバーを最初のチューブの反対側に挿入し、もう一方のチャンバーについても繰り返します。すべてのポートをチューブまたはリザーバーに接続したら、リザーバーに3.5 mLの細胞培養培地を入れます。
- 蓋が取り付けられているチューブの緩い面をリザーバーの上に置き、各チャンバーのマイクロ流体システムを閉じます。この状態で、バイオチップを蠕動ポンプに輸送します。
注:インキュベーターまでの距離と実験室の周囲に応じて、事前に洗浄してオートクレーブ滅菌したボックスを使用してチップをインキュベーターに移すことができます。 - チューブをポンプに接続するには、蠕動ポンプストッパーを使用します。媒体がリザーバーからキャビティに流れ込み、チューブに流れ込み、ポンプを介してリザーバーに戻るように、各チューブを蠕動ポンプに接続します(図4)。リザーバーは、円形灌流のバブルトラップとして機能し、空気がシステムに閉じ込められるのを防ぎます。50μL/minの流速で各チャンバーを灌流すると、上部チャンバーで0.013 dyn/cm2、下部チャンバー8で0.006 dyn/cm2のせん断応力が得られます。
注:下部腔と上部腔の媒体が反対方向に移動される場合、腸組織のより高い三次元成長を達成することができる13。したがって、上部と下部の空洞の貯留層は反対側に配置されます(図4)。環状灌流は、必要な細胞培養培地の量を減らしますが、サイトカインや代謝物の濃縮につながる可能性があります。必要に応じて、バイオチップの線状灌流も可能です。 - バイオチップを37°Cおよび5%CO2で72時間灌流します。

図4:蠕動ポンプに接続されたバイオチップ。 蠕動ポンプに接続されたバイオチップの例が示されています。上皮性C2BBe1細胞は下部チャンバーで培養され(赤色のC2培地は前面のリザーバーにあります)、HUVECは上部チャンバーで培養されます(黄色がかったECコンディショニング培地は背面のリザーバーにあります)。異なる細胞培養培地は、成長した組織のバリア機能のために混合されていません。バイオチップは、媒体がリザーバーからキャビティに流れるように蠕動ポンプに接続されています。ここから、媒体はポンプを介してチューブを通ってリザーバーに逆流します。 この図の拡大版を表示するには、ここをクリックしてください。
8. LPSによる上皮バリアのコンディショニング
- 72時間の予備灌流後、蠕動ポンプを停止し、各リザーバーのチューブに接続されている蓋を取り外します。.ポンプの隣の滅菌ティッシュの上に置きます。
- すべての培地を取り出し、リザーバーに2mLの新しく調製した培地を入れます。C2BBe1細胞を含む上皮側については、100 ng/mL LPSを培地に加えます。
注:LPSは、組織のバリア機能を高め、単球由来のマクロファージを刺激して上皮組織に移動し、単球由来の樹状細胞の分化を可能にします。 - チューブと蓋をリザーバーに再接続し、50 μL/minの流速でさらに24時間、円形灌流を続けます。
注:この時点から、チップモデルは化合物試験や感染研究などの実験に使用できます。24時間ごとにリザーバーあたり2mLの中程度の交換をお勧めします。
9. さまざまな読み出し方法のための組織へのアクセス
- 灌流中は常にリザーバーから細胞培養培地の上清を収集します。リザーバーを開き、目的のボリュームを収集します(手順8.1〜8.3を参照)。これらの上清は、代謝物、サイトカイン、またはその他の分子の検出に使用します。
- 組織にアクセスするには、メスを使用して上部チャンバーの外側に沿って正確なカットを行い、ボンディングホイルを取り外してマイクロ流体キャビティを開きます。腸内バイオチップモデルの組織にアクセスできるようになりました。マイクロ流体チャンバーの外側に沿って慎重に切断し、バイオチップからメンブレンを剥がします。ピンセットを使用して組織含有膜を収集します。
注意: このステップでは指の位置に注意し、事故を防ぐために慎重に作業してください。耐切創性手袋をお勧めします。 - あるいは、酵素溶液、すなわちトリプシンまたはTriton X-100含有バッファーを使用して溶解した細胞を使用して、バイオチップ内の別々の層から細胞を回収します。
10. FITC-デキストラン拡散による透過性評価
注:組織のバリア機能は、蠕動ポンプの切断後にFITC-デキストラン透過性アッセイを介して分析できます。FITC-デキストラン透過性評価は、Deinhardt-Emmer et al.4 から採用されました。
- フルオレセインイソチオシアネート(FITC)-デキストラン(分子量3-5 kDa、 表1)のストック溶液を調製します。
- リザーバーを空にし、チップを灌流から切り離します。
- 上部と下部のチャンバーでフェノールレッドフリー培地と培地交換を行います。
注:実験中にフェノールレッドフリー培地がすでに使用されている場合、この手順は必要ありません。 - 1 mg/mL FITC-デキストラン溶液 350 μL を C2BBe1 細胞を含むチャンバーに加えます。
- ポートを閉じ、上皮側を上に向けてチップを37°Cで60分間インキュベートします。
- インキュベーション時間後、チップの両チャンバーから培地を別々に収集し、測定まで光から保護して4°Cで保存します。
- 測定には、C2培地とフェノールレッドを含まないECコンディショニング培地で、1,000 μg/mLから0 μg/mLのFITC-デキストランを11回連続して1:2段階希釈して標準曲線を調製します。
- 各サンプルの200 μLを、底が透明な黒色の96ウェルプレートに移します。マイクロプレートリーダーで励起波長495 nm、発光波長517 nmの蛍光を測定します。
- 標準曲線を使用して、サンプルのFITC-デキストラン濃度、ひいては透過性係数を計算します。
11. 免疫蛍光染色
注:生体組織は顕微鏡で調べることができます。取り扱いを容易にするために、バイオチップをペリスタルティックポンプから取り外し、倒立顕微鏡で長距離対物レンズを使用することをお勧めします。エンドポイント分析として、免疫蛍光染色などの手順のために、組織をバイオチップ内に固定することができます。
- 蠕動ポンプを停止し、すべての空洞のリザーバーを開きます。リザーバーを空にし、チューブとリザーバーをバイオチップから外します。
- チャンバーごとに2回、マイクロ流体キャビティを500μLの冷たいPBS +/+で洗浄します。氷冷したメタノール500μLをすべてのキャビティに加え、-20°Cで15分間インキュベートします。 次に、キャビティごとに2回、マイクロ流体チャンバーを500μLのPBS +/+で洗浄します。
注:4%パラホルムアルデヒドまたはカルノイ固定剤による固定などの他の固定方法も適しています。固定後、チップは4°Cで保存するか、直接免疫蛍光染色に進むことができます。注意:メタノールやパラホルムアルデヒドなどの固定化学物質は有毒です。ヒュームフードの下でそれぞれの作業を行い、それに応じて廃棄物を収集します。 - ステップ9.2の説明に従ってチップを開き、組織にアクセスします。組織含有PETメンブレンを最大3つに切断して、異なるイムノパネルと並行して染色します。
- 精密ピンセットを使用して、各メンブレン片をブロッキングおよび透過化溶液(表1)を含む別々の24ウェルプレートに移します。染色プロセス全体を通して、目的の細胞層が常に上を向いていることを確認してください。メンブレンピースを室温で30分間インキュベートします。
注:血清を二次抗体に一致させると、最良の染色結果が得られます。例えば、ヤギ種から二次抗体が得られる場合は、正常なヤギ血清の使用を推奨します。 - メンブレン片を湿ったチャンバー内の清潔なスライドガラスに移します。染色液(表1)で一次抗体パネルを調製し、各メンブレンピースに50 μLを加えます。4°Cで一晩インキュベートします。
注:最適な抗体濃度と染色効果は、メーカーやクローンによって異なる場合があります。染色パネルは、事前に2D細胞培養で試験することをお勧めします。 - インキュベーション後、サンプルを24ウェルプレートに移し、メンブレンを洗浄液で3 x 5分間穏やかに洗浄します(表1)。
- 再度、メンブレン片を湿気の多いチャンバー内のきれいなスライドガラスに移します。二次抗体パネルを染色溶液(表1)で調製し、各メンブレン片に50 μLを加えます。必要に応じて、4',6-ジアミジノ-2-フェニルインドール(DAPI)やHoechstなどの核対比染色を添加します。室温で30分間インキュベートします。
注:蛍光色素を使用している間は、光退色を防ぐためにサンプルを光から保護して画像品質を向上させてください。 - インキュベーション後、サンプルを24ウェルプレートに移し、メンブレンを洗浄液で2 x 5分間穏やかに洗浄します(表1)。次に、PBS +/+で5分間一度洗浄します。
- 蛍光封入剤とカバーガラスを使用して、透明なスライドガラスにメンブレンピースを取り付けます。顕微鏡イメージングまで4°Cで保存してください。
Access restricted. Please log in or start a trial to view this content.
結果
これらの代表的な結果は、インタネインオンチップモデルの異なる組織層を示しています。それらは、プロトコルセクション11に記載されているように免疫蛍光染色されています。画像は、落射蛍光顕微鏡または共焦点蛍光顕微鏡でZスタックとして撮影され、直交投影に処理されました。顕微鏡のセットアップとソフトウェアの詳細については、材料の表を参照してください。
Access restricted. Please log in or start a trial to view this content.
ディスカッション
提示されたプロトコルは、免疫適格な腸オンチップモデルを生成するために必要な手順を詳述しています。免疫蛍光顕微鏡法、サイトカインおよび代謝物分析、フローサイトメトリー、タンパク質および遺伝子分析、透過性測定などの特定の技術と可能な読み出し方法について説明しました。
記載されたモデルは、初代HUVEC、単球由来マクロファージ、および単球由来樹...
Access restricted. Please log in or start a trial to view this content.
開示事項
M.R.はDynamic42 GmbHのCEOであり、同社の株式を保有しています。A.S.M.はDynamic 42 GmbHの科学顧問であり、同社の株式を保有しています。
謝辞
この作業は、Collaborative Research Center PolyTarget 1278 (プロジェクト番号 316213987) から V.D.W. と A.S.M. A.F. への財政的支援を受けており、A.S.M. はさらに、ドイツのエクセレンス戦略 - EXC 2051 - Project-ID 690 390713860 に基づくクラスター・オブ・エクセレンス「Balance of the Microverse」による財政的支援を認めています。Astrid Tannert 氏と Jena Biophotonic and Imaging Laboratory (JBIL) が共焦点レーザー走査型顕微鏡 ZEISS LSM980 へのアクセスを提供してくださったことに感謝いたします。 図 1C と 図 2 は Biorender.com を使用して作成されました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 96-well plate black, clear bottom | Thermo Fisher | 10000631 | Consumables |
| Acetic acid | Roth | 3738.4 | Chemicals |
| Alexa Fluor 488 AffiniPure, donkey, anti-mouse IgG (H+L) | Jackson Immuno Research | 715-545-150 | Secondary Antibody Vascular Staining and Epithelial Staining |
| Alexa Fluor 647 AffiniPure, donkey, anti-rabbit IgG (H+L) | Jackson Immuno Research | 711-605-152 | Secondary Antibody Epithelial Staining |
| Alexa Fluor 647, donkey, anti-rabbit IgG (H+L) | Thermo Fisher Scientific, Invitrogen | A31573 | Secondary Antibody Vascular Staining |
| Axiocam ERc5s camera | Zeiss | 426540-9901-000 | Technical equipment |
| Basal Medium MV, phenol red-free | Promocell | C-22225 | Cell culture consumables |
| Biochip | Dynamic 42 | BC002 | Microfluidic consumables |
| BSA fraction V | Gibco | 15260-037 | Cell culture consumables |
| C2BBe1 (clone of Caco-2) | ATCC | CRL-2102 | Epithelial Cell Source |
| Chloroform | Sigma | C2432 | Chemicals |
| CO2 Incubator | Heracell | 150i | Technical equipment |
| Collagen IV from human placenta | Sigma-Aldrich | C5533 | Cell culture consumables |
| Coverslips (24 x 40 mm; #1.5) | Menzel-Gläser | 15747592 | Consumables |
| Cy3 AffiniPure, donkey, anti-goat IgG (H+L) | Jackson Immuno Research | 705-165-147 | Secondary Antibody Vascular Staining |
| Cy3 AffiniPure, donkey, anti-rat IgG (H+L) | Jackson Immuno Research | 712-165-150 | Secondary Antibody Epithelial Staining |
| Descosept PUR | Dr.Schuhmacher | 00-323-100 | Cell culture consumables |
| DMEM high glucose | Gibco | 41965-062 | Cell culture consumables |
| DMEM high glucose w/o phenol red | Gibco | 31053028 | Cell culture consumables |
| DPBS (-/-) | Gibco | 14190-169 | Cell culture consumables |
| DPBS (+/+) | Gibco | 14040-133 | Cell culture consumables |
| EDTA solution | Invitrogen | 15575-038 | Cell culture consumables |
| Endothelial Cell Growth Medium | Promocell | C-22020 | Cell culture consumables |
| Endothelial Cell Growth Medium supplement mix | Promocell | C-39225 | Cell culture consumables |
| Ethanol 96%, undenatured | Nordbrand-Nordhausen | 410 | Chemicals |
| Fetal bovine Serum | invitrogen | 10270106 | Cell culture consumables |
| Fluorescein isothiocyanate (FITC)-dextran (3-5 kDa) | Sigma Aldrich | FD4-100MG | Chemicals |
| Fluorescent Mounting Medium | Dako | S3023 | Chemicals |
| Gentamycin (10mg/mL) | Sigma Aldrich | G1272 | Cell culture consumables |
| GlutaMAX Supplement (100x) | Gibco | 35050061 | Cell culture consumables |
| Histopaque | Sigma-Aldrich | 10771 | Cell culture consumables |
| Hoechst (bisBenzimid) H33342 | Sigma-Aldrich | 14533 | Epithelial Staining |
| Holotransferrin (5mg/mL) Transferrin, Holo, Human Plasma | Millipore | 616397 | Cell culture consumables |
| Human recombinant GM-CSF | Peprotech | 300-30 | Cell culture consumables |
| Human recombinant M-CSF | Peprotech | 300-25 | Cell culture consumables |
| Illumination device | Zeiss | HXP 120 C | Fluorescence Microscope Setup |
| Laser Scanning Microscope | Zeiss | CLSM980 | Fluorescence Microscope Setup |
| Lidocain hydrochloride | Sigma-Aldrich | L5647 | Cell culture consumables |
| Lipopolysaccharide (LPS) | Sigma | L2630 | Cell culture consumables |
| Loftex Wipes | Loftex | 1250115 | Consumables |
| Low attachment tubes (PS, 5 mL) | Falcon | 352052 | Consumables |
| Luer adapter for the top cap (M) | Mo Bi Tec | M3003 | Microfluidic consumables |
| Male mini luer plugs, row of four,PP, opaque | Microfluidic chipshop | 09-0556-0336-09 | Microfluidic consumables |
| MEM Non-Essential Amino Acids Solution | Gibco | 11140 | Cell culture consumables |
| Methanol | Roth | 8388.2 | Chemicals |
| Microscope | Zeiss | Axio Observer 5 | Fluorescence Microscope Setup |
| Microscope slides | Menzel | MZ-0002 | Consumables |
| Monoclonal, mouse, anti-human CD68 Antibody (KP1) | Thermo Fisher Scientific, Invitrogen | 14-0688-82 | Primary Antibody Vascular Staining |
| Monoclonal, rat, anti-human E-Cadherin antibody (DECMA-1) | Sigma-Aldrich, Millipore | MABT26 | Primary Antibody Epithelial Staining |
| Multiskan Go plate reader | Thermo Fisher | 51119300 | Technical equipment |
| Normal donkey serum | Biozol | LIN-END9010-10 | Chemicals |
| Optical Sectioning | Zeiss | ApoTome | Fluorescence Microscope Setup |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140-122 | Cell culture consumables |
| Plugs | Cole Parmer | GZ-45555-56 | Microfluidic consumables |
| Polyclonal, goat, anti-human VE-Cadherin Antibody | R&D Systems | AF938 | Primary Antibody Vascular Staining |
| Polyclonal, rabbit, anti-human Von Willebrand Factor Antibody | Dako | A0082 | Primary Antibody Vascular Staining |
| Polyclonal, rabbit, anti-human ZO-1 antibody | Thermo Fisher Scientific, Invitrogen | 61-7300 | Primary Antibody Epithelial Staining |
| Power Supply Microscope | Zeiss | Eplax Vp232 | Fluorescence Microscope Setup |
| Primovert microscope | Zeiss | 415510-1101-000 | Technical equipment |
| Reglo ICC peristaltic pump | Ismatec | ISM4412 | Technical equipment |
| SAHA (Vorinostat) | Sigma Aldrich | SML0061-25MG | Chemicals |
| Saponin | Fluka | 47036 | Chemicals |
| S-Monovette, 7.5 mL Z-Gel | Sarstedt | 01.1602 | Consumables |
| S-Monovette, 9.0 mL K3E | Sarstedt | 02.1066.001 | Consumables |
| Sodium Pyruvate | Gibco | 11360-088 | Cell culture consumables |
| Tank 4.5 mL | ChipShop | 10000079 | Microfluidic consumables |
| Trypane blue stain 0.4% | Invitrogen | T10282 | Cell culture consumables |
| Trypsin | Gibco | 11538876 | Cell culture consumables |
| Tubing | Dynamic 42 | ST001 | Microfluidic consumables |
| Tweezers (Präzisionspinzette DUMONT abgewinkelt Inox08, 5/45, 0,06 mm) | Roth | K343.1 | Consumables |
| Wheat Germ Agglutinin (WGA) | Thermo Fisher Scientific, Invitrogen | W32464 | Epithelial Staining |
| X-VIVO 15 | Lonza | BE02-060F | Cell culture consumables, Hematopoietic cell medium |
| Zellkultur Multiwell Platten, 24 Well, sterile | Greiner Bio-One | 662 160 | Consumables |
| Zellkultur Multiwell Platten, 6 Well, sterile | Greiner Bio-One | 657 160 | Consumables |
| Zen Blue Software | Zeiss | Version 3.7 | Microscopy Software |
参考文献
- Alonso-Roman, R., et al. Organ-on-chip models for infectious disease research. Nat Microbiol. 9 (4), 891-904 (2024).
- Fahrner, R., Groger, M., Settmacher, U., Mosig, A. S. Functional integration of natural killer cells in a microfluidically perfused liver on-a-chip model. BMC Res Notes. 16 (1), 285(2023).
- Raasch, M., et al. Microfluidically supported biochip design for culture of endothelial cell layers with improved perfusion conditions. Biofabrication. 7 (1), 015013(2015).
- Deinhardt-Emmer, S., et al. Co-infection with Staphylococcus aureus after primary influenza virus infection leads to damage of the endothelium in a human alveolus-on-a-chip model. Biofabrication. 12 (2), 025012(2020).
- Kaden, T., et al. Generation & characterization of expandable human liver sinusoidal endothelial cells and their application to assess hepatotoxicity in an advanced in vitro liver model. Toxicology. 483, 153374(2023).
- Maurer, M., et al. A three-dimensional immunocompetent intestine-on-chip model as in vitro platform for functional and microbial interaction studies. Biomaterials. 220, 119396(2019).
- Hoang, T. N. M., et al. Invasive aspergillosis-on-chip: A quantitative treatment study of human aspergillus fumigatus infection. Biomaterials. 283, 121420(2022).
- Kaden, T., et al. Modeling of intravenous caspofungin administration using an intestine-on-chip reveals altered Candida albicans microcolonies and pathogenicity. Biomaterials. 307, 122525(2024).
- Shah, P., et al. A microfluidics-based in vitro model of the gastrointestinal human-microbe interface. Nat Commun. 7, 11535(2016).
- Jaffe, E. A., Nachman, R. L., Becker, C. G., Minick, C. R. Culture of human endothelial cells derived from umbilical veins. Identification by morphologic and immunologic criteria. J Clin Invest. 52 (11), 2745-2756 (1973).
- Mosig, S., et al. Different functions of monocyte subsets in familial hypercholesterolemia: Potential function of cd14+ cd16+ monocytes in detoxification of oxidized ldl. FASEB J. 23 (3), 866-874 (2009).
- Peterson, M., Mooseker, M. Characterization of the enterocyte-like brush border cytoskeieton of the c2bbe clones of the human intestinal cell line, caco-2. J Cell Sci. 102, Pt 3 581-600 (1992).
- Shin, W., Hinojosa, C. D., Ingber, D. E., Kim, H. J. Human intestinal morphogenesis controlled by transepithelial morphogen gradient and flow-dependent physical cues in a microengineered gut-on-a-chip. iScience. 15, 391-406 (2019).
- Kim, H. J., Ingber, D. E. Gut-on-a-chip microenvironment induces human intestinal cells to undergo villus differentiation. Integr Biol (Camb). 5 (9), 1130-1140 (2013).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab Chip. 12 (12), 2165-2174 (2012).
- Karra, N., Fernandes, J., James, J., Swindle, E. J., Morgan, H. The effect of membrane properties on cell growth in an 'airway barrier on a chip'. Organs-on-a-Chip. 5, 10025(2023).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved