成体マウス脳室下領域からの神経幹細胞の単離、増殖、およびヌクレオフェクション
要約
ここでは、成体マウス脳室下ゾーンから単離された拡大神経幹細胞(NSC)における遺伝子導入効率を高めるように設計されたヌクレオフェクションシステムについて説明します。この知見は、この方法が神経幹細胞における遺伝子摂動を大幅に改善し、従来のトランスフェクションプロトコルの有効性を上回り、細胞の生存率を向上させることを示しています。
要約
成体マウス脳の脳室下領域(SVZ)からの神経幹細胞(NSC)の単離と増殖は、マイトジェンとして塩基性線維芽細胞増殖因子(bFGF)と上皮成長因子(EGF)を添加した培地で達成でき、ニューロスフェアとして知られるクローン凝集体を産生します。この in vitro システムは、NSCの可能性を研究するための貴重なツールです。プラスミドに取り込まれたsiRNAまたは遺伝子のトランスフェクションは、遺伝子発現の摂動を誘導し、NSC生物学を研究するために使用できます。しかし、NSC培養物への外因性核酸送達は、中枢神経系(CNS)細胞トランスフェクションの効率が低いため、困難です。ここでは、成体マウスSVZからの拡大したNSCにおける遺伝子導入の高効率を達成する改良されたヌクレオフェクションシステムを紹介します。この比較的簡便な方法により、成体神経幹細胞における遺伝子摂動が増強され、従来のトランスフェクションプロトコルを凌駕し、生存率が80%を超えることを示しました。さらに、この方法は一次単離された神経幹細胞にも適用でき、ニューロスフェア培養におけるノックダウンまたは過剰発現による遺伝子発現操作を通じて、遺伝子機能研究に重要な進歩をもたらします。
概要
神経幹細胞(NSC)は、脳に常在する多能性幹細胞です。これらの細胞は、自己複製し、アストロサイト、オリゴデンドロサイト、ニューロンの3つの神経系統に分化する能力を持っています1。その結果、神経幹細胞は、哺乳類の成体神経新生、つまり脳内で新しいニューロンが生成されるプロセスにおいて重要な役割を果たしています2。神経幹細胞は、主に成人の脳内の神経原性ニッチと呼ばれる2つの領域、すなわち側脳室の壁に沿った脳室下ゾーン(SVZ)と海馬の歯状回内の顆粒下ゾーン(SGZ)に存在します3,4。成体マウスで最も活発な神経原性ニッチであるSVZのNSC(B細胞とも呼ばれる)は、自己複製してトランジット増幅前駆細胞(TAPまたはC細胞)を産生し、その後神経芽細胞(A細胞)に分化します。これらの神経芽細胞は、吻側遊走流(RMS)を介して嗅球(OB)に移動し、そこで介在ニューロンへの完全な分化を経て、既存の回路3,4,5,6に統合されます。
これらのニッチ内でNSCを調節する分子的な手がかりとシグナルの複雑な相互作用を理解することは、治療への応用にその可能性を活用するために重要です。そのために、NSCの選択的初代培養から表面マーカー7,8,9,10を用いた細胞選択まで、この細胞集団を研究するためのさまざまな方法が開発されてきた。本稿では、塩基性線維芽細胞増殖因子(bFGF)と上皮成長因子(EGF)の両方のマイトジェンを含む無血清選択培地を用いたSVZ NSCのin vitroでの単離と培養について詳述しています。この培地は、細胞増殖を促進し、成体マウス脳のSVZから得られるNSCの幹細胞性を維持し、ニューロスフェアとして知られるin vitroクローン性、三次元性、非接着性凝集体を形成します9。ニューロスフェア培養は、NSCの増殖、自己複製、分化、および生存に影響を与える分子メカニズムと因子を操作および研究するための制御されたプラットフォームとして機能します11。特に、培養物中に形成された初代ニューロスフェアの数は、in vivoでSVZに存在するNSCの数を推定することを可能にし、成体のNSCプール12,13に対するさまざまな条件の影響を研究するための強力なツールになります。さらに、初代培養が確立されると、NSCは増殖条件下で対称的な分裂を通過する際に新しい凝集体(二次ニューロスフェア)を生成することができる14。したがって、二次ニューロスフェア細胞の低密度播種(クローンアッセイ)は、これらの培養物の自己複製率を評価するために利用することができる4,15,16,17。
NSC調節を支配するメカニズムを明らかにするニューロスフェアの可能性にもかかわらず、一部の研究者は、細胞が成長する人工的な条件が神経因性ニッチの複雑なin vivo微小環境を忠実に再現しない可能性があると主張して、in vitroの知見の妥当性に疑問を呈しています18,19,20,21,22 .もう1つの論争の的となっている点は、ニューロスフェアで観察された不均一性をめぐるものです。それにもかかわらず、この変動性は、in vivoで自然に発生するNSCの対称的および非対称的な分裂を反映していると考えられています23,24。さらに、近年のバリデーションにより、in vivoでSVZ神経原性ニッチ内での働きを予測するためのNSC培養の利用が支持され、いくつかの研究では、in vitroで培養されたNSCがin vivoで観察されたトランスクリプトームプロファイルを正確に維持することが実証されています11,25。
したがって、ニューロスフェア培養は、NSCの増殖および分化能力を探求する方法としてだけでなく、NSC生物学を支配する遺伝子の影響を研究するシステムも提供します。神経幹細胞における遺伝子機能を調べるための重要な手法は、遺伝子発現摂動です。プラスミドを介して送達されたsiRNAまたは遺伝子は、細胞培養物にトランスフェクションすることができ、その結果、標的遺伝子のノックダウンまたはアップレギュレーションが起こります。この汎用性の高いアプローチは、条件付きノックアウトマウスを使用して培養を確立する場合と比較して、時間とコストを大幅に削減し、ニューロン新生の遺伝的基盤を解明し、治療の見通しを探求するための有望な道を提供します。神経幹細胞における特定の遺伝子の発現を変化させることで、その挙動の調節が可能になり、増殖、分化、移動などの重要な生物学的プロセスに影響を与えることができます。しかし、特にマウスのニューロスフェア内でNSCをトランスフェクションする見通しには、顕著な課題があります。ニューロスフェアの三次元構造はトランスフェクションの効率を損ない、しばしば成功した外因性核酸送達率の低下をもたらし、遺伝子操作の程度を制限する26,27。さらに、トランスフェクション手順は、細胞の生存能力と機能に悪影響を与える可能性があります27。これに関連して、細胞損傷を軽減する方法としてヌクレオフェクションシステムを提示し、NSC培養の摂動に使用される遺伝子導入アッセイで高い生存率を達成し、より高い有効性を確保します。
この原稿は、ニューロスフェア培養システムを使用して、成体SVZ神経原性ニッチからNSCを単離、拡大、およびヌクレオフェクトして遺伝子を摂動する手順を説明することを目的としています。この方法は、従来のトランスフェクションプロトコルの有効性を上回り、標的細胞間の生存率が大幅に向上し、遺伝子導入効率が向上します。
プロトコル
動物を用いたすべての実験は、バレンシア大学の倫理委員会によって承認され、Conselleria de Agricultura, Ganadería y Pesca, Generalitat Valenciana (Spain) によって承認されました。
1. ニューロスフェアの初代培養
- 試薬の調製
- ダルベッコのリン酸生理食塩水(DPBS)の緩衝液を脱イオン水に調製し、オートクレーブ滅菌します。あるいは、脱イオン水に137 mM NaCl、2.7 mM KCl、10 mM Na2HPO4、 および1.8 mM KH2PO4溶液を加えて、0.1 M PBS pH 7.4を調製します。
- 2つの12ウェルプレートに以前に冷却したDPBSを充填し、氷上に保ちます:1つは解剖前に全脳を保存するために使用され、もう1つは組織処理まで解剖されたSVZを保存します。
- 以下に説明するように、パパイン含有酵素ミックスを調製します。
- EDTA/L-システイン解離溶液をEarl's Balanced Salt Solution(EBSS)に調製し、最終濃度をそれぞれ0.2 mg/mLにします。完全に溶解するには、チューブを37°Cのウォーターバスでインキュベートします。
- 12 U/mLのパパインをEDTA/L-システイン溶液に溶解します。脳あたり500μLの酵素溶液が使用されると考えてください。
- パパイン溶液を37°Cの水浴に約20分間、酵素が完全に溶解するまで導入します。
- シリンジと0.22μmポアフィルターで酵素ミックスをフィルター滅菌し、使用するまで4°Cに保ちます。
注:パパインは37°Cで30分後に活性化され、4°Cで12時間保存できます。
- 表1に従ってホルモンミックス溶液を添加してコントロール培地を調製し、ニトロセルロース0.22μm細孔フィルターを使用してフィルター滅菌します。培地を4°Cに保ち、37°Cのウォーターバスで温めてから使用してください。
- 表1に示すように、使用する直前にコントロール培地にEGFとbFGFを添加して、完全な培地を調製します。ろ過するとマイトジェンが失われる可能性があるため、完全な培地をろ過しないでください。
- 脳の抽出とSVZ解剖
注:マウスは、安楽死の前に食物と水に自由にアクセスできます。8週齢から16週齢のC57BL/6マウスを使用します。雌雄ともに、調製に目立った違いなく使用されます。- 手術前にオートクレーブ滅菌して解剖ツールを滅菌します。次に、メス、ピンセット、ハサミ、ヘラを70%エタノールで満たされたビーカーに沈めます。70%エタノールですべての作業面を完全に清掃します。
- CO2の過剰摂取によりマウスを犠牲にし、子宮頸部脱臼により確認する。脳組織の汚染の可能性を最小限に抑えるために、ヘッドに70%エタノールをスプレーします。
- はさみを使用して、マウスの頭を体の他の部分から分離します。頭蓋骨が完全に覆われるまで、吻尾軸に沿って小さなハサミで頭蓋骨の上の皮膚を切ります。
- 最初に小さなハサミで矢状縫合糸に沿って頭蓋骨を切って脳を露出させ、次に細いピンセットを使用して骨を取り除きます。このステップでは、頭蓋骨の下の脳組織に損傷を与えないように注意してください。
- ヘラを使用して頭蓋骨から脳を慎重に抽出し、冷たいDPBSを含む12ウェルプレートに入れます。解剖が完了するまでプレートを氷の上に置いておきます。
- 解剖が行われるシリコンパッドに脳全体を移し、脳全体に冷たくしたDPBSを数滴塗布します(図1A)。
- メスを使用して、脳の吻側端にあるOBと尾側部分にある小脳を切除し、両側脳室を含む脳の中央部分を保持します(図1B)。
- 縦方向の裂け目に沿って脳を2つの半球に分割し、次に両方の半球を別々に解剖します(図1C)。
- 1つの半球で作業し、内側領域が上を向くように向きを変えます。脳梁の線に沿って脳を開き、皮質と線条体を海馬、中隔、間脳から分離し、側脳室を露出させます(図1D)。
注:SVZは心室の空洞と線条体の間にあるため、次のステップでは、SVZを周囲の組織からできるだけ正確に分離することを目的としています。 - 心室の腹側限界(図1E、F)、SVZの吻側端と尾側端の向こう側の組織(図1G)、および脳梁に続く皮質(図1H、I)に従って、海馬、中隔、および間脳波を切除します。
- SVZが横を向くように組織を傾け(図1J)、SVZの下の線条体組織(図1K)を除去して、NSCを含む薄い組織片(図1L)を得ることができます。
- 組織処理が開始されるまで、同じマウスから解剖した両方のSVZを、冷たく滅菌したDPBSを含む12ウェルプレートに保存します。
注:1つの脳から両方のSVZを解剖するには10分かかります。時間が長いと、細胞の生存率に影響を与える可能性があります。培養物の収量を増やす必要がある場合は、同じ年齢、性別、遺伝的背景、および遺伝子型の複数のマウスからのSVZをプールできます。
- NSCの分離と播種
- 各SVZを4〜5個の小片にカットして、組織の解離を促進します。
注:このステップから、すべての手順を層流フード内の無菌状態で実行する必要があります。 - 刻んだSVZを滅菌プラスチックパスツールピペットを使用して15 mLの遠心分離チューブに移します。プレートに破片が残っていないことを確認してください。
- チューブの底に組織沈殿物を沈殿させ、残りのDPBSを取り除きます。
- 濾過したパパイン含有酵素ミックスを1脳あたり500 μL(2 SVZ)加え、チューブを37°Cの水浴で30分間インキュベートします。
- インキュベーション後、37°Cで予熱したコントロール培地5 mLを各サンプルに加えます。
- サンプルを300 x g で5分間遠心分離します。次に、マイクロピペットまたは真空ポンプを使用して上清を慎重に取り除きます。
- 1 mLのコントロール培地を加え、ペレットを慎重に機械的に分解し、ファイヤーポリッシュしたパスツールガラスピペットを使用して、均一な細胞懸濁液が得られるまで10倍から20倍にピペッティングします。
注意:これは、過度または不十分なディスアグリゲーションが培養物の収量に悪影響を与えるため、プロトコルで最も重要なステップの1つです。 - コントロール培地4mLを加え、反転して混合して細胞を洗浄します。300 x g で5分間遠心分離します。次に、上清を取り除きます。
- 1 mLの完全培地を加え、ピペッティングで10回上下させてペレットを再懸濁し、細胞懸濁液を均質化します。
- 細胞懸濁液のアリコートをトリパンブルーで1/2希釈した後、顕微鏡下でノイバウアーチャンバーを使用して細胞懸濁液をカウントするか、自動セルカウンターを使用します。培養物がシングルセルレベルで分解されていることを確認してください。
- 細胞懸濁液を調製したら、得られた細胞を48ウェルプレートの8ウェルに均等に播種し、最終容量500 μLの完全培地に播種します。
注:通常、2つのSVZから20,000個の細胞を取得し、その結果、最終的な播種密度は約2,500細胞/mLになり、培養で最大の収量を達成します。
- 各SVZを4〜5個の小片にカットして、組織の解離を促進します。
- ニューロスフェア形成
- 加湿インキュベーター内で、37°Cおよび5%CO2のin vitro(DIV)で細胞を5〜7日間インキュベートします。これらの条件下では、分化した細胞は死滅し、NSCと前駆細胞は分裂促進刺激に応答して増殖し、一次神経球として認識されるクローン性凝集体を形成します。
注:EGFまたはbFGFのいずれかを使用して、ニューロスフェアの形成を誘導することができます。しかし、これら2つの成長因子は完全に代替可能ではありません。 - 倒立顕微鏡結合カメラを使用してニューロスフェアのサイズを確認し、ニューロスフェアが50〜100μmのサイズ範囲に達したら、ウェル内で形成されたすべての主要なニューロスフェアを10倍の倍率でカウントします。形成された一次ニューロスフェアの総数は、SVZニッチに存在するNSCの数の推定値として機能します。
- 10日間の期間後、各ウェルから培地を回収して継代を開始します。その後、5〜7 DIV後に継代を行いますが、一次球体が継代培養の理想的なサイズ(約100μm)に到達するまでにわずかに長い期間が必要になる場合があることに注意してください。
- 加湿インキュベーター内で、37°Cおよび5%CO2のin vitro(DIV)で細胞を5〜7日間インキュベートします。これらの条件下では、分化した細胞は死滅し、NSCと前駆細胞は分裂促進刺激に応答して増殖し、一次神経球として認識されるクローン性凝集体を形成します。
表1:培養培地ソリューション。 制御媒体のレシピが記載されている。あらかじめ混合されたホルモン混合溶液が作られます。ストックホルモン溶液は、示されているように事前に調製し、-20°Cで保存することができます。 細胞培養の前に、コントロール培地にEGFとbFGFを添加して、完全な培地を調製します。各コンポーネントについて、保管仕様、ストック、および作業濃度が提供されます。 この表をダウンロードするには、ここをクリックしてください。
2. ニューロスフィア文化の展開
- ニューロスフェアの通過
- ニューロスフェアを含む培地をマルチウェルプレートから回収し、15 mLの遠心チューブに移します。数ミリリットルのDPBSでウェルをすすぐことにより、できるだけ多くの細胞の回収を確保します。
- ニューロスフェアを300 x gで5分間遠心分離します。次に、上清を取り除きます。
- 200 μLの酵素溶液( 材料表を参照)をペレットに加え、チューブの底を軽くたたいて取り除きます。室温で10分間インキュベートして、ニューロスフェアの解離を促進します。
- 1 mLのコントロール培地を添加して酵素反応を停止させ、ピペッティングを10倍から20倍にすることで、ニューロスフェアをP1000マイクロピペットで機械的に解離します。
- コントロール培地4mLを追加し、反転して混合して細胞を洗浄します。
- 細胞を300 x gで5分間遠心分離します。次に、上清を取り除きます。
- 1 mLの完全培地を加え、ペレットを再懸濁して、ピペッティングを10回上下させて細胞懸濁液を均質化します。
注:ニューロスフェアの元の数とサイズが高すぎる場合は、細胞懸濁液を希釈するために完全な培地をより多く追加し、信頼性の高い細胞数を確保します。 - 細胞懸濁液のアリコートをトリパンブルーで1/2希釈した後、ノイバウアーチャンバーを使用して細胞懸濁液をカウントするか、自動セルカウンターを使用します。
- 細胞培養を拡大するには、適切な培養プレートまたはフラスコで完全な培地を使用して、10,000細胞/cm2 の密度で細胞を播種します( 表2を参照のこと)。
- 加湿インキュベーター内で、各継代ごとに37°Cおよび5%CO2の加湿インキュベーターで5〜7 DIVの細胞をインキュベートします。
注:ニューロスフィア培養は、増殖能力を変えることなく、10継代を超えない範囲で、反復的な継代を通じて一貫して拡大および増殖することができます。EGFまたはbFGFのいずれかを培養に利用できます。しかし、培養物の長期的な拡大は、EGFの存在下でのみ達成できます。
- 自己再生アッセイ
- ニューロスフェア培養物を継代した後、96ウェルプレートに1,000個の個々の細胞をプレートし、完全な培地で最大200μLの最終容量を完成させ、5細胞/μLの培養物の最終細胞密度が得られます。
注: シードされるセルの数は、できるだけ正確である必要があります。必要に応じて、播種前に細胞懸濁液量の信頼性を確保するために中間希釈液を調製します。さらに、技術的なばらつきを減らすために、条件ごとに4〜5回の繰り返しをめっきすることをお勧めします。 - 加湿インキュベーター内で細胞を37°Cおよび5%CO2で5日間、またはニューロスフェアが適切なサイズ(60〜100μm)に達するまでインキュベートします。ニューロスフェアの凝集を防ぐために、マルチウェルプレートを動かしたり振ったりしないでください。
- ニューロスフェア形成後、カメラを取り付けた倒立位相差顕微鏡を用いて、各ウェルに形成されたニューロスフェアの数をカウントします。自己再生アッセイは、EGFまたはbFGFを別々に使用して実施できます。
- ニューロスフェア培養物を継代した後、96ウェルプレートに1,000個の個々の細胞をプレートし、完全な培地で最大200μLの最終容量を完成させ、5細胞/μLの培養物の最終細胞密度が得られます。
- NSC培養物の凍結保存
注:ニューロスフィア培養物は、将来の使用のために凍結保存することができ、必要なマウスの数を最小限に抑えることができます。継代10までの細胞を保存することをお勧めします。- 細胞を凍結保存するには、完全培地中の細胞懸濁液1 mLを適切に標識したクライオチューブに移します。
- ジメチルスルホキシド(DMSO)を最終濃度10%まで細胞懸濁液に添加し、チューブを反転させて穏やかに混合します。
注:DMSOは凍結保護剤として機能しますが、細胞に対して毒性がある可能性があるため、この手順は迅速に実行する必要があります。 - チューブを-80°Cの冷凍庫に入れ、1°C/分で徐々に温度を下げることができる冷凍容器を使用します。この段階的な凍結プロセスにより、凍結保存中に氷の結晶が形成されることによる細胞の損傷が防止されます。長期保存の場合は、チューブを液体窒素タンクに-196°Cに維持します。
- NSC培養の解凍
注:必要に応じて、細胞を解凍し、実験のために培養物を再拡大することができます。- 凍結したNSCを含むクライオチューブを液体窒素貯蔵タンクから取り出し、すぐに37°Cのウォーターバスに完全に解凍するまで約5分間置きます。
注意:DMSOは毒性があり、細胞の生存率に影響を与える可能性があるため、入浴時間を最小限に抑えることが重要です。 - 解凍した細胞を、予め加温したコントロール培地5 mLが入った15 mLの遠心チューブに素早く移します。
- 細胞を300 x g で5分間遠心分離し、上清を除去します。1 mLの完全培地を加え、播種前に細胞懸濁液を均質化するために10倍に静かにピペッティングしてペレットを再懸濁します。
注:解凍は細胞の生存率に影響を与える可能性があります。したがって、新しい実験のために播種する前に、少なくとも一度は細胞を継代することをお勧めします。
- 凍結したNSCを含むクライオチューブを液体窒素貯蔵タンクから取り出し、すぐに37°Cのウォーターバスに完全に解凍するまで約5分間置きます。
- マイコプラズマ検査
注:マイコプラズマの汚染は、細胞の健康を損ない、増殖速度に影響を与える可能性があります。したがって、マイコプラズマ試験は、実験の完全性と信頼性を確保するために重要です。- DNA抽出
- DNA抽出のために、最低100μLの細胞培養液を採取します。上清と細胞ペレットの両方をDNA抽出に使用できます。このアリコートは抽出するまで-20°Cで保存してください。
- チューブの蓋に穴を開け、サーモブロックを使用してアリコートを99°Cで15分間煮沸します。
注:チューブの蓋に穴を開けると、高温での沸騰時にチューブが開くのを防ぎます。 - 16,900 x gで5分間遠心分離します。DNAを含む上清を新しいチューブに移します。PCR検査まで、DNAを入れたチューブを-20°Cで保存します。
- マイコプラズマ検出のためのPCR
- 8.9 μL のヌクレアーゼフリー水、3 μL の 5x 反応バッファー、1.2 μL の 25 mM MgCl2、0.25 μL の 2.5 mM dNTP、0.15 μL の Taq ポリメラーゼ、0.25 μL の各マイコプラズマ特異的プライマー、10 μM の濃度 (フォワード、Fw: 5'GATGTTTAGCCGGGTCGAGAG3' およびリバース、Rv: 5'GATGTCAAGAGTGGGTAAGGTT3')。
- ゲノム抽出したDNAを1 μL加えます。DNAコンタミネーションを防ぐために、層流フードでPCRミックスを調製します。
- 95°Cで5分間の初期変性、続いて95°Cで30秒間35サイクルの変性、53°Cで1分間アニーリング、72°Cで30秒間の伸長、および72°Cで5分間の延長で、サーマルサイクラーで反応をインキュベートします。
- 得られたバンドのサイズ(約500 bp)を特定するには、DNA PCR産物15 μLを6倍ローディング色素溶液3 μLと混合して2%アガロースゲルにロードし、電気泳動を100 Vで40〜50分間実行します。
- DNA抽出
表2:培養に使用したプレートとフラスコ。 最も一般的に使用される播種プレートとフラスコの寸法と容量が提供されています。この表には、各容器の直径、増殖面積、および培地容量と、増殖条件(10,000細胞/cm2)で播種するNSCの数の例が含まれています。 この表をダウンロードするには、ここをクリックしてください。
3. ニューロスフェア培養の核形成
- 試薬の調製
- DNA調製
- 形質転換のために、1.5 mLのチューブに25 μLのコンピテント 大腸菌 DH5α細胞を調製します。
- 目的のプラスミド1μL(100〜200 ng/μL)を細胞に添加し、42°Cで45秒間の熱衝撃を受けさせます。ここでは、 Snrpn 発現をサイレンシングするための短いヘアピン(sh)RNAを含むプラスミドと、コントロールプラスミドshSCRAMBLEを使用します。
注:形質転換の有効性を維持するために、手順全体を通してコンピテントセルを氷上に置いてください。 - 形質転換細胞をLB寒天プレート上に適切な抗生物質で播種し、37°Cで18時間インキュベートします。細菌のコロニーを乱す可能性のある結露による液滴の形成を防ぐために、ペトリ皿を逆さまにしてください。
注:LB培地に適切な抗生物質を添加して、形質転換細菌の増殖を排他的に許可します。 - 滅菌ピペットチップを使用して、個々の細菌コロニーをピッキングし、250 mLのLBを充填した三角フラスコに移して、液体培養を開始します。大きなターゲットコロニーの周囲に配置された小さなサテライトコロニーは、目的のプラスミドを取り込んでいない可能性があるため、選択しないでください。
- フラスコを37°Cのオービタルシェーカーで一晩激しく振とうしながらインキュベートします。
- エンドトキシンフリーのmaxiprepキットを使用し、製造元の指示に従って細菌培養物から純粋なプラスミドDNAを抽出します。DNAを適切な量のエンドトキシンフリー水に再構成して、1〜2 μg/μLのプラスミド濃度を得ます。
注:maxiprepの収量は、培養物の増殖に依存します。通常、プラスミドDNAペレットを200 μLの容量に再懸濁すると、目的のDNA濃度が得られます。 - プラスミドDNAを入れたチューブは、使用するまで-20°Cで保存してください。ヌクレオフェクション用のプラスミドDNAを2〜6μg含む最終容量5μLの1.5mLチューブを調製します。
- 材料の準備
- ヌクレオフェクション溶液を調製します。推奨キット( 材料表を参照)を使用する場合は、目的のヌクレオフェクションごとに1.5 mLチューブに95 μLのヌクレオフェクション溶液を調製します。通常、ピペットとキュベットがキットに含まれています。各ヌクレオフェクション条件に対してそれぞれ1つずつ調製します。
- 条件ごとに4 mLの予熱済み完全培地で満たされたT25フラスコを準備し、使用するまでインキュベーターに保管します。
- DNA調製
- NSCのヌクレオフェクション
- 評価には、条件ごとに1〜2 x 106 個の個々のセルを使用します。細胞を300 x gで5分間遠心分離し、上清を除去します。
- 1 mLのDPBSを添加し、ピペッティングで10回上下させてペレットを再懸濁し、均一な細胞懸濁液を確保します。
- 遠心分離(ステップ2.1.6)を繰り返して2回目の洗浄を行い、最後にペレットを95 μLのヌクレオフェクション溶液に再懸濁します。
注:洗浄手順は、コントロール培地から抗生物質を除去し、効果的なヌクレオフェクションを確保するために重要です。 - 95 μLの細胞を、ヌクレオフェクション用に選択した各プラスミド(合計2 μg)を5 μL含むプレミックス溶液と組み合わせます。
- P200マイクロピペットを使用して、この溶液をキュベットに移し、ヌクレオフェクターデバイスに入れます。
- ヌクレオフェクターシステムの最適化されたNSCプログラムを使用して、目的のプラスミドで細胞を核分離します。
- エレクトロポレーションが完了したら、キットに付属のパスツールピペットを使用して、温かい完全な培地をキュベットに慎重に導入します。続いて、キュベットの内容物を、予め加温した完全な培地を含む事前に準備したT25フラスコに移します。エレクトロポレーション後、細胞死、DNA沈殿、および粘性凝集体の形成が起こる可能性があります。これをT25フラスコに移すと、細胞の生存率が低下する可能性があるため、避けてください。
注:このステップは非常に重要であり、高収率のヌクレオフェクションとその後の培養生存を確保するために、できるだけ早く実行する必要があります。 - 有核細胞を37°Cおよび5%CO2で加湿インキュベーター内で3〜5日間インキュベートします。
- 核球細胞の選択
- 戦略A:蛍光活性化セルソーティング(FACS)によるフローサイトメトリーの選択
- ヌクレオフェクションの3〜5日後、ステップ2.1に従ってヌクレオフェクトした培養物を継代し、得られたすべての個別化細胞を回収します。
- 40 μmのセルストレーナーでサンプルをろ過して細胞凝集体を除去し、Cell Sorterフローサイトメーターで分析します。
注:比較結果を得るには、各条件で同じ数のセルをソートすることが重要です。 - サイトメーターのソフトウェアを使用して、細胞サイズに対応する前方散乱光(FSC-A)と細胞内の複雑さに対応する側方散乱光(SSC-A)の2つの尺度に基づいて細胞をゲートアライブします。高FSC-Aおよび高SSC-Aを特徴とする生細胞の集団を選択します。
注:オプションで、ソーティング前に0.1 μg/mLの4′,6-ジアミジノ-2-フェニルインドール(DAPI)を細胞懸濁液に加えます。これにより、死んだ細胞やアポトーシス体をゲーティングから廃棄することができます。 - セルのダブレットとトリプレットを破棄するには、FSC-A と FSC-H のパラメーターをプロットします。プロットの対角線に含まれる事象 (シングレットを表す) を選択します。
注:細胞がレーザーを通過すると、サイトメーターは時間の経過に伴う電圧変化を検出します。FSC-Aは信号領域を表し、FSC-Hはピーク高さを表します。一重項はFSC-AとFSC-H(プロットの対角線上)の間に比例関係を示し、セル凝集体はシグナルが長いため、FSC-Hに対してより大きなFSC-Aを示します。 - 使用するプラスミドによってコードされるレポーター遺伝子の蛍光強度に基づいて、核球化細胞を選択します。例えば、GFP+を使用する場合、FITC-Aの蛍光レベルとSSC-Aプロットに基づいて細胞を選択することができます。
- 各条件に必要な数の標的細胞を分離し、完全な培地で満たされた収集チューブに直接収集します。
- 10,000細胞/cm2の密度でヌクレオフェクトされたNSCを播種します。選別した細胞培養物を加湿インキュベーターで37°Cおよび5%CO2でインキュベートします。
- 戦略B:プラスミドにコードされた抗生物質耐性を用いた選択
- ヌクレオフェクションの48時間後、適切な抗生物質濃度を添加して、耐性細胞を選択します。
注:開始する前に、非核球細胞で複数の濃度の抗生物質をテストすることをお勧めします。最適な抗生物質濃度は、すべての非耐性細胞が排除される最小量です。例えば、NSC培養に最適な濃度は4 μg/mLの抗生物質ブラスティックスであると判断しました。 - 細胞を37°Cおよび5%CO2で加湿インキュベーター内で48時間インキュベートします。
- 抗生物質治療の48時間後、ステップ2.1に従って核球細胞を継代培養します。ニューロスフェアが小さいままの場合は、300 x g で5分間遠心分離することにより、抗生物質を培地から取り出します。細胞を再懸濁し、完全培地のみを使用してフラスコで培養します。ステップ2.1に従って細胞が拡大できるようになるまで、加湿インキュベーターで細胞を37°Cおよび5%CO2でインキュベートします。
- ヌクレオフェクションの48時間後、適切な抗生物質濃度を添加して、耐性細胞を選択します。
- 戦略A:蛍光活性化セルソーティング(FACS)によるフローサイトメトリーの選択
代表的な結果
最適な培養条件により、成人SVZ由来のNSCのin vitroでの単離と増殖が可能
成体SVZに由来するNSCの培養物は、特定の微小環境内でNSCを調節する分子メカニズムとニッチシグナルを調査するための貴重なin vitro法として役立っています。この原稿で概説されているニューロスフェアアッセイは、成人のSVZ内のNSC数を調べるために採用されました。SVZ組織を生後3ヶ月齢マウスの脳から単離し、解離させ、EGFとbFGFの両方を補充した完全なNSC培地で培養しました。10日間のin vitro(DIV)後、これら3つの異なる培養条件下で形成された初代球の総数を位相差顕微鏡を用いて定量しました(図2A、B)。驚くべきことに、私たちの調査結果は、EGFの存在が最大の一次球の形成につながったことを示しており、これはbFGFのみの培養で観察された一次球の数が減少したことから明らかです(図2A、B)。さまざまな培地条件下でのNSCの自己再生能力を評価するために、細胞を継代培養し、前述のマイトジェンの組み合わせを添加した培地に低密度(5細胞/μL)でプレーティングしました。二次球の定量により、SVZ NSCが効率的に自己複製するためには少なくともEGFが必要であり、EGFとbFGFの両方の組み合わせが細胞の自己複製能力を改善することが明らかになりました(図2B)。さらに、多様な培地条件にわたる増殖ダイナミクスの詳細な解析のために、7つの継代で播種および得られた細胞の数を記録しました。異なる培地条件から得られた成長曲線により、EGF単独またはbFGFとの組み合わせで添加した培養物は、bFGFのみを添加した培養物と比較して、成長動態の改善が認められました(図2C)。まとめると、これらの知見は、EGFとbFGFの両方を同時に使用すると、in vitroでのNSC培養収量が向上することを実証しています。
出生後年齢の異なるSVZ内のNSC数を調査し、マウスの老化がニューロスフェア培養効率に与える影響を評価するために、生後1か月から12か月までのマウスのSVZ組織を解剖しました。特に、私たちの調査結果は、年齢が上がるにつれて一次球の数が大幅に減少し、生後約2〜4か月で球の数が最大になることを示しています(図2D)。さらに、継代培養中のNSCの自己複製能を評価するために、生後2〜4か月齢のマウスのNSCを継代培養し、完全培地にクローン密度(5細胞/μL)で播種しました。その後の継代全体での二次球の数の定量化は、継代全体で培養効率がかなり低下することを示しました(図 2E)。これらすべての観察結果に基づいて、NSC培養条件をさらに最適化するために、早期継代中に自己再生アッセイを実施することをお勧めします。
ヌクレオフェクションは、成体神経幹細胞における遺伝子発現を操作するための非常に効率的な技術です
NSCは容易にトランスフェクションできないことを考えると、遺伝子発現を操作するために、ここでは、ウイルス形質導入を使用せずに遺伝子導入の成功率が高いヌクレオフェクションのプロトコルを提示します。生後2ヶ月から4ヶ月齢のマウスの個々のSVZを解剖し、培養した後、記載されたように、NSCにGFPを保有するプラスミドをヌクレオフェクトしました(図3A)。ヌクレオフェクションの2日後におけるGFP陽性細胞の検出は、30%から50%の範囲の効率を示し、これは以前の文献と一致している28。核形成に成功したNSCを特異的に単離するために、細胞を核形成後3〜5日のGFP蛍光強度に基づいてFACSによって選別しました(図3A-C)。FACS前に解析した細胞の約40%が高いGFP蛍光レベルを示し、その後、選別によって選択されました(図3C)。選別されたGFP+ NSCの再播種により、すべての細胞がGFP陽性であることが示され、ヌクレオフェクションベースの細胞単離法が検証されました(図3D)。特に、ヌクレオフェクト化されたNSCは、その後の継代を通じて生存率を維持し、成体NSCのヌクレオフェクションの実現可能性を確認しました。これらの結果は、ヌクレオフェクションとFACSを組み合わせて修飾されたNSCの純粋な培養を確立することの有効性を強調しています。
成体神経幹細胞における遺伝子調節の例として、ショートヘアピン(sh)RNAヌクレオフェクションによる遺伝子の減衰が用いられた。具体的には、2ヶ月齢マウス由来のNSC培養物において、CAG-GFPレポーター(shSNRPN)を保有するSmall nuclear ribonucleoprotein polypeptide N(Snrpn)遺伝子を標的とするshRNAを核形成した。Snrpnのダウンレギュレーションは、shSNRPNプラスミドでヌクレオフェクトされた細胞のqPCRおよび免疫細胞化学によって確認されましたが、コントロールのshSCRAMBLEプラスミドでは確認されませんでした(図3E,F)29。SnrpnのダウンレギュレーションがNSCの自己複製能に及ぼす影響を解明するために、核球形成細胞で低密度アッセイを行いました(図3F、G)。ヌクレオフェクト培養における二次ニューロスフェアの定量により、Snrpnのダウンレギュレーションによるニューロスフェア形成能力の増加が明らかになりました(図3G)。このアッセイは、成体NSCにおける遺伝子発現を操作するヌクレオフェクション能力を強調し、より具体的には、成体NSCにおける幹細胞性の維持におけるSnrpnの役割を特定します。
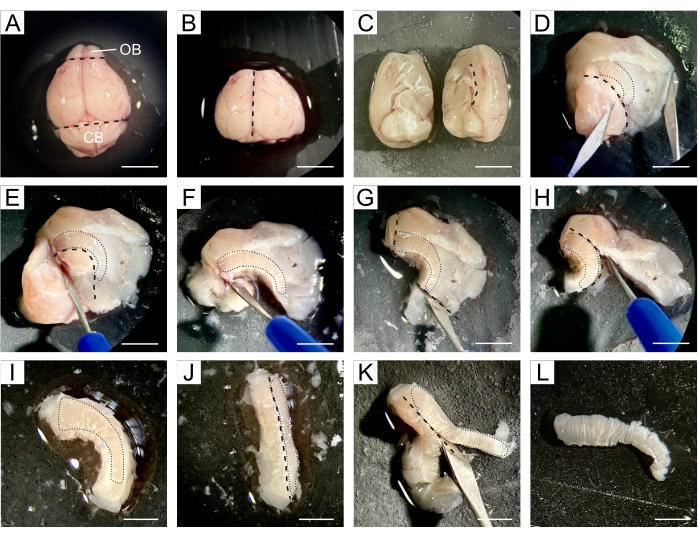
図1:SVZ解剖の詳細な説明(A)マウスの脳を取り出した後、DPBSで全脳をシリコンパッドに移して解剖します。(B)メスを使用してOBと小脳を脳から取り除きます。(C)脳を2つの半球に分割して、別々に解剖を進めます。(D)脳は脳梁の線に沿って開き、皮質と線条体を海馬、中隔、間脳から分離し、それによって側脳室を露出させます。(E-F)海馬、中隔、および間脳は、心室の腹側限界に従って除去されます。(G-I)SVZの吻側端と尾側端、および皮質を超える組織は、脳梁に続いて除去されます。(J-K)組織は、SVZが横を向くように傾けられ、SVZの下の線条体組織を除去できます。(L)SVZを含む薄い組織片が得られる。黒の破線は切断部位を示します。黒の点線は、各ステップでのSVZの位置を示します。略語:OB =嗅球;CB = 小脳。AHのスケールバー:5 mm;I-Lで:3 mmこの図の拡大版を表示するには、ここをクリックしてください。
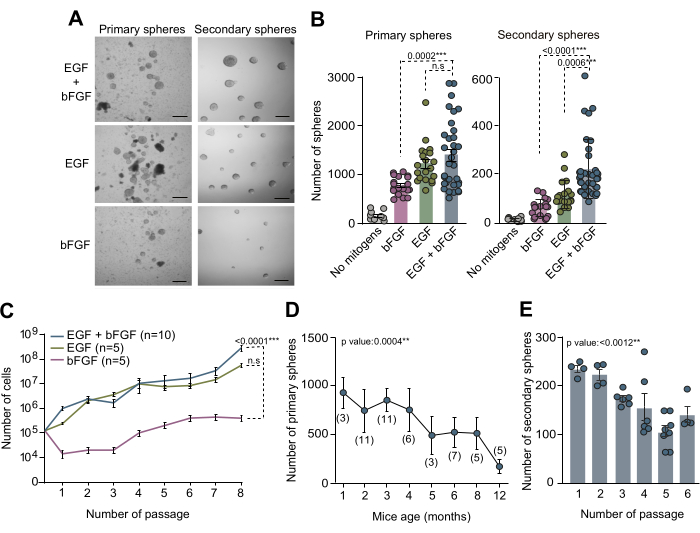
図2:in vitroでのNSCの最適な培養と増殖には、マイトジェンEGFとbFGFの両方が必要です。 (A)EGFとbFGFの両方、または各マイトジェンを別々に補充したNSC培地中の一次および二次ニューロスフェア培養の位相コントラスト顕微鏡画像。(B)培地のマイトジェン組成に基づいて、マウスおよびウェルごとに得られる一次球の数:マイトジェンなし(灰色、n = 9)、EGF + bFGF(青、n = 33)、EGFのみ(緑、n = 20)、またはbFGFのみ(ピンク、n = 19、左パネル)。培地のマイトジェン組成に基づくウェルあたり低密度(5細胞/μL)で形成された二次ニューロスフェアの数:マイトジェンなし(灰色、n = 11)、bFGF(ピンク、n = 18)、EGF(緑、n = 18)またはEGF + bFGF(青、n = 37、右パネル)。ダンの事後分析によるKruskal-Wallisテストが使用されました。(C)培地中に存在するマイトジェンに応じて、異なるニューロスフェア培養で8回の継代後に形成された細胞の総数を示す成長曲線:bFGF(ピンク、n = 5)、EGF(緑、n = 5)またはEGF + bFGF(青、n = 10)。線形回帰分析を使用しました。 (D)出生後のさまざまな発達段階で動物から解剖および分解された個々のマウスに由来する一次ニューロスフェアの数。線形回帰分析を使用しました。n は括弧内に示します。(E)自己複製能力を評価するために、その後のイン ビトロ での継代を通じて低密度(5細胞/μL)で形成された二次ニューロスフェアの数。Kruskal-Wallis検定が使用され、p値が含まれています:*:p<0.05;**: p<0.01;: p<0.001;: p<0.0001.N.S: 重要ではありません。エラーバーはSEMを表し、Aのスケールバーは100μmです。 この図の拡大版を表示するには、ここをクリックしてください。
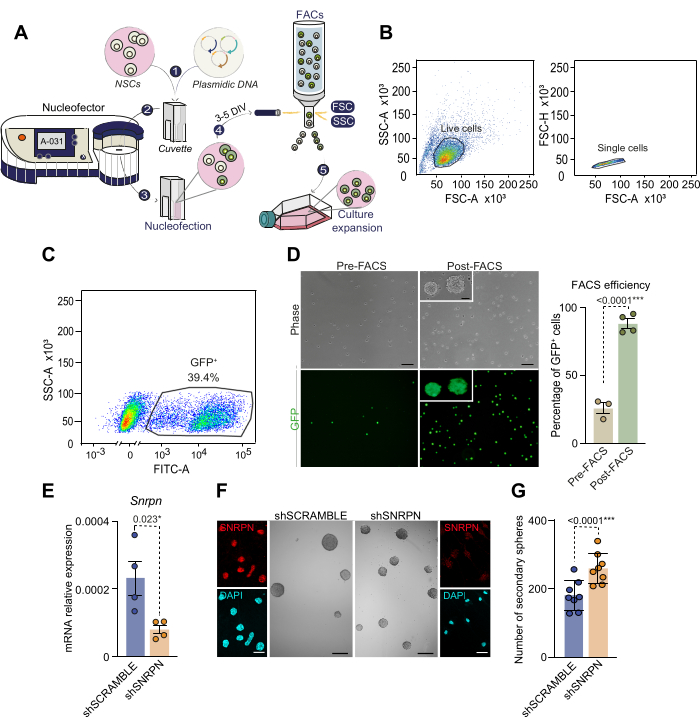
図3:ヌクレオフェクションプロセスとFACSベースのヌクレオフェクト細胞の細胞選択の概略図。 (A)核形成プロセスとFACSに基づく核形成細胞の細胞選択の概要。1)プラスミドDNA溶液をヌクレオフェクション溶液と結合し、細胞に添加します。次に、この混合物をキュベットに移してヌクレオフェクションします。2)DNAと細胞が入ったキュベットをヌクレオフェクターに挿入し、電気ショックを与えます。成体SVZから単離されたニューロスフェア培養には、A-031 NSCプログラムの使用をお勧めします。3)ヌクレオフェクション後、細胞をEGFおよびbFGFを添加した完全培地を含むフラスコに移します。4)細胞は、プラスミドDNAに含まれるレポーターの発現に基づいてFACSによって選別されます。5)選別した細胞は、その後の実験のためにさらに培養されます。(B)FACSに基づく選択戦略とヌクレオフェクトNSCのゲーティング。まず、高FSC-Aと高SSC-Aに基づいて生細胞を選抜し(左のグラフ)、次にFSC-AとFSC-Hのパラメータを解析することで細胞のダブレットとトリプレットを排除します(右のグラフ)。(C)GFP発現に基づく有核細胞のFACSゲーティング(SSC-A対FITC-A蛍光)。(D)FACS選択前(n = 3)および選択後(n = 4)の核形成されたNSCの位相コントラスト顕微鏡法およびGFP蛍光画像(左パネル)。核吸収されたGFP+細胞の割合は、FACS選択の前後で示されています(右パネル)。t検定を用いた。(E) Snrpn特異的shRNA(n = 4)でヌクレオフェクトされた増殖性NSCにおけるSnrpn発現の定量的PCR(qPCR)分析。shRNA SCRAMBLEを用いたヌクレオフェクションをコントロールとして使用しました(n=4)。t検定を用いた。(F)shRNAヌクレオフェクションの7日後のNSCのSNRPN(赤)を示す免疫細胞化学画像(外側パネル)。DAPIはDNAの対比染色に利用されました。shSNRPNおよびshSCRAMBLE条件下でのNSCに由来するニューロスフェアを描いた代表的な画像(中央パネル)。(G)shSNRPN(n = 8)またはshSCRAMBLE(n = 8)によるヌクレオフェクション後のNSC培養物で形成されたニューロスフェアの数の定量化。t検定を用いた。p値が含まれます: *: p<0.05;**: p<0.01;: p<0.001;: p<0.0001.N.S: 重要ではありません。エラーバーはSEMを表します。 D、10μmのスケールバー。Fでは100μm(Fでは高倍率画像、7μm)。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
in vivoでNSC集団を同定するための決定的なマーカーがないため、NSCの分析は主に、ex vivo条件で神経原性ニッチから単離された細胞の挙動を観察することに基づいています。Reynolds氏とWeiss氏による先駆的な研究は、正確な培養条件を確立することで基礎を築き、非接着条件下で若年体(生後2か月)マウスSVZ組織から個々の細胞を単離および増殖することを可能にしました。これらの細胞は通常、EGFとbFGFを含む無血清培地で増殖します。これは、ニューロンとグリアへの分化を完全に防ぎ、増殖を促進する条件です。実際、これらの培養条件下では9、ほとんどの細胞は培養の最初の数日間に死滅するが、小さなサブセットが分裂し始め、主に浮遊ニューロスフェア9を形成する。これらの細胞凝集体の酵素的解離および継代培養は、培養増殖を促進し、これらの培養物の自己複製能力を実証する。
特に、ニューロスフェア培養物はEGFのみを添加すると拡大の可能性を示すが、bFGFのみを含む培地で増殖したNSCは長期的な細胞増殖を示さない30。どちらの証拠も、EGFが主要なNSC自己再生マイトジェンであることを示しています。それにもかかわらず、培養培地中にEGFとbFGFの両方が存在すると、NSCの自己複製能力が向上するだけでなく、アストロサイト、ニューロン、およびオリゴデンドロサイト32,33,34,35への分化能のバランスをとるのにも寄与する。さらに、培地を補うために市販の代替品の代わりに、ホルモンと因子の定義された混合物を使用することで、NSC培養の高い品質と再現性が保証されます。これらの条件下では、マウスNSC培養物は、不死化を受けることなく安定した細胞株として存続することができます。それにもかかわらず、ニューロスフェア培養における懸念は、増殖性細胞集団が遺伝子形質転換を受け、細胞周期調節メカニズムを回避し、不死化表現型につながる可能性があることです。したがって、ニューロスフェア培養物は非常に拡張可能ですが、10回のin vitro継代を超える培養物は、反復的な老化を受ける可能性があり、染色体含量が異常な細胞や不規則な増殖動態を持つ細胞が出現する可能性があるため、通常は研究のために廃棄されます。さらに、長期的に確立されたニューロスフェア培養物の使用を継続的に監視する必要があります。また、ニューロスフィア培養は、制御された環境でその特性と可能性を調べる機会を提供し、in vivoよりも正確に調節および監視できる、より正確で調整可能な設定を提供します。in vitroでのクローン形成または集団分析を通じて、これらの細胞の自己複製および増殖能力を定量化することが可能になり、これらの特性を支配する根本的なメカニズムの特定が容易になります。
それにもかかわらず、 in vitroでNSCを扱うことの利点は数多くあるにもかかわらず、この培養プロトコルの性質とNSCの繊細さは、この分野での課題となっています。例えば、典型的な解剖中に生成される一次ニューロスフェアの数は、実験者のスキルと精度によって大きく異なる可能性があります。一次ニューロスフェアの結果は、2か月齢のマウスのSVZから得られた一次ニューロスフェアの数のこの変動性を示しており、これは500〜3000のニューロスフェアの範囲です。この変動には、さまざまな要因が寄与する可能性があります。まず、解剖の精度により、不要な実質組織を最小限に抑え、一次球の形成を阻害します。次に、SVZ組織の小片を生成することで、効率的な酵素消化とトリチュレーションが可能になり、細胞損失が減少します。これは、解剖プロトコルの十分な事前の実践と、ニューロスフィア培養の確立中の組織処理の微調整された開発の必要性を強調しています。
これらの培養物のもう一つの限界は、ニューロスフェアがNSCと前駆細胞の両方を含むことができるという事実にあり、初代培養内でこれら2つの集団を区別することが困難であるという事実にあります。GFAP、Nestin、Musashi、SOX2などのさまざまなマーカーがNSCによって発現することが報告されていますが8、これらのいずれもNSCとのみ関連しているわけではありません。これらの研究は、トランジット増幅前駆細胞が通過時にニューロスフェアを形成できないことを実証しています25,36。したがって、SVZ細胞とニューロスフェア開始細胞との関係はさらなる改良を必要とする一方で18、19、20、21、22、23、ニューロスフェアが長期間にわたって連続的に継代される能力は、培養中のNSCの存在を反映している可能性がある。
このニューロスフェア培養システムは、シグナル伝達経路と遺伝子発現がin vitroでNSCの自己複製能力を維持するために与える影響を調査するための堅牢なモデルとして機能しています15,29。これらの側面を調査する1つのアプローチには、NSCをトランスフェクションして特定の遺伝子を過剰発現またはノックダウンすることが含まれます。これは、ウイルス法や非ウイルス法など、さまざまな手法で実現できます。ウイルスベクターはしばしば高い遺伝子導入効率を達成する一方で、高い安全性要件や時間のかかるベクター産生など、重要な限界がある26。逆に、リポフェクションやエレクトロポレーションなどの従来のトランスフェクション法は、トランスフェクション率が非常に低いため、トランスフェクションが困難な細胞には適していません。ヌクレオフェクション技術は、細胞タイプ固有のヌクレオフェクション溶液と各細胞タイプに固有の電気的パラメータを組み合わせることにより、ユーザーフレンドリーなアプローチを提供します37,38。これにより、DNAが細胞核39に直接移行することが保証され、細胞周期に依存しない方法でDNAの取り込みが可能になる。その結果、ヌクレオフェクションは、マウスNSC28,40のようなトランスフェクションが困難な細胞をトランスフェクションするための実行可能な技術として浮上している。
この方法の1つの制限は、各ヌクレオフェクションに対して最低2×106個の細胞が推奨され、必要であることであるが、最適な条件では、単一のヌクレオフェクション(すなわち、5個×10個の5 個の細胞)につきより少ない数の細胞を使用できる。この方法の別の欠点は、ヌクレオフェクションに使用されるDNAの品質と濃度が遺伝子導入効率に大きく影響することです。エンドトキシンの存在による細胞死亡率の上昇を防ぐために、エンドトキシンフリーの調製済みDNAを利用することを強くお勧めします。さらに、ヌクレオフェクションに6 μgを超える全DNAを使用すると、遺伝子導入効率と細胞生存率の両方が大幅に低下する可能性があります。最後に、電気パルス投与も核細胞の生存にとって重要です。
本研究では、エピソームプラスミドを用いてSnrpn遺伝子の発現をダウンレギュレーションする戦略を採用することにより、 Snrpn 遺伝子発現の操作を例示しました。これらのプラスミドは細胞のゲノムに組み込まれていないため、 NSCがin vitroで増殖し続けると、導入されたDNAはその後、細胞分裂によって希釈され、遺伝子操作の影響が失われます。したがって、この戦略は、短期間での急性変化の影響を研究したり、 in vitroで細胞を生年月日に研究したりするのに価値があります。遺伝子摂動のより長期的な影響を評価するためのいくつかの代替手段が利用可能です。例えば、トランスポゾンベースのpiggyBACのような統合的なシステムを使用することができる。このシステムは、トランスポゼーション配列に隣接するプラスミドに含まれる所望のコード配列を導入し、酵素トランスポゼース41の配列を含むプラスミドを細胞にコヌクレオフェクトすることからなる。あるいは、トランスポゾンまたはCRISPR/Casシステムを使用することもできます。
トランスフェクション技術のさらなる開発は、成体神経幹細胞生理学におけるさまざまな遺伝子の役割を評価するためのハイスループットアッセイに向けた重要なステップとなります。これらの研究は、ますます高度化する精製および増殖方法と組み合わせることで、成体NSCの in vitro 生物学の理解と、浮遊ニューロスフェアと in vivoでのNSCの生物学的な違いの比較を可能にします。
開示事項
著者は、競合する金銭的利益を宣言しません。
謝辞
この研究は、Ministerio de Ciencia e InnovaciónおよびAgencia Estatal de Investigación(MCIN/AEI)(PID2019-110045GB-I00;PID2022-142734OB-I00 および EUR2023-143479) を SRF に発行します。EJV(FPU20/00795)とDSL(FPU22/03797)は、Spanish Formación de Profesorado Universitarioフェローシッププログラム(FPU)によって資金提供されています。LLC(PRE2020-094137)およびJDM(PREP2022-000680)は、Spanish Formación de Personal Investigador(FPI)フェローシッププログラムによって資金提供されています。CMM(CIACIF/2022/366)は、Generalitat Valencianaによって資金提供されています。MIL(CPI-22-481)は、Programa INVESTIGOフェローシップ(Next Generation EU)によって資金提供されています。オープンアクセスの資金は、Ministerio de Ciencia e Innovaciónによって提供されます。
資料
| Name | Company | Catalog Number | Comments |
| 0.22 μm pore-filter bottles (250 mL) | VWR | 514-0330P | |
| 0.22 μm pore-filter bottles (500 mL) | VWR | 514-0332P | |
| 12-well plate | LabClinics | PLC30012 | |
| 15 mL tube | Fisher | 10738771 | |
| 24-well plate | LabClinics | PLC30024 | |
| 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid (HEPES) | BioWest | L0180-100 | |
| 4′,6-diamidino-2-phenylindole (DAPI) | Sigma | D9542 | |
| 48-well plate | ThermoFisher | 150687 | |
| 6-well plate | LabClinics | PLC30006 | |
| 96-well plate | Labclinics | PLC30096 | |
| Accutase solution | Sigma | A6964-100ML | Referred as enzymatic solution |
| Amaxa Mouse Neural Stem Cell Nucleofector Kit | Lonza | VPG-1004 | |
| Amaxa Nucleofector Iib | Lonza | 10700807 | |
| Antibiotic/Antimitotic (A/A) | Sigma | A5955 | |
| Apo-t-Transferrine | Sigma | T2252-1G | |
| Basic Fibroblast Growth Factor (bFGF) | Sigma | F0291 | |
| Blasticidin | Sigma | 203350 | |
| Bovine Serum Albumin (BSA) | Sigma | B4287-25MG | |
| Cell strainer 40 μm | LabClinics | PLC93040 | |
| Deoxynucleotide triphosphate (dNTPs) | NZYTech | MB08701 | |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | |
| Dulbecco’s Phosphate Saline Buffer (DPBS) | Gibco | 14080-055 | |
| Dulbecco's Modified Eagle's Medium (DMEM) F12 1:1 | Gibco | 11320-074 | |
| E. coli DH5α Competent Cells | ThermoFisher | EC0112 | |
| Earles's Balanced Salt Solution (EBSS) | Gibco | 24010-043 | |
| Epidermal Growth Factor - Human recombinant (EGF) | Gibco | 53003-018 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma | E-6511 | |
| Fine Forceps | Fine Science Tools | 11274-20 | |
| Fine Scissors Sharp | Fine Science Tools | 14060-09 | |
| Glucose | Sigma | G-7021 | |
| GoTaq G2 Flexi DNA Polymerase | Promega | M7805 | Kit includes reagents for PCR |
| Heparin | Sigma | H-3149 | |
| Insuline | Sigma | I6634 | |
| LB agar (Lennox) | LabKem | AGLB-00P-500 | |
| LB broth (Lennox) | LabKem | LBBR-00P-500 | |
| L-Cysteine | Sigma | C-8277 | |
| L-Glutamine | Gibco | 25030-024 | |
| Neubauer chamber | Blaubrand | BR718620 | |
| Nuclease free water | Labbox | WATR-00A-10K | |
| NZYMaxiprep Endotoxin Free Kit | NZYTech | MB39901 | |
| Papain Lyophilized | Worthington | LS003119 | |
| Progesterone | Sigma | P-6149 | |
| Putrescine | Sigma | P-7505 | |
| Scalpel | Fine Science Tools | 10316-14 | |
| shSCRAMBLE | Mission (Sigma) | SHC003 | |
| shSNRPN | Mission (Sigma) | TRCN0000109285 | |
| Sodium Selenite | Sigma | S-9133 | |
| Spatula | Fine Science Tools | 10090-17 | |
| Sterile PES Syringe Filters (0.22 μm pore-filter) | Epica | SFPE-22E-050 | |
| T12.5 cm2 Flask | Biofil | TCF012025 | |
| T25 cm2 Flask | LabClinics | PLC70025 | |
| T75 cm2 Flask | LabClinics | PLC70075 | |
| Tweezers | Fine Science Tools | 91150-20 |
参考文献
- Gage, F. H. Mammalian neural stem cells. Science. 287 (5457), 1433-1438 (2000).
- Ming, G., Song, H. Adult neurogenesis in the mammalian central nervous system. Ann Rev Neurosci. 28 (1), 223-250 (2005).
- Doetsch, F., Caillé, I., Lim, D. A., García-Verdugo, J. M., Alvarez-Buylla, A. Subventricular zone astrocytes are neural stem cells in the adult mammalian brain. Cell. 97 (6), 703-716 (1999).
- Obernier, K., et al. Adult neurogenesis is sustained by symmetric self-renewal and differentiation. Cell Stem Cell. 22 (2), 221-234 (2018).
- Doetsch, F., García-Verdugo, J. M., Alvarez-Buylla, A. Regeneration of a germinal layer in the adult mammalian brain. Proc Natl Acad Sci. 96 (20), 11619-11624 (1999).
- Doetsch, F., García-Verdugo, J. M., Alvarez-Buylla, A. Cellular composition and three-dimensional organization of the subventricular germinal zone in the adult mammalian brain. J Neurosci. 17 (13), 5046-5061 (1997).
- Mamber, C., Kozareva, D. A., Kamphuis, W., Hol, E. M. Shades of gray: The delineation of marker expression within the adult rodent subventricular zone. Prog Neurobiol. 111, 1-16 (2013).
- Cebrian-Silla, A., et al. Single-cell analysis of the ventricular-subventricular zone reveals signatures of dorsal and ventral adult neurogenesis. eLife. 10, e67436 (2021).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255 (5052), 1707-1710 (1992).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and expansion of the adult mouse neural stem cells using the neurosphere assay. J Vis Exp. (45), e2393 (2010).
- Jensen, J. B., Parmar, M. Strengths and limitations of the neurosphere culture system. Mol Neurobiol. 34 (3), 153-161 (2006).
- Ferrón, S. R., et al. Postnatal loss of Dlk1 imprinting in stem cells and niche astrocytes regulates neurogenesis. Nature. 475 (7356), 381-385 (2011).
- Gil-Perotín, S., et al. Adult neural stem cells from the subventricular zone: A review of the neurosphere assay. Anat Record. 296 (9), 1435-1452 (2013).
- Obernier, K., Alvarez-Buylla, A. Neural stem cells: origin, heterogeneity and regulation in the adult mammalian brain. Development. 146 (4), 156059 (2019).
- Ferrón, S. R., et al. A combined ex/in vivo assay to detect effects of exogenously added factors in neural stem cells. Nat Prot. 2 (4), 849-859 (2007).
- Ferron, S., et al. Telomere shortening and chromosomal instability abrogates proliferation of adult but not embryonic neural stem cells. Development. 131 (16), 4059-4070 (2004).
- Singec, I., et al. Defining the actual sensitivity and specificity of the neurosphere assay in stem cell biology. Nat Meth. 3 (10), 801-806 (2006).
- Santa-Olalla, J., Baizabal, J., Fregoso, M., Cárdenas, M. D. C., Covarrubias, L. The in vivo positional identity gene expression code is not preserved in neural stem cells grown in culture. Eur J Neurosci. 18 (5), 1073-1084 (2003).
- Pastrana, E., Silva-Vargas, V., Doetsch, F. Eyes wide open: A critical review of sphere-formation as an assay for stem cells. Cell Stem Cell. 8 (5), 486-498 (2011).
- Wan, F., et al. The utility and limitations of neurosphere assay, CD133 immunophenotyping and side population assay in Glioma stem cell research. Brain Pathol. 20 (5), 877-889 (2010).
- Deleyrolle, L. P., Rietze, R. L., Reynolds, B. A. The neurosphere assay, a method under scrutiny. Acta Neuropsych. 20 (1), 2-8 (2008).
- Campos, L. S. Neurospheres: Insights into neural stem cell biology. Neurosci Res. 78 (6), 761-769 (2004).
- Reynolds, B. A., Rietze, R. L. Neural stem cells and neurospheres—re-evaluating the relationship. Nat Meth. 2 (5), 333-336 (2005).
- Parker, M. A. Expression profile of an operationally-defined neural stem cell clone. Exp Neurol. 194 (2), 320-332 (2005).
- Belenguer, G., et al. Adult neural stem cells are alerted by systemic inflammation through TNF-α receptor signaling. Cell Stem Cell. 28 (2), 285-299 (2021).
- Cruz, M. T. G., Simões, S., Lima, M. C. P. de Improving lipoplex-mediated gene transfer into C6 glioma cells and primary neurons. Exp Neurol. 187 (1), 65-75 (2004).
- Hagemann, C., et al. High efficiency transfection of glioma cell lines and primary cells for overexpression and RNAi experiments. J Neurosci Meth. 156 (12), 194-202 (2006).
- Moritz, S., Lehmann, S., Faissner, A., Holst, A. von An induction gene trap screen in neural stem cells reveals an instructive function of the niche and identifies the splicing regulator Sam68 as a Tenascin-C-regulated target gene. Stem Cells. 26 (9), 2321-2331 (2008).
- Montalbán-Loro, R., et al. TET3 prevents terminal differentiation of adult NSCs by a non-catalytic action at Snrpn. Nat Comm. 10 (1), 1726 (2019).
- Gritti, A., et al. Epidermal and fibroblast growth factors behave as mitogenic regulators for a single multipotent stem cell-like population from the subventricular region of the adult mouse forebrain. J Neurosci. 19 (9), 3287-3297 (1999).
- Nieto-Estévez, V., Pignatelli, J., Araúzo-Bravo, M. J., Hurtado-Chong, A., Vicario-Abejón, C. A global transcriptome analysis reveals molecular hallmarks of neural stem cell death, survival, and differentiation in response to partial FGF-2 and EGF deprivation. PLoS One. 8 (1), 53594 (2013).
- Vergaño-Vera, E., Méndez-Gómez, H. R., Hurtado-Chong, A., Cigudosa, J. C., Vicario-Abejón, C. Fibroblast growth factor-2 increases the expression of neurogenic genes and promotes the migration and differentiation of neurons derived from transplanted neural stem/progenitor cells. Neuroscience. 162 (1), 39-54 (2009).
- Gabay, L., Lowell, S., Rubin, L. L., Anderson, D. J. Deregulation of dorsoventral patterning by FGF confers trilineage differentiation capacity on CNS stem cells in vitro. Neuron. 40 (3), 485-499 (2003).
- Hack, M. A., Sugimori, M., Lundberg, C., Nakafuku, M., Götz, M. Regionalization and fate specification in neurospheres: the role of Olig2 and Pax6. Mol Cell Neurosci. 25 (4), 664-678 (2004).
- Bithell, A., Finch, S. E., Hornby, M. F., Williams, B. P. Fibroblast growth factor 2 maintains the neurogenic capacity of embryonic neural progenitor cells in vitro but changes their neuronal subtype specification. Stem Cells. 26 (6), 1565-1574 (2008).
- Pastrana, E., Cheng, L. C., Doetsch, F. Simultaneous prospective purification of adult subventricular zone neural stem cells and their progeny. Proc Natl Acad Sci. 106 (15), 6387-6392 (2009).
- Kobayashi, N., et al. Gene delivery to embryonic stem cells. Birth Def Res C. 75 (1), 10-18 (2005).
- Gresch, O., Altrogge, L. Transfection of difficult-to-transfect primary mammalian cells. Meth Mol Biol. 801, 65-74 (2011).
- Maasho, K., Marusina, A., Reynolds, N. M., Coligan, J. E., Borrego, F. Efficient gene transfer into the human natural killer cell line, NKL, using the Amaxa nucleofection system. J Immunol Meth. 284 (1-2), 133-140 (2004).
- von Holst, A., Egbers, U., Prochiantz, A., Faissner, A. Neural stem/progenitor cells express 20 tenascin C isoforms that are differentially regulated by Pax6. J Biol Chem. 282 (12), 9172-9181 (2007).
- Woodard, L. E., Wilson, M. H. piggyBac-ing models and new therapeutic strategies. Trend Biotechnol. 33 (9), 525-533 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved