Method Article
RGD官能化アビジン-ビオチンテザーを用いた血小板遊走を研究するためのIn vitroアッセイ
要約
RGD官能基化されたアビジン-ビオチンテザーを使用して、密度を調整可能な単一の移動血小板をイメージングするための詳細なプロトコルが提供されており、血小板がアビジン-ビオチン結合を破裂するのに十分な力を生成することが明らかになりました。
要約
血小板は無核細胞の断片であるにもかかわらず、現在ではその多面的な能力で広く認識されています。彼らは怪我後の出血を防ぐために血栓を形成するだけでなく、炎症性疾患の間、感染症と戦い、血管の完全性を維持します。止血プラグは血小板の集団的な活性化と凝集を必要としますが、炎症を起こした血管を保護する役割は単一細胞レベルで果たされます。これに関連して、最近のデータでは、血小板が自律的に移動できることが示されていますが、このプロセスは接着環境の機械感知に依存します。ここでは、ポリ-L-リジングラフトポリ(エチレングリコール)(PLL-PEG)-ビオチン骨格(1)、蛍光アビジンリンカー(2)、および血小板インテグリン結合モチーフとしてのビオチン環状Arg-Gly-Asp(cRGD)(3)からなる3層コーティングシステムを利用して、単一血小板遊走をイメージングするための詳細なプロトコルを示します。この還元主義的アプローチにより、基質の接着特性を正確に制御でき、血小板移動の根底にあるメカニズムを研究するためのシンプルで標準化された in vitro アッセイとして機能します。この結果は、cRGDに結合する移動する血小板が、アビジン-ビオチン結合を破壊する力を発揮することを示しています。さらに、ビオチン-cRGDの密度は、血小板の拡散と遊走の両方に大きく影響します。
概要
血小板は、骨髄の巨核球に由来する小さな核細胞断片です。活性化された血小板は、血栓の基礎を形成する凝集体に集まり、生理的止血で血管病変を密閉したり、病的血栓症で病気の血管を閉塞したりします1。しかし、ここ数十年で、血小板が炎症、感染、悪性腫瘍の病態生理学においても中心的な役割を果たしていることが明らかになり、免疫細胞、がん細胞、侵入する病原体との多面的な相互作用が宿主の免疫応答の形成に重要であることが明らかになりました2,3。最近のデータによると、血小板は自律的に移動する能力を持っていることが示されています4。全身性菌血症に応答して、血小板は肝臓の正弦波に動員され、そこで付着して移動します。遊走により、血小板は細菌を捕捉して結合し、それが白血球の活性化をサポートします。特に、この過程で血小板は血管内に留まり、内皮下組織4に移動しません。さらに、血小板は血管の炎症の番人であり、炎症を起こした血管をスキャンして、免疫細胞の血管外漏出によって引き起こされる微小損傷を検出し5、炎症を起こした血管6,7を保護するために移動を利用します。ここで、血小板はインテグリンを使用して、炎症を起こした内皮に沈着したフィブリノーゲンに結合します。次に、血小板はラメリポディカル突起を形成し、周囲の接着特性をスキャンできます。その後、血小板は分極し、フィブリノーゲンの高密度に向かって移動し、これはハプトタキシスとして知られるプロセスです。指向性血小板移動は、筋肉や肺などの炎症組織の出血を防ぐ内皮微小病変でのポジショニングを最終的にサポートします。
血小板の移動は、接着基材の機械的特性に大きく依存します4,8。環境の機械的特性を感知し、伝達する課題は、主にインテグリン受容体によって媒介され、インテグリン受容体は、細胞外マトリックス上のリガンドに細胞外ドメインが結合し、アダプタータンパク質9,10を介してアクチン細胞骨格に結合する細胞外ドメインを持つαサブユニットとβサブユニットで構成される。 最も豊富に存在した血小板インテグリンはαIIbβ3であり、その主要なリガンドはフィブリン(ogen)11である。インテグリン-リガンドの関与は、接着性血小板7の前縁を形成するArp2/3駆動ラメリポディウムの形成で最高潮に達するシグナル伝達イベントを引き起こします。付着性血小板は、それを引っ張ることにより、接着環境の機械的特性を即座に調査します4。ミオシンIIa依存性の引っ張り力が細胞外マトリックス(フィブリン(ogen)など)の機械的安定性を克服すると、血小板は弱くなったリガンドを機械的に破裂させ、そのラメリポディアル突起を使用して微小環境をスキャンして接着性リガンドを探し、新しい基質結合を確立し、リガンドが枯渇した環境から移動します6.非タンパク質分解性の機械的リガンドの枯渇によって引き起こされる細胞遊走は、接着マトリックス8を機械的に再モデリングできる細胞で観察される一般的な現象であるように思われるため、血小板機能を超えた役割を果たす可能性が高い。リガンドの枯渇速度は、移動速度を決定し、リガンドの安定性と基質のリガンド密度の両方に依存する8。低リガンド密度の血小板は、約160ピコニュートン(pN)12,13,14,15の非結合力を持つビオチン-アビジンテザーでガラスカバースリップに結合した工学的インテグリンリガンド(環状Arg-Gly-Asp(cRGD))6,7を機械的に破壊することができる。
ここでは、これらの観察結果を利用して、リガンドに不安定な接着面を生成するための簡単な in vitro プロトコルを開発し、血小板遊走メカニズムの研究を促進します。このプロトコルで概説されている接着コーティングは、(1)PLL-PEG-ビオチン骨格と(2)(3)ビオチン-cRGD(接着性リガンド)のPLL-PEG-ビオチン骨格への結合を促進するニュートラアビジン-フルオレセインイソチオシアネート(NA-FITC)リンカーの3つの重要な要素で構成されています( 図1Bも参照)。このコンストラクトの安定性は、ビオチン-アビジン結合の強度に依存し、(A)PLL-PEG-ビオチン-NA-FITCまたは(B)FITC-NA-ビオチン-cRGD界面のいずれかで切断される可能性があります。さらに、最下層のPLL-PEG-ビオチンとPLL-PEGの比率を適合させることにより、接着性配位子の密度を調整できます。結合の破壊(A)は、コーティングからFITCが放出され、移動する血小板の下の蛍光シグナルの減少につながります。したがって、このプロトコルに記載されているコーティングを組み合わせることで、機械的および接着性基板の特性を正確に調整でき、血小板の移動を蛍光ベースで容易に読み取ることができます。
プロトコル
この研究で実施された動物実験は、マウスを含む研究に関連するすべての倫理規則に準拠して実施され、動物保護に関する現地の法律によって承認されました(Regierung von Oberbayern、ミュンヘン、190-15、2015)。この研究では、8〜10週齢(体重20〜25 g)の雌と雄のC57BL / 6マウスを使用しました。使用した試薬や機器の詳細は 、資料表に記載されています。
1. ビオチン-ニュートラアビジン-ビオチンcRGDコーティング
- ガラスカバースリップ(24mm×24mm;#1.5)を20%HNO3 以内で1分間超音波処理し、続いてイソプロパノール、エタノール、およびH2O内で1分間超音波処理します。各超音波処理の後、カバーガラスを蒸留水(ddH2O)で広範囲にすすぎ、最後にインキュベーター内でそれらを乾燥させます。
- 事前に洗浄したカバースリップをO2 プラズマでプラズマクリーナーで2分間処理し、次に前述の16と同様に粘着性のあるスライドで組み立てます。粘着性のあるスライドとガラスのカバースリップは、それらの間にチャネルを形成します( 図1Aに示すように)。
注:効率的なプラズマ処理が重要です。プラズマ源としてO2 を使用します。 - 97.5 μL の PLL-PEG (1 mg/mL) で希釈した 2.5 μL の PLL-PEG-ビオチン (1 mg/mL) をチャネルに充填し、室温 (RT) で 30 分間インキュベートした後、PBS で 3 回洗浄します。PLL-PEG-ビオチンは次のステップでニュートラアビジンに結合しますが、PLL-PEG骨格はタンパク質と血小板の非特異的結合を防ぐ不活性基質を形成します。
注:コーティング溶液中のPLL-PEG-ビオチンの濃度は、cRGDリガンドの最終密度を定義します。 - 100 μLのニュートラアビジン-FITC(25 μg/mL)を加え、室温で30分間インキュベートした後、PBSで3回洗浄します。
注:ニュートラアビジン-FITC濃度をPLL-PEG-ビオチン濃度に調整します。PLL-PEG-ビオチン密度が高い場合は、ニュートラアビジン-FITC濃度を増加させます。 - 100 μLのシクロ[Arg-Gly-Asp-D-Phe-Lys (Biotin-PEG-PEG)] (cRGD-biotin) (0.1-1 μM)を加え、室温で30分間インキュベートし、PBSで3回洗浄します。カバースリップはすぐに使用できます。コーティングの概略図を 図1Bに示します。
2.血液からのマウス血小板の分離
- 136.9 mMのNaCl、12.1 mMのNaHCO3、2.6 mMのKCl、5.5 mMのグルコース、10 mMのHEPESを含む改変型チロード緩衝液を調製し、pHを7.4および6.5に調整します。
- 0.5 mg / kgフェンタニル、5 mg / kgミダゾラム、および0.05 mg / kgメデトミジンの腹腔内注射により、マウスを麻酔します(施設で承認されたプロトコルに従います)。つま先をつまんで麻酔の深さを確認した後、ハサミで胸部の皮膚を切除します。
- 2 mLのシリンジ(26 G針)と150 μLの酸-クエン酸-デキストロース(ACD)を抗凝固剤として調製します。胸骨の左側にある2本目と3本目の肋骨の間に針を差し込んで、心臓から血液を採取します。その後、子宮頸部脱臼によりマウスを安楽死させます。
注:(1)ACD緩衝液の組成:111 mMのグルコース中に85 mMのクエン酸ナトリウム三塩基性脱水物と65 mMのクエン酸一水和物。(2)採血は、血栓の形成を避けるためにスムーズに行う必要があります。8〜10週齢のマウスから約1mLの血液を採取できます。 - 血液を5 mLのFACS(ポリスチレン丸底)チューブに1 mLのチロード緩衝液(pH 6.5)と混合し、ブレーキをオフにしてRTで70 x g で20分間遠心分離します。
- 遠心分離後、多血小板血漿(PRP)を含む上部(約1 mL)を服用します。3 mLのTyrode's buffer(pH 6.5)と混合し、100 ng/mLのプロスタサイクリン(PGI2)を添加して血小板の活性化を防ぎます。
- 1200 x g で RT で 5 分間遠心分離し、上清を廃棄し、ペレットを 500 μL の Tyrode 緩衝液 (pH 6.5) に再懸濁し、血球計算盤を使用して血小板数を測定します。
3. ビオチン-ニュートラアビジン-ビオチンcRGDコーティング上のマウス血小板遊走
- 改変チロード緩衝液(pH 7.4)に10 x 103/μLマウス血小板、1 mMのCaCl2、2 μMのU46619、および4 μMのアデノシン5′-二リン酸ナトリウム塩(ADP)を添加し、ステップ1で調製したチャネルに総容量240 μLをピペットで移します。
- ステージインキュベーターを備えた倒立顕微鏡を使用して、生きた血小板移動を記録します。あるいは、インキュベーター内でチャネルを37°Cで1時間インキュベートします。
- サンプルを4%パラホルムアルデヒドで室温で10分間固定し、PBSで5回洗浄します。
- 血小板をTriton-X(PBS中0.2%)で5分間透過処理し、PBSで5回洗浄します。
- 2.5 μL の Alexa Fluor 594 ファロイジン (40x メタノールストック) を 100 μL の PBS で希釈します。暗所で30分間血小板とインキュベートし、PBSで5回洗浄します。
- 蛍光顕微鏡でスライドを画像化します。
4. 定量化
注:糸状仮足(指のような突起)またはラメリポディア(シート状の突起)を形成する血小板は、付着性血小板としてカウントされました4。その直径の1つ以上の移動距離を持つ血小板は、移動する血小板として定義されました。
- 移動する血小板の割合:フィジーの マルチポイント ツールを使用して、血小板の接着または移動数をカウントします。ツールバーの ポイントツールの ドロップダウンメニューを右クリックして、 マルチポイント ツールを選択します。移動する血小板の数を接着性血小板の数で割ることにより、移動する血小板の割合を計算します。
- 移動の平均距離: フリーハンドライン ツールを使用して、ニュートラアビジン-FITCコーティングに「刻印」された移動経路の長さを測定することにより、固定サンプルから移動距離を抽出します。ツールバーの [Straight Line ] のドロップダウン メニューを右クリックして、[ Free Hand Line ] ツールを選択します。
- 血小板形状記述子: Threshold 関数を使用して蛍光血小板(Alexa594-Phalloidin)をセグメント化することにより、バイナリマスクを生成します。ツールバーで [画像] > [しきい値の調整] > を選択します。
- 面積、周囲長、真円度、アスペクト比などの形状記述子は、粒子の分析で取得できます。「解析」>セット測定で形状記述子を選択し、「解析」>「パーティクルを解析」で結果を表示を選択します。
結果
活性化血小板は、PLL-PEG-ビオチン-ニュートラアビジン-FITC-ビオチン-cRGDコーティングスライド(図1Cおよび図2A、0分および5分)上に容易に付着して広がり、続いて前縁にラメリポディウムを形成することにより分極します(図2A、10分)。この過程で、偽核(血小板の中心にある暗い領域)が血小板の中心から後部に移動しました(図2A)。その後、分極した血小板は明らかな方向性なしに移動を開始します(図2A、15分、20分、図2B)。PLL-PEG-ビオチン-ニュートラアビジン-FITC-ビオチン-cRGDコーティング上を移動する血小板は、移動経路に沿った蛍光強度の低下によって証明されるように、ニュートラアビジン-FITC-ビオチン-PLL-PEG結合を切断できることを観察しました(図1Cおよび図2A、B)。さらに、破壊されたニュートラアビジン-FITC-ビオチン-cRGD複合体が血小板表面に蓄積します(図2A、B)。この現象は、移動する血小板が基質からフィブリノーゲンを除去し、開放性小管系(OCS)内に蓄積した以前の知見と似ています4。
リガンド密度が血小板遊走にどのように影響するかを調べるために、最初のコーティング層でPLL-PEGに対するPLL-PEGの比率を変化させることにより、cRGD密度を調整しました。これらのデータから、マウスの血小板は2.5%濃度のPLL-PEG-ビオチンで最適な遊走を達成することが明らかになりました。PLL-PEG-ビオチンの濃度が低い(1%)と高い(10%)の両方で、移動が減少します(図3A、B)。これらの基質依存的な遊走行動の変化は、血小板形態の変化を伴います(図3C)。リガンド密度が低い(1%)と、血小板は十分に広がりません(これは、投影された血小板面積と周囲長が低いことからも明らかです(図3C)。これは、インテグリンの活性化とアウトサイドインシグナル伝達が不十分であることを示唆しています7。その結果、血小板はcRGDリガンドに力を加えることができず、基質のリモデリングに失敗し、移動しません(図3A、B)。
リガンド密度が中程度(2.5%)では、血小板の面積と周囲が有意に増加します(図3C)。血小板は効果的に広がり、不安定なcRGDリガンドを機械的に破壊し、遊走します(図3A、B)。しかし、リガンド密度が高い(10%)と、拡散は増加するものの、血小板は分極せず、アスペクト比が低下します(図3C)。これらの条件下では、血小板は粘着性基質に付着したままであり、不安定なcRGDリガンドを切断できないため、移動しません(図3A、B)。
これらの知見は、血小板の移動が基材の接着特性に大きく依存することを示しています。血小板は、それらが接着性配位子と十分に噛み合い、同時に接着性基材4,6,7,8の張力耐性を克服するのに十分な強度の牽引力を生成する場合にのみ移動することができる。
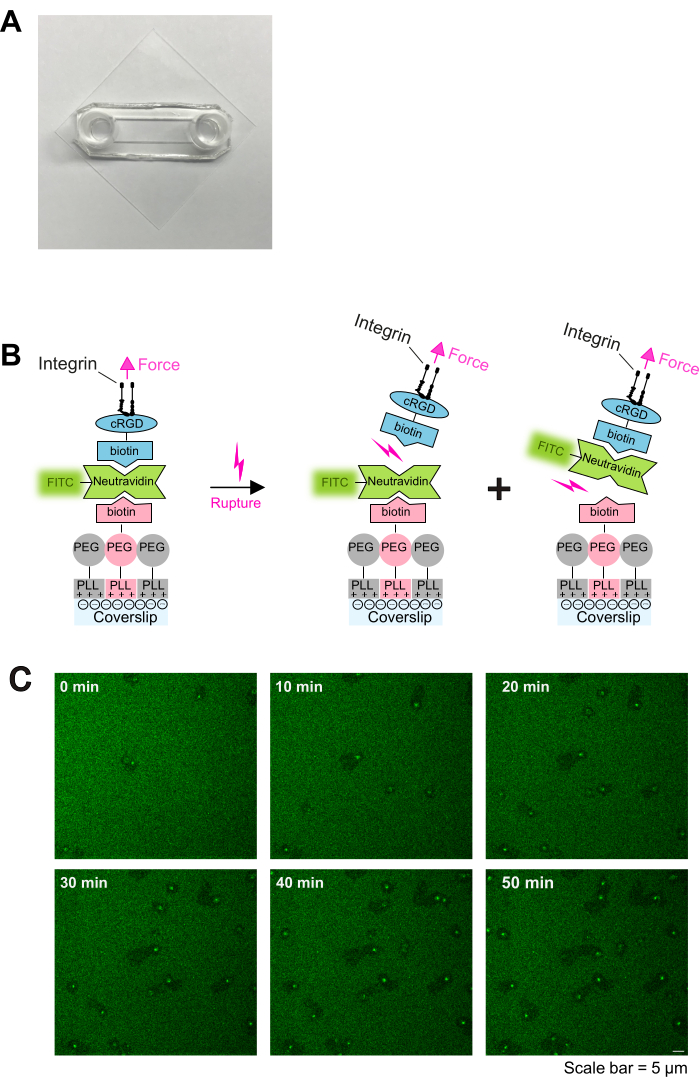
図1:コーティング手順と血小板-基質相互作用のライブイメージング(A)組み立てられたチャンバーの写真。(B)議定書の原則。左:コーティングの概略図。プラズマ処理されたガラスカバースリップを3層でコーティングしました。最初の層は、PLL-PEGとPLL-PEG-ビオチンの混合物です(PLL-PEG骨格は細胞に対して不活性であり、非特異的な結合を防ぎます)。第2層はニュートラアビジン-FITCであり、第3層はビオチン-cRGDです。ニュートラアビジン-FITCは、PLL-PEG-ビオチンとビオチン-cRGDを架橋します。血小板は、原形質膜のインテグリンを介してビオチン-cRGDに結合します。右:血小板インテグリンによるビオチン-アビジンの結合解除の図。血小板は、インテグリン-cRGDの結合を通じて基質に力を及ぼし、上部cRGD-ビオチン-ニュートラアビジン-FITC-結合または下部ニュートラアビジン-FITC-PLL-PEG-ビオチン-結合のいずれかを破裂させます。ニュートラアビジン-FITCとビオチン-PLL-PEGとの間の下部結合の破裂は、蛍光シグナルの減少をもたらすが、ビオチン-cRGDとニュートラアビジン-FITCとの間の上部結合の切断は、そうではない。蛍光が減少した領域は血小板の移動経路を示し(図2Aも参照)、蛍光が増加した領域は、移動する血小板にFTIC-ニュートラアビジン-ビオチン-cRGDが蓄積していることを示します。スケールバー:5μmこの図の拡大版を表示するには、ここをクリックしてください。

図2:リモデリングされた基質によってコードされた血小板遊走の免疫蛍光イメージング(A)単一血小板遊走の代表的な動画シーケンス。左:移動する血小板の位相差画像。血小板は、前縁にラメリポディウムを形成することによって分極し、その後移動します。右:ニュートラアビジン-FITCを基板から除去し、血小板移動の「フットプリント」を残しました。破裂したcRGD-ビオチン-ニュートラアビジン-FITCは、移動する血小板の中心に蓄積します。(B)リガンド不安定性cRGD-ビオチン-アビジンコーティング上の血小板遊走の代表的な画像。上:ファロイジン(Alexa FluorTM 594)で染色した血小板は、大きなラメリポジウム形成と、移動する血小板を連想させる偏光形状を示しました。移動する血小板は、cRGD-ビオチン-ニュートラアビジン-FITC結合を切断し、FITCシグナルの減少で示される遊走経路を基質上に生成します。下:拡大倍率でトリミングされた画像。(C)移民トラックは、フィジーで黄色の線で手動で描かれました。スケールバー:5μmこの図の拡大版を表示するには、ここをクリックしてください。

図3:PLL-PEGに対するPLL-PEG-ビオチンの比率は、血小板の移動と形状を決定します。 (A)1%、2.5%、および10%のPLL-PEG-ビオチンコーティング上の血小板の代表的な画像、スケールバー:5μm。 (B)血小板接着、移動効率、および移動距離の定量化、n = 4独立した実験。平均値/SD;一元配置ANOVA/テューキー;**p < 0.01;p < 0.001;p < 0.0001、ns:有意ではない (C)血小板形状記述子(面積、周囲長、真円度、およびアスペクト比)の定量化、n = 4独立した実験。平均/最小-最大;一元配置ANOVA/テューキー;**p < 0.01;p < 0.001;p < 0.0001、ns: 有意ではありません。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
このプロトコルでは、(1)PLL-PEG-ビオチン骨格と(2)(3)ビオチン-cRGD(接着性リガンド)のPLL-PEG-ビオチン骨格への結合を容易にするニュートラアビジン-FITCリンカーからなる3層コーティング手順が提示されます( 図1Bも参照)これにより、PLL-PEG-ビオチンとPLL-PEGの比率を変化させることにより機械的および接着性基板特性の正確な調整が可能になり、血小板移動の蛍光ベースの読み出しが容易になります。このプロトコルでは、FITC標識ニュートラアビジンとAlexa Fluor 594標識ファロイジンを使用して血小板の遊走と形状を追跡しますが、他の蛍光色素標識アビジンとファロイジンを使用することもできます。PLL-PEG、PLL-PEG-ビオチン、ニュートラアビジン-FITC、cRGD-ビオチンを含むすべてのコーティング試薬、および血小板活性化剤が市販されているため、この実験はそれほど手間をかけずに行うことができます。非効率的なプラズマ処理は、PLL-PEG/PLL-PEG-ビオチンの基質への不十分な結合につながり、血小板の接着と移動の失敗につながるため、重要なステップはプラズマ処理です。プラズマクリーナーの性能は重要です。一般に、13.6 MHzの発電機を備えたプラズマクリーナーは、40 KHzまたは100 KHzのプラズマクリーナーよりも優れた性能を発揮します。さらに、酸素プラズマ源は周囲の空気よりも適しています。プラズマ処理が成功した後、コーティングステップでエラーが発生しにくくなります。
血小板は、基質の接着に大きく依存する間葉系の移動モードを使用することが以前に示されています4,17。線維芽細胞と同様に、リガンド密度が低いと、血小板が基質に付着しにくくなるため、リガンド密度が低いと、固い接着が離脱するのを防ぐことで移動が妨げられます18(図3)。中程度の密度では、血小板は接着しますが、インテグリン結合あたりのミオシンIIA依存性の引っ張り力は、接着を切断するのに十分です。注目すべきは、インテグリンαIIbβ3とそのリガンドフィブリン(ogen)との高い親和性が、接着性リガンドの放出ではなく、in vivo の内皮細胞や in vitro のカバーガラスなどの下層基質からの剥離または剥離を通じて接着の分解をもたらすことです 4,6.下にある基質からフィブリノーゲンを分離するために必要な結合解除力は、制御が困難なことが多い物理的および(バイオ)化学的特性に大きく影響され、移動効率に大きなばらつきをもたらす可能性があります。ここで紹介するアッセイは、この問題に対処するための還元主義的なアプローチを提供します。しかし、アビジン-ビオチン結合の切断力は約160pNに固定されているため、二本鎖DNAテザーに基づくようなより高度な張力センサーを使用して、より低い力領域での血小板接着を研究する必要があります19。
以前の研究では、血小板遊走がin vivoでの細菌感染と血管の炎症に関与していることがわかりました。その結果、ミオシン収縮性の障害、アクチン重合、またはインテグリンのアウトサイドインシグナル伝達などの遊走欠損を有する血小板は、細菌クリアランスおよび血管完全性の障害を示す4,6,7。ここで紹介するアッセイはシンプルで安定しているため、低分子阻害剤とその血小板遊走への影響のスクリーニングに適しています。これは、炎症または血栓症の治療標的を探索するための新しいin vitroツールを提供します。
開示事項
著者は何も開示していません。
謝辞
この研究は、ドイツ研究振興協会(DFG;ドイツ研究財団)プロジェクト番号514478744およびF.G.への514477451このプロジェクトは、欧州連合(ERC、MEKanics、101078110)によって資金提供されています。表明された見解や意見は著者のものであり、必ずしも欧州連合または欧州研究会議事務局の見解や意見を反映するものではありません。欧州連合も付与機関も、それらに対して責任を負うことはできません。
資料
| Name | Company | Catalog Number | Comments |
| Adenosine 5′-diphosphate sodium salt (ADP) | Sigma-Aldrich | A2754 | |
| Alexa Fluor 594 phalloidin | Thermofisher | A12381 | |
| Blood counter | Sysmex | XN-1000 | |
| Bottomless 6 channel sticky slide | IBIDI, sticky slides VI0.4 | 80608 | |
| Centrifuge | Eppendorf | 5804 | |
| Confocal microscope | Zeiss | LSM880 | |
| cyclo [Arg-Gly-Asp-D-Phe-Lys(Biotin-PEG-PEG)] | Peptide international | PCI-3697-PI | |
| FACS tubes | Corning Brand | 352052 | |
| FITC conjugate neutravidin | Thermofisher | A2662 | |
| Formaldehyde | Thermofisher | 28908 | |
| HEPES solution | Sigma-Aldrich | H0887 | |
| Phase contrast and epifluorescent microscope | Olympus | IX83 | |
| Plasma cleaner | Diener | 116531 | |
| PLL(20)-g[3.5]-PEG(2)/PEG(3.4)-biotin(50%) | Susos | PLL(20)-g[3.5]-PEG(2)/PEG(3.4)-biotin (50%) | |
| Poly(L-lysine)-graft-poly(ethylene glycol) co-polymer | Susos | PLL(20)-g[3.5]-PEG(2) | |
| Prostaglandin I2 sodium salt (PGI2) | Abcam | ab120912 | |
| Sonicator | BANDELIN | SONNOREX RK514M | |
| Ttriton X-100 20% v/v | Cayman Chemical | 600217 | |
| U46619 | Enzo Life Sciences | BML-PG023-0001) |
参考文献
- Jackson, S. P. Arterial thrombosis--insidious, unpredictable and deadly. Nat Med. 17, 1423-1436 (2011).
- Kaiser, R., Escaig, R., Nicolai, L. Hemostasis without clot formation: how platelets guard the vasculature in inflammation, infection, and malignancy. Blood. 142 (17), 1413-1425 (2023).
- Gaertner, F., Massberg, S. Patrolling the vascular borders: Platelets in immunity to infection and cancer. Nat Rev Immunol. 19 (12), 747-760 (2019).
- Gaertner, F., et al. Migrating platelets are mechano-scavengers that collect and bundle bacteria. Cell. 171 (6), 1368-1382.e23 (2017).
- Gros, A., et al. Single platelets seal neutrophil-induced vascular breaches via GPVI during immune-complex-mediated inflammation in mice. Blood. 126 (8), 1017-1026 (2015).
- Nicolai, L., et al. Vascular surveillance by haptotactic blood platelets in inflammation and infection. Nature Comm. 11, 5778 (2020).
- Kaiser, R., et al. Mechanosensing via a GpIIb/Src/14-3-3zeta axis critically regulates platelet migration in vascular inflammation. Blood. 141 (24), 2973-2992 (2023).
- Sarkar, A., LeVine, D. N., Kuzmina, N., Zhao, Y., Wang, X. Cell migration driven by self-generated integrin ligand gradient on ligand-labile surfaces. Curr Biol. 30 (20), 4022-4032 (2020).
- Hynes, R. O. Integrins: Bidirectional, allosteric signaling machines. Cell. 110 (6), 673-687 (2002).
- Kechagia, J. Z., Ivaska, J., Roca-Cusachs, P. Integrins as biomechanical sensors of the microenvironment. Nat Rev Mol Cell Biol. 20, 457-473 (2019).
- Shattil, S. J., Newman, P. J. Integrins: Dynamic scaffolds for adhesion and signaling in platelets. Blood. 104 (6), 1606-1615 (2004).
- Yuan, C., Chen, A., Kolb, P., Moy, V. T. Energy landscape of streptavidin-biotin complexes measured by atomic force microscopy. Biochemistry. 39 (33), 10219-10223 (2000).
- Florin, E. L., Moy, V. T., Gaub, H. E. Adhesion forces between individual ligand-receptor pairs. Science. 264 (5157), 415-417 (1994).
- Merkel, R., Nassoy, P., Leung, A., Ritchie, K., Evans, E. Energy landscapes of receptor-ligand bonds explored with dynamic force spectroscopy. Nature. 397, 50-53 (1999).
- Jurchenko, C., Chang, Y., Narui, Y., Zhang, Y., Salaita, K. S. Integrin-generated forces lead to streptavidin-biotin unbinding in cellular adhesions. Biophys J. 106 (7), 1436-1446 (2014).
- Fan, S., Lorenz, M., Massberg, S., Gaertner, F. Platelet migration and bacterial trapping assay underflow. Bio-Protocol. 8 (18), e3018 (2018).
- Lauffenburger, D. A., Horwitz, A. F. Cell migration: A physically integrated molecular process. Cell. 84 (3), 359-369 (1996).
- Palecek, S. P., Loftus, J. C., Ginsberg, M. H., Lauffenburger, D. A., Horwitz, A. F. Integrin-ligand binding properties govern cell migration speed through cell-substratum adhesiveness. Nature. 385, 537 (1997).
- Zhao, Y., Wetter, N. M., Wang, X. Imaging integrin tension and cellular force at submicron resolution with an integrative tension sensor. J Vis Exp. (146), e59476 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved