このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
抗菌酸化グラフェン/銅ナノ複合材料の作製
要約
ここでは、抗菌ナノ材料として酸化グラフェン/銅(GO/Cu)ナノコンポジットを紹介します。GO/Cuナノコンポジットの抗菌効果は、抗生物質耐性のグラム陽性菌とグラム陰性菌の両方に対して評価されました。
要約
抗生物質は、現在、細菌を殺すために最も使用されている抗菌治療薬です。しかし、細菌は抗生物質に過剰にさらされ続けると耐性を獲得します。抗生物質耐性菌は、現在のすべての抗生物質に対する耐性メカニズムを持ち、院内感染を促進する可能性があるため、既存の抗生物質に代わる抗菌剤の開発が不可欠です。この課題に対処するために、本研究では、既存の抗生物質に代わる抗菌材料として、酸化グラフェン/銅(GO/Cu)ナノ複合材料を提案します。GO/Cuナノコンポジットは、透過型電子顕微鏡と走査型電子顕微鏡によって特徴付けられます。その結果、銅(Cu)ナノ粒子が酸化グラフェンシート上で良好に成長していることが示されました。さらに、院内感染に関与することが多いメチシリン耐性 黄色ブドウ球 菌(MRSA)および 緑膿菌 (P.aeruginosa)に対する抗菌物質の有効性を確認するために、微量希釈ブロス法が使用されます。具体的には、500 μg/mLのGO/Cuナノコンポジットにより、MRSAの99.8%と 緑膿菌 の84.7%が除去されます。金属ナノ複合材料は、イオンを放出し、活性酸素種を形成し、細菌に物理的に損傷を与えることにより、抗生物質耐性細菌を根絶することができます。この研究は、抗菌剤耐性菌の根絶における抗菌性GO/Cuナノ複合材料の可能性を示しています。
概要
細菌感染症は公衆衛生に大きな影響を与えます。特に病原菌は、体内の防御メカニズムを回避し、病気を引き起こす可能性があります1。抗生物質は、細菌感染症の治療に広く使用されています。しかし、抗生物質の不適切な使用は、抗生物質耐性菌の出現を促進しました。現在、抗生物質耐性菌に起因する院内感染は、医療施設で顕著な合併症を引き起こしています2。残念ながら、細菌は現在のすべての抗生物質に対する耐性メカニズムを持っています3。そのため、新たな抗菌薬の開発は不可欠ですが、耐性メカニズムが出現する可能性も高いとされています。
金属ナノ粒子は、その効果的な抗菌特性により、抗生物質耐性菌と戦うための有望な薬剤として浮上しています4,5,6。細菌が金属ナノ粒子に対する耐性メカニズムを発達させることは困難です、なぜならそれらは特定の細菌受容体に結合しないため7。特に、銀、銅、および酸化亜鉛ナノ粒子は、その顕著な抗菌効果8,9,10,11,12,13のために広範な研究の焦点となっている。金属ナノ粒子のバクテリアに対する毒性は、1)金属イオンの放出、2)活性酸素種(ROS)の生成、(1)および•Oなどの活性酸素種(ROS)の生成、3)物理的相互作用と付着、4,14の3つの主要なメカニズムに起因します。
本研究では、抗菌剤として酸化グラフェン/銅(GO/Cu)ナノ複合材料を開発した。銅(Cu)は、その表面に遭遇する病原体を効率的に殺し、細菌の遺伝子複製を妨害します。しかし、それは人体に不可欠な微量元素であり、細胞内のCuの濃度を調節する恒常性メカニズムを持っているため、哺乳類細胞に対する毒性は低くなります4。Cuナノ粒子が酸化されると、それらはCuイオンを生成し、これは負に帯電した細菌に対して比較的高い親和性を有する15,16。Cuイオンは細胞構造(タンパク質、膜、DNAなど)に結合し、細胞機能を破壊する17。酸化グラフェン(GO)の表面でCuナノ粒子を合成することにより、金属イオンの放出速度を制御することができます18,19,20。GOは、酸化ストレスによる粗い表面での細菌の付着を防ぐか、ROS21,22を形成することにより、抗菌効果も示します。さらに、GO/Cuナノ複合材料は、Cu2+の化学作用によりGOよりも多くのROSを放出し、細菌のタンパク質やDNAを損傷し、細菌の死に至ります23,24。
この論文では、GO/Cuナノコンポジットを合成するためのプロトコルを概説し、院内感染を引き起こす最も一般的な多剤耐性菌株である臨床細菌MRSAおよび緑膿菌に対する抗菌試験アプローチを紹介します25。このプロトコルは、抗生物質耐性菌の増殖を妨げる可能性のあるGO/Cuナノ複合材料を合成するための簡便な化学還元法を導入することを目的としています。前駆体として塩化銅(II)(CuCl2)を、水素化ホウ素ナトリウム(NaBH4)をそれぞれ前駆体として、還元剤として使用します。このプロトコルでは、これらのナノコンポジットをマイクロ希釈ブロス法を使用して細菌に適用する方法の詳細も説明しています。金属ナノ粒子の吸収干渉による誤差を排除し、正確な評価を行うために、コロニーカウンティング法を用いて抗菌能力を評価します。
プロトコル
1. GO/Cuナノコンポジットの作製
注:GOナノシート上で成長するCuナノ粒子のサイズおよび形態は、GO酸化の程度、Cu前駆体の濃度、および還元剤26の濃度によって決定される。
- ガラス瓶に1 mg / mL GO懸 ?? 液10 mLを調製します。.GOが蒸留水(DI)に十分に分散するまで、GO懸濁液を1時間超音波処理します。
- ガラスバイアルに20 mM CuCl2溶液を調製します。CuCl2が脱イオン水に十分に分散するまで、CuCl2溶液を超音波処理します。
- GO溶液に20mM CuCl2 溶液10mLを加え、混合物を70°Cで1時間超音波処理します。
- 20 mM NaBH4 溶液を調製します。
注意: この手順は、化学薬品のヒュームフードで実行する必要があります。還元剤NaBH4を水に導入するとすぐに酸化還元反応が起こります。実験の直前にNaBH4溶液を調製します。 - NaBH4、GO、CuCl2の混合物の調製
- 20 mLの20 mM NaBH4 溶液をGOおよびCuCl2 混合物に加え、200 rpmの磁気バーで撹拌しながら調製します。NaBH4 溶液を加えた後、30分間連続して撹拌します。
注意: この手順は、化学薬品のヒュームフードで実行する必要があります。
- 20 mLの20 mM NaBH4 溶液をGOおよびCuCl2 混合物に加え、200 rpmの磁気バーで撹拌しながら調製します。NaBH4 溶液を加えた後、30分間連続して撹拌します。
- 混合物の遠心分離
- ステップ1.5.1の混合物を遠心分離管に移します。溶液を23,000 × g で室温で10分間遠心分離します。上清を捨てます。
注意: 遠心分離機を操作するときは、常に同じ重量のチューブを配置してバランスを保ってください。
- ステップ1.5.1の混合物を遠心分離管に移します。溶液を23,000 × g で室温で10分間遠心分離します。上清を捨てます。
- GO/Cuナノコンポジット混合物を10mLの脱イオン水で再懸濁し、沈殿物が溶液全体に均一に分散するように超音波処理します。
- 溶液を23,000 × g で室温で10分間遠心分離します。次に、上清を取り除きます。
- 手順1.7〜1.8をもう一度繰り返して、未反応の化学物質を取り除きます。
- GO/Cuナノ複合材料に1mLの蒸留水を加え、混合物を超音波処理して沈殿物を液相全体に均一に分散させます。
注:すべてのGO/Cuナノコンポジット溶液を1本の円錐形チューブに集めます。 - GO/Cuナノコンポジットが完全に乾燥し、GO/Cuナノコンポジット粉末が得られるまで、溶液を真空下で-60°Cで一晩凍結乾燥します。
- GO/Cuナノコンポジットパウダーは、使用するまで-20°Cで保存してください。
2. 抗菌試験用細菌の調製
注意: この手順は、アルコールランプを備えた生物学的安全キャビネットで実行する必要があります。細菌性廃棄物は、廃棄する前にオートクレーブ滅菌する必要があります。抗生物質耐性菌を取り扱う際は、手袋、ガウン、マスクを着用し、実験後に石鹸や手指消毒剤で手を洗う必要があります。常に徹底的に消毒してください。実験エリアに汚染が発生した場合は、直ちに70%エタノールで消毒してください。
- 細菌培養培地の調製
- フラスコに20gのトリプシン性大豆寒天と500mLの蒸留水を混ぜます。混合物をオートクレーブ内で121°Cで15分間滅菌します。
- 寒天が固まる前に、15mLの寒天溶液をペトリ皿に注いで寒天プレートを準備します。寒天プレートは使用するまで4°Cで保管してください。
注:これは、寒天溶液が固まる前に迅速に行う必要があります。汚染を防ぐために、硬化中に寒天プレートをUVで15分間滅菌します。 - フラスコに15gのトリプシン大豆ブロス(TSB)と500mLの蒸留水を混ぜます。混合物をオートクレーブ内で121°Cで15分間滅菌します。
- 40〜50 mLのブロス溶液を50 mLのコニカルチューブに分注します。.ブロスを使用するまで4°Cで保管してください。
注意: 汚染を防ぐために、分注したブロスをUVで15分間滅菌します。
- 細菌培養
- MSRAまたは 緑膿菌 のストック溶液をループを使用して寒天プレートに接種します。寒天プレートを振盪インキュベーターを使用して37°Cで24時間インキュベートします。
- ループを使用して、細菌の1コロニーを10mLのブロスに接種します。ブロスを200rpmの振とうインキュベーターを使用して37°Cで24時間インキュベートします。
- 手順2.2.1〜2.2.2をもう一度繰り返して、同じ特性を持つ細菌を取得します。
- 24時間後、滅菌蒸留水を使用して細菌溶液を10倍に連続希釈します。希釈した細菌懸濁液100μLを寒天プレートに接種し、スプレッダーで広げます。寒天プレートを振盪インキュベーターを使用して37°Cで24時間インキュベートします。
注:希釈レベルは細菌によって異なります。寒天プレートに調製するコロニーは100未満を目指します。 - 24時間のインキュベーション後の細菌コロニーをカウントし、式(1)を使用してコロニー形成単位(CFU)を決定します。
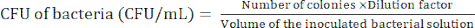 (1)
(1) - 手順2.2.4-2.2.5を少なくとも3回繰り返して、細菌のCFUが比較的一定かどうかを確認します。
3. 微量希釈ブロス法による抗菌試験
- 1日目)寒天プレートからの細菌の1コロニーをループを使用して10mLのブロスに接種します。ブロスを200rpmの振とうインキュベーターを使用して37°Cで24時間インキュベートします。
- 2日目)DULBECCOのリン酸緩衝生理食塩水(DPBS)を使用して、GO / Cuナノ複合材料混合物を少なくとも3つの濃度で調製します。GO/Cuナノコンポジット懸濁液がDPBSに十分に分散するまで、GO/Cuナノコンポジット懸濁液を超音波処理します。
注:このプロトコルでは、GO/Cuナノコンポジット混合物の500、250、125、および62.5μg/mLを試験しました。 - 制御ソリューションを準備します。ネガティブコントロールはDPBSであり、ポジティブコントロールはDPBS中のペニシリン/ストレプトマイシン溶液の1%であり、細菌を殺します。
- 100 μLのGO/Cuナノコンポジット懸濁液と制御溶液を96ウェルプレートに加えます。すべてのサンプルをトリプリケートで追加します。
注:サンプルをバクテリアに適用する前に、サンプルをUVで15分間滅菌します。 - インキュベーションの24時間後のCFUに基づいて、TSBを使用して細菌懸濁液を1 × 106 CFU/mLに希釈します。
注:ステップ2.2.5によると、私たちの研究における最初のMRSAおよび 緑膿菌 培養懸濁液濃度は、それぞれ4.5 × 109 CFU / mLおよび3 × 109 CFU / mLです。1 × 106 CFU/mLの細菌濃度は、培養物をそれぞれ4,500倍および3,000倍に希釈することによって得られます。 - 1 × 106 CFU/mL 希釈した細菌懸濁液 100 μL を 96 ウェルプレートのサンプルウェルに接種します。96ウェルプレートを200 rpmの振とうインキュベーターを使用して、37°Cで24時間インキュベートします。
注:細菌の最終濃度は、100μLのサンプルと混合した後、5×105 CFU / mLです。 - 3日目)サンプルと細菌懸濁液を200μLのマイクロピペットチップで激しく混合します。サンプルとバクテリアの混合物を滅菌蒸留水で10倍に連続希釈します。
注:希釈レベルは細菌によって異なります。寒天プレートに調製するコロニーは100未満を目指します。 - 希釈した細菌懸濁液100μLを寒天プレートに接種し、スプレッダーで広げます。寒天プレートを振盪インキュベーターを使用して37°Cで24時間インキュベートします。
- 4日目)式(2)を使用して、細菌コロニーをカウントし、CFU値を決定して、GO / Cuナノコンポジットの抗菌活性を確認します。
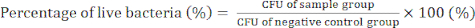 (2)
(2)
結果
透過型電子顕微鏡(TEM)、走査型電子顕微鏡(SEM)、エネルギー分散型X線分光法(EDS)による分析を行い、GO/Cuナノコンポジットの形成を確認しました。 図1A、B は、GOシート上に不均一なCuナノ粒子を成長させたことを示しています。 図1Cに示すように、EDSマッピングにより、GOシート上の粒子がCuナノ粒子であること...
ディスカッション
ここでは、Cuナノ粒子を堆積させたGOナノシートを低コストで簡便に調製する方法を報告します。これは、抗生物質耐性菌を根絶するための潜在的に効率的な方法です。GO/Cuナノコンポジットの合成における重要なステップは、GOとCuCl2 を溶液中に完全に分散させ、それらを混合しながら高温を維持することです。また、還元剤は水と接触するとすぐに還元反?...
開示事項
Jonghoon Choi博士は、Nanomedicine CorporationのFeynman Institute of TechnologyのCEO/Founderであり、Yonghyun Choi博士はCTOです。
謝辞
本研究は、2022年(Jonghoon Choi教授のサバティカル休暇中)に中安大学研究助成金の支援を受けました。本研究は、教育部が資金提供する韓国国立研究財団(NRF)による基礎科学研究プログラム(No.RS-2023-00275006)、および韓国環境産業技術院(KEITI)の助成金は、韓国環境省(MOE)(第2022002980003号)の資金提供を受けています。臨床MRSAと 緑膿菌 は中央大学病院から入手しました。
資料
| Name | Company | Catalog Number | Comments |
| Antibiotic-Antimycotic | Gibco | 15240062 | |
| Clinical MDR bacterial strains | Chung-Ang University Hospital (Seoul, South Korea) | ||
| Copper(II) chloride dihydrate | Duksan | 10125-13-0 | |
| Field Emission Scanning Electron Microscope (FE-SEM) | Carl Zeiss | SIGMA | |
| Graphene oxide | Sigma | 796034 | |
| Sodium Borohydride | Sigma | 71320 | |
| Transmission Electron Microscopy (TEM) | JEOL | JEM-2100 | |
| Tryptic Soy Agar | BD difco | 236950 | |
| Tryptic Soy Broth | BD difco | 211825 |
参考文献
- Doron, S., Gorbach, S. L. Bacterial infections: Overview. International Encyclopedia of Public Health. , 273-282 (2008).
- Van Duin, D., Paterson, D. L. Multidrug-resistant bacteria in the community: An update. Infect Dis Clin North Am. 34 (4), 709-722 (2020).
- Blair, J. M. A., Webber, M. A., Baylay, A. J., Ogbolu, D. O., Piddock, L. J. V. Molecular mechanisms of antibiotic resistance. Nat Rev Microbiol. 13 (1), 42-51 (2015).
- Sánchez-López, E., et al. Metal-based nanoparticles as antimicrobial agents: An overview. Nanomaterials (Basel). 10 (2), 292 (2020).
- Makabenta, J. M. V., et al. Nanomaterial-based therapeutics for antibiotic-resistant bacterial infections. Nat Rev Microbiol. 19 (1), 23-36 (2021).
- Liang, X., Govindaraju, S., Yun, K. Dual applicability of polyaniline coated gold nanorods: A study of antibacterial and redox activity. BioChip J. 12 (2), 137-145 (2018).
- Niño-Martínez, N., Salas Orozco, M. F., Martínez-Castañón, G. A., Torres Méndez, F., Ruiz, F. Molecular mechanisms of bacterial resistance to metal and metal oxide nanoparticles. Int J Mol Sci. 20 (11), 2808 (2019).
- Kim, J., Choi, Y., Park, J., Choi, J. Gelatin-gallic acid microcomplexes release go/cu nanomaterials to eradicate antibiotic-resistant microbes and their biofilm. ACS Infect Dis. 9 (2), 296-307 (2023).
- Jang, J., et al. Development of antibiofilm nanocomposites: Ag/cu bimetallic nanoparticles synthesized on the surface of graphene oxide nanosheets. ACS Appl Mater Interfaces. 12 (32), 35826-35834 (2020).
- Jang, J., Choi, Y., Tanaka, M., Choi, J. Development of silver/graphene oxide nanocomposites for antibacterial and antibiofilm applications. J Ind Eng Chem. 83, 46-52 (2020).
- Bankier, C., et al. Synergistic antibacterial effects of metallic nanoparticle combinations. Sci Rep. 9 (1), 16074 (2019).
- Mendes, C. R., et al. Antibacterial action and target mechanisms of zinc oxide nanoparticles against bacterial pathogens. Sci Rep. 12 (1), 2658 (2022).
- Yoon, S., et al. Biologically benign multi-functional mesoporous silica encapsulated gold/silver nanorods for anti-bacterial applications by on-demand release of silver ions. BioChip J. 13 (4), 362-369 (2019).
- Slavin, Y. N., Asnis, J., Häfeli, U. O., Bach, H. Metal nanoparticles: Understanding the mechanisms behind antibacterial activity. J Nanobiotechnology. 15 (1), 65 (2017).
- Ismail, N. A., et al. Sonochemical synthesis of a copper reduced graphene oxide nanocomposite using honey and evaluation of its antibacterial and cytotoxic activities. Front Mol Biosci. 9, 995853 (2022).
- Tu, Y., et al. Remarkable antibacterial activity of reduced graphene oxide functionalized by copper ions. Adv Funct Mater. 31 (13), 2008018 (2021).
- Li, M., et al. Toward a molecular understanding of the antibacterial mechanism of copper-bearing titanium alloys against staphylococcus aureus. Adv Healthc Mater. 5 (5), 557-566 (2016).
- Yang, Z., et al. Long-term antibacterial stable reduced graphene oxide nanocomposites loaded with cuprous oxide nanoparticles. J Colloid Interface Sci. 533, 13-23 (2019).
- Yang, Y., et al. Graphene oxide/copper nanoderivatives-modified chitosan/hyaluronic acid dressings for facilitating wound healing in infected full-thickness skin defects. Int J Nanomedicine. 15, 8231-8247 (2020).
- Mao, M., et al. Graphene oxide-copper nanocomposites suppress cariogenic streptococcus mutans biofilm formation. Int J Nanomedicine. 16, 7727-7739 (2021).
- Ravikumar, V., Mijakovic, I., Pandit, S. Antimicrobial activity of graphene oxide contributes to alteration of key stress-related and membrane bound proteins. Int J Nanomedicine. 17, 6707-6721 (2022).
- Afreen, G., Shoeb, M., Upadhyayula, S. Effectiveness of reactive oxygen species generated from rgo/cds qd heterostructure for photodegradation and disinfection of pollutants in waste water. Mater Sci Eng C. 108, 110372 (2020).
- Yang, F., et al. Fabrication of graphene oxide/copper synergistic antibacterial coating for medical titanium substrate. J Colloid Interface Sci. 638, 1-13 (2023).
- Rajapaksha, P., et al. Antibacterial properties of graphene oxide-copper oxide nanoparticle nanocomposites. ACS Appl Bio Mater. 2 (12), 5687-5696 (2019).
- Sachdeva, C., Satyamoorthy, K., Murali, T. S. Microbial interplay in skin and chronic wounds. Curr Clin Microbiol Rep. 9 (3), 21-31 (2022).
- Ramos, M. K., Zarbin, A. J. G. Graphene/copper oxide nanoparticles thin films as precursor for graphene/copper hexacyanoferrate nanocomposites. Appl Surf Sci. 515, 146000 (2020).
- Fivenson, E. M., et al. A role for the gram-negative outer membrane in bacterial shape determination. PNAS. 120 (35), e2301987120 (2023).
- Wu, C., et al. Copper-containing mesoporous bioactive glass scaffolds with multifunctional properties of angiogenesis capacity, osteostimulation and antibacterial activity. Biomater. 34 (2), 422-433 (2013).
- Zhang, W., et al. Graphene oxide-copper nanocomposite-coated porous cap scaffold for vascularized bone regeneration via activation of hif-1α. Adv Healthc Mater. 5 (11), 1299-1309 (2016).
- Labauve, A. E., Wargo, M. J. Growth and laboratory maintenance of pseudomonas aeruginosa. Curr Protoc Microbiol. 25 (1), 6E.1.1-6E.1.8 (2012).
- Lin, J., et al. The icmf3 locus is involved in multiple adaptation- and virulence-related characteristics in pseudomonas aeruginosa pao1. Front Cell Infect Microbiol. 5, 70 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved