高解像度呼吸測定法によるヒトおよびマウス骨格筋線維のミトコンドリア呼吸の測定
要約
ここでは、ヒトまたはマウスの筋肉から採取した新鮮な透過性骨格筋線維におけるミトコンドリアの酸化的リン酸化を測定するための包括的な方法について説明します。この方法により、ミトコンドリア呼吸のリアルタイム定量化と、既存のミトコンドリアネットワークと膜の完全性を維持しながら、燃料の好みと代謝の柔軟性の評価が可能になります。
要約
細胞エネルギー生産の基礎となるミトコンドリア機能は、代謝の恒常性を維持するために重要です。骨格筋におけるその機能不全は、一般的な代謝障害(例:.、糖尿病および肥満)、筋ジストロフィー、およびサルコペニア。ミトコンドリアの含有量と形態を評価する手法は数多くありますが、ミトコンドリアの機能を評価するための顕著な方法は、呼吸測定によるミトコンドリアの酸化的リン酸化(OXPHOS)の測定です。ミトコンドリアOXPHOSの定量化により、ミトコンドリアの酸化エネルギー生産と細胞生体エネルギーの効率に関する洞察が得られます。高分解能呼吸計は、ミトコンドリアの酸素消費率のリアルタイムな変化を測定することにより、透過性筋線維中のミトコンドリアOXPHOSの高感度で堅牢な測定を提供します。単離されたミトコンドリアとは対照的に、透過処理された筋線維を使用すると、ミトコンドリアネットワークが維持され、ミトコンドリア膜の完全性が維持され、最終的にはより生理学的に関連性のある測定が可能になります。このシステムは、燃料の好みと代謝の柔軟性(筋肉エネルギー代謝のダイナミックな側面)の測定も可能にします。ここでは、高解像度の呼吸計を使用したヒトおよびマウスの骨格筋線維のミトコンドリアOXPHOS測定の包括的なガイドを提供します。骨格筋群は、ミトコンドリアの燃料の好みや生体エネルギーが異なるさまざまな種類の繊維で構成されています。高分解能呼吸計を使用して、好気性解糖基質と脂肪酸基質の両方を評価し、食物繊維の種類に依存する方法で燃料の好みと代謝の柔軟性を評価する方法について説明します。このプロトコルは汎用性が高く、ヒトとげっ歯類の両方の筋線維に適用できます。目標は、ミトコンドリア機能評価の再現性と精度を向上させることであり、これにより、筋肉の健康に重要な細胞小器官の理解が向上します。
概要
ミトコンドリアは細胞エネルギー生産の基盤であり、細胞および生物の恒常性を最適に維持するために不可欠です。これらの二重膜オルガネラは、主に酸化的リン酸化に関与しています。このプロセスにより、糖類や脂肪酸などの栄養素が、細胞のエネルギー通貨であるアデノシン三リン酸(ATP)に効率的に変換されます。ミトコンドリアは、エネルギー代謝における役割だけでなく、アポトーシス、カルシウム恒常性、活性酸素種(ROS)1,2など、さまざまな細胞プロセスの主要な調節因子でもあります。ミトコンドリアの機能は、細胞や生物の恒常性を維持する上で極めて重要な役割を担っているため、ミトコンドリアの機能障害は、しばしば組織や生物の健康に悪影響を及ぼします。骨格筋では、ミトコンドリアの機能障害は、代謝障害(肥満、糖尿病、心血管疾患など)、サルコペニア、筋ジストロフィーなど、多くの病状と関連しています3,4,5,6,7,8。
ミトコンドリアの機能障害は、主にミトコンドリアの内容、数、形態の変化、および代謝の混乱として現れることがあります。したがって、ミトコンドリアの機能障害を包括的に理解するには、統合的かつ全体的なアプローチが必要です。初期の特性評価研究には、ミトコンドリア含有量の読み出しとしての呼吸鎖タンパク質複合体の発現レベルの調査、ミトコンドリア生合成の尺度としてのミトコンドリアDNAと生合成マーカーの定量化、およびミトコンドリアの形態を評価するための高度な電子顕微鏡イメージングが含まれます9,10。ミトコンドリア機能の追加評価には、細胞のROSおよびATP産生、およびミトコンドリア膜電位の評価が含まれます9。
ミトコンドリアは細胞のエネルギー生産と恒常性維持に不可欠であるため、ミトコンドリアの機能を評価するための特徴は、ミトコンドリアの酸化的リン酸化(OXPHOS)を測定することです。透過性筋線維の高解像度呼吸測定は、ミトコンドリアの酸素消費率のリアルタイムな変化の測定を可能にし、ミトコンドリアのOXPHOS呼吸鎖活動の動的変化を読み取ることができる9,11,12。選択的な化学調節剤と阻害剤の適用により、異なる呼吸器複合体の活性を直接かつ連続的に測定することができます。単離されたミトコンドリアは呼吸器法で使用されることもありますが、新鮮で透過処理された筋線維を使用すると、内因性のミトコンドリアネットワークと膜の完全性が維持されるため、より生理学的に関連性のある測定が可能になります。さらに、筋繊維の種類が異なれば、基質の好みや呼吸速度も異なるため、このシステムでは、食物繊維の種類13に基づいて燃料の好みと代謝の柔軟性の変化を測定できます。
ここでは、高分解能呼吸計システムでヒトまたはマウスの骨格筋線維を使用したミトコンドリアOXPHOS測定の包括的なプロトコルについて説明します。ピルビン酸またはパルミトイルカルニチンを基質として使用して、酸化繊維または解糖繊維のミトコンドリア酸素呼吸を定量する方法が含まれます。このプロトコルは、他の燃料基質を使用して、基質の利用と燃料嗜好の欠陥に関連する特定の代謝問題に対処することを可能にします。
プロトコル
すべてのマウス手順は、ワシントン大学の動物管理および使用委員会によって承認されました。これらの実験には、性別、年齢、体重を問わずマウスを使用することができ、対処しようとする実験問題の性質によって異なります。ここで使用するマウスは成体(12-16週齢)の雄性野生型C57BL/6マウスです。すべての人間の手順は、ワシントン大学の治験審査委員会によって承認されました。データの使用に同意した被験者、およびこのプロトコルに含まれる代表的なヒト被験者データは、公開された研究14 からのものです。ここでのデータは、非糖尿病性閉経後(55〜75歳)の女性からのものです。アッセイに必要な試薬の調製に関する詳細は、 表1に示されている。アッセイに使用された特定の試薬、ツール、およびマシンに関する情報は、 材料表に記載されています。プロトコルの概略図の概要を 図1に示します。
図1:透過処理された骨格筋サンプルの高解像度呼吸測定の概略図。 この原稿で詳述されている方法は、1)呼吸緩衝液と試薬の調製、2)アッセイ当日の器具と試薬の準備、3)筋肉サンプルの調製と透過化、4)サンプルと器具の調製、5)呼吸アッセイの実行、6)データ解析の6つのセクションに分かれています。BioRender.com で作成 この図の拡大版を表示するには、ここをクリックしてください。
1. アッセイ調製と装置のキャリブレーション
- アッセイ当日は、各呼吸化合物(ブレビスタチン、パルミトイルカルニチン、グルタミン酸、リンゴ酸、ADP、コハク酸、シトクロムC、FCCP)の必要な数のアリコートを除去し、氷上で解凍します。BIOPSとMiR05のバイアルを氷上で解凍します。
- 表1に示すように、サポニンとピルビン酸溶液を調製します。表05のようにMiR1の作業溶液を準備します。装置あたり 5 mL の MiR05 の作業溶液を調製します (2 チャンバー)。必要に応じてスケールアップします。
- 高解像度呼吸計システムと真空システムの電源を入れます。ストッパーを取り外し、70%エタノール貯蔵液を真空で取り出し、チャンバーに超高純度分子グレードのH2Oを補充します。合計3回の洗浄を繰り返します。最終洗浄後、各チャンバーに 2 mL の MiR05 (クレアチンまたはブレビスタチンを含まない) を加えます。
- 呼吸器測定ソフトウェアを開きます。ソフトウェアが開始されると、機器設定用のポップアップボックスが開きます。チャンバーの攪拌速度を750 rpm、温度を37 °C、データ記録間隔を2秒に設定します。酸素センサーのゲインを1に、分極電圧を800mVに設定します。「 Oxygraph に接続」 をクリックして、装置との通信を確立します。
- 通信が確立されると、実験ファイルに名前を付けて保存するためのダイアログボックスが開きます。現在の日付とキャリブレーションでファイルを保存します。ファイルを保存すると、実験の詳細を示すポップアップダイアログボックスが表示されます。キャリブレーションの実行には情報は必要なく、ボックスを閉じることができます。
- 酸素濃度を少なくとも30分間記録して、チャンバーをウォームアップし、空気校正の信号を記録することができます。これは、以下のステップ2で詳しく説明するように、筋繊維を準備しながら行うことができます。
- 校正期間の終了時に、酸素濃度が安定している領域(青い線)を横切る校正領域をマークします。これを行うには、 Shift キーと マウスの左 ボタンを押したまま、タイムライン上の領域をドラッグします。
- Oxygraph > O2 Calibrationに移動して、キャリブレーションウィンドウを開きます。[Air Calibration] で、手順 1.8 で生成されたマークを選択します。[キャリブレーションしてクリップボードにコピー] をクリックします。
- 残りのチャンバーについて、手順1.6〜1.8を繰り返します。毎日空気校正を行います。エアキャリブレーションの記録を停止し、保存します file 機器から切断して。サンプルの準備ができたら、ステップ3に進み、アッセイを実施します。
2. 骨格筋線維の採取と透過化
- マウス組織の単離
- 分析するサンプルごとに、12ウェル培養皿の1ウェルに1 mLのBIOPSを満たします。プレートを氷の上に置いて冷やします。
- 二酸化炭素の吸入とそれに続く頸部脱臼によってマウスを安楽死させた後、目的の骨格筋を採取し、すべての結合組織と脂肪を確実に除去します(図2A)。BIOPSを含むウェルの1つに筋肉を置きます。繊維が準備されるまで氷の上に置きます。
注:このプロトコルを使用して、どの骨格筋も検査することができます - 検査される筋肉のタイプは、対処しようとする実験的な問題によって異なります。腓腹筋など、繊維の種類が混在する骨格筋の場合、組織を白と赤の切片に分離して、主に速筋線維(白切片)と主に遅筋線維(赤切片)を測定することができます(図2B)。
- ヒト組織の分離
- 臨床プロトコル14に従って組織を採取します。冷たく滅菌したPBSで組織をすばやくすすぎ、2 mLのBIOPS溶液が入った円錐形のチューブに入れます。繊維が調製されるまで組織を氷上に保ちます。
- 繊維の調製
- 透過化は、6ウェル組織培養プレートで行われます。2 mL の BIOPS 溶液を 1 つのウェルセットに加え、2 mL の MiR05 を別のウェルセットに加えます。アッセイするサンプルごとに1セットのウェルが必要になります。
- トレイに氷を詰め、ガラスのペトリ皿を逆さまにして氷の上に置きます。常に筋肉を氷の上に置いておくようにしてください。
- 採取した筋肉サンプルを鉗子を使用して冷やしたペトリ皿プラットフォームに移します。先端の細い2つの鉗子と光源付きの解剖顕微鏡を使用して、筋肉に付着している腱、筋膜、脂肪組織を取り除き、組織をやさしく洗浄します。
- 無関係な非筋肉組織をすべて取り除いたら、先端の細い鉗子で筋線維をそっと引き離し、長さ0.75〜1.0mmの半透明繊維の小さな束になるまで引き離します(図2C-D)。繊維を分離した後、鉗子を使用して、氷上のBIOPS溶液を含む6ウェルプレート上のウェルに繊維束を移します。
- 各BIOPSウェルに20 μLの5 mg/mLサポニン溶液を加え、プレートを氷上でインキュベートし、冷蔵室で20分間静かに揺さぶります。
- サポニン処理後、アッセイ前に筋繊維を MiR05 を含むウェルに移し、すすぎます。冷たい部屋で15分間静かに揺れながら、氷上でインキュベートします。
- MiR05 での繊維のインキュベーションが完了したら、鋭利な鉗子で繊維を集め、タスクワイプで筋繊維をやさしく拭いて乾かします。1.5 mLのプラスチック製微量遠心チューブをバランスよく風袋引きし、チューブに2〜3 mgの繊維を入れます。各チューブの側面に最終的な繊維重量を記録します。チューブを氷の上に置きます。他のサンプルでも繰り返します。すぐに手順3に進みます。
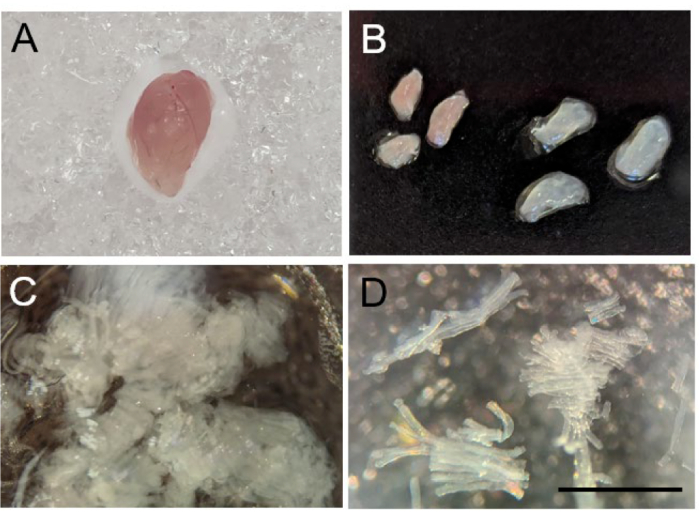
図2:マウス骨格筋線維の分離。 (A)収穫後のマウス腓腹筋の全形態。(B)腓腹筋を赤(左)と白(右)のセグメントに解剖します。(C)機械的に分離された筋繊維。(D)正常に分離された筋線維の10倍画像。スケールバーは1 mmです。 この図の拡大版を表示するには、ここをクリックしてください。
3. 呼吸計での筋肉サンプルの準備
- 上記のステップ 1 で詳述したように、機器のキャリブレーションに使用した MiR05 を真空引きし、各チャンバーに 2.1 mL の作業用 MiR05 溶液を追加します。
- ステップ 1.5 で説明したのと同じ装置設定を使用して、実験用の新しいファイルを開始します。上。ファイル名と保存設定を行います。
- ファイル名を設定した後、次の画面は特定の実験の詳細に関するダイアログボックスになります。サンプル情報と、各チャンバーに追加された各サンプルの重量を入力します。ダイアログボックスを閉じます。
- 新しい実験ファイルに移動したら、O2 Calibrationウィンドウを開いてキャリブレーションを設定します。「 ファイルからコピー 」をクリックし、手順1.9で保存したファイルを選択します。上。[ キャリブレーションしてクリップボードにコピー ]ボタンをクリックします。残りのチャンバーについてもこのプロセスを繰り返します。
- 細い鉗子を使用して、筋繊維の束を慎重に呼吸溶液に移し、適切なチャンバーに移動します。残りのチャンバーについても繰り返します。
- ストッパーをチャンバーに置き、ストッパーを底まで約半分押してチャンバーを慎重に半閉じます。ストッパーのOリングがチャンバー壁にかみ合って抵抗が生じたら、押し下げながらねじる動作で閉じます。チャンバーを半分閉じると、チャンバーの上部に小さな気泡が観察できます。
注:透過処理された繊維は、通常の呼吸器条件下では酸素拡散制限の対象となります。この制限を回避するために、アッセイは高い酸素濃度11の下で行われる。 - 10mLのプラスチックシリンジに酸素タンクからの純酸素を入れます。機器に付属の長くて鈍い針をシリンジに置きます。.針を最初のチャンバーに置き、約1 mLの酸素をゆっくりとチャンバーに供給します。
- 呼吸器測定ソフトウェアでチャンバーの酸素濃度を監視します。チャンバーの酸素濃度が350〜400 nmol / mLに達したら、ストッパーを押し下げながらゆっくりとひねり、チャンバーを完全に閉じます。チャンバーを覗き込み、気泡が残っていないことを確認します。気泡がある場合は、チャンバーを慎重にすばやく再度開き、100 μL の作業用 MiR05 溶液を追加して、チャンバーをすばやく再度閉じます。残りのチャンバーで繰り返します。
- アッセイ中は、酸素濃度を250 nmol / mL以上に維持する必要があります。必要に応じて、チャンバーを部分的に開き、シリンジから気泡に酸素を追加し、チャンバーを再度慎重に閉じて、酸素を追加します。
- 酸素フラックスデータを実験に使用した組織の質量に正規化します。グラフを調整するには、O2 フラックス (pmol O2 / (s x mg)) を反映するようにレイアウトを変更します。レイアウトメニューから、「 06 - Specific Flux per Unit Sample」レイアウトを選択します。データは、各チャンバー内の組織の量に正規化されて表示されます。
4.高解像度呼吸測定
- 酸素添加後、酸素濃度(青線)とO2 フラックス(赤線)が安定したら、呼吸プロトコルを開始します。酸素は、青い線が平坦であるか、ゆっくりと減少している場合に安定していると見なすことができます。O2 フラックスも平坦で、5pmol O2 / s x mg以内である必要があります。
- ガラスシリンジを使用してすべての試薬を添加します。基材、阻害剤、およびアンカプラーに同じシリンジを使用しないことが重要です。それぞれに別々のシリンジを用意してください。各化合物を添加した後、呼吸数が安定してから1〜2分間酸素流束を記録してから、次の試薬を添加します。
- 呼吸測定
- 10 μLのガラスシリンジを使用して、各チャンバーに2.5 μLの0.8 Mリンゴ酸を加えます。 F4 を押してタイムラインをマークし、マークにM.安定したO2 フラックスを1〜2分間記録します。
- 以下に説明するように、栄養素特異的試薬を添加します。
- 好気性解糖系:10 μLのガラス製シリンジを使用して、2 Mグルタミン酸10 μLと2 Mピルビン酸5 μLを各チャンバーに加えます。 F4 を押してタイムラインをマークし、マークにGPのラベルを付けます。 安定したO2 フラックスを1〜2分間記録します。
- 脂肪酸:10 μLのガラス製シリンジを使用して、2 Mグルタミン酸10 μLと10 μLの10 mMパルミトイルカルニチンを各チャンバーに加えます。 F4 キーを押してタイムラインをマークし、マークに G PC のラベルを付けます。安定したO2 フラックスを1〜2分間記録します。
- 25 μLガラスシリンジを使用して、0.5 M(MgCl2を含む)ADPを20 μLを各チャンバーに加えます。 F4 キーを押してタイムラインをマークし、マークに ADP のラベルを付けます。安定したO2 フラックスを1〜2分間記録します。
- 25 μLのガラスシリンジを使用して、各チャンバーに20 μLの1 Mコハク酸を加えます。 F4 を押してタイムラインをマークし、マークにSのラベルを付けます。 安定したO2 フラックスを1〜2分間記録します。
- 10 μLガラスシリンジを使用して、5 μLの4 mMシトクロムCを各チャンバーに加えます。 F4 を押してタイムラインをマークし、マークにCyt Cのラベルを付けます。安定したO2 フラックスを1〜2分間記録します。
- 10 μL ガラスシリンジを使用して、1 mM FCCP の 3 つの 1 μL ボーラスで滴定します。一般に、FCCPを追加すると、O2 フラックスレベルが一時的に減少するミキシング効果があります。O2 フラックスが増加して安定するのを待ってから、次のステップに進みます。追加するたびに F4 を押して、タイムラインとラベルマークをFCCPでマークします。各添加後1分間、安定したO2 フラックスを記録します。
- 呼吸アッセイが完了したら、ストッパーをねじって上に引っ張って優しく取り外します。噴出ボトルから超高純度H2Oでチャンバーを3回すすぎ、続いて噴出ボトルから70%エタノールで3回すすぎます。最終的なエタノールすすぎ後、チャンバーに70%エタノールを充填して保存します。
- 抵抗を感じるまでストッパーをチャンバーにセットします。ストッパーを完全に閉じないでください。ストッパーにキャップをかぶせ、アッセイファイルを保存し、装置を呼吸器測定ソフトウェアから切断します。機器の電源を切ります。
5. データ分析
- 呼吸器測定ソフトウェアで分析ファイルを開きます。呼吸化合物の注入後に得られた安定した酸素フラックス領域からデータを抽出します。
- 関心領域をマークするには、 Shift キーを押しながら マウスの左 ボタンをクリックし、以下に詳述するアッセイステージの安定したO2 フラックスレート領域を横切ってボックスをドラッグします。
- アッセイステージ 14,15,16,17,18,19,20
- リンゴ酸/グルタミン酸/ピルビン酸(好気性解糖プロトコル)またはリンゴ酸/グルタミン酸/パルミトイルカルニチン(脂肪酸プロトコル)の添加後にタイムラインをマークします。このレートは、コンプレックス I 状態 2 の呼吸 (LEAK(n)) レートを表します。
- ADPの追加後にタイムラインをマークします。この率は、複合体 I 状態 3 の呼吸 (CI OXPHOS) 率を表します。
- コハク酸を追加した後、タイムラインをマークします。この速度は、複雑性 I+II 状態 3 呼吸 (CI+II OXPHOS) 速度を表します。
- シトクロムCを追加した後、タイムラインをマークします。この速度は、Complex I+II+Cytochrome State 3 呼吸 (CI+II+Cyt C OXPHOS) 率を表します。
- FCCP滴定のタイムラインを、O2 フラックスレートが最も高いものにマークします。このレートは、最大呼吸数 (MAX ETS) を表します。
- タイムライン上のマークされた領域のデータ値を取得するには 、[>統計をマーク] を選択します。マークされたチャンバーのO2 フラックスレート(pmol O2/(s x mg))をスプレッドシートにコピーします。
- 追加のチャンバーに対してマーキングとデータ抽出を繰り返します。
- コンプレックス I+II 状態 3 (コハク酸追加後) をコンプレックス I 状態 2 (ADP 追加前) で割ることにより、呼吸制御比 (RCR) を計算します。
代表的な結果
図3 および 図4 は、適切に準備されたマウスの赤および白の腓腹筋線維のための好気性解糖および脂肪酸呼吸器測定プロトコルの酸素プロットをそれぞれ示しています。また、参照用の代表的な定量化された結果も示されています。 図5 は、適切に調製されたヒト筋生検サンプルにおける好気性解糖呼吸器の酸素プロットを示しています。代表的な定量化された結果も示されています。 図3、 図4、 および図5では、ADP添加後にシトクロムCを添加しても酸素フラックスに影響を与えず、サンプルのミトコンドリア外膜が損傷していないことを示しています。 図6 は、ADP後にシトクロムCを追加すると酸素フラックスが急上昇(40%増加)し、ミトコンドリア外膜が損傷しているため、サンプルを呼吸測定に使用すべきではないことを示す好気性解糖呼吸器測定の酸素プロットを示しています。 組織の透過化を延長し、新たに分離された組織を使用しない。
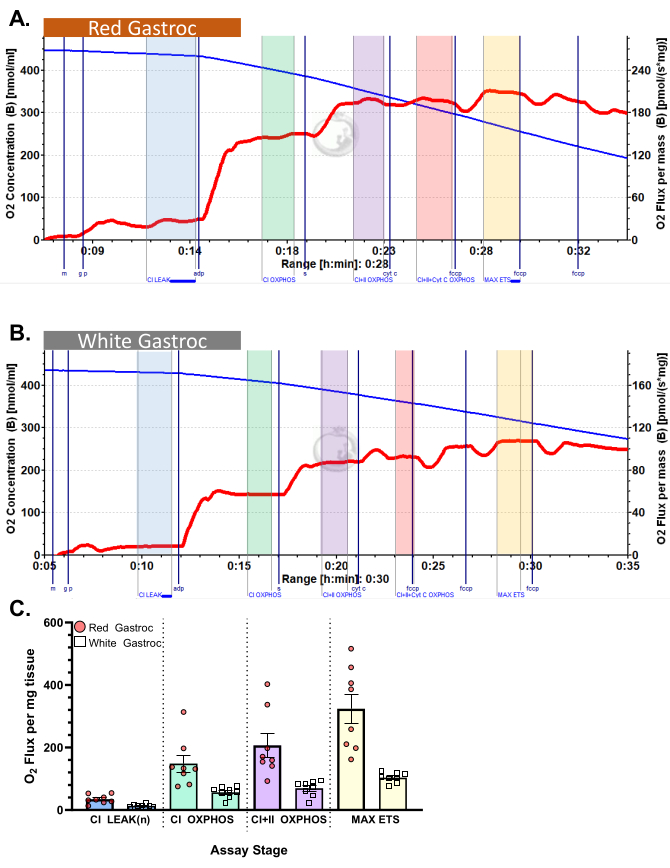
図3:マウスの酸素消費量。 結果は、ピルビン酸プロトコルを使用した(A)赤と(B)白の腓腹筋の酸素消費量を示しています。リンゴ酸、グルタミン酸、およびピルビン酸を添加した後の状態2フラックス(青色の色合い、CI LEAK)。ADP投与後(緑の色合い、CI OXPHOS)にO2 消費の有意な刺激が観察され、コハク酸(紫色の色合い、CI+II OXPHOS)の添加後に呼吸がさらに促進されます。シトクロムCは有意な増加を示さず(<15%)、ミトコンドリア外膜が無傷であることを示しています(オレンジ色、CI+II+Cyt C OXPHOS)。ミトコンドリアは、FCCP(黄色の色合い、MAX ETS)の添加により分離されます。青い線は密閉チャンバー内の酸素濃度を表しています。赤い線は酸素消費量(O2 フラックス)を表しています。添加化合物:リンゴ酸(m)、グルタミン酸(g)、ピルビン酸(p)、アデノシン二リン酸(ADP)、シトクロムC(cyt c)、シアン化カルボニル-p-トリフルオロメトキシフェニルヒドラゾン(FCCP)。 (C) 棒グラフは代表的な結果を反映しています (n=8)。データは SEM ±表されます。 この図の拡大版を表示するには、ここをクリックしてください。
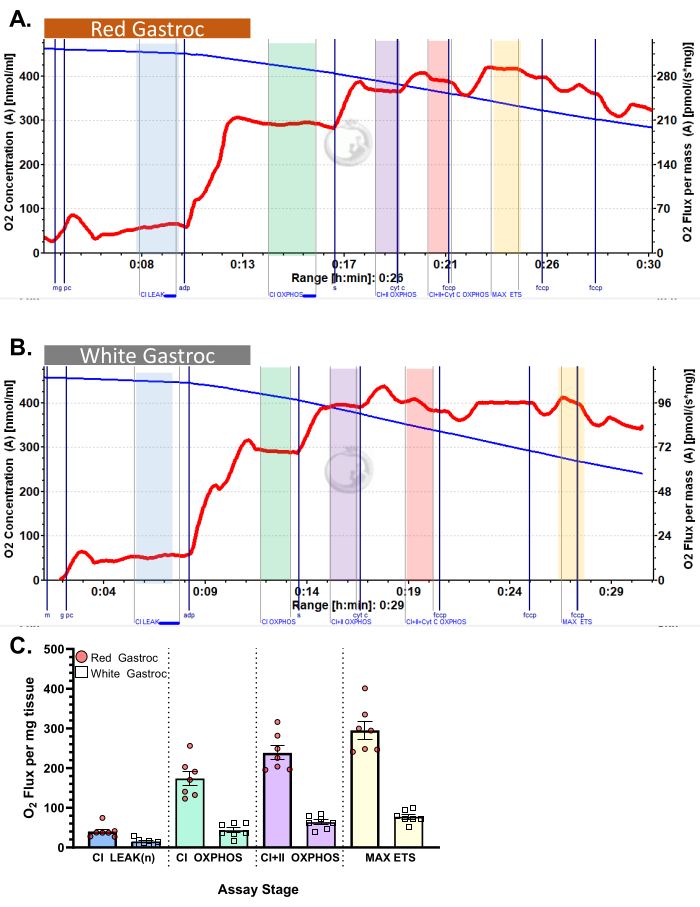
図4:マウスの酸素消費量。 結果は、パルミトイルカルニチンプロトコルを使用した(A)赤と(B)白の腓腹筋の酸素消費量を示しています。リンゴ酸、グルタミン酸、およびパルミトイルカルニチンを添加した後の状態2フラックス(青色の色合い、CI LEAK)。ADP投与後(緑の色合い、CI OXPHOS)にO2 消費の有意な刺激が観察され、コハク酸(紫色の色合い、CI+II OXPHOS)の添加後に呼吸がさらに促進されます。シトクロムCは有意な増加を示さず(<15%)、ミトコンドリア外膜が無傷であることを示しています(オレンジ色、CI+II+Cyt C OXPHOS)。ミトコンドリアは、FCCP(黄色の色合い、MAX ETS)の添加により分離されます。青い線は密閉チャンバー内の酸素濃度を表しています。赤い線は酸素消費量(O2 フラックス)を表しています。添加化合物:リンゴ酸(m)、グルタミン酸(g)、パルミトイルカルニチン(pc)、アデノシン二リン酸(ADP)、シトクロムC(cyt c)、シアン化カルボニル-p-トリフルオロメトキシフェニルヒドラゾン(FCCP)。 (C) 棒グラフは代表的な結果を反映しています(n = 7)。データは SEM ±表されます。 この図の拡大版を表示するには、ここをクリックしてください。
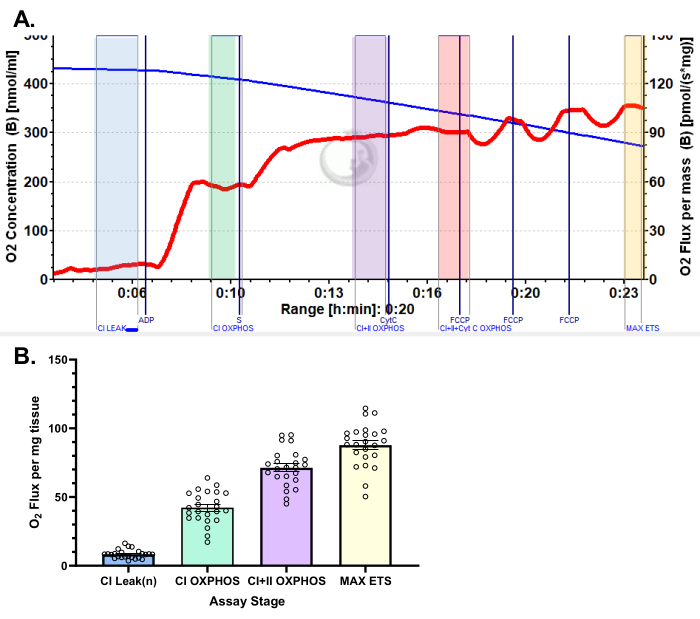
図5:ピルビン酸プロトコルを使用したヒト外側広筋の酸素消費量の代表的な結果(A)リンゴ酸、グルタミン酸、およびピルビン酸を添加した後の状態2フラックス(青の色合い、CIリーク)。ADP投与後(緑の色合い、CI OXPHOS)にO2消費の有意な刺激が観察され、コハク酸(紫色の色合い、CI+II OXPHOS)の添加後に呼吸がさらに促進されます。シトクロムCは有意な増加を示さず(<15%)、ミトコンドリア外膜が無傷であることを示しています(オレンジ色、CI+II+Cyt C OXPHOS)。ミトコンドリアは、FCCP(黄色の色合い、MAX ETS)の添加により分離されます。青い線は密閉チャンバー内の酸素濃度を表しています。赤い線は酸素消費量(O2 フラックス)を表しています。添加化合物:リンゴ酸(m)、グルタミン酸(g)、ピルビン酸(p)、アデノシン二リン酸(ADP)、シトクロムC(cyt c)、シアン化カルボニル-p-トリフルオロメトキシフェニルヒドラゾン(FCCP)。(B)棒グラフは、外側広筋生検(n = 24)から得られた代表的な結果を反映しています。データは SEM ±表されます。この図の拡大版を表示するには、ここをクリックしてください。
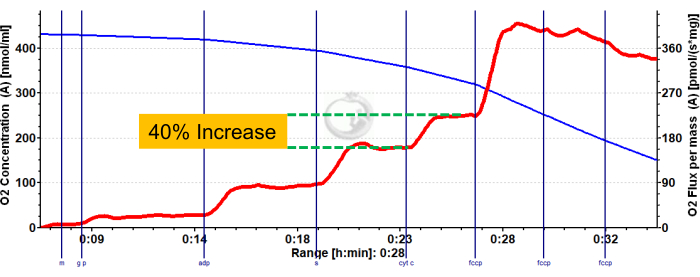
図6:マウスの赤腓腹筋におけるミトコンドリア外膜の完全性の低下を示す代表的な結果。 リンゴ酸、グルタミン酸、およびピルビン酸を添加した後の状態2フラックス(青色の色合い、CI LEAK)。ADP投与後(緑の色合い、CI OXPHOS)にO2 消費の有意な刺激が観察され、コハク酸(紫色の色合い、CI+II OXPHOS)の添加後に呼吸がさらに促進されます。シトクロムCはO2 消費量の有意な増加(>15%)を誘発し、ミトコンドリア外膜の損傷を示しています。青い線は密閉チャンバー内の酸素濃度を表しています。赤い線は酸素消費量(O2 フラックス)を表しています。添加化合物:リンゴ酸(m)、グルタミン酸(g)、ピルビン酸(p)、アデノシン二リン酸(ADP)、シトクロムC(cyt c)、シアン化カルボニル-p-トリフルオロメトキシフェニルヒドラゾン(FCCP)。 この図の拡大版を表示するには、ここをクリックしてください。
表1:呼吸化合物と呼吸溶液の試薬調製。 アッセイに必要な試薬の調製について、最終ストック濃度や調製・保管方法など、詳細に説明します。 この表をダウンロードするには、ここをクリックしてください。
ディスカッション
このプロトコルは、ヒトとマウスの両方のサンプルについて、透過処理された骨格筋線維のミトコンドリア機能を評価するための包括的でわかりやすいテンプレートプロトコルを提供します。単離されたミトコンドリアの代わりに透過処理された繊維を使用することには、いくつかの利点があります。主な利点の1つは、透過性繊維の使用には少量(2〜5 mg)の組織が必要であり、この方法がヒト筋生検サンプルとマウス筋肉の両方に適していることです。単離されたミトコンドリアに対する別の利点は、細胞構造が無傷のままであり、ミトコンドリアと細胞成分との間の構造的および機能的相互作用の保存を確実にすることである12,21,22,23。
当社の好気性解糖プロトコルにおけるピルビン酸、リンゴ酸、およびグルタミン酸の使用は、複合体I 24,25,26,27,28へのNADH供給の包括的で広範な評価を提供します。この包括的なアプローチは、全体的および生理学的に関連する代謝条件下でのコンプレックスI活性の評価を提供しますが、ピルビン酸-リンゴ酸またはグルタミン酸-リンゴ酸の使用がより適切な実験的アプローチである可能性があります。例えば、グルタミン酸-リンゴ酸の使用は、アミノ酸異化作用に関連するミトコンドリア機能の違いを解き明かすかもしれない29。研究者の皆様には、特定の研究モデルに使用する適切なアプローチを慎重に検討することをお勧めします。
このプロトコルは、ミトコンドリアの活性を評価するための基質の使用に焦点を当てていますが、実験目的を達成するためには、特定の阻害剤の使用が必要な場合があります。例えば、ロテノンは複合体I12,21,30を阻害するために、オリゴマイシンは複合体V(ATPシンターゼ)12,21を阻害するために使用し、アンチマイシンAは非ミトコンドリア呼吸の評価のために複合体III12,21を阻害するために使用することができます。上記で提供されたプロトコルは、特定の阻害剤の使用を含むように容易に適合させることができる。重要な点として、阻害剤の使用に関する注意点の1つは、これらの化合物は粘着性があり、装置チャンバーから除去するために広範な洗浄が必要であることです。10% BSAの溶液を60分間使用すれば、残留阻害剤の除去には十分であることがわかりました。
LEAK呼吸とは、ATP合成に依存しない酸素消費率を指します。この速度は、ミトコンドリア内膜を横切ってミトコンドリアマトリックスに戻る陽子の流れを表しています。ATP合成(LEAK)とは無関係に酸素消費量を評価するために、3つの方法が受け入れられています。最初のLEAK(n)は、基質の存在下での酸素消費率を測定するが、アデニル酸塩(ADPまたはATP)31,32,33を添加していない。このLEAK状態は、ミトコンドリア膜の固有の漏れを表しています。2 番目の方法である LEAK(t) は ATP34 の存在下で測定され、3 番目の LEAK(o) は ATP 合成酵素阻害剤であるオリゴマイシン 35,36,37 の存在下で測定されます。このプロトコルでは、この評価にLEAK(n)を使用しますが、実験の目的やモデルによっては、LEAK酸素フラックスを測定するための他の方法が適切な場合があります。
このアッセイでは、MiR05 にクレアチン(3 mg/mL)とブレビスタチン(10 μM)の両方を添加します。ミトコンドリアのADP輸送はクレアチンキナーゼ(CK)によって促進され、クレアチンはCK活性を飽和させるために呼吸溶液に添加される38,39。筋線維は自発的に収縮することができ、ADPによる収縮にも敏感です。収縮の影響を受けずにミトコンドリアの呼吸活動を評価するために、ブレビスタチンが追加されて繊維収縮活性を阻害している38。さらに、ヒトの筋肉に関する研究では、呼吸能力が生検法(マイクロバイオプシー対バーグストロム針)によって影響を受ける可能性があり、この違いは得られた繊維長の違いによるものである可能性があることが示唆されています40,41。繊維が短いと、調製中に損傷を受けやすくなる可能性があり、ブレビスタチンの使用は機能の維持に役立ちます。繊維の緩和が研究目的に適合しない特定の条件がある場合があり、その場合、ブレビスタチンを MiR05 ソリューションから除外できます。
サポニンによる骨格筋線維の透過化により、原形質膜に細孔が生成され、基質と阻害剤が細胞内に自由に侵入できるようになります。サポニンはコレステロールに対して高い親和性を持ち、コレステロールは細胞の原形質膜に豊富に含まれていますが、ミトコンドリアの膜はコレステロールが乏しいです42,43。このプロトコルで繊維調製に使用されるサポニン処理は、ミトコンドリア膜の完全性を維持することが期待されます。ミトコンドリアの損傷は、組織が繊維に機械的に分離することから生じるせん断力によっても発生する可能性があります。組織を繊維束に分離することは、迅速かつ最小限の取り扱いで行うことをお勧めします。ミトコンドリアの損傷の可能性を評価するために、呼吸プロトコルにシトクロムCの滴定を含めました。シトクロムCは、無傷のミトコンドリア外膜12を通過することができないため、シトクロムCの添加後にO2フラックスが増加することは、サンプル調製プロセス中にミトコンドリア外膜への損傷が生じたことを示している。私たちの最近の研究の1つでは、シトクロムCの添加後にO2フラックスが8%15増加したことを発見し、このプロトコルで提案されているサポニンの使用がミトコンドリアの損傷を引き起こさないことを検証しました。我々は、シトクロムCを添加した後にO2フラックスが15%以上増加したことを示すサンプルは、分析から除外すべきであることを提案する44。このステップは、コンプレックスIV活動の評価としてではなく、厳密に品質管理手段として含まれています。
高分解能呼吸測定は、酸素消費量の高感度で信頼性の高い測定を提供する点で優れていますが、装置の顕著な制限は、装置ごとに同時に測定できるサンプルが2つだけであることです。そのため、複数のサンプルを持つコホートを含む研究を設計する際には、慎重な検討が必要です。一日中、さまざまなサンプルセットで測定を行いたいという誘惑に駆られるかもしれませんが、研究者には、概日リズムが代謝に与える影響を考慮することを強くお勧めします。ヒトとげっ歯類の両方の骨格筋に関する研究により、ミトコンドリア機能に対する体内時計の影響が明らかになった45,46。そのため、これらの概日変動を考慮するために、同じ時間帯に数日間にわたって測定を行うことをお勧めします。
最後に、再現性のある堅牢な呼吸測定を確保するために、呼吸計は定期的なクリーニング、メンテナンス、およびキャリブレーションを受ける必要があります。プロトコールに詳述されているように、空気校正は毎日実施する必要があります。また、ポーラログラフ式酸素センサーの月次校正(空気とゼロの両方)も実施することをお勧めします。ユーザーは、この校正方法の詳細と定期的な機器のメンテナンスの手順については、製造元のドキュメントとWebサイトを参照する必要があります。
高解像度呼吸測定は、ミトコンドリア呼吸を測定するためのゴールドスタンダードであり続けています。このプロトコルで詳述されている方法は、げっ歯類とヒトの骨格筋の両方におけるミトコンドリア容量の堅牢な評価を容易にします。このプロトコルは、栄養補助食品投与14,20および運動17,18後の慢性腎臓病19の文脈で、遺伝的マウスモデル15,16に関連するミトコンドリア機能を評価する研究に適用されています。
開示事項
著者は何も開示していません。
謝辞
本書で報告された研究は、Nutrition Obesity Research Center、NIH grant P30 DK056341、NIH grant K01 HL145326の支援を受けたものです。
資料
| Name | Company | Catalog Number | Comments |
| 10 µL Hamilton Syringe (glass syringe) | ThermoFisher | 14-813-125 | For respiration assay titration |
| 25 µL Hamilton Syringe (glass syringe) | ThermoFisher | 14-813-133 | For respiration assay titration |
| ADP | Merck | 117105 | Respirometry Assay |
| Black Glass Dissection Dish | Scintica | DD-90-S-BLK | For sample preparation |
| Blebbistatin | Sigma | B0560 | Working MiR05 Solution |
| BSA, fatty acid free | Sigma | A6003 | MiR05 Solution |
| Calcium Carbonate | Sigma | C4830 | BIOPS Solution |
| Creatine | Sigma | 27900 | Working MiR05 Solution |
| Cytochrome C | Sigma | C7752 | Respirometry Assay |
| DatLab | Oroboros Instruments | N/A | Respirometry Software |
| Dithiothreitol (DTT) | Sigma | D0632 | BIOPS Solution |
| D-Sucrose | Sigma | 84097 | MiR05 Solution |
| EGTA | Sigma | E4378 | BIOPS & MiR05 Solution |
| FCCP | Sigma | C2920 | Respirometry Assay |
| Glutamate | Sigma | G1626 | Respirometry Assay |
| HEPES | Sigma | H7523 | MiR05 Solution |
| Imidazole | Sigma | 56750 | BIOPS Solution |
| KH2PO4 | Sigma | P5379 | MiR05 Solution |
| Lactobionic acid | Sigma | 153516 | MiR05 Solution |
| Malate | Sigma | M1000 | Respirometry Assay |
| MES hydrate | Sigma | M8250 | BIOPS Solution |
| MgCl2 - 6 H2O | Sigma | M2670 | BIOPS & MiR05 Solution |
| Oroboros Oxygraph-2K (O2K) System | Oroboros Instruments | 10203-03 | High resolution respirometer |
| Palmitoyl-Carnitine | Sigma | P4509 | Respirometry Assay |
| Potassium Hydroxide | Sigma | P1767 | BIOPS Solution |
| Precision Tweezers | Fisher | 17-467-168 | For sample preparation |
| Saponin | Sigma | S2149 | For Fiber Permeabilization |
| Sodium ATP | Sigma | A2383 | BIOPS Solution |
| Sodium Phosphocreatine | Sigma | P7936 | BIOPS Solution |
| Sodium Pyruvate | Sigma | P2256 | Respirometry Assay |
| Succinate | Sigma | S2378 | Respirometry Assay |
| Taurine | Sigma | T0625 | BIOPS & MiR05 Solution |
参考文献
- Rizzuto, R., De Stefani, D., Raffaello, A., Mammucari, C. Mitochondria as sensors and regulators of calcium signalling. Nat Rev Mol Cell Biol. 13 (9), 566-578 (2012).
- Ruegsegger, G. N., Creo, A. L., Cortes, T. M., Dasari, S., Nair, K. S. Altered mitochondrial function in insulin-deficient and insulin-resistant states. J Clin Invest. 128 (9), 3671-3681 (2018).
- Simoneau, J. A., Kelley, D. E. Altered glycolytic and oxidative capacities of skeletal muscle contribute to insulin resistance in NIDDM. J Appl Physiol. 83 (1), 166-171 (1997).
- Ryan, T. E., et al. Extensive skeletal muscle cell mitochondriopathy distinguishes critical limb ischemia patients from claudicants. JCI Insight. 3 (21), 123235 (2018).
- Sullivan, M. J., Green, H. J., Cobb, F. R. Skeletal muscle biochemistry and histology in ambulatory patients with long-term heart failure. Circulation. 81 (2), 518-527 (1990).
- Giebelstein, J., et al. The proteomic signature of insulin-resistant human skeletal muscle reveals increased glycolytic and decreased mitochondrial enzymes. Diabetologia. 55 (4), 1114-1127 (2012).
- Tezze, C., et al. Age-associated loss of OPA1 in muscle impacts muscle mass, metabolic homeostasis, systemic inflammation, and epithelial senescence. Cell Metab. 25 (6), 1374-1389 (2017).
- Hughes, M. C., et al. Early myopathy in Duchenne muscular dystrophy is associated with elevated mitochondrial H(2) O(2) emission during impaired oxidative phosphorylation. J Cachexia Sarcopenia Muscle. 10 (2), 643-661 (2019).
- Yin, Y., Shen, H. Common methods in mitochondrial research (Review). Int J Mol Med. 50 (4), 5182 (2022).
- Vue, Z., et al. 3D reconstruction of murine mitochondria reveals changes in structure during aging linked to the MICOS complex. Aging Cell. 22 (12), e14009 (2023).
- Doerrier, C., et al. High-resolution fluoRespirometry and OXPHOS protocols for human cells, permeabilized fibers from small biopsies of muscle, and isolated mitochondria. Methods Mol Biol. 1782, 31-70 (2018).
- Pesta, D., Gnaiger, E. High-resolution respirometry: OXPHOS protocols for human cells and permeabilized fibers from small biopsies of human muscle. Methods Mol Biol. 810, 25-58 (2012).
- Picard, M., Hepple, R. T., Burelle, Y. Mitochondrial functional specialization in glycolytic and oxidative muscle fibers: tailoring the organelle for optimal function. Am J Physiol Cell Physiol. 302 (4), C629-C641 (2012).
- Yoshino, M., et al. Nicotinamide mononucleotide increases muscle insulin sensitivity in prediabetic women. Science. 372 (6547), 1224-1229 (2021).
- Mousa, M. G., et al. Site-1 protease inhibits mitochondrial respiration by controlling the TGF-beta target gene Mss51. Cell Rep. 42 (4), 112336 (2023).
- Moon, S. H., et al. Genetic deletion of skeletal muscle iPLA(2)gamma results in mitochondrial dysfunction, muscle atrophy and alterations in whole-body energy metabolism. iScience. 26 (6), 106895 (2023).
- Bittel, A. J., et al. A single bout of premeal resistance exercise improves postprandial glucose metabolism in obese men with prediabetes. Med Sci Sports Exerc. 53 (4), 694-703 (2021).
- Bittel, A. J., et al. A single bout of resistance exercise improves postprandial lipid metabolism in overweight/obese men with prediabetes. Diabetologia. 63 (3), 611-623 (2020).
- Bittel, D. C., Bittel, A. J., Varadhachary, A. S., Pietka, T., Sinacore, D. R. Deficits in the skeletal muscle transcriptome and mitochondrial coupling in progressive diabetes-induced CKD relate to functional decline. Diabetes. 70 (5), 1130-1144 (2021).
- Mills, K. F., et al. Long-term administration of nicotinamide mononucleotide mitigates age-associated physiological decline in mice. Cell Metab. 24 (6), 795-806 (2016).
- Djafarzadeh, S., Jakob, S. M. High-resolution respirometry to assess mitochondrial function in permeabilized and intact cells. J Vis Exp. (120), e54985 (2017).
- Lemieux, H., Semsroth, S., Antretter, H., Hofer, D., Gnaiger, E. Mitochondrial respiratory control and early defects of oxidative phosphorylation in the failing human heart. Int J Biochem Cell Biol. 43 (12), 1729-1738 (2011).
- Gnaiger, E. Capacity of oxidative phosphorylation in human skeletal muscle: new perspectives of mitochondrial physiology. Int J Biochem Cell Biol. 41 (10), 1837-1845 (2009).
- Appelman, B., et al. Muscle abnormalities worsen after post-exertional malaise in long COVID. Nat Commun. 15 (1), 17 (2024).
- O'Rourke, A. R., et al. Impaired muscle relaxation and mitochondrial fission associated with genetic ablation of cytoplasmic actin isoforms. FEBS J. 285 (3), 481-500 (2018).
- Inigo, M. R., et al. Estrogen receptor-alpha in female skeletal muscle is not required for regulation of muscle insulin sensitivity and mitochondrial regulation. Mol Metab. 34, 1-15 (2020).
- Musci, R. V., et al. Phytochemical compound PB125 attenuates skeletal muscle mitochondrial dysfunction and impaired proteostasis in a model of musculoskeletal decline. J Physiol. 601 (11), 2189-2216 (2023).
- Englund, D. A., et al. p21 induces a senescence program and skeletal muscle dysfunction. Mol Metab. 67, 101652 (2023).
- Zhang, K., et al. Mitochondrial supercomplex assembly regulates metabolic features and glutamine dependency in mammalian cells. Theranostics. 13 (10), 3165-3187 (2023).
- Davis, M. S., Barrett, M. R. High-resolution fluoro-respirometry of equine skeletal muscle. J Vis Exp. (192), e65075 (2023).
- Schytz, C. T., et al. Skeletal muscle mitochondria demonstrate similar respiration per cristae surface area independent of training status and sex in healthy humans. J Physiol. 602 (1), 129-151 (2024).
- Hingst, J. R., et al. Inducible deletion of skeletal muscle AMPKalpha reveals that AMPK is required for nucleotide balance but dispensable for muscle glucose uptake and fat oxidation during exercise. Mol Metab. 40, 101028 (2020).
- Krumschnabel, G., Eigentler, A., Fasching, M., Gnaiger, E. Use of safranin for the assessment of mitochondrial membrane potential by high-resolution respirometry and fluorometry. Methods Enzymol. 542, 163-181 (2014).
- Gnaiger, E., Mendez, G., Hand, S. C. High phosphorylation efficiency and depression of uncoupled respiration in mitochondria under hypoxia. Proc Natl Acad Sci U S A. 97 (20), 11080-11085 (2000).
- Basse, A. L., et al. Nampt controls skeletal muscle development by maintaining Ca(2+) homeostasis and mitochondrial integrity. Mol Metab. 53, 101271 (2021).
- Flensted-Jensen, M., et al. Combined changes in temperature and pH mimicking exercise result in decreased efficiency in muscle mitochondria. J Appl Physiol. 136 (1985), 79-88 (2024).
- Porter, C., et al. Mitochondrial respiratory capacity and coupling control decline with age in human skeletal muscle. Am J Physiol Endocrinol Metab. 309 (3), E224-E232 (2015).
- Perry, C. G., et al. Inhibiting myosin-ATPase reveals a dynamic range of mitochondrial respiratory control in skeletal muscle. Biochem J. 437 (2), 215-222 (2011).
- Veksler, V. I., et al. Muscle creatine kinase-deficient mice. II. Cardiac and skeletal muscles exhibit tissue-specific adaptation of the mitochondrial function. J Biol Chem. 270 (34), 19921-19929 (1995).
- Isner-Horobeti, M. E., et al. Microbiopsies versus Bergstrom needle for skeletal muscle sampling: impact on maximal mitochondrial respiration rate. Eur J Appl Physiol. 114 (5), 885-889 (2014).
- Hughes, M. C., et al. Mitochondrial bioenergetics and fiber type assessments in microbiopsy vs. Bergstrom percutaneous sampling of human skeletal muscle. Front Physiol. 18 (6), 360 (2015).
- Kuznetsov, A. V., et al. Analysis of mitochondrial function in situ in permeabilized muscle fibers, tissues and cells. Nat Protoc. 3 (6), 965-976 (2008).
- Elustondo, P., Martin, L. A., Karten, B. Mitochondrial cholesterol import. Biochim Biophys Acta Mol Cell Biol Lipids. 1862 (1), 90-101 (2017).
- Ramos, P. M., Li, C., Elzo, M. A., Wohlgemuth, S. E., Scheffler, T. L. Mitochondrial oxygen consumption in early postmortem permeabilized skeletal muscle fibers is influenced by cattle breed. J Anim Sci. 98 (3), 044 (2020).
- van Moorsel, D., et al. Demonstration of a day-night rhythm in human skeletal muscle oxidative capacity. Mol Metab. 5 (8), 635-645 (2016).
- de Goede, P., et al. Time-restricted feeding during the inactive phase abolishes the daily rhythm in mitochondrial respiration in rat skeletal muscle. FASEB J. 36 (2), e22133 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
JoVEについて
Copyright © 2023 MyJoVE Corporation. All rights reserved