このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
人工呼吸器マウスにおける過分極 129Xe肺MRIおよび分光法
要約
過分極キセノンMRIは、トランスレーショナルリサーチや臨床ケアにおいて、局所的な肺の微細構造(空域寸法)と生理機能(換気とガス交換)を定量化することができます。困難ではありますが、前臨床試験で同等の肺の洞察を提供することができます。このプロトコルは、マウスで定期的なキセノン肺MRIを実行するために必要なインフラストラクチャと手順を説明しています。
要約
過分極(HP)キセノン-129(129Xe)は、換気、制限された拡散(肺胞-空域サイズ)、ガス交換などの肺生理学を定量化するために利用できる独自のスペクトルおよび物理的特性を持つ吸入磁気共鳴画像法(MRI)造影剤です。ヒトでは、さまざまな肺疾患の重症度と進行を評価するために使用されており、米国と英国で臨床使用が承認されています。 129Xe MRIは、その臨床応用だけでなく、肺の病態生理学を非侵襲的に評価し、空間的に解決された情報を提供する能力も、前臨床研究にとって価値があります。動物モデルの中では、遺伝子改変疾患モデルが利用できるため、マウスが最も広く使用されています。ここで、 129Xe MRIは、肺疾患の進行と治療反応を縦断的に監視するための低侵襲、放射線フリー、高感度の技術として有望です(創薬など)。この技術は、MRIトリガーの自由呼吸装置または人工呼吸器を組み込んでガスを供給することにより、前臨床アプリケーションまで拡張できます。ここでは、品質管理のための熱分極キセノンガスファントムの作成、分極の最適化、動物の取り扱い(鎮静、挿管、換気、マウスのケア)、換気、制限拡散、ガス交換データのプロトコルなど、堅牢なデータ収集と分析を確保するための手順とチェックリストを提供します。前臨床 の129Xe MRIは、さまざまな動物モデル(ラット、ブタ、ヒツジなど)に適用できますが、このプロトコルは、マウスの小さな解剖学的構造によってもたらされる課題のため、手頃な価格と多くの疾患モデルの利用可能性によってバランスが取れているため、マウスに焦点を当てています。
概要
肺疾患は依然として世界的な罹患率と死亡率の主な原因ですが1、過去10年間で患者の転帰は劇的に改善しました。これらの改善は、部分的には2つの要因によって推進されています。まず、第III相臨床試験では、死亡率よりも肺機能の変化をエンドポイントとして優先するようになり、薬物試験が加速しています2,3,4,5。第二に、改良された動物モデルの進歩は、疾患のメカニズムに関する洞察を提供し、治療法の開発を支援しました6,7。マウスモデルは、ヒトと生理学的に類似し、手頃な価格で、疾患が急速に進行するため、トランスレーショナルリサーチに好まれることがよくあります。遺伝子工学により、利用可能なモデルの範囲と品質が拡大し、International Mouse strain Resourceは現在、ラット系統がわずか4,218系統であるのに対し、現在では32,000系統以上のマウス系統8を誇っています(Rat Genome Database9)。これらのモデルは、慢性閉塞性肺疾患(COPD)10、嚢胞性線維症(CF)11、肺線維症12,13、肺高血圧症14,15、喘息16など、さまざまな肺疾患のメカニズムドライバーと治療反応を調査するための新たな道を開きました。
残念ながら、マウスを用いた肺研究は、疾患の負荷を定量化するために利用可能な技術によって制限されています。研究は、1)全肺情報(生化学的アッセイ)または局所情報(組織学)を提供し、2)横断的デザインと大きなサンプルサイズを要求する最終手順に依存することがよくあります。したがって、彼らは空間的または時間的な疾患のダイナミクスを捉えません。対照的に、非侵襲的な3次元イメージングは、肺の構造、分子プロセス、および機能を経時的に評価できます。
肺の構造(気道異常や間質性線維症など)は、超短エコータイム(UTE)MRIとマイクロコンピューター断層撮影(μCT)で高解像度で視覚化できます。機能情報および機構情報(例、換気、灌流、腫瘍代謝、および炎症過程)は、外因性造影剤(例、キセノン増強CTおよび酸素増強UTE)および電離核医学アプローチ(すなわち、陽電子放出断層撮影法[PET]、および単一光子放出型コンピュータ断層撮影法[SPECT])を用いて取得できる。しかし、機能的なイメージングは、コントラスト対雑音比が控えめであるため(特に、前臨床MRIに使用される高い磁場強度で酸素増強UTEの場合、T1が長くなる)、正常レベルよりも高い放射線の電離モダリティを使用しないため、困難です。これらのモダリティによるイメージングは、従来の線量を用いた動物モデルでは忍容性が高いが、累積放射線は免疫学、炎症、および肺がんに関する研究で結果を混乱させる可能性がある17。しかし、過分極(HP)キセノン-129(129Xe)磁気共鳴画像法(MRI)は、低侵襲で、非照射性で、高感度の構造的および機能的情報を提供します。この技術は、肺気腫18,19、線維症20、肺がん21、COPD22、および放射線誘発性肺損傷23などの状態を単一または複数の時点で特徴付けるために前臨床研究で採用されてきましたが、前臨床設定では十分に活用されていません。
ルーチンの前臨床 129Xe MRIを可能にするには、施設の規制サポート、過分極デバイス、129Xeで調整された高周波(RF)コイル、多核対応スキャナーなど、いくつかの前提条件が必要です。高度なアプリケーション24、25、26、27、28、29、30、31、32、33 は、このプロトコルの範囲外のベンダー固有のパルスプログラミングを必要としますが、基本的なアプリケーションは、適度なソフトウェア変更で実現できます。そのため、私たちは、前臨床の129Xe MRIに特有の品質管理、磁化処理、データ収集、および動物処理手順(人工呼吸器を含む)に焦点を当てています(図1)。
現在までに、小動物用129Xe Imagingは、自由呼吸、ピストン駆動、圧力損失という3つのMRセーフガス供給アプローチを採用してきましたが、それぞれに長所と短所があります。自由呼吸は、挿管や気管切開による怪我のリスクなしに自発的な吸入を可能にしますが、大幅に多くのHPガスを消費し、モーションアーティファクト34,35を導入する可能性があります。市販のピストン駆動デバイスは、自己校正機能を備えており、箱から出してすぐに使用できますが、法外に高価になる場合があります36。ここで使用されている圧力損失ベースのアプローチは、文献に詳しく説明されており、モジュール式でカスタマイズ可能で、オープンソースコード37、38、39、40によって実行されます。さらに、費用対効果が高く、通常、合計で$10k未満で、数週間の専用ビルド時間で済みます。圧力降下型人工呼吸器は、挿管されたマウスの気道圧を監視しながら、加圧キャニスター内のドーズバッグから129Xeを供給します。
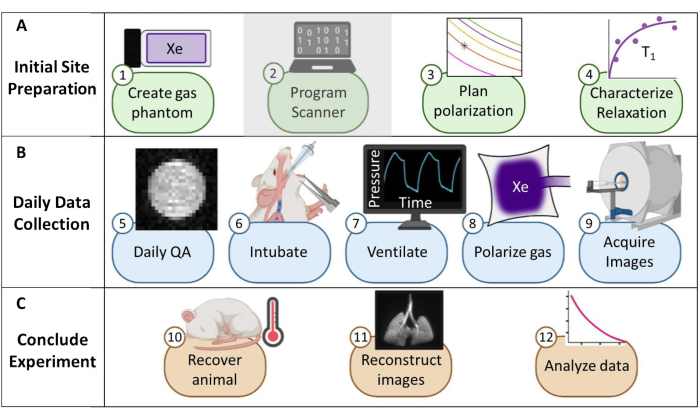
図1:マウスの日常的なキセノン-129(129Xe)磁気共鳴画像法(MRI)を収集するためのプロトコルの概要(A)初期設定の手順。(注: スキャナーのプログラミングは各ベンダーに固有であり、このプロトコルでは説明されていません)。(B)日々の品質保証(QA)および動物データを収集するための手順。(C)実験の結論とデータ解析を成功させるためのステップ。この図の拡大版を表示するには、ここをクリックしてください。
ここでは、129Xe MRIデータの3つの一般的なクラス、換気、拡散強調イメージング(肺胞空域サイズ)、およびガス交換を収集して分析します。換気画像は、吸入された129Xeガスの分布を示しています。HPのガス画像では、空気の流れが減少した肺の領域が暗く見え、病理は換気不良の量によって定量化されます。ヒトでは、換気欠陥率(VDP)は、COPD43,44,45や喘息46,47などの疾患における肺閉塞に対する高い再現性41,42と高い感受性を示しています。
空域内の129個のXe原子の制限拡散は、見かけ拡散係数(ADC)を介して測定でき、空域サイズの代用として機能します。ADCは、拡散重み付けなしのベースライン画像(b0)と、バイポーラ勾配誘起拡散重み付けの存在下で取得された1つ以上の画像(bN)を取得することによって計算されます。ADCの上昇は、老朽化または気腫性改造による空域サイズの増加を反映しています18,48。さらに、複数のb値画像(≥4)を使用すると、より詳細な形態計測情報(例えば、平均線形切片)を計算することができる49,50。
ガス交換は、1)毛細血管膜組織、血漿、および赤血球(赤血球)における129Xeの溶解度、および2)これらのコンパートメントに溶解したときの129Xeの>200 ppmのダウンフィールド化学シフトにより特徴付けることができます。分光データと画像データの両方から、心肺疾患(肺高血圧症や左心不全など)に関する洞察が得られます51,52,53。多くの種(ヒト、イヌ、ラット)は各コンパートメントに由来する独自のスペクトルピークを示しますが、マウスはヘモグロビン-キセノン結合部位の相互作用の違いにより、独自のRBCシグナルを欠いています。代わりに、すべての溶解成分がマウス54の単一のシグナルに結合される。しかし、鎌状赤血球症54のモデルで使用されるような、ヒトヘモグロビンを発現するトランスジェニックマウスにおいて、明確なRBC共鳴を観察することが可能である。全体として、溶解した129Xe分光法とイメージングは、マウス55,56の心肺病態生理学に関する独自の洞察を提供します。
このプロトコルを試す前に、マウス研究に必要なMRIスキャナー、人工呼吸器、およびマウスの取り扱い技術に関する背景情報を理解する必要があります。動物実験を開始する前に、すべての手続きは、地元の動物施設管理および使用委員会(IACUC)によって承認されなければならない57。マウスの肺で利用可能な全磁気モーメントは本質的に低い(つまり、潮汐量~250μL)ため、解剖学的に同等の分解能を達成するためには、ボクセルサイズをヒトよりも1000倍小さくする必要があります。マウスの呼吸数も非常に速い(>100呼吸/分)。そのため、人間の画像診断に一般的に使用される一息止めの手順は実行可能ではありません。代わりに、各ブレス内で適用できる RF 励起は数個しかないため、 129個の Xe 画像を数十から数百のブレスでエンコードする必要があります。パルスプログラミングは、集録の外部トリガを可能にし、S/N比(SNR)、分解能、スキャン時間のバランスを取りながら、スライス、位相エンコード、および/または拡散強調画像を適切にループするために必要になる場合があります。ここでは、人工呼吸器は呼吸ごとに1回トランジスタトランジスタロジック(TTL)パルスを出力して、データ収集をトリガーします(図2)。
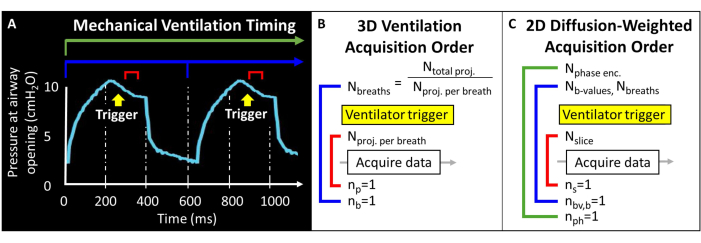
図2:代表的な機械換気とデータ取得のタイミング。(A)ユーザー制御の換気は、エンドインスピレーション時、息止め中、または呼気終了時にデータ収集をトリガーできます。(B)この3D橈骨換気シーケンスでは、ユーザーは、取得された投影の総数と呼吸あたりの投影の数を定義します。(C)スライス選択的な2D拡散強調画像の場合、ユーザーはスライスの順序、b値画像、および位相エンコードを定義します。 この図の拡大版を表示するには、ここをクリックしてください。
信頼性の高い換気と129Xeの送達を可能にするには、しっかりとした鎮静と挿管の手順が必要です。各研究について、各麻酔薬の下流への影響を考慮する必要があります-分時換気、心拍数(HR)、および血圧58,59,60,61,62,63,64,65,66の変化を含む。前臨床のHPガスMRIにはさまざまな鎮静剤が使用されてきましたが、その入手可能性、費用対効果、信頼性、および持続時間67,68のために、ケタミン、キシラジン、およびアセプロマジンの混合物を使用しています。鎮静剤を投与された動物は、効果的な人工呼吸器のために挿管する必要があります。マウスの挿管は、解剖学的構造が小さいため難しいため、この技術を徹底的に訓練することが重要です。研究者には、公開されたビデオプロトコル69,70を確認することをお勧めします。ほとんどの市販の挿管カニューレにはステンレス鋼が含まれているため、気道の直径に合わせてカスタマイズしてマウスの気管壁と気密シールを作成できる、金属フリー(つまり、MRIおよびHPガス互換)のくさび形カニューレを作成する技術を紹介します。
129個の Xe 画像は多くの呼吸で収集されるため、人工呼吸器の設定は非常に重要です。肺の損傷を防ぐために、保護換気戦略を慎重に検討する必要があります71,72,73,74。特に、低潮汐量 (TV)、中程度の呼気終末陽圧 (PEEP)、および肺胞動員法 (RM) の使用は、ヒト患者および動物モデル75,76,77,78,79,80,81における人工呼吸器誘発性肺損傷のリスクを低下させる。ここでは、圧力損失型の 129Xe 機械換気と互換性があり、保護機能があり、十分な 129Xe イメージ SNR を提供する簡単な手法をお勧めします。具体的には、人工呼吸器の呼気ラインに市販のPEEPバルブを追加することでPEEPを適用します。RMを実行するには、呼気ラインを閉じて、目標の圧力と持続時間に達するまで動物が呼気なしで複数回吸入できるようにする必要があります。
全体を通して、一般的な換気設定を提供していますが、特定の研究目標82,83に対処するために文献を確認することをお勧めします。人工呼吸器中のピーク吸気圧のモニタリングに加えて、動物の体温のモニタリングも重要であり、これは標準的なマウスの温度モニタリング方法を用いて行うことができます。イメージングには必要ありませんが、心電図(ECG)による心拍数のモニタリングは有利です。心電図は、動物が鎮静から目覚めているか、過剰摂取しているか、または苦痛を感じているかを示すことができ、研究者が介入することができます。
我々が説明するプロトコルは、 129Xe 3Dラジアル換気データ61、2D GRE拡散強調データ76、および動的パルス取得分光法ガス交換データを収集するように設計されている。このプロトコルは、小動物モデルでの前臨床研究と 129Xe MRIの可能性との間のギャップを埋め、肺疾患の理解を深めることを目的としています。
プロトコル
ここに記載されているすべての方法は、シンシナティ小児病院医療センターの動物施設管理および使用委員会(IACUC)によって承認されています。
1. 用地の初期準備
- 熱偏波 129Xeガスファントムを作成してテストします(図3)。
- ホウケイ酸ガラス容器(~60 mL)、フロントシーリングOリング付きプランジャーバルブ、および粉砕ホウケイ酸ガラスステム(すべて定格150 psig)を入手します。磁性部品がないことを確認してください。ガラスステムに圧縮フィッティングを取り付けます。締めると、気密シールになります。
- 図3Aに従って、容器を真空ポンプと酸素リザーバーに接続します。真空容器を100mTorrの絶対圧未満にします。
- 容器を 1.5 気圧の圧力で酸素で満たし、 129Xe T1 を > 30 分から ~2 秒 (7 T 磁場強度;9.4 Tスキャナーの場合は、1.6 atm酸素を使用してください)。シール容器。
注:電界強度を高くするには、T1≤ 2 s84を達成するために、やや高い酸素分圧が必要になります。 - ガス不透過性のリザーバーに400 mLの同位体濃縮キセノン(85% 129Xe)を満たします。
注:天然存在量のキセノン(26% 129Xe)も使用できますが、SNRの~3倍の低下を緩和するには、シグナルのタベレージングを増やす必要があります。 - 容器を 129Xeのリザーバーに接続します。真空チューブを100mTorrの絶対圧未満に。
- 口を開けたベンチトップ液体N2 Dewarを~90%まで充填します。容器の底(~5cm)を液体窒素に浸してO2 を凝縮させ、真空にします(図3B)。水中でバルブを開き、リザーバーからの 129Xeが容器に流れ込むようにします(図3C)。
- プランジャーの流入穴がOリングを越えて引っ張られるまで、ステムをゆっくりと引っ張って、プランジャーバルブをシールします。穴がOリングを通過した直後に、手で締めて容器を密封します。容器を液体窒素から取り出し、解凍します。
注:解凍後、容器は~4.5気圧(2気圧O2 + 2.5気圧 129Xe)まで加圧されます。 - ガラス器具を保護します(例:パッド入りポリ塩化ビニル(PVC)パイプ容器に容器を挿入します、 図3D)。
注意: 適切にメンテナンスされていれば、ファントムは10年以上圧力を維持できます。 - ファントムのT1 を測定します(たとえば、分光反転回復シーケンスを使用)。7 T スキャナーの場合は T1 < 2 s を確認します。品質保証(QA)のために、信号とT1 を経時的に追跡します。
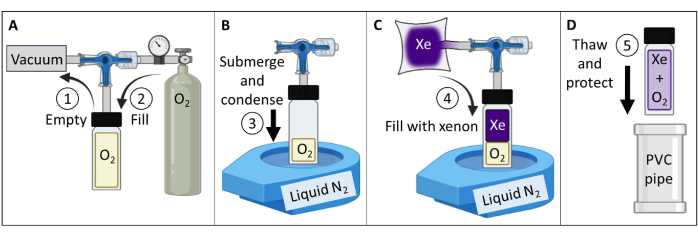
図3:ステップ1.1で詳述したプロトコルに導かれた熱偏光 129Xeガスファントムの作成。 O2 および 129Xe分圧は、T1 をカスタマイズして、適切な 129Xe T1 倍および所与の電界強度84における信号強度を得るために変更することができる。 この図の拡大版を表示するには、ここをクリックしてください。
- 熱偏極ガスファントムで品質保証を行います(表1、図4)。
- 129Xeコイルを磁石のアイソセンタに配置し、129Xeガスファントムをコイルの中央に配置します。1 回のパルス アンド アクイジット シーケンス (「シングル パルス」) で、動作周波数をファントムの約 129Xe ガス周波数 (7T で ~83.07 MHz) と一致するように設定します。
- 取得周波数と励起周波数を 129Xe Larmor周波数の中央に置き、この周波数をすべてのファントムキャリブレーションと品質管理 129Xeスキャンに使用します。すべてのQAスキャンの実験パラメータについては、 表1 を参照してください。ファントムがファントムローカライザーで中央に配置されていることを確認します(図4A)。
- 回転角度を較正するための章動実験の実施:SNRが十分であると仮定して、繰り返し時間(TR)間隔が5 x T1>単一のRFパルスを使用します。集録ごとに、信号がゼロになって反転し始めるまで、RF電力を段階的に増やします。ここで使用される標準は、パルス数 = 65 です。TR = 10秒;パルス持続時間 = 125 μs;RF電力 = 1-13.8 W、0.2 Wずつ増加
- フーリエ変換と位相は、最初のスペクトル(つまり、最小のRF電力で取得したスペクトル)です。すべてのスペクトルに同じ位相を適用します。実際のスペクトルをRFパルス電力の関数としてプロットします(図4B)。
- ヌルピークを生成するパワー(つまり、最小ピーク高さ)は、180°のフリップ角度に対応します。180°のフリップ角度を生成するのに必要なパルス長の半分で同じ電力を使用して、90°のフリップ角度を達成します。スキャナーソフトウェアで許可されていると仮定して、この90°の基準電力とパルス長を後続のフリップ角度スケーリング用に設定します。
- 129Xeスペクトルの半値(TR ~ 1 s)で全幅を最小化することにより、単一のパルスを使用してシムします。必要に応じて、シム後に周波数を中央に戻します。全角半値を記録します。
- 129Xe QAスキャンを実行します(表1および図4C)。QAデータ(SNR、平均ファントム信号、ノイズの標準偏差)を記録します。
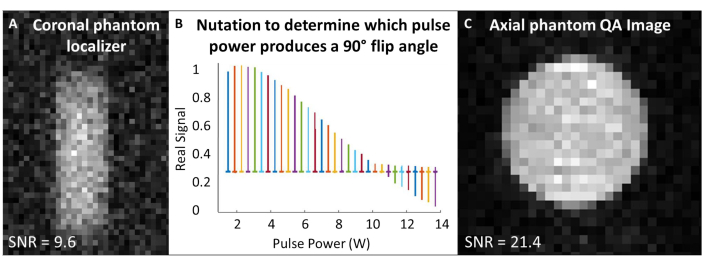
図4:スキャン前の品質保証 (A) 低解像度の2D GREコロナルファントムローカライザは、ファントムが磁石の中心にあることを確認します。(B)90°パルスを設定する章動実験では、180°パルスにヌルピークが示されています。(C)フリップ角度をローカライズしてキャリブレーションした後、より高解像度の2D GRE QA画像を取得します。 この図の拡大版を表示するには、ここをクリックしてください。
| プロトコルの短縮名 | シーケンスの説明 | TR (ミリ秒) | TE (ミリ秒) | 平均/繰り返し | フリップ角度 (°) | マトリックスサイズまたはNpts | 視野角 (mm2) | RF帯域幅(kHz) | スライス/スラブの厚さ(mm) | スキャン時間 |
| シングルパルス | パルス集録 | 1000 | 1 / 1 | 60 | 2048 | 10 | 1秒 | |||
| ファントムローカライザー | 2D GRE | 200 | 3.7 | 20 / 1 | 48 | 60×32 | 120×48 | 3 | 60 | 2分間 |
| フリップ角度キャリブレーション | パルス集録 | 7000 | 1 / 65 | 20 | 2048 | 5.12 | 7.5 min(英語) | |||
| 129名Xe QAの | 2D GRE | 5000 | 3.3 | 8 / 1 | 90 | 322 | 322 | 3 | 40 | 21分 |
表1:ファントムキャリブレーション品質保証シーケンスパラメータ。 TR = 繰り返し時間、TE = エコー時間、Npts = ポイント数、FOV = 視野、BW = 帯域幅。 この表をダウンロードするには、ここをクリックしてください。
- 偏光を計画します(図5A、B)。
- 偏光 129Xe の容量と蓄積時間を選択:このプロトコルには 15 分で 400 mL が最適です(図 5)が、他のアプリケーションや機器に合わせて簡単に調整できます。
- 過偏光子内の既知のデッドボリューム(例:Vデッドボリューム= 80 mL)を仮定して、必要な分注量V、129Xeガス分画f、および蓄積時間taccの流量(SLMのFXe)を計算します。
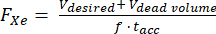 (1)
(1)
注:通常、作製時間が長いほど偏光が高くなりますが、 in vivo イメージングには実用的でない場合があります。過偏光子85、86、87、88 の適切なモデルを使用して、生産時間と偏光のバランスをとる流量を決定します。ここでは、J. W. Plummer et al.89 (図 5A) のモデルを使用しました。これは、連続フロー偏光子に適用され、ストップフロー超偏光子90には適用されません。 - これらのパラメータに従ってガスを分極し、商用または自作のデバイスで分極を測定し、QAの予測分極と比較します。
- 輸送中の偏光損失を測定します。偏光が十分に大きく減少する場合(例:>10%)、輸送中の偏光を保護するために磁気キャリングケースを構築します。 補足ファイル1:輸送中の偏波の管理および 補足図1を参照してください。
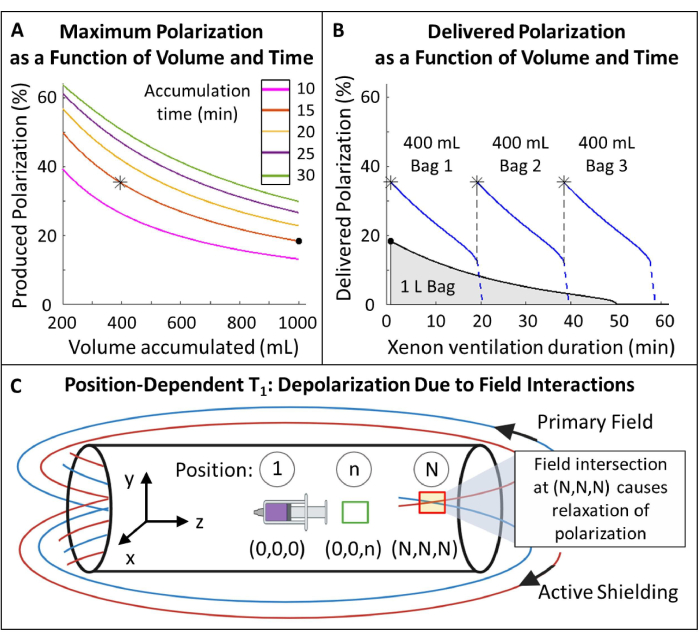
図5:分極管理(A)分極と生産量は、蓄積時間と流量の関数です。400 mL のガス袋は、20 分間で高い初期分極率 (~35%) を提供します。1 L のガスを使用することは魅力的に思えるかもしれませんが、初期分極は低くなります (~20%)。(B)~15分間の換気後、HP 129Xeの1リットルバッチは<10%の分極まで減少するが、600mLのガスは116のままである。したがって、129Xe の 400 mL バッグを複数使用すると、送達分極の平均が高くなります。C) プライマリフィールドとアクティブシールドフィールドが交差する場所(位置(N、N、N)の赤いボックス)は、HP 129Xeの急速な緩和を引き起こす可能性があります。磁石のフリンジ磁場の特性評価は、HP 129Xeのリザーバーを急激な緩和なしに配置できる安全ゾーンを特定するのに役立ちます(位置(0,0,n)の緑色のボックス)。この図の拡大版を表示するには、ここをクリックしてください。
補足ファイル1:輸送中の偏波の管理。このファイルをダウンロードするには、ここをクリックしてください。
- HP 129Xeの位置依存性T1をフリンジフィールド内で測定します(図5C)。
- X、Y、Z 寸法に沿って、磁石の等心を基準とした既知の距離と位置を持つ参照点を作成します。等角線にラベルを付け、他の位置に n から N にラベルを付けます。調査するポジションの数は、使用可能なスペースによって異なります。
- 少量の 129Xe (~250 mL) を過分極し、MRI 制御室に運びます。大型のシリンジ(50-100 mL)に129Xeを充填し、磁石内のアイソセンタ(図5Cの位置1)に置きます。~1°のフリップ角度パルスを再生して、信号を測定します。
- シリンジを所定の位置に ~10 分間置いてから、別のスペクトルを取得します。信号が少なくとも1 T1 減衰するまで(つまり、信号が初期値の~1/3に減衰するまで)、10分ごとに信号を再測定します。
- ステップ 1.4.2 を繰り返して、新しい 129Xe シリンジで新しい T1 実験を開始します。
- シリンジを新しい位置( 例:図5Cの位置n)に移動し、10分間そのままにしておきます。シリンジをアイソセンタに戻し、さらに~1°のフリップ角度スペクトルを取得します。
- このプロセスを繰り返します:シリンジを位置nに移動し、10分間待ってからアイソセンターに戻し、信号が少なくとも1 T1減衰するまで信号を再測定します。
- X、Y、Z方向をカバーする残りの参照位置について、手順1.4.4〜1.4.6を繰り返します。
- 初期信号(S0)は、θフリップ角度でn個のRFパルスにわたって単指数関数的に減衰します。信号 (S) を時間 (t) の関数としてフリンジ場に当てはめ、各位置の T1 を計算します。
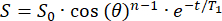 (2)
(2) - 129Xe リザーバーの配置に十分な T1 (>20 分) の位置を特定します。
- メタルフリーの挿管カニューレを作成します(図6)。
- ルアーコネクタ付きの静脈留置ポリテトラフルオロエチレン(PTFE)カテーテルを2本入手します。針は鋭利物処理容器に捨ててください。
注:25 g>マウスの場合は、18 Gおよび20 Gのカテーテルを使用してください。小動物には、20Gと22Gのカテーテルを使用してください。 - ルアーコネクタをカテーテルから切断します。小さい方のカテーテルを大きい方のカテーテルの上端に送り込み、より鋭く先細りで長いカニューレを作成します。複合カニューレを、ルアーベースを含まない斜めの端で~4.6cmにカットします(図6A、B)。
- 200 μL ピペットチップの幅の広い方の端を ~2.6 cm の長さに切り取ります (図 6C)。
- ピペットチップの内側を一般的な離型剤でコーティングします。内部に挿入された別のピペットチップを使用して、潤滑剤を薄く分散させます。ピペットチップにアセトキシシリコーン加硫ペーストエポキシを充填します(図6D、E)。
- 両端から伸びる22Gワイヤーでカニューレを差し込みます。カニューレチューブをピペットチップのシリコンに通します。チューブをピペットチップの端から~7mm伸ばします(図6F、G)。
- ピペットチップの幅の広い側のカニューレチューブをプラスチック製のオススリップルアーコネクタに通し、ピースをエポキシで接着します。ルアーコネクタを越えて伸びるチューブをトリムします(図6H)。
- エポキシが乾くのを待って(>24時間)、シリコン挿管カニューレをピペットチップ型から慎重に取り外します。カニューレからワイヤーを取り外し、チューブが閉塞していないことを確認します(図6I)。
- 挿管を容易にするハンドルを作成するには、チューブ(1/16インチまたは1/8インチ)をメスのルアーコネクタに接続します。挿管の準備ができたら、このメス型ルアーコネクタをオス型ルアー挿管カニューレに接続します。この部品は、挿管後に簡単に取り外すことができます(図6J)。
- 動物に使用する前に毎回消毒してください:カニューレの外側を70%アルコールで拭いてください。20 Gワイヤーを消毒剤で拭き、カニューレにワイヤーを通して内部を消毒し、詰まりがないことを確認します。
- ルアーコネクタ付きの静脈留置ポリテトラフルオロエチレン(PTFE)カテーテルを2本入手します。針は鋭利物処理容器に捨ててください。
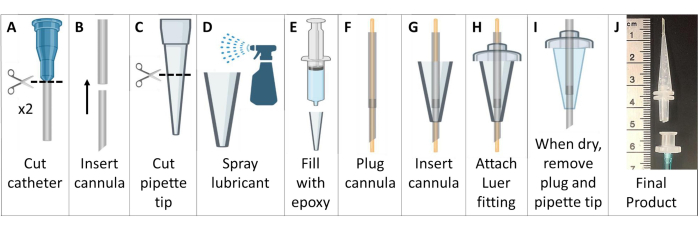
図6:MRIおよびHP 129Xe互換のマウス挿管カニューレの作成。 これらのカニューレは、ステップ1.5で説明したように、静脈カテーテル、ピペットチップ、およびシリコンシーラントで構成されています。 この図の拡大版を表示するには、ここをクリックしてください。
2. 日々のデータ収集
注: 補足ファイル2:前臨床スキャンQAチェックリストを参照してください。
補足ファイル2:前臨床スキャンQAチェックリスト。このファイルをダウンロードするには、ここをクリックしてください。
- 毎日のスキャナーの品質管理と人工呼吸器のセットアップを完了します(図4)。
- ファントムを使用して、スキャナーでQAプロトコルを実行します(QAスキャンパラメータについては 表1 を、日常の品質管理手順についてはステップ1.2を参照してください)。
- J. Nouls et al.38の方法に従って人工呼吸器を校正します。 補足ファイル3:人工呼吸器のキャリブレーション、 補足図2、 および 補足図3を参照してください。
- エンド吸気時のイメージングの人工呼吸器を設定します(表2)。動物用ベッドをスキャナーラックに置き、生命維持モジュール(つまり、機械的な人工呼吸器部品)をスキャナーの隣のテーブルに置きます。
- サイトスペシフィックな動物暖房システムをアクティブにします。ヒーターを35.5〜40°Cに設定し、循環空気をオンにし、動物の頭が休む場所から~5インチ以内にエアホースを配置して、スキャナーの穴を事前に温めます。
| 換気設定 | HP 129Xe MRIの推奨事項 | 筆記 |
| 潮汐量(TV) | 8〜10 mL/kgの理想的な体重 | モデレートテレビ;テレビが低いと、より高いBRが必要になり、画像にモーションアーチファクトが発生する可能性があります |
| 呼気終末陽圧法(PEEP) | 2–6 cmH2O | |
| 呼吸数(BR) | 80〜120 br/min | |
| リクルートマニューバー(RM) | ~35 cmH2Ω 6 秒、5 分間隔 | |
| 換気時間;立場 | <6時間;仰臥 位 | 胸の動きをよりよく見るための仰臥位 |
| 吸気酸素の割合(FIO2) | 0.3–0.5 | 麻酔マウスの低酸素症を予防する |
| 吸気と呼気の比率(I:E) | 1:2–1:4 | |
| 総サイクル持続時間への吸気 | 0.2–0.4 | |
| 分単位の換気 | ≥0.57 mL・g-1・min-1 | |
| 私たちの基準: | ||
| BR = 80 br/min、吸気持続時間 = 200 ms、FIO2 = 0.3 | ||
| エンドスピレーションでのイメージング: 息止め= 200ミリ秒、トリガー遅延= インスピレーション開始後200ミリ秒 | ||
| 息止め中のイメージング: 息止め= 250ミリ秒、トリガー遅延= 吸気開始後250ミリ秒 | ||
| 呼気終了時のイメージング: 息止め= 200ミリ秒、トリガー遅延= 吸気開始後650ミリ秒 | ||
表2:129Xeイメージングの推奨人工呼吸器設定。パラメータは、特定の研究目的および実験条件に合わせて微調整することができる 117,118,119,120,121,122,123,124。この表をダウンロードするには、ここをクリックしてください。
補足ファイル3:人工呼吸器のキャリブレーション。このファイルをダウンロードするには、ここをクリックしてください。
- 動物を落ち着かせて挿管します。
- インキュベーターを27.7°Cに、および/または電気加熱パッドを37.7°Cにオンにします。 動物の体重を測定して記録します。質量に基づいて鎮静剤の投与量を計算します。.典型的な投与計画については、 表3 を参照してください。.
- 鎮静剤を腹腔内に注射します。.注射の時間に注意し、鎮静剤の次の投与のタイマーを設定します。.
注:セクション2(毎日のデータ収集)の残りの手順をできるだけ早く完了して、鎮静中の時間と過剰摂取のリスクを最小限に抑えます。. - 動物の目に目の潤滑剤を塗布し、低体温症を防ぐために動物を加熱パッドのケージまたはインキュベーター内に置きます。
- 鎮静剤注射68の10〜15分後につま先つま先つまみテストを行うことにより、動物が完全に鎮静されていることを確認する。Das et al.69に概説されている手順に従って挿管します。.
注:Das et al.69 による論文には、この手法の包括的なビデオデモンストレーションが添付されています。手順は次のとおりです。 - 動物を仰向けで、傾斜したボードの歯で吊るします。げっ歯類の舌圧子を使用して舌を引き出します。
- 声帯が見えるようにするには、挿管カニューレ内の光ファイバーケーブルまたは喉の外側に配置された明るい光を介して白色光を供給します。カニューレを声帯から5mm未満に挿入します。
- カニューレが食道ではなく気管にあることを確認し、カニューレを小さな水滴が入ったチューブに接続します。水滴が動物の呼吸に合わせて移動する場合、位置は正しい可能性があります。
| エージェント | 用量 | ルート | 期間 | コメント | |||
| 吸入剤 | |||||||
| イソフルラン | 誘導:4%–5% メンテナンス:1%– 3%または効果 | 吸入 | 連続フロー中 | •校正済みの気化器の使用が必要です | |||
| 注射剤 | |||||||
| 推奨:ケタミン+キシラジン+アセプロマジン | 90 + 9 + 3 mg / kg | 腹腔内 | 20-60分 | •低体温症に対する感受性を作成します | |||
| •繰り返し投与する場合は、過剰摂取を防ぐためにケタミン+キシラジン混合物に切り替えることをお勧めします | |||||||
| •摩耗すると揺れを引き起こします。イメージングについては、投与スケジュールを厳守してください | |||||||
| •徐脈を引き起こす可能性があります | |||||||
| ケタミン+キシラジン | 90 + 9 mg / kg | 腹腔内 | 20〜40分 | •上記参照(ケタミン+キシラジン+アセプロマジン) | |||
| ペントバルビタール | 50 - 70 mg/kg | 腹腔内 | 20-60分 | •呼吸数と運動を抑制します | |||
| •費用が法外な費用になる場合があります | |||||||
| •医薬品グレードは利用できない場合があります | |||||||
| 免責事項:これらは一般的なガイドラインです。実装する前に、獣医師に相談してください。 | |||||||
表3:マウスの一般的な麻酔薬処方。この表をダウンロードするには、ここをクリックしてください。
- 動物を換気します(表2)。
- 挿管カニューレのルアーコネクタを介して動物を人工呼吸器に取り付けます。横隔膜の動きとピーク吸気圧(一回換気量10mL/kgの体重に対して~10-12cmH2O)を監視します。圧力や呼吸の動きが異常な場合は、必要に応じてカニューレの首の角度と深さを慎重に調整してください。
- リクルート操作を実行して、挿管カニューレが気密であることを確認します:動物が息を吐かずに複数回吸い込むように、呼気を防ぎます(たとえば、指で呼気ポートを塞ぎます)。
注:気道内圧が~6秒以上で35cmH2Oピーク吸気圧に達すると、気道シールは十分に締まります。そうでない場合は、トラブルシューティングの説明を参照してください。 - 通常の呼気が再開されるのを待ちます。スキャンの合間や、スキャンをしていないときは~5分ごとにリクルート操作を行い、肺のコンプライアンスを維持し、無気肺を予防します。PEEPバルブを呼気ラインに接続します。PEEPを4 cmH2Oに設定し、その量だけピーク吸気圧が上昇するのを観察します。
- 挿管が成功したら、スキャン中に動物が目覚めないように、鎮静剤の再投与スケジュールに合わせてHP 129Xeの生産を計画し、初期化します。実験全体を通して体温をモニターします。
- データ取得:換気画像を収集します。
注:データ取得ステップ2.4、2.5、および2.6は、任意の順序で実行できます- エンドインスピレーションでのイメージングのために 、表2 に従って人工呼吸器をセットします。
- 次のセットアッププロトコルをロードします:陽子動物ローカライザー、マウス肺のガス周波数を中心とする単一パルス、および 129Xe動物ローカライザー。スキャン・パラメーターについては、 表 4 を参照してください。
- 動物をアイソセンタに配置し、胸腔が陽子局在化を伴う視野の中心にあることを確認します。単一周波数のコイルを使用している場合は、プロトンコイルを 129Xe-tunedRFコイルに交換してください。
- 129Xe偏光を記録し、MRIスキャナーに転送します。補足ファイル4:キセノン分極QAチェックリストを参照してください。
- 129Xeの袋をベンチレーターキャニスターに入れ、密封します。キャニスターをベンチレーターと一直線に接続し、キャニスターを加圧します(3〜6 psig)。
- 129Xeの機械換気を開始します。129Xeベンチレーションが作動するたびに、スキャンを開始する前に動物が~5回の呼吸を完了させて、肺の機能的残存容量をターンオーバーさせます。
注:過分極ガスを節約するために、129回のXeスキャン間でN2 / O2混合物に切り替えます。 - 1 つのパルスを使用して、気体 129Xe の in vivo 共振周波数 (7 T で ~83.07 MHz) に一致するように動作周波数を調整します。周波数を後続のすべての気相129Xeスキャンにコピーします。129Xe ローカリゼーションを行い、肺がアイソセンタにあることを確認します。
- 129Xe ラジアル換気シーケンスをロードして実行します。ピーク吸気圧を監視します。
注:プロトコールが完了する前に 129Xeガスがなくなると、ピーク吸気圧は急速に低下します。 129Xe の 400 mL バッグは、 129Xe を 70% で 80 回/分、10 mL/kg の理想的な体重で換気すると、30 g マウスを ~24 分間換気できます。 - スキャンが終了したら、N2/O2 混合物による換気に切り替え、 129Xeの空の袋を取り出します。
- 呼気終了時のイメージングでは、 表2 に従って息止め時間とトリガー遅延を変更し、手順2.4.2〜2.4.9を繰り返します。
- スキャナーから生データをエクスポートします。
| プロトコルの短縮名 | シーケンスの説明 | トリガー | TR (ミリ秒) | TE (ミリ秒) | 繰り返し | フリップ角度 (°) | マトリックスサイズまたはNpts | 視野角 (mm2) | RF帯域幅(kHz) | スライス/スラブの厚さ (mm) | スキャン時間 |
| シングルパルス | パルス取得(気相) | 随意 | 1000 | 1 | 60 | 2048 | 10 | 1秒 | |||
| 動物ローカライザー | 2D GRE | はい | 50 | 1.7 | 1 | 60 | 642 | 322 | 3 | 25 | 60秒 |
| ラジアルベンチレーション | 3Dマルチエコーラジアル | はい | 20 | キャプションを参照 | 1 | 30 | 613 | 223 | 32.05 | 30 | 16分 |
| 溶解相シングルパルス | パルス取得(溶解相) | いいえ | 80 | 1 | 90 | 512 | 10.35 | 80ミリ秒 | |||
| 溶解相動的仕様。 | パルス取得(溶解相) | いいえ | 50 | 1000 | 90 | 512 | 10.5 | 50秒 | |||
| 拡散加重 | 2D GRE | はい | 12.2 | 8.1 | 4 | 45 | 642 | 322 | 3 | 1.5 | 18分 |
表4: in vivo 配列パラメータ。 前述の3Dマルチエコー放射状換気シーケンス39 は、6エコー時間で画像を取得する。最初のエコー画像(TE = 1.12 ms、 図7)の結果を示します。 この表をダウンロードするには、ここをクリックしてください。
補足ファイル4:キセノン偏光QAチェックリスト。このファイルをダウンロードするには、ここをクリックしてください。
- データ取得:動的溶解相分光法を実行します。
- 息止め中のイメージングのために 、表2 に従って人工呼吸器を設定します。BRを100呼吸/分に設定します。手順2.4.2〜2.4.5のように 、129Xeの新しいバッグを準備します。
- 129Xeの機械換気を開始します。1 つのパルスをロードして実行し、ディゾルブ周波数 (7 T で ~83.084 MHz) に一致するように動作周波数を調整します。動作周波数を溶存位相動的分光法にコピーします。
注:これは、野生型ヘモグロビン54を持つマウスのシングルピークになります。 - 動物の肺の溶解頻度を中心とした動的分光法シーケンスをロードして実行します。スキャンが終了したら、N2/O2 混合物による換気に切り替え、 129Xeの空の袋を取り出します。スキャナーから生データをエクスポートします。
- データ取得:拡散強調された画像を収集します。
- 息止め中のイメージングのために 、表2 に従って人工呼吸器を設定します。手順2.4.2〜2.4.7のように 、129Xeの新しいバッグを準備します。
- 拡散加重シーケンスを読み込んで実行します。スキャンが終了したら、N2/O2 混合物による換気に切り替え、 129Xeの空の袋を取り出します。スキャナーから生データをエクスポートします。
3. 実験のまとめ
- 動物を回収します。
- 挿管カニューレを動物の口からまっすぐ引き出します。動物がすぐに自発的に呼吸を始めない場合は、軽い胸骨圧迫を行ってください。可能であれば、動物の顔の近くに医療グレードの酸素を軽く流して、鎮静の回復をサポートします。
- 動物が自力で安定して呼吸するようになったら、動物が>2時間鎮静された場合は、脱水を防ぐために0.5〜1mLの生理食塩水を皮下に投与します。
- 動物を一人でケージに戻します。ケージをインキュベーターまたは加熱パッドの上に置きます。
注:鎮静状態の動物は共食いに対して脆弱であり、完全に回復するまで(つまり、独立して歩き回る)まで、ケージメイトと一緒にケージに入れることはできません。鎮静剤を投与された動物は体温を調節できません。手の甲を使って、数分ごとに動物の体温を感じます。 - 動物が立ち直り反射に戻るまで(つまり、仰臥位から腹臥位に独立して反転できる)まで、動物を注意深く監視します。
- 動物が独立して歩行できるようになると、動物を熱サポートから外します。動物をケージの仲間と一緒にケージに戻します。
注:ケージメイトがいない動物は、鎮静誘発性低体温症にかかりやすくなります。動物に予備の寝具を提供し、利用可能な場合は、動物をインキュベーターに一晩置いておきます。 - 動物の健康状態を監視するために、週に一度、2週間にわたって動物の体重を記録します。
注:挿管により動物が口や食道に損傷を負った場合、食事をやめることがあります。動物が最初の体重の>20%を失った場合は、安楽死について獣医師に相談してください。
- 換気画像を解析します(図7)。
- 生データをプログラミングプラットフォームにロードします。非デカルト画像91のオープンソース再構築フレームワークをダウンロードしてください。
- オープンソースのフレームワークの指示に従ってイメージを再構築します。各放射状投影39上の最初の点を正規化する。
- 画像内の肺実質を、 129Xeシグナルが低いまたはまったくないボクセルを含むセグメント化します。大きな気道は含めないでください。画像内のバックグラウンドノイズをセグメント化します。肺、気道、画像アーティファクトを除外します。
注:プロトンローカライザー画像は、実質境界の決定に役立ちます。 - 次の式を使用して SNR を計算します。
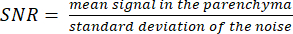 (3)
(3) - 換気不良を定量化します。
注:小動物モデルにおける換気障害を定量化するために、さまざまな方法が提案されています。分析方法は依然として未解決の検討領域であるが、容易に実施できるアプローチには、(i)半定量的手動セグメンテーション92、(ii)気管からの信号を使用して実質信号を正規化するヒストグラムアプローチ47、および(iii)総肺活量(TLV)をセグメント化し、信号閾値(例えば、全肺平均の<60%)を定義して、肺を欠陥容積と換気肺活量(VV)に分割する。VDP 93,94 を次のように定量化します。
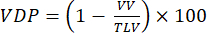 (4)
(4)
- 溶存相動的分光法を解析します(図8)。
- 生データをプログラミングプラットフォームにロードします。高速フーリエ変換を実行し、スペクトルを位相化します(このアプリケーションには、スペクトルの同時手動ゼロ次位相化で十分です)。
- 標準的な核磁気共鳴(NMR)データ95,96を計算します:SNR、全幅半値、積分面積、化学シフト、および両方のピークの位相。
- 振幅データから、各繰り返しの溶解スペクトルの信号振幅をガススペクトルの信号振幅で除算して、時間の経過に伴う溶解とガスの比率を求めます。
- 拡散強調画像を解析します(図9)。
- 生データをプログラミングプラットフォームにロードします。ステップ 3.2.3 のように b0 画像の肺実質をセグメント化します。各 b 値イメージの SNR を計算します。
- 信号値対雑音比 SVNR0 は、 b0 イメージの各ボクセルの信号をイメージ ノイズの標準偏差で割ることにより計算します。SVNR0 <イメージ ノイズ97 の 2.5 倍のボクセルを除外します。
注:SVNR0 は個々のボクセルメトリックであり、実質SNRは全肺メトリックです。 - 式 598,99 に従って、信号減衰を b 値 (bi) に合わせることにより ADC を計算します。
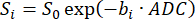 (5)
(5)
結果
換気イメージ
動物の準備と換気手順が適切に実施されていれば、吸気時または呼気時にデータ取得を行ったときに、3D放射状イメージングで換気パターンをうまく捉えることができます(図7)。これらの画像は何度も呼吸して収集されますが、ここで説明する方法は、人間で使用される 1 回の呼吸イメージング方...
ディスカッション
過分極 129Xe MRI は、小動物モデルで肺の微細構造と機能を研究するための洗練された強力な技術として浮上しています。このプロトコルは、HP 129Xeを使用したマウス肺の換気、拡散、およびガス交換を定量化するために必要な実験手順を説明し、初期部位の準備をガイドすることを目的としています。実験の主な前提条件には、129Xeガスファン...
開示事項
Peter Niedbalskiは、Polarean Imaging, Plcのコンサルタントです。
謝辞
著者は、人工呼吸器製造の指針となるジェリー・ダルクに心から感謝します。HP 129Xeガスを醸造してくれたCarter McMasterに感謝します。また、Matthew Willmering博士とJuan Parra-Robles博士の示唆に富む科学的な議論に感謝します。BioRender.com で作成されたフィギュア。この研究は、国立衛生研究所(National Institutes of Health)から資金提供を受けました(助成金番号:NHLBI R01HL143011、R01HL151588)
資料
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | fisher scientific | Catalog No.14-955-464 | https://www.fishersci.com/shop/products/sterile-syringes-single-use-12/14955464 |
| 10 mL graduated cylinder | Cole-Parmer | UX-34502-69 | https://www.coleparmer.com/i/cole-parmer-essentials-graduated-cylinder-glass-hexagonal-base-10-ml-2-pk/3450269?PubID=UX&persist=true&ip=no& gad_source=1&gclid=CjwKCAi A6KWvBhAREiwAFPZM7h3do -ssjascARuVviKd7V7kC5ztdIB6 _70DnMr-K3qk9RKeJ7-IrhoCeT 0QAvD_BwE |
| 18 G - veinous PFTE catheters (nonsterile) | Terumo Surflo | SROX1832CA | https://www.shopmedvet.com/product/iv-catheter-18-x-1-25inch?r=GSS17&p=GSS17&utm_source= google&utm_medium=google_ shopping&gad_source=1&gclid= CjwKCAiA0bWvBhBjEiwAtEsoW 4oTvZkAgWQCda6ocVtQlulVrG 2536FNbu5soMVSFN8xK_g1Uh pXIRoCGwoQAvD_BwE |
| 20 G - veinous PFTE catheters (nonsterile) | Terumo Surflo | SROX2051CA | https://www.shopmedvet.com/product/iv-catheter-20-x-2inch?r=GSS17&p=GSS17&utm_source =google&utm_medium=google_ shopping&gad_source=1&gclid= CjwKCAiA0bWvBhBjEiwAtEsoW 87ggCkgToD_XF_UgpQBTpmN dgSNfCml6TkDKlW8k27Dq_daR itPuhoCnBQQAvD_BwE |
| 22 G - veinous PFTE catheters (nonsterile) | Terumo Surflo | SROX2225CA | https://www.shopmedvet.com/product/iv-catheter-22-x-1inch?r=GSS17&p=GSS17&utm_source= google&utm_medium=google_ shopping&gad_source=1&gclid =CjwKCAiA0bWvBhBjEiwAtEso W9IM6mpee6m7e-lBfR8dZhSN KYbMUs7qgEU4gYCRTW_rJAs W_lGkthoCm30QAvD_BwE |
| 400 mL tedlar bags | Jensen Inert Products | GST-001S-3507TJC | NA |
| 60 mL syringe | fisher scientific | Catalog No.14-955-461 | https://www.fishersci.com/shop/products/sterile-syringes-single-use-12/14955461 |
| 70% alcohol | Cole-Parmer | UX-80024-34 | https://www.coleparmer.com/i/labchem-isopropyl-alcohol-70-v-v-500-ml/8002434?PubID=UX&persist=true&ip= no&gad_source=1&gclid=CjwKC AiA6KWvBhAREiwAFPZM7gGh p8g7MBHBBKadaRCAwfEMgV gna5fhYRsuXIuqoqOiToCC4fem nhoCGMEQAvD_BwE |
| Dewar for liquid nitrogen | Terra Universal | 4LDB | https://www.laboratory-equipment.com/tw-4ldb-liquid-nitrogen-dewar-ic-biomedical.html?srsltid=AfmBOooxwMtOA1Z2TweR P8V5Iy5EvYT3alZuzoiY 3UF3Ib9RgFnDxVTfWP0 |
| Eye lubricant | Refresh | REFRESH P.M. | https://www.refreshbrand.com/Products/refresh-pm |
| Fiber optic light | AmScope | HL250-AY | https://amscope.com/products/hl250-ay?tw_source=google &tw_adid=&tw_campaign= 16705014684&gad_source= 1&gclid=CjwKCAiA6KWvBhA REiwAFPZM7p-DpyvHJaGxR pAD1385hzGf1oPdKHHLFDR Sp8yrtxry11SNJeJnKxoCtAoQ AvD_BwE |
| Gaussmeter | Apex Magnets | GMHT201 | https://www.apexmagnets.com/magnets/accessories/ht-digital-gaussmeter-with-peak-hold-can-display-gauss-or-tesla |
| Glass vessel (phantom) | Ace Glass | 8648-24 | https://aceglass.com/results.php?t=8648-24&t=8648-24 |
| Heating pad | Office Depot | 9206211 | Pure Enrichment PureRelief Express Designer Series Heating Pad 12 x 15 Palm Aqua - Office Depot |
| Hyperpolarizer | Polarean | 9820 | https://polarean.com/xenon-mri-platform/ |
| Intubation board | Hallowell EMC | 000A3467 | https://hallowell.com/product/rodent-tilting-workstand/ |
| Intubation supplies | Parts list published elsewhere | NA | https://app.jove.com/t/50318/a-simple-method-of-mouse-lung-intubation |
| Isotopically enriched xenon cylinder | Linde Isotopes | XE-129(1%)N2(10%)HE CGMP 302SZ | NA |
| Liquid nitrogen | Linde | NI LC160-22 | https://www.lindedirect.com/store/product-detail/nitrogen_n2_nitrogen_liquid _lc160_22_psi_ni_lc160_22 /ni-lc160-22?cat_id=shop&node=b89 |
| Male slip luer | Cole-Parmer | UX-21943-27 | https://www.coleparmer.com/i/diba-omnifit-t-series-solvent-waste-cap-adapter-polypropylene-male-luer-slip-x-1-16-id-hose-barb-5-pk/2194327 |
| Manometer | Grainger | 3T294 | https://www.grainger.com/product/3T294?gucid=N:N:PS: Paid:GGL:CSM-2295:4P7A1P: 20501231&gad_source=1&gclid =CjwKCAiAi6uvBhADEiwAWiyR dltxrPJmmcm0bFiYLuPrB25HV QFdEfKMBqvgJBNdQUs3DZ7b TLr8CRoCanAQAvD_BwE& gclsrc=aw.ds |
| Minivent ventilator | harvard apparatus | 73-0044 | https://www.harvardapparatus.com/minivent-ventilator-for-mice-single-animal-volume-controlled-ventilators.html |
| Mouse ear puncher | fisher scientific | 13-812-201 | https://www.fishersci.com/shop/products/fisherbrand-animal-ear-tag-punch/13812201 |
| Mouse tongue depressor | Medical Tools | VRI-617 | https://medical-tools.com/shop/rodent-tongue-depressor.html |
| Mouse weight scale | Cole-Parmer | UX-11712-12 | https://www.coleparmer.com/i/adam-equipment-cqt2000-core-portable-balance-2000g-x-1g-220-v/1171212?PubID=UX&persist=true&ip=no&gad _source=1&gclid=CjwKCAiA6K WvBhAREiwAFPZM7iYnAG5Ilc Z5DZWrdJ6wcLDZSCSfNJHOH m2PQOpyyWe0TjFa75R3tBoCjB sQAvD_BwE |
| MRI scanner | Bruker | 7T Biospec horizontal system | https://www.bruker.com/de/products-and-solutions/preclinical-imaging/mri/biospec.html |
| Multimeter | Home Depot | 1007898529 | https://www.homedepot.com/p/Klein-Tools-600-Volt-Digital-Multi-Meter-Manual-Ranging-MM325/320822947 |
| Natural abundance xenon | Linde Isotopes | UN 2036 | NA |
| Needle | fisher scientific | 305194 | https://www.fishersci.com/shop/products/bd-general-use-precisionglide-hypodermic-needles-20/148266C?keyword=true |
| Needle safe syringe holder | fisher scientific | NC2703873 | https://www.fishersci.com/shop/products/ndlsafe-ii-syr-uncap-deca/NC2703873#?keyword=needlesafe |
| Nitrogen cylinder | Linde | NI M-K | https://www.lindedirect.com/store/product-detail/nitrogen_n2_nitrogen_nf_k/ni-m-k?cat_id=shop&node=b89 |
| Oxygen cylinder | Linde | OX M-K | https://www.lindedirect.com/store/product-detail/oxygen_o2_oxygen_usp_k/ox-m-k?cat_id=shop&node=b90 |
| Oxygen sensor | Apogee instruments | MO-200 | https://www.apogeeinstruments.com/mo-200-oxygen-sensor-with-handheld-meter/ |
| Oxygen sensor inline flowhead | Apogee instruments | AO-002 | https://www.apogeeinstruments.com/ao-002-oxygen-meter-sensor-flow-through-head/ |
| PEEP valve | Hallowell EMC | 000A6556A | https://hallowell.com/product/adjustable-peep-valve-with-exhaust-port-range-5-20cm-disposable/ |
| Pipette tips | fisher scientific | Catalog No.02-707-108 | Fisherbrand Stack-Rack Space-Saver Tips: 101-1000 L Standard; Blue; Volume: | Fisher Scientific |
| Plunger valve | Ace glass | 8648-20 | https://www.aceglass.com/results.php?t=8648 |
| Preclinical coil | Doty scientific | custom built | https://dotynmr.com/products/bmax-xy-low-e/ |
| Pressure regulators | Cole-Parmer | UX-98202-11 | https://www.coleparmer.com/i/cole-parmer-single-stage-regulator-1500-scfh-capacity-346-cga-fitting/9820211?PubID=UX&persist=true&ip=no& gad_source=1&gclid=CjwKCAi A6KWvBhAREiwAFPZM7pruR xCAiaj52nA_8Y1nveQZRsD6B f0QO65o2DKFYqRoz0PopSkX QxoCxqcQAvD_BwE |
| Pressure-drop ventilator | Parts list published elsewhere | NA | https://sites.duke.edu/driehuyslab/resources/ |
| PVC pipe for phantom | Home Depot | 193682 | https://www.homedepot.com/p/IPEX-1-2-in-x-10-ft-White-PVC-SCH-40-Potable-Pressure-Water-Pipe-30-05010HD/319692959 |
| SAI animal heating system | SAII | Model 1030 | https://i4sa.com/product/model-1030-monitoring-gating-system/ |
| Saline | Farris Laboratories Inc. | 0409488820-1 | https://www.farrislabs.com/products/bacteriostatic-sodium-chloride-0-9-30ml-bottle?variant=42807174824167¤cy =USD&utm_medium=product_ sync&utm_source=google&utm_ content=sag_organic&utm_ campaign=sag_organic&utm_ campaign=gs-2021-09-24&utm _source=google&utm_medium =smart_campaign&gad_source =1&gclid=CjwKCAiA6KWvBh AREiwAFPZM7oS3-hFDETO_2f6OWOoKyBMb WuDuWqYxdWRYUWEkY M2Py73VfGzVtRoC2FQQAvD_BwE |
| Sharps container | fisher scientific | 22-730-455 | https://www.fishersci.com/shop/products/sharps-container-47/p-7250579#?keyword=needle%20safe |
| Silicone epoxy | Grainger | 3KMY7 | https://www.grainger.com/product/3KMY7?gucid=N:N:PS:Paid:GGL:CSM- 2295:4P7A1P:20501231&gad_ source=1&gclid=CjwKCAiA6KW vBhAREiwAFPZM7voahkm8tda t1Euql1A8DFhC6AZVJ0wXzCE PfE6iUzrIJXV-Hl8o4xoCQLYQA vD_BwE&gclsrc=aw.ds |
| Silicone mold release lubricant | Grainger | 19MW95 | https://www.grainger.com/product/CRC-Mold-Release-Agent-16-oz-19MW95 |
| Spirometer | ADInstruments | FE141 | https://www.adinstruments.com/products/spirometer |
| Spirometer - mouse flowhead | ADInstruments | MLT1L | https://www.adinstruments.com/products/respiratory-flow-heads |
| Tubing - 1/4 OD | Clippard | URH1-0402-CLT-050 | https://www.clippard.com/part/URH1-0402-CLT-050 |
| Tubing - 1/8 OD | Clippard | URH1-0804-CLT-050 | https://www.clippard.com/part/URH1-0402-CLT-050 |
| Vacuum pump | Cole-Parmer | UX-60062-11 | https://www.coleparmer.com/i/environmental-express-diaphragm-pump-high-volume-120v/6006211?PubID=UX&persist=true&ip=no&gad _source=1&gclid=CjwKCAiA6K WvBhAREiwAFPZM7uFGwmW pRelHNFgZVvJJV09vDUVyfyG HoKeZTiFNIiVTe-05IpJJPxoCO PoQAvD_BwE |
| Wire - 18 gauge | Digikey | 2328-18H240-ND | https://www.digikey.com/en/products/detail/remington-industries/18H240/15202027?s=N4 IgjCBcoOwBxVAYygMwIYBsDOB TANCAPZQDa4YATPAGwgC6h ADgC5QgDKLATgJYB2AcxAB fQmAAMAFkqIQKSBhwFiZEA GZNATi0SGzNpE48BwsSErqw 6uQqV5CJSOQCsMF%2Bq11 GIVuy58QqLmss4gALbogvy4L AAEAO683LgMIkA |
| Xenon polarization measurement station | Polarean | NA | https://polarean.com/xenon-mri-platform/ |
参考文献
- World Health Organization. Global health estimates 2020: Deaths by cause, age, sex, by country and by region, 2000-2019. World Health Organization. , (2020).
- Middleton, P. G., et al. Elexacaftor-Tezacaftor-Ivacaftor for cystic fibrosis with a single Phe508del allele. N Engl J Med. 381 (19), 1809-1819 (2019).
- Taylor-Cousar, J. L., et al. Tezacaftor-Ivacaftor in patients with cystic fibrosis homozygous for Phe508del. N Engl J Med. 377 (21), 2013-2023 (2017).
- Richeldi, L., et al. Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. N Engl J Med. 370 (22), 2071-2082 (2014).
- King, T. E., et al. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis. N Engl J Med. 370 (22), 2083-2092 (2014).
- Yong, K. S. M., Her, Z., Chen, Q. Humanized mice as unique tools for human-specific studies. Arch Immunol Ther Exp (Warsz. 66 (4), 245-266 (2018).
- Li, H., Auwerx, J. Mouse systems genetics as a prelude to precision medicine. Trends Genet. 36 (4), 259-272 (2020).
- Eppig, J. T., Motenko, H., Richardson, J. E., Richards-Smith, B., Smith, C. L. The International Mouse Strain Resource (IMSR): cataloging worldwide mouse and ES cell line resources. Mamm Genome. 26 (9-10), 448-455 (2015).
- Vedi, M., et al. 2022 updates to the rat genome database: A Findable, Accessible, Interoperable, and Reusable (FAIR) resource. Genetics. 224 (1), 042 (2023).
- Ghorani, V., Boskabady, M. H., Khazdair, M. R., Kianmeher, M. Experimental animal models for COPD: a methodological review. Tob Induc Dis. 15, 25 (2017).
- Semaniakou, A., Croll, R. P., Chappe, V. Animal models in the pathophysiology of cystic fibrosis. Front Pharmacol. 9, 1475 (2018).
- Moore, B. B., et al. Animal models of fibrotic lung disease. Am J Respir Cell Mol Biol. 49 (2), 167-179 (2013).
- Jenkins, R. G., et al. An official American thoracic society workshop report: Use of animal models for the preclinical assessment of potential therapies for pulmonary fibrosis. Am J Respir Cell Mol Biol. 56 (5), 667-679 (2017).
- Gomez-Arroyo, J., et al. A brief overview of mouse models of pulmonary arterial hypertension: problems and prospects. Am J Physiol Lung Cell Mol Physiol. 302 (10), L977-L991 (2012).
- Dignam, J. P., Scott, T. E., Kemp-Harper, B. K., Hobbs, A. J. Animal models of pulmonary hypertension: Getting to the heart of the problem. Br J Pharmacol. 179 (5), 811-837 (2022).
- Woodrow, J. S., Sheats, M. K., Cooper, B., Bayless, R. Asthma: The use of animal models and their translational utility. Cells. 12 (7), 1091 (2023).
- Van de Velde, G., et al. Longitudinal in vivo microcomputed tomography of mouse lungs: No evidence for radiotoxicity. Am J Physiol Lung Cell Mol Physiol. 309 (3), L271-L279 (2015).
- Mata, J. F., et al. Evaluation of emphysema severity and progression in a rabbit model: comparison of hyperpolarized 3He and 129Xe diffusion MRI with lung morphometry. J Appl Physiol (1985). 102 (1985), 1273-1280 (2007).
- Boudreau, M., Xu, X., Santyr, G. E. Measurement of 129Xe gas apparent diffusion coefficient anisotropy in an elastase-instilled rat model of emphysema. Magn Reson Med. 69 (1), 211-220 (2013).
- Cleveland, Z. I., et al. 3D MRI of impaired hyperpolarized 129Xe uptake in a rat model of pulmonary fibrosis. NMR Biomed. 27 (12), 1502-1514 (2014).
- Kimura, A., et al. Inflammation during lung cancer progression and ethyl pyruvate treatment observed by pulmonary functional hyperpolarized 129Xe MRI in mice. Contrast Media Mol Imaging. 2021, 9918702 (2021).
- Kimura, A., et al. Treatment response of ethyl pyruvate in a mouse model of chronic obstructive pulmonary disease studied by hyperpolarized 129Xe MRI. Magn Reson Med. 78 (2), 721-729 (2017).
- Ouriadov, A., et al. Early stage radiation-induced lung injury detected using hyperpolarized 129Xe Morphometry: Proof-of-concept demonstration in a rat model. Magn Reson Med. 75 (6), 2421-2431 (2016).
- Willmering, M. M., et al. Improved pulmonary 129Xe ventilation imaging via 3D-spiral UTE MRI. Magn Reson Med. 84 (1), 312-320 (2020).
- Kaushik, S. S., et al. Single-breath clinical imaging of hyperpolarized 129Xe in the airspaces, barrier, and red blood cells using an interleaved 3D radial 1-point Dixon acquisition. Magn Reson Med. 75 (4), 1434-1443 (2016).
- Zanette, B., Munidasa, S., Friedlander, Y., Ratjen, F., Santyr, G. A 3D stack-of-spirals approach for rapid hyperpolarized 129Xe ventilation mapping in pediatric cystic fibrosis lung disease. Magn Reson Med. 89 (3), 1083-1091 (2023).
- Zanette, B., Stirrat, E., Jelveh, S., Hope, A., Santyr, G. Physiological gas exchange mapping of hyperpolarized 129Xe using spiral-IDEAL and MOXE in a model of regional radiation-induced lung injury. Med Phys. 45 (2), 803-816 (2018).
- Collier, G. J., et al. Dissolved 129Xe lung MRI with four-echo 3D radial spectroscopic imaging: Quantification of regional gas transfer in idiopathic pulmonary fibrosis. Magn Reson Med. 85 (5), 2622-2633 (2021).
- Qing, K., et al. Assessment of lung function in asthma and COPD using hyperpolarized 129Xe chemical shift saturation recovery spectroscopy and dissolved-phase MRI. NMR Biomed. 27 (12), 1490-1501 (2014).
- Ruppert, K., Brookeman, J. R., Hagspiel, K. D., Mugler, J. P. Probing lung physiology with xenon polarization transfer contrast (XTC). Magn Reson Med. 44 (3), 349-357 (2000).
- Kern, A. L., et al. Investigating short-time diffusion of hyperpolarized 129Xe in lung air spaces and tissue: A feasibility study in chronic obstructive pulmonary disease patients. Magn Reson Med. 84 (4), 2133-2146 (2020).
- Amzajerdian, F., et al. Simultaneous quantification of hyperpolarized xenon-129 ventilation and gas exchange with multi-breath xenon-polarization transfer contrast (XTC) MRI. Magn Reson Med. 90 (6), 2334-2347 (2023).
- Perron, S., et al. Application of a 2D frequency encoding sectoral approach to hyperpolarized 129Xe MRI at low field. J Magn Reson. 336, 107159 (2022).
- Loza, L. A., et al. Quantification of ventilation and gas uptake in free-breathing mice with hyperpolarized 129Xe MRI. IEEE Trans Med Imaging. 38 (9), 2081-2091 (2019).
- Imai, H., et al. Regional fractional ventilation mapping in spontaneously breathing mice using hyperpolarized 129Xe MRI. NMR Biomed. 28 (1), 24-29 (2015).
- Friedlander, Y., et al. Effect of inhaled oxygen concentration on 129Xe chemical shift of red blood cells in rat lungs. Magn Reson Med. 86 (3), 1187-1193 (2021).
- Virgincar, R. S., et al. A portable ventilator with integrated physiologic monitoring for hyperpolarized 129Xe MRI in rodents. J Magn Reson. 295, 63-71 (2018).
- Nouls, J., Fanarjian, M., Hedlund, L., Driehuys, B. A constant-volume ventilator and gas recapture system for hyperpolarized gas MRI of mouse and rat lungs. Concepts Magn Reson Part B Magn Reson Eng. 39B (2), 78-88 (2011).
- Niedbalski, P. J., et al. Preclinical hyperpolarized 129Xe MRI: ventilation and T2* mapping in mouse lungs at 7 T using multi-echo flyback UTE. NMR Biomed. 33 (7), e4302 (2020).
- Akinyi, T. G. . An Affordable Open-Source Small Animal MR and Hyperpolarized Gas Compatible Ventilator: Feasibility in Preclinical Imaging. , (2017).
- Smith, L. J., et al. The assessment of short and long term changes in lung function in CF using 129Xe MRI. Eur Respir J. 6, 2000441 (2020).
- Svenningsen, S., et al. Reproducibility of hyperpolarized 129Xe MRI ventilation defect percent in severe asthma to evaluate clinical trial feasibility. Acad Radiol. 28 (6), 817-826 (2021).
- Kirby, M., et al. Hyperpolarized 3He and 129Xe MR imaging in healthy volunteers and patients with chronic obstructive pulmonary disease. Radiology. 265 (2), 600-610 (2012).
- Virgincar, R. S., et al. Quantitative analysis of hyperpolarized 129Xe ventilation imaging in healthy volunteers and subjects with chronic obstructive pulmonary disease. NMR Biomed. 26 (4), 424-435 (2013).
- Ebner, L., et al. Multireader determination of clinically significant obstruction using hyperpolarized 129Xe-ventilation MRI. AJR Am J Roentgenol. 212 (4), 758-765 (2019).
- Driehuys, B., et al. 3He MRI in mouse models of asthma. Magn Reson Med. 58 (5), 893-900 (2007).
- Mistry, N. N., Thomas, A., Kaushik, S. S., Johnson, G. A., Driehuys, B. Quantitative analysis of hyperpolarized 3He ventilation changes in mice challenged with methacholine. Magn Reson Med. 63 (3), 658-666 (2010).
- Costa, M., et al. Noninvasive assessment of in vivo mouse lung microstructural changes due to aging and PEEP. Am J Respir Crit Care Med. 207, A4713 (2023).
- Sukstanskii, A. L., Yablonskiy, D. A. Lung morphometry with hyperpolarized 129Xe: theoretical background. Magn Reson Med. 67 (3), 856-866 (2012).
- Chan, H. F., Stewart, N. J., Norquay, G., Collier, G. J., Wild, J. M. 3D diffusion-weighted 129Xe MRI for whole lung morphometry. Magn Reson Med. 79 (6), 2986-2995 (2018).
- Bier, E. A., et al. Noninvasive diagnosis of pulmonary hypertension with hyperpolarised 129Xe magnetic resonance imaging and spectroscopy. ERJ Open Res. 8 (2), 00035 (2022).
- Bier, E. A., et al. A protocol for quantifying cardiogenic oscillations in dynamic 129Xe gas exchange spectroscopy: The effects of idiopathic pulmonary fibrosis. NMR Biomed. 32 (1), e4029 (2019).
- Wang, Z., et al. Diverse cardiopulmonary diseases are associated with distinct xenon magnetic resonance imaging signatures. Eur Respir J. 54 (6), 1900831 (2019).
- Freeman, M. S., Cleveland, Z. I., Qi, Y., Driehuys, B. Enabling hyperpolarized 129Xe MR spectroscopy and imaging of pulmonary gas transfer to the red blood cells in transgenic mice expressing human hemoglobin. Magn Reson Med. 70 (5), 1192-1199 (2013).
- Iguchi, S., et al. Direct imaging of hyperpolarized 129Xe alveolar gas uptake in a mouse model of emphysema. Magn Reson Med. 70 (1), 207-215 (2013).
- Imai, H., et al. Noninvasive detection of pulmonary tissue destruction in a mouse model of emphysema using hyperpolarized 129Xe MRS under spontaneous respiration. Magn Reson Med. 64 (4), 929-938 (2010).
- Silk, S. B., Hampton, L. L., Brown, P. A. What investigators need to know about the use of animals. ILAR J. 54 (3), 324-328 (2014).
- Cereda, M., et al. Mild loss of lung aeration augments stretch in healthy lung regions. J Appl Physiol. 120 (1985), 444-454 (2016).
- Constantinides, C., Murphy, K. Molecular and integrative physiological effects of isoflurane anesthesia: The paradigm of cardiovascular studies in rodents using magnetic resonance imaging. Front Cardiovasc Med. 3, 23 (2016).
- Irwin, M. R., Curay, C. M., Choi, S., Kiyatkin, E. A. Basic physiological effects of ketamine-xylazine mixture as a general anesthetic preparation for rodent surgeries. Brain Res. 1804, 148251 (2023).
- Roth, D. M., Swaney, J. S., Dalton, N. D., Gilpin, E. A., John Ross, J. Impact of anesthesia on cardiac function during echocardiography in mice. Am J Physiol Heart Circ Physiol. 282 (6), H2134-H2140 (2002).
- Massey, C. A., Richerson, G. B. Isoflurane, ketamine-xylazine, and urethane markedly alter breathing even at subtherapeutic doses. J Neurophysiol. 118 (4), 2389-2401 (2017).
- Janssen, B. J. A., et al. Effects of anesthetics on systemic hemodynamics in mice. Am J Physiol Heart Circ Physiol. 287 (4), H1618-H1624 (2004).
- Lenzarini, F., Di Lascio, N., Stea, F., Kusmic, C., Faita, F. Time course of isoflurane-induced vasodilation: A Doppler ultrasound study of the left coronary artery in mice. Ultrasound Med Biol. 42 (4), 999-1009 (2016).
- Mondonedo, J. R., et al. Volatile anesthetics and the treatment of severe bronchospasm: A concept of targeted delivery. Drug Discov Today Dis Models. 15, 43-50 (2015).
- Nolan, J. P. Anaesthesia and Neuromuscular Block. Clinical Pharmacology. , 295-310 (2012).
- Arras, M., Autenried, P., Rettich, A., Spaeni, D., Rülicke, T. Optimization of intraperitoneal injection anesthesia in mice: drugs, dosages, adverse effects, and anesthesia depth. Comp Med. 51 (5), 443-456 (2001).
- Navarro, K. L., et al. Mouse anesthesia: The art and science. ILAR J. 62 (1-2), 238-273 (2021).
- Das, S., MacDonald, K., Chang, H. Y., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. (73), e50318 (2013).
- Thomas, J. L., et al. Endotracheal intubation in mice via direct laryngoscopy using an otoscope. J Vis Exp. (86), e50269 (2014).
- Slutsky, A. S., Ranieri, V. M. Ventilator-induced lung injury. N Engl J Med. 369 (22), 2126-2136 (2013).
- Matute-Bello, G., et al. An official American thoracic society workshop report: features and measurements of experimental acute lung injury in animals. Am J Respir Cell Mol Biol. 44 (5), 725-738 (2011).
- Kulkarni, H. S., et al. Update on the features and measurements of experimental acute lung injury in animals: An official American thoracic society workshop report. Am J Respir Cell Mol Biol. 66 (2), e1-e14 (2022).
- Tsuchida, S., et al. Atelectasis causes alveolar injury in nonatelectatic lung regions. Am J Respir Crit Care Med. 174 (3), 279-289 (2006).
- Fan, E., et al. An official American thoracic society/European society of intensive care medicine/society of critical care medicine clinical practice guideline: Mechanical ventilation in adult patients with acute respiratory distress syndrome. Am J Respir Crit Care Med. 195 (9), 1253-1263 (2017).
- Santos, R. S., Silva, P. L., Pelosi, P., Rocco, P. R. Recruitment maneuvers in acute respiratory distress syndrome: The safe way is the best way. World J Crit Care Med. 4 (4), 278-286 (2015).
- Mekontso Dessap, A., et al. Conflicting physiological and genomic cardiopulmonary effects of recruitment maneuvers in murine acute lung injury. Am J Respir Cell Mol Biol. 46 (4), 541-550 (2012).
- García-Fernández, J., et al. Recruitment manoeuvres in anaesthesia: How many more excuses are there not to use them. Rev Esp Anestesiol Reanim (Engl Ed). 65 (4), 209-217 (2018).
- Allen, G. B., Suratt, B. T., Rinaldi, L., Petty, J. M., Bates, J. H. Choosing the frequency of deep inflation in mice: balancing recruitment against ventilator-induced lung injury. Am J Physiol Lung Cell Mol Physiol. 291 (4), L710-L717 (2006).
- da Silva, A. C. L., et al. Sigh maneuver protects healthy lungs during mechanical ventilation in adult Wistar rats. Exp Biol Med. 245 (15), 1404-1413 (2020).
- Riva, D. R., et al. Recruitment maneuver: RAMP versus CPAP pressure profile in a model of acute lung injury. Respir Physiol Neurobiol. 169 (1), 62-68 (2009).
- Schwarte, L. A., Zuurbier, C. J., Ince, C. Mechanical ventilation of mice. Basic Res Cardiol. 95 (6), 510-520 (2000).
- Joelsson, J. P., Ingthorsson, S., Kricker, J., Gudjonsson, T., Karason, S. Ventilator-induced lung-injury in mouse models: Is there a trap. Lab Anim Res. 37 (1), 30 (2021).
- Jameson, C. J., Jameson, A. K., Hwang, J. K. Nuclear spin relaxation by intermolecular magnetic dipole coupling in the gas phase. 129Xe in oxygen. J Chem Phys. 89 (7), 4074-4081 (1988).
- Kelley, M., Branca, R. T. Theoretical models of spin-exchange optical pumping: Revisited and reconciled. J Appl Phys. 129 (15), 1-16 (2021).
- Norquay, G., Leung, G., Stewart, N. J., Wolber, J., Wild, J. M. 129Xe chemical shift in human blood and pulmonary blood oxygenation measurement in humans using hyperpolarized 129Xe NMR. Magn Reson Med. 77 (4), 1399-1408 (2017).
- Norquay, G., Collier, G. J., Rao, M., Stewart, N. J., Wild, J. M. 129Xe-Rb spin-exchange optical pumping with high photon efficiency. Phys Rev Lett. 121 (15), 153201 (2018).
- Ball, J. E., Wild, J. M., Norquay, G. Investigating Rubidium density and temperature distributions in a high-throughput 129Xe-Rb spin-exchange optical pumping polarizer. Molecules. 28 (1), 11 (2022).
- Plummer, J. W., et al. A semi-empirical model to optimize continuous-flow hyperpolarized 129Xe production under practical cryogenic-accumulation conditions. J Magn Reson. 320, 106845 (2020).
- Nikolaou, P., et al. Near-unity nuclear polarization with an open-source 129Xe hyperpolarizer for NMR and MRI. Proc Natl Acad Sci U S A. 110 (35), 14150-14155 (2013).
- Robertson, S. H., et al. Optimizing 3D noncartesian gridding reconstruction for hyperpolarized 129Xe MRI-focus on preclinical applications. Concepts Magn Reson Part A Bridg Educ Res. 44 (4), 190-202 (2015).
- Thomas, A. C., et al. A robust protocol for regional evaluation of methacholine challenge in mouse models of allergic asthma using hyperpolarized 3He MRI. NMR Biomed. 22 (5), 502-515 (2009).
- Niedbalski, P. J., et al. Protocols for multi-site trials using hyperpolarized 129Xe MRI for imaging of ventilation, alveolar-airspace size, and gas exchange: A position paper from the 129Xe MRI clinical trials consortium. Magn Reson Med. 86 (6), 2966-2986 (2021).
- Woodhouse, N., et al. Combined helium-3/proton magnetic resonance imaging measurement of ventilated lung volumes in smokers compared to never-smokers. J Magn Reson Imaging. 21 (4), 365-369 (2005).
- Brown, R. W., Cheng, Y. C. N., Haacke, E. M., Thompson, M. R., Venkatesan, R. . Magnetic Resonance Imaging: Physical Principles and Sequence Design. , (2014).
- Levitt, M. H. . Spin Dynamics: Basics of Nuclear Magnetic Resonance. , (2013).
- Salerno, M., et al. Emphysema: hyperpolarized helium 3 diffusion MR imaging of the lungs compared with spirometric indexes—initial experience. Radiology. 222 (1), 252-260 (2002).
- Niedbalski, P. J., et al. Validating in vivo hyperpolarized 129Xe diffusion MRI and diffusion morphometry in the mouse lung. Magn Reson Med. 85 (4), 2160-2173 (2021).
- Bdaiwi, A. S., et al. Improving hyperpolarized 129Xe ADC mapping in pediatric and adult lungs with uncertainty propagation. NMR Biomed. 35 (3), e4639 (2022).
- Ruppert, K., Brookeman, J. R., Hagspiel, K. D., Driehuys, B., Mugler, J. P. NMR of hyperpolarized 129Xe in the canine chest: spectral dynamics during a breath-hold. NMR Biomed. 13 (4), 220-228 (2000).
- Driehuys, B., et al. Imaging alveolar-capillary gas transfer using hyperpolarized 129Xe MRI. Proc Natl Acad Sci U S A. 103 (48), 18278-18283 (2006).
- Nakamura, K., et al. 129Xe spectra from the heads of rats with and without ligation of the external carotid and pterygopalatine arteries. Magn Reson Med. 53 (3), 528-534 (2005).
- Kershaw, J., et al. Confirming the existence of five peaks in 129Xe rat head spectra. Magn Reson Med. 57 (4), 791-797 (2007).
- Chen, R. Y., et al. Tissue-blood partition coefficient for xenon: temperature and hematocrit dependence. J Appl Physiol. 49 (2), 178-183 (1980).
- Möller, H. E., et al. Magnetic resonance angiography with hyperpolarized 129Xe dissolved in a lipid emulsion. Magn Reson Med. 41 (5), 1058-1064 (1999).
- Norquay, G., et al. Relaxation and exchange dynamics of hyperpolarized 129Xe in human blood. Magn Reson Med. 74 (2), 303-311 (2015).
- Zhang, L., et al. Absolute thermometry of human brown adipose tissue by magnetic resonance with laser polarized 129Xe. Commun Med. 3 (1), 147 (2023).
- Barshishat-Kupper, M., et al. Protein oxidation in the lungs of C57BL/6J mice following X-irradiation. Proteomes. 3 (3), 249-265 (2015).
- Olsson, L. E., et al. Measurement of MR signal and T2* in lung to characterize a tight skin mouse model of emphysema using single-point imaging. J Magn Reson Imaging. 25 (3), 488-494 (2007).
- Crowle, A. J. Delayed hypersensitivity in mice. J Allergy. 30 (2), 151-164 (1959).
- Guo, J., Cao, X., Cleveland, Z. I., Woods, J. C. Murine pulmonary imaging at 7T: T2* and T1 anisotropic UTE. Magn Reson Med. 79 (4), 2254-2264 (2018).
- Sonobe, T., et al. Imaging of the closed-chest mouse pulmonary circulation using synchrotron radiation microangiography. J Appl Physiol. 111 (1), 75-80 (2011).
- Wang, W., et al. Imaging lung microstructure in mice with hyperpolarized 3He diffusion MRI. Magn Reson Med. 65 (3), 620-626 (2011).
- Ouriadov, A. V., et al. Application of a stretched-exponential model for morphometric analysis of accelerated diffusion-weighted 129Xe MRI of the rat lung. Magn Reson Mater Phy. 34 (1), 73-84 (2021).
- O'Halloran, R. L., Holmes, J. H., Altes, T. A., Salerno, M., Fain, S. B. The effects of SNR on ADC measurements in diffusion-weighted hyperpolarized He-3 MRI. J Magn Reson. 185 (1), 42-49 (2007).
- Moller, H. E., Cleveland, Z. I., Driehuys, B. Relaxation of hyperpolarized 129Xe in a deflating polymer bag. J Magn Reson. 212 (1), 109-115 (2011).
- Reiss, L. K., Kowallik, A., Uhlig, S. Recurrent recruitment manoeuvres improve lung mechanics and minimize lung injury during mechanical ventilation of healthy mice. PLoS One. 6 (9), e24527 (2011).
- Cagle, L. A., et al. Effects of positive end-expiratory pressure and recruitment maneuvers in a ventilator-induced injury mouse model. PLoS One. 12 (11), e0187419 (2017).
- Cannizzaro, V., et al. Lung volume recruitment maneuvers and respiratory system mechanics in mechanically ventilated mice. Respir Physiol Neurobiol. 169 (3), 243-251 (2009).
- Hohlbaum, K., et al. Impact of repeated anesthesia with ketamine and xylazine on the well-being of C57BL/6JRj mice. PLoS One. 13 (9), e0203559 (2018).
- Blevins, C. E., Celeste, N. A., Marx, J. O. Effects of oxygen supplementation on injectable and inhalant anesthesia in C57BL/6 mice. J Am Assoc Lab Anim Sci. 60 (3), 289-297 (2021).
- Cannizzaro, V., et al. Impact of supplemental oxygen in mechanically ventilated adult and infant mice. Respir Physiol Neurobiol. 165 (1), 61-66 (2009).
- Sembroski, E., Sanghavi, D. K., Bhardwaj, A. Inverse Ratio Ventilation. StatPearls Publishing. , (2023).
- Boros, S. J. Variations in inspiratory:expiratory ratio and airway pressure wave form during mechanical ventilation: the significance of mean airway pressure. J Pediatr. 94 (1), 114-117 (1979).
- Zheng, W., Cleveland, Z. I., Moller, H. E., Driehuys, B. Gradient-induced longitudinal relaxation of hyperpolarized noble gases in the fringe fields of superconducting magnets used for magnetic resonance. J Magn Reson. 208 (2), 284-290 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved