Method Article
成体マウスにおける側方尾静脈注射によるアデノ随伴ウイルスの一貫した送達
要約
ここでは、成体マウスにアデノ随伴ウイルス(AAV)を全身投与するためのマウス側尾静脈注射の最適化されたプロトコルについて詳しく説明します。さらに、AAV形質導入を評価するために一般的に使用されるアッセイのプロトコルについても説明します。
要約
多くの疾患は複数の臓器に影響を及ぼしたり、体のさまざまな領域に関与したりするため、さまざまな部位にある患部細胞を標的とする治療薬を全身的に送達することが重要です。静脈内注射は、全身への投与を目的とした治療を評価する前臨床試験で広く使用されている全身送達ルートです。成体マウスでは、マウスの外側尾静脈に治療薬を静脈内投与します。使いこなせば、尾静脈注射は安全で迅速であり、シンプルで一般的に入手可能なツールのみが必要です。しかし、尾静脈注射は技術的に困難であり、意図した用量を正確に送達するためには、広範なトレーニングと継続的な練習が必要です。
ここでは、私たちの経験と以前に他のグループから報告された推奨事項に基づいて開発した、詳細で最適化された側方尾静脈注射プロトコルについて説明します。マウスの拘束具とインスリン注射器以外に、このプロトコルでは、ほとんどのラボですぐに利用できる試薬と機器のみが必要です。このプロトコルに従うと、鎮静剤を投与していない7〜9週齢のマウスの尾静脈へのアデノ随伴ウイルス(AAV)の静脈内送達が一貫して成功することがわかりました。さらに、蛍光レポータータンパク質の組織学的検出と、AAV形質導入と生体内分布の評価に使用される二倍体ゲノム(vg/dg)定量化によるベクターゲノムの組織学的検出に最適化されたプロトコルについても説明します。このプロトコルの目標は、実験者が尾静脈注射を成功裏かつ一貫して簡単に行えるように支援することであり、これにより、技術を習得するために必要な練習時間を短縮できます。
概要
単一遺伝子性疾患は希少疾患の80%を占め、世界中で3億人が罹患しています1,2。現在、これらの非常に衰弱させる希少疾患の大部分に対して承認された治癒療法はありません1,2,3。しかし、単一遺伝子疾患は、機能不全の遺伝子を置換、補完、修正、または沈黙させることができる遺伝子治療の理想的な候補です4,5。現在、複数のベクターが開発され、特定の細胞タイプに遺伝子治療を送達するために使用されています4,6。そのベクターの1つがアデノ随伴ウイルス(AAV)です。AAVは非病原性パルボウイルスであり、遺伝子治療ベクターとしてますます使用されています7。他のウイルスベクターと比較して、AAVは免疫原性が低く、宿主ゲノムに組み込まれる可能性が低く、さまざまな組織で分裂細胞と非分裂細胞を効率的に形質導入する能力を持っています7,8。さらに、特異的な組織指向性や免疫原性をさらに低下させるなどの望ましい特性を持つAAVを設計および同定するための複数のアプローチが開発されており、これにより、さまざまな適応症のウイルスベクターとしてのAAVの汎用性が大幅に向上しています9。これらの要因により、AAVは広く研究されている遺伝子治療ベクターとなり、FDAが承認した複数のAAVベースの遺伝子治療の開発につながっています10。
マウスモデルは、in vivoで遺伝子治療の可能性を試験し、単一遺伝子疾患の病態メカニズムをよりよく理解するために一般的に使用されます。これは、マウスモデルがさまざまな条件の病状を再現していること、そのゲノムがヒトゲノムと類似していること、マウスの取り扱い、維持、および世代が比較的容易であることによるものです11,12,13。in vivo試験は、筋ジストロフィーなど、体の複数のシステムや領域に影響を与える疾患を研究する場合に特に重要です。これらの疾患については、in vitro試験では、全身投与後にさまざまな身体領域に到達することを意図した治療薬の安全性、有効性、薬物動態、および薬力学を包括的に評価するには不十分である可能性がある14。
薬物の送達には、さまざまな全身投与経路を使用することができます。各ルートには、その利点、欠点、および調査対象の動物モデルおよび薬物との適合性の程度があります15。静脈内(IV)側方尾静脈注射は、マウス16におけるAAVの全身送達に一般的に使用される経路である。側方尾静脈注射は、マウスの血流への注射液の迅速かつ直接的な投与を可能にし、体循環における高い薬物バイオアベイラビリティを確保する17。また、比較的単純で一般的に利用可能なツールを実行する必要があります。しかし、主に尾静脈の直径が小さく、静脈の位置を特定するのが難しいため、側方尾静脈注射は技術的に困難であり、注射の試みの失敗や不完全な用量送達を避けるために、高度なスキルと絶え間ない練習が必要です16,17,18,19。これらは、高価な試薬の損失や不正確な結果につながる可能性があります。特に、注入中に不完全な注入が認識されない場合です。ここに要約された私たちの経験は、私たちが使用に適応した十分に文書化された記事で報告されたプロトコルに基づいており、側尾静脈注射手順のさまざまなステップを最適化して、一貫して成功した注射を保証します20,21,22,23,24,25,26,27。
ここでは、シンプルで一般的に利用可能なツールを使用して、鎮静剤を投与していない7〜9週齢のマウスにAAVを送達するための、この詳細に最適化された側尾静脈注射プロトコルについて説明します。さらに、AAVの送達と生体内分布の評価に使用される方法のプロトコルを提供します。これらのプロトコルは、注射後の組織収集、組織固定、DNA抽出、および二倍体ゲノム(vg/dg)定量化あたりのデジタルポリメラーゼ連鎖反応(dPCR)ベクターゲノムをカバーしています。ここで提供されるIV注射プロトコルと指針は、側方尾静脈注射を成功裏に行うことの容易さを高めることを目的としています。これにより、注射技術の習得に必要な時間を短縮すると同時に、注射の精度と一貫性を向上させることができる可能性があります。
プロトコル
すべての動物の取り扱いと注射の手順は、NINDSの動物管理委員会によって承認されました。すべての動物処置は、NINDSの動物管理および使用ガイドラインに準拠して実施されました。
1.プレインジェクションの準備
- AAV用量調製
- 注射するマウスの平均体重を決定します。
- 式(1)に示すように、施設の動物管理ガイドラインに従って、最大許容注入量を計算します。最大注入液量は、通常、容量(μL)/マウス体重(g)値(例:10μL/g)です。
最大注入液量 (μL)/マウス= (最大注入液量 (μL/g)) × (マウスの平均重量 (g)) (1)
注:サンプル計算:最大注入量/マウス= 10μL / g×20g /マウス= 200μL /マウス - マウスごとに送達されるAAVベクターゲノム(vg)の線量を設定します。
注:これは、異なるマウス間で同じ絶対値である可能性があります(たとえば、各マウスの重量に関係なく、すべてのマウスは1.5×1012 vgを受け取ります)。または、用量がvg / kgである可能性があるため、マウスごとに注射される合計vgは、注射日のマウスの体重に応じて各マウスについて計算する必要があります。- 用量がvg / kgの場合は、投与準備の前の注射日に各マウスの体重を量ります。.
- 式(2)を使用して、各マウスに送達されるベクターゲノムをその体重に応じて計算します。
特定のマウスに送達するベクターゲノム(vg)=あらかじめ規定されたvg/kg値(vg/kg)×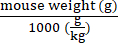 (2)
(2)
注:特定の前臨床試験では、vg /マウスの代わりにvg / kgを用量単位として使用する方が、注射された用量間の有効な比較を確保するためにより適切である可能性があります。.これは、同じ年齢のオスとメスのマウス間、またはおそらく同性のマウス間の体重差によるものです。 - 最大注入量と AAV (vg) 用量を使用して、必要な用量を調製するために必要なストック AAV と滅菌リン酸緩衝生理食塩水 (PBS) の量を計算します (式 (3-6) を参照)。注入する容量が、許容される最大注入量以下であることを確認してください。ピペッティングエラーやシリンジのデッドスペースを考慮して、注入する容量よりも少なくとも15 μL大きい注入液量を常に準備してください。
注入液の濃度 (vg/μL) =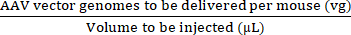 (3)
(3)
注入液を調製するために添加するAAVベクターゲノムの総量(vg)=注入液の濃度(vg/μL)×調製する容量(μL)(4)
注入液を調製するために添加するAAVストックの量)(μL)=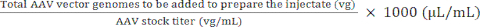 (5)
(5)
注入液を調製するために添加されるPBSの量(μL)=調製される容量(μL)-注入液を調製するために添加されるAAVストックの量(μL)(6)
注:サンプル計算:
6 × 1013 vg/kg (用量) は、25 g の重量のマウスで 200 μL/マウス (注入する容量) で送達されます。AAV ストック力価は 3.0 × 1013 (vg/mL) です。
この特定のマウスに送達されるベクターゲノム (vg) = 6 × 1013 (vg/kg) ×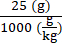 = 1.5 × 1012 vg
= 1.5 × 1012 vg
注入液の濃度=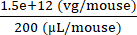 = 7.5 × 109 (vg/μL)
= 7.5 × 109 (vg/μL)
注入液を調製するために添加するAAVベクターゲノム総数 = 7.5 × 109 (vg/μL) × (200 (μL) + 15 (μL)) = 1.6125 × 1012 (vg)
注入液を調製するために添加するAAVストックの量 =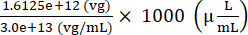 = 53.75 (μL)
= 53.75 (μL)
注入液を調製するために添加するPBSの量 = 215 (μL) - 53.75 (μL) = 161.25 (μL)
- AAV線量調製手順
注:AAVの取り扱いに関する施設のバイオセーフティおよびPPEガイドラインに従って、オートクレーブ滅菌RNaseフリーおよびDNaseフリーの1.7mL微量遠心チューブで、ステップ1.1.3.3の計算に従って、AAVストックと滅菌PBSを使用してAAV注入液を調製します。ストックAAVとAAV注入液は常に氷上に保管してください。清潔なマイクロピペットと新しいマイクロピペットチップボックスを使用して、無菌性を確保してください。AAVで汚染されたマイクロピペットの先端は、施設の廃棄物管理ガイドラインに従って廃棄してください。- ストックAAVを氷上で解凍します。
注意: AAVストックの解凍や再凍結は避けてください。AAVストックを100〜200μLのアリコートで注文または準備して、再凍結が必要になる用量調製後の過剰なAAVを回避します。
- ストックAAVを氷上で解凍します。
- インジェクションステーションの準備
- 清掃
- 70%エタノール(EtOH)で作業エリアを清掃します。
- 殺菌剤、殺菌剤、および殺ウイルス剤を使用して作業領域を消毒します。
- マウスチューブの拘束具を水と石鹸で洗浄します。
- ステーションツールのセットアップ
- 清潔な空の15 mLコニカルチューブをチューブホルダー/ラックに入れます。
- マウスチューブ拘束装置を設置する高架プラットフォームを設置します(図1A、B)。
- 清潔なマウスチューブの拘束具を作業エリアに置きます。
- 利用可能なマウスチューブ拘束具よりもはるかに小さいマウスを注射する場合は、プラスチック製のげっ歯類拘束コーンを使用して拘束スリーブを作成します。手順 2.1.3-4 を参照してください。
- 注射に使用するシリンジを作業エリアに置きます。29Gの針が付いた0.3mLのインスリン注射器を使用します。.
- 廃棄物容器を注入ステーションのできるだけ近くに配置して、AAVで汚染されたツールをすぐに廃棄できるようにします。
- 各シリンジのプランジャーを複数回引っ張ったり押したりして、プランジャーがスムーズに動くことを確認し、注射中にシリンジによる抵抗がないようにします。プランジャーがスムーズに動かない場合は、このシリンジを廃棄して新しいシリンジと交換してください。
- マウススケールとミニ遠心分離機を注入エリアの隣に用意します。
- 準備したAAV on iceを注入エリアに用意します。
- 温水(38-40°C)を準備します。マウスの尻尾に火傷を負わせないように、水温が40°Cを超えないように注意してください。
- 清掃
2.注入手順
- マウスの拘束
- 必要に応じて、各マウスの体重を量り、投与量をvg / kgで計算します。
- マウスが完全に拘束され、動かないことを確認します。
注意: マウスが完全に拘束されていない場合、IV投与中にマウスが動き、針がずれる可能性があります。.これにより、針が静脈から外れたり、マウスが怪我をしたりする可能性があります。 - チューブ拘束具の場合:
- マウスの間に温水と石鹸でレストレインを洗い、ホルダーを清掃して温めます。
- マウスの尻尾を持ちます。マウスのテールをチューブの上部開口部に挿入します。次に、マウスをゆっくりとチューブ拘束装置に引き込みます。チューブ拘束具のサイズがマウスのサイズに適している場合は、マウスが逃げないようにプラグをマウスの前に置きます。
注意: プラグは、マウスがチューブ内で移動したり回転したりしないように、マウスに十分に近づける必要がありますが、マウスが自由に呼吸できるように、プラグがマウスの鼻を遮らないようにする必要があります。マウスがチューブ拘束具のサイズよりも小さい場合は、以下の手順2.1.4で説明するように、チューブ拘束具に加えて柔軟な使い捨て拘束コーンを使用します。
- 必要に応じて、柔軟な使い捨て拘束コーンの場合(小型マウス用の拘束スリーブを作るため):
- コーンの鼻端に切り込みを入れて、マウスの鼻が塞がれず、マウスが呼吸するのに十分なスペースがあることを確認します。
- コーンがマウスとほぼ同じ長さになるように(コーンがチューブ内に収まるように)コーンの背面をカットします(図1A、B)。
- 上記の手順2.1.3で説明したように、マウスをチューブ拘束装置に入れます。マウスのテールを保持しながら、開口部の広い側から最初にレストレインコーンをチューブに挿入します。
- マウスの尾を保持しながら、マウスをコーンに歩かせます。次に、コーンの残りの部分をチューブにスライドさせます。マウスの尾がチューブの後ろから完全に出ていること、およびマウスがコーン内で呼吸するスペースがあることを確認してください。
- チューブプラグをコーンの鼻の開口部のすぐ前に固定し、マウスが完全に拘束され、呼吸するのに十分なスペースがあることを確認します。
- マウスの注入
- 15 mLのコニカルチューブに温水を入れます。
- マウスを入れたチューブ拘束装置を高架プラットフォームに置きます(図1B)。
- 拘束したマウスの尾を、側静脈がはっきりと拡張して見えるようになるまで、少なくとも1分間、温水にできるだけ浸します(図1B)。
- テールウォーミングステップ中に、AAV用量をシリンジにロードします。
- キャップなしのAAV含有1.7 mL微量遠心チューブをチューブラックに入れます。利き手で針をチューブに垂直に挿入します。針がチューブの内側に入ったら、利き手ではない手でチューブを持ちます。
注意: 針を垂直に挿入することで、チューブ壁に触れることによる針の損傷を防ぎます。他の代替シリンジローディング方法を使用することもできますが、実験者と注射されたマウスの安全性を確保する必要があります。利き手ではない手でチューブを保持すると、チューブを保持したまま針を挿入した場合に、偶発的な針穿刺による怪我を防ぐことができます。 - 針をチューブの内側に置き、針がチューブの壁に触れないようにしながら、チューブとシリンジを同時に目の高さまで上げます。両腕をテーブルに置いて安定させます。ゆっくりと用量をシリンジに引き込みます。.
注意: ゆっくりと吸引すると、細かい気泡がシリンジバレルの側面に付着するのを防ぎます。 - シリンジから気泡を排出します。AAVを注入する場合は、バイオハザードボックスに廃棄される使い捨ての吸収パッドを介して、気泡がシリンジから排出されていることを確認してください。
- 注入液を少なくとも40秒間保持して温めます。.
注意: 注入する前に、注入液が温かいことを常に確認してください。コールドインジェクションを投与すると、最初の数μLを除いて、インジェクションが静脈を通らない可能性があります。 - 毎分尾静脈をチェックしてください。
注:静脈は注射部位まで非常に見える必要があります(尾部を温める時間を追加し、静脈がはっきりと見えるまで必要に応じて新鮮な温水と交換しますが、施設の動物取り扱いプロトコルで許可されているマウスの拘束時間を超えないようにします)。 - 静脈がはっきりと見えることを確認した後、高架プラットフォームの上部からチューブ拘束装置を取り外し、チューブ拘束装置を直接テーブルの上に置きます。マウスを足を横ではなく下にして、マウスをレストレインに配置して、テールを簡単に取り扱えます。
注意: マウスを横にしたり、拘束装置の内側に戻したりしないでください。マウスは完全に拘束されており、拘束装置内で移動または回転したり、テールを動かしたり引っ張ったりすることはできません。 - 尾をガーゼですばやく拭いて、尾を乾かします。アルコール綿棒で尾を拭き、乾いたガーゼで拭いて乾かします。
注意: 乾いたガーゼを使用して、テールをしっかりとつかむのに十分なほど乾かしますが、完全に乾くことはありません。尾が完全に乾いていると、静脈が見えにくくなることがあります。 - テールを左または右に約90°回転させて、2つの側静脈の1つが上を向くようにします。尾部の中央3分の1以内に適切な注入部位を見つけます。最初の注射を遠位 (尾の先端に近い) に開始し、試行の失敗により追加の注射が必要な場合、または実験デザインで必要になった場合は、近位に移動します。
注意: 注入液がその前の注入部位から漏れる可能性があるため、前の注入部位の遠位に注入しようとしないでください。.オプション:利き手ではない手の親指と人差し指を使用して、注射部位の近位(上流/マウス体に近い)に10秒間圧力をかけます。指は止血帯として機能し、注射部位の静脈をさらに拡張します。10秒止血帯の直後に、止血帯の指を放し、2つの側静脈の1つが上を向いていて、はっきりと見えることを確認します。 - 親指と人差し指を使用して、注射部位のすぐ遠位にある利き手ではない手で尾を持ちます。尾を人差し指の上に折りたたんで、注射部位が人差し指の上に平らになるようにします。テールを引き戻して、テールを引き伸ばし、注入部位が完全に水平(0°)になるようにします(水平テーブルと平行)(図1C)。
- シリンジのバレルフランジの両側にある利き手の人差し指と中指を使用してシリンジを持ち、親指をプランジャーで準備したままにします。
注意: これにより、針が静脈の内側に入ったら、親指や針を動かさないようにしやすくなります(図1C)。 - 両手をテーブルに置いて安定させ、針を尾と静脈と平行に直接置き、斜角を上に向けて置きます。注入部位を人差し指に近づけてテールを保持し、注入部位の制御と安定性を向上させます。
注意: チューブ拘束具は、両手がテーブルで支えられるように、テーブル内で十分に深くする必要があります。 - 針を尾静脈と平行に保ち、針に下向きの圧力をかけながら、針を静脈内に前方にスライドさせます。
注意: 下向きの圧力は、針を正しい角度で静脈に挿入するのに十分である必要があります。静脈は非常に浅いため、静脈に入ろうとするときは針をできるだけ平らにする必要があります。 - 溶液をゆっくりと静脈に注入します。用量を投与した後、ゆっくりと針を引き抜き、直ちに注射部位にガーゼで少なくとも10秒間圧力を加えて出血を止めます。.
注:注入された試薬の損失の可能性を避けるために、出血が完全に止まるまで必要なだけ圧力をかけます。通常、針を抜いた後、針が静脈を貫通したことを示す血液滴が現れます。時折、注射が成功しても血滴が現れないことがあります。血液滴は注射が成功したことを示すものではありません。針が静脈を貫通したことを示しているだけです。信頼性の高い成功した注入指標は、注入中にプランジャー抵抗がまったくないことです。針が静脈内にある場合、注射液の注入中に針プランジャーに抵抗があってはならず、注射部位の近位にある静脈は一時的にわずかに色が薄く見えます(ブランチング)(静脈のブランチングは、一部のマウス株ではあまり明確でない場合があります)。抵抗がある場合、および/または注射部位に膨らみが現れ始めた場合、針は静脈内に正しく配置されていません。これが発生した場合は、尾から針を完全に取り外し、失敗した注射部位の近位(マウスの体に近い)の新しい注射部位に静脈を注入してみてください。 - AAVで汚染された注射器とチューブは、機関の廃棄物管理ガイドラインに従って廃棄してください。
- マウスを拘束具から解放し、注射していないマウスとは別の新しいケージに戻します。マウスを10分間監視して、注射後の正常な活動レベルを確認します。
注:これにより、感染性薬剤が投与された場合、注射された薬剤が注射されていないマウスに感染する可能性が回避されます。. - 殺菌剤、殺菌剤、殺ウイルス剤、および70%EtOHを使用して作業領域を消毒します。マウスチューブの拘束具を水と石鹸で洗浄します。
- キャップなしのAAV含有1.7 mL微量遠心チューブをチューブラックに入れます。利き手で針をチューブに垂直に挿入します。針がチューブの内側に入ったら、利き手ではない手でチューブを持ちます。
3. 解剖と組織採取・固定27
- 組織採取ステーションの準備
- 製造元の指示に従って、作業ステーションをDNA分解試薬で洗浄し、作業領域に存在する可能性のある汚染DNAを分解します。
- メチルブタンを金属容器に入れます。メチルブタン金属容器を発泡スチロールの箱の中に入れます。次に、金属製の容器をドライアイスで囲み、容器を囲むドライアイスのレベルが容器内のメチルブタンレベルよりも高くなるようにします。
- 空の2 mL微量遠心組織保存チューブにラベルを付け、ドライアイスの上に置きます。メチルブタンと組織保存チューブをドライアイスで少なくとも20分間冷ましてから、組織の凍結を開始します。組織移植鉗子をドライアイスの上に置きます。
- 2 mLの微量遠心組織保存チューブの別のセットを標識して、新鮮な4%パラホルムアルデヒド(PFA)を充填し、室温で保管します。チューブに入れる組織を完全に沈めるために、各チューブに十分な4%PFAを加えます。
- 組織の収集と固定
- 施設の動物管理ガイドラインに従ってマウスを安楽死させます。
注:ここでは、マウスは子宮頸部脱臼を使用して安楽死させられました。 - マウスに70%EtOHを完全にスプレーします。
- 必要なティッシュを収集します。
注:ここで説明する収集および固定プロトコルは、骨格筋および肝臓で試験された。 - DNA抽出に使用される組織の場合:
- ドライアイスの上で予冷したメチルブタンに組織を落とし、組織をメチルブタンに少なくとも1分間放置します。予め冷却された移載鉗子を使用して、凍結組織をメチルブタンから予め冷却された空の2mL微量遠心組織保存チューブに移します。ティッシュは-80°Cで保存してください。
注:オプション:組織を20 mgに切断してからメチルブタンに滴下し、ステップ4.1.4で使用する準備を整えることができます。
- ドライアイスの上で予冷したメチルブタンに組織を落とし、組織をメチルブタンに少なくとも1分間放置します。予め冷却された移載鉗子を使用して、凍結組織をメチルブタンから予め冷却された空の2mL微量遠心組織保存チューブに移します。ティッシュは-80°Cで保存してください。
- 組織学的解析およびレポータータンパク質の蛍光保存に使用される組織の場合:
- 室温に保たれたPFA指定の鉗子を使用して、4%PFAを含むそれぞれの微量遠心チューブ(室温で保存)に組織を落とし、組織が4%PFA溶液に完全に浸されていることを確認します。
注:PFA汚染は、さまざまなダウンストリーム分子アッセイに悪影響を与える可能性があります。PFAを取り扱うときは、他の組織や器具のPFA汚染を防ぐために、PFA指定の鉗子のみを使用してください。 - マイクロ遠心チューブをラックに置き、ラックをホイルペーパーで覆ってチューブを暗く保ちます。蓋付きのラックをシェーカーで4°Cでインキュベートし、一晩穏やかに振とうします。
- 一晩インキュベートした後、5.0 gのスクロースを70 mLの1x PBSに激しく振とうして、5%スクロース(% w/v)を1x PBSに調製します。最終総容量100 mLに十分な量の1x PBSを添加して、5%ショ糖溶液(% w / v)を得ます。
- 0.22 μmシリンジフィルターを使用して5%スクロース溶液を滅菌します。2.0 mLの微量遠心チューブを標識し、新たに調製した5%スクロースを充填します。
- 組織を4%PFAから5%スクロースを含むそれぞれの微量遠心チューブ(室温で保存)に移し、組織が5%スクロース溶液に完全に浸されていることを確認します。
- マイクロ遠心チューブをラックに置き、ラックをホイルペーパーで覆ってチューブを暗く保ちます。蓋付きのラックをシェーカーで4°Cでインキュベートし、一晩穏やかに振とうします。
- 一晩インキュベートした後、20.0 gのスクロースを70 mLの1x PBSに激しく振とうして、20%スクロース(% w / v)を1x PBSに調製します。最終総容量100 mLに十分な量のPBSを1倍加えると、20%ショ糖溶液(% w/v)が得られます。
- 0.22 μmシリンジフィルターを使用して20%ショ糖溶液を滅菌します。2.0 mLの微量遠心チューブを標識し、新たに調製した20%スクロースを充填します。
- 組織を5%スクロースから20%スクロースを含むそれぞれの微量遠心チューブ(室温で保持)に移し、組織が20%スクロース溶液に完全に浸されていることを確認します。
- マイクロ遠心チューブをラックに置き、ラックをホイルペーパーで覆ってチューブを暗く保ちます。蓋付きのラックをシェーカーで4°Cでインキュベートし、一晩穏やかに振とうします。
- 一晩インキュベートした後、メチルブタンを金属容器に入れ、メチルブタン金属容器を発泡スチロールボックスに入れます。金属製の容器をドライアイスで囲み、容器を囲むドライアイスのレベルが容器内のメチルブタンレベルよりも高くなるようにします。
- 空の2 mL微量遠心組織保存チューブにラベルを付け、ドライアイスの上に置きます。メチルブタンと組織保存チューブをドライアイスで少なくとも20分間冷ましてから、組織の凍結を開始します。トランスファー鉗子をドライアイスの上に置きます。
- 精密ワイプを使用して組織をすばやく拭き取り、余分な20%のスクロースを取り除きます。ドライアイスで予冷したメチルブタンに組織を落とします。組織をメチルブタンに少なくとも1分間放置します。
- 予め冷却された移載鉗子を使用して、凍結組織をメチルブタンから予め冷却された空の2mL微量遠心組織保存チューブに移します。ティッシュは-80°Cで保存してください。
- 室温に保たれたPFA指定の鉗子を使用して、4%PFAを含むそれぞれの微量遠心チューブ(室温で保存)に組織を落とし、組織が4%PFA溶液に完全に浸されていることを確認します。
- 施設の動物管理ガイドラインに従ってマウスを安楽死させます。
4. vg/dg定量のためのdPCR
- 組織からのDNA抽出と初期RNA消化
注: 材料の表 に記載されているDNA抽出キットのハンドブックを使用して、このDNA抽出プロトコルを導き出しました。凍結したティッシュピースの入ったチューブは、必ずドライアイスの上に置いてください。- 氷のバケツを準備します。
- 各DNAサンプルについて、1.5 mL溶解ビーズチューブ1本と空のRNaseフリーおよびDNaseフリーの1.7 mL微量遠心チューブ2本を標識します。
- 第1のDNA抽出キットバッファー180 μLを各ビーズチューブに加えます。バッファーを含む最初のビーズチューブを風袋引きします。
注:手順3.2.4.1で組織を事前にカットしなかった場合、ドライアイスで事前に冷却したかみそりの刃を使用して、組織を20 mgにカットします。このステップは、-20°C以下に保たれた清潔なクライオスタット内で行う必要があります。 - チューブにティッシュを1枚加えます。組織の重量を量り、記録します(~20mg)。
- すぐに組織を入れた溶解ビーズチューブを氷の上に置きます。バッファーが結晶化する可能性があります。
- 各組織サンプルについて、前の手順を繰り返します。
- チューブを溶解ビーズチューブブレンダーに移し、4°Cで最高速度(速度10)で1分間運転します。
- サンプルを氷上に置いて、遠心分離機に移します。20,000 × g 、4°Cで1分間遠心分離します。
- 遠心分離ステップでは、20 μLのプロテイナーゼKを1.7 mLの微量遠心チューブの最初のシリーズに加えます。遠心分離ステップの後、ホモジネートの上清をプロテイナーゼKを含む1.7 mLチューブに移し、よく混合します。500 RPMを混合しながら、56°Cで15分間インキュベートします。
- ミニ遠心分離機を使用してチューブを1〜2秒間遠心分離することにより、チューブの壁と蓋から液滴を収集します。室温で2分間インキュベートします。
- 4 μLのRNase Aを加え、短時間のパルスボルテックスで混合します。室温で2分間インキュベートします。パルス渦15秒。
- ミニ遠心分離機を使用してチューブを1〜2秒間遠心分離することにより、チューブの壁と蓋から液滴を収集します。2つ目のDNA抽出キットバッファー200μLを添加します。パルス渦15秒。
- ミニ遠心分離機を使用してチューブを1〜2秒間遠心分離することにより、チューブの壁と蓋から液滴を収集します。100% EtOHを200 μL加えます。パルス渦15秒。
- ミニ遠心分離機を使用してチューブを1〜2秒間遠心分離することにより、チューブの壁と蓋から液滴を収集します。ライセートをDNA抽出スピンカラムに移します。6,000 × g で1分間撹拌します。
- スピンカラムを新しいコレクションチューブに入れます。3つ目のDNA抽出キットバッファー500 μLをスピンカラムに加えます。6,000 × g で1分間撹拌します。
- スピンカラムを新しいコレクションチューブに入れます。4つ目のDNA抽出キットバッファー500 μLをスピンカラムに加えます。20,000 × g で3分間遠心します。
- スピンカラムを新しい1.7 mL微量遠心チューブに入れます。100 μLの分子グレードの水をスピンカラムに加えます。室温で1分間インキュベートします。6,000 × g で室温で1分間遠心します。
- 必要に応じてDNA濃度を測定します。短期保存の場合は4°C、長期保存の場合は-20°Cで保存してください。
- FACS選別細胞からのDNA抽出
注: 材料の表 に記載されているDNA抽出キットのハンドブックを使用して、このDNA抽出プロトコルを導き出しました。- 細胞を選別した後、サンプルを300 × g で5秒間遠心分離し、側面と蓋のすべての滴を収集します。すべてのドロップが収集されていることを確認します。
注:サンプル量が1.5 mL未満の場合は、次の手順に直接進んでください。サンプル量が1.5 mLを超える場合は、マイクロピペットを使用して上清の上部を慎重に取り除き、サンプルを1〜1.5 mL残して廃棄します。 - ピペッティングを複数回上下させてサンプルを混合し、サンプルを1.7 mLの微量遠心チューブに移します。515 × g で室温で1分間遠心分離します。
- 最後の50 μLを除いて上清を捨て、ペレットを最初のDNA抽出キットバッファーの50 μLに再懸濁して、最終容量を100 μLにします。
- 少量の血液からゲノムDNAを単離するためのメーカーのプロトコルに従ってください( 材料の表を参照)。
- 10 μL のプロテイナーゼ K と 100 μL の 2 つ目の DNA 抽出キットバッファーを添加します。パルスボルテックスで15秒間混合します。サンプルを56°Cで10分間インキュベートし、300RPMで混合します。このインキュベーション期間中に、サンプルを穏やかに反転して2回混合します。
- ミニ遠心分離機を使用してチューブを1〜2秒間遠心分離することにより、チューブの壁と蓋から液滴を収集します。50 μLの100% EtOHを加え、パルスボルテックスで15秒間混合します。サンプルを室温で5分間インキュベートします。
- ミニ遠心分離機を使用してチューブを1〜2秒間遠心分離することにより、チューブの壁と蓋から液滴を収集します。リムを濡らさずに、サンプルをDNA抽出カラム(カラムは2 mLコレクションチューブに入れられています)に移します。6,000 × g で1分間遠心分離します。
- カラムを清潔な2 mLの収集チューブに入れた後、フロースルーを含む収集チューブを廃棄します。3つ目のDNA抽出キットバッファー500 μLをリムを濡らさずにカラムに加え、6,000 × g で1分間遠心分離します。
- 再度、カラムを清潔な 2 mL の収集チューブに入れた後、フロースルーの入った収集チューブを廃棄します。4つ目のDNA抽出キットバッファー500 μLをリムを濡らさずにカラムに加え、6,000 × g で1分間遠心分離します。
- カラムを清潔な 2 mL コレクションチューブに入れ、フロースルー含有コレクションチューブを廃棄します。20,000 × g で3分間遠心分離します。
- カラムを清潔な 1.7 mL 微量遠心チューブに入れ、フロースルー含有コレクションチューブを廃棄します。溶出のためにカラムメンブレンの中心に20 μLの分子グレードの水を加えます。蓋を閉め、サンプルを分子グレードの水と室温で5分間インキュベートします。
- 20,000 × g で1分間遠心分離します。溶出したDNAは、短期保存の場合は4°C、長期保存の場合は-20°Cで保存してください。
- 細胞を選別した後、サンプルを300 × g で5秒間遠心分離し、側面と蓋のすべての滴を収集します。すべてのドロップが収集されていることを確認します。
- RNAの消化とクリーンアップ
注: 材料の表 に記載されているDNA抽出キットのハンドブックを使用して、このDNAクリーンアッププロトコルを導き出しました。dPCRの条件、試薬、プライマーやプローブの設計によっては、dPCR vg/dgの定量に進む前に、DNAサンプル中にRNAが完全に存在しないことを確認する必要がある場合があります。RNAコンタミネーションは、特定のdPCR条件下でさまざまな程度の不正確なvg/dg値を引き起こす可能性があります。- 0.2 mL PCRチューブまたは1.7 mL微量遠心チューブに、抽出したDNAサンプルを最大20 μL、DNaseフリーRNaseを1.5 μLずつ各DNAサンプルに加えます。DNA/RNaseの混合量が21.5 μL未満の場合は、最終容量の21.5 μLまで十分な分子グレードの水を加え、チューブを反転させて25倍に混合します。チューブを反転させて10分ごとに定期的に混合しながら、37°Cで30分間インキュベートします。
注:チューブに添加される核酸の総量は、175 ngから700 ngの間である必要があります。DNAサンプルにこの範囲外のボリュームまたは核酸量が含まれている場合、またはDNAサンプルが異なる方法で単離された場合は、修正が必要になることがあります。 - 氷の上に2分間置きます。各DNA/RNaseミックスに十分な分子グレードの水を加えて、最終容量を100 μLにします。
注:ここにリストされているRNaseは、標的DNAやダウンストリームのPCRアッセイに悪影響を与えることなく、汚染されたRNAを消化するため、推奨されます。 - ゲノムDNAのクリーンアップについては、製造元のプロトコルに従ってください( 材料の表を参照)。
- 第1のDNA抽出キットバッファー10μLと第2のDNA抽出キットバッファー250μLを添加します。パルスボルテックスで10秒間混合します。
- リムを濡らさずに、サンプルを2 mLコレクションチューブ内のDNA抽出カラムに移します。6,000 × g で1分間遠心分離します。
- カラムを清潔な2 mLの収集チューブに入れた後、フロースルーを含む収集チューブを廃棄します。2つ目のDNA抽出キットバッファー500 μLを、リムを濡らさずにカラムに加えます。6,000 × g で1分間遠心分離します。
- カラムを清潔な 2 mL コレクションチューブに入れ、フロースルー含有コレクションチューブを廃棄します。20,000 × g で6分間遠心分離します。
- カラムを清潔な 1.7 mL 微量遠心チューブに入れ、フロースルーの入った回収チューブを廃棄します。カラムメンブレンの中央に20 μLの分子グレードの水を加えて溶出させ、蓋を閉めて、サンプルを分子グレードの水と室温で5分間インキュベートします。
- 20,000 × g で1分間遠心分離します。短期保存の場合は4°C、長期保存の場合は-20°Cで保存してください。
- エンドポイント PCR、dPCR、または定量的 PCR(qPCR)により、単一のエクソンだけでなく複数のエクソンにまたがる mRNA 領域を増幅する PCR プライマーペアを使用して、RNase 消化サンプルに RNase コンタミネーションがないことを確認します。
注:mRNAターゲットは、mRNAコンタミネーションが存在する場合に正しく識別されるように、ターゲット組織/細胞タイプで高度に発現する遺伝子である必要があります。複数のエクソンにまたがるアンプリコンは、mRNAの汚染に起因するバンドとゲノムDNAの混入によって生じるバンドを区別します。PCR反応のポジティブコントロールとして、RNaseで消化されていないDNAサンプルを常に用意し、mRNAコンタミネーションが存在する場合に検出されるようにします。
- 0.2 mL PCRチューブまたは1.7 mL微量遠心チューブに、抽出したDNAサンプルを最大20 μL、DNaseフリーRNaseを1.5 μLずつ各DNAサンプルに加えます。DNA/RNaseの混合量が21.5 μL未満の場合は、最終容量の21.5 μLまで十分な分子グレードの水を加え、チューブを反転させて25倍に混合します。チューブを反転させて10分ごとに定期的に混合しながら、37°Cで30分間インキュベートします。
- デジタルPCR(dPCR)
- プライマーの特異性と最適なPCR条件を確認するためのエンドポイントPCR(オプション)
- ベクターゲノム用のdPCRプライマーペアとプローブ、およびサンプル中の二倍体ゲノムの定量に使用されるマウス参照遺伝子用のdPCRプライマーペアとプローブを設計します。
注:アンプリコンサイズは60 bpから150 bpを目標にしてください。マウス参照遺伝子は、二倍体ゲノムごとに一定の遺伝子コピー数を持つ遺伝子である必要があります。ここにリストされている計算では、参照遺伝子(Polr2a)は二倍体ゲノムごとに2つのコピーを持っています。 - 10 μLのエンドポイントPCR反応では、後でdPCR反応に使用する試薬と最終濃度を使用してPCRミックスを調製します。DNAポリメラーゼとdNTPを含む最終濃度の1x dPCRマスターミックス、各フォワードプライマー0.8 μM、各リバースプライマー0.8 μM、各プローブ0.4 μM、および制限酵素0.025 U/μLの最終濃度に、RNase消化テンプレートDNAサンプル(核酸量範囲56-223 ng)を添加します(制限酵素の最終濃度は、使用する制限酵素とブランドによって異なります)。分子グレードの水を加えて、最終容量10 μLにします。
注:PCRミックスには、少なくとも2つのプライマーペアと2つのプローブが必要です:1つのプライマーペアと1つのプローブはベクターゲノムを検出し、1つのプライマーペアと1つのプローブはマウスゲノムを検出します。 - PCRサーマルサイクル条件:最初の熱活性化ステップを95°Cで2分間、続いて95°Cで25秒間の変性ステップを35〜45サイクル行い、58〜62°Cで1分間のアニーリング/伸長ステップの組み合わせを行います。
注:最適なアニーリング温度は、アンプリコンとプライマーのペアごとに決定する必要があります。サイクル数は、サンプル中のテンプレートDNAの量に応じて調整できます。 - ゲル電気泳動を用いてアガロースゲル上でPCR産物を可視化し、標的アンプリコンバンドの存在と非特異的増幅バンドの可能性を判定します。
- プライマーペアとサイクリング条件が標的配列の特異的な増幅をもたらすことを確認した後、次のdPCRステップに進みます。
- ベクターゲノム用のdPCRプライマーペアとプローブ、およびサンプル中の二倍体ゲノムの定量に使用されるマウス参照遺伝子用のdPCRプライマーペアとプローブを設計します。
- dPCR反応
- 40 μL dPCR反応の場合、最大4 μLのRNase消化テンプレートDNAサンプル(核酸量範囲50-330 ng)を、DNAポリメラーゼとdNTPを含む1x dPCRマスターミックスの最終濃度まで、各フォワードプライマー0.8 μM、各リバースプライマー0.8 μM、各プローブ0.4 μMを加えます。 0.025 U/μLの制限酵素(制限酵素の最終濃度は、使用する制限酵素とブランドによって異なります)。分子グレードの水を加えて、最終容量が40 μLになるようにします。
- dPCRサーマルサイクル条件:最初の熱活性化ステップを95°Cで2分間、続いて95°Cで25秒間の変性ステップを40〜50サイクル行い、58〜62°Cで1分間のアニーリング/伸長ステップの組み合わせを行います。
注:最適なアニーリング温度は、アンプリコンとプライマーのペアごとに決定する必要があります。サイクル数は、サンプル中のテンプレートDNAの量に応じて調整できます。ここに記載されている容量、濃度、および条件は、 材料表に記載されているdPCRプレート、試薬、およびデバイスに対して最適化されています。これらの条件は、反応の精度を低下させる可能性のある潜在的なdPCR阻害剤の影響を低下させます。 - dPCR反応を実行し、ベクターゲノムとマウス参照遺伝子の絶対値を取得した後、式(7-8)を使用してサンプル中のvg/dgを計算します。
2つの遺伝子コピー/二倍体ゲノムを持つ参照遺伝子の場合:
二倍体ゲノムの絶対値 (dg) =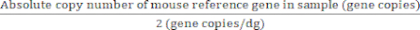 (7)
(7)
VG/DG =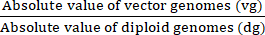 (8)
(8) - dPCR反応の1D散布図をチェックして、アッセイと定量の有効性を確認します(図3A、C)。アッセイを有効にするには、1D散布図が次のすべての基準を満たしていることを確認してください。正確な閾値の決定を可能にするために、正のパーティションと負のパーティションを明確に分離します。また、正のパーティションとネガティブなパーティションの間に液滴が存在しないか少ない(雨とも呼ばれます)ため、dPCR定量の精度が低下する可能性があります。
- プライマーの特異性と最適なPCR条件を確認するためのエンドポイントPCR(オプション)
結果
7〜9週齢の雄マウスに、1.5 ×1012 vg/マウスで側尾静脈注射を介してAAVを150〜200μLの注入液量で注入しました。ここで使用したssDNA AAVは、CMVプロモーターによって駆動されるCreリコンビナーゼ導入遺伝子を送達しました。注射されたマウスは、CreレポーターAi14対立遺伝子に対してホモ接合体でした。Creリコンビナーゼに曝露されると、Ai14対立遺伝子含有細胞は蛍光tdTomatoタンパク質を発現します。tdTomatoの発現はCreによるゲノム組換えによるものであるため、tdTomato発現細胞は、AAVによって直接形質導入された細胞、または形質導入された細胞の子孫細胞である細胞を示します。ここに示すデータは、160μL(5.8-5.9 ×10 13 vg/kg)で1.5 ×10 12 vg/マウスでAAV9-CMV-Creを注入したマウスのデータです。マウスは注射後28日で屠殺し、上記のように組織を採取した。いくつかの骨格筋と肝葉を消化し、それらの細胞をFACSを使用して収集しました。いくつかの肝葉は、核酸抽出のために予め冷却されたメチルブタンを使用してすぐに凍結されました。いくつかの骨格筋と肝葉は、蛍光tdTomatoの組織学的イメージングのために固定凍結されました。tdTomatoは、肝臓(図2A)と大腿四頭筋(図2C)全体にびまん性に発現しており、AAV9が両組織の異なる領域に広く到達し、形質導入したことを示しました。
新鮮凍結肝臓およびFACS選別細胞から抽出したDNAを用いて、dPCRを用いてvg/dgを定量した。Vg/dg定量は、分析されたサンプル中のAAVの注入の一貫性と形質導入効率を評価するために使用できます。新鮮凍結肝臓組織サンプルとFACSで選別された細胞からの1D液滴散布図を使用して、アッセイの有効性を確認しました(図3A、C)。散布図では、正と負のパーティションの存在、検出閾値を正確に決定できる正のパーティションとネガティブなパーティション間の明確な分離、および正のパーティションと負のパーティションの間に液滴が存在しないか少ないことが示されました。これにより、dPCRアッセイの精度が低下する可能性があります。これらすべての基準を満たすことは、dPCRアッセイの結果が有効であることを示しました。各サンプル中の Polr2a 遺伝子コピー数を定量化してマウス二倍体ゲノムの数を決定し( 2 Polr2a 遺伝子コピー/マウス二倍体ゲノム)、Creリコンビナーゼ導入遺伝子配列に対するプライマー/プローブを使用してウイルスゲノムを定量しました(1 Transitionine copy/viral genome、 表1)。vg/dg値は、新鮮凍結肝臓組織サンプルおよびFACS選別細胞について定量化され、各サンプルにそれぞれ187.7 vg/dgおよび4.7 vg/dgが存在することが示されました(図3B、D)。PBSを注入したマウスおよび核酸を含まない非テンプレートコントロールのサンプルをネガティブコントロールとして使用した。

図1:静脈内注射ステーションの概要(A)IV注射を行うために必要なツール。ここに示されているのは、(1)タイマー、(2)マウスチューブ拘束具、(3)未カットおよび(4)カットプラスチック拘束コーン、(5)アルコール綿棒、(6)マウスチューブ拘束具を上昇させるためのプラットフォームとして使用される空のピペットチップボックス、(7)使い捨て吸収パッド、(8)温水入り15mLコニカルチューブ、(9)15mLチューブホルダー、(10)ガーゼ、(11)インスリン注射器です。(B)マウスは最初にチューブ拘束具の内側に配置されます。次に、マウスが小さすぎてチューブ拘束装置だけでは拘束できない場合は、カットされた拘束コーンを挿入してマウスの周りに拘束スリーブを作成します。マウスの呼吸が拘束具によって妨げられていないことを確認してください。チューブ拘束具は、マウステールを温水に配置できるように、高架プラットフォームの上部に配置されています。(C)注入を行う直前のマウステールの位置と針の保持角度。テールを引き戻してテールを伸ばし、注入部位が完全に水平になるようにします。針は尾と静脈に平行で、斜角は上を向いています。この図の拡大版を表示するには、ここをクリックしてください。
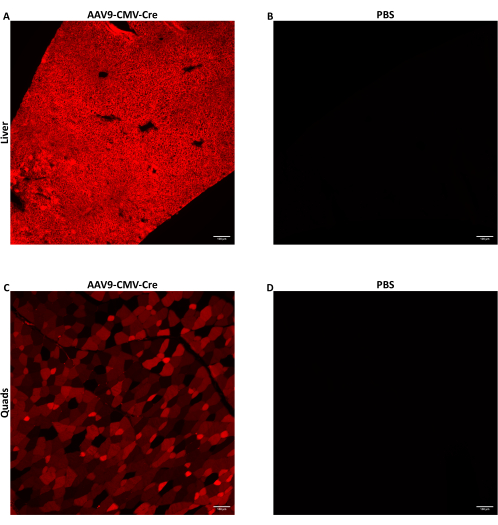
図2:IV注入後の蛍光レポータータンパク質の検出。CreレポーターAi14対立遺伝子を有する7〜9週齢の雄マウスに、160μL(5.8-5.9 × 1013 vg/kg)またはPBSで1.5 × 1012 vg/マウスのAAV9-CMV-CreをIV注射しました。Cre IV注射を投与するAAV9後のマウス(A)肝臓または(C)大腿四頭筋切片の代表的な蛍光画像。(B)PBSを注入したマウスの肝臓または(D)大腿四頭筋切片を、ネガティブコントロールとして機能するように画像化しました。組織は収集され、IV注射の28日後に固定凍結されました。Creばく露後、蛍光tdTomatoタンパク質は、形質導入細胞および形質導入細胞の子孫細胞で発現します。厚さ10μmの切片を10倍の倍率で画像化しました。スケールバー = 100 μm。この図の拡大版を表示するには、ここをクリックしてください。
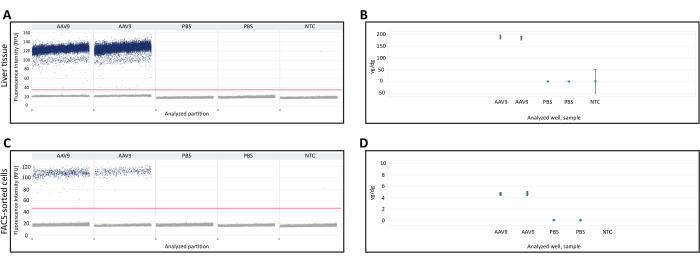
図3:二倍体ゲノムあたりのベクターゲノム(vg/dg)定量 (A)肝臓組織または(C)AAV9-CMV-CreまたはPBSを注射したマウスから採取したFACSソート細胞におけるdPCRベクターゲノム定量の1D散布図。散布図は、陽性と陰性のdPCRパーティション、およびサンプルを横切る水平線で示された検出しきい値を示しています。(B、D)(B)肝臓組織または(D)FACSで選別された細胞サンプル中のマウス二倍体ゲノムおよびベクターゲノムを定量した後のvg/dg定量。ここに示す結果は、AAV9を注入したマウス1匹とPBSを注入したマウス1匹と、各マウスにテクニカルdPCRの複製を行ったものです。エラーバーは、各サンプルの95%信頼区間を示します。略語: NTC= 非テンプレート制御;dPCR =デジタルPCR;FACS = 蛍光活性化細胞ソーティング。 この図の拡大版を表示するには、ここをクリックしてください。
| 入門 | 順序 |
| Cre フォワードプライマー | CTGACGGTGGGAGAATGTTAAT |
| Cre リバースプライマー | CATCGCTCGACCAGTTTAGTT |
| Cre プローブ | /56-FAM/CGCAGGTGT/ZEN/AGAGAAGGCACTTAGC/3IABkFQ/ |
| Polr2a フォワードプライマー | GACTCCTTCACTCACTGTCTTC |
| Polr2a リバースプライマー | TCTTGCTAGGCAGTCCATTATC |
| Polr2a プローブ | /5HEX/ACGAGATGC/ZEN/TGAAAGAGCCAAGGT/3IABkFQ/ |
表1:vg/dgの定量に使用したプライマーとプローブの配列。 Cre プライマーとプローブを使用して、ベクターゲノムを定量しました。 Polr2a プライマーとプローブを使用して、マウスの二倍体ゲノムを定量しました。
ディスカッション
AAVベースの治療法は、遺伝子治療ベクターとしてのAAVの汎用性により、単一遺伝子障害に対して大きな可能性を秘めており、これにより、さまざまな障害の様々な送達ニーズに合わせてAAVをカスタマイズすることが可能になる4,5,7,9。AAVは、一般的に前臨床マウスモデルでIV注射を介して投与され、潜在的な治療法の安全性と有効性をテストします16。異なる注入されたAAV用量は、実験結果に顕著な違いをもたらす可能性があるので、生成されたin vivoデータ28の有効性および頑健性を確保するために、実験者が意図したAAV用量を一貫して注入できることが重要である。IV注射は広く使用されていますが、技術的には困難であり、注射を一貫して成功させるスキルレベルを開発および維持するために広範なトレーニングと継続的な練習が必要です16,17,18,19。AAVを正しく注入することに加えて、通常、注入されたAAVの生体内分布および標的組織または細胞への送達効率を評価するためにアッセイを使用することが望まれる29,30。
このプロトコルは、7〜9週齢の非鎮静マウスにAAVを投与するための最適化されたIV注射プロトコルの詳細を徹底的に説明することにより、実験者が簡単にIV注射を成功裏かつ一貫して行うのを支援することを目的としています。ここで使用される年齢範囲の野生型マウスよりも著しく小さいまたは大きいマウスは、静脈の視認性が低下したり、この方法で使用される拘束具と互換性がなくなったりするため、より大きな課題を提示する可能性があることに注意することが重要です。テールIV注射は、血管サイズが31と小さいため、生後6週未満のマウスに試薬を静脈内投与するのに適切ではないことが以前に報告されています。可能であっても、体重が22.0g未満のマウスに一貫して注射するのは難しいかもしれません。非定型サイズのマウスを使用する研究者は、手順に適応する必要があるかもしれません。このプロトコルでは、AAVの生体内分布と形質導入効率を評価するために使用できるいくつかのアッセイについても概説しています。
このプロトコルに従う際には、いくつかの重要な点に留意する必要があります。注射中、針が静脈内にない場合、29 Gの針はより大きな抵抗を提供します。これにより、失敗した注入試行中に誤って溶液の血管周囲注射によって失われる体積が減少します。インスリン注射器は、通常の注射器よりもデッドボリュームが小さくなっています。ここに記載されているものとは異なるシリンジおよび/または針を使用する場合、より大きなデッドスペース容量を考慮して、プロトコルステップ1.1.3.3で追加の注入液量を準備する必要がある場合があります(例:15μLではなく、意図した用量に30μLを追加します)。
AAV用量をシリンジに吸引する際に、シリンジ側に微細な吸引による気泡が形成された場合は、注射液をゆっくりとシリンジのさらに上に引っ張ってください。.これにより、ほとんどの小さな気泡が除去されます。注入する予定の容量に少なくとも10〜15μLのAAVを追加でロードします。この追加ボリュームは、気泡の排出中または潜在的な注入試行の失敗中に失われる可能性のあるボリュームを説明するためのものです。(例:注入する目標容量が150 μLの場合、165 μLをシリンジにロードします(シリンジスケールの160 μLと170 μLの中間)。針が静脈内に正しく配置され、注射が成功する直前にシリンジ内の容量が165 μLの場合、シリンジに15 μLが残るまで試薬を送達します(10 μLと20 μLの中間)ため、150 μL(165 μL - 150 μL = 15 μL))が送達されます。ベベルルーメン(ベベルが上を向いている)をシリンジスケールに合わせると、注入中に送達された量を追跡できます。
実験者によっては、マウスを横向きにして、足にマウスを乗せた場合に比べて、静脈の1つがまっすぐでアクセスしやすいようにすることを好むかもしれません。ただし、マウスの横向きの尾は、マウスのサイズに応じて異なる角度で傾斜するため、異なるサイズのマウスを注入する場合は注入角度の調整が必要です。これは、手順の成功の一貫性に悪影響を与える可能性があります。最初の練習試行では、実験者は両方のマウス抑制方向を試して、好みのアプローチを決定できます。マウスを足に置くと、両方の外側尾静脈にすばやく簡単にアクセスできます。これにより、複数回の注射失敗の場合に両方の静脈へのアクセスが必要な場合の拘束時間が短縮されます。
尾根付近(マウス本体に近い)に側静脈を注入する場合(特に体重>30g)のマウスの場合、尾根の静脈は遠位よりも少し深いため、静脈と平行な静脈から注入角度を静脈に対して5°〜10°に調整してください。
ここに挙げたRNase消化およびRNAコンタミネーションチェックのプロトコールは、20 μL中に合計175-700 ngの核酸を含む新鮮凍結肝臓組織から単離されたDNAサンプルで検証されました。RNase消化プロトコルは、RNase消化後のベクターゲノムとマウスゲノムの存在を確認するために、新鮮凍結肝臓組織およびFACS選別細胞から単離されたDNAサンプルでも試験されました。結果は、標的アンプリコンのエンドポイントPCR増幅のアガロースゲル電気泳動を使用して視覚化されました。
記載されている方法論に従うことで、IV注射を習得するために必要なトレーニングと練習時間を短縮し、注射成功率を高めることができ、試薬を節約できます。このプロトコルは、シンプルで一般的に使用されるツールを利用しており、すぐには利用できない可能性のある高度な機器やセットアップは必要ありません。さらに、ここに挙げたIV注入ステップは、アンチセンスオリゴヌクレオチド(ASO)など、静脈内投与が必要な幅広い注入剤に適用することができ、注入液に応じて注射剤調製ステップに適切な変更を加えることができます。
開示事項
著者は、この記事で公開された研究に関連する開示を持っていません。
謝辞
著者は、NINDS動物ケア施設のスタッフの支援に感謝します。この研究は、NINDSのNIHの学内研究部門(年次報告書番号1ZIANS003129)の支援を受けました。内容は著者の責任であり、必ずしも国立衛生研究所の公式見解を表すものではありません。
資料
| Name | Company | Catalog Number | Comments |
| 0.22 µm syringe filter | Millipore | SLGVM33RS | |
| 0.3 mL insulin syringes with 29G needle | BD Biosciences | 324702 | |
| 1.7 mL microcentrifuge tube | Crystalgen | 23-2051 | |
| 10 mL syringe | BD Biosciences | 302995 | |
| 100% EtOH | The Warner Graham Company | 201096 | |
| 10x phosphate-buffered saline (PBS) | Corning | 46-013-CM | Used to prepare 1x PBS for tissue fixation |
| 15 mL conical tube | Corning | 430766 | |
| 15 mL conical tube holder | Multiple sources | N/A | |
| 190 proof ethyl alcohol | The Warner Graham Company | 6810-01-113-7320 | Used to prepare 70% ethanol |
| 1x sterile PBS | Gibco | 10010023 | |
| 2 mL microcentrifuge tissue storage tubes | Eppendorf | 022363344 | |
| 4% paraformaldehyde (PFA) | Electron Microscopy Sciences | 157-4 | |
| Adeno-associated virus (AAV) | Charles River | N/A | Single-stranded DNA (ssDNA) AAV was packaged to deliver Cre recombinase as the transgene driven by CMV promoter |
| Alcohol swab | BD Biosciences | 326895 | |
| Bead lysis tube | Next Advance | GREENE5 | |
| BsuRI (HaeIII) restriction enzyme | Thermo Fisher Scientific | ER0151 | |
| Bullet blender | Next Advance | BBX24B | |
| Ai14-derived mice from JAX 007914 strain (genetic background: C57BL/6J) | N/A | N/A | Mice containing Ai14 Cre-reporter allele were purchased from JAX (catalog number: 007914) |
| Disposable absorbent pads | Fisherbrand | 1420662 | |
| Dissection forceps | Fine Science Tools (F.S.T) | 11251-35 | |
| Dissection scissors | Fine Science Tools (F.S.T) | 14085-08 | |
| DNA degradation reagent (DNAZap) | Invitrogen | AM9890 | |
| DNA-Extraction RNase A | Qiagen | 19101 | For RNA digestion during nucleic acid extraction |
| DNase-free RNase for DNA cleanup | F. Hoffmann-La Roche | 11119915001 | For RNA digestion after nucleic acid extraction |
| dPCR Probe PCR Kit | Qiagen | 250102 | |
| dPCR software | Qiagen | N/A | QIAcuity Software Suite |
| Elevated platform | Multiple sources | N/A | An empty pipette tips box was used to elevate the mouse restrainer during tail warming up |
| Fluorescence microscope | Multiple sources | N/A | Model used here: Nikon Eclipse Ti |
| Fluorescence microscope software | Multiple sources | N/A | Software used here: NIS-Elements |
| Gauze | Covidien | 9022 | |
| Heat block | Eppendorf | Thermomixer 5350 | |
| High-speed centrifuge | Eppendorf | 22620689 | |
| Metal container | Vollrath | 80125 | |
| Methylbutane | J.T. Baker | Q223-08 | |
| Molecular grade water | Quality Biological | 351-029-131 | |
| Mouse tube restrainer | Braintree Scientific | TV-RED-150-STD | |
| Myfuge mini centrifuge | Benchmark Scientific | C1012 | |
| Polymerase chain reaction thermal cycler | Bio-Rad Laboratories | 1851148 | Model: C1000 Touch |
| Precision wipes | Kimberly-Clark Professional | 7552 | |
| Proteinase K | Qiagen | 19131 | |
| QIAcuity dPCR Nanoplate 26k 24-well | Qiagen | 250001 | |
| QIAcuity One dPCR system | Qiagen | 911020 | |
| Qiagen DNeasy Blood & Tissue Kit | Qiagen | 69504 | Used for DNA extraction from tissues |
| Qiagen QIAamp DNA Micro Kit | Qiagen | 56304 | Used for cleanup of genomic DNA, and the isolation of DNA from small volumes of blood prtocotol was used for DNA extraction from FACS-sorted cells |
| Rodent restrainer cone | Braintree Scientific | MDC-200 | |
| Scale | Ohaus | 72212663 | |
| Styrofoam box | Multiple sources | N/A | |
| Sucrose | Sigma-Aldrich | S9378-1kg | |
| Surface cleaner and disinfectant | Peroxigard | 29101 | |
| Timer | Multiple sources | N/A | |
| Transfer forceps | Fine Science Tools (F.S.T) | 91113-10 | |
| Vortex | Daigger & Company | 22220A | Model: Daigger Vortex Genie 2 |
参考文献
- Tisdale, A., et al. The ideas initiative: Pilot study to assess the impact of rare diseases on patients and healthcare systems. Orphanet J Rare Dis. 16 (1), 429 (2021).
- Condo, I. Rare monogenic diseases: Molecular pathophysiology and novel therapies. Int J Mol Sci. 23 (12), 6525 (2022).
- Vaisitti, T., et al. The frequency of rare and monogenic diseases in pediatric organ transplant recipients in italy. Orphanet J Rare Dis. 16 (1), 374 (2021).
- Bulcha, J. T., Wang, Y., Ma, H., Tai, P. W. L., Gao, G. Viral vector platforms within the gene therapy landscape. Signal Transduct Target Ther. 6 (1), 53 (2021).
- Lundstrom, K. Viral vectors in gene therapy: Where do we stand in 2023. Viruses. 15 (3), 698 (2023).
- Wang, C., et al. Emerging non-viral vectors for gene delivery. J Nanobiotechnology. 21 (1), 272 (2023).
- Naso, M. F., Tomkowicz, B., Perry, W. L., Strohl, W. R. Adeno-associated virus (aav) as a vector for gene therapy. BioDrugs. 31 (4), 317-334 (2017).
- Ghosh, S., Brown, A. M., Jenkins, C., Campbell, K. Viral vector systems for gene therapy: A comprehensive literature review of progress and biosafety challenges. Appl Biosaf. 25 (1), 7-18 (2020).
- Wang, D., Tai, P. W. L., Gao, G. Adeno-associated virus vector as a platform for gene therapy delivery. Nat Rev Drug Discov. 18 (5), 358-378 (2019).
- Srivastava, A. Rationale and strategies for the development of safe and effective optimized aav vectors for human gene therapy. Mol Ther Nucleic Acids. 32, 949-959 (2023).
- Mukherjee, P., Roy, S., Ghosh, D., Nandi, S. K. Role of animal models in biomedical research: A review. Lab Anim Res. 38 (1), 18 (2022).
- Jucker, M. The benefits and limitations of animal models for translational research in neurodegenerative diseases. Nat Med. 16 (11), 1210-1214 (2010).
- Vandamme, T. F. Use of rodents as models of human diseases. J Pharm Bioallied Sci. 6 (1), 2-9 (2014).
- Anders, H. J., Vielhauer, V. Identifying and validating novel targets with in vivo disease models: Guidelines for study design. Drug Discov Today. 12 (11-12), 446-451 (2007).
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: Routes of administration and factors to consider. J Am Assoc Lab Anim Sci. 50 (5), 600-613 (2011).
- Prabhakar, S., Lule, S., Da Hora, C. C., Breakefield, X. O., Cheah, P. S. Aav9 transduction mediated by systemic delivery of vector via retro-orbital injection in newborn, neonatal and juvenile mice. Exp Anim. 70 (4), 450-458 (2021).
- Hauff, P., Nebendahl, K., Kiessling, F., Pichler, B. J., Hauff, P. Drug administration. Small Animal Imaging: Basics and Practical. , 127-152 (2017).
- Saleem, M., et al. A new best practice for validating tail vein injections in rat with near-infrared-labeled agents. J Vis Exp. (146), (2019).
- Resch, M., Neels, T., Tichy, A., Palme, R., Rulicke, T. Impact assessment of tail-vein injection in mice using a modified anaesthesia induction chamber versus a common restrainer without anaesthesia. Lab Anim. 53 (2), 190-201 (2019).
- Glascock, J. J., et al. Delivery of therapeutic agents through intracerebroventricular (icv) and intravenous (iv) injection in mice. J Vis Exp. (56), 2968 (2011).
- Grames, M. S., Jackson, K. L., Dayton, R. D., Stanford, J. A., Klein, R. L. Methods and tips for intravenous administration of adeno-associated virus to rats and evaluation of central nervous system transduction. J Vis Exp. (126), 55994 (2017).
- Yano, J., Lilly, E. A., Noverr, M. C., Fidel, P. L. A contemporary warming/restraining device for efficient tail vein injections in a murine fungal sepsis model. J Vis Exp. (165), 61961 (2020).
- Warren, J. S. A., Feustel, P. J., Lamar, J. M. Combined use of tail vein metastasis assays and real-time in vivo imaging to quantify breast cancer metastatic colonization and burden in the lungs. J Vis Exp. (154), 60687 (2019).
- JoVE Science Education Database. . Lab Animal Research. Compound administration I. , (2023).
- UCSF Office of Research, Institutional Animal Care and Use Program. Lateral tail vein injection in mice and rats (preferred technique for vascular access in mice Available from: https://iacuc.ucsf.edu/sites/g/files/tkssra751/f/wysiwyg/STD%20PROCEDURE%20-%20Misc%20Rodent%20Procedures%20-%20Lateral%20Tail%20Vein%20Injection%20in%20Mice%20and%20Rats.pdf (2023)
- Jones, K. Tail vein injections in the mouse and rat sop. UBC Animal Care Guidelines SOP: ACC-2012-Tech03. , (2012).
- Liadaki, K., Luth, E. S., Kunkell, L. M. Co-detection of gfp and dystrophin in skeletal muscle tissue sections. Biotechniques. 42 (6), 699-700 (2007).
- Burr, A., et al. Allometric-like scaling of aav gene therapy for systemic protein delivery. Mol Ther Methods Clin Dev. 27, 368-379 (2022).
- Lang, J. F., Toulmin, S. A., Brida, K. L., Eisenlohr, L. C., Davidson, B. L. Standard screening methods underreport aav-mediated transduction and gene editing. Nat Commun. 10 (1), 3415 (2019).
- Rodriguez-Estevez, L., Asokan, P., Borras, T. Transduction optimization of aav vectors for human gene therapy of glaucoma and their reversed cell entry characteristics. Gene Ther. 27 (3-4), 127-142 (2020).
- Hatakeyama, S., Yamamoto, H., Ohyama, C. Tumor formation assays. Methods Enzymol. 479, 397-411 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved