このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
エレクトロスプレー技術を用いたブラックシードオイル含有、アルギン酸ベース、pH感受性ビーズの合成
要約
高電圧と標的を絞った有効成分を充填したエマルジョンを使用して、pH応答性で均一なマイクロビーズを作製する技術を紹介します。
要約
ニゲラ・サティバ(Nigella sativa)の種子に由来するブラックシードオイル(BSO)は、特に結腸がんの文脈で、その潜在的な抗がん特性が注目を集めています。その活性化合物であるチモキノンは、がん細胞の増殖を阻害し、結腸がん細胞のアポトーシスを誘導するのに役立つ可能性があります。さらに、ブラックシードオイルの抗炎症作用と抗酸化作用は、より健康な腸内環境に貢献し、がんのリスクを減らす可能性があります。したがって、この研究では、pH 1.2 (胃) で薬物を放出することなく、BSO を制御された放出方法で結腸に送達する pH 感受性アルギン酸ビーズを合成し、pH 6.8 で明確に定義された放出パターンを提供しました。エレクトロスプレー技術を使用すると、胃腸培地での膨潤と拡散率が高い小さく均質なビーズの配合が容易になり、プロセス性能が向上します。
配合されたビーズは、 ex-vivo 粘液接着強度試験、ビーズサイズ、球形度係数(SF)、カプセル化効率(EE)、走査型電子顕微鏡(SEM)、 in vitro 膨潤挙動(SB)、および酸性および緩衝媒体中でのin vitro 薬物放出によって特徴付けられました。これらの製造されたビーズはすべて、このテストで0.58 ± 0.01 mmの適度なサイズと0.03 ± 0.00 mmの球形を示しました。この製剤は、 in vitroで有望な浮遊特性と放出特性を示しました。ビーズの累積割合が非常に低いため、油EEは90.13%±0.93%と高く、放出研究ではpH 6.8で90%以上が胃に浮遊する性質があることが示されました。さらに、ビーズは腸全体に均等に間隔を空けていました。このプロトコルで使用されるエレクトロスプレーアプローチは再現性があり、一貫した結果が得られます。したがって、このプロトコルは、商業化を目的とした大規模生産に使用できます。
概要
ブラックシード、特にBSOは、その確立された薬効成分により、さまざまな病気を治すために古くから使用されてきました。チモキノンは、おそらくBSO1に含まれる最も重要な植物化学物質の1つです。近年、研究者はチモキノンのin vivoおよびin vitroでの潜在的な治療効果を研究し、BSOの使用を支持する経験的証拠を生み出しています。これらの研究では、湿疹、高血圧、喘息、咳、頭痛、インフルエンザ、発熱、抗がん剤、めまい、活動性などの症状の治療に使用できるBSOについて、降圧作用、抗菌作用、抗ヒスタミン作用、抗真菌作用、抗真菌作用、鎮痛作用、抗糖尿病作用、脂質低下作用、および抗炎症作用が全て実証されています2,3。
液体や分散液、または固体材料の粒子の小さな液滴に比較的薄い被覆を適用することは、マイクロカプセル化として知られています。オイルに関しては、BSOのような一部の形態のオイルは栄養価の高い食品と見なされ、薬効があるため、マイクロカプセル化オイルは通常非常に価値があります4。ただし、食品のマトリックスに直接油を追加すると、揮発を引き起こす可能性があり、酸素や紫外線にさらされた結果として活動がすぐに消える可能性があります5。さらに、オイルの放出速度を制御できないため、即時かつ一時的な影響が生じます。マイクロカプセル化またはマイクロ球化によってエッセンシャルオイルの周囲にポリマーコーティングを作成することは、これらの欠点を克服する1つの方法である6。
マイクロカプセルは、マイクロスフィアとも呼ばれ、有害な環境条件からオイルを保護します7。このプロセスは、薬効の向上、薬物含有量の保存、錠剤の時間放出性の向上、味のマスキングの改善、製品の保存期間中の風味損失の低減、口当たりの延長、および1回の投与量での不適合成分の分離に広く使用されています8。マイクロカプセル化は、代謝吸収の維持、油の放出速度の制御、および特定の場所で意図した結果を得るための適切な濃度の維持にも役立ちます9。
電気流体力学的カプセル化は、簡単で適応性の高い方法です。活性物質は、外部シェルで構成されるマイクロカプセルの内部コアに収容されています。この点で、それは明確に定義された核ではなく、活性成分がより効果的に播種できることを保証するためにかなり強力なマトリックスを特徴としています。スフェリリサイクルに先立って、活性物質とポリマー溶液を組み合わせてミクロスフェア9を生成する必要があります。一方、油は揮発性であるため、マイクロカプセル化は非常に困難であり、慎重な温度制御が必要です。
オイルを封入するには、さまざまな方法があります。たとえば、特定のオイルは、生理活性成分の分解や揮発を防ぐために低温でカプセル化する必要があります。マイクロおよびナノサイズの構造を作成するために、電気流体力学噴霧(EHDA)が研究者によって広く研究されてきました10。この意味で、流量、印加電圧、ノズルサイズを含む処理条件、ならびに高分子溶液の収集距離特性は、所望の粒子サイズまたは形態11,12を生成するために考慮しなければならない2つの主要な要素である。
この研究では、アルギン酸塩(経口摂取に適した天然に存在する多糖類の一種)を使用してBSOをカプセル化しました。茶色の海藻には、自然に存在するアニオン性ポリマーであるアルギン酸塩が含まれています。これは、α-L-グルロン酸(G)と1-4βD-マンヌロン酸(M)酸13の2つのモノマー構造で構成されています。そのポリマーは無毒であり14、高度な生体適合性を持ち、安価で、効果的に分解します15。そのため、バイオテクノロジーやエンジニアリングの分野で頻繁に使用されています。
アルギン酸塩は、Sr2+、Ca2+、Zn2+イオンなどの二価カチオンとイオン性結合を形成することにより、さまざまなアルギン酸鎖のG基間に架橋構造を作り出すことができるため、イオンゲル化によるカプセル化に最適な材料です。ゲル化プロセスは、二価カチオンを並んでいるアルギン酸分子上の2つのカルボキシル基に制限するエッグボックスモデルによって適切に特徴付けることができます。アルギン酸ナトリウムビーズのヒドロゲル特性が、高分子および低分子の放出を調節する可能性があることが示唆されています。アルギン酸ナトリウムビーズは、その粘液接着性により、腸粘膜に長時間付着する可能性があります。さらに、アルギン酸塩は、酸性媒体16などの外部要素から油を保護し、油を胃腸管17の送達チャネルに移すことができるシールドを提供する。それ以来、粘膜組織18,19への薬物の部位特異的投与を支援するための研究に採用されてきた。
この研究では、電気流体力学的アプローチを使用して、市販の油を乳化してカプセルを作成することの実行可能性を調査しました20。ここでは、電気流体力学的アプローチを使用して、アルギン酸BSOを充填した微小球20を生成して分析しました。この研究では、ミクロスフェアのSF、 生体外、 粘膜接着特性、EE%、物理的外観、サイズ分布、ゼータ電位など、他の多くの要因を評価しました。減衰全反射率-フーリエ変換赤外(ATR-FTIR)分光法を使用して、化学的適合性をテストしました20。
プロトコル
1. アルギン酸-BSOエマルジョンの調製
- 10% w/v BSO を 1% w/v アルギン酸ナトリウム溶液に分散させ、1、3、5% w/v レシチンを含む 50 mL ビーカーに溶解します。
- 超音波ホモジナイザーを使用してナノエマルジョンを得る。 電力 レベルを 20%に設定します。 開始 ボタンをクリックしてホモゲナイザーを55秒間実行し、プロセスを完了します。
2. アルギン酸-BSOエマルジョンの特性評価
- ゼータ電位と粒度分布の解析
- 作りたてのエマルジョン0.1mLを25mLのガラスビーカーに取り、9.9mLの蒸留水で希釈します。
- この希釈溶液2.5mLを3mLの石英キュベットに取り、キュベットを測定チャンバーに入れます。
- カバーを開けてキュベットをデバイスの内部に置き、キュベットが光線の経路に対して正しい向きになっていることを確認します。 測定 アイコンをクリックします。
- キュベットを取り出します。サンプルを回収するか、適切に廃棄します。
- データをPDFファイルとして個人用フォルダに保存して、後で使用できるようにします。
- エマルジョンの安定性(ES)の測定
- 10 mLの遠心分離チューブに5 mLの新しく調製したエマルジョンを取ります。.エマルジョン(n = 3)を894 × gで5分間遠心分離します。
- 式(1)を使用して、相分離インターフェースの位置に基づいてESを決定します。
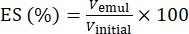 (1)
(1)
ここで、Vemulは遠心分離後の残りのエマルジョンの量であり、Vinitialは初期エマルジョンの量です。
- ビーズの準備
- BSOアルギン酸ビーズ
- EHDAと呼ばれるエレクトロスプレー技術を使用してBSOアルギン酸ビーズを調製します。10% BSO、1% アルギン酸ナトリウム、および 3% レシチン溶液で構成される体積重量 (w/v) BSO エマルジョンを使用します。
- シリンジポンプを使用して流量を調整し、エマルジョンを10mLのプラスチックシリンジにロードし、22Gの針に押し込みます。針先を高電圧電源の正極に取り付けます。
- コレクターとして、50mLの1%w / w塩化カルシウム(ゲル化浴)を入れた接地ビーカーを使用します。塩化カルシウム溶液の表面から10cmの距離を維持しながら、3、5、および7kVの電圧で1mL/minから3mL/minの間で滴下流量を交互に減らします。
- 完全なゲル化を確認するために、ビーズを攪拌しながらゲル化浴に30分間放置します。ステンレス製フィルターを使用してゲル化槽からビーズを取り出し、集めたビーズを超純蒸留水で洗います。
- ビーズを実験室のベンチで室温で16時間乾燥させます。式(2)を使用して、ビーズの歩留まりを計算します。
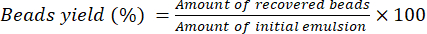 (2)
(2)
- BSOフリーのアルギン酸ビーズ
- アルギン酸ナトリウムの1%w / v溶液を調製します。レシチンを1%、3%、および5%w / vの濃度で溶液に加えます。レシチンが完全に溶解するまで溶液を完全に混合します。
- ステップ2.3.2.1の溶液を使用して、ステップ2.3.1.2-2.3.1.5で説明されているようにBSOフリーのアルギン酸ビーズを調製します。式(2)を使用して歩留まりを計算します。
- BSOアルギン酸ビーズ
3. ビーズの特性評価
- サイズと形状の決定
- ビーズのサイズと形状を確認するには、画像アナライザーを使用します。デジカメで濡れたビーズと乾いたビーズを撮影します。
- 次に、装置にプリインストールされているスケールバーを使用してビーズの直径を測定します。直径の値を使用して、式 (3) を使用して、取得した直径の値から SF を計算します。
SF=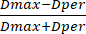 (3)
(3)
ここで、Dmaxはビーズの中心を通る最大直径(mm単位)を表し、DperはDmaxに垂直でビーズの中心を通過する直径(mm単位)を指します。
注:SFがゼロの場合は理想的な球形のビーズを示し、SF値が増えると球形からの偏差が大きいことを示します。さらに、ビーズはSFが0.05以下の場合、球形と見なされます。
4. EE%の決定
- ビーズをリン酸緩衝生理食塩水(PBS)で分解して、ビーズをエマルジョンに戻します。得られたエマルジョンの600nmでの吸光度をUV-vis分光光度計で測定します。
- 吸光度値を使用して、エマルジョンの濁度を表します。エマルジョン中の既知の量のBSOを使用して標準曲線を作成します。
- 式 (4) を使用して EE% を計算します。
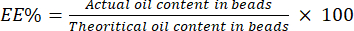 (4)
(4)
5. 走査型電子顕微鏡(SEM)
注:SEMを使用して、BSOアルギン酸ビーズの微細構造と表面形態を観察します。
- 乾燥したビーズの内側を調べるには、ビーズを数個カットします。カットしたビーズをアルミのスタブにスポットし、カーボン粘着テープで貼り付けます。
- アルゴン雰囲気の真空蒸発器でカーボンスパッタモジュールでビーズをスパッタコートします。カーボンコーティングに100 Åと50 Åの厚さを塗布します。
- コーティングされたビーズの画像を、10kV〜15kVの電圧加速器を使用して高真空で取得します。
6. ATR-FTIRを用いた薬物-賦形剤相互作用の決定
- 周囲の空気を背景として、1 cm-1 の解像度を使用して、計器の波数を 4,000 cm-1 から 400 cm-1 の間に設定します。補足ファイル1を参照してください。
- BSO、アルギン酸ナトリウム、レシチン、塩化カルシウム、BSOフリービーズ、アルギン酸BSOビーズ、および有効成分と賦形剤の物理的混合物(アルギン酸ナトリウム、レシチン、塩化カルシウム、BSO)のスペクトルを個別に記録します。
- サンプル(5〜10 mg)をサンプリングエリアに置きます。20スキャン、解像度4、ゲージ力80、先端が平らな圧力アームを調整します。 Auto Increment が Blank オプションに設定されたままで、スペクトラムが目的のフォルダに自動的に保存されるようにします。
- サンプル測定を開始するには 、[サンプル] ボタンをクリックします。 [サンプル]を選択後は、待ち時間がございませんので、必ずサンプルを用意し、クランプの圧力を下げてください。すべてのサンプルを個別に分析します。分光法ソフトウェアを使用して、記録されたすべてのスペクトルを個別に分析します。
7. 示差走査熱量測定(DSC)
注:BSOを装填したビーズの熱特性と適合性は、DSC(補足ファイル1)を使用して調査しました。
- ~3.20 mg の重さのビーズを通常のアルミ鍋で密封します。20 L/minの速度で流れる窒素の流れの下で50-350 °Cの温度範囲で分析しながら、サンプルを10 °C/minの速度で加熱します。
8. ビーズの膨潤特性
- 乾燥アルギン酸-BSOビーズ100mgを調製します。
- 模擬腸液(SIF)と模擬胃液(SGF)を、適切なサイズ-6L、10L、または25Lの清潔で乾燥した混合容器に調製し、必要な容量の約33%(2L、3L、または8L)に精製水を加え、濃縮液のボトルの内容物を容器に移します。ボトルを精製水ですすぎ、すすぎ水と精製水を混合容器に加えて、必要な量にします。よく混ぜます。pHを測定し、仕様の範囲内で続行します。必要に応じてpHを調整します。
- 模擬腸液(SIF)と模擬胃液(SGF)を含む50 mLの培地にビーズを浸します。37 ± 0.5°Cで2時間条件を維持します。
- 膨らませたビーズを取り外し、0、10、20、30、40、50、60、70、80、90、100、110、120分以上の事前定義された間隔で金属メッシュを介してフィルタリングします。ペーパータオルを使用して、膨らんだビーズから余分な水分を取り除きます。
- 電子分析天びんを使用して、拭き取ったビーズの重量を測定します。式(5)を使用して、膨潤指数(%SI)のパーセンテージを決定します。
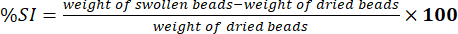 (5)
(5)
結果
BSOを充填したアルギン酸マイクロビーズの調製
図1は、BSOを充填したアルギン酸マイクロビーズを調製するための実験装置を示しています。使用したレシチンの量は、BSOエマルジョンの安定性にかなりの影響を与えました。3つのレシチン濃度すべてで作られたエマルジョンは比較的安定していました。この実験では、遠心分離法...
ディスカッション
EHDAプロセスを使用して、BSOをロードしたアルギン酸マイクロビーズをpH感受性キャリアとして作成しました。ビーズのネットワークは、カルボン酸基が豊富に存在するため、pH依存的な膨潤と薬物放出挙動を示しました。このポリマー鎖間の強力な分子間水素結合が、pH 1.2でBSOを充填したビーズの膨潤特性の低下の背後にある理由であることが明らかになりました。B...
開示事項
著者には、開示すべき利益相反はありません。
謝辞
この研究は、サウジアラビアのリヤドにあるプリンセス・ヌーラ・ビント・アブドゥルラーマン大学のプリンセス・ヌーラ・ビント・アブドゥルラーマン大学の研究者支援プロジェクト番号(PNURSP2024R30)の支援を受けました。この研究は、サウジアラビアのリヤドにあるキングサウード大学の研究者支援プロジェクト番号(RSPD2024R811)によって資金提供されました。
資料
| Name | Company | Catalog Number | Comments |
| 10 mL Centrifuge Tubes | Globe Scientific | 22-171-624 | |
| 22 G needle | Sigma-Aldrich (St.Louis, Missouri, USA). | CAD4172 | |
| 3 mL quartz-cuvette | Sigma-Aldrich (St.Louis, Missouri, USA). | Z276669 | |
| 50 mL beaker | |||
| Aluminum stubs | |||
| An electronic analytical balance | |||
| ATR-FTIR | Bruker Malaysia Sdn Bhd, Kawasan Perindustrian Temasya, 40150 Shah Alam, Selangor, Malaysia. | ||
| Black seed oil | IKOP Pharmaceutical Ltd. (IKOP, Faculty of Pharmacy, IIUM, 25200 Kuantan, Pahang, Malaysia | B182111 | Active ingredient |
| Calcium chloride dehydrate, CaCl2 · 2H2O | Sigma-Aldrich (St.Louis, Missouri, USA). | 21074 | Gelling agent |
| Carbon adhesive tapes | |||
| Centrifuge | |||
| Differential scanning calorimetry | |||
| Digital camera | |||
| Grounded beaker | |||
| High guluronic acid content Sodium alginate (mw. 97,000) with medium viscosity (40 – 100 mPa s) | Sigma-Aldrich (St.Louis, Missouri, USA). | W201502 | Polymer |
| High voltage power supply | |||
| Isopropyl alcohol | Sigma-Aldrich (St.Louis, Missouri, USA). | W292912 | ATR-FTIR cleaning purpose |
| Lecithin | Sigma-Aldrich (St.Louis, Missouri, USA). | P7568 | Surfactant |
| Microscope | |||
| Paper towel | |||
| Scanning electron microscopy | |||
| Simulated gastric fluid | Sigma-Aldrich (St.Louis, Missouri, USA). | 1651 | Release media and swelling media |
| Simulated intestinal fluid | Sigma-Aldrich (St.Louis, Missouri, USA). | 84082-64-4 | Release media and swelling media |
| Spectroscopy software | |||
| Stainless-steel filter | |||
| Syringe pump | SEN JIN SDN BHD Malaysia, Taman Desaria, 46150 Petaling Jaya, Selangor Darul Ehsan Malaysia | ||
| Ultrapure distilled water | Supplied by institutional lab | ||
| Ultrasonic homogenizer | SEN JIN SDN BHD Malaysia, Taman Desaria, 46150 Petaling Jaya, Selangor Darul Ehsan Malaysia | ||
| UV-vis spectrophotometer. | |||
| Vacuum evaporator | SEN JIN SDN BHD Malaysia, Taman Desaria, 46150 Petaling Jaya, Selangor Darul Ehsan Malaysia | ||
| Voltage accelerator | SEN JIN SDN BHD Malaysia, Taman Desaria, 46150 Petaling Jaya, Selangor Darul Ehsan Malaysia | ||
| Zetasizer Nano-ZS | (Malvern Zetasizer Nano series Nano-S and Nano-Z, Malvern Instruments Ltd., Worcestershire, UK) |
参考文献
- Benavides, S., Cortés, P., Parada, J., Franco, W. Development of alginate microspheres containing thyme essential oil using ionic gelation. Food Chem. 204 (8), 77-83 (2016).
- Agbaria, R., Gabarin, A., Dahan, A., Ben-Shabat, S. Anticancer activity of Nigella sativa (black seed) and its relationship with the thermal processing and quinone composition of the seed. Drug Des Devel Ther. 9 (1), 3119 (2015).
- Wang, D., Qiao, J., Zhao, X., Chen, T., Guan, D. Thymoquinone inhibits IL-1β-induced inflammation in human osteoarthritis chondrocytes by suppressing NF-κB and MAPKs signaling pathway. Inflammation. 38 (7), 2235-2241 (2015).
- Beyki, M., et al. Encapsulation of Mentha piperita essential oils in chitosan-cinnamic acid nanogel with enhanced antimicrobial activity against Aspergillus flavus. Ind Crop Prod. 54 (3), 310-319 (2014).
- Hosseini, S. M., et al. Incorporation of essential oil in alginate microparticles by multiple emulsion/ionic gelation process. Inter J Biol Macromol. 62 (11), 582-588 (2013).
- Banerjee, S., et al. Influence of process variables on essential oil microcapsule properties by carbohydrate polymer-protein blends. Carbohydr Polym. 93 (2), 691-697 (2013).
- Sebe, I., Szabó, E., Zelkó, R. Advances in drug delivery via electrospun and electrosprayed formulations. In Emerging Drug Delivery and Biomedical Engineering Technologies. , 71-104 (2023).
- Akram, N., et al. Fabrication and characterization of PVA-WPI based nanofiber mats for improved viability of Lactobacillus rhamnosus GG. Foods. 12 (21), 3904 (2023).
- Azad, A. K., Sinan, M. A. A., John, F. K., Bappaditya, C., Hriday, B. Electro-hydrodynamic assisted synthesis of lecithin-stabilized peppermint oil-loaded alginate microbeads for intestinal drug delivery. Int J Biol Macromol. 185 (8), 861-875 (2021).
- Chan, E. S. Preparation of Ca-alginate beads containing high oil content: Influence of process variables on encapsulation efficiency and bead properties. Carbohydr Polym. 84 (4), 1267-1275 (2011).
- Xie, J., Jiang, J., Davoodi, P., Srinivasan, M. P., Wang, C. H. Electrohydrodynamic atomization: A two-decade effort to produce and process micro-/nanoparticulate materials. Chem Eng Sci. 125 (3), 32-57 (2015).
- Zamani, M., Prabhakaran, M. P., Ramakrishna, S. Advances in drug delivery via electrospun and electrosprayed nanomaterials. Int J Nanomed. 8 (8), 2997 (2013).
- Husain, O., Lau, W., Edirisinghe, M., Parhizkar, M. Investigating the particle to fibre transition threshold during electrohydrodynamic atomization of a polymer solution. Mater Sci Eng. C. 65 (8), 240-250 (2016).
- Wan, L. Q. Calcium concentration effects on the mechanical and biochemical properties of chondrocyte-alginate constructs. Cell Mol Bioeng. 1 (3), 93-102 (2008).
- Baimark, Y., Srisuwan, Y. Preparation of alginate microspheres by water-in-oil emulsion method for drug delivery: Effect of Ca2+ post-cross-linking. Adv Powder Technol. 25 (5), 1541-1546 (2014).
- Paques, J. P., Sagis, L. M. C., van Rijn, C. J. M., van der Linden, E. Nanospheres of alginate prepared through w/o emulsification and internal gelation with nanoparticles of CaCO3. Food Hydrocoll. 40 (10), 182-188 (2014).
- Suksamran, T. Biodegradable alginate microparticles developed by electrohydrodynamic spraying techniques for oral delivery of protein. J Microencapsul. 26 (7), 563-570 (2009).
- Wang, H., et al. Characterization, release, and antioxidant activity of curcumin-loaded sodium alginate/ZnO hydrogel beads. Int J Biol Macromol. 121 (1), 1118-1125 (2019).
- Bera, H., Boddupalli, S., Nayak, A. K. Mucoadhesive-floating zinc-pectinate-sterculia gum interpenetrating polymer network beads encapsulating ziprasidone HCl. Carbohydr Polym. 131 (10), 108-118 (2015).
- Azad, A. K., et al. Encapsulation of black seed oil in alginate beads as a pH-sensitive carrier for intestine-targeted drug delivery: In vitro, in vivo and ex vivo study. Pharmaceutics. 12 (3), 219 (2020).
- Azad, A. K., et al. A dataset of microstructure features of electro-hydrodynamic assisted 5-fluorouracil-grafted alginate microbeads and physicochemical properties for effective colon targeted carriers drug delivery. Data in Brief. 53 (4), 110202 (2024).
- Danaei, M., et al. Impact of particle size and polydispersity index on the clinical applications of lipidic nanocarrier systems. Pharmaceutics. 10 (2), 57 (2018).
- Piornos, J. A., Burgos-Díaz, C., Morales, E., Rubilar, M., Acevedo, F. Highly efficient encapsulation of linseed oil into alginate/lupin protein beads: Optimization of the emulsion formulation. Food Hydrocoll. 63 (2), 139-148 (2017).
- Morales, E. Alginate/Shellac beads developed by external gelation as a highly efficient model system for oil encapsulation with intestinal delivery. Food Hydrocoll. 70 (9), 321-328 (2017).
- Nikoo, A. M., Kadkhodaee, R., Ghorani, B., Razzaq, H., Tucker, N. Electrospray-assisted encapsulation of caffeine in alginate microhydrogels. Int J Biol Macromol. 116 (9), 208-216 (2018).
- Shao, L., et al. Effect of cold-spray parameters on surface roughness, thickness and adhesion of copper-based composite coating on aluminum alloy 6061 T6 substrate. Processes. 11 (3), 959 (2023).
- Li, W., et al. Effects of spraying parameters and heat treatment temperature on microstructure and properties of single-pass and single-layer cold-sprayed Cu coatings on Al alloy substrate. Surf Coat Technol. 30 (490), 131184 (2024).
- . . US Pharmacopoeia National Formulary, USP 23/NF 18. , (2000).
- Chen, Y. -. C., Ho, H. -. O., Liu, D. -. Z., Siow, W. -. S., Sheu, M. -. T. Swelling/floating capability and drug release characterizations of gastroretentive drug delivery system based on a combination of hydroxyethyl cellulose and sodium carboxymethyl cellulose. PLoS One. 10 (1), e0116914 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved