このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
肺動脈バンディングを用いた右側心臓リモデリングと不整脈のラットモデル
要約
右心不全(RHF)は、右側の心臓の拡張と肥大を特徴とし、心室および心房の機能不全を引き起こします。RHFに関連する心肺疾患は、心不整脈のリスクの増加を伴います。この記事では、心室および心房性不整脈形成の亢進に関連する肺動脈バンディング誘発性RHFの標準化されたモデルについて説明します。
要約
慢性閉塞性肺疾患や肺動脈性肺高血圧症(PAH)などの臨床症状は、慢性的な右心室圧過負荷や進行性右心不全(RHF)につながる可能性があります。RHF は、RV と右心房 (RA) に影響を与える異常な心筋機能に関連する右側心肥大と拡張によって特定できます。私たちは最近、重度のRHFが心房の炎症、心房線維症、および心房不整脈(CA)の最も一般的なタイプである心房細動(AF)のリスクの増加を伴うことを示しました。最近の研究では、RVおよびRAの炎症が、AFを含むCAの不整脈形成に重要な役割を果たしていることが示されています。しかし、RHFにおけるCAおよびAFの発症における炎症の影響については、十分に説明されていません。
RHFの実験モデルは、右側心筋の炎症とCAとの関連をよりよく理解するために必要です。モノクロタリン(MCT)誘発性肺高血圧症(PH)のラットモデルは、RHFを誘発することが十分に確立されています。しかし、MCTは重度の肺毒性と肺の炎症を引き起こします。したがって、MCT誘発性RHFは、その後の心筋炎症がRHF自体に由来するのか、それとも損傷した肺から分泌される循環炎症シグナルに由来するのかを区別するのに役立ちません。
この記事では、肺動脈幹バンディング(PAB)を含む機械的方法を使用して、右側の心不整脈を誘発しました。PAB は、肺動脈幹の永久縫合を 3 週間行うことで構成されます。このようなアプローチでは、右側の圧力過負荷が増加します。PAB 後の D21 では、縫合糸により、肥大、拡張、および炎症を起こした RV と RA が生じます。PAB 誘発性 RHF は、心房細動を含む心室性および心房性不整脈に対する脆弱性も伴います。
概要
右心不全(RHF)は、右心室(RV)および心房(RA)の肥大と拡張を特徴とし、肺動脈(PA)の狭窄による慢性的なRV圧力過負荷に反応して右側心不全を引き起こします1。したがって、PAの狭窄を誘発する条件は、RHF 1,2,3,4のリスク増加の原因となる可能性があります。臨床データから、RHFがPA高血圧症(PAH)患者の入院の主な原因(56%)であることが明らかになりました2。臨床研究では、血栓塞栓性肺高血圧症(PH)や特発性PAHなどのPAHの原因とは無関係に、患者はRHFにしばしば影響を受け、上室性頻脈性不整脈や心房細動(AF)2,5,6などの心不整脈を発症しやすくなることが示されています。
PAHとRHFとの関連をよりよく理解するために、モノクロタリン(MCT)の単回投与モデルを含む動物実験を使用して、重度の肺炎症とRHF7,8を誘発しています。最近、MCT誘発性RHFがRA炎症およびAF9と関連していることが観察されました。しかし、MCT誘発性肺炎症および循環サイトカインの重要性のために、MCT誘発性RA炎症がRHFのみの結果であるかどうかを説明することは困難であった9。したがって、RHF 誘発性心不整脈の新しいモデルが必要でした RA 炎症状態を研究するために。
PAトランクバンディング(PAB)実験モデルは、閉塞性PA疾患を模倣し、心臓の右側に影響を与える関連する病理学的心臓リモデリングを研究するために、さまざまな動物種で使用されてきました10。PAB は、RV 過負荷 10,11,12,13,14,15,16 を模倣したさまざまな研究で、右 RV の機能不全と失敗を誘発する効果的な方法として報告されています。技術的には、PABはPA体幹に永久縫合糸を留置することであり、PA体幹の直径10の機械的減少を引き起こす。PABは、RV10への圧力過負荷を増加させます。まず、RV後負荷の急激な増加に対する代償的適応として、RV腔が拡張し、慢性的なRV肥大10,13を引き起こします。RVの拡張と肥大は三尖弁に影響を及ぼし、三尖弁は漏れやすくなります13。より正確には、RVの顕著な拡張と高いRV後負荷の組み合わせは、RVとRA13,17の間に位置する三尖弁輪を伸ばす効果があります。弁の不完全な閉塞により、収縮期にRVから排出される血液の一部は、RA腔17に向けられます。三尖弁の漏出は心エコー検査で観察でき、三尖弁逆流と呼ばれます17。その後、RAは不適切に高血圧になり、RAの拡張と肥大の増加に寄与します13。慢性的なRVおよびRAリモデリングは、RVおよびRA線維症および機能の喪失につながる局所的な心筋炎症反応を伴います9,13。心臓線維症は、収縮性が低く、心室細動やAFなどの心不整脈の発症に関与する伝導ブロックおよび再突入回路を誘発しやすい低電圧ゾーンの発達を特徴としています18,19。
この論文の独創性は、PAB 誘発性の右側心臓リモデリングの標準化された方法を利用して、PAB 後 3 週間で心不整脈の誘発性を誘発および研究することにあります。この外科的アプローチの主な利点は、i) PA体幹径の減少に対する直接的な制御、および ii) 肺の炎症を回避してRHFに焦点を当てた 心筋不整脈、AFを含む心不整脈を研究するための炎症。
ここで説明するアプローチには、PAB を作成するための精密な顕微手術、RV 後負荷の増加の評価、PAB 誘発性心筋の構造的および機能的リモデリングを観察するための心エコー検査、および AF を含む心不整脈に対する脆弱性を評価するための電気生理学的研究が含まれます。
プロトコル
以下に説明するすべての手順は、モントリオール心臓研究所の倫理委員会(プロトコル番号:2021-2938-2021-47-01および2024-3412-2024-48-01)によって承認され、カナダ動物管理評議会(CCAC)のガイドラインに厳密に従いました。6〜8週齢の雄のWistarラット(225〜275 g)を手順に使用しました。すべての動物はモントリオール心臓研究所の動物管理施設に収容され、水と食物に無料でアクセスできました。
1. 術前準備
- 手術前に、121°Cから134°Cの温度で15〜30psiの高圧飽和蒸気のオートクレーブを使用して、すべての手術器具と材料を滅菌し、その後25分間の乾燥サイクルを行います。
- 手術に必要な量の薬をすべて準備します。ブプレノルフィン (0.05 mg/kg) とケトプロフェン (5 mg/kg) を手術の 30 分前に皮下注射し、手術後 6 時間 (ブプレノルフィン) と 24 時間後に繰り返す (ブプレノルフィンとケトプロフェン) を含むマルチモーダル鎮痛アプローチを使用します。さらに、切開部位で局所鎮痛を行います(リドカイン5 mg / mL)。.
- 手術前にベースラインの経胸壁心エコー検査を実行します (ステップ 6.1-6.13 の経胸壁心エコー検査の詳細な手順を参照) PA の直径を決定し、リードとして使用される適切なゲージ針を選択します PAB 中に予想される PA 直径の 60% の減少を生成します。
注:この論文では、225〜275gの雄Wistarラットを使用し、19Gの針の利用は、PA直径のそのような60%の減少を生成するために適切でした。 - リードとして使用する19Gの針(またはステップ1.3で決定された適切な口径)を準備します(下記を参照:ステップ4.18および4.19)最適なPA体幹狭窄を取得し、ラットの心臓の深刻なリモデリングを引き起こします。.鉗子を使用して、19Gを90〜110°に曲げます(図1A)。
注:19 Gを曲げると、i)PAトランクの近くに配置され、ii)手順中に結紮を適用することが容易になります。19 Gは、PAの直径を1.0 mm(体重225-275 gのラットで60 %減少)に縮小するために縫合糸を取り付けるリード線として使用されます。これにより、3週間で深刻なRVリモデリングの原因となる大幅なRV圧力過負荷が誘発されます。
2.麻酔の導入と動物の準備
注:分析は、6〜8週齢の雄のWistarラット(225〜275 g)で行われました。.次の手順のすべてのステップで加熱パッドを使用して、動物の体温を約37°Cに保ちます。 直腸プローブを適用して体温を監視します。
- イソフルラン3%と100%酸素2〜3 L / minを連続吸入して動物に麻酔をかけます。
- 角膜を乾燥から保護するために、目の潤滑ジェルを塗布します。
- つま先のピンチ反射を使用して麻酔のレベルを確認します。
3. 挿管
注:挿管は、前述のように行われました20。
- 動物を仰臥位で傾斜した挿管ステーションに移します。糸のループを使用してラットを上切歯で保持し、体を45°の吊り下げ位置に維持して、喉の視覚化を改善します。
- 柔軟な光源を首の表面に向け、咽頭喉頭蓋領域を透過照らします。
- 綿棒を使用して舌を伸ばし、湾曲した計量ヘラを舌圧子として上顎で安定させます。
- 気管と声帯を視覚化します。
- 16Gの血管カテーテルを使用して挿管を行います。カテーテルを気管チューブとして使用し、斜めの先端の針を鈍くしてイントロデューサーとして使用します。
- イントロデューサー(斜め先端針)に取り付けられた気管内チューブ(16G血管カテーテル)を気管に進め、位置が決まったらイントロデューサーを取り外します(図1B)。
- 通常の呼吸パターン(体重225gのラットで約80呼吸/分、体重275gのラットで約70呼吸/分)と、カニューレのハブのフランジに置いたときに金属ヘラ(または小さな鏡)の表面にミストが存在することを確認して、チューブの正しい位置を確認します。
- 正しく挿管されたら、動物を恒温性発熱パッドを介して仰臥位の手術ステーションに迅速に移します。
- ラットの体重に応じて、人工呼吸器の一回換気量と潮汐量を調整します。約225〜275 gのラットは、人工呼吸器を使用して2.0〜2.5 mLの一回換気量と70〜80回の呼吸/分を受け取ります。.
- 気管内チューブを人工呼吸器に接続して、機械換気を開始します。人工呼吸器の流出先端を水シリンダーに入れます。各呼吸後に流出から出てくる気泡は、挿管が成功したことを示しています。
- 安定した呼吸が確立されたら、気管内チューブをサージカルテープで固定し、直腸プローブを尾に沿って固定して体温を監視します。
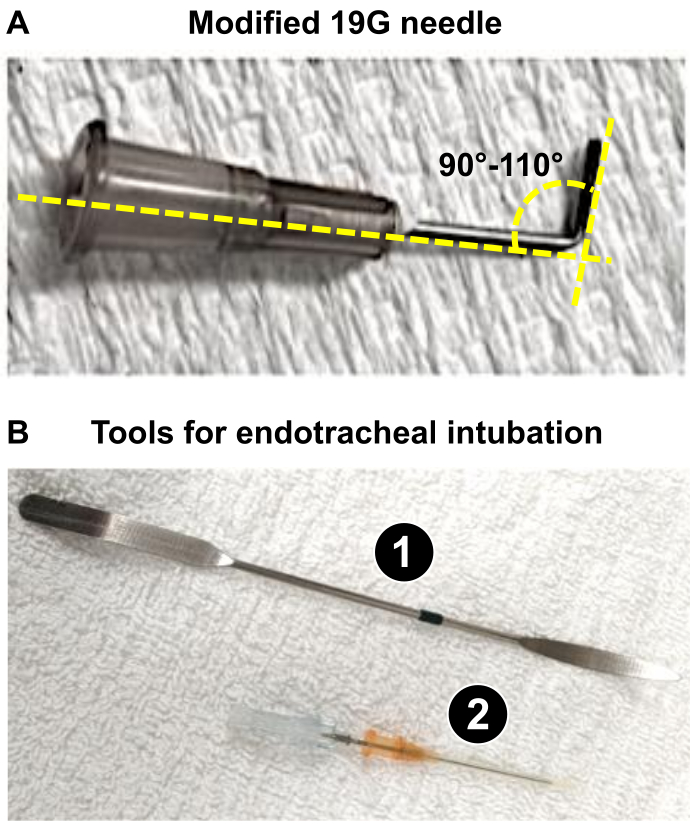
図1:PABの顕微手術の準備に必要な主要な器具 (A)PAB後のPA体幹の直径1mmを得るためのリードとして使用される修正された19G針。(B)ラットの気管内ツールの使用または挿管の成功。 1. ヘラは、麻酔をかけたラットの舌圧子として使用され、気管を露出させます。 2. 16Gカテーテルは、スタイラスの先端を鈍らせた後、気管内チューブとして機能します。 この図の拡大版を表示するには、ここをクリックしてください。
4. PAB手術(図2)
注:すべての手順は、厳格な無菌手術技術に従って実行する必要があります。
- クリッパーと脱毛クリームを使用して胸部の左側を剃り、2%クロルヘキシジンと70%アルコールスクラブ(3回繰り返す)を塗布して皮膚を準備します。
- 前肢を医療用テープで開いた位置に固定し、呼吸に影響を与えないように手足を伸ばしすぎないように注意してください。
- 右後肢を少し下に引っ張り、尻尾に沿って固定します。
- 左後肢を伸ばして内転させ、動物の右側に固定してわずかに右側の位置を生成し、胸の左側を露出させます。
- このステップでは、手術の残りの部分に滅菌手袋を使用してください。
- 動物に滅菌ドレープを配置し、剣状突起の約2 cm上から開始し、ラットの左前肢の基部に向かって斜めに向け、胸部の左側に2〜3 cmの皮膚切開を行います。
- 皮膚の下で、続いて胸筋(小胸筋と大胸筋)を分離し、丸い先端のはさみを使用して鈍い解剖によってそれらを脇に移動します。磁気リトラクターを使用して筋肉を保持し、その下にある胸郭を適切に視覚化できるようにします。
- 水シリンダーからアウトフローチューブ(人工呼吸器に接続されている)を取り外して、肺を膨らませます(手順3.10を参照)。水から流出チューブを取り外すと、肺への圧力が低下し、ローブの脱膨張が発生します。
- 湾曲した解剖鉗子を使用して左側開胸術を行います。3番目 と4番目の 肋骨の間にある筋肉の鎖骨中央線に小さな穴を開けます。
- 湾曲した鉗子を開口部に導入し、2本の肋骨の間の筋肉の左内壁に沿ってスライドさせて、左胸壁をわずかに持ち上げ、筋肉を切断しながら肺に触れないようにします。
- 導入した鉗子を目安に、虹彩ハサミで肋骨まで約1cmの縦方向に切開します。左胸壁を持ち上げたまま、はさみを慎重に操作して、真下の左肺葉を傷つけないようにします。
- 丸い先端のはさみを使用して、肋間切開を動物の左側に1〜2cmに拡大します。
- 傷口を開いたままにするために、リトラクターを肋骨の下に再配置します。
- 胸腺の下部と肺の左葉の一部を観察します。
- 胸腺と肺をこのレベルで脇に押しのけます、これらの臓器が占めるかなりのスペースを考慮して。鉗子による鈍的解剖を使用して胸腺葉を分離し、濡れたガーゼを使用して左側に肺を保持します。次に、心臓の上部、左心房(LA)、肺幹、大動脈弓を露出させます。
- この領域の心臓を覆っている心膜の薄い層を、付着している脂肪組織とともに慎重に鈍く解剖して、大動脈と肺幹がまだ付着している部分を見つけるのを助けます。心膜の解剖を最小限に抑え、胸膜に触れないようにします。
- 湾曲した鉗子を、LA付属器と肺幹の間の空間、血管の可視部分の中央に閉じた位置に挿入して、血管の反対側に到達します(図2A)。
注意:血管の破裂や出血のリスクを防ぐために、心臓の大動脈基部に近づきすぎないようにしてください。 - 鉗子の先端が結膜を通って肺幹に向かって見えるようにします。2番目の鉗子を使用して先端を解剖し、メンブレンを慎重に突き刺して小さな開口部を作ります。次に、肺幹の下に配置された湾曲した鉗子をわずかに開いて、5-0シルクスレッドをつかみます。鉗子を引っ込めて、糸を肺幹の一方の側からもう一方の側に持ってきます(図2B、C)。
- 肺動脈幹の狭窄を行います。まず、動脈の近くで5-0シルクの緩いダブルノットを練習します。19Gの針を血管に沿って糸の下に挿入します。この最初の結び目をきつく締め、19 Gを取り外す前に2番目の単純な結び目で固定します(図2D)。
注意: 肺動脈幹の完全な閉塞の持続時間を最小限に抑えるために、迅速かつ慎重に作業してください。 - 最後の簡単な結び目を実行し、結び目から約0.5〜1cmのところに残りの5-0シルク糸を切ります(図2D)。
- 胸腺葉の位置を変え、胸部リトラクターを取り外します。
- 人工呼吸器の流出を2秒間つまんで、肺を再度膨らませます。
- 合成吸収性5-0縫合糸でクロスステッチパターンを実行して、胸郭を閉じます。
- 創傷領域に0.9%生理食塩水を数滴塗布し、胸壁の両側を圧迫して気泡を取り除き、胸部陰圧を再確立します。
- 胸筋の位置を変え、滅菌ガーゼで残りの生理食塩水を拭き取ります。
- 注射器を使用して、傷の表面と周辺領域にリドカインのスプラッシュブロックを塗布します。
- 針付きの合成吸収性5-0縫合糸を使用して、連続した皮下パターンで皮膚を閉じます。
注:偽のラットは、ステップ4.18と4.19なしで同じ手順を受けます。
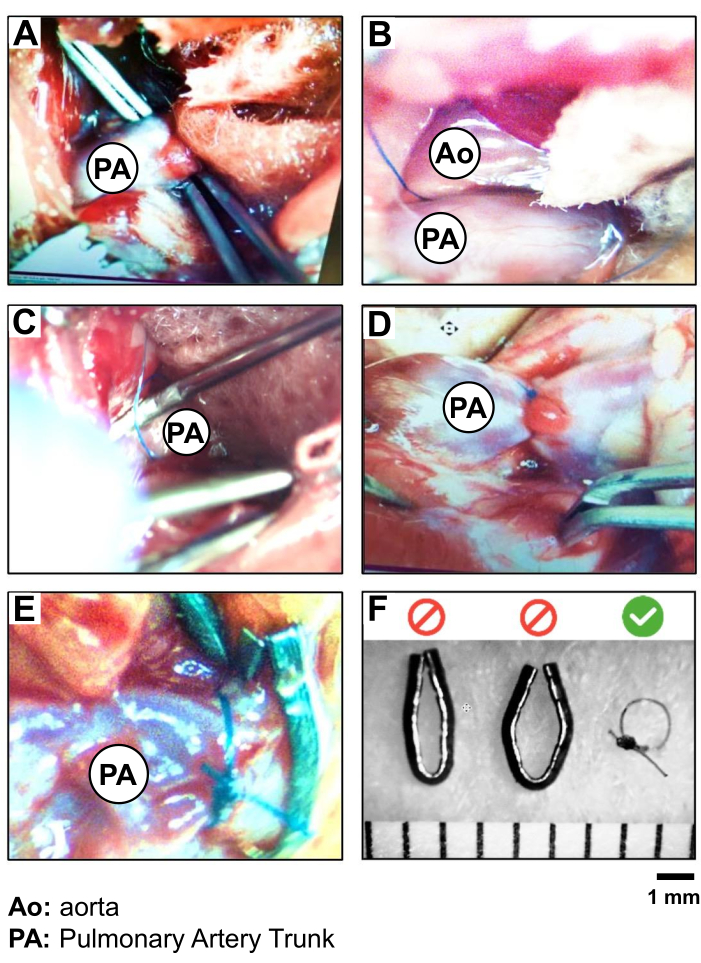
図2:PABの手順と5.0シルク縫合糸と金属クリップの検証。 PAトランクの段階的な単離と結紮の写真、(A)PAトランクの露出と単離、(B)PAトランクの周りの縫合糸(5.0シルク)の位置、(C)PA(PAB)の結紮(リードとして19G針を使用)を示しています。(D)PABに続く心臓の動きとPAルートおよびRV過負荷の検証。(E)シルク縫合糸と金属クリップで行われたPABの比較。(F)PABの絹縫合糸の選択の検証により、PA体幹の周囲に1mmのより再現性のある直径を作り出すこと。 この図の拡大版を表示するには、ここをクリックしてください。
5. 術後の回復
- 酸素の流れのみでラットを機械的換気下に維持しながら、イソフルランを取り外してください。.ラットを右側または腹側に向け、呼吸を促進します。
- 0.9%生理食塩水を背側頸部に皮下注射して、体液の回復を促進します(麻酔の10 mL / kg / hとして計算)。
- 自律呼吸が確認されたら、気管内チューブをスムーズに取り外します。
- ラットが自分で動き始めるのを観察し、動物を加熱パッドから新しい滅菌ケージに移して回復させます。水とウェットフードを 自由自在に提供します。
- 術後期間(4〜6時間)には、ケージを加熱パッド(ケージの半分)の上に置いて、体温を維持し、動物を綿密に監視します。
- 痛み、呼吸困難、または異常な行動の兆候を迅速に管理してください。
- 術後ケアでは、手術の6時間後に、0.05 mg / kgブプレノルフィンの2回目の投与を注射します。.翌日、手術の24時間後に、0.05 mg / kgブプレノルフィンの3回目の投与と5 mg / kgケトプロフェンの2回目の投与を注射します。.
- ラットが完全に健康に回復するまで監視します。
6. 経胸壁心エコー検査
注:この論文は、ラットが経胸壁心エコー検査を受けた手術後21日目に得られたデータを示しています。ただし、研究目的と研究デザインの要件に応じて、研究者はPAB経胸壁心エコー検査の前後に他の時点を定義できます。
- 手術前にベースラインの経胸壁心エコー検査を実施して、PA 直径を決定し、PAB 中に予想される PA 直径の 60% の減少を生成するためのリードとして使用される適切なゲージ針を選択します。
注:この研究では、225〜275gの雄Wistarラットを使用し、19Gの針の利用は、PA直径のそのような60%の減少を生成するために適切でした。 - ラットの体重を量り、継続的に吸入したイソフルラン(3%および2 L / min O2)で麻酔します。.
- 12Sセクター/マルチエレメントプローブ(4.5-11.5 MHz)と画像取得システムを使用して、各動物に経胸壁心エコー検査を行います。
- 12Sプローブを大動脈弁のレベルに配置することにより、2次元(2D)胸骨傍短軸ビューでカラーマッピングを使用します。エコーマシンのカラードップラーボタンをクリックして、肺幹の肺動脈バンディング(PAB)領域を横切る血流パターンを視覚化します。
- 2D胸骨傍短軸ビューのカラーマッピングによって導かれてPABを横切ることにより、連続波ドップラー(CW)を実行し、ピーク速度(cm / s)や平均圧力勾配(mmHg)など、PAB領域を横切る血流の特性を記録します。ドップラー曲線を取得するには、肺動脈バンディングのレベルでサンプル量を調整します。
- 12Sプローブを心臓の頂点の高さに配置して2Dアピカル4チャンバービューを適用し、手術後のRAとRVの拡大を実証し、ミリメートル(mm)で表される心収縮末期(RAD)のRA水平寸法を決定します。
- 2D アピカル 4 チャンバー ビューでカラー マッピングを適用し、エコー マシンでシネループを取得することにより、PAB による三尖弁逆流を明らかにします。
- 三尖弁輪とRV側壁の合部を交差させることにより、頂端4チャンバービューで Mモード 心エコー検査を行い、mmで表される三尖弁輪面収縮期エクスカーション(TAPSE)を研究します。
- 三尖弁輪と RV 側壁の合流点のレベルで頂端 4 チャンバー ビューで組織 ドップラー イメージング (TDI) を使用して、RV 収縮期パフォーマンスを評価するためのセンチメートル/秒 (cm/s) で表される RV 側壁収縮性 (Sr) を測定します。
- パルス波ドップラーを使用して拡張期経三尖弁流(TTF)を頂端4チャンバービューで記録し、初期充填(E)波のピーク速度、心房充填(A)波、TTFのE / Aの比率など、RV拡張期特性を研究します。
- 大動脈弁のレベルで胸骨傍長軸図で M モード 心エコー検査を行い、心拡張期末の RV 流出路 (RVOT、ミリメートルで表される) と心収縮期末の左心房寸法 (LAD、ミリメートルで表される) を測定します。
- 乳頭筋のレベルで胸骨傍短軸図で 2D M モード 心エコー検査を行い、収縮末期および拡張期の LV 寸法 (LVD および LVDd) を評価します。拡張末期のLV前壁の厚さ(LVAWd)は、すべてミリメートルで表されます。
- 短軸傍胸骨ビューで 2D M モードを実行し、LV フラクショナル短縮 (LVFS、パーセントで表される) と LV 駆出率 (LVEF、パーセントで表される) を決定します。
7. 電気生理学的研究(図3)
- in vivo 経食道電気生理学的研究 (EPS) のための in vivo 心エコー検査後にラットを麻酔下で維持します。
- 心電図電極をラットの皮下(左前肢付近に1枚、右後肢付近に1枚、左後肢付近に1枚)に挿入します。
- 極間距離が4mmの5F-四極カテーテルを食道に静かに導入します(図3A)。
- 表面心電図で心房収縮を表すP波が経食道カテーテルの心電図で得られたP波と一致するタイミングを正確に判断することにより、RAに近い経食道カテーテルの位置を調整します(図3A、B)。
- 各動物の刺激閾値を決定します。このしきい値は、刺激装置が心拍数に直接影響を与える最小電圧です。
- 12回の刺激バーストを3セット実行し、各刺激バーストが50Hzで3秒間続き、その後2秒間の静止(1分/セット)のプロトコルに従って、しきい値電圧の4倍に相当する電圧バーストを印加することにより、AFの脆弱性を評価します。各セットの間に、ラットは1分間の休息期間9,13,21を持っていました。
- 各バースト後に、AFや心房粗動などの心タキアリュアリズムの発生を特定し、定量化します。
注:AFは、不規則で超高速の心房拍動(>800 bpm)として定義されます。心房粗動は、P波の不在または規則的に連続するR-R間隔間の複数のP波の規則的なパターンの存在に関連する規則的だが急速な心房リズムとして定義されます。1秒以上続く不整脈エピソードのみが考慮されます。. - 2つの連続した刺激の間の休息期間内に洞調律が自然に回復しない場合は、次の刺激のセットを停止することにより、AFまたは心房粗動の進行中のエピソードを中断することを避けてください。.
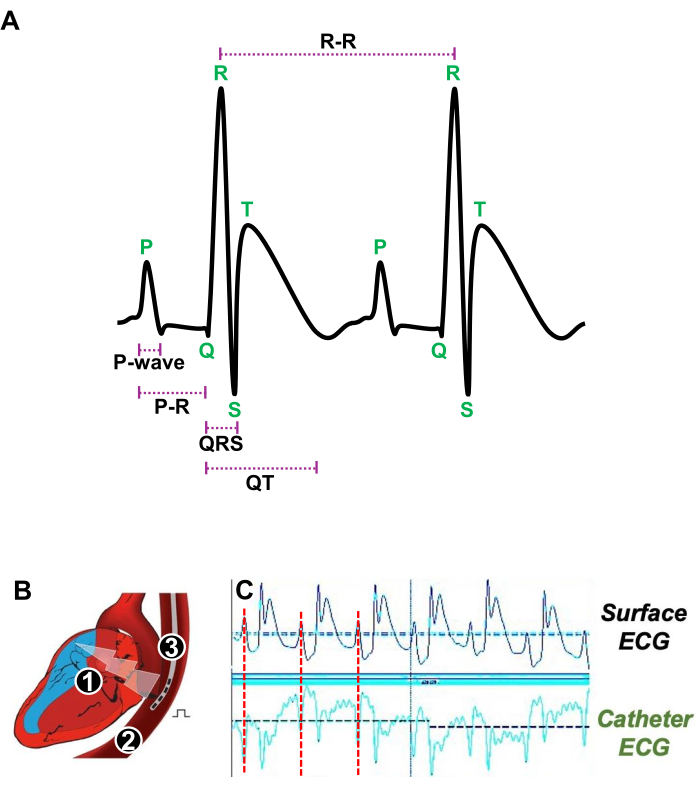
図3:安静時の心拍の図と in vivo 電気生理学的研究のための経食道カテーテルの適切な位置 (A)P波、PR間隔、QRS群、QT間隔、およびR-R間隔を示す安静時の2つの連続した心拍の代表的な心電図。(B)心臓(1)の縦断面と食道(2)の概略図で、四極カテーテル(3)が導入されて心房心電図を刺激し、獲得します。(C)表面心電図(上側トレース)からの心房信号(赤線)がカテーテル心電図(下側トレース)の心房信号と一致する場合の経食道カテーテルの好ましい位置を示す代表的な心電図信号。 この図の拡大版を表示するには、ここをクリックしてください。
8. 心電図解析
注:ECGの記録と刺激は、ECG取得ソフトウェアを使用して行われました。解析は、ECG解析ソフトウェアを用いて行いました(図3A)。
- 心房収縮に対応するP波の持続時間をミリ秒(ms)で測定します。
- 房室(AV)結節を通る電気伝導の持続時間に対応するPR間隔(ミリ秒で表される)を決定します。
- 心室脱分極に対応する QRS 群 (ミリ秒単位) の持続時間を報告します。
- 心室脱分極と再分極の合計時間を反映する QT 間隔 (ミリ秒で表される) を評価しました。
- RR間隔(ミリ秒単位)を定量化し、2つの連続した心拍間の時間を示し、心拍数を決定します。
9. 組織学的解析
- PAB 後 21 日目にイソフルラン麻酔 (5%、2 L/min O2) 下での放血によりラットを安楽死させます。
- RAとLAを分離して、RHFおよび心不整脈に関連するかどうかの心房組織学的リモデリングを分析します。
- 切除したばかりの心臓の横断面を頂点から 5 mm のところで行い、RHF および心不整脈に関連するかどうかの心室リモデリングを評価します。
- 心筋サンプルをホルマリンで固定し、Massonのトリクローム溶液22 で組織スライドを染色して、PAB後のD21での心室壁の厚さと拡張および心房線維症を定量化します。
10. 統計分析
- Shapiro-Wilk 検定によって分布の正規性を評価します。スチューデントのt検定を使用して正規分布データを比較します。
- データがノンパラメトリック分布の場合は、マンホイットニー検定を実行します。フィッシャーの正確確率検定を使用して、AF誘導性などのカテゴリ変数を分析します。
- 結果を平均 ± 標準誤差を平均値 (S.E.M.) として表します。両側のP値が0.05<統計的に有意な差を考慮します。
結果
手術中のPA体幹の適切な結紮の視覚的確認
PAB処置中、縫合糸の良好な位置決めの指標は、血圧の即時増加とRVとRVとの接合部でのPA体幹の根元の迅速な拡張です。縫合糸は、3週間にわたって一定かつ恒久的な圧力過負荷を確保するために動かしてはなりません。この研究では、5-0 Silkの使用が金属製のクリップよりも安定していることが確認されました(...
ディスカッション
PABの正常なパフォーマンスは、このプロトコルの最も重要な部分です。大動脈とPA体幹を適切に区別することが重要です。PAの分離は、処置中の裂傷、出血、死亡を避けるために細心の注意を払って行う必要があります。19Gリードの周りの縫合糸の適用は、リードの存在によるPAの「完全な閉塞」が長すぎるのを避けるために、迅速に行い、その後すぐにリードを取り...
開示事項
著者は何も開示していません。
謝辞
著者らは、経胸壁心エコー検査の技術的性能についてColombe Roy氏、YanFen Shi氏、Sandra Querry氏、Josiane Deslandes氏に感謝し、PAB法の標準化における予備的な技術支援を提供してくれたNathalie L'Heureux氏に感謝しています。モントリオール心臓研究所の動物ケア施設のメンバーに感謝しています。
資料
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chlorine Injection USB (100 ml) | Baxter | JB1302P | Solution used for drugs (analgesic and anti-inflammatory) dilution and for preparing saline water syringes dedicated to rehydrating the animal after the surgery |
| 19 G x 1 1/2 PrecisionGlide Needle | BD | 305187 | Needle modified (bent and blunted) to be used as a spacer during for the partial constriction of the pulmonary trunk |
| 2" x 2" Non Woven Non-Sterile Ritmed Gauze Sponge, 4-Ply | AMD-Ritmed | A2101-CH | Gauze sponges used to absorb blood from the wound or to gently push organs (ex: thymus) aside. |
| 4" x 4" Non Woven Non-Sterile Ritmed Gauze Sponge, 4-Ply (x200) | AMD-Ritmed | A2100-CH | Gauze sponges used to absorb blood from the wound or to gently push organs (ex: thymus) aside. |
| 5-0 Vicryl Violet Suture RB-1 1/2 Circle Needle 17mm 27" | Ethicon | J303H | Synthetic absorbable sterile surgical suture with a taperpoint needle used for muscle and skin wounds closure. |
| Anafen (100 mg/mL) | Merial Canada, Inc. | 1938126 | Diluted injectable solution of ketoprofen administered as a nonsteroidal anti-inflammatory, analgesic and antipyretic drug. |
| AutoClip System | FST | 12020-00 | Can be used to close the skin wound. Includes a clip applier, wound clips (9 mm) and a clip remover. |
| Dumont #5/45 Forceps | FST | 11251-35 | Dumoxel forceps with tips angled at 45°. Used to tighten the knots around the spacer placed on the pulmonary trunk. |
| Fine Scissors - Sharp | FST | 14060-10 | Stainless steel iris scissors dedicated to intercostal muscles incision and suture cutting. |
| Forane (Isoflurane) 100 mL | Baxter Canada | BAXCA2L9100 | Inhalation anesthetic used for rodents during their PAB surgery. |
| IV Catheter 16 G x 1.77 " (Straight) | BD Insyte | 381257 | Catheter used as an endotracheal tube with its metal stylet blunted. |
| Light LED 130 F - DrMach | Eickemeyer | M130300 | LED wall mounted light. |
| Magnetic Fixator Retraction System: Base plate | FST | 18200-50 | Metal plate on which the associated fixtures are installed. It is placed around the heating plate. |
| Magnetic Fixator Retraction System: Elastomer (2 m Roll) | FST | 18200-07 | Used to attach the retractors to the fixators. |
| Magnetic Fixator Retraction System: Fixators | FST | 18200-02 | Movable anchors that can be placed on the base plate. |
| Magnetic Fixator Retraction System: Retractors | FST | 18200-11 | Retractors allowing to maintain the surgical wound with the desired opening |
| Metzenbaum Scissors (Curved) | FST | 14017-14 | Stainless steel blunt scissors used for blunt dissection of the skin and muscles. |
| Micro-Adson Forceps | FST | 11018-12 | Stainless steel serrated forceps used to grasp skin and other tissues. |
| Oster Golden A5 2-Speed Clipper | Oster Professional | 34264416949 | Pet grooming clipper used to prepare the surgical field. Since it's meant to be used with large animals, the user needs to be careful with rats. |
| Rodent heating plate or warming system | Custom made | N/A | Plate connected to a unit equipped with a LED screen displaying the temperature detected by the rectal probe as well as the target temperature. |
| Rodent Ventilator Model 683 | Harvard Apparatus | 74240-2 | Mechanical ventilator used for small laboratory animals (max 5 kg). |
| Semken Forceps with Serrations (Curved) | FST | 11009-13 | Stainless steel forceps used for tissue dissection. |
| Semken Forceps with Serrations (Straight) | FST | 11008-13 | Stainless steel forceps used for tissue dissection. |
| Silky Fresh Hair removal Cream | Veet | 62200825036 | Hair removal product used to prepare the surgical site after shaving. |
| Soluprep | 3M | 103.26 | Bottled antiseptic solution tinted with 2% chlorhexidine and 70 % alcohol 225 mL. |
| Stainless steel spatula 195 mm | Heathrow Scientific | HS15907 | Spatula used as a tongue depressor during rat intubation. |
| Stereomicroscope System SZ61TR | Olympus | 88-126 | Microscope equipped with binoculars and a built-in camera allowing for video filming. |
| Sterile Sodium Chloride 0.9% Irrigation Bottle (60 mL) | Saline H2O | 25-6048SA-L | Solution used to keep the wound moist throughout the surgery. |
| Surgical Scissors - Sharp-Blunt (Straight) | FST | 14001-12 | Stainless steel scissors used to make the initial skin incision. |
| Suture 5-0 Silk No Needle | Henry Schein | 102-6344 | Silk thread used to do the constriction of the pulmonary trunk |
| Systane Ointment | Alcon | 2444062 | Eyes lubricant providing a temporary relief of burning and irritation caused by the dryness of the eyes during surgery. |
| SZ2-STU2 stereomicroscope stand | Olympus | N1198900 | The arm attached to the base provides a great freedom of movement to the microscope head. |
| Tissue forceps - 1X2 Teeth | FST | 11021-15 | Stainless steel forceps allowing to grasp, hold and manipulate tissues (skin and muscles). |
| Transpore Surgical Tape | 3M | 1527-1 | Medical tape used to immobilized the rats' forelimbs and hindlimbs. |
| Vetbond Tissue Adhesive (3 mL) | 3M | 1469SB | Surgical glue that can be applied in small amounts on the skin It can be used as a complement to subcutaneous sutures. |
| Vetergesic Multidose (0.3 mg/mL) 10 mL | Ceva Canada | 2342510 | Diluted injectable solution of buprenorphine administered as an analgesic drug. |
| Veterinary anesthesia evaporator Tec 4 | Dispomed | 34001 Iso | Enables vaporization of isoflurane and concentration at 0–5%. |
参考文献
- Cassady, S. J., Ramani, G. V. Right heart failure in pulmonary hypertension. Cardiol Clin. 38 (2), 243-255 (2020).
- Campo, A., et al. Outcomes of hospitalization for right heart failure in pulmonary arterial hypertension. Eur Respir J. 38 (2), 359-367 (2011).
- Naeije, R., Manes, A. The right ventricle in pulmonary arterial hypertension. Eur Respir Rev. 23 (134), 476-487 (2014).
- Vonk-Noordegraaf, A., et al. Right heart adaptation to pulmonary arterial hypertension: physiology and pathobiology. J Am Coll Cardiol. 62 (25 Suppl), D22-D33 (2013).
- Olsson, K. M., Nickel, N., Tongers, J., Hoeper, M. M. Atrial flutter and fibrillation in patients with pulmonary hypertension. Int J Cardiol. 167 (5), 2300-2305 (2013).
- Mercurio, V., et al. Pulmonary arterial hypertension and atrial arrhythmias: incidence, risk factors, and clinical impact. Pulm Circ. 8 (2), 2045894018769874 (2018).
- Dignam, J. P., Scott, T., Kemp-Harper, B., Hobbs, A. J. Animal models of pulmonary hypertension: Getting to the heart of the problem. Br J Pharmacol. 179 (5), 811-837 (2021).
- Silva, A. L., et al. Monocrotaline induces acutely cerebrovascular lesions, astrogliosis and neuronal degeneration associated with behavior changes in rats: A model of vascular damage in perspective. Neurotoxicology. 94, 59-70 (2023).
- Hiram, R., et al. Right atrial mechanisms of atrial fibrillation in a rat model of right heart disease. J Am Coll Cardiol. 74 (10), 1332-1347 (2019).
- Hirata, M., et al. Novel model of pulmonary artery banding leading to right heart failure in rats. Biomed Res Int. 2015, 753210 (2015).
- Jalal, Z., et al. Unexpected internalization of a pulmonary artery band in a porcine model of tetralogy of Fallot. World J Pediatr Congenit Heart Surg. 8 (1), 48-54 (2017).
- Akazawa, Y., et al. Pulmonary artery banding is a relevant model to study the right ventricular remodeling and dysfunction that occurs in pulmonary arterial hypertension. J Appl Physiol. 129 (2), 238-246 (2020).
- Le Quilliec, E., et al. Atrial cardiomyocytes contribute to the inflammatory status associated with atrial fibrillation in right heart disease. Europace. 26 (4), euae082 (2024).
- Cheng, H. W., et al. Assessment of right ventricular structure and function in mouse model of pulmonary artery constriction by transthoracic echocardiography. J Vis Exp. (84), e51041 (2014).
- Cheng, T. C., Philip, J. L., Tabima, D. M., Hacker, T. A., Chesler, N. C. Multiscale structure-function relationships in right ventricular failure due to pressure overload. Am J Physiol Heart Circ Physiol. 315 (3), H699-H708 (2018).
- Mamazhakypov, A., Veith, C., Schermuly, R. T., Sydykov, A. Surgical protocol for pulmonary artery banding in mice to generate a model of pressure-overload-induced right ventricular failure. STAR Protoc. 4 (4), 102660 (2023).
- Prihadi, E. A., et al. Morphologic types of tricuspid regurgitation. Characteristics and prognostic implications. JACC: Cardiovasc Imaging. 12 (3), 491-499 (2019).
- Samson, N., Paulin, R. Epigenetics, inflammation and metabolism in right heart failure associated with pulmonary hypertension. Pulm Circ. 7 (3), 572-587 (2017).
- Liu, Z., et al. Low-voltage zones as the atrial fibrillation substrates: Relationship With initiation, perpetuation, and termination. Front Cardiovasc Med. 8, 705510 (2021).
- Tomasello, G., et al. Simple and fast orotracheal intubation procedure in rats. Acta Biomed. 87 (1), 13-15 (2016).
- Halațiu, V. B., Perian, M., Balan, A. I., Scridon, A. Transesophageal atrial burst pacing for atrial fibrillation induction in rats. J Vis Exp. (180), e63567 (2022).
- Prophet, E. B., Mills, B., Arrington, J. B., Sobin, L. H. . Laboratory Methods in Histotechnology. , (1992).
- Silva, J. M. A., et al. Hypertrophy of the right ventricle by pulmonary artery banding in rats: a study of structural, functional, and transcriptomics alterations in the right and left ventricles. Front Physiol. 14, 1129333 (2023).
- Camacho, P., Fan, H., Liu, Z., He, J. Q. Small mammalian animal models of heart disease. Am J Cardiovasc Dis. 6 (3), 70-80 (2016).
- Andersen, S., et al. A pulmonary trunk banding model of pressure overload induced right ventricular hypertrophy and failure. J Vis Exp. (141), e58050 (2018).
- Ukita, R., et al. A large animal model for pulmonary hypertension and right ventricular failure: Left pulmonary artery ligation and progressive main pulmonary artery banding in sheep. J Vis Exp. (173), e62694 (2021).
- Myers, P. O., et al. Impact of age and duration of banding on left ventricular preparation before anatomic repair for congenitally corrected transposition of the great arteries. Ann Thorac Surg. 96 (2), 603-610 (2013).
- Liu, C., et al. Reverse remodeling of pulmonary arterioles after pulmonary artery banding in patients ≥ 2 years old with severe pulmonary arterial hypertension and congenital heart disease. Pediatr Cardiol. 40 (5), 958-964 (2019).
- Roy, B., Vacas, S., Ehlert, L., McCloy, K., Saggar, R., Kumar, R. Brain structural changes in patients with pulmonary arterial hypertension. J Neuroimaging. 31 (3), 524-531 (2021).
- Hiram, R. Resolution-promoting autacoids demonstrate promising cardioprotective effects against heart diseases. Mol Biol Rep. 49 (6), 5179-5197 (2022).
- Hiram, R. Cardiac cytokine therapy? Relevance of targeting inflammatory mediators to combat cardiac arrhythmogenic remodeling. Int J Cardiol Heart Vasc. 37, 100918 (2021).
- Al-U'datt, D. G. F., et al. Implications of enigmatic transglutaminase 2 (TG2) in cardiac diseases and therapeutic developments. Biochem Pharmacol. 201, 115104 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved