Method Article
膜性腎症ラットにおけるPI3K/AKTシグナル伝達経路を介したKemeng Fangによる足細胞アポトーシス阻害のメカニズム
要約
現在のプロトコルでは、膜性腎症 (MN) 動物モデルの確立と、Kemeng Fang の阻害が PI3K/AKT シグナル伝達経路を活性化することにより MN ラット足細胞のアポトーシスを減少させる方法について説明します。
要約
膜性腎症(MN)は、成人ネフローゼ症候群の一般的な病理学的タイプです。MN患者の最大20%が末期腎疾患(ESRD)を発症します。足細胞は、糸球体濾過バリアを維持する重要な機能を持ち、タンパク尿とMNの発生と発達に重要な役割を果たします。PI3K/AKTシグナル伝達経路は、足細胞の増殖、分化、およびアポトーシスの全過程に関与しています。Kemeng Fang(KMF)は、腎臓の損傷を遅らせるために使用されてきた伝統的な漢方薬の処方です。しかし、MNにおけるKMFの治療メカニズムは不明です。ここでは、カチオン化ウシ血清アルブミン(C-BSA)の腋窩、鼠径部、尾静脈への注射によりMNラットモデルを確立し、その後、KMF阻害剤とPI3K阻害剤(LY294002)を投与しました。ラットの肝機能、腎機能、血中脂質、腎臓病理、足細胞機能、PI3K/AKTシグナル伝達経路の発現レベル、およびトランスクリプトミクスのデータは、KMFがPI3K/AKTシグナル伝達経路を活性化することによりMNラットの足細胞に保護効果をもたらし、MNの進行を効果的に予防できることを示しました。
概要
膜性腎症(MN)は、成人ネフローゼ症候群の一般的な病理学的タイプであり、年間発生率は10万人あたり約5〜10人です。主に30歳から50歳の間に発生し、子供ではまれです(約5%)。女性よりも男性の方が有意に多く見られます(2:1)。さらに、MN患者の最大20%が末期腎疾患(ESRD)を発症します。さらに、MN患者が年々ESRDを発症する傾向が見られます1,2,3。MNの病理学的特徴は、顆粒性免疫グロビンG(IgG)と補体膜攻撃複合体(MAC)が足細胞に隣接する糸球体基底膜(GBM)に大量に沈着することです。この沈着は、GBMの肥厚と糸球体濾過バリアの完全性の崩壊につながり、最終的にはタンパク尿4につながります。
支持療法、免疫抑制剤、および標的モノクローナル抗体は、MNを治療するための主な方法です。これらの介入は、タンパク尿を大幅に減らし、腎機能低下の進行を遅らせることができますが、多くの欠点もあります。まず、支持療法は低リスクの患者にのみ適しています5。第二に、免疫抑制剤は、大腿骨頭壊死、二次感染、骨髄造血機能の阻害などの副作用を引き起こす可能性があります6。第三に、オファミズマブ、オツズマブ、ダレトズマブ、イサツキシマブなどのモノクローナル抗体の使用に関するエビデンスに基づく医療を提供するためには、広範なランダム化比較試験研究が必要である 7,8,9。したがって、MNの有効な治療法を積極的に模索することは、ESRDの発症を遅らせ、MN患者の生活の質を向上させる上で大きな意義があります。
足細胞は、糸球体内臓上皮細胞とも呼ばれ、GBMの外側に付着しており、GBM毛細血管内皮が一緒になって糸球体血液ろ過バリアを形成します。それらは、糸球体タンパク質ろ過バリアの維持、正常な基底膜の合成、糸球体毛細血管神経叢10,11の構造的支持の提供などの重要な機能を持っています。研究によると、足細胞のアポトーシスは、タンパク尿とMNの発生と発達に重要な役割を果たしており、PI3K / AKTシグナル伝達経路は、足細胞の成長、分化、およびアポトーシスの全プロセスに関与していることが示されています12,13,14。
ますます多くの研究が、漢方薬がMNの治療に大きな利点をもたらし、血中クレアチニン、タンパク尿、および遅発性腎障害を大幅に減らすことができることを示しています15,16。KMFは、13の植物に由来する成分を含む伝統的な漢方薬化合物です:Codonopsis pilosula(フランシュ。ナンフ。(ダンシェン、DS);Astragalus membranaceus(フィッシュ。バンジ。(黄旗、本社);コプティス・チネンシスフランシュ。(黄蓮、HL);Perilla frutescens(L.)ブリット。(スイエ、SY);Rehmannia glutinosa(Gaertn。(Shudihuang、SDH);Ligusticum chuanxiong Hort. (Chuanxiong, CX);ユーリアレフェロックスサリスブ。(銭士、QS);サビアジャポニカ諺。(秦豊天、QFT);Rhus chinensis(ラス・チネンシス)ミル(Wubeizi、WBZ);ロベリア・チネンシス寂しい。(バンビアンリアン、BBL);オルデンランディア・ディフューサ (Willd.)ロックスブ。(バイワシェシェカオ、BHSSC;表 1)。KFMには、腎臓の調子を整える(腎機能を高める)、気を高める(免疫力を強化する)、利尿を促進する、側副血縁石を浚渫する(血行を促進する)など、多くの機能があります。しかし、MNにおけるKMFの治療メカニズムは不明である17,18。
現在、HEYMANN腎炎モデル、C-BSA腎炎モデル、α3NC1マウスモデルなど、MNモデルを構築する多くの方法があり、Heymann腎炎モデルでは、主な病原性抗原メガリンタンパク質はヒトMNには見られないため、ヒトMNの病因とは異なり、α3NC1マウスモデル、マウスモデルの成功率のDBA / 1遺伝的背景のみが高くなります。 残りのマウスはモデリングにあまり成功しなかったか、19,20,21をモデル化することさえできませんでした。C-BSA腎炎モデルは、費用対効果が高く、操作が簡単で、その病因はヒトのMN動物モデル19と非常によく似ています。基本的な原理は、GBMが負に帯電しており、C-BSAが正に帯電しているため、GBMを簡単に通過して植えられた抗原になり、循環抗体がそこに蓄積してin situ免疫複合体を形成し、それによってMNモデル22,23を構築することです。本研究の目的は、トランスクリプトミクスと分子生物学を組み合わせて、KMFのMNに対する治療効果とその分子メカニズムを観察し、KMFによるMNの治療に信頼できる科学的根拠を提供することであった。
プロトコル
本試験は、湖北省疾病管理予防センター(ID番号:202220144)の実験動物管理・使用委員会によって審査され、承認されました。ラットは、23±1°Cおよび50%-60%の大気湿度の非病原性条件下で、12時間の明暗サイクルを受けた。湖北省疾病管理予防センター(認可番号:SYXK [E] 2022-0065)から生後8週齢の雄のSprague-Dawleyラット100匹を調達し、特定の病原体フリーグレードの環境で1週間、通常の維持給餌と飲用滅菌水を用いて適応摂食を行いました。
1.薬剤の調製
- KMFの準備
- 使用した漢方薬は、長春中医薬大学付属病院から提供されたもので、具体的な組成と投与量を 表1に示します。準備するには、合計147 gの生薬を使用します-Codonopsis pilosula (20 g)、 Astragalus membranaceus (30 g)、 Coptis chinensis (3 g)、 Perilla frutescens (6 g)、 Rehmannia glutinosa (15 g)、 Ligusticum chuanxiong (15 g)、 Euryale ferox (15 g)、 Sabia japonica (10 g)、 Rhus chinensis (3 g)、 Lobelia chinensis (15 g)、 Oldenlandia diffusa (15 g)。1470mLの蒸留水に30分間混合して浸します。
- ハーブ混合物をセラミックポットに入れ、100°Cで90分間加熱して煎じ薬にします。2層の医療用ガーゼでろ過し、室温で保管します。
- 残りのハーブ混合物に蒸留水(1470 mL)を再度加え、ステップ1.1.2で説明したように、上記の煎じ薬操作をもう一度繰り返します。濾液を室温で保存します。
- 上記の2つの濾液を混合し、水溶液が完全に蒸発し、溶質のみが粉末の形で保持されるまで、80°Cで10時間オーブン乾燥します。
- 粉末を秤量し、生理食塩水に溶解して、ラットに投与する薬剤の1日量である4mLあたり1.323g、2.646g、5.292gの薬剤を含む溶液を作ります(濃度はそれぞれ0.331g/mL、0.662g/mL、1.323g/mL)。
- 塩酸ベネドリルの調製
- 塩水100mLに塩酸ベネドリル錠(90g)を加え、よく振って完全に溶解します。
- PI3K阻害剤LY294002の調製
- DMSO1.1mLにLY294002粉82.3mgを加え、よく振ると完全に溶解します。次に、生理食塩水198.9mLを加えて希釈し、0.41 mg / mLの濃度を得ます。
- C-BSA乳化剤の調製
- 500mLの再蒸留水に67mLの無水エチレンジアミンを加えて混合します。6 M塩酸350 mLをゆっくりと加え、pHを4.75に調整します。最終溶液の温度を25°Cに保ちます。
- 5 gの天然ウシ血清アルブミンを25 mLの再蒸留水に溶解し、溶液を25°Cの一定温度に保ち、絶えず攪拌します。2時間後に、1.8 gの塩酸カルボジイミドと30 mLのpH 4.75の4 M酢酸緩衝液を添加して、C-BSA溶液を得ます。
- 得られた溶液を4°Cで72時間(水は3〜5時間ごとに交換する)再蒸留水でセレナイト紙を使用して透析し、凍結乾燥してC-BSA凍結乾燥粉末を取得し、-80°C24で保存します。
- 生理食塩水50mLにC-BSA乾燥粉末100mgを加えてC-BSA溶液を作ります。これを等量の不完全フロイントアジュバントと混合して、完全な乳化を行います。その濃度は1mg / mLです。
- C-BSA溶液の調製
- 100mLのPBSに640mgのC-BSA乾燥粉末を加え、よく振って完全に溶解します。その濃度は6.4 mg / mLです。
2. MNモデル動物の構築
注:実験は、正常対照群(CON)、モデル群(MOD)、ベナゼプリル塩酸塩群(BEN)、KMF低用量群(KM-L)、KMF中用量群(KM-M)、KMF高用量群(KM-H)、PI3K阻害剤群(PI3K)、およびPI3K阻害剤+KMF中用量群(PI3K + KM-M)の8つのグループに分けられました。正常な対照群を除くすべての群にC-BSAを投与し、MNモデルを作成しました。
- 9週目に事前免疫を行います:腋窩と鼠径部にC-BSA乳化剤を複数回皮下注射します。
注:首筋(肩甲骨間)は、C-BSA乳化剤の皮下投与の代替部位です。.- 左手でネズミの背中の皮膚をつかみ、腹部の皮膚を引き締めた状態で腹部を上に向けます。C-BSA乳化剤をラットの腋窩と鼠径部に2.5mLシリンジを使用して、1日おきに1回1週間皮下注射します。.
- 形式免疫:C-BSA溶液の尾静脈注射
- 10週目に、ラットをケージから取り出し、尻尾を実験者に向けてワイヤーバーの蓋に置きます。
- ネズミの尻尾をアルコールの綿球で拭き、左手の親指と人差し指でネズミの尻尾の両側をつまんで静脈を埋め、静脈を上に向けておきます。
- 1mLの注射器を右手に持ち、針が尾静脈に対して30°になるようにします。針の先端を上に面取り、針を血管と平行に保ち、皮膚に優しく刺した直後。針から血液が戻ってきた場合は、2.5 mL / kgのC-BSA用量とともに週に3回、4週間注射します。.
- 注入終了後、乾いたコットンボールで注入点を約1分間押して出血を止めます。マウスをイモビライザーから取り外し、ケージに戻します。
3. KMFの分析
- サンプル1 gを2 mLの遠心チューブに礁量し、600 μLのMeOH(2-アミノ-3-(2-クロロフェニル)-プロピオン酸(4 ppm)を含む-20°Cで保存)を加え、混合物を30秒間ボルテックスします。
- 約100 mgのガラスビーズを加え、混合物をティッシュグラインダーに60 Hzで90秒間置きます。
- 室温で40kHzで15分間超音波を実行します。
- 15,984 x g、4°Cで10分間遠心分離し、0.22 μmのメンブレンで上清をろ過します。LC-MS検出用の検出ボトルを移し替えます。
4. 薬物治療
注:成人は1日あたり147 gKMFが必要です。ラット実験用とヒト薬剤用用量の換算式によれば、ラットの等価実験用量(g/kg)=ヒト用量(g)/体重(70kg)×6.3、ラットの1日量は約13.23g/kgであった。
- 14週目には、左手でラットの背中の皮膚をつかみ、腹部を上に向け、腹部の皮膚を引き締めます。10mL注射器の針を右手に持ち、片側から口に挿入し、口蓋と咽頭の後壁に沿ってスライドさせ、さらに嚥下作用を使用して胃に滑り込ませます。
- 右手の人差し指でゆっくりと薬剤を投与し、投与終了後に胃針を引き抜きます。投与された薬物の投与量は、合計4週間で10mL / kgです。
- CONおよびMODグループの場合、10 mL / kg /日生理食塩水を強制経口投与します。.
- BEN群には、9 mg / kg /日ベネドリル塩酸塩水溶液を強制経口投与します。.
- KM-L群は、KMFの水性抽出物3.3075g/kg/dayを強制経口投与します。KM-M群には、KMFの水性抽出物6.615 g/kg/dayを強制経口投与します。KM-H群は、KMFの水性抽出物13.23 g/kg/dayを強制経口投与します。
- PI3K群は、2.1 mg/kg/dayをLY294002強制経口投与します。
- PI3K+KM-M群は、2.1 mg/kg/day LY294002(5 mL/kg)+6.615 g/kg/dayのKMF水性抽出物(5 mL/kg)を強制経口投与します。
5. KMFの有効性評価
- 血液および尿の生化学的指標の検出
- 14週目以降は、実験開始後2週間ごとに尿を採取してください。1匹のラットを代謝ケージに24時間置きます。食事制限を行い、飲料水への無料アクセスを提供する。代謝ケージの下に置かれた50mLの遠心分離チューブを使用して尿を採取します。.
- 尿を15,984 x g で10分間遠心分離し、上清を使用して尿中タンパク質テストキットの指示に従って尿中タンパク質のレベルを推定します。.
- 18週目に、5%イソフルランを吸入してラットを安楽死させます。乾燥を防ぐために、目に獣医軟膏を使用してください。子宮頸部脱臼法を使用して死亡を確認します。左手でネズミの背中の皮膚をつかみ、ハサミでネズミのヒゲを整えます。
- 眼球の周りの皮膚をエタノールで消毒し、止血鉗子を使用して眼球をすばやく取り除きます。遠心チューブに滴下した血液を採取し、室温で30分間放置した後、15,984 x g で10分間遠心分離します。上清を集めます。
- アラニンアミノトランスフェラーゼ(ALT)、アスパラギン酸トランスアミナーゼ(AST)、アルブミン(ALB)、トリグリセリド(TG)、総コレステロール(TC)、血中尿素窒素(BUN)、血清クレアチニン(Scr)、総タンパク質(TP)、その他の血液指数を自動生化学分析装置で検出します。
- 腎組織の分離
- ラットから血液を採取した後、手術用プレートに固定し、腹部の正中線で毛皮と筋肉層をゆっくりと切断し、腸管を押して開いて腹部の大動脈と腎臓を露出させます25。
- 外科的動脈クランプを使用して、右腎臓の上の腹部大動脈を塞ぎます。頭皮針を5mLシリンジに取り付けてブロックの下に穿刺し、PBSバッファーを灌流して腎臓を灌流し、両方の腎臓が白くなるか色が薄くなるまで腎臓を洗浄します。
- 腎臓を取り出し、骨膜を鈍く分離します。右腎臓を凍結保存チューブに分け、-80°Cで冷蔵庫に保管します。 左腎臓を4%パラホルムアルデヒド溶液に固定します。
- 24時間の固定後、腎臓を取り外してください。脱水、透明化、パラフィン包埋を行います。ワックスブロックが固まった後、ティッシュスライサーで厚さ3μmでスライスし、裂開防止スライドで魚を釣り上げ、スライスを98°Cで20分間焼き、予備の26個を保存します。
- 腎臓病理組織学的解析
- 切片を勾配キシレン脱ロウと無水エタノール脱水にかけ、蒸留水を使用してすすぎます。キシレンに15分間、続いて新鮮なキシレン溶液を15分間浴びます。無水エタノールに5分間切り替え、新鮮な無水エタノールに5分間交換し、続いて90%エタノールを5分間、次に80%エタノールを5分間、次に70%エタノールを5分間、最後に蒸留水で洗い流します。
- サンプル染色には、ヘマトキシリン-エオシン染色(H&E)、過ヨウ素酸-シッフ染色(PAS)、およびMasson染色キットの指示に従ってください。
- グラジエント無水エタノール脱水を行い、キシレンクリアを再度行います。
- スライスを恒温インキュベーターに入れ、温度を90°Cに設定し、20分間焼きます。焼いた後、スライスを取り除き、中性ガムを滴下します。カバーガラスで覆います。
- 光学顕微鏡で200倍の倍率で観察し、画像を収集します。
- 腎組織の免疫蛍光(IF)分析
- セクションを脱ワックスし、ステップ5.3.1で説明されているように脱水します。0.01 M EDTA緩衝液にサンプルを入れ、高圧、高熱(103 KPaで125°C)15分間固定します。サンプルを自然冷却し、PBSで3回ずつ3分間洗浄します。
- 切片を3%過酸化水素溶液に入れ、10分間インキュベートします。サンプルをPBSでそれぞれ5分間3回洗浄します。次に、切片を10%ヤギ血清に入れ、30分間インキュベートし、PBSでそれぞれ3回3分間洗浄します。
- 一次抗体IgG(1:100)とC3(1:100)を滴下し、4°Cのウェットボックスで一晩インキュベートします。一次抗体の希釈倍率を 表2に示します。セクションを冷蔵庫から取り出し、TBST 3xでそれぞれ3分間洗います。
- 蛍光二次抗体(1:100)を滴下し、37°Cで1時間インキュベートし、TBST 3xで各3分間洗浄します。
注:この手順とそれに続くすべての手順は、暗闇27,28で実行する必要があります。 - 4',6-ジアミジノ-2-フェニルインドール(DAPI)と室温で5分間インキュベートし、光を避け、トリス緩衝生理食塩水とTween 20(TBST)をそれぞれ5回3回洗浄して、余分なDAPIを除去します。
- 自家蛍光クエンチャーを円形に添加し、5分間インキュベートし、流水で10分間すすぎます。切片を振って乾燥させ、蛍光防止焼入れシーラーで密封します。200倍の蛍光顕微鏡で観察し、画像を収集します。
- 腎臓組織の免疫組織化学(IHC)分析
- セクションを脱ワックスし、ステップ5.3.1で説明されているように脱水します。高圧(125°C・103KPa)で0.01M EDTA緩衝液中で15分間修復します。自然冷却後、PBSで3回ずつ3分間洗浄します。
- ステップ5.4.2に記載されているように、内因性ペルオキシダーゼおよび血清シーリング操作方法をブロックします。
- 一次抗体WT-1(1:200)とネフリン(1:100)を滴下し、4°Cの冷蔵庫のウェットボックスで一晩インキュベートします29。
- 4°Cの冷蔵庫から切片を取り出し、PBSで3回ずつ5分間洗浄します。二次抗体(1:200)を滴下し、37°Cで30分間インキュベートし、PBSで3回ずつ3分間洗浄します。
- 調製したばかりのジアミノベンジジン(DAB)発色溶液を滴下し、200倍の光学顕微鏡で観察します。正の信号は茶色がかった黄色または茶色がかった茶色です。切片の色の変化が観察されたら、直ちに染色液を水道水で洗ってください。
- ヘマトキシリンで3分間再染色した後、1%塩酸アルコールを添加して分化させ、水道水で10分間すすぎます。
- セクションを脱水し、透明にし、ステップ5.2.4で説明したように密封します。200倍の光学顕微鏡で観察し、画像を収集します。
- 腎臓組織の末端デオキシヌクレオチジルトランスフェラーゼ媒介性dUTPニックエンドラベリング(TUNEL)染色の解析
- ステップ5.3.1を使用して、切片を脱パラフィンおよび脱水します。免疫組織化学ペンを使用して組織の周囲に円を描き、100 μLのプロテイナーゼKワーキングソリューションを各サンプルに滴下します。37°Cで20分間インキュベートし、PBSで3回ずつ5分間洗浄し、処理したサンプルをウェットボックスに保存してください。
- 切片を3%過酸化水素溶液に入れ、10分間インキュベートし、PBSで3回それぞれ5分間洗浄します。
- 平衡緩衝液(100 μL)を円に滴下して組織を覆い、室温で20分間インキュベートします。
- 各サンプルに50 μLの標識作業溶液(平衡溶液:蛍光標識溶液:TDT酵素=35 μL:10 μL:5 μL)を滴下し、37°Cのウェットボックス内で60分間インキュベートし、光から保護し、PBSで3回5分間洗浄します。
- DAPIを添加し、DAPIと室温で5分間インキュベートし、光の下で、PBSで3回、それぞれ5分間洗浄します。
- 切片を振盪して乾燥させ、蛍光消光シーラーで密封した後、200倍の蛍光顕微鏡で観察し、画像を収集します。
- 腎組織の電子顕微鏡分析のためのサンプル調製
- 腎臓組織を2.5%グルタルアルデヒドで4°Cで2〜4時間固定し、PBSでそれぞれ3回15分間洗浄します。
- 光から離れた室温でオスミウム酸(1%)に2時間固定し、PBSで3回、各15分間洗浄します。
- アセトンと包埋剤を使用して、グラジエントアルコールとアセトン脱水を行います Immerse in 1:1、1:2、1:31 グラジエントにそれぞれ 2 時間、4 時間、8 時間。この後、純粋な包埋剤を使用し、サンプルを37°Cで一晩包埋します。
- 8時間後、埋め込まれたプレートを60°Cのオーブンに入れて48時間重合します。上記で処理した樹脂ブロックを極薄スライサーでスライスし、スライスの厚さを60〜80nmに設定します。銅メッシュを使用してスライスを取り除きます。
- 2%過酸化水素アセテートとアルコール溶液を使用して8分間染色した後、70%エタノールと超純水で3回洗浄します。2.6%エタノールと超純水で洗浄すれば完成です。
- 透過型電子顕微鏡で観察し、画像を取得します。
- 定量的リアルタイムポリメラーゼ連鎖反応(qRT-PCR)アッセイ解析
- 凍結腎臓組織20mgをマイクロ遠心チューブに加え、高速ティッシュグラインダーで組織塊が見えなくなるまで徹底的に粉砕します。
- 遠心分離後、15,984 x g で10分間上清を回収します。250 μL のクロロホルムを加え、チューブを 15 秒間反転させます。溶液は十分に混合されます。室温で3分間放置した後、15,984 x g で4°Cで10分間遠心分離します。
- 上部水相を回収し、新しいRNaseフリー遠心分離チューブに移します。等量の70%エタノール(RNaseフリー水調製)を加え、反転させ、混合します。
- RNA洗浄のために収集チューブにロードされた吸着剤カラムに溶液を追加します。Buffer RW洗浄後、カラムを室温で5分間放置して乾燥させます。
- 新しいRNaseフリー遠心分離チューブにカラムを置き、カラムの中央に30〜50 μLのRNaseフリー水を加え、室温で1分間静置した後、15,984 x gで1分間遠心分離します。RNA溶液を採取し、-80°Cで保存します。
- RNA溶液をフリーザーから取り出し、90°Cで10分間前変性させた後、95°Cで15秒、60°Cで35秒、72°Cで25秒のサイクルを40回行い、最後に95°Cで15秒、60°Cで60秒、95°Cで15秒の順に溶解します(補足表1)。
- β-アクチンを内部参照として、各サンプルのCt値(ΔΔCt=標的遺伝子のCt値-内部参照遺伝子のCt値)に基づいて、2¬-ΔΔCt法を用いて WT-1 と ネフリン の相対発現を計算する30。プライマーの詳細な情報を 表3に示します。
- ウェスタンブロット(WB)解析
- プロテアーゼ阻害剤:ホスファターゼ阻害剤:RIPA= 1:1:100の比率に従ってライセートを調製し、500 μLのライセートを微量遠心チューブに加えます。
- 凍結腎臓組織100mgをマイクロ遠心チューブに加え、高速ティッシュグラインダーで組織塊が見えなくなるまで徹底的に粉砕します。
- 微量遠心チューブを取り外し、氷上で30分間溶解した後、15,984 x g で10分間遠心分離します。上清を吸引し、-80°Cで保存します。
- ビシンコニン酸(BCA)タンパク質濃度アッセイキットの指示に従ってタンパク質濃度を検出し、PBS溶液を滴下して、各グループで一貫したタンパク質濃度を確保します。
- 5倍タンパク質アップサンプリングバッファーを微量遠心チューブに加え、100°Cで15分間インキュベートして完全に変性させ、冷却後に除去します。
- 12.5% SDS-PAGEゲル電気泳動でタンパク質を分離し、最初に80 Vを使用してすべてのサンプルを平らな青色の線に押し込み、次に電圧を130 Vに調整して、ブロモフェノールブルーがゲルプレートの底からなくなるまでします。電気泳動を停止します。
- ジェルを取り除きます。濾紙をメンブレントランスファーバッファーで濡らします。ポリフッ化ビニリデン(PVDF)メンブレンをメタノール中で30秒間活性化します。次に、すべてを次の順序で配置します:スポンジメッシュ/フィルターペーパー/ジェル/ PVDFメンブレン/フィルターペーパー/フィルターペーパー/スポンジメッシュメンブレンの転写に使用するクリップ。
- ゲルを負極に、PVDFメンブレムを正極に置き、メンブレンを200MAの電流で90分間移します。
- PVDFメンブレンをはがし、TBSTで5分間1回洗浄します。クロージャー溶液を室温で90分間振とうしながら加えます。TBST 3回で各5分間洗浄します。
- 一次抗体PI3K(1:1000)、PIK3CA(1:1000)、AKT(1:1000)、P-AKT(1:1000)、BAD(1:1000)、P-BAD(1:1000)、Bcl-2(1:1000)、BAX(1:4000)、およびc-caspase3(1:1000)を添加し、ウェットボックス内で4°Cの冷蔵庫31,32で一晩インキュベートする。
- PVDFメンブレンを4°C冷蔵庫から取り出し、TBST 3xでそれぞれ5分間洗浄します。二次抗体(1:10,000)を滴下し、37°Cで90分間インキュベートし、TBST 3xで各3分間洗浄します。
- 比率(A:B = 1:1)に従って現像液を調製し、指示に従って機械上で現像します。
結果
KMFのコンポーネントの分析結果
LC-MS/MS で分析したポジティブイオンモードとネガティブイオンモードでは、それぞれ 147 種と 120 種の化合物が同定されました(図 1A-B)。一部の化合物と、MFで計算された分子量、m/z値、保持時間、および親イオンを補足表2に示します。
KMFはMNラットの脂質代謝障害と肝臓および腎臓の損傷を改善しました
SDラットとC-BSAを用いて、MNモデルを確立した。C-BSAの尾静脈注射の1週間後、MNラットはさまざまな程度の精神的疲労、食欲減退、成長の遅さ、くすんだ髪の色、ふわふわの毛皮、反応の遅延、および体重減少を示し、一部のラットは陰嚢浮腫を発症しました。投与の4週間後、KMFの異なる用量は、24時間尿中総タンパク質(24時間-UTP)、Scr、およびBUNの発現レベルを有意に低下させ、腎機能を強化しました(図2A-C)。ALTおよびASTの発現レベルの低下、TPおよびALBの発現レベルの増加、肝機能の向上(図2D-G)。TCおよびTGの発現レベルを減少させ、脂質調節の機能を改善しました(図2H-I)。これらの結果は、KMFが腎機能に対する保護効果を有することを示唆しています。しかし、その具体的な作用機序はまだ明らかではありません。
KMFはMNラットの腎組織の病理組織学的損傷を改善します
KMFがMNラットの腎障害を改善できるかどうかを検証するために、H&E、PAS、Masson、およびIFを使用して腎組織の組織病理学的損傷を検出しました。H&EおよびPAS染色では、MOD群で糸球体肥大、メサンギウム細胞の軽度の増殖、腎尿細管の拡張、および腎尿細管上皮細胞の液胞変性が示されました(図3A)。マッソン染色は、MODグループで腎線維症の領域に有意な増加を示しました(図3B-C)。免疫蛍光法により、MOD群のIgGおよびC3の相対蛍光強度は、CON群のそれよりも有意に高いことが示されました(図3D-F)。KMF、BEN、またはPI3K阻害剤+KM-Mを投与した後、糸球体肥大の程度、およびつながれた細胞の増殖の程度が減少し、腎線維症の領域が有意に減少し、IgGとC3の相対的な蛍光強度が有意に低下しました。これらの結果は、KMFがMNラットの腎病理学的損傷を緩和できることを示しています。
KMFはPI3K/AKTシグナル伝達経路を活性化することにより足細胞の損傷を軽減します
MNの主要な足細胞の損傷は、ここで説明した方法、すなわちIHC、PCR、TUNEL、およびTEMを使用しても観察されました。IHCおよびPCRの結果、MOD群はCON群と比較して、足細胞特異的および機能マーカータンパク質であるWT-1およびネフリンの発現レベルが有意に減少し、足細胞の損傷を示す一方、KMF治療はWT-1、ネフリンの発現レベルを増加させ、足細胞の損傷を軽減することが示されました(図4A-E)).TUNEL染色の結果は、MOD群の足細胞の重度のアポトーシスを示しましたが、KMF処理は蛍光強度を大幅に減少させ、アポトーシスの発生率を低下させました(図4F-G)。TEMの結果は、MOD群の糸球体の基底膜が著しく不均一に肥厚し、足細胞のミトコンドリアが重度の腫脹、まばらなマトリックス、およびマトリックスの空の衝撃を示し、クリステが減少または欠如していることを示しました。KMF投与後、糸球体基底膜の肥厚は大幅に減少し、足細胞ミトコンドリアの形態は大幅に回復しました(図4H)。これらの結果は、KMFがMNラットの足細胞の損傷を軽減できることを示しています。
WBによるPI3K/AKTシグナル伝達経路関連タンパク質26,27の発現をさらに検出したところ、CON群と比較して、MOD群はPI3K、PIK3CA、AKT、P-AKT、BAD、BAX、およびC-カスパーゼ3の発現レベルが有意に増加し、P-BADおよびBCL-2の発現レベルは有意に減少したことが明らかになった。KMF処理は、PI3K、PIK3CA、AKT、P-AKT、BAD、BAX、およびC-カスパーゼ3の発現レベルを低下させますが、P-BADおよびBCL-2の発現レベルを増加させます(図4I-J)。これらの結果は、KMFがPI3K/AKTシグナル伝達経路を活性化することにより、MNラットの足細胞損傷を改善できることをさらに示しています。
トランスクリプトミクスに基づくMNに対するKMF療法の可能なメカニズムの探索
KMFのMN治療における標的と潜在的なメカニズムをさらに明らかにするために、Tandem Mass Tag(TMT)に基づくトランスクリプトーム解析を行いました。その結果、CON群とMOD群の間には898の差次的発現遺伝子(DEG)があり、そのうち372がアップレギュレーション遺伝子、526がダウンレギュレーション遺伝子であることが示されました(図5A-B)。同様に、KM-L群とMOD群の間には360のDEGがあり、そのうち202のアップレギュレーション遺伝子と158のダウンレギュレーション遺伝子が含まれていました(図5C-D)。影響を受ける可能性のある遺伝子とシグナル伝達経路を特定するために、Gene Ontology(GO)と京都遺伝子・ゲノム百科事典(KEGG)の濃縮機能解析が行われました(図5E-H)。その結果、DEGの生物学的プロセスは主に細胞プロセスと生物学的調節に焦点を当てているのに対し、DEGの機能は主にCAMP、PPAR、PI3K-AKT、p53シグナル伝達経路などの神経活性リガンド受容体相互作用に焦点を当てていることが示されました。これらの結果は、KMFがこれらのシグナル伝達経路に影響を与えることによりMNを治療する可能性があることを示唆しており、PI3K/AKTシグナル伝達経路は実験で検証されています。最後に、上位100個のDEGを度数の高い順に選択して、タンパク質間相互作用(PPI)ネットワークを構築しました(図5I-J)。
図1:LC-MS/MS ピークイオンクロマトグラム (A)ポジティブイオンモード。(B)マイナスイオンモード。 この図の拡大版を表示するには、ここをクリックしてください。
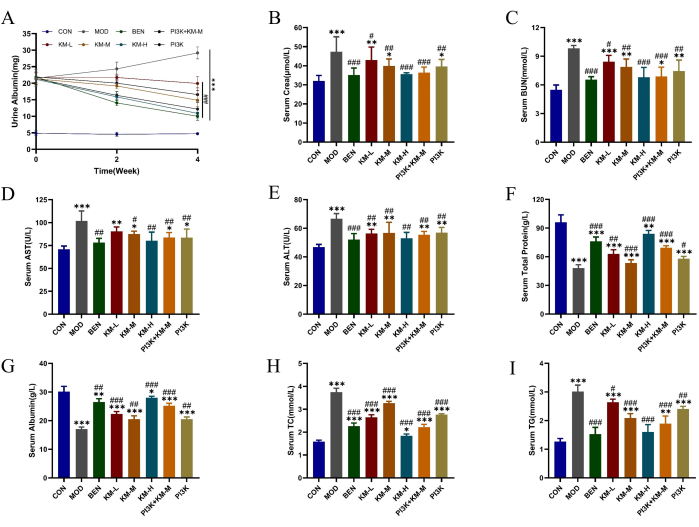
図2:KMFは、MNラットの脂質代謝障害と肝臓および腎臓の損傷を改善します。 (A-C)24時間尿アルブミン、血清セラ、血清BUNなどの腎機能に対するKemeng Fangの影響。(D-G)Kemeng Fangの肝機能への影響には、アラニンアミノトランスフェラーゼ(ALT)、アスパラギン酸トランスアミナーゼ(AST)、総タンパク質、および血清アルブミンが含まれます。(H-I)トリグリセリド(TG)や総コレステロール(TC)などの血中脂質代謝の調節に対するKemeng Fangの影響。データは、T検定の一元配置分散分析を使用して、ブランクグループ*p<0.05、**p<0.01、***p<0.001と比較し、モデルグループ#p < 0.05、##p < 0.01、###p < 0.001と比較し、3〜6個の独立したサンプルの平均±標準偏差として表されます。この図の拡大版を表示するには、ここをクリックしてください。
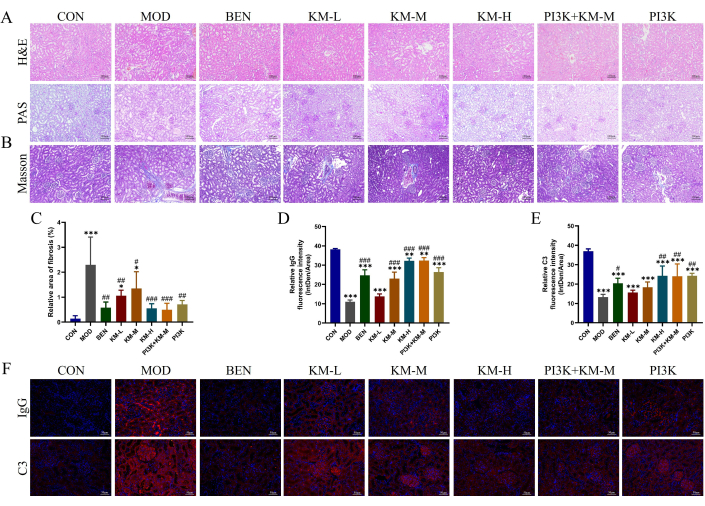
図3:Kemeng Fangは、MNラットの腎臓に対する組織病理学的損傷を改善します。 (A) H&E および PAS (200x) を含む腎組織学的検査。(B-C)Masson stainingおよびImage Jソフトウェアを使用した腎線維症(青色コラーゲン線維)の相対面積の半定量的分析。(D-F)IFおよびImage Jソフトウェアを使用した腎組織中のIgGおよびC3の相対蛍光強度(Intden/Area、Intdenは総局所蛍光強度、面積は局所領域)の半定量的分析。この図の拡大版を表示するには、ここをクリックしてください。
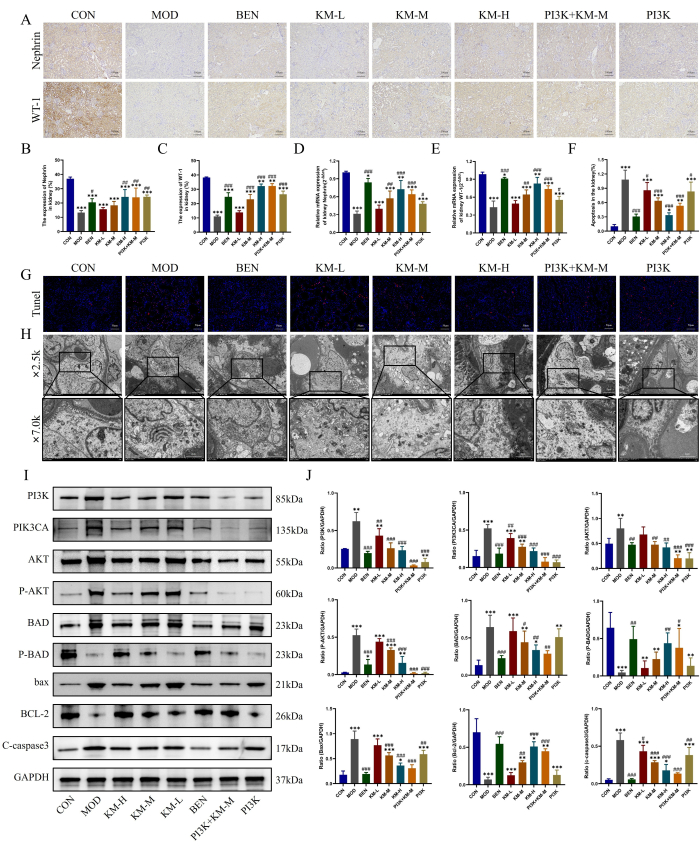
図4:Kemeng Fangは、PI3K/AKTシグナル伝達経路を活性化することにより、足細胞の損傷を軽減します。(A-C) IHCを使用して、腎臓組織における2つの足細胞マーカータンパク質、WT-1およびネフリンの相対発現レベルを検出しました。(D-E)腎臓組織における2つの足細胞マーカータンパク質、WT-1およびネフリンの相対的mRNA発現のPCR検出。(F-G)TUNEL染色は、腎組織におけるアポトーシスの発生率を検出するために使用されました。(H) TEMによる糸球体基底膜と足細胞ミトコンドリア構造の観察 (2,500x, bar=5 μM; 7,000x, bar=2 μM).(I-J)腎組織におけるPI3K、PIK3CA、AKT、P-AKT、BAD、P-BAD、BCL-2、bax、およびC-caspase3の相対タンパク質発現レベルのWB検出。この図の拡大版を表示するには、ここをクリックしてください。
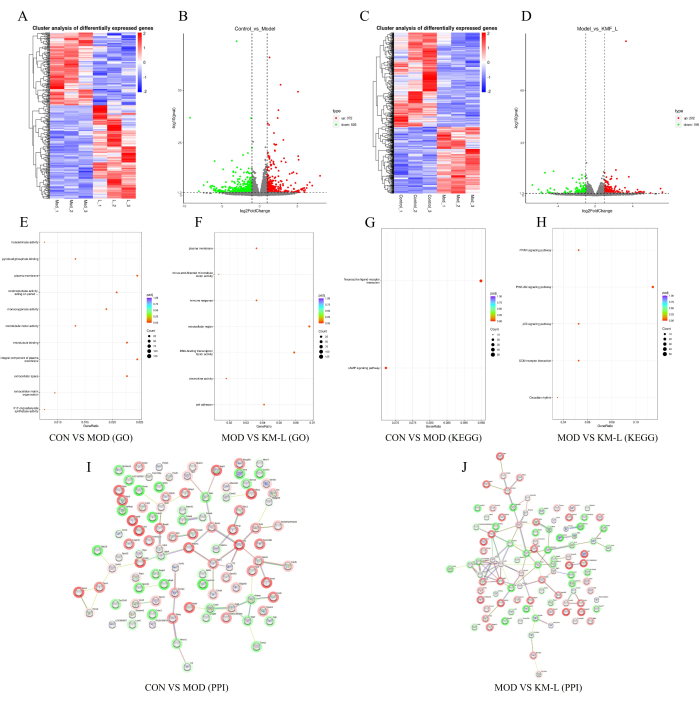
図5:トランスクリプトミクスに基づくMN治療におけるKemeng Fangの可能なメカニズムの探索(A-B)CONグループとMODグループ間の遺伝子ヒートマップと火山プロット、青はダウンレギュレーション、赤はアップレギュレーションを表しています。(C-D)MODグループとKM-Lグループ間の遺伝子ヒートマップと火山プロットの違い(青はダウンレギュレーション、赤はアップレギュレーションを表します)。(E)CONグループとMODグループ間のGOエンリッチメント。(F)MODグループとKM-Lグループ間のGO濃縮。(G)CONグループとMODグループ間のKEGG濃縮。(H)MODグループとKM-Lグループ間のKEGG濃縮。(I)CONグループとMODグループ間で差次的に発現する上位100遺伝子のタンパク質間相互作用(PPI)チャート。(J)MODグループとKM-Lグループ間の上位100DEG度の値のPPIチャート。この図の拡大版を表示するには、ここをクリックしてください。
| いいえ。 | 中国語名 | ラテン語の名前 | 家族 | 使用部品 | 投与量(g) |
| 1 | ダンシェン (DS) | Codonopsis pilosula (フランス)ナンフ。 | キキョウ科 | 根 | 20 |
| 2 | 黄旗(本社) | Astragalus membranaceus (フィッシュ。バンジ。 | マメ科 | 根 | 30 |
| 3 | 黄蓮(HL) | コプティス・チネンシス フランシュ。 | キンポウゲ科 | 根と塊茎 | 3 |
| 4 | スイエ (SY) | シソfrutescens (L.)ブリット | シソ科 | 葉 | 6 |
| 5 | シュディファン (SDH) | Rehmannia glutinosa (Gaertn。直流。 | ゴマノハグサ科 | 根と塊茎 | 15 |
| 6 | チュアンション (CX) | Ligusticum chuanxiong Hort. | ウンベリフェラエ | 根と塊茎 | 15 |
| 7 | 銭士(QS) | ユーリアレフェロックス サリスブ。 | スイレン科 | 種 | 15 |
| 8 | 秦豊天 (QFT) | サビアジャポニカ 諺。 | サビア科 | 根、塊茎、葉 | 10 |
| 9 | 五北子 (WBZ) | Rhus chinensis(ラス・チネンシス) 工場。 | ウルシ科 | 葉 | 3 |
| 10 | バンビアンリアン (BBL) | ロベリア・チネンシス 寂しい。 | キキョウ科 | 塊茎と葉 | 15 |
| 11 | バイワシェシェカオ (BHSSC) | オルデンランディア・ディフューサ (Willd.)ロックスブ。 | アカネ科 | 塊茎と葉 | 15 |
表1:Kemeng Fang(KMF)の組成。
| 抗体 | 希釈倍数 |
| IgG(免疫ギグジカル) | 1:100 |
| C3の | 1:100 |
| WT-1 | 1:200 |
| ネフリン | 1:100 |
| PI3K(パイ3K) | 1:1000 |
| PI3K3CA | 1:1000 |
| AKTの | 1:1000 |
| P-AKTの | 1:1000 |
| 悪い | 1:1000 |
| Pバッド | 1:1000 |
| BCL-2 | 1:1000 |
| バックス | 1:4000 |
| C-カスパーゼ3 | 1:1000 |
| ガプド | 1:1000 |
表2:抗体希釈倍率。
| 遺伝子 | 入門 | シーケンス (5'-3') | PCR製品 | |
| ラットGAPDH | フォワード | ACAGCAACAGGGTGGTGGAC | 253 bpの | |
| 逆 | TTTGAGGGTGCAGCGAACTT | |||
| ラットWT-1 | フォワード | AATGGACAGAAGGGCAGCAの | 209 bpの | |
| 逆 | TGGGTACGCACACATGAAAGG | |||
| ラットネフリン | フォワード | CGGAGAACAAGAACGTGACC | 177 bpの | |
| 逆 | ATTGTCTTCTCTCCGCACCA | |||
表3:qRT-PCRプライマーの詳細情報。
補足表1:PCR反応。このファイルをダウンロードするには、ここをクリックしてください。
補足表2:代謝物同定の定量的リスト。 ID:一次分子量シリアル番号。名前:識別結果。Mz:質量と核の比率。Rt:保持時間(S);正確な質量:正確な分子量。Ppm:検出された分子量と理論分子量との間の誤差(ppmで測定)。precursor_type:イオン化モード、[M + H] +は正イオンモード、[MH]-は負イオンモードです。クラス:HMDBデータベースでの三重分類。sub_class:HMDBデータベースの4レベル分類。KEGG: KEGG 複合番号。KEGG_Pathway:KEGGシグナル伝達経路;CAS:Chemical Abstracts Service登録番号。HMDB: HMDB データベース番号。図書館:データベース;式:理論分子式;KEGG: KEGG 複合番号。図書館:データベース;level:代謝物同定レベル。pos:ポジティブイオンモード;neg:マイナスイオンモード;KMF_1/2/3:3つの実験の合計イオン強度。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
この研究は、KMFの薬理学的効果を観察し、MNラット足細胞のアポトーシスを阻害するその特異的なメカニズムを調査することを目的としていました。まず、KMFがPI3K/AKTシグナル伝達経路を活性化することにより、足細胞のアポトーシスを緩和し、MNの進行を遅らせることができることを in vivo で実証しました。次に、トランスクリプトームの結果は、KMFがPPAR、PI3K / AKT、およびp53シグナル伝達経路、ECM受容体相互作用などを通じてその効果を発揮する可能性があることを示しました。その中で、PI3K/AKTシグナル伝達経路は実験で検証されています。これらの知見は、MN患者の潜在的な治療選択肢としてのKMFの臨床使用に科学的根拠を提供する可能性があります。
研究によると、足細胞のアポトーシスは、MNの段階的な進行につながる重要な要因の1つです。さらに、MNは足細胞の分裂と増殖能力を制限します。したがって、この後遺症は、損傷または紛失すると、腎機能に深刻な影響を及ぼします。足細胞の数が減少してGBMを完全に覆うことができないと、GBMは完全に露出してボーマン嚢に付着し、糸球体毛細血管ループの圧迫または崩壊を引き起こし、最終的にMNがESRD33,34,35,36に発展するのを促進します。したがって、足細胞のアポトーシスの特異的なメカニズムと、足細胞のアポトーシスをブロックまたは阻害する方法に関するさらなる研究が、MNの進行を遅らせるための鍵となります。研究によると、PI3K/AKTシグナル伝達経路は、細胞のアポトーシス、酸化ストレス、および炎症反応の調節に複数の機能を持ち、MNの発生と進行に重要な調節役割を果たしています。WT-1とネフリンは、足細胞上に発現する細孔膜タンパク質であり、細孔細胞に発現するタンパク質であり、細孔細胞の正常な構造と機能を維持するだけでなく、PI3K/AKT依存性シグナル伝達経路を開始し、足細胞シグナル伝達に関与します。これらのタンパク質の発現レベルの減少は、しばしば足細胞の損傷を示しています37,38,39。
PI3Kは、制御サブユニットであるp85と触媒サブユニットであるp110で構成される二量体であり、さまざまな成長因子や複合体によって活性化できます。これは、この経路40における重要かつ開始要因である。PIK3CA遺伝子は3番染色体上に位置し、合計20個のエクソンがあります。その主な機能は、PI3K酵素の触媒サブユニットの1つであるp110 αタンパク質をコードすることです。したがって、PIK3CAの変化は、PI3K酵素を持続的な活性化状態に留まらせる可能性がある41。PI3Kが活性化されると、セカンドメッセンジャーであるPIP3は下流のAKTシグナル伝達経路を生成し、継続的に刺激しますが、p-AKTはアポトーシス促進分子であるBadのリン酸化を促進し、Badのアポトーシス促進複合体をBcl-2およびBcl-xLと解離させ、細胞質内の14-3-3タンパク質と複合体を形成することで、アポトーシス促進機能を失います。抗アポトーシス分子であるBCL-2およびBcl-xLは、完全に解離し、足細胞のアポトーシスに対して阻害効果を発揮することができる42,43。カスパーゼ-3は、細胞アポトーシスの実行段階で中核的な役割を果たすプロテアーゼであり、最終的にはDNA修復酵素PARPを小さな断片に切断することにより細胞アポトーシスを引き起こす44。アポトーシス促進性タンパク質Badによるミトコンドリアから細胞質へのシトクロムc放出の誘導は、カスパーゼを活性化する重要なステップであり、14-3-3タンパク質へのP-Bad結合の複合体はこのプロセスを阻害し、それによりアポトーシスカスケード45,46,47の発生を防止する。
トランスクリプトームの結果は、MNに対するKMF治療がPI3K/AKT、PPAR、およびp53シグナル伝達経路と密接に関連していることを示しています。WB解析によりPI3K/AKTシグナル伝達経路をバリデーション。実験結果は、MNラットのPI3K/AKTシグナル伝達経路が有意に阻害される一方で、KMFはPI3K/AKTシグナル伝達経路を有意に活性化し、アポトーシス促進分子であるBadとBaxの生成を減少させ、抗アポトーシス分子BCL-2の生成を促進し、それによって足細胞裂孔膜タンパク質、WT-1およびネフリンの発現レベルを増加させることを示しました。 足細胞アポトーシスの発生率を減らします。したがって、KMFはPI3K/AKTシグナル伝達経路を活性化することにより足細胞のアポトーシスを抑制し、MNモデルラットに対して保護効果があることがわかった。
ただし、この研究にはいくつかの制限があります。まず、この研究では、in vivo動物実験のレベルでの足細胞アポトーシスのKMF阻害のメカニズムのみを調査したが、これはin vitro細胞実験によって検証されるだけでなく、メカニズムの詳細な調査によっても検証される必要がある。第二に、足細胞の損傷はオートファジー、免疫炎症、およびピロトーシスとも密接に関連しており、KMFがオートファジー、免疫炎症、およびピロトーシスを調節することによりMNに影響を与えることができるかどうかをさらに調査する必要があります48,49。
PPARファミリー(PPAR α、PPAR β/δ、PPARファミリー γ)は、リガンドの活性化に依存する核ホルモン受容体であり、エネルギー代謝への参加、細胞アポトーシスの調節、炎症反応などの重要な機能を持っています50,51。それらは、レチノイン酸X受容体(RXR)とのヘテロ二量体化を形成することにより遺伝子転写に影響を与え、PPAR γはどちらも炎症因子NF-κBを調節します。B活性化の鍵は、足細胞を損傷から保護する機能にあります52,53,54。複数の研究により、PPAR γ作動薬(TZD、ピオグリタゾンなど)は、血糖降下作用とは無関係に腎保護効果を有し、足細胞を直接損傷から保護し、さまざまな腎臓病動物モデル55,56,57,58,59においてタンパク質尿および糸球体損傷を軽減することが示されています。また、PPARがカスパーゼ-360の活性化を阻害することにより、足細胞のアポトーシスを減少させることができることを示す報告もあります。最新の研究では、新しいタイプのPPAR γである選択的調節因子GQ-16が、タンパク尿やネフローゼ症候群関連合併症の軽減にTZDよりも効果的であることが示されており、これも腎臓病の治療に夜明けをもたらします61。KMFは、PI3K/AKTシグナル伝達経路を活性化することにより、MNラット足細胞のアポトーシスに対する保護効果を有する。腎臓におけるPPARシグナル伝達経路の重要な役割に基づいて、KMF、PPAR、およびMNの関係についてさらに詳細な調査が今後必要となります。
開示事項
すべての著者は、宣言する利益相反を持っていません。
謝辞
この研究は、吉林省自然科学基金会(No.YDZJ202301ZYTS145およびNo.YDZJ202301ZYTS208)。
資料
| Name | Company | Catalog Number | Comments |
| 2-Amino-3-(2-chloro-phenyl)-propionic acid | Aladdin | 103616-89-3 | |
| 30% H2O2 | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10011218 | |
| 812 embedding agent | SPI | 90529-77-4 | |
| Acetone | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10000418 | |
| Acetonitrile | Thermo | 75-05-8 | |
| Ammonia | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10002118 | |
| Ammonium formate | Sigma | 540-69-2 | |
| Analytical balance | Changzhou Lucky Electronic Equipment Co., Ltd | FA | |
| Anhydrous ethanol | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10009218 | |
| Anti fluorescence quenching and sealing agent | southernbiotech | 0100-01 | |
| Automatic biochemical analyzer | Rayto Life and Analytical Sciences | Chemray240 | |
| BCA Protein Assay Kit | Solarbio | PC0020 | |
| Benazepril hydrochloride tablets | Xinya Minhang | H20044840 | |
| Blender | Kylin-Bell | BE-2600 | |
| Brick and stone cutting blade | Daitome | Ultra45 | |
| BSA | ZSGB-BIO | ZLI-9027 | |
| Buffer RW | Beijing Baiao Leibo | WK191 | |
| Carbodiimide hydrochloride | Hubei Xinghengye Technology | 25952-53-8 | |
| Cell apoptosis detection kit | Elabscience | E-CK-A322 | |
| Chemiluminescence imaging system | Hangzhou Shenhua Technology Co., Ltd | SH-523 | |
| Chloroform | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10006818 | |
| Constant temperature drying oven | Thermo Fisher | Heto PowerDiy LL3000 | |
| Cover glass slide | Jiangsu Shitai Experimental Equipment Co., Ltd | 10212450C | |
| CY3 Conjugated AffiniPure Goat Anti-rabbit IgG (H+L) | BOSTER | BA1032 | |
| DAB reagent kit | Servicebio | G1212-200T | |
| DAPI | Blue Cloud Sky | C1002 | |
| Decolorization shaker | Wuhan Lingsi Biotechnology Co., Ltd | TSY-B | |
| Dehydration machine | Wuhan Junjie Electronics Co., Ltd | JJ-12J | |
| DL2000 DNA Marker | TIANGEN | MD114 | |
| DMSO | MCE | HY-Y0320 | |
| dNTP | TIANGEN | CD117 | |
| EBlot L1 Rapid Wet Rotation Instrument | Kingsray Biotechnology Co., Ltd | L00686C | |
| ECL substrate solution | affinity | KF8003 | |
| Electric constant temperature water bath pot | Fisaff Instrument (Hebei) Co., Ltd | DK-20000-IIIL | |
| Electrophoresis instrument power supply | Beijing Longfang Technology Co., Ltd | LF-600S | |
| Embedding machine | Wuhan Junjie Electronics Co., Ltd | JB-P5 | |
| Equilibrium buffer | Wuhan Lingsi Biotechnology Co., Ltd | E8090 | |
| Ethylenediamine | Ruichengkang Pharmaceutical Technology | 107-15-3 | |
| FA series multifunctional analytical electronic balance | Changzhou Lucky Electronic Equipment Game Company | FA1204 | |
| Filter membrane | Jinteng | Nylon6-0.22μm | |
| Formaldehyde solution | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10010018 | |
| Formic acid | TCI | 64-18-6 | |
| Freezing centrifuge | Xiangyi | H1850-R | |
| Frozen platform | Wuhan Junjie Electronics Co., Ltd | JB-L5 | |
| Glacial acetic acid | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10000218 | |
| Glass bead | Sigma | G8772-500G | |
| Glass slide | Nantong Meiweide Life Science Co., Ltd | PC2-301 | |
| glycine | Biofroxx | 30166428 | |
| Hematoxylin | Wuhan Lingsi Biotechnology Co., Ltd | G1140 | |
| High speed refrigerated centrifuge | Hunan Kecheng Instrument Equipment Co., Ltd | H1-16KR | |
| Horizontal agarose electrophoresis tank | Long Fang | LF-31DS | |
| Horizontal shaker | Jiangsu Haimen Qilin Bell Instrument Manufacturing Co., Ltd | TS-1 | |
| HRP Conjugated AffiniPure Goat Anti-rabbit IgG (H+L) | BOSTER | BA1054 | |
| hydrochloric acid | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10011028 | |
| Imaging system | Nikon | Nikon DS-U3 | |
| Incomplete Freund's adjuvant | MCE | ISA-51 | |
| Intelligent digital magnetic heating stirrer | Hangzhou Miou Instrument Co., Ltd | TP-350E+ | |
| Isoflurane | Sigma | 26675-46-7 | |
| Isopropanol | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 80109218 | |
| KCl | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10020318 | |
| KH2PO4 | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 1115GR500 | |
| Liquid chromatograph | Thermo | IQLAAAGABHFAPUMBJC | |
| marker(10-250KD) | Mei5bio | MF028-plus-01 | |
| marker(20-120KD) | GenScript | M00521 | |
| Mass spectrometer | Thermo | IQLAAEGAAPFALGMBDK | |
| Masson staining kit | BASO | BA4079B | |
| Methanol | Thermo | 67-56-1 | |
| microscope | Nikon | ECLIPSE Ci | |
| microwave oven | Galanz Microwave Oven Electrical Appliance Co., Ltd | P70D20TL-P4 | |
| Multi sample tissue grinder | Shanghai Jingxin Industrial Development Co., Ltd | Tissuelyser-24L | |
| Multiskan FC ELISA reader | Thermo scientific | 1410101 | |
| Na2HPO4.12H2O | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10017618 | |
| NaCl | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10000218 | |
| Neutral resin | Wuhan Lingsi Biotechnology Co., Ltd | G8590 | |
| Normal Goat Serum | Solarbio | SL038 | |
| Organizational spreading machine | Zhejiang Jinhua Kedi Instrument Equipment Co., Ltd | KD-P | |
| Osmic acid | Ted Pella Inc | 18450 | |
| oven | Shanghai Huitai Instrument Manufacturing Co., Ltd | DHG-9140A | |
| Palm centrifuge | Wuhan Lingsi Biotechnology Co., Ltd | D1008E | |
| Paraformaldehyde | Solarbio | P1110 | |
| PAS staining kit | BASO | BA4114B | |
| Pathological slicer | Shanghai Leica Instrument Co., Ltd | RM2016 | |
| PBS | Solarbio | P1020 | |
| PCR instrument | Hangzhou Miou Instrument Co., Ltd | PR-96 | |
| PH meter | Sedolis Scientific Instruments (Beijing) Co., Ltd | PB-10 | |
| PH meter | Sedolis Scientific Instruments (Beijing) Co., Ltd | 2018C132-11 | |
| PI3K inhibitor LY294002 | MCE | HY-10108 | |
| Pipette gun | Dragon | KE0003087/KA0056573 | |
| Protein phosphatase inhibitor complex | Meilunbio | MB12707-1 | |
| PVDF membrane (0.22 μm) | Solarbio | ISEQ00010 | |
| PVDF membrane (0.45 μm) | Solarbio | YA1701 | |
| Quick primary/secondary antibody diluent | Solarbio | A1811 | |
| Rabbit anti-AKT | Affinity | AF0836 | |
| Rabbit anti-BAD | Affinity | AF6471 | |
| Rabbit anti-C3 | Affinity | DF13224 | |
| Rabbit anti-GAPDH | Hangzhou Xianzhi | AB-P-R 001 | |
| Rabbit anti-IgG | CST | 3900S | |
| Rabbit anti-Nephrin | bioss | bs-10233R | |
| Rabbit anti-P-AKT | Affinity | AF0016 | |
| Rabbit anti-p-BAD | invitrogen | PA5-105023 | |
| Rabbit anti-PI3K | Affinity | AF6241 | |
| Rabbit anti-PIK3CA | Bioss | Bs-2067R | |
| Rabbit anti-WT-1 | Affinity | DF6331 | |
| Real-Time PCR System | ABI | QuantStudio 6 | |
| RIPA Lysis Buffer | Meilunbio | MA0151 | |
| SDS | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10019318 | |
| Slide and cover glass | Jiangsu Shitai Experimental Equipment Co., Ltd | 10212432C | |
| Super pure water instrument | Zhiang Instrument (Shanghai) Co., Ltd | Clever-S15 | |
| SYBR Green Master Mix | VAZYME | Q111-02 | |
| Taq Plus DNA Polymerase | TIANGEN | ET105-02 | |
| Tissue grinder | Beautiful Wall | MB-96 | |
| Transmission electron microscope | HITACHI | HT7800/HT7700 | |
| Tris-base | Biofroxx | 10019318 | |
| Trizol | Ambion | 15596-026 | |
| TUNEL Cell Apoptosis Detection Kit (FITC) | Beijing Baiao Leibo | SY0475 | |
| Tween 20 | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 30189328 | |
| Ultra micro UV visible spectrophotometer | Hangzhou Miou Instrument Co., Ltd | ND-100 | |
| Ultra thin slicer | Leica | Leica UC7 | |
| Ultrasonic cleaner | shumei | KQ- 800DE | |
| Upright optical microscope | Nikon | Nikon Eclipse CI | |
| Urinary Protein Test Kit | Nanjing Jiancheng Bioengineering Research Institute | C035-2 | |
| Vertical electrophoresis tank | Beijing 61 Instrument Factory | DYCZ-24DN | |
| Vortex mixer | Wuhan Lingsi Biotechnology Co., Ltd | MX-F | |
| Western Blocking Buffer | Solarbio | SW3010 | |
| xylene | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10023418 |
参考文献
- McQuarrie, E. P., Mackinnon, B., Stewart, G. A., Geddes, C. C., Registry, S. R. B. Membranous nephropathy remains the commonest primary cause of nephrotic syndrome in a northern European Caucasian population. Nephrol Dial Transplant. 25 (3), 1009-1011 (2010).
- Ronco, P. H., Debiec, H. Pathophysiological advances in membranous nephropathy: time for a shift in patient's care. Lancet. 385 (9981), 1983-1992 (2015).
- Xu, X., et al. Long-term exposure to air pollution and increased risk of membranous nephropathy in China. J Am Soc Nephrol. 27 (12), 3739-3746 (2016).
- Fogo, A. B., Lusco, M. A., Najafian, B., Alpers, C. E. AJKD atlas of renal pathology: Membranous nephropathy. Am J Kidney Dis. 66 (3), e15-e17 (2015).
- Li, X., Zhang, X. Comments on the 2021 Kidney Disease: Improving Global Outcomes (KDIGO) clinical practice guideline for anticoagulant therapy in patients with membranous nephropathy. Kidney Int. 101 (1), 186-187 (2022).
- Ruggenenti, P., Fervenza, F. C., Remuzzi, G. Treatment of membranous nephropathy: time for a paradigm shift. Nat Rev Nephrol. 13 (9), 563-579 (2017).
- Klomjit, N., Fervenza, F. C., Zand, L. Successful treatment of patients with refractory PLA2R-associated membranous nephropathy with Obinutuzumab: A report of 3 cases. Am J Kidney Dis. 76 (6), 883-888 (2020).
- Podestà, M. A., Ruggiero, B., Remuzzi, G., Ruggenenti, P. Ofatumumab for multirelapsing membranous nephropathy complicated by rituximab-induced serum-sickness. BMJ Case Rep. 13 (1), e232890-e232896 (2020).
- Stehlé, T., et al. Anti-CD38 therapy for PLA2R-positive membranous nephropathy resistant to conventional immunosuppression. Kidney Int. 101 (2), 416-418 (2022).
- Trimarchi, H., Coppo, R. Podocytopathy in the mesangial proliferative immunoglobulin A nephropathy: new insights into the mechanisms of damage and progression. Nephrol Dial Transplant. 34 (8), 1280-1285 (2019).
- Kopp, J. B., et al. Podocytopathies. Nat Rev Dis Primers. 6 (1), 68-72 (2020).
- Hoxha, E., Reinhard, L., Stahl, R. A. K. Membranous nephropathy: new pathogenic mechanisms and their clinical implications. Nat Rev Nephrol. 18 (7), 466-478 (2022).
- Chiou, T. T., et al. Rapamycin attenuates PLA2R activation-mediated podocyte apoptosis via the PI3K/AKT/mTOR pathway. Biomed Pharmacother. 144 (8), 112349-112356 (2021).
- Chen, J., et al. Danshen injection induces autophagy in podocytes to alleviate nephrotic syndrome via the PI3K/AKT/mTOR pathway. Phytomedicine. 107 (7), 154477-154489 (2022).
- Wang, Y., et al. Fangji Huangqi decoction ameliorates membranous nephropathy through the upregulation of BNIP3-mediated mitophagy. J Ethnopharmacol. 324 (13), 117734-117743 (2024).
- Wei, L., et al. Shenqi granule upregulates CD2AP and α-actinin4 and activates autophagy through regulation of mTOR/ULK1 pathway in MPC5 cells. J Ethnopharmacol. 303 (16), 115942-115954 (2023).
- Wang, P., et al. A review of the botany, phytochemistry, traditional uses, pharmacology, toxicology, and quality control of the Astragalus memeranaceus. Front Pharmacol. 14 (2), 1242318-1242325 (2023).
- Wang, Q., et al. Traditional Chinese medicine method of tonifying kidney for hypertension: Clinical evidence and molecular mechanisms. Front Cardiovasc Med. 20229 (16), 1038480-1038487 (2022).
- Tang, X., et al. Experimental models for elderly patients with membranous nephropathy: Application and advancements. Exp Gerontol. 185 (8), 112341-112353 (2024).
- Zhang, J. J., et al. Murine membranous nephropathy: immunization with α3(IV) collagen fragment induces subepithelial immune complexes and FcγR-independent nephrotic syndrome. J Immunol. 188 (7), 3268-3277 (2012).
- Hopfer, H., et al. The importance of cell-mediated immunity in the course and severity of autoimmune anti-glomerular basement membrane disease in mice. FASEB J. 17 (8), 860-868 (2003).
- Fleuren, G., Grond, J., Hoedemaeker, P. J. In situ formation of subepithelial glomerular immune complexes in passive serum sickness. Kidney Int. 17 (5), 631-637 (1980).
- Border, W. A., Ward, H. J., Kamil, E. S., Cohen, A. H. Induction of membranous nephropathy in rabbits by administration of an exogenous cationic antigen. J Clin Invest. 69 (2), 451-461 (1982).
- Border, W. A., Ward, H. J., Kamil, E. S., Cohen, A. H. Induction of membranous nephropathy in rabbits by administration of an exogenous cationic antigen. J Clin Invest. 69 (2), 451-461 (1982).
- Rubio-Navarro, A., et al. Phenotypic characterization of macrophages from rat kidney by flow cytometry. J Vis Exp. (116), e54599(2016).
- Hou, Y., et al. Longzhibu disease and its therapeutic effects by traditional Tibetan medicine: Ershi-wei Chenxiang pills. J Ethnopharmacol. 249, 112426(2020).
- Sethi, S., et al. Hematopoietic stem cell transplant-membranous nephropathy is associated with protocadherin FAT1. J Am Soc Nephrol. 33 (5), 1033-1044 (2022).
- Gong, Q., Lai, T., Liang, L., Jiang, Y., Liu, F. Targeted inhibition of CX3CL1 limits podocytes ferroptosis to ameliorate cisplatin-induced acute kidney injury. Mol Med. 29 (1), 140-148 (2023).
- Li, H., et al. IL-23 reshapes kidney resident cell metabolism and promotes local kidney inflammation. J Clin Invest. 131 (12), e142428-e142441 (2021).
- Wang, C., et al. Artificially cultivated Ophiocordyceps sinensis alleviates diabetic nephropathy and its podocyte injury via inhibiting P2X7R expression and NLRP3 inflammasome activation. J Diabetes Res. 356 (11), 1390418-1390431 (2018).
- Cheng, H., et al. PI3K/Akt signaling pathway and Hsp70 activate in hippocampus of rats with chronic manganese sulfate exposure. J Trace Elem Med Biol. 50 (12), 332-338 (2018).
- Ji, K., et al. The immunoreaction and antioxidant capacity of juvenile blunt snout bream (Megalobrama amblycephala) involves the PI3K/Akt/Nrf2 and NF-κB signal pathways in response to dietary methionine levels. Fish Shellfish Immunol. 105 (10), 126-134 (2020).
- Chiou, T. T., et al. Rapamycin attenuates PLA2R activation-mediated podocyte apoptosis via the PI3K/AKT/mTOR pathway. Biomed Pharmacother. 144 (3), 112349-112357 (2021).
- Lv, Q., Yang, F., Chen, K., Zhang, Y. Autophagy protects podocytes from sublytic complement induced injury. Exp Cell Res. 341 (2), 132-138 (2016).
- Mundel, P., Shankland, S. J. Podocyte biology and response to injury. J Am Soc Nephrol. 13 (12), 3005-3015 (2002).
- Sun, Z., Xu, Q., Ma, Y., Yang, S., Shi, J. Circ_0000524/miR-500a-5p/CXCL16 axis promotes podocyte apoptosis in membranous nephropathy. Eur J Clin Invest. 51 (3), e13414-e13422 (2021).
- Huber, T. B., et al. Nephrin and CD2AP associate with phosphoinositide 3-OH kinase and stimulate AKT-dependent signaling. Mol Cell Biol. 23 (14), 4917-4928 (2003).
- Ai, Z., et al. Deciphering the pharmacological mechanisms of Rostellularia procumbens (L) Nees. Extract alleviates adriamycin-induced nephropathy in vivo and in vitro. Phytomedicine. 113 (6), 154736-154742 (2023).
- Wang, X., et al. Nicorandil alleviates apoptosis in diabetic cardiomyopathy through PI3K/Akt pathway. J Cell Mol Med. 23 (8), 5349-5359 (2019).
- Fox, M., Mott, H. R., Owen, D. Class IA PI3K regulatory subunits: p110-independent roles and structures. Biochem Soc Trans. 48 (4), 1397-1417 (2020).
- Miricescu, D., et al. PI3K/AKT/mTOR signaling pathway in breast cancer: From molecular landscape to clinical aspects. Int J Mol Sci. 22 (1), 173-179 (2020).
- Feng, C., et al. Neuroprotective effect of Danhong injection on cerebral ischemia-reperfusion injury in rats by activation of the PI3K-Akt pathway. Front Pharmacol. 11 (4), 298-312 (2020).
- Zhou, Y., et al. 1,3-Dicaffeoylquinic acid targeting 14-3-3 tau suppresses human breast cancer cell proliferation and metastasis through IL6/JAK2/PI3K pathway. Biochem Pharmacol. 172 (12), 113752-113761 (2020).
- Li, J., et al. Tetrandrine inhibits colon carcinoma HT-29 cells growth via the Bcl-2/Caspase 3/PARP pathway and G1/S phase. Biosci Rep. 39 (5), (2019).
- Downward, J. How BAD phosphorylation is good for survival. Nat Cell Biol. 1 (2), E33-E35 (1999).
- Fan, J., et al. A model of ischemia and reperfusion increases JNK activity, inhibits the association of BAD and 14-3-3, and induces apoptosis of rabbit spinal neurocytes. Neurosci Lett. 473 (3), 196-201 (2010).
- Chipuk, J. E., Green, D. R. How do BCL-2 proteins induce mitochondrial outer membrane permeabilization. Trends Cell Biol. 18 (4), 157-164 (2008).
- Yin, L., Yu, L., He, J. C., Chen, A. Controversies in podocyte loss: Death or detachment. Front Cell Dev Biol. 9 (11), 771931-771942 (2021).
- Yang, C., et al. Research progress on multiple cell death pathways of podocytes in diabetic kidney disease. Mol Med. 29 (1), 135-143 (2023).
- Calvier, L., et al. PPARγ links BMP2 and TGFβ1 pathways in vascular smooth muscle cells, regulating cell proliferation and glucose metabolism. Cell Metab. 25 (5), 1118-1134 (2017).
- Dai, Z. W., Cai, K. D., Xu, L. C., Wang, L. L. Perilipin2 inhibits diabetic nephropathy-induced podocyte apoptosis by activating the PPARγ signaling pathway. Mol Cell Probes. 53 (3), 101584-101596 (2020).
- Kota, B. P., Huang, T. H., Roufogalis, B. D. An overview on biological mechanisms of PPARs. Pharmacol Res. 51 (2), 85-94 (2005).
- Wahli, W. Peroxisome proliferator-activated receptors (PPARs): from metabolic control to epidermal wound healing. Swiss Med Wkly. 132 (7-8), 83-91 (2002).
- Agrawal, S., He, J. C., Tharaux, P. L. Nuclear receptors in podocyte biology and glomerular disease. Nat Rev Nephrol. 17 (3), 185-204 (2021).
- Miglio, G., et al. Protective effects of peroxisome proliferator-activated receptor agonists on human podocytes: proposed mechanisms of action. Br J Pharmacol. 167 (3), 641-653 (2012).
- Miglio, G., et al. The subtypes of peroxisome proliferator-activated receptors expressed by human podocytes and their role in decreasing podocyte injury. Br J Pharmacol. 162 (1), 111-125 (2011).
- Agrawal, S., Guess, A. J., Benndorf, R., Smoyer, W. E. Comparison of direct action of thiazolidinediones and glucocorticoids on renal podocytes: protection from injury and molecular effects. Mol Pharmacol. 80 (3), 389-399 (2011).
- Sonneveld, R., et al. Sildenafil prevents podocyte injury via PPAR-γ-mediated TRPC6 inhibition. J Am Soc Nephrol. 28 (5), 1491-1505 (2017).
- Agrawal, S., et al. Pioglitazone enhances the beneficial effects of glucocorticoids in experimental nephrotic syndrome. Sci Rep. 6 (3), 24392-24404 (2016).
- Kanjanabuch, T., et al. PPAR-gamma agonist protects podocytes from injury. Kidney Int. 71 (12), 1232-1239 (2007).
- Bryant, C., et al. Selective modulator of nuclear receptor PPARγ with reduced adipogenic potential ameliorates experimental nephrotic syndrome. iScience. 25 (4), 104001(2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved