このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ヒトキメラ抗原受容体制御性T細胞の作製
要約
このプロトコールは、ヒトキメラ抗原受容体制御性T細胞(CAR制御性T細胞)を生成および試験するための合理化されたワークフローを提供します。
要約
キメラ抗原受容体(CAR)T細胞療法は、がん治療の様相を変え、これまで不治の病であった血液がんの記録的な寛解率をもたらしました。これらの成功により、免疫応答の調節と阻害を主に担うCD4+ T細胞の小さいながらも重要なサブセットである制御性T細胞(Treg)にCARプラットフォームを適応させることへの関心が高まっています。制御性T細胞の免疫抑制活性を任意の細胞外標的にリダイレクトする能力は、自己免疫疾患、臓器移植拒絶反応、および移植片対宿主病の細胞療法の作成に多大な影響を及ぼします。ここでは、ヒト末梢血からの 真正な 制御性制御性制御細胞の単離、アデノ随伴ウイルスを介した相同指向性修復(HDR)テンプレート送達を使用したレンチウイルスまたはCRISPR/Cas9支援ノックインを利用したヒト制御性制御細胞の遺伝子改変、および安定したヒトCAR制御細胞の ex vivo 拡大のための方法論について詳しく説明します。最後に、ヒトCAR Tregの表現型の安定性と in vitro 抑制機能の評価について説明し、ヒトCAR Tregが前臨床および臨床応用でどのように振る舞うかについての洞察を提供します。
概要
キメラ抗原受容体(CAR)T細胞療法は、血液悪性腫瘍の治療に革命をもたらし、これまで治療できなかったがんにおいて非常に高い寛解率を達成しました1,2。CAR-T細胞を用いた膠芽腫3,4,5の治療に用いた初期の結果は、CAR技術の汎用性と、幅広い悪性腫瘍を標的とする将来の可能性を浮き彫りにしています。この分野でCARのさらなる応用が検討されるにつれて、制御性T細胞(Treg)が有望な細胞タイプとして浮上しています。制御性T細胞は、免疫恒常性を維持し、IL-2の隔離、免疫抑制性サイトカインの分泌、抗原提示細胞の調節など、いくつかのメカニズムを通じて免疫応答を調節する上で重要な役割を果たします6,7。
CAR技術により、制御性T細胞は、臓器移植拒絶反応、自己免疫疾患、アレルギーや喘息などの炎症性疾患の治療に活用することができます6,8,9。CAR-Tregsは、免疫系全体を阻害し、有害な副作用と関連している免疫抑制薬の使用を減らすことにより、患者の転帰と生活の質の大幅な改善につながる可能性があります10,11。前臨床モデルは、CAR技術を制御性T細胞に変換する上で有望な結果を示しており、1型糖尿病、多発性硬化症、移植片対宿主病、炎症性腸疾患などの疾患への応用に成功しています9,12,13,14,15。クリニックでは、固形臓器移植拒絶反応16を防ぐためにCAR制御性Tregsが現在調査されています。
この記事では、ヒトキメラ抗原受容体制御性T細胞(CAR制御性T細胞)を作製するための詳細な方法論を紹介します。このプロトコルでは、ヒト末梢血から制御性T細胞を分離し、レンチウイルス形質導入やCRISPR/Cas9遺伝子編集およびアデノ随伴ウイルス(AAV)ベクターを用いた精密な遺伝子ノックインなどの技術を用いてTregを遺伝子組み換えします。また、これらの操作された制御性T細胞の表現型の安定性と抑制機能の評価についても説明します。これは、治療の可能性を検証するための重要なステップです17,18,19。このアプローチは、CAR-T細胞療法の設計と早期試験を効率化し、CAR-T細胞療法の変革的な影響を拡大して免疫系を調節する可能性を秘めています。私たちの方法論を共有することで、急成長しているCARトレグ療法の分野でさらなる研究と革新を促したいと考えています9,20。
プロトコル
1. ヒトTregの単離
- ロイコパック加工
- ロイコパックの内容物を50mLのコニカルチューブに移します。ピペットで穏やかに混合することにより、等量のダルベッコのリン酸緩衝生理食塩水(DPBS)+2%ウシ胎児血清(FBS)を追加します。
- 室温(RT)で300 × g で10分間遠心します。上清を慎重に吸引します。細胞ペレットを2mLのDPBS + 2%FBSに再構成します。8 mLの塩化アンモニウム溶液をピペットで細胞懸濁液に4:1の比率で加え、穏やかに反転して混合し、残りの赤血球を氷上で15分間溶解させます。
- 室温で300 × g で10分間回転させ、上清を慎重に吸引します。30mLのDPBS+2%FBSを加えて細胞を洗浄します。ブレーキを切った状態で、洗浄した細胞を150 × g で室温で10分間回転させ、上清を慎重に吸引します。細胞ペレットを30 mLのDPBS + 2% FBSに再懸濁します。
- 単離された末梢血単核細胞(PBMC)をトリパンブルーで1:1の比率でカウントします。
- 細胞濃度が高いため、最初に10μLの細胞をDPBSで1:100に希釈します。次に、1:100で希釈した細胞10 μLをトリパンブルー溶液10 μLと混合して、最終的な1:1希釈にします。自動セルカウンターを使用する場合は、報告された濃度に100を掛けて200倍希釈を反映するように細胞数を修正します(ほとんどのカウンターは2倍希釈を想定しています)。1/10ロイコパックから1-2.5 × 109 PBMCの収穫を期待してください。
- CD4+ T細胞単離(ネガティブセレクション)
- 10 8-10 9 PBMCを500 × gで5分間室温でスピンダウンし、Cell Separation Buffer(DPBS + 1 mM EDTA + 2% FBS)で5 × 107 cells/mLで再懸濁します。
注:遺伝子組み換えに十分なヒトTregを取得するには、1 × 109 PBMCsから始めることをお勧めします。 - CD4+ T細胞濃縮キットの製造元の指示に従って磁気分離を行います。
- トリパンブルー(10 μLの細胞+ 10 μLのトリパンブルー)でカウントすることにより、CD4+ T細胞の量を決定します。
- 10 8-10 9 PBMCを500 × gで5分間室温でスピンダウンし、Cell Separation Buffer(DPBS + 1 mM EDTA + 2% FBS)で5 × 107 cells/mLで再懸濁します。
- CD8+ T細胞単離(ネガティブセレクション)
- 5 × 107 PBMCsを500 gで500 × g 、室温で5分間スピンし、Cell Separation Buffer (DPBS + 1 mM EDTA + 2% FBS) で5 × 107 cells/mLで再懸濁します。
注:5 × 107 PBMCから始めて、2-5 × 106 CD8+ T細胞を取得することをお勧めします。 - CD8+ T細胞濃縮キットの製造元の指示に従って磁気分離を行います。
- トリパンブルー(10 μLの細胞+ 10 μLのトリパンブルー)でカウントすることにより、単離されたCD8+ T細胞の数を決定します。
- 5 × 107 PBMCsを500 gで500 × g 、室温で5分間スピンし、Cell Separation Buffer (DPBS + 1 mM EDTA + 2% FBS) で5 × 107 cells/mLで再懸濁します。
- Treg蛍光支援セルソーティング(FACS)
- ステップ1.2で説明したようにCD4+ T細胞を単離し、2% FBSを4°Cで1晩保存します(細胞数と生存率の損失は最小限です)翌日のFACSのために。ステップ1.2から、トリパンブルー(10 μLの細胞+ 10 μLのトリパンブルー)でカウントすることにより、CD4+ T細胞の数を決定します。
- CD4+ 細胞を500 × g で5分間スピンします。200 μLのDPBSで細胞を再構成します。
- 1×106 細胞につき、1μLの抗ヒトCD4 FITCを、1μLの抗ヒトCD25 APC、および1μLの抗ヒトCD127 PEを添加する。穏やかに渦巻き、4°Cの暗い冷蔵庫に30分間置きます。
- 細胞を10mLのDPBSと2% FBSで洗浄します。500 × g で5分間回転させます。染色した細胞を1.5 × 107 細胞/mLで、2% FBSを含むDPBSで穏やかに再懸濁します。これは、蛍光活性化セルソーティング(FACS)によるソーティングに推奨される細胞濃度です。
- 染色した細胞懸濁液を40μmのフィルターキャップに通し、FACSチューブに入れ、チューブを氷上に保ちます。
- 3 mLのRPMI10培地を含む15 mLのコレクションチューブを調製し、氷上に置きます。
注:この培地は、RPMI1640基底培地、10%FBS、1xペニシリン-ストレプトマイシン、1xL-アラニル-L-グルタミン、1x非必須アミノ酸、1xピルビン酸ナトリウム、および1xHEPESで構成されています。 - 図1Aに示すように、FACSを用いてCD4+CD25の高CD127-制御性T細胞(Tregs)およびCD4+CD25の低CD127+従来型T細胞(Tconv)を選別します。
- 細胞の収量と生存率を決定します。その後、ダウンストリーム解析またはT細胞活性化に進みます。
2. T細胞の活性化
- 単離されたT細胞をトリパンブルーでカウントします(10 μLの細胞+ 10 μLのトリパンブルー)。
- 得られたT細胞1個×10個6個につき、25μLの抗CD3/CD28ビーズ(10個6ビーズ)を洗浄し、ビーズとT細胞の比率を1:1に保ちます。DPBSを添加し、磁石で3分間インキュベートし、細胞に毒性のある希釈した抗CD3/CD28ビーズバッファーを除去して、抗CD3/CD28ビーズを洗浄します。
- チューブを磁石から取り外し、洗浄したビーズをRPMI10培地に再懸濁して、10個×6 個のビーズ/1mLのRPMI10を充填します。
- 抗CD3/CD28ビーズをRPMI10培地に1 × 106 T細胞/mLの濃度で再懸濁します。次に、1,000 IU/mL の IL-2 を Treg 細胞に、100 IU/mL の IL-2 を CD4+ Tconv 細胞に、300 IU/mL の IL-2 を CD8+ T 細胞に添加します。
- 24ウェルプレートのウェルあたり1×106 細胞でT細胞を培養し、抗CD3/CD28ビーズとIL-2の量が異なります。24ウェルプレートを37°C、5%CO2 組織培養インキュベーターに入れます。
- IL-2の存在下で活性化T細胞を9〜12日間増殖させ、実験に使用するか、抗CD3/CD28ビーズで再活性化してさらに増殖させます。2〜3日ごとにメディアを交換し、新しいメディアが追加されるたびにIL-2を追加します。増殖中は、細胞をカウントするか、分割前に目視検査を行うことにより、増殖中にTregの細胞密度を5 × 105 to 1 × 106 細胞/mLに保ちます。
3. ヒトTregレンチウイルス形質導入
- 再懸濁し、活性化後48時間でTregsをカウントします。RTで500 ×g で5分間遠心し、1.25 × 106 細胞/mLのIL-2を含むRPMI10の制御性T細胞を再懸濁します。
- 遠心分離機を32°Cに予温します。
- レンチウイルスを含むCARコンストラクトを氷上で解凍します。
注:シングルユースのレンチウイルスアリコートは、-80°CでMOI1で2.5×105 細胞を形質導入するのに十分なレンチウイルスとともに保存します。 - 各レンチウイルスアリコートを200 μL中の2.5 ×10 5 Tregsに微量遠心チューブで加えます。各チューブは反応を示します。1,000 × g で32°Cで1時間猡費します。
- 各200 μL反応液を24ウェルプレートに移します。メディアが全体をしっかりと覆っていることを確認してください。形質導入したTregsと24ウェルプレートを組織培養インキュベーターで一晩(16〜18時間)インキュベートします。各ウェルをRPMI10培地で2 mLに補充し、最終的なIL-2濃度を1,000 IU/mLにします。
- 活性化後9〜12日で、細胞を分割し、必要に応じて(2〜3日ごとに)新鮮な予熱したRPMI10とIL-2を補給することにより、形質導入された制御性T細胞の拡大を続けます。細胞の理想的な濃度は、5 × 105-1 × 106 細胞/mLです。
- 図2に示すように、フローサイトメトリーを使用して遺伝子改変効率を評価します。
注:当社のレンチウイルスCARコンストラクトには、CAR遺伝子のN末端にMycタグがあり、2AペプチドによってCAR遺伝子に結合されたGFPレポーター遺伝子が含まれているため、抗体染色(GFP)なしで形質導入効率を定量化し、CAR表面発現(Mycタグ)を確認できます。遺伝子改変効率は、形質導入の5日後に評価します。形質導入効率は、ドナーと使用するCARコンストラクトによって30%から70%の間で変動します。CAR+ 細胞は、必要に応じてソートすることができます。 - 修飾された制御性T細胞が活性化サイクル(9〜12日)を完了し、IL-2が存在しない状態で24時間休むことを確認してから、実験に使用してください。
4. ヒトTregsにおけるCRISPR/Cas9を介した遺伝子ノックイン
- Tregを再懸濁し、活性化後48時間で15mLコニカルチューブに移します。細胞懸濁液を磁石で3分間インキュベートします。
- 磁石の中にいる間に、培地中の細胞をピペットで新しいチューブに移します。抗CD3/CD28ビーズはチューブ壁に付着したままになります。ビーズ除去後、デビーズしたTregをRPMI10で2時間休ませると、デビーディングの即時のストレスから回復し、将来の形質導入効率とエレクトロポレーションからの回復が向上します。
- トリパンブルーでデビーズされたTregsを数えます。
- FBSを含まない減血清培地を37°Cに予温します。
- 抗生物質(ペニシリン-ストレプトマイシン) を含まない 2.5 mL の RPMI10 培地と 1,000 IU/mL IL-2 をウェルあたり 1 ウェルで 6 ウェルプレートを調製します。プレートを組織培養インキュベーターで37°Cに予温します。
- アデノ随伴ウイルス(AAV)を含むCAR相同性発現修復(HDR)テンプレートを氷上で解凍します。
注:-80°Cで20,000のMOIで4×106 細胞に感染するのに十分なAAVを含むシングルユースアリコートを保存します。 - Tregsを500 × g で5分間スピンします。上清をデカントした後、予熱した還元血清培地で細胞を4 × 107 細胞/mLで再懸濁します。
- 低タンパク質結合性1.5 mL遠心分離チューブで100 μLの細胞を分注します。MOI 20,000のCAR AAVを各サンプルに追加し、再懸濁します。反応チューブを組織培養インキュベーターで1時間インキュベートします。
- 1時間のインキュベーション中に、8.3 μLのCas9タンパク質(1 mg/mLストック)をTRAC遺伝子座を標的とする2.5 μLのsgRNAにゆっくりと加え、Cas9とsgRNAのモル比が1:1、サンプルあたり総RNP量が10.8 μLになるように、CRISPR/Cas9リボ核タンパク質(RNP)複合体を調製して組み立てます。ゆっくりと上下にピペッティングして混ぜます。RNP混合物を組織培養インキュベーターで37°Cで15分間インキュベートします。
注:RNP複合体は、使用する準備ができるまでRTに留まることができます。 - 新鮮なエレクトロポレーションチューブ(Eチューブ)に3mLの高浸透圧エレクトロポレーションバッファーを充填します。充填されたEチューブをエレクトロポレーションシステムのピペットステーションにカチッという音がするまで挿入します。エレクトロポレーションシステムでエレクトロポレーション条件を 2,200 V、20 ms、1パルス に設定します。
- AAVとの1時間のインキュベーションが完了したら、AAVで細胞を300 × g で室温で5分間スピンします。上清を慎重に吸引し、エレクトロポレーションシステムが提供する細胞再懸濁バッファー100 μLに細胞ペレットを再懸濁します。
注:迅速に作業し、セルをバッファーに15分以上放置しないようにしてください。バブルの作成は避けてください。 - サンプルあたり10.8 μLのRNP複合体を添加します。泡を作らずにピペットでよく混ぜます。
- ピペットを2回目のストップまで押してクランプを開き、100μLのエレクトロポレーションチップを挿入します。クランプがピストンの取り付けステムにしっかりとかみ合うまで、ピペットの上部ヘッドをエレクトロポレーションチップに配置します。ピペットを下向きの圧力に保ちながらボタンを徐々に離し、チップが隙間なくぴったりと収まるようにします。
- ピペットを最初のストップまで押し込み、エレクトロポレーションチップを細胞-RNP混合物に浸します。サンプルを気泡が入らないようにピペットにそっと引き上げます。
注:エレクトロポレーション中にチップ内に気泡が存在することはありません。 - サンプルが入ったエレクトロポレーションチップが取り付けられたピペットを、カチッという音が聞こえるまでEチューブに垂直に挿入します。気泡が発生しないようにします。
- ヒトTregの最適な設定が入力されていることを確認し(2,200 V、20 ms、1パルス)、タッチスクリーンの start を押して細胞をエレクトロポレーションします。
- エレクトロポレーションの完了時にタッチスクリーンに 完了 と表示されるのを待ちます。ピペットを静かに取り外し、すぐにサンプルを、ウェルあたり1,000 IU/mLのIL-2を含む2.5 mLの予温済み抗生物質フリーRPMI10培地を含む準備した6ウェルプレートに移します。残りのサンプルで繰り返します。プレートを直線的(左から右、上から下)で静かに揺さぶり、各ウェル内の細胞が均一に分布するようにし、組織培養インキュベーターに配置します。
注:エレクトロポレーションチップの再利用は、同じ細胞とRNP複合体が使用されている場合、最大3倍まで許容されます。細胞を数えたり、必要に応じてHDRエンハンサーを追加するなどの方法で細胞を乱したりする前に、30分の回復期間を確保してください。 - 翌日、16〜18時間後に培地を抗生物質含有培地と交換し、エレクトロポレーションされたTregをトリパンブルーでカウントし、1,000 IU/mL IL-2で106 細胞/mLで培養します。ステップ2.6で説明したように、細胞を分割し、新鮮なRPMI10とIL-2を補充することにより、エレクトロポレーションTregsの増殖を続けます。
- サンプルを氷上に保管し、フローサイトメトリーによる分析を行います。
- 単色補正コントロールを設定し、実験ファイルに適用します。
- 最初に未染色のサンプルを読み取り、FSCおよびSSCのゲインを調整して、リンパ球の集団が「すべてのイベント」ドットプロットの中央に来るようにします。
- 図3Cに示すように、リンパ球を非破片に、または単一細胞から生存細胞、CD4+細胞にゲーティング戦略を設定します。
- フローサイトメトリーを使用して遺伝子改変効率を評価します。
注:当社のAAV CARコンストラクトには、TRAC遺伝子座相同性アームに加えて、図3に示すように、2AペプチドによってCAR遺伝子にリンクされた切断上皮成長因子受容体(EGFRt)レポーター遺伝子が含まれています。遺伝子のノックイン効率は、CD3の表面染色によって決定され、その欠失はTCR表面発現の喪失を示し、したがって、CRISPR/Cas9によるTRAC遺伝子座の標的化の成功、およびCAR導入遺伝子の組み込みの成功を示すEGFRtによるTRAC遺伝子座の標的化の成功を示します。CARノックインTregはCD3-EGFRt+細胞です。エレクトロポレーションの5日後に遺伝子改変効率を評価します。 - 修飾された制御性T細胞が活性化サイクル(9〜12日)を完了し、IL-2が存在しない状態で24時間休ませてから実験に使用することを確認してください。
5. ヒトCAR制御性Tregの活性化
- 共培養のセットアップ(0日目)
- CAR抗原発現標的細胞株を円錐管に集めます。
注:HLA、CD80、およびCD86の発現を欠くヒト骨髄性白血病細胞株であるK562細胞をCARTreg活性化の標的細胞として使用します。親K562細胞をネガティブコントロールとして使用し、CAR抗原発現K562を使用してCAR制御性Tregを活性化します17,21。 - 標的細胞株に 4,000 rad をセシウム137またはX線照射器で照射します。照射器にアクセスできない場合は、マイトマイシンC処理を行い、標的細胞22における表面抗原発現を維持しながら細胞増殖を止める。
- まだ行っていない場合は、抗CD3/CD28ビーズに結合したTregを再懸濁し、15mLのコニカルチューブに移すことにより、Tregをデビードします。細胞懸濁液を磁石で3〜5分間インキュベートします。磁石の中にいる間に、培地中の細胞をピペットで新しいチューブに移します。抗CD3 / CD28ビーズはチューブ壁に取り付けられたままになります。
- 照射した標的細胞と脱ビーズしたCAR制御細胞の濃度をトリパンブルーで測定します。
- 照射した標的細胞とCAR制御性Tregsを500 × g で5分間スピンします。予熱したRPMI10を106 細胞/mLで別々のチューブに再懸濁します。IL-2をCAR制御性T細胞に添加し、2,000 IU/mLの濃度にします。
注:この量のIL-2は、CAR制御性Tregが標的細胞と結合して最終IL-2濃度が1,000 IU/mLになると、2倍に希釈されます。 - 1 × 105 CAR Tregs(100 μL)と1 ×10 5 (100 μL)CAR抗原陰性照射標的細胞1個(活性化陰性コントロール)、1 × 105 (100 μL)CAR抗原陽性照射標的細胞(実験)、または96ウェル丸底プレートに2.5 μLの抗CD3/CD28ビーズ(活性化ポジティブコントロール)と97.5 μLのRPMI10培地を共培養します。プレートを37°C、5%CO2 組織培養インキュベーターに48時間置きます。
注:ウェルあたりの最終容量は 200 μL です。各条件に 3 回の繰り返しがあることを確認してください。
- CAR抗原発現標的細胞株を円錐管に集めます。
- フローサイトメトリーのリードアウト
- プレートリーダーを使用しない限り、各ウェルの内容物を96ウェル丸底プレートから再懸濁し、それらをFACSチューブに移します。500 x gで5分間遠心します。上清をデカントし、細胞ペレットを穏やかにボルテックスします。
- フローサイトメトリー抗体マスターミックスを調製:DPBS、抗ヒトCD4 PE/Cy7 1:200、抗ヒトCD71 PE 1:100、およびGhost Viability Dye BV510 1:2000を含む100 μL/サンプル。
注:このパネルは、CARレポーター遺伝子がGFPの場合にうまく機能します。レポーター遺伝子がEGFRtなどの抗体染色を必要とする表面タンパク質をコードしている場合、例えば、FITC標識抗体を使用することができます。 - 抗体マスターミックス100 μLを各サンプルにピペットで入れ、穏やかに混合し、4°C冷蔵庫で30分間インキュベートします。
- 500 μLのDPBSで500 μLのDPBSで500 × g で5分間洗浄します。細胞ペレットを200 μLのDPBSに再懸濁します。
- サンプルを氷上に保管し、フローサイトメトリーによる分析を行います。
- 単色補正コントロールを設定し、実験フローファイルに適用します。
- 未染色のサンプルを読み取り、SSCおよびFSCのゲインを調整して、リンパ球の集団が「すべてのイベント」ドットプロットの中央になるようにします。
- 図3Cに示すように、リンパ球を非破片に、または単一細胞から生存細胞に、CD4+細胞にゲーティング戦略を設定します(異なる蛍光色素を使用)。
- 約 1,500 イベント/秒のイベントレートでサンプルを読み取り、Treg の活性化を評価します。
注:期待される結果は、 図4に示すように、CAR抗原の存在下でのCAR制御性におけるCD71表面発現のアップレギュレーションです。CAR抗原の存在下でアップレギュレーションが見られない場合は、強直性シグナル伝達が存在する可能性があります。
6.人間のCAR制御性安定性
- 共培養のセットアップと拡大(0-9日目)
- 手順 5.1 の説明に従って、CAR 制御要素をアクティブ化するように共培養を設定します。
- 48時間後、各96ウェル丸底プレートウェルから共培養を、予熱した2 mLのRPMI10と1,000 IU/mL IL-2を含む24ウェルプレートウェルに移し、細胞増殖を可能にします。
- 温めた新しいRPMI10を1,000 IU/mL IL-2で加え、必要に応じて追加の24ウェルプレートに分割します。
- フローサイトメトリーのリードアウト
- 各レプリケートの内容物を再懸濁し、15 mLまたは50 mLのコニカルチューブに移します。細胞濃度を決定します。
- 5 × 105 および 1 × 106 細胞を複製ごとに FACS チューブに移します。500 × g で5分間回転させます。
- 表面染色用のフローサイトメトリー抗体マスターミックスを調製:DPBS、抗ヒトCD4 PE/Cy7 1:200、抗ヒトCD25 APC 1:200、およびGhost Viability Dye BV510 1:2000を含む100 μL/サンプル。必要に応じて、CARレポータータンパク質用のFITC標識抗体を含めます。
- ステップ6.2.2から上清をデカントし、細胞ペレットを穏やかにボルテックスします。表面染色抗体マスターミックス100 μLを各FACSチューブにピペットで移します。短時間渦巻き、4°Cの冷蔵庫に30分間暗闇の中で置きます。
- 転写因子染色バッファーセットを使用して、1容量のFixation/Permeabilization濃縮液に3容量のFixation/Permeabilization希釈液を添加して、Fixation/Permeabilizationバッファーを調製します。各サンプルには100 μLの固定/透過化バッファーが必要です。
- 表面染色した細胞を500 μLのDPBSで洗浄します。500 × g で5分間遠心し、上清をデカントします。調製した固定/透過化バッファー100μLを各チューブにピペットで入れます。短時間ボルテックスし、暗所で4°Cで30〜60分間固定します。
- 転写因子染色バッファーセットを使用して、1容量のPermeabilization Buffer 10x concentrateに9容量の蒸留水を加えて、1x Permeabilization Bufferを調製します。各サンプルには、洗浄用に1,000 μLの透過処理バッファー、細胞内タンパク質を標的とする抗体による染色には100 μLの透過処理バッファーが必要です。
- 固定/透過処理した細胞を、1x Permeabilization bufferを500 μL添加して洗浄します。500 × g で室温で5分間遠心します。
- 1x Permeabilization buffer、anti-human FOXP3 eFluor 450 1:50、anti-human HELIOS PE 1:50、およびanti-human CTLA-4 PerCP-e710 1:50を含む細胞内染色抗体マスターミックスを調製します。各サンプルには100 μLの抗体マスターミックスが必要です。
注:このパネルは、CARレポーター遺伝子がGFPである場合、またはCARレポータータンパク質(EGFRtなど)がFITC標識抗体で染色されている場合に機能します。 - ステップ6.2.8から上清をデカントします。細胞内染色用抗体マスターミックス100 μLを加え、短時間ボルテックスし、室温で暗所で30分間インキュベートします。
- 染色した固定/透過処理した細胞を、1x Permeabilization bufferを500 μL加えて洗浄します。500 × g で5分間回転します。上清をデカントし、細胞ペレットを300 μLのDPBSに再懸濁し、氷上に保存します。
- 図5に示すように、フローサイトメトリーで解析します。予想される結果は、ほとんどのCAR制御性TregがFOXP3+HELIOS+細胞になることです。CD4+ Tconv細胞をFOXP3およびHELIOS染色のネガティブコントロールとして使用します。
7. ヒトCAR制御性Treg抑制
- レスポンダーT細胞(Tresp)細胞微量色素染色および一晩中活性化
- 増殖したCAR Treg細胞、 新たに単離された CD4+ Tconv細胞、および 新たに単離された CD8+ T細胞を別々の15 mLコニカルチューブに集め、まだ行っていない場合は抗CD3/CD28ビーズをデビードします。
- ステップ5.1に記載されているように、照射したCAR抗原発現標的細胞を調製します。
- 非活性化T細胞および照射された標的細胞の濃度を測定します。
- 5 × 106 CD4+ Tconv細胞を5 × 106 CD8+ T細胞(1:1の比率)と組み合わせます。これらは、アッセイでCAR制御性T細胞によって阻害される レスポンダーT細胞(Tresp) です。Tresp細胞を500 × g で5分間室温でスピンし、上清を慎重に吸引し、Tresp細胞を1 mLのDPBSに再懸濁します。
- DMSOで再構成した5 mM CellTrace Violet(CTV)色素1 mLを、1 mLのDPBS中の10 7 Tresp細胞に添加し、最終濃度を5 μM CTVにします。37°Cのウォーターバスに20分間入れます。10分後、静かに渦を巻いて、沈降したCTVを再分配します。
- 予熱したRPMI10完全培地9 mLで洗浄します。500 × g で5分間回転します。予熱したRPMI10完全培地5 mLに再懸濁します。
- CTV標識Tresp細胞の濃度を測定します。最小増殖制御として、96ウェル丸底プレートの3-6ウェル中の200μLのRPMI10培地に5個×10個の4CTV 標識 非活性化 Tresp細胞を添加します。
- 抗CD3/CD28ビーズを用いて、IL-2を含まないRPM10培地中のCTV標識Tresp 細胞を1:10のビーズで 活性化します。組織培養インキュベーター内の24ウェルプレートのウェルあたり10 mLのRPMI10培地に10個の6 CTV標識Tresp細胞を分注します。
- 並行して、10個の6CAR+制御列を取得します。この量は、96ウェル丸底プレートウェルあたり5 × 104の標的細胞で、5 × 104 × 3 + 2.5 × 104 × 3 + 1.25 × 104 × 3 + 0.625 × 104 × 3 = 2.81 × 10 5 CAR Tregsの4つのCARTreg比、1:1、1:2、10 5 CARの3つの3倍、3:10 105のCARトレグ比の3倍、5倍、照射されたCAR抗原陰性標的細胞(ネガティブコントロール、 活性化なし)、CAR抗原陽性標的細胞を照射しました(実験、CAR活性化)。
- 3 × 105 CAR制御株と3つの×10 5 照射CAR抗原陰性細胞(1:1の比率)および3つの× 105 CAR制御株と3つの× 105 照射CAR抗原陽性標的細胞(1:1の比率)を、2つの別々の15 mLコニカルチューブに組み合わせ、室温で500 × g で5分間遠心します。
- ステップ7.1.10の各チューブ内のペレットを、予熱したRPMI10培地600μLに再懸濁します。この結果、1:1 Treg:Trespの三重奏ごとに200 μLになります。96ウェル丸底プレートで次のように段階希釈を行います。
- 調製した600μLのTreg+標的細胞懸濁液から、200μLの細胞懸濁液を3つの1:1比率のウェルのそれぞれにピペットで移します。
- 予熱したRPMI10完全培地100 μLを、空の1:2、1:4、および1:8の比率のウェルのそれぞれに加えます。
- 各トリプリケートについて、1:1ウェルから関連する1:2比率のウェルに100μLの細胞懸濁液をピペットで移します。
- 各トリプリケートについて、1:2ウェルから100μLの細胞懸濁液を関連する1:4比率のウェルにピペットで移します。
- 各トリプリケートについて、1:4ウェルから100μLの細胞懸濁液を関連する1:8比率のウェルにピペットで移します。
- 1:8の比率のウェルから残りの100μLの細胞懸濁液を廃棄物容器にピペットで移します。
注:各ウェルには、5 × 104 (1:1)、2.5 × 104 (1:2)、1.25 × 104 (1:4)、または 0.625 × 104 (1:8) CAR Treg と同数の照射標的細胞を含む 100 μL の細胞懸濁液が含まれている必要があります。
- CAR TregおよびTresp細胞の共インキュベーション
- 活性化後16〜18時間後、活性化したTresp細胞を24ウェルプレートから円錐形のチューブに集め、磁石を介して抗CD3 / CD28ビーズを除去します。
- ビード除去されたCTV標識Tresp細胞数を決定します。
- 2 × 106 Tresp細胞を500 × g で5分間洗浄し、紡糸します。上清を慎重に吸引します。細胞を4 mLのRPMI10完全培地に再懸濁します。
- 100 μLのT細胞懸濁液(5 × 104 T細胞)をCAR制御性T細胞を含む各ウェルに加え、100 μLのRPMI10培地のみを含む3〜6ウェルに添加して、増殖を最大限に制御します。プレートを37°C、5%CO2 組織培養インキュベーターに72時間置きます。
注:96ウェルの丸底プレートには、非活性化Tresp細胞のみ(最小増殖制御)の3〜6ウェル、活性化Tresp細胞のみ(最大増殖制御)の3〜6ウェル、およびCAR制御細胞の数が減少する中での活性化Tresp細胞があります。
- フローサイトメトリーのリードアウト
- 各96ウェル丸底プレートの内容物を再懸濁し、ラベル付けされたFACSチューブに移します。あるいは、プレート読み取りモード付きのフローサイトメーターが利用可能な場合は、96ウェルV底プレートに移します。500 × g で5分間回転させます。
- その間に、DPBS、抗ヒトCD4 PE/Cy7 1:200、および抗ヒトCD8 PerCP 1:200を含む抗体マスターミックスを調製します。各サンプルには100 μLの抗体マスターミックスが必要です。
- 細胞ペレットを穏やかにボルテックスします。100 μLの抗体マスターミックスを各FACSチューブにピペットで入れます。短時間ボルテックスし、暗所で4°Cで30分間インキュベートします。
- 500μLのDPBSで洗浄します。96ウェルVボトムを使用する場合は、100μLのDPBSで2回洗浄します。500 × g で5分間回転します。上清をデカントし、細胞ペレットを200 μLのDPBSに再懸濁し、チューブを氷上暗所で保存します。
- 図6に示すように、フローサイトメトリーで解析します。期待される結果は、非活性化Tresp細胞のみ(最小増殖)が均一な高CTV蛍光ピークを示すこと、活性化Tresp細胞のみが各細胞分裂に対応するCTV強度の複数のピーク(最大増殖)を示すこと、および活性化CAR制御細胞の存在下で活性化CD4+およびCD8+ T細胞がCTVピークの数および高さの減少を示すことであり、 したがって、増殖しています。
- Treg細胞を介した抑制は、次のように計算します。
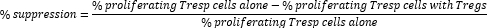
注:FlowJoソフトウェアを使用している場合、細胞増殖モデリングを使用して各サンプルの分裂指数(DI)を計算し、上記の式の増殖細胞の割合ではなくDIを使用して抑制率を計算することもできます。
結果
ここで説明するプロトコルは、自己免疫疾患、移植片対宿主病、臓器移植拒絶反応、およびアレルギーの生きた治療法を作成することを目的として、ヒト制御性T細胞(Treg)における新しいキメラ抗原受容体(CAR)コンストラクトを評価するための合理化された標準化されたパイプラインを提供します。図1は、ex vivo増殖?...
ディスカッション
このプロトコルは、ヒトキメラ抗原受容体制御性T細胞(CAR Tregs)を生成および評価するための合理化された包括的な方法論を提供します。CAR技術が血液がんの治療に成功したことで、T細胞の免疫抑制サブセットであるTregsへの応用が促されました。従来のT細胞とは異なり、制御性T細胞は免疫応答を阻害し、自己免疫疾患、臓器移植拒絶反応、移植片対宿主病、アレル?...
開示事項
LMRFは発明者であり、遺伝子操作された免疫細胞に関する特許からロイヤリティを受け取っており、Guidepoint GlobalとMcKessonのコンサルティングを行っています。残りの著者は、競合する利益を宣言しません。
謝辞
LMRFは、Human Islet Research Network(HIRN)のEmerging Leader in Type 1 Diabetes助成金U24DK104162-07、American Cancer Society(ACS)のInstitutional Research Grant IRG-19-137-20、South Carolina Clinical and Translational Research(SCTR)Pilot Project Discovery Grant 1TL1TR001451-01、Diabetes Research Connection(DRC)の助成金IPF 22-1224、Swim Across America Grant 23-1579から資金提供を受けています。RWCは、細胞・生化学・分子科学研修助成金のT32GM132055とHollings Cancer Center Lowvelo大学院フェローシップの支援を受けています。この研究は、サウスカロライナ医科大学Hollings Cancer CenterのFlow Cytometry and Cell Sorting Shared Resource(P30 CA138313)によって部分的に支援されました。CAR変異プラスミドを寄贈してくださったカリフォルニア大学サンフランシスコ校(UCSF)のQizhi Tang博士に心から感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Adeno-associated virus (AAV) | Charles River Laboratories | ||
| CAR target-expressing K562 cells | e.g., CD19-K562 | ||
| Cesium-137 irradiator | |||
| Anti-human CD8 PerCP (clone SK1) | Biolegend | 344708 | |
| Anti-human CD4 PE/Cy7 (clone SK3) | Biolegend | 344612 | |
| DynaMag-15 magnet | ThermoFisher | 12301D | |
| Ghost BV510 viability dye | TONBO | 13-0870-T100 | |
| K562 cells | American Type Culture Collection | CCL-243 | |
| 0.5 M EDTA, pH 8.0 | Gibco | 15575020 | |
| 1 M HEPES | Gibco | 15630080 | |
| Ammonium chloride solution | STEMCELL Technologies | 7850 | |
| Anti-human CD127 PE (clone hIL-7R-M21) | BD Biosciences | 557938 | |
| Anti-human CD25 APC (clone BC96) | Biolegend | 302610 | |
| Anti-human CD4 FITC (clone SK3) | Biolegend | 344604 | |
| Anti-human CD71 PE (clone SK1) | Biolegend | 334106 | |
| Anti-human CD8 PerCP (clone SK1) | Biolegend | 344707 | |
| Anti-human CTLA-4 PerCP-e710 | ThermoFisher | 46-1529-42 | |
| Anti-human EGFR APC (clone AY13) | Biolegend | 352905 | |
| Anti-human FOXP3 eFluor 450 | ThermoFisher | 48-4776-42 | |
| Anti-human HELIOS PE | Biolegend | 137216 | |
| Ca2+ and Mg2+ free Dulbecco’s Phosphate Buffered Saline (DPBS) | Gibco | 14190144 | |
| Cell counter (TC20 Automated Cell Counter) | Bio-Rad | 1450102 | |
| Cell Counting Slides | Bio-Rad | 1450016 | |
| CellTrace Violet Cell Proliferation Kit | ThermoFisher | C34571 | |
| DNA LoBind Tubes | Eppendorf | 22431021 | |
| Easy 50 EasySep magnet | STEMCELL Technologies | 18002 | |
| EasySep Human CD4+ T cell Enrichment Kit | STEMCELL Technologies | 19052 | |
| EasySep Human CD8+ T cell Enrichment Kit | STEMCELL Technologies | 19053 | |
| EasySep magnet | STEMCELL Technologies | 18000 | |
| eBioscience Foxp3 transcription factor staining buffer set | ThermoFisher | 00-5523-00 | |
| Falcon Round-Bottom Polystyrene Test Tubes with Cell Strainer Snap Cap, 5 mL | Fisher Scientific | 08-771-23 | 40μm |
| Fetal Bovine Serum (FBS) | Gibco | 26140079 | |
| Flow cytometer | Beckman Coulter | CytoFLEX LX U3-V5-B3-Y5-R3-I2 | |
| Fluorescence-activated cell sorter | BD Biosciences | FACS Aria III Cell Sorter | |
| GlutaMAX | Gibco | 35050061 | |
| Human CD3/28 T Cell Expansion and Activation Dynabeads | Gibco | 11131D | |
| Invitrogen Neon Transfection System | ThermoFisher | 10431915 | |
| Invitrogen Neon Transfection System 100 μL Kit | ThermoFisher | 10114334 | |
| Lentivirus | VectorBuilder | ||
| MEM Non-Essential Amino Acids Solution | Gibco | 11140050 | |
| Myc Tag antibody A647 (clone 9B11) | Cell Signaling Technologies | 2233S | |
| Opti-MEM I Reduced Serum Medium | ThermoFisher | 31985062 | |
| Penicilin-Streptomycin solution | Gibco | 15140122 | |
| Recombinant human interleukin-2 (rhIL-2) | Peprotech | 200-02 | |
| RPMI 1640 medium, no glutamine | Gibco | 11875093 | |
| Sodium pyruvate | Gibco | 11360070 | |
| Spectral Flow Cytometer | Cytek | Northern Lights | |
| TRAC gRNA | Synthego | Sequence (CAGGGTTCTGGATATCTGT) | |
| TrueCut Cas9 Protein v2 | ThermoFisher | A36496 | |
| Trypan Blue solution | Sigma | T8154-100ML | |
| 1/10 Leukopak | STEMCELL Technologies | 200-0092 | 1-2 billion PBMC |
参考文献
- Zhang, X., Zhu, L., Zhang, H., Chen, S., Xiao, Y. CAR-T cell therapy in hematological malignancies: current opportunities and challenges. Front Immunol. 13, 927153 (2022).
- Cappell, K. M., Kochenderfer, J. N. Long-term outcomes following CAR T cell therapy: what we know so far. Nat Rev Clin Oncol. 20 (6), 359-371 (2023).
- Choi, B. D., et al. Intraventricular CARv3-TEAM-E T cells in recurrent glioblastoma. N Engl J Med. 390 (14), 1290-1298 (2024).
- Brown, C. E., et al. Locoregional delivery of IL-13Ralpha2-targeting CAR-T cells in recurrent high-grade glioma: a phase 1 trial. Nat Med. 30 (4), 1001-1012 (2024).
- Bagley, S. J., et al. Intrathecal bivalent CAR T cells targeting EGFR and IL13Ralpha2 in recurrent glioblastoma: phase 1 trial interim results. Nat Med. 30 (5), 1320-1329 (2024).
- Ghobadinezhad, F., et al. The emerging role of regulatory cell-based therapy in autoimmune disease. Front Immunol. 13, 1075813 (2022).
- Sakaguchi, S., Yamaguchi, T., Nomura, T., Ono, M. Regulatory T cells and immune tolerance. Cell. 133 (5), 775-787 (2008).
- Sakaguchi, S., et al. Regulatory T cells and human disease. Annu Rev Immunol. 38, 541-566 (2020).
- Ferreira, L. M. R., Muller, Y. D., Bluestone, J. A., Tang, Q. Next-generation regulatory T cell therapy. Nat Rev Drug Discov. 18 (10), 749-769 (2019).
- Rosenblum, M. D., Gratz, I. K., Paw, J. S., Abbas, A. K. Treating human autoimmunity: current practice and future prospects. Sci Transl Med. 4 (125), 125sr121 (2012).
- Sawitzki, B., et al. Regulatory cell therapy in kidney transplantation (The ONE Study): a harmonised design and analysis of seven non-randomised, single-arm, phase 1/2A trials. Lancet. 395 (10237), 1627-1639 (2020).
- Spanier, J. A., et al. Tregs with an MHC class II peptide-specific chimeric antigen receptor prevent autoimmune diabetes in mice. J Clin Invest. 133 (18), e168601 (2023).
- Muller, Y. D., et al. Precision engineering of an anti-HLA-A2 chimeric antigen receptor in regulatory T cells for transplant immune tolerance. Front Immunol. 12, 686439 (2021).
- MacDonald, K. G., et al. Alloantigen-specific regulatory T cells generated with a chimeric antigen receptor. J Clin Invest. 126 (4), 1413-1424 (2016).
- Boardman, D. A., et al. Flagellin-specific human CAR Tregs for immune regulation in IBD. J Autoimmun. 134, 102961 (2023).
- Schreeb, K., et al. Study design: human leukocyte antigen Cclass I molecule A(*)02-chimeric antigen receptor regulatory T cells in renal transplantation. Kidney Int Rep. 7 (6), 1258-1267 (2022).
- Zimmerman, C. M., Robino, R. A., Cochrane, R. W., Dominguez, M. D., Ferreira, L. M. R. Redirecting human conventional and regulatory T cells using chimeric antigen receptors. Methods Mol Biol. 2748, 201-241 (2024).
- Tang, Q., et al. Selective decrease of donor-reactive T(regs) after liver transplantation limits T(reg) therapy for promoting allograft tolerance in humans. Sci Transl Med. 14 (669), eabo2628 (2022).
- Bender, C., et al. A phase 2 randomized trial with autologous polyclonal expanded regulatory T cells in children with new-onset type 1 diabetes. Sci Transl Med. 16 (746), eadn2404 (2024).
- Ferreira, L. M. Conference report: Advanced Therapies Week 2023. Regen Med. 18 (4), 297-299 (2023).
- Cochrane, R. W., et al. How to test human CAR T cells in solid tumors, the next frontier of CAR T cell therapy. Methods Mol Biol. 2748, 243-265 (2024).
- Roy, A., Krzykwa, E., Lemieux, R., Neron, S. Increased efficiency of gamma-irradiated versus mitomycin C-treated feeder cells for the expansion of normal human cells in long-term cultures. J Hematother Stem Cell Res. 10 (6), 873-880 (2001).
- Eyquem, J., et al. Targeting a CAR to the TRAC locus with CRISPR/Cas9 enhances tumour rejection. Nature. 543 (7643), 113-117 (2017).
- Negrini, M., Wang, G., Heuer, A., Bjorklund, T., Davidsson, M. AAV Production everywhere: a simple, fast, and reliable protocol for in-house AAV vector production based on chloroform extraction. Curr Protoc Neurosci. 93 (1), e103 (2020).
- Velasco Cardenas, R. M., et al. Harnessing CD3 diversity to optimize CAR T cells. Nat Immunol. 24 (12), 2135-2149 (2023).
- Boomer, J. S., Green, J. M. An enigmatic tail of CD28 signaling. Cold Spring Harb Perspect Biol. 2 (8), a002436 (2010).
- Suhoski, M. M., et al. Engineering artificial antigen-presenting cells to express a diverse array of co-stimulatory molecules. Mol Ther. 15 (5), 981-988 (2007).
- Fung, V. C. W., Rosado-Sanchez, I., Levings, M. K. Transduction of human T cell subsets with lentivirus. Methods Mol Biol. 2285, 227-254 (2021).
- Bailey-Bucktrout, S. L., et al. Self-antigen-driven activation induces instability of regulatory T cells during an inflammatory autoimmune response. Immunity. 39 (5), 949-962 (2013).
- Nakagawa, H., et al. Instability of Helios-deficient Tregs is associated with conversion to a T-effector phenotype and enhanced antitumor immunity. Proc Natl Acad Sci U S A. 113 (22), 6248-6253 (2016).
- Dawson, N. A. J., et al. Functional effects of chimeric antigen receptor co-receptor signaling domains in human regulatory T cells. Sci Transl Med. 12 (557), eaaz3866 (2020).
- Rana, J., et al. CAR- and TRuC-redirected regulatory T cells differ in capacity to control adaptive immunity to FVIII. Mol Ther. 29 (9), 2660-2676 (2021).
- Battaglia, M., Stabilini, A., Tresoldi, E. Expanding human T regulatory cells with the mTOR-inhibitor rapamycin. Methods Mol Biol. 821, 279-293 (2012).
- Brady, B. L., Steinel, N. C., Bassing, C. H. Antigen receptor allelic exclusion: an update and reappraisal. J Immunol. 185 (7), 3801-3808 (2010).
- Samarasinghe, S., et al. Functional characterization of alloreactive T cells identifies CD25 and CD71 as optimal targets for a clinically applicable allodepletion strategy. Blood. 115 (2), 396-407 (2010).
- Voss, K., et al. FOXP3 protects conventional human T cells from premature restimulation-induced cell death. Cell Mol Immunol. 18 (1), 194-205 (2021).
- Collison, L. W., Vignali, D. A. In vitro Treg suppression assays. Methods Mol Biol. 707, 21-37 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved