Method Article
乳酸菌における媒介細胞外電子移動の特性評価 3電極2チャンバー生体電気化学システムによる
要約
ここでは、3電極、2チャンバーの生体電気化学システムを使用して、乳酸菌の媒介細胞外電子移動(EET)を特徴付けるためのプロトコルを紹介します。この方法を Lactiplantibacillus plantarum と酸化還元メディエーター1,4-ジヒドロキシ-2-ナフト酸で説明し、媒介EETの評価に使用される電気化学的手法について詳しく説明します。
要約
多くの細菌は、細胞外電子移動(EET)を行い、それによって電子が細胞から細胞外末端の電子受容体に移動します。この電子受容体は電極であり、電子は酸化還元活性メディエーター分子を介して間接的に送達することができます。ここでは、食品業界で広く使用されているプロバイオティクス乳酸菌である Lactiplantibacillus plantarumの媒介EETを、生体電気化学システムを使用して研究するためのプロトコルを紹介します。3電極、2チャンバーの生体電気化学システムを組み立てる方法を詳しく説明し、クロノアンペロメトリーとサイクリックボルタンメトリー技術を使用して可溶性メディエーターの存在下でのEETの特性評価に関するガイダンスを提供します。1,4-ジヒドロキシ-2-ナフト酸(DHNA)を介した L. plantarum を用いたEET実験の代表的なデータを用いて、データの解析と解釈を実証します。このプロトコルに記載されている技術は、電気発酵と生体電気触媒の新たな機会を開くことができます。この電気化学技術を L. plantarum に最近応用したところ、食品発酵における重要な風味成分である発酵最終製品の生産に向けた代謝フラックスの加速が実証されました。そのため、このシステムは、食品製造の風味を変えたり、貴重な化学物質を生産したりするためにさらに開発される可能性があります。
概要
生物電気化学システムは、微生物と電極をインターフェースし、細胞外電子移動(EET)メカニズムの研究を可能にし、生体電気触媒への再生可能なアプローチを提供します1,2,3。EETを自然に行う微生物は、代謝に由来する電子を細胞外末端電子受容体(例えば、鉄(水)酸化物や電極1)に伝達する外電原として知られている。Geobacter および Shewanella 種 4,5 で初めて特徴付けられ、その後、EET 経路は多くの細菌で同定されています。これらの外電原は、廃棄物の流れからの電気エネルギーの生成、CO2の固定、電気合成による貴重な化学物質の生成など、いくつかの微生物電気化学技術で中心的な役割を果たしています1,6,7,8,9,10,11,12。
そのような外電原の1つが、グラム陽性乳酸菌13であるLactiplantibacillus plantarumです。L. plantarumは、ヒトや他の脊椎動物の腸を含む広範囲の環境に生息する遊牧民のプロバイオティクス細菌であり、肉、穀物、野菜、発酵食品や飲料などの多くの種類の食品にも生息しています14,15,16,17。そのゲノムは、柔軟なヘテロ発酵代謝をコードしており、これらの多様な環境への適応を成功させています。これはよく研究されており、食品および健康業界で広く使用されており、食品医薬品局18,19によって一般的に安全であると認識されています。そのため、L. plantarumは、EETベースの技術の有用なプラットフォームとして機能する可能性を秘めています。
L. plantarumでの最近の研究では、もともとListeria monocytogenesで特徴付けられた複雑なEET経路をコードする多遺伝子オペロンが同定されました13,20。L. plantarumでは、このオペロンから合成されたタンパク質は、キノン1,4-ジヒドロキシ-2-ナフト酸(DHNA)を電子メディエーターとして供給すると、生体電気化学システム(BES)でEETを促進する13。この経路の最初の必須タンパク質は、膜結合性NADH-キノン酸化還元酵素(Ndh2)であり、NADHを酸化してDHNAを減少させます。DHNAは、電子を直接電極に送達するか、アクセサリータンパク質PplAを介して間接的に送達します(図1)13,21,22。最近の研究では、L. plantarumは、電子メディエーターとしてDHNAと構造的に類似した他のキノンも使用する可能性があることが示唆されています。しかし、L. plantarumはDHNAまたはこれらの代替キノンを産生することができないため、EETが発生するためにはメディエーターが環境中に外因的に存在しなければならない13,22,23。
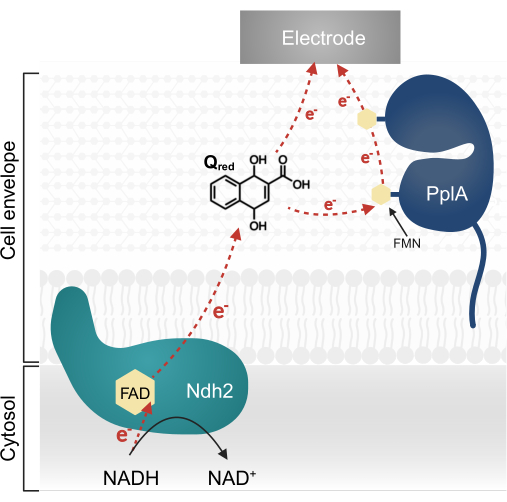
図1: Lactiplantibacillus plantarum EETの電子の流れ。 Ndh2はNADHからキノンDHNAに電子を渡します。電子は電極にシャトルされ、還元キノンによって直接的に、またはアクセサリータンパク質PplAを介して間接的に電流を生成します。略語:FAD =フラビンアデニンジヌクレオチド;FMN =フラビンモノヌクレオチド;EET = 細胞外電子移動;NADH =還元型ニコチンアミドアデニンジヌクレオチド;Ndh2 = NADH-キノン酸化還元酵素;DHNA = 1,4-ジヒドロキシ-2-ナフト酸;PplA = ホスホリパーゼA. この図の拡大版を表示するには、ここをクリックしてください。
この記事では、 BESベースのメソッドを使用してL. plantarumのDHNA媒介EETを特徴付けるための包括的なプロトコルを提供します。3電極、2チャンバーシステムは、バクテリアを作用電極に閉じ込め、バクテリアに印加される電位を正確に制御しながら、作用電極と対電極の間のクロストークを防ぎます。実験前の準備、BESアセンブリ、クロノアンペロメトリー(CA)とサイクリックボルタンメトリー(CV)を利用したEET分析、実験後のサンプル分析を網羅した5日間にわたる包括的なプロトコルを紹介します。このプロトコルは、EET経路のメカニズムを解明し、電気発酵および電極触媒のシステムを構築するために適用できます。
プロトコル
注:2チャンバーBESアセンブリは、次のプロトコルでは「リアクター」と呼ばれます。
1. 培地の準備
- L. plantarum培養培地を調製します。
- 指示に従って市販のMRS(de Man Rogosa Sharpe)培地を調製し、表1に記載の通りmMRS培地24を調製する。mMRSのpHを6.5に調整します。両方の培地を0.22μmのフィルターに通してフィルター滅菌し、使用するまで両方を4°Cで保存します。
- 表2に記載されているように、マンニトール(mCDM)13,25を含む既知組成培地を調製し、pHを6.5に調整します。各リアクターの陽極チャンバーに110 mLの培地を満たすのに十分な培地を準備します。0.22 μmフィルターでmCDMをフィルター滅菌します。
注意: mCDMは、使用予定日に新しく準備する必要があります。コンポーネント溶液は、事前に調製することができます。すべての成分溶液を0.22 μmフィルターでフィルター滅菌し、4°Cで保存します。ウルフのビタミン剤を調製する際は、pHを11に調整してから滅菌し、暗所で保管するか、ホイルで包んで保管してください。ウルフミネラルを調製する際は、ニトリロ三酢酸(NTA)を添加した後、pHを8に調整してください。その後、残った成分を添加して滅菌し、暗所またはホイルで包んで保管します。
- 1x PBSとオートクレーブを調製して滅菌します。このプロトコールで使用するために4°Cで保存してください。
- 指示に従って市販のM9培地(表3)を調製し、オートクレーブで滅菌します。各反応器の陰極チャンバーを110mLで満たすのに十分な培地を準備します。室温で保存してください。
2. 1日目:BES反応器の組み立てと初期培養
注:BESリアクターの概略図と、プロトコルに示されているアセンブリピースの詳細を示す図については、 図2 を参照してください。
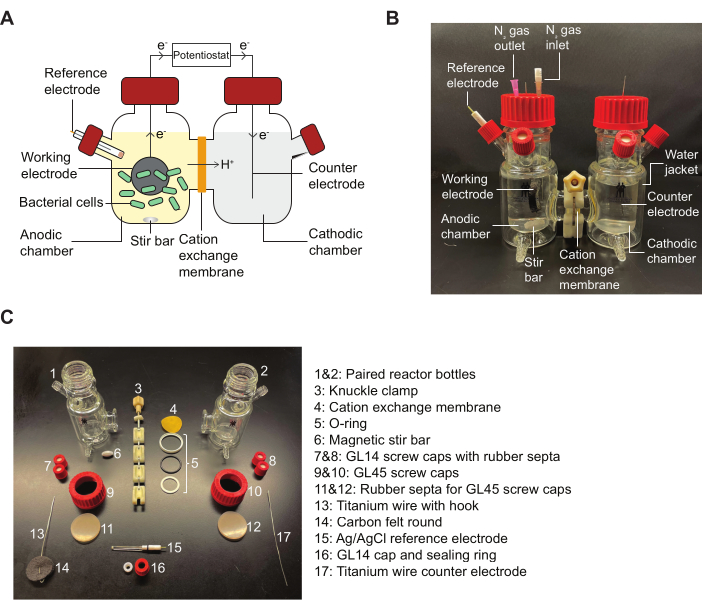
図2:BESの部品と組み立て用図(A)2チャンバーBES反応器の概略図。陽極チャンバー内の細菌(緑色)は、キノンメディエーターの存在下で電子を作用電極(黒丸)に伝達します。電子は回路を通って陰極チャンバーに流れ、ポテンショスタットによってアノードとカソードの間の電流測定を行うことができます。(B)陽極チャンバー内のN2入口および出口針を含む、完全に組み立てられたBES反応器を描いた画像。(C)分解された反応器のすべての部分を描いた画像。略語:BES =生体電気化学システム。この図の拡大版を表示するには、ここをクリックしてください。
- リアクターを組み立てて滅菌します。
- 作用電極と対電極を準備します。作業電極と対電極用の直径1.0mmのチタンワイヤーを、酸化アルミニウムサンドペーパーで均一に光沢が出るまで砂でプリカットします。ペンチを使用して、各作用電極ワイヤーの一方の端を小さなフックに曲げます。16 cm2 のカーボンフェルトを各作用電極ワイヤーにスライドさせ、カーボンフェルトのワイヤーを一度丸く出し入れし、フックに固定されるまでラウンドをワイヤーに引き下げます。ゴム製のセプタムにワイヤーを突き刺し、数センチメートル引っ張って、作業電極と対電極をGL45キャップに固定します。
- ペアリアクターを組み立てるには、まずOリングを組み立て、組み立てたOリングに水にあらかじめ浸したプレカット陽イオン交換膜を置きます。2つのペアのリアクターボトルの大きな底の開口部の間にメンブレンを備えたOリングを配置します。リアクターペアボトルとOリングをメンブレンでナックルクランプで指でしっかりと固定します。マグネティックスターバーを各陽極チャンバーに落とし、ゴム製のセプタムを取り付けたGL14キャップで各ボトルの上部にあるすべての小さな開口部を閉じます。
注意: ナックルclを締めすぎないでくださいamp ボトルのひび割れや破損につながる可能性があるため、キャップやキャップ。 - 各リアクターボトルに110 mLの脱イオン(DI)水を入れ、適切な電極取り付けのGL45キャップで各ボトルを閉じます。カーボンフェルトの丸い作動電極を取り付けたキャップを挿入し、フェルトラウンドの上部をそっと押し下げて、ラウンドがフックに留まるようにします。
注:フレッシュカーボンフェルトは疎水性で、初期組み立てで反応器内の水をはじきます。オートクレーブにより、カーボンフェルトは実験に適した親水性になります。 - シリコンシールリングを取り付けたGL14電極キャップを集めます。
- オートクレーブする前に、すべてのGL45キャップを静かに緩めます。オートクレーブ水入りリアクターと電極キャップを滅菌します。オートクレーブ後、反応器を室温まで冷却します。
- 培養 L.プランタルムNCIMB8826 。無菌条件下で、グリセロールストックの上部から一部の細菌をこすり落とし、市販のMRS培地3mLに接種します。振らずに37°Cで一晩培養します。
注: L. plantarum は、末端電子受容体として酸素を使用しません。したがって、26を振とうして培地を酸素化する必要はありません。ただし、他の微生物を使用すると培養条件が異なります。
3. 2日目:参照電極の準備、実験開始に向けた反応器の準備、 L. plantarum の継代培養
- Ag/AgCl参照電極を調製します。
注:これらの手順は、 材料の表に示されているAg/AgCl参照電極の調製を説明しています。ユーザーは、別の参照電極を使用する場合は、製造元の指示に従う必要があります。- Ag/AgCl参照電極を分解し、ワイヤーを研磨します。電極をガラスハウジングからそっと引き出し、ガラスハウジングをフリックして古いKCl溶液を空にします。電極ワイヤーを酸化アルミニウムサンドペーパーで均一に光沢が出るまで優しく研磨し、酸化した材料を取り除きます。
- 紙やすりで磨かれたすべての参照電極ワイヤーを小さなビーカーと小さな攪拌棒に集め、ワイヤーが完全に水没するまでビーカーに100%漂白剤を充填します。電極が濃い灰色に変わるまで、攪拌プラットフォームでワイヤーを30分間漂白することにより、ワイヤーを塩化物にします。漂白後、電極線を脱イオン水で十分に洗い流してください。
- 参照電極を再組み立てするには、シリンジを使用してガラスハウジングに塩化銀で飽和した3 M KCl溶液を完全に充填し、側面を軽くたたいて気泡を取り除きます。同じシリンジを使用して、電極ワイヤーキャップにKCl溶液を充填し、ワイヤーをハウジングに挿入します。ガラスハウジングの底をベンチトップのペーパータオルに当て、電極をガラスハウジングに挿入してから、キャップをしっかりと押し下げて電極を閉じます。参照電極は、必要になるまでKCl溶液を浅く充填したビーカーに保管し、残りのすべての参照電極で繰り返します。
- デジタルマルチメータを使用して、自家製のAg/AgCl参照電極の電圧を測定します。
- Ag/AgCl参照電極(標準水素電極(SHE)に対して197 mVと推定)の端を3 M KClで満たされたビーカーに浅く沈めます。マルチメータを、同じKCl電解質に浸した市販の飽和カロメル電極(SCE、241 mV対SHE)にしっかりと接続します。
- 各参照電極とSCEの電位差を測定し、参照電極がSCEと44±10mV異なることを確認します。この範囲外にある参照電極を分解して再組み立てします。
- キャップがガラスハウジングと接する部分の継ぎ目をパラフィルムで密封します。
- 実験用の原子炉を準備します。
- 滅菌バイオセーフティキャビネットで、リアクター内のオートクレーブ水と適切な媒体と交換します。オートクレーブ水に注ぎます。陰極チャンバーに110 mLのオートクレーブ滅菌済みM9培地を充填します。陽極チャンバーに110 mLの調製したばかりのmCDMを満たします。
- 参照電極を取り付けます。各陽極チャンバーからGL14キャップを1つずつ取り外し、オートクレーブ処理された電極キャップ(シリコンシールリング付きGL14キャップ)と交換します。参照電極に70%エタノールを噴霧して滅菌し、電極キャップを介して1つの参照電極を各陽極チャンバーに配置します。
注意: 参照電極がカーボンフェルトラウンドに直接接触しないようにしてください。 - バイオセーフティキャビネットからリアクターを取り外す前に、漏れを防ぐために、すべてのキャップとクランプを指で締めます。
- リアクターをウォーターポンプシステムに取り付けます。各リアクターを適切な攪拌子プラットフォームに置きます。各リアクターのウォータージャケットスピゴットをゴムチューブで次のリアクターに接続し、エンドリアクターをウォーターポンプの流入チューブと流出チューブに接続します。
注意: 必要に応じて結束バンドを使用してチューブを固定し、すべての接続が漏れなくしっかりと締まっていることを確認します。 - ポンプに水を入れ、4〜6滴のウォーターコンディショナーを追加します。ポンプシステムをオンにし、温度を30°Cに設定します。ポンプを始動し、すべての原子炉のウォータージャケットを通る水の流れを観察し、どの接続部にも漏れがないことを確認します。
- 攪拌プラットフォームの電源を入れ、220RPMで連続攪拌するように設定します。
- 原子炉を窒素散布ガスラインに取り付けます。エアフィルターを4インチ、22Gの針に取り付け、リアクター陽極チャンバーの上部セプタムからニードルを媒体に挿入して、窒素入口として機能します。別の1インチ、18 Gの針を陽極チャンバーの上部中隔に挿入して、窒素出口として機能します。窒素源からのガスラインをエアフィルターに接続し、バルブを開いてガスが反応器内で穏やかに泡立つようにします。実験中、窒素がすべての陽極チャンバー内で連続的に泡立つことを確認し、嫌気性条件を維持します。
注意: インレットニードルがカーボンフェルトラウンドから離れていることを確認してください。気泡流は、カーボンフェルトまたは参照電極のいずれかと接触してはなりません。 - バイオリアクターをポテンショスタットリードに取り付けます。動作電極、カウンター電極、および参照電極のワニ口クリップリード線をポテンショスタットから対応する電極に接続します。
注意: マルチメータを使用して、ワイヤ/集電体と電極の間の抵抗をチェックし、適切な電気的接続を確保し、潜在的な測定誤差を最小限に抑えます。
- プリランのポテンショスタットパラメータを入力します。
注意: クリティカルテクニックの設定を以下に示します。各手法のソフトウェア設定の拡張リストについては、 表 4 を参照してください。- ポテンショスタットをオンにし、コンピューター上のEC-labソフトウェアを初期化します。ポテンショスタットをコンピューターに接続するには、左上のパネルの[デバイス]の下にあるポテンショスタット記号ボタンをクリックします。接続すると、デバイス名が下のテキストボックスに緑色の円とともに表示されます。
- バイオリアクターに接続されているすべてのチャンネルを1つのグループに同期するには、[ Edit ]タブをクリックし、[ synchronize]を選択します。適切な チャンネル番号ボックスをクリック | ok.
- 開回路電圧(OCV)の手法をポテンショスタットに追加するには、左側のパラメータ設定パネルの+ボタンをクリックします。青い設定ボックスで。参照電極(RE)に対する作用電極電位(EWE)を測定するように設定し、36秒ごとに間隔dtで合計3時間を記録します。
- 次に、サイクリックボルタンメトリー(CV)の手法をポテンショスタットに追加します。EWEの初期電位を0V対REのEIに設定し、スキャンレートを2mV/sに設定します。0.4 V 対 RE の頂点電位 (E1) にスイープし、逆に -0.7 V 対 RE の頂点電位 (E2) に反転します。スキャンを合計 2 回繰り返します。
注:微生物電気化学システムでは、微生物の接種とバイオフィルムの形成により、金属材料や無機分子に比べて高い容量が誘導されます。サイクリックボルタンメトリースキャン中、電位は変化し、充電電流がバックグラウンドとして機能します。高いS/N比を実現するには、スキャンレートを低くする必要がありますが、スキャンの時間が長くなります。1.1 Vの広い電気化学ウィンドウをカバーする2サイクルをスキャンするため、スキャンレートが2 mV/sの場合、ハーフサイクルには最大9.1分かかります。したがって、2つのサイクルには合計36.4分かかります。スキャン速度をさらに下げると、時間がかかりすぎます。 - クロノアンペロメトリー(CA)の技術を追加します。t = 200 h の時間に対して 0.2 V の定電位 EWE を RE に対して印加し、25 秒から 40 秒ごとに間隔 dt で時間を記録します。ポテンショスタットソフトウェアに基づいて時間間隔を調整し、必要な詳細レベルを取得します。
注:DHNAの中点電位は、Ag/AgClに対して約-0.093Vです。したがって、作用電極への0.2V対REの印加電位は、DHNAから電極への電子移動を可能にするのに十分です。 - すべてのパラメータを入力したら、 緑色の開始三角形を押して実行を開始します。ソフトウェアの指示に従って必要に応じてファイルを保存し、[ 保存]をクリックします。ソフトウェアは、手法 1 「OCV」を開始します。OCVトレースを数分間観察して、すべてのリアクタが確実に読み取り、安定した信号で互いに接近していることを確認します。実験を一晩実行してOCVと初期CVを完了し(培地制御CVについては 補足図S1 を参照)、CAが安定するまで実行します。
- 無菌条件下で、 L. plantarum 1:200のMRS培養物を50 mLのmMRSで継代培養します。細胞を振とうせずに37°Cで一晩成長させます。
注:50mLの一晩培養では、通常、反応器での最終OD600 を0.2と仮定すると、6つの反応器に十分な細胞が生成されます。より大きな実験またはより小さな実験のために、それに応じて培養量を調整します。
4. 3日目:細胞とDHNA/DMSOの注入
- 細胞を洗浄し、反応器に注入します。
- 午前中にインキュベーターからmMRS L. plantarum 培養物を取り出します。無菌条件下で、培養物を50 mLの円錐形チューブに移し、培養物を氷上に置きます。
- 細胞を滅菌した冷たい1x PBSで2回洗浄します。これを行うには、培養物を4,000 × gで4°Cの遠心分離機で5分間遠心分離し、細胞をペレット化します。無菌条件下で、細胞を50mLのPBSに穏やかに、しかし完全に再懸濁し、その後、前と同じように再び遠心分離します。2回目の洗濯を繰り返します。最終遠心分離後、細胞を冷PBSに再懸濁してOD600 = 11にします。
- 無菌条件下で、再懸濁した細胞2 mLを、各リアクターに針を取り付けた3 mLシリンジにロードします。
- リアクターステーションで、セルシリンジのキャップを外し、リアクター陽極チャンバーの上部に針を挿入します。このとき、シリンジプランジャーを押さないでください。すべてのリアクターに対して繰り返します。すべてのシリンジが所定の位置に配置されたら、プランジャーを押し下げて細胞をリアクターに注入し、CAトレースから注入時間を記録します。この体積のセルは、反応器内で0.2の最終OD600 を生成する。すべての注射器はバイオハザードボックスに廃棄し、針は指定された鋭利物バイオハザード容器に廃棄します。.電流がCAトレースで2〜4時間フラットに安定するのを待ちます。
注:注入時には、CAトレース上で電流の変動が観察されます。2〜4時間後、これらの変動はフラットな電流(1時間にわたる電流の変化<2μA)に安定し、その時点でDHNAを注入できます。
- 初期pHを測定し、DHNAを注入します。
- DHNAソリューションを準備します。1.5 mLチューブに、粉末状のDHNAを100% DMSOに溶解して、20 mg/mLのDHNA溶液500 μLを調製します。3つのインスリンシリンジに110μLのDHNA溶液を充填し、3つのインスリンシリンジに110μLのDMSOのみを満たします。
注:DHNAは水にわずかに溶けますが、この濃度のDHNAストックにはDMSOの方が優れた溶媒です。メディエーターの溶媒は、他のメディエーターを使用する場合、異なる場合があります。 - BESリアクターステーションで、実験リアクターを + DHNA とラベル付けし、溶媒制御リアクターを -DHNAとラベル付けします。DHNAシリンジのキャップを外し、 + DHNAとして指定された各陽極チャンバーの上部にシリンジを挿入します。DMSO専用シリンジを 、DHNAとして指定された各陽極チャンバーに挿入します。このとき、シリンジプランジャーを押さないでください。
- サンプル分析のために0時間の時点のサンプルを取ります。2インチ、21Gの針を取り付けた3mLシリンジを使用して、未使用のスモールキャップセプタムを介して各陽極チャンバーから2mLの培地サンプルを採取し、サンプルを24ディープウェルプレートに移して、0時間の時点(DHNA注入ポイント)のpH測定を行います。必要に応じて、各陽極チャンバーから1 mLの使用済み培地を取り出し、0.2 μmフィルターで清浄な標識チューブにろ過し、HPLCまたはその他のアッセイを使用して代謝物を定量します。使用済み培地サンプルは-80°Cで保存してください。
- すべてのDHNAおよびDMSOシリンジのプランジャーを押し下げて、リアクターに注入します。CA トレースから挿入の時間を記録します。すべての注射器と針は適切に廃棄してください。
- 各リアクターの0 h pHサンプルを測定し、記録します。
- DHNAソリューションを準備します。1.5 mLチューブに、粉末状のDHNAを100% DMSOに溶解して、20 mg/mLのDHNA溶液500 μLを調製します。3つのインスリンシリンジに110μLのDHNA溶液を充填し、3つのインスリンシリンジに110μLのDMSOのみを満たします。
5. 4日目:実験完了とサンプル採取
- DHNA注入の24時間後に電気化学分析を行い、最終サンプルを採取します。
- DHNA注入の24時間後にCAランを終了します。
- ステップ4.2.3に従って、サンプル分析のために24時間の時点のサンプルを採取します。
- ステップ 3.3.4 で説明されているパラメータに従って、24 時間後の時点から CV を再度実行します。
- 各リアクターからの24時間サンプルのpHを測定し、記録します。
- リアクターを分解して清掃します。
- ポテンショスタットをオフにします。次に、動作リード線、カウンターリード線、および参照リード線を各リアクタから外します。ポテンショスタットリードワニ口クリップから水分を拭き取ります。
- 窒素ガスの流れを止めます。ガスリード線を外してから、流入針と流出針を取り外します。すべての針は鋭利物容器に適切に廃棄してください。
- ウォーターポンプの電源を切ります。ポンプから流入チューブと流出チューブを外し、水がバケツに排出されるようにします。切断するときは、水が床に吸い上げられるのを防ぐために、チューブの端をポンプの喫水線より高く保ってください。1つずつ、各リアクタをウォータージャケットチューブから外し、最終的な流出リアクタから最初のインストリームリアクターまで作業します。
- リアクターからすべての媒体を大きなバイオハザードコンテナに空にします。通常の培養漂白方法に従って廃棄してください。
- 空になったら、すべてのリアクター部品を分解して清掃します。陽イオン交換膜とカーボンフェルトラウンドは、適切なバイオハザード廃棄物に廃棄します。参照電極とチタン線を70%エタノールで洗浄し、洗浄した参照電極は水で浅く満たされたビーカーに保管します。リアクターボトル、キャップ、Oリング、クランプを実験室用洗剤でぬるま湯でやさしく洗浄し、脱イオン水で十分にすすぎ、すべての部品を風乾してから保管してください。
6. 5日目:電気化学分析
注:以下は、このプロトコルのデータプロットの一般的な説明です。分析とデータ解釈に関するより詳細な説明は、代表的な結果のセクションで提供されます。
- CA解析の場合:DHNAインジェクションの時間を0時間の時点として設定します。0 h 時点からのすべての反復について、36 秒ごとに取得された測定電流密度 (j (μA/cm2) ) の平均と標準偏差を時間 (h) の関数としてプロットします。電流密度を作用電極面積(16 cm2)の関数として計算します。
- CV解析の場合:各実験条件(媒体のみ、DMSO、またはDHNA)の代表的なCVトレースをプロットし、電流密度(μA /cm2のj)を作用電極電位(VのEWE )の関数として表します。選択したCV実行のサイクル2をプロットします。
結果
クロノアンペロメトリー分析
L. plantarumのEETは、図3に示すクロノアンペロメトリー(CA)データを通じて観察でき、電流密度トレースはL. plantarumから作用電極への電子移動を視覚化します。電流密度(j)を時間に対して監視し、Ag/AgClに対して+200mVの一定の電位を24時間維持しました。攪拌電解質溶液に20 μg/mL DHNAを注入すると、非生物的DHNA酸化スパイクが観察され、その後、生体電流密度が急速に増加し、約8時間の時点で132.0±2.47μA/cm2でピークに達しました。逆に、DMSOの注入では、電流密度は無視できる程度でした。これらの結果は、L. plantarumと電極との間の電子移動を促進するための必要かつ効率的なメディエーターとしてのDHNAの重要性を強調しています。ユーザーは、BES内のDHNAの濃度を調整することにより、電流出力を調整できます。また、先行研究では、L. plantarumは広範囲のDHNA濃度で用量依存的にDHNAに応答し、0.01 μg/mLという低いDHNA濃度の存在下で大きな電流を生成することが示されています13,22。
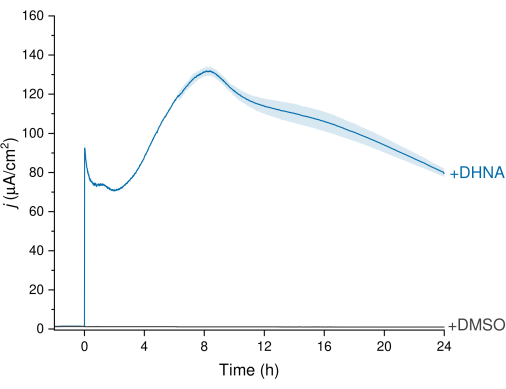
図3:DHNAを媒介とするLactiplantibacillus plantarum EETのクロノアンペロメトリー分析。DHNA(20 μg/mL)または DMSO を mCDM 電解質(pH~ 6.5)に注入し、注入時間を t = 0 と同定しました。Jは、作用電極面積の関数としての電流密度を表します。実験は、200mV対Ag/AgClで、カーボンフェルト電極(16cm2)を用いて攪拌しながら行いました。値は、三重BESリアクターで得られた平均±sdとしてプロットされます。略語:EET =細胞外電子移動;DHNA = 1,4-ジヒドロキシ-2-ナフト酸;DMSO = ジメチルスルホキシド;mCDM = マンニトールを含む既知化合物。この図の拡大版を表示するには、ここをクリックしてください。
サイクリックボルタンメトリー解析
L. plantarumにおけるDHNA媒介EETをさらに評価するために、DHNA注入の24時間後にサイクリックボルタンメトリーを実施した。ここでは、20 μg/mL DHNAを含むL. plantarum、DMSOを含むL. plantarum、および20 μg/mL DHNAを含む培地の3つの条件のCVトレースを示します。図4Aに示すように、L. plantarumを含む反応器に20 μg/mL DHNAが存在すると、DMSOのみの存在下では発生しなかった50 mVでの酸化電流の明確な増加が生じました。これらのデータは、L. plantarumと陽極との間の電子移動を促進するために、酸化還元メディエーターDHNAの添加が必要であることを裏付けています。 L. plantarum + DMSO トレースではさまざまな小さな酸化還元ピークが観察されましたが、これらのピークは培地制御トレースと類似しており、mCDM の酸化還元活性成分に起因する可能性が高いです(補足図 S1)。図4Bでは、生物的条件下での微量のDHNA(L.plantarum + DHNA)と非生物的条件下でのDHNA(Media + DHNA)を比較しました。どちらのトレースも50 mV付近で明確なDHNA酸化ピークを示しましたが、50 mVを超える電流の持続的な増加が観察されたのは生物的条件下でのみでした。触媒ピークは300mVで129μA/cm2の電流密度に達し、非生物的トレースと比較して256%増加しました。このターンオーバーCVプロファイルは、微生物EET27の特徴であり、アノードでのDHNAの酸化後、電子源(マンニトール)の存在下でL.plantarum細胞によるDHNAの再還元を示しています。さらに、非生物的トレースは、-240 mVおよび-180 mV付近で新たな酸化ピークを示しました。先行研究は、これらのピークの出現が、DHNAのACNQ(2-アミノ-3-カルボキシ-1,4-ナフトキノン)21,28への分解によるものである可能性があることを示している。生物の痕跡ではこれらのピークは観察されなかったため、L. plantarum細胞とDHNAとの相互作用がDHNAを安定させ、劣化を防ぐ可能性があることを示しています。注意すべき点は、20 μg/mL DHNAを含む培地の24時間トレースは、細胞を追加せずにこのプロトコルに従って別々に実施したことです。
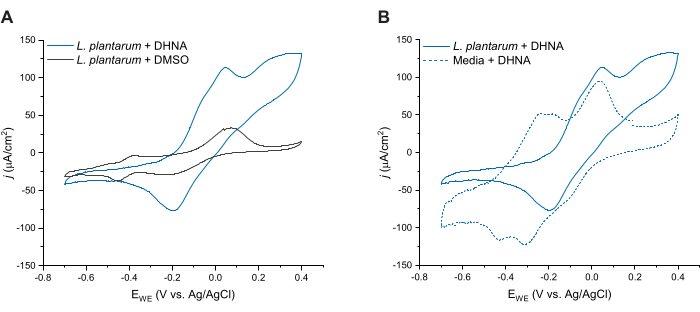
図4:代表的なサイクリックボルタンメトリートレース。 すべてのCV実験は、カーボンフェルト(16 cm2)を作用電極として使用して、溶液を攪拌しながら2 mV / sのスキャン速度でmCDMで実行されました。(A)d = 24時間でのDHNA(20 μg / mL)またはDMSOのいずれかを使用した Lactiplantibacillus plantarum のCVトレース (B)L plantarum (生物的条件)またはmCDMのみ(非生物的条件)のいずれかで20 μg / mL DHNAのCVトレース。略語:CV =サイクリックボルタンメトリー。mCDM = マンニトールを含む化学的に定義された培地。DHNA = 1,4-ジヒドロキシ-2-ナフト酸;DMSO = ジメチルスルホキシド。 この図の拡大版を表示するには、ここをクリックしてください。
pH分析
L. plantarumのEET活性は、24時間にわたってpHの顕著な低下をもたらしました。図5に示すように、DHNAに曝露されたL. plantarumの平均サンプルpHは3.33 ± 0.01(p = 6.85 × 10-6、n = 3)に低下し、DMSOに曝露されたL. plantarumの平均サンプルpHは6.50 ± 0.06(p = 0.0409、n = 3)に低下しました。先行研究で示されたように、この低下は、L. plantarumがEET13を実行するときに発生する発酵代謝の増加に起因しています。L. plantarumは通常、解糖経路と発酵経路を通じてマンニトールを代謝し、最終発酵生成物として酢酸、乳酸、およびエタノールを生成し、基質レベルのリン酸化を通じてATPを生成します29。EET条件下では、発酵による代謝フラックスが増加し、それによりBES培地13における最終発酵産物の生産が増加する。この代謝シフトにより、DHNAを搭載したリアクターでは、DMSOコントロールリアクターと比較して、培地のpHが急速に低下します。
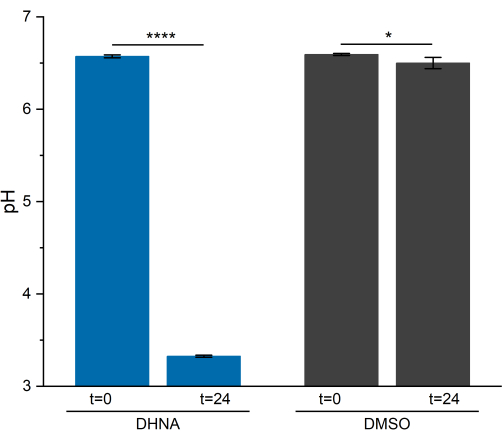
図5: Lactiplantibacillus plantarum 生体電気化学システムのpH分析。 サンプルは、クロノアンペロメトリー中にt = 0およびt = 24時間で収集されました。値は、三重BESリアクターで得られた平均±sdとしてプロットされます。有意性は、 片側t検定によって決定されました。DHNA:P値= 6.85 × 10-6。DMSO: P 値 = 0.0409。略語:DHNA = 1,4-ジヒドロキシ-2-ナフト酸;DMSO = ジメチルスルホキシド。 この図の拡大版を表示するには、ここをクリックしてください。
表1:mMRS培地の調製用成分24.この表をダウンロードするには、ここをクリックしてください。
表2:mCDM培地の調製用材料。 この表は、Tejedor-Sanz et al.13 および Aumiller et al.25 から引用しています。 この表をダウンロードするには、ここをクリックしてください。
表3:M9培地の調製用成分。この表をダウンロードするには、ここをクリックしてください。
表4:OCV、CA、およびCV技術のEC-Labパラメータ設定。 略語:OCV =開回路電圧;CA = クロノアンペロメトリー;CV = サイクリックボルタンメトリー。 この表をダウンロードするには、ここをクリックしてください。
補足図S1:DMSOおよびmCDMのみを使用した Lactiplantibacillus plantarum の代表的な環状ボルタンメトリーの痕跡。 t = 24 h で DMSO を使用し、t = 0 h で mCDM のみを使用した L. plantarum の CV トレース。すべてのCV実験は、カーボンフェルト(16 cm2)を作用電極として使用して、溶液を攪拌しながら2 mV / sのスキャン速度で実行しました。略語:CV =サイクリックボルタンメトリー。mCDM = マンニトールを含む化学的に定義された培地。DHNA = 1,4-ジヒドロキシ-2-ナフト酸;DMSO = ジメチルスルホキシド。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
ここで説明した3電極2チャンバーの生体電気化学システムを用いて、 L. plantarumにおけるDHNA媒介EETからの電流発生の測定を示した。これらのBES実験は高品質のデータを生成します。ただし、BESは敏感です。したがって、プロトコールの成功は、特にリアクターと参照電極の組み立て、陽極チャンバー内の針と電極の配置、陽イオン交換膜の交換において、ユーザーの精度にかかっています。リアクターは慎重に組み立て、オートクレーブや実験中に水や媒体が漏れないようにすることが重要です。水漏れは、カチオン交換メンブレンがOリングに正確にフィットするように切断されていることを確認し、ナックルクランプを指でしっかりと締めることで解決できます。また、オートクレーブ中にカーボンフェルトを完全に水に浸して、実験のために親水性にすることも不可欠です。新規のユーザーは、オートクレーブする前に、水で満たされた新しく組み立てられたリアクターを2時間放置し、メインボトルの接合部の下にゆっくりとした漏れの兆候がないか確認することをお勧めします。さらに、適切な参照電極アセンブリを確保することで、リアクタ間で一貫したデータ複製が保証されます。ガラスハウジング内部のテフロンフリットが変色、ひび割れ、乾燥すると、参照電極の抵抗が高くなる可能性があります。ユーザーは、ガラスハウジングを交換して、参照電極の性能を回復できます。
実験中に陽極チャンバー内のすべての針と電極を適切に向き合わせることは、実験の成功にとって重要です。参照電極は、カーボンフェルト作用電極のどの部分にも直接接触してはなりません。ユーザーは、作用電極チタンワイヤーを反応器の上からゆっくりと回転させることにより、カーボンフェルトの位置を調整できます。さらに、窒素散布のための針の配置は、チャンバー内の電極またはチャンバーの上の電極/ポテンショスタット接続と直接接触しないようにする必要があります。窒素の流れは、どちらの電極にも流れ込まないように調整する必要があります。最後に、ユーザーは、作用電極を攪拌子の1〜2 cm上に配置することにより、攪拌子が作用電極に接触しないようにする必要があります。OCVで不規則な信号が観察された場合、これは通常、反応器内の電極と窒素流の適切な配置を確保し、ポテンショスタットリードと反応器電極間の接続が正しく安全であることを確認することで解決できます。最後に、私たちの経験では、DHNAのような電子メディエーターは陽イオン交換膜内に保持され、何度も再利用すると高いバックグラウンド電流を引き起こす可能性があることが示されています。カチオン交換メンブレンは、特に媒介性EETを調査する場合は、信頼性の高い実験結果を保証するために、2〜3回の使用後に交換することをお勧めします。
電極への微生物の直接付着が電子移動を促進する直接EETとは異なり、媒介EETは細胞膜と電極を横切る電子シャトルの一貫した拡散を必要とし、ここで説明した独自のBES設定をもたらします。まず、陽イオン交換膜で陽極反応と陰極反応を分離するためのプロトコルで、シングルチャンバー対応物ではなくダブルチャンバーBESを選択しました。この分離により、自由拡散電子メディエーター(DHNA)と微生物がカソードと交差相互作用するのを防ぎ、微生物EETが電子メディエーターとアノードを減らす主要な電子源であることが保証されます。また、分離により、メディエーターの濃度/分布やアノードへの電位などのパラメータを正確に制御することもできます。さらに、アノード材料としてカーボンフェルトを選択し、グラファイトロッド、金属電極、ガラス状カーボン、酸化インジウムスズ(ITO)などの他のオプションを選択しました。これは、カーボンフェルトの3D多孔質構造が電極30よりもはるかに大きな表面積を提供し、高濃度でもメディエーターを効率的に利用できるためです。当社の3電極、2チャンバーのBES設定は、長期モニタリングでも媒介EETの信頼性と再現性のある読み出しを提供します。ただし、このプロセスは比較的低スループットです。このプロトコルは、EETメカニズムのベンチスケールの理解や、EETアプリケーションのプロトタイプのテストに適しています。ポータブルまたはプリンテッドBESs31,32、相補型金属酸化膜半導体(CMOS)アレイ33、またはアップスケールBESs34などの代替BESアーキテクチャは、研究者によって異なる基本的または応用的な目的で検討することができる。
このプロトコルでは、最も一般的に使用される電気化学技術であるクロノアンペロメトリー(CA)とサイクリックボルタンメトリー(CV)の詳細な手順を提供します。電気化学インピーダンス分光法(EIS)や差動パルスボルタンメトリー(DPV)などの他の電気化学手法が、電荷移動抵抗と二重層容量35,36,37を分析することにより、BESについてより深い洞察を提供できることは注目に値する。このBESプロトコルはEET測定を可能にしますが、電気化学データを代謝活性や細胞バイオマス測定で補完することも、包括的な分析に不可欠です。L. plantarumのような微生物は、乳酸やエタノールなどの他の発酵副産物とともに、EETを電子シンクの1つとして関与させます。さらに、細胞バイオマスの成長が電子シンク13としても機能していることは注目に値する。したがって、消費された電子供与体(マンニトールなど)の定量化、細胞バイオマスの成長の評価、および発酵副産物のモニタリングにより、EETの効率と生理学的影響についてより深い洞察が得られます。細胞代謝物は、通常、クロマトグラフィーおよび酵素アッセイを用いて定量されますが、細胞生存率および増殖は、コロニー形成単位をカウントし、600nmでの使用済み培地の光学密度を測定することにより評価されます13。EET測定は、実験条件での小さな摂動に敏感であることに注意することも重要です。これには、pH、温度、攪拌速度、および窒素ガス散布速度38が含まれるが、これらに限定されない。したがって、測定されたEETレベルをバイオアナリシス測定で正規化することは、内部コントロールとして機能し、異なる日に実施された実験間で一貫した評価を容易にします。
電気化学技術を他の生物分析測定と組み合わせることで、媒介EETは電気発酵と生体電極触媒の新たな機会を生み出します。有機、無機、または酵素電極触媒の従来の使用は、コストが高く、劣化しやすいという課題があります。あるいは、微生物を生きた電極触媒として使用することは、微生物の自己修復および自己複製能力により、より安価でスケーラブルな解決策を提供する39。L. plantarumは、一般的に安全な乳酸菌として認識されており、特に興味深いシャーシです。このプロトコルに記載されているのと同じ電気化学的設定を使用して、L. plantarumがEET条件下でケールジュースを発酵させ、乳酸、酢酸塩、コハク酸などの発酵最終製品をより多く生成するための代謝フラックスを加速できることを以前に示しました13。これらの有機酸は、食品発酵に不可欠なフレーバー化合物です。これは、電気化学的手法を使用することにより、L. plantarumの媒介EETが潜在的に乗っ取られ、代謝フラックスを操作したり、食品の風味を変更したり、貴重な化学物質を生成したりする可能性があることを意味します。このプロトコルで提示された電気化学的技術は、L. plantarumに適用できるだけでなく、媒介EET40,41を実行する他の天然または遺伝子操作された微生物にも一般的に適用できることは注目に値します。フラビン、フェロセン、中性赤色、フェリシア化物、ローソン、およびメナジオンなどの異なる電子メディエーターは、使用されている特定の微生物の電子伝達メカニズムに基づいて選択することができる22,42。さらに、この研究で確立されたBESプロトコルは、以前にShewanellaおよびGeobacter種43,44で実証されたように、メディエーターレスEETを実行する外電原に拡張できます。最適化された増殖培地を使用して、特定の微生物の細胞活動をサポートし、そのEET性能を促進する必要があります。このプロトコルは、L. plantarumのDHNA媒介EETのパラメータを微調整しますが、異なる微生物と電子メディエーターが適用されると変更が予想されます。
開示事項
著者は、宣言する競合する利益を持っていません。
謝辞
BESの組み立て、メンテナンス、重要な手順、トラブルシューティングについて洞察に満ちた議論をしていただいたAjo-Franklin研究室のメンバーに感謝します。この研究は陸軍研究局が後援し、助成金番号W911NF-22-1-0239(C.M.A-F、RAを支援)およびテキサス州がん予防研究所、助成金#RR190063(CMAFを支援、R.C.、S.L.、およびBBK)の下で達成されました。 図 1 は BioRender.com を使用して作成されました。
資料
| Name | Company | Catalog Number | Comments |
| 1,4-Dihydroxy-2-naphthoic acid (DHNA) | Sigma-Aldrich | 281255-25G | |
| 1.0 mm diameter titanium wire | Thermo Fisher Scientific | 045485.BY | Cut to size for working and counter electrodes |
| 120-C Aluminum Oxide Sheets 9" x 11" | Johnson Abrasives | 10108-15 | |
| 3 mL plastic syringes | Thermo Fisher Scientific | 14955457 | |
| 3M KCl solution saturated with silver chloride | Millipore Sigma | 60137-250ML | |
| 6.35-mm-thick carbon felt | Thermo Fisher Scientific | 043200.RF | Cut into 16 cm2 rounds |
| Ag/AgCl reference electrode | CH Instruments | CH111 | |
| Air-Tite Premium Hypodermic Needles | Thermo Fisher Scientific | 14-817-102 | |
| AlK(SO)4 * 12H2O | Sigma-Aldrich | 237086-100G | |
| Ammonium citrate tribasic | Millipore Sigma | A1332 | |
| Avanti J-15R Centrifuge | Beckman Coulter | B99517 | |
| BD Precision Glide Needle, 18 G x 1 inch | Thermo Fisher Scientific | 14-826-5G | |
| BD Precision Glide Needle, 21 G x 2 inch | Thermo Fisher Scientific | 14-821-13N | |
| Bel-Art SP Scienceware Cleanware Aqua-Clear Water Condtioner | Thermo Fisher Scientific | 23-278339 | |
| Biotin | Millipore Sigma | B4639 | |
| CaCl2 | Millipore Sigma | C4901 | |
| Calcium D-(+)-pantothenate | Millipore Sigma | 1087009 | |
| Casamino acids | Millipore Sigma | 2240-OP | |
| cation exchange membrane | Membranes International | CMI-7000 | Cut into rounds fit to the BES O-ring |
| CoCl2 * 6H2O | Millipore Sigma | C8661 | |
| CuSO4 * 5H2O | Millipore Sigma | C8027 | |
| Cysteine-HCl * H2O | Millipore Sigma | 30129 | |
| DMSO | Millipore Sigma | 5439001000 | |
| DS-11+ Spectrophotometer | Denovix | N/A | |
| EC-Lab Software | BioLogic | N/A | |
| ECO E 4 S heating circulator | Lauda-Brinkmann | Cat. No. 115 V; 60 Hz : L001191 | |
| FeSO4 * 7H2O | Millipore Sigma | 215422 | |
| Folic acid | Millipore Sigma | F8758 | |
| H3BO3 | Millipore Sigma | B6768 | |
| Insulin syringes with BD Micro-Fine IV Needle | Thermo Fisher Scientific | 14-829-1A | |
| Lactiplantibacillus plantarum NCIMB8826 | N/A | N/A | Reference: Tejedor-Sanz et al., 2022 |
| Lactobacillus MRS Broth | HiMedia | M369 | |
| M9 Broth | Milliport Sigma | 63011 | |
| Magnesium sulfate anhydrous | Millipore Sigma | 208094 | |
| Manganese sulfate monohydrate | Millipore Sigma | 221287 | |
| mannitol | Millipore Sigma | M1902-1KG | |
| Mettler Toledo FiveEasy Benchtop pH Meter | Hogentogler | F20-KIT | |
| MgCl2 * 6H2O | Millipore Sigma | M9272 | |
| MgSO4 * 7H2O | Millipore Sigma | M2773 | |
| Millex - GV 0.22 µm PVDF Membrane Filter Unit | Millipore Sigma | SLGV004SL | |
| MnCl2 * 4H2O | Millipore Sigma | 203734 | |
| MnSO4 * H2O | Millipore Sigma | 221287 | |
| MOPS | Millipore Sigma | M1442 | |
| N2 gas | Airgas | NI UHP300 | Filter before use |
| Na2MoO4 * 2H2O | Millipore Sigma | 331058 | |
| Na2SO4 | Millipore Sigma | 238597 | |
| NaCl | Millipore Sigma | S9888 | |
| NH4Cl | Millipore Sigma | A9434 | |
| Nicotinic acid | Millipore Sigma | N-0761 | |
| Nitrilotriacetic acid (NTA) | Millipore Sigma | 72560 | |
| p-Aminobenzoic acid | Millipore Sigma | P9879 | |
| Phosphate buffered saline, 10x solution | Thermo Fisher Scientific | BP399-1 | |
| Potassium phosphate dibasic | Millipore Sigma | P8281 | |
| potentiostat | BioLogic | VMP-300 | |
| Protease peptone #3 | Bacto | 211693 | |
| Pyridoxine HCl | Millipore Sigma | P6280 | |
| Riboflavin | Millipore Sigma | 555682 | |
| RO10 magnetic stir bar platform | IKA | 3691000 | |
| Sodium acetate trihydrate | Millipore Sigma | 935700 | |
| Stir bar, egg-shaped | Thermo Fisher Scientific | 14-512-121 | Place in anodic chamber of BES |
| Thiamine HCl | Millipore Sigma | V-014 | |
| Thioctic acid (α-Lipoic acid) | Millipore Sigma | T-1395 | |
| Tryptophan | Millipore Sigma | 9136 | |
| Tween80 | Millipore Sigma | P4780 | |
| Vitamin B12 | Millipore Sigma | V6629 | |
| Jacketed MCF set, 100 ml, NW25, 2 x GL14 port | Adams & Chittenden Scientific Glass | NA | Customized |
| Yeast extract | Millipore Sigma | Y1625 | |
| ZnSO4 * 7H2O | Millipore Sigma | Z0251 |
参考文献
- TerAvest, M. A., Ajo-Franklin, C. M. Transforming exoelectrogens for biotechnology using synthetic biology. Biotechnol Bioeng. 113 (4), 687-697 (2016).
- Chen, H., Dong, F., Minteer, S. D. The progress and outlook of bioelectrocatalysis for the production of chemicals, fuels and materials. Nat Catal. 3 (3), 225-244 (2020).
- Chen, H., et al. Fundamentals, applications, and future directions of bioelectrocatalysis. Chem Rev. 120 (23), 12903-12993 (2020).
- Lovley, D. R., Phillips, E. J. P. Novel mode of microbial energy metabolism: organic carbon oxidation coupled to dissimilatory reduction of iron or manganese. Appl Environ Microbiol. 54 (6), 1472-1480 (1988).
- Myers, C. R., Nealson, K. H. Bacterial manganese reduction and growth with manganese oxide as the sole electron acceptor. Science. 240 (4857), 1319-1321 (1988).
- Koch, C., Harnisch, F. Is there a specific ecological niche for electroactive Microorganisms. ChemElectroChem. 3 (9), 1282-1295 (2016).
- Zhao, J., et al. Microbial extracellular electron transfer and strategies for engineering electroactive microorganisms. Biotechnol Adv. 53, 107682 (2021).
- Zhang, J., Li, F., Liu, D., Liu, Q., Song, H. Engineering extracellular electron transfer pathways of electroactive microorganisms by synthetic biology for energy and chemicals production. Chem Soc Rev. 53 (3), 1375-1446 (2024).
- Logan, B. E. Exoelectrogenic bacteria that power microbial fuel cells. Nat Rev Microbiol. 7 (5), 375-381 (2009).
- Logan, B. E., Rabaey, K. Conversion of wastes into bioelectricity and chemicals by using microbial electrochemical technologies. Science. 337 (6095), 686-690 (2012).
- Gu, L., Xiao, X., Yup Lee, S., Lai, B., Solem, C. Superior anodic electro-fermentation by enhancing capacity for extracellular electron transfer. Bioresour Technol. 389, 129813 (2023).
- Boucher, D. G., et al. Bioelectrocatalytic synthesis: concepts and applications. Angew Chem Int Ed. 62 (46), e202307780 (2023).
- Tejedor-Sanz, S., et al. Extracellular electron transfer increases fermentation in lactic acid bacteria via a hybrid metabolism. eLife. 11, e70684 (2022).
- Martino, M. E., et al. Nomadic lifestyle of Lactobacillus plantarum revealed by comparative genomics of 54 strains isolated from different habitats. Environ Microbiol. 18 (12), 4974-4989 (2016).
- Fidanza, M., Panigrahi, P., Kollmann, T. R. Lactiplantibacillus plantarum-nomad and ideal probiotic. Front Microbiol. 12, 712236 (2021).
- Duar, R. M., et al. Lifestyles in transition: evolution and natural history of the genus Lactobacillus. FEMS Microbiol Rev. 41 (Suppl_1), S27-S48 (2017).
- Kaushik, J. K., et al. Functional and probiotic attributes of an indigenous isolate of Lactobacillus plantarum. PLOS ONE. 4 (12), e8099 (2009).
- Seddik, H. A., et al. Lactobacillus plantarum and its probiotic and food potentialities. Probiotics Antimicrob Proteins. 9 (2), 111-122 (2017).
- Siezen, R. J., et al. Phenotypic and genomic diversity of Lactobacillus plantarum strains isolated from various environmental niches. Environ Microbiol. 12 (3), 758-773 (2010).
- Light, S. H., et al. A flavin-based extracellular electron transfer mechanism in diverse Gram-positive bacteria. Nature. 562 (7725), 140-144 (2018).
- Tolar, J. G., Li, S., Ajo-Franklin, C. M. The differing roles of flavins and quinones in extracellular electron transfer in Lactiplantibacillus plantarum. Appl Environ Microbiol. 89 (1), e0131322 (2023).
- Li, S., De Groote Tavares, C., Tolar, J. G., Ajo-Franklin, C. M. Selective bioelectronic sensing of pharmacologically relevant quinones using extracellular electron transfer in Lactiplantibacillus plantarum. Biosens Bioelectron. 243, 115762 (2024).
- Blackburn, B., Alba, R., Hatch, A., Ajo-Franklin, C. M., Mevers, E. Understanding the Chemical Properties that Drive Extracellular Electron Shuttles. ChemRxiv. , (2024).
- De Man, J. C., Rogosa, M., Sharpe, M. E. A medium for the cultivation of Lactobacilli. J Appl Bacteriol. 23 (1), 130-135 (1960).
- Aumiller, K., et al. A chemically-defined growth medium to support Lactobacillus-Acetobacter sp. community analysis. PLOS ONE. 18 (10), e0292585 (2023).
- Brooijmans, R. J. W., de Vos, W. M., Hugenholtz, J. Lactobacillus plantarum WCFS1 electron transport chains. Appl Environ Microbiol. 75 (11), 3580-3585 (2009).
- LaBelle, E., Bond, D. R. Cyclic voltammetry for the study of microbial electron transfer at electrodes. Bio-electrochemical systems: from extracellular electron transfer to biotechnological application. , (2009).
- Mevers, E., et al. An elusive electron shuttle from a facultative anaerobe. eLife. 8, e48054 (2019).
- Dirar, H., Collins, E. B. End-products, Fermentation balances and molar growth yields of homofermentative Lactobacilli. Microbiology. 73 (2), 233-238 (1972).
- Huong Le, T. X., Bechelany, M., Cretin, M. Carbon felt based-electrodes for energy and environmental applications: A review. Carbon. 122, 564-591 (2017).
- Zhou, A. Y., Baruch, M., Ajo-Franklin, C. M., Maharbiz, M. M. A portable bioelectronic sensing system (BESSY) for environmental deployment incorporating differential microbial sensing in miniaturized reactors. PLOS ONE. 12 (9), e0184994 (2017).
- Benjamin, S. R., de Lima, F., Nascimento, V. A. d. o., de Andrade, G. M., Oriá, R. B. Advancement in paper-based electrochemical biosensing and emerging diagnostic methods. Biosensors. 13 (7), 689 (2023).
- Kumashi, S. R., et al. A CMOS multi-modal electrochemical and impedance cellular sensing array for massively paralleled exoelectrogen screening. IEEE Trans Biomed Circuits Syst. 15 (2), 221-234 (2021).
- Jadhav, D. A., et al. Scale-up of the bioelectrochemical system: Strategic perspectives and normalization of performance indices. Bioresour Technol. 363, 127935 (2022).
- Kim, J., Cestellos-Blanco, S., Shen, Y., Cai, R., Yang, P. Enhancing biohybrid CO2 to multicarbon reduction via adapted whole-cell catalysts. Nano Lett. 22 (13), 5503-5509 (2022).
- He, Z., Mansfeld, F. Exploring the use of electrochemical impedance spectroscopy (EIS) in microbial fuel cell studies. Energy Environ Sci. 2 (2), 215-219 (2009).
- Okamoto, A., Hashimoto, K., Nealson, K. H., Nakamura, R. Rate enhancement of bacterial extracellular electron transport involves bound flavin semiquinones. Proc Natl Acad Sci U S A. 110 (19), 7856-7861 (2013).
- Zhang, X., Li, X., Zhao, X., Li, Y. Factors affecting the efficiency of a bioelectrochemical system: a review. RSC Adv. 9 (34), 19748-19761 (2019).
- Kornienko, N., Zhang, J. Z., Sakimoto, K. K., Yang, P., Reisner, E. Interfacing nature's catalytic machinery with synthetic materials for semi-artificial photosynthesis. Nat Nanotechnol. 13 (10), 890-899 (2018).
- Glasser, N. R., Saunders, S. H., Newman, D. K. The colorful world of extracellular electron shuttles. Annu Rev Microbiol. 71 (1), 731-751 (2017).
- Gemünde, A., Lai, B., Pause, L., Krömer, J., Holtmann, D. Redox mediators in microbial electrochemical systems. ChemElectroChem. 9 (13), e202200216 (2022).
- Kundu, B. B., et al. Extracellular respiration is a latent energy metabolism in Escherichia coli. bioRxiv. , (2024).
- O'Brien, J. P., Malvankar, N. S. A simple and low-cost procedure for growing Geobacter sulfurreducens cell cultures and biofilms in bioelectrochemical systems. Curr Protoc Microbiol. 43 (1), A.4K.1-A.4K.27 (2016).
- Su, L., Fukushima, T., Ajo-Franklin, C. M. A hybrid cyt c maturation system enhances the bioelectrical performance of engineered Escherichia coli by improving the rate-limiting step. Biosens Bioelectron. 165, 112312 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved