このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
初期のニワトリ胚をex vivo(新文化)の文化のための方法
要約
このビデオでは、新しい文化、最大24時間までのニワトリ胚が卵の外側に培養される方法を示しています。このメソッドは1つが、マウスのE7 - 9に相当する期間を早期に開発を(14 SOMの原条。)勉強することができます。この技術のアプリケーションでは、in situハイブリダイゼーションと免疫組織化学では、エレクトロポレーションが含まれています。
要約
ニワトリ胚は、初期胚発生の研究に貴重なツールです。その透明性、アクセス性と操作の容易さ、それを脳、神経管、体節、心臓原基の形成およびパターニングを研究するための理想的なツールとなっています。ニワトリ胚培養のアプリケーションでは、成長因子の移植、遺伝子機能を解析するためにそのようなFGFのとBMPだけでなく、in situハイブリダイゼーションと免疫組織化学の全体マウントとしてコーティングされたビーズをDNAまたはRNA構築物のエレクトロポレーションが含まれています。このビデオでは、ニワトリ胚培養における異なる手順を示し、まず、胚は生理食塩水に植されています。その後、胚をガラスリングの中央に配置されます。胚を包む膜は、リングの壁に沿って持ち上げられて。リングは、アルブミンのプールを含む培養皿に置かれます。培養皿を密封し、胚が最大24時間培養された湿潤なチャンバ内に置かれます。最後に、胚は、リングから削除さに固定し、さらにアプリケーション用に処理されます。トラブルシューティングガイドも表示されます。
プロトコル
パート1:ベンチのセットアップ
- 湿気の多い室は、プラスチック製のチャンバー内にキムワイプ/のddH 2 Oを配置することによって調製される。
- 文化、リング、watchglassと廃棄物処理のためのアルブミン、皿を収集するためのファルコンチューブはベンチ上に配置されます。
- パイレックス皿は1.4リットルの生理食塩水で満たされている(ノートを参照してください[A])。
パート2:胚は生理食塩水で外植され
- 卵は16時間(ステージ4)の後にインキュベーターから削除されます。卵は、ピンセットで殻をタップしopeneです。シェルの部分が削除されます。
- 薄いアルブミンは、ファルコンチューブに回収される。厚いアルブミンは、鉗子で除去されます。
- 胚は生理食塩水ディッシュ内のプラスチック製シャーレに入れられます。残りのアルブミンは、鉗子で除去されます。
パート3:胚がリングの中央に
- 卵黄嚢は胎芽が上方を向くように鉗子で傾いている。
- 卵黄嚢は、赤道のレベル以下でカットされます。
- 微細な鉗子を使用して、卵黄膜が速やかに剥離される。卵黄膜は、粒状の側(非シニーホッケー)が上方を向くように配向される。
- 細かい鉗子を使用して、卵黄膜は、時計皿上に置かれている。
- 微細な鉗子を使用して、ガラスのリングは、卵黄膜の上に適用され、胚はセンタリングされます。
- 卵黄膜は、ガラスのリングの周囲に持ち上げられる。アセンブリは、生理食塩水皿から削除されます。
パート4:文化を顕微鏡下で設定されている
- 卵黄膜は、顕微鏡下で微細な鉗子を用いて、ガラスリング上で解除される。
- パスツールピペットを使用して、生理食塩水は、リングの外側の端から削除されます。
- 細かいハサミを使用して、過剰な卵黄膜は、ガラスのリングの内側の端から削除されます。ケアはないピペットまたはピンセットで膜を貫通して取得されます。
- 胚を穏やかに緩やかな膜と卵黄細胞を除去するために生理食塩水で洗浄される。
- 200μlの生理食塩水は、リングの外側のエッジ(これは後で転送を容易にする)に追加されます。
- アセンブリは、逆プラスチック皿で覆われている。
第5部:培養はインキュベーターに転送される
- ファルコンの培養皿にラベルが付けられます。
- 薄いアルブミンの2.5ミリリットルはファルコン皿の一番下に追加されます。
- 薄いアルブミン200μlのは、ファルコンディッシュの蓋の内側の端に追加されます。
- 逆皿は、アセンブリから削除されます。
- 微細な鉗子を使用して、ガラスのリングは時計皿の縁に沿ってslided、およびファルコン皿に移している。
- すべての残りの生理食塩水は、リングの内面から削除されます。
- ファルコンディッシュは蓋で覆われ、封止される。
- アセンブリは、湿度の高い室でして、インキュベータ内に配置されます。
- 胚を38℃で24時間できるようにまで培養されています
パート6:以下の培養、胚は固定され、文化は、インキュベーターに転送されます。
- (胚のin situハイブリダイゼーションのために処理するかどうかまたはDEPC - PBS)固定の皿は、氷冷PBSで満たされている。
- 培養は、インキュベーターから取り出し、直ちに氷上に配置されます。培養皿は、直ちに氷冷PBS / DEPC - PBSで満たされている。
- 胚は卵黄膜から切り離される。胚は、パスツールピペットの平滑末端を使用して、固定の皿に移している。
- 胚は、先の尖っていない微細な鉗子を使用してダウンして固定されます。固定の皿をカバーするPBSは削除されます。固定液が追加される(ノートを参照してください[B])。
- アプリケーションによっては、胚を4で6〜8時間固定されています° C(クライオスタット)、4℃でO / N ° C(内臓の)、または全体のマウント免疫組織化学のためのRTで1時間。
- 固定液は氷冷PBS / DEPC PBSで除去し、置き換えられます。
- このようなin situハイブリダイゼーションまたはimmantibody染色のようなダウンストリームアプリケーションのために:神経系と心臓ブラントエンドマイクロキャピラリーニードルまたはマイクロダイセクションのナイフを使用して穴あきですが、これは後のステップでプローブ/抗体の捕捉できなくなります。
ノート :[A]生理食塩水が構成されています:溶液(1リットル用):121.0グラムのNaCl、15.5グラムのKCl、10.4グラムのCaCl 2 · 2H 2 O、12.7グラムのMgCl 2 · 6H 2 O、B液(1L用) :2.4グラムのNa 2 HPO 4 · 2H 2 O、0.2グラムのNaH 2 PO 4 · 2H 2 O、オートクレーブ、使用前には、120mlを混ぜて2700ミリリットルH 2 Oと、180ミリリットルB.ミックスを追加[1]; [B]固定液は、(4%内臓のためにPBSまたはDEPC - PBSでPFA)、使用直前に調製される。
パート7:代表的な結果
文化の前に、胚は、原始線条のステージ(HH4)にあります。培養期間の終了時に、胚は、HH10(長さ2〜3ミリメートル)に開発され、培養皿の中央に表示されている。カルボシアニン蛍光DIIと細胞のグループにラベルを付けることが可能です単に文化の前に(0H)と培養期間を通して、運動に従ってください。このケースでは、ヘンゼンのノード(HN)下のセルは、DIIで標識した。これらの細胞は徐々に開発する体節(SOM)と脊索(n)に寄与することが示されている。 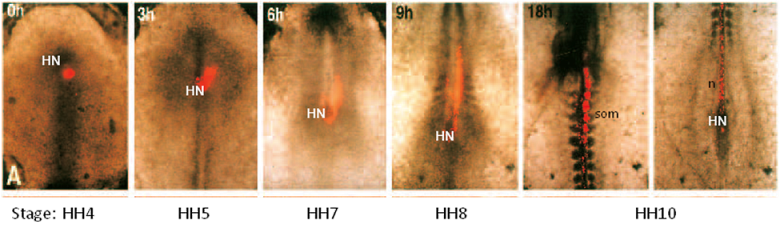
パート8:トラブルシューティング
| 問題が | 原因と | 救済策 |
|---|---|---|
| 胚は、細胞膜(ステップ2)で出てくるのではなく、卵黄とまま | 貧しい卵質 | 受領後、13でのストア卵℃、要求されたばかりの卵を生産。卵の到着日と同じ日をインキュベートする。 |
| 離れてリングの時計メーカーのガラスは、次の配置(ステップ3)から卵黄膜のスライド | アルブミンの残党 | ステップ2では、すべてのアルブミンが傾いたピンセットで膜から引き抜くようにして削除されていることを確認してください |
| 胚はアクセス不能です:メンブレン(ステップ4)の下にある | 膜の反対側は上向きです。 | ステップ3では、卵黄顆粒を含む膜の側面が上を向いていることを確認してください。光沢のある、洗練された側が下方に向くようにします。 |
| 生理食塩水/アルブミン、以下の培養で水没胚(ステップ6) | 前の文化にリングの内側にある左側のアルブミン/生理食塩水、細胞膜の穴 | ステップ5では、生理食塩水/すべてのアルブミンがリングの内側から削除されていることを確認し、手順4で、(平滑末端鉗子を使用する)鉗子でピアスの膜をしないことを確認してください |
| 胚では、次の文化を崩壊 | 細菌感染 | すべてのツールとガラス製品を殺菌し、抗生物質/抗真菌剤を使用 |
ディスカッション
新しい培養法2は、in situハイブリダイゼーションおよび全体のマウント免疫組織化学4 に全体のマウントにビーズ3を 、含んでいる成長因子の移植に至るまで幅広いアプリケーションに使用できます。 24時間の期間にわたって文化は、そのような時間経過の細胞運動の分析5あるいはエレクトロポレーションの構成要素6を含むGFPの監視などのアプリ?...
謝辞
この作品は、RHFへマーガレットM. Alkek財団によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments | |
| Eggs | Animal | Charles River Laboratories | Premium Fertile | |
| Stereomicroscope | Microscope | Leica Microsystems | MZ9.5 or similar | |
| Marsh Automatic Incubator | Tool | Lyon | RX | |
| Hybridization Incubator | Tool | Robbins Scientific, SciGene | M1000 | |
| Pyrex dish (2) | Tool | |||
| Watchmaker’s glass 50mm | Tool | VWR international | 66112-060 | |
| Glass rings | Tool | Physical Plant facility | cut 4 mm thick sections of glass tubing (27 mm outer diam, 25 mm inner diam). Do not fine polish. | |
| Curved Forceps (1) | Surgery | Electron Microscopy Sciences | 72991-4C | |
| Forceps (2) | Surgery | Fine Science Tools | 11002-13 | blunt ended using sharpening Stone and 100ul mineral oil |
| Sharpening Stone Dan’s Black Arkansas | Surgery | Electron Microscopy Sciences | 62082-00 | |
| Fine scissors | Surgery | Fine Science Tools | 14161-10 | |
| Plastic dishes | Tool | Falcon BD | 353001 | |
| Rubber Bulb | Tool | Electron Microscopy Sciences | 70980 | |
| Pasteur Capillary Pipette | Tool | Electron Microscopy Sciences | 70950-12 | round edge under flame |
| Microcapillary tube | Surgery | Sigma-Aldrich | P1049-1PAK | Pull using vertical micropipette puller; blunt end with fine forceps |
| Microdissecting knife | Surgery | Fine Science Tools | 10056-12 | Use to puncture cavities prior to in situ hybridization |
| Minuten pins 0.2mm diam | Surgery | Fine Science Tools | 26002-20 | |
| Sylgard 184 Silicon Elastomer Curing Agent and Base | Reagent | Dow Corning | 0001986475 | Mix 1 part Curing Agent, 9 parts Base; set O/N at 37C |
| Diethylpyrocarbonate (depc) | Reagent | Acros Organics | 10025025 | Add 1ml depc to 1l PBS; shake; autoclave |
参考文献
- Pannett, P. A., Compton, C. A. The cultivation of tissues in saline. Lancet. 206, 381-384 (1924).
- New, D. T. A new technique for the cultivation of the chick embryo in vitro. J. Embryol. Exp. Morph. 3, 326-331 (1955).
- Alvarez, I. S., Araujo, M., Nieto, M. A. Neural induction in whole chick embryo cultures by FGF. Dev. Biol. 199, 42-54 (1998).
- Psychoyos, D., Stern, C. D. Restoration of the organizer after radical ablation of Hensen's node and the anterior primitive streak in the chick embryo. Development. 122, 3263-3273 (1996).
- Psychoyos, D., Stern, C. D. Fates and migratory routes of primitive streak cells in the chick embryo. Development. 122, 1523-1534 (1996).
- Voiculescu, O., Papanayotou, C., Stern, C. D. Spatially and temporally controlled electroporation of early chick embryos. Nature Protoc. 3, 419-426 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved