JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
상향 류 혐기성 슬러지 블랭킷 반응기에서 해양 퇴적물과 트리클로로 에틸렌 감소에서 Sulfidogenic 슬러지의 개발
요약
Microbial sulfate reduction is a process of great importance in environmental biotechnology. The success of the sulfidogenic reactors depends among other factors on the microbial composition of the sludge. Here, we present a protocol to develop sulfidogenic sludge from hydrothermal vents sediments in a UASB reactor for reductive dechlorination purposes.
초록
The importance of microbial sulfate reduction relies on the various applications that it offers in environmental biotechnology. Engineered sulfate reduction is used in industrial wastewater treatment to remove large concentrations of sulfate along with the chemical oxygen demand (COD) and heavy metals. The most common approach to the process is with anaerobic bioreactors in which sulfidogenic sludge is obtained through adaptation of predominantly methanogenic granular sludge to sulfidogenesis. This process may take a long time and does not always eliminate the competition for substrate due to the presence of methanogens in the sludge. In this work, we propose a novel approach to obtain sulfidogenic sludge in which hydrothermal vents sediments are the original source of microorganisms. The microbial community developed in the presence of sulfate and volatile fatty acids is wide enough to sustain sulfate reduction over a long period of time without exhibiting inhibition due to sulfide.
This protocol describes the procedure to generate the sludge from the sediments in an upflow anaerobic sludge blanket (UASB) type of reactor. Furthermore, the protocol presents the procedure to demonstrate the capability of the sludge to remove by reductive dechlorination a model of a highly toxic organic pollutant such as trichloroethylene (TCE). The protocol is divided in three stages: (1) the formation of the sludge and the determination of its sulfate reducing activity in the UASB, (2) the experiment to remove the TCE by the sludge, and (3) the identification of microorganisms in the sludge after the TCE reduction. Although in this case the sediments were taken from a site located in Mexico, the generation of a sulfidogenic sludge by using this procedure may work if a different source of sediments is taken since marine sediments are a natural pool of microorganisms that may be enriched in sulfate reducing bacteria.
서문
환경 생명 공학에 가장 중요한 공헌 중 하나는 (접종) 사용 된 슬러지는 황산염 환원 조건 하에서 수행 할 수 있었다있는 생물 반응기의 디자인이었다. 황산 환원 (SR)은 COD, 중금속 및 유기 오염 물질, SR을 오니 (1)의 바람직한 특성을 만드는 사실의 동시 제거에 부가하여 고농도의 황산을 함유 폐수의 처리를 허용한다. 황산에 오염 된 폐수의 예로는 무두질, 종이, 제약 및 화학 제조 산업 (1)에서 왔습니다. 그러나 문헌의 대부분은 메탄 입상 슬러지 sulfidogenesis 2에 적용되었을 때 슬러지를 sulfidogenic을 의미한다. 이러한 조정은 일반적으로 COD / 생물 반응기에서 SO 4 2- 비 조작 및 슬러지의 2,3- 노젠을 억제하는 화학 물질을 첨가함으로써 달성된다. m 긴 시간에 추가AY sulfidogenic 과립의 형성을 필요로 노젠과 황산 감속기 및 황화물의 고농도 슬러지 공차 간의 경쟁은 생물 반응기에 사용 sulfidogenic 슬러지의 적응로부터 획득되는 경우 발생할 수있는 그 주요 문제점 중 일부입니다 주로 메탄 슬러지 조건 황산 환원합니다. 이 작품에서 우리는 상향 류 혐기성 슬러지 블랭킷 반응기 (UASB)에서 열수 통풍구 퇴적물 (푼타 미타, 나야 리트, 멕시코)에서 주로 sulfidogenic 슬러지를 획득하는 절차를 설명, 우리는 시간이 지남에 따라 활동을 감소의 황산을 평가하고 실험을 수행 환원 탈염 소화에의 응용 프로그램을 평가한다. 가 해당 사이트에 의한 특정 장소 (4) 거주 미생물 군집에 의해 전시 된 황산 감소 활동에 황화물의 형성이보고되어 있기 때문에 퇴적물의 위치는 선택되었다.
끊다가 있습니다sulfidogenesis에 메탄 세분화 된 슬러지를 적응을 통해 퇴적물에서이 sulfidogenic 슬러지를 얻는 등의 장점. 이러한 이점 중 일부이다 : (1) (3)이되는 슬러지가 적응 메탄 슬러지 작동 다른 UASB에 비해 황화물의 비교적 높은 농도를 견뎌 (2), 바이오 리액터를 동작하는 과립을 형성 할 필요가없고, 아세테이트 슬러지의 형성을 촉진하는 배지에 포함 된 휘발성 지방산의 혼합물에 사용하는 경우에도 노젠와 기판에 대한 경쟁하지 않는다.
해양 침전물은 황산, 환원 세균 박테리아 발효 세균은 몇 5,6- 물론 탈 할로겐 같은 미생물의 다양한 천연 풀 때문 절차 sulfidogenesis을 촉진 하였다. 이 프로토콜을 이용하여 개발 된 해양 침전물로부터 컨소시엄 유형 황산 환원하므로, 높은 S 효율을 나타낼 수있다 ulfate는 메탄과 황산염 환원 박테리아에 독성으로보고보다 더 높은 농도에서 황화 시간에 활동과 높은 내성을 감소시킨다. 한편, 탈 할로겐 기능도 프로토콜이 여기에서 제안하지만 원래 미생물 군집에 의존 할 수있다 다음으로 퇴적물에 도시되는 가능성이 높다. 이러한 가정은 환원성 탈염은 호흡 또는 cometabolism로 인해서 발생할 수 있다는 사실에 기초하여 수행되는, 해양 미생물 군집 7에서 촉진 될 수있다 두 조건. 슬러지를 얻었다 퇴적물 재배 이들 휘발성 지방산 황산 환원 세균의 여러 균주에 의해 사용되기 때문에 기판으로서 아세트산, 프로피온산, 부티르산의 혼합물을 사용하여 수행 하였다. 이 산은 바다 퇴적물 5,6의 탄소 질 물질에 문학의 여러 보도에 따르면, 자주 해양 퇴적물에서 발견 된 탄소 화합물의 유형입니다.
내용 "> 마지막으로, 전 세계 지하수 등의 물을 몸에서 발견되는 가장 독성 화합물의 일부는 트리클로로 에틸렌 (TCE) 또는 퍼 클로로 에틸렌 (PCE)와 같은 염소계 용제이다. 이들 화합물은 독성뿐만 아니라 인간에 있지만, 또한 미생물로, 여전히 미국 환경 보호국 (EPA)에 의해 우선 순위 오염 물질로 간주 특히 TCE는 8.이 작품에서 우리는에있는 sulfidogenic 슬러지 농도에서 TCE를 감소의 능력을 테스트하는 실험을 제안 메탄 조건 9,10에서 염소 화합물의 생분해에 대해보고 범위. 그것은 염소 화합물의 생분해에 대한 연구의 대부분이 메탄 조건 9,10에서 실시 된 것을 언급 할 가치가있다. 우리는이 프로토콜에 제안 된 TCE와 실험을 것을 고려 슬러지의 잠재적 인 응용의 좋은 예.이 실험의 목적은 전자 것이었다TCE에 슬러지와 활성을 감소 페이트상에서 TCE 효과 내성을 평가할. (1) (2) COD를 제거하고, (3) 분리, 황산 제거 : 염소화 화합물의 생분해에 대한 연구의 대부분은 메탄 조건 하에서 수행되는 것을 고려하면,이 프로토콜은 슬러지의 형성을 동시에하기 위해 사용될 수있다 제안 염소 화합물. 상기 공정은, (외에 황산 COD까지) 조건 하에서 메탄 평가할 수없는 두 가지 조건을 TCE 중금속의 동시 제거에 슬러지를 평가할 수 있었다.프로토콜

프로토콜의 단계 1. 계획을 그림. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
1. 슬러지의 형성을위한 해양 퇴적물을 수집
- (때문에 높은 황산 감소 활동을 나타낼 수 황화물의 존재에) 열수 통풍구에 가까운 또는 유기 물질의 파편이 검출있는 지역 중 하나 가까이 해저 지역을 확인합니다.
- 이 작업의 목적을 위해, 퇴적물의 약 3 4kg을 가지고 샘플 떨어져 물을 배수. 어두운 비닐 봉지에 샘플을 놓습니다. 냉장이 필요하지 않습니다.
- 그들은 즉시 사용하지 않을 경우는 실험실에서 일단 냉장고에 샘플 가방을 유지. 이 작품, SAMP의 목적레는 사용하기 전에 몇 주 또는 몇 달 동안 냉장고에있을 수 있습니다.
- 퇴적물 샘플 (즉, 1 또는 2 ㎏)의 큰 부분을 가지고 퇴적물 찾을 수있다 탄소 재료의 큰 파편 또는 존재할 수있는 일부 바위에서 제거하기 위해 적절한 메쉬 (0.2 cm)를 사용합니다.
주의 : 이러한 경우에 0.20 cm 직경 (에 0.0767)의 메쉬를 사용 하였다 있지만 시료의 입자 크기에 따라 다른 크기 일 수있다.- 메쉬를 통해 퇴적물을 통과 한 후, 부분이 균일 한 것을 촉진하기 위해 선택한 부분을 섞는다.
- 표준 방법 (11)에 따라 휘발성 부유 물질 (VSS) 내용을 결정하기 위해 분리 된 작은 샘플을 (즉, 2-3g) 가져 가라.
참고 : 단계 1.2-1.4 그림 2를 참조하십시오.

퇴적물 샘플 2. 사진을 그림.(A) 퇴적물 샘플 직후에 촬영된다. (B) 침전물 샘플을 메쉬를 통과 한 후. 휘발성 부유 물질 이전 (VSS) 결정을 계량 촬영 (C) 샘플. 페트리 접시는 멸균 할 필요가 없습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 생물 반응기 설정까지
- 이 연구의 목적을 위하여, 대안 3 L. 총 작업 볼륨 UASB 유리 반응기를 사용하여, 1 또는 2 L의 유리제 반응기를 사용한다.
- 퇴적물 VSS 내용에 따라 퇴적물의 양을 계산하는 L. 1 VSS 5 g을 얻었다 접종원으로 사용될
- 계산 후의 침전물의 양이 너무 큰 경우, 바이오 리액터의 후 약 25 % 내지 30 % 양 대신 퇴적물에 의해 점유되어야한다고 고려.
- 그 이후 VSS 내용을 기록미생물 군집은 생물 반응기에 충실 할 때 변경됩니다. VSS 콘텐츠는 생물 반응기에서 활성을 감소 황산 계산을 위해 필요하다.
- 생물 반응기의 기초 중간 버퍼 용액의 최종 농도가 게레로 - 바라하스 등의 알에 의해보고 된 유사 있는지 확인하십시오. (2014) 12.
- 퇴적물, 기초 배지, 완충액 및 휘발성 지방산의 최종 부피가 반응기의 최종 작업 볼륨 동일한 지 확인. 기본 배지 제조법 (12)는 미량 금속과 비타민 솔루션에 적합한 농도가 포함되어 있습니다.
- (즉, 2, 3 또는 4 단계 2.4에보고보다 배 더 집중)이 희석 될 때되도록, 그것은 인 사용 반응기의 작동 부피에 대해 적절한 농도 기초 배지 및 완충액 원액을 제조 게레로 - 바라하스 등에 의해보고 된 농도. (2014)12).
주 : 기본 배지 용 원액 그러나 완충액 만 개시까지 필요에 항상 필요하다. 이는이 시간 이후 완충액을 추가 할 필요가 없다. - 1 : 1 COD 비율 2.5 아세테이트, 프로 피오 네이트 및 부티레이트 : 휘발성 지방산의 주식 솔루션을 준비합니다. 아세트산 나트륨은 기본 배지에 포함 된 계산을 위해 고려. 원자로의 마지막 COD 농도는 2.7 G / L 있어야합니다.
주의 : 흄 후드에서이 솔루션을 준비합니다. 이 솔루션의 준비를 위해 니트릴 장갑과 고글을 착용 할 것. 계정으로도 3에 도시되어있는 휘발성 지방산의 황산 반응의 화학량 걸릴. - 반응기에 황산 이온 (SO 4 2-) 4,000 ㎎ / ℓ의 최종 농도를 제공하도록 적당한 농도의 황산나트륨의 스톡 용액 (SO 4 나 2)을 준비한다. 또한, 일 포함대신 최종 황산만큼 원액에서 추가의 기초 매체에 필요한 황산의 전자 금액 (SO 4 2-)의 농도는 권리입니다.
- 그들 반응기의 바닥에 도달 확인 기본 배지의 일부와 혼합 반응기에 퇴적물을 놓는다.
- 휘발성 지방산 용액 및 황산 용액과 혼합 기초 배지 및 버퍼 용액의 나머지를 추가한다. 휘발성 지방산의 솔루션은 액체에 주입되어 있는지 확인합니다. 참고 : 흄 후드에서이 단계를 실시한다.
- 재순환 펌프에 연결 및 반응기의 파이프 라인을 설정합니다. / 분에서 60 mL의 재순환 유량을 설정한다. 34 ° C의 온도 챔버에서 생물 반응기를 설정합니다. 정기적으로 온도 변화가 있는지 확인 작은 (즉, 34 ± 1.7 ℃로)
- 가스 변위 컬럼에 대한 연결을 설정합니다.
참고 : 단계 2.1-2.5 그림 4를 참조하십시오.
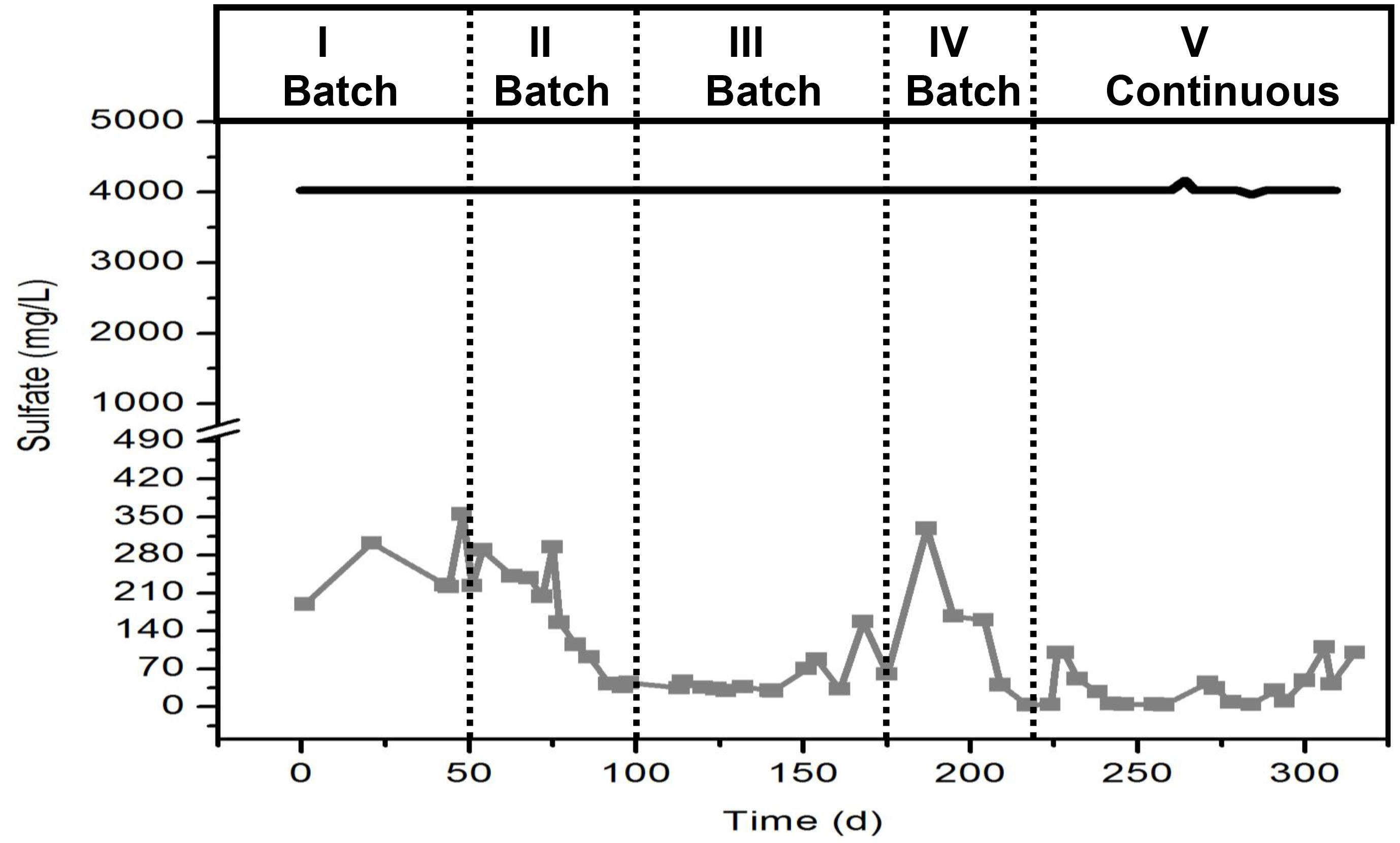
그림 VFA (아세테이트, 프로 피오 네이트 및 부티레이트)와 황산 감소 3. 화학 양론. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
그림 4. UASB 반응기. (A) 초기 시간. (B) 연속 정권 운전 300 일 후. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.원자로 3. 작동은 미생물의 Sulfidogenesis과 성장을 촉진
참고 : 접종이 V를 소비하는 허용지방산 및 황산 olatile. 이를 위해, 설페이트, 설파이드 및 COD 소비 제 분석을 수행하기 일주일 동안 기다린다.
- 인큐베이션 일주일 COD에 대한 분석을 수행하도록 액체 5~7 ㎖가 샘플을 채취 한 후, 황산과 황화물 함량과 pH를, 13은 표준 방법에 따라 11.
- 메틸렌 블루 (13)는 다음의 방법으로 (670 nm의 파장 (λ)에서) 액체의 분광 분석 설파이드.
- , 25 mL의 메스 플라스크에 (w / w 2 %) 아세트산 아연 용액 5 ㎖를 배치 아세트산 아연 용액에 시료 신속 200 μL를 추가한다.
- N, N - 디메틸 피의 -phenylenediamine 옥살 레이트 2.5를 가하여 (DMP) 용액 (0.2 % w / w 20 % SO H 2 4) 및 철 / w (III), 황산 암모늄 용액 (10 %, 125 μL 2 %의 H 2 SO 4), 메스 플라스크에 25 ㎖의 증류수에 완전히 w. 반응에 30 분을 기다립니다푸른 색이 안정화되는 시간입니다. (13)이 발생합니다.
참고 : 적어도 15 분을 기다립니다,하지만 더 60 분 이상은 분광 광도계의 샘플을 테스트합니다. 분광 광도계의 푸른 최종 솔루션의 판독을 실시한다.
- 표준 방법 (11)에 따라 황산을 분석합니다. 여기서, 혼탁도 방법을 사용하여, 황산 바륨 등의 황산염을 정량화.
- 컨디셔닝 용액 5 ㎖를 배치 (염산은 염산 1 : 1) 25 ㎖의 메스 플라스크에, 이전에 원심 분리 한 시료 1 ㎖ (11,320 × g에서), 증류수로 메스 플라스크의 25 mL의 완성 및 염화 바륨의 1g을 추가합니다.
- 소용돌이 1 분을위한 솔루션을 섞는다. 형성과 420 나노 미터 (11)의 파장 (λ)의 분광 광도계에서 샘플을 읽을 수있는 황산 바륨 4 분 동안 기다립니다.
- 표준 방법 (11)에 따라 COD를 분석합니다. 대안 적으로, COD determina를 사용기 키트.
- COD 결정하기 전에, 결정에 방해가 될 수 나머지 황화물을 제거하기 위해 (11,320 XG에서) 철저하게 샘플을 원심 분리기. 필요한 경우 회 원심 : 처음 즉시 시료와 두번째 복용 후 6 또는 8 시간 기다렸다가 COD 분석을 수행.
- , COD 판정 키트의 반응 바이알에 2 ㎖의 샘플을 추가 바이알을 밀봉하고 교반과 혼합하여 균질화. 다른 반응 바이알에 증류수 2 ㎖를 첨가하여 빈을 제조하고, 혼합물을 균질화시킨다.
- 2 시간 동안 150 ° C에서 소화 반응기에서 튜브를 놓습니다. 튜브를 제거하고 어둠 속에서 냉각 할 수 있습니다. 620 nm의 파장에서 분광 광도계에서 유리 병의 측정 값을 가져 가라.
- 가스 변위 열에서 가스 부피를 얻습니다.
- 메틸렌 블루 (13)는 다음의 방법으로 (670 nm의 파장 (λ)에서) 액체의 분광 분석 설파이드.
- 황산 소비 다른 5-7일까지 때까지 기다립니다. 황산 COD는 소비해야pproximately 전의 85 % 내지 90 %의 새로운 회분식이 개시된다.
- 황산 (및 COD)이 소비되면, 완전히 단계를 반복 2.4. 각 배치에 대한 새로운 매체와 새로운 영양소를 공급한다.
- 반복 3.1 및 3.2 단계를 반복합니다. 이 시점에서 각 배치는 7 10 일 사이에 지속되어야한다.
- 3-4 배치가 완료되면, 단계 2.4를 반복하지만 4g / L로 COD 농도를 증가시킨다.
- 단계를 반복 3.1 단계 3.2.
- 단계를 반복 3.3하지만 6g / L로 COD 농도를 증가시킨다.
- 이 10g / L가 될 때까지 점진적으로 COD 농도를 증가 3.6과 3.6.1를 반복합니다.
참고 : 시간 (D) 대 황산 농도 (㎎ / ℓ)를 제시 그래프를 확인합니다.
- 황산 소비 미만 24 시간에서 80 % 이상이며, 이는 일주일 이상이 발생하면, 연속 식 반응기의 작동을 전환. 연속 모드에 대해 24 시간에서 유압 체류 시간 (HRT)을 설정 및 4g의 / L의 COD와 황산의 농도를 유지10g / L에서.
주 : 시간이 지남에 따라 황산 소비해야한다 빨리.
4. 황산염 활동 테스트 감소
- 이 테스트에 앞서 지속적인 정권에서 생물 반응기가 남아있는 황산 농도 10 % 미만의 변화를 제시해야합니다.
- 주어진 일에, 하나 HRT주기 및 실시 단계 2.4 이후 원자로를 중지합니다. 단계 2.4.3의 경우 10g / L의 COD 농도를 사용합니다.
- 생물 반응기가 공급되면, 액체의 5-7 ml의 샘플을 가지고 COD, 황산염, 황화물 (3.1 단계) 및 pH를 모든 시간 동안 분석을 수행합니다. 생산 된 가스의 부피를 기록한다.
- 문학 (14)에 따라 활동을 감소 황산을 계산합니다.

SRA = 황산 활동을 감소 (mg의 COD-H 2 S) / gVSS * D
M의 H 2 S = 황화물 농도 밀리그램 COD-H 2 S로 표현
VSS = 휘발성 부유 물질 농도
T = 시간 (d 또는 시간)
- ㎎ / ℓ에서 시간이 지남에 황화물의 농도에 비해 황산 소비의 비율을 보여 해당 그래프를 확인합니다. 시간이 지남에 따라 COD 소비의 비율을 보여주는 그래프를 확인합니다. 시간이 지남에 따라 pH가 변화를 보여주는 그래프를 확인합니다.
5. 트리클로로 에틸렌 (TCE) 감소 테스트
- 이 테스트에 앞서 생물 반응기는 연속 정권에서 작업하고 나머지 황산 농도 10 % 미만의 변화를 제시되어 있는지 확인합니다. 생물 반응기에서 황산 감소가 90 % 미만인 경우이 테스트를 시작하지 마십시오.
- 생물 반응기의 액상이 화합물의 최종 농도가 300 μM이어야 고려 트리클로의 스톡 용액 (TCE)을 준비한다. partitioni을 고려34 ° C에 대한 TCE Henry's 법 차원 상수 (H')를 사용하여 헤드 스페이스에 화합물 NG. TCE에 대한 H'at 34 ° C는 0.4722이다.
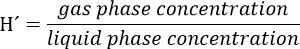
주의 : fumehood에이 솔루션을 준비하고 장갑과 고글을 착용하십시오.- 예를 들어, 5,000 μm의 주식 솔루션에 대해 다음과 같이 계산한다 :
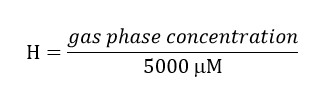
TCE 기상 농도 = (0.4722) * (5000) = 2,139 μM. TCE의 양이 헤드 스페이스로되기 때문에 원액의 제조에서 이러한 농도를 포함한다.
이어서 원액의 액체 (물)에서, 실제의 TCE 농도가 될 것이다 : 5000 + 2139 = 7139 μM. TCE 밀도 = 1.43 g / ㎖. mg의 7139 μM 변환하고 TCE의 밀도를 이용하여 콘텐츠에 대한 TCE 용액의 부피를 계산.
참고 : TCE 원액 (M)의 농도를바깥보다 낮은 5,000 μM, 즉, 3,000 또는 1,000 μm의 일이이 솔루션의 많은 볼륨의 액상 부피에 따라 생물 반응기에 전달 될 수있다 방법에 따라 달라집니다.
- 예를 들어, 5,000 μm의 주식 솔루션에 대해 다음과 같이 계산한다 :
- , TCE에 대한 가스 크로마토 그램의 표준 곡선을 제조 -1,2- 디클로로 에틸렌, 트랜스 -1,2- 디클로로 에틸렌, 비닐 클로라이드 및 에텐 CIS. TCE 원액 5.2에서 설명 된 것과 동일한 절차를 수행하여, 시스에게 이들 화합물의 스톡 용액으로부터 -1,2- 디클로로 에틸렌 및 트랜스 -1,2- 디클로로 에틸렌 표준 곡선을 준비한다. 표준 (가스통)에서 각 가스의 농도를 희석시켜, 염화 비닐과 에텐의 표준 곡선을 준비한다.
- 20~300 μM의 범위에서 이들 화합물의 표준 곡선을 준비한다. 게레로 - 바라하스 등에 의해보고 된 방법을 사용합니다. (2011) 가스 크로마토 그래프에서 이러한 화합물의 분석 (15).
주의 :이 서 준비ARD fumehood의 솔루션과 장갑과 고글을 착용하십시오.
- 20~300 μM의 범위에서 이들 화합물의 표준 곡선을 준비한다. 게레로 - 바라하스 등에 의해보고 된 방법을 사용합니다. (2011) 가스 크로마토 그래프에서 이러한 화합물의 분석 (15).
- 주어진 일에, 하나 HRT주기 및 실시 단계 2.4 이후 원자로를 중지합니다. 단계 2.4.3의 경우 10g / L의 COD 농도를 사용합니다.
- 생물 반응기가 공급되면 5.2으로 제조 원액에서 생물 반응기에 액체를 직접 TCE 추가 생물 반응기의 액상 TCE 최종 농도가 300 μM이어야한다. 12 시간에 HRT를 설정합니다.
- 한 HRT주기의 끝에서 대구, 황산 황화물의 액체 (500 ~ 1,000 μL) 및 행동 분석의 샘플을 채취 (3.1.1, 3.1.2과 3.1.3 단계). 헤드 스페이스 (100 μL 250)의 샘플을 채취하여 가스 크로마토 그래프에 -1,2- 디클로로 에틸렌, 트랜스 -1,2- 디클로로 에틸렌, 염화 비닐 및 에텐 시스, TCE에 대한 분석을 실시하고 있습니다.
- 단계를 반복 2.4. 단계 2.4.3의 경우 10g / L의 COD 농도를 사용합니다.
- 생물 반응기 9 위에 표시 될 때까지 TCE 감소 테스트를 반복하지 마십시오바이오 리액터에 잔류 0 % 황산 환원 및 10 % 이하의 변화 모두, 황산 및 황산 환원.
- 5.4, 5.5 및 5.6 두 개 또는 세 번 이상 반복합니다.
- 다만 TCE 환원 테스트가 완료되면, 미생물의 식별을 수행하는 퇴적물 샘플 (0.5 g)을 타고. 2 또는 3 TCE 감소 테스트 후이 작업을 수행합니다.
TCE 감소 실험 후 활동 테스트를 감소 6. 황산
- 4 단계를 반복 완전히.
7. 미생물 식별
- 약 0.5g을 각각의 슬러지의 샘플을 가지고 표준 방법 (12)에 따라 RNA 총 추출한다.
- (RT-PCR) 증폭 한 단계 12 중합 효소 연쇄 반응을 역전사 16S rRNA 유전자를 증폭 및 행동.
- 증폭 또는 초기 접근 방식으로 문학 (11)에서 제안하는 사람을 사용하는 프라이머를 디자인합니다. 충전 앰프를 따라확인해 주시죠 절차는 문학 (12)에 제안했다.
- 16S rRNA의 라이브러리를 구축합니다. PCR 증폭 산물을 클로닝 키트 (11)를 이용하여 복제 될 수있다. 일반적으로, 각 플레이트 (한 PCR 산물을 대표하는 각 식민지)에서 10 콜로니를 복제 할 수 있습니다. 문헌 12에 제안 된 방법에 따라 서열 분석을위한 플라스미드 DNA를 준비한다.
- 조각의 염기 서열을 실시한다. 문헌 12에 제안 된 방법에 따라 전술 한 PCR 증폭 용 프로토콜 (단계 7.4), 클론과 PCR 외부 제품의 약 1,400 bp의 재 증폭. E.에서 재조합 플라스미드를 분리 같은 대장균 식민지 문학 (12)에 제안했다. M13 보편적 인 프라이머 (12)와 염기 서열에 대한 부분적인 절차를 수행 마십시오.
- 서열 분석을 실시한다. 그 Clustal X를 사용하여 염기 서열을 맞추고 수동으로 텍스트 편집기에서 조정한다. NCBI에 databas의 BLAST 검색을 수행전자. (http://www.ncbi.nlm.nih.gov/BLAST/Blast.cgi) 12.
- 염기 서열의 가입 번호를 얻습니다. 해당 기탁 번호 (즉, 증폭 JQ713915eJQ713925 시퀀스에서) 12 하에서 EMBL 뉴클레오티드 서열 데이터베이스 (젠 뱅크 / EMBL / DDBJ)에서 식별 된 클론의 염기 서열을 침착.
결과
생물 반응기에서 황산 환원 전형적인 동작은도 5에 도시되어있다. 이것은 동작 황산 환원 첫 주 동안 느린 것이라고 통지하는 것이 중요하다. 그러나 천천히, 시간이 지남에 황산 90 %의 소비는 접종이 황산염 환원 박테리아 풍부한 따라서 황산을 감소시킬 수있는 미생물 지역 사회를 개발하고 있음을 나타냅니다. 도면에서 다른 기간에는 황산 환원 시간이 지남에 그 속도를 증가되었?...
토론
환경 생명 공학 sulfidogenesis의 여러 응용 프로그램, 박테리아를 발효하는 폐수 처리에와 컨소시엄에서 황산염 환원 박테리아의 대사 중 가장 많이 사용되는 응용 프로그램 중 하나가 있습니다. UASB 반응기는 높은 황산 농도와 산업 폐수 처리의 주요 설계 방식 중입니다. 본 연구에서 우리는 UASB 반응기에서 해양 침전물로부터 sulfidogenic 슬러지를 얻는 프로토콜을 제시한다. 해양 침전물로부터 sulfido...
공개
The authors Selene Montserrat García-Solares, Claudio Garibay-Orijel and Claudia Guerrero Barajas submitted (as inventors) in 2012 the application to obtain a patent entitled: “Process for the anaerobic treatment of industrial wastewater with high content of sulfate and chlorinated compounds”. This submission has been approved to the stage of the formatting. The submission has Instituto Politécnico Nacional as the rights owner.
감사의 말
The authors are grateful for the financial support provided by Instituto Politécnico Nacional grants 20120110, 20130399 and 20140239 SIP and also by Instituto de Ciencia y Tecnología del Distrito Federal Mexico (PICS 08-79, ICYT-DF, 2009-2012). Thanks also to CONACYT – Mexico for the graduate scholarship (225806) awarded to Selene Montserrat García-Solares and for the financial support provided by grant 82627.
자료
| Name | Company | Catalog Number | Comments |
| trichloroethylene | sigma Aldrich | 251402 | |
| cis-1,2-dichlorotehylene | sigma Aldrich | ||
| trans-1,2-dichloroethylene | sigma Aldrich | D-62209 | |
| vinyl chloride scotty standard | supelco | 1,000 ppm v/v in nitrogen | |
| ethene scotty standard | supelco | 99% purity | |
| pump | Masterflex | Model 7553-75 | |
| spectrophotometer | any | ||
| microcentrifuge | any | ||
| gas tight syringes | any | 100 and 200 microliters | |
| UASB glass reactor | any | under design | |
| gas chromatograph | any | FID detector | |
| capillary column SPB-624 | supelco | ||
| pH meter | any | ||
| viton tubing | Masterflex | ||
| basal medium reagents | any | ||
| trace metals reagents | any | ||
| vitamins solution reagents | any | ||
| sodium sulfate | any | ||
| volatile fatty acids | any | ||
| COD determination kit | HACH | range 0-15,000 mg/L | |
| TOPO-TA cloning kit pCR®4.0 | Invitrogen, US | ||
| S.N.A.P. TM Miniprep Kit | Invitrogen, UK | ||
| Pure link TM Quick Plasmid Miniprep kit | Invitrogen |
참고문헌
- Lens, P., Esposito, M. V. G., Zandvoort, M. Perspectives of sulfate reducing bioreactors in environmental biotechnology. ReViews Environmental Science and Biotechnology. 1 (4), 311-325 (2002).
- Omil, F., Lens, P., Hulshoff, P., Lettinga, G. Characterization of biomass from a sulfidogenic, volatile fatty acid-degrading granular sludge reactor. Enzyme and MicrobialTechnology. 20, 229-236 (1997).
- Lopes, S. I. C., Wang, X., Capela, M. I., Lens, P. N. L. Sulfate reduction during the acidification of sucrose at pH 5 under thermophilic (55 °C) conditions.II: Effect of sulfide and COD/SO4-2 ratio. Bioresource Technology. 101, 4278-4284 (2010).
- Alfonso, P., Prol-Ledesma, R. M., Canet, C., Melgarejo, J. C., Fallick, A. E. Sulfur isotope geochemistry of the submarine hydrothermal coastal vents of Punta Mita, Mexico. Journal of Geochemical Exploration. 78-79, 301-304 (2003).
- Valdemarsen, T., Kristensen, E. Degradation of dissolved organic monomers and short chain fatty acids in sandy marine sediment by fermentation and sulfate reduction. Geochimica et Cosmochimica Acta. 74, 1593-1605 (2010).
- Quistad, S. D., Valentine, D. L. Anaerobic propane oxidation in marine hydrocarbon seep sediments. Geochimica et Cosmochimica Acta. 75, 2159-2169 (2011).
- Futagami, T., Morono, Y., Terada, T., Kaksonen, A. H., Inagaki, F. Dehalogenation activities and distribution of reductive dehalogenase homologous genes in marine subsurface sediments. Applied and Environmental Microbiology. 75 (21), 6905-6909 (2009).
- U.S. Environmental Protection Agency. List of priority pollutants. Clean Water Methods. , (2014).
- Ozdemir, C., Dursun, S., Karatas, M., Sen, N., Sahinkaya, S. Removal of trichloroethylene (TCE) in upFlow anaerobic sludge blanket reactors (UASB). Biotechnology and Biotechnological Equipment. 21 (1), 107-112 (2007).
- Zhang, Y., Wang, X., Hu, M., Li, P. Effect of hydraulic retention time (HRT) on the biodegradation of trichloroethylene wastewater and anaerobic bacterial community in the UASB reactor. Applied Microbiology and Biotechnology. 99, 1977-1987 (2015).
- . . Standard Methods for the Examination of Water and Wastewater. , (1998).
- Guerrero-Barajas, C., et al. Enhanced sulfate reduction and trichloroethylene (TCE) biodegradation in a UASB reactor operated with sludge developed from hydrothermal vents sediments: process and microbial ecology. International Biodeterioration and Biodegradation. 94, 182-191 (2014).
- Trüper, H. G., Schlegel, H. G. Sulphur metabolism in Thiorhodaceae I. Quantitative measurements on growing cells of Chromatium okenii. Antoine van Leeuwenhoek. 30, 225-238 (1964).
- Gallegos-García, M. G. . Biological processes of sulfate reduction in biofilms for metals precipitation [Ph D thesis]. , (2009).
- Guerrero-Barajas, C., Garibay-Orijel, C., Rosas-Rocha, L. E. Sulfate reduction and trichloroethylene biodegradation by a marine microbial community from hydrothermal vents sediments. International Biodeterioration and Biodegradation. 65, 116-123 (2011).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유