JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
흐름 유도 된 폐동맥 고혈압에 대한 쥐 모델에서 션트 수술, 오른쪽 심장 도관 및 혈관 형태 계측
요약
This protocol describes a surgical procedure to create a model for flow-induced pulmonary arterial hypertension (PAH) in rats and the procedures to analyze the principle hemodynamic and histological end-points in this model.
초록
In this protocol, PAH is induced by combining a 60 mg/kg monocrotalin (MCT) injection with increased pulmonary blood flow through an aorto-caval shunt (MCT+Flow). The shunt is created by inserting an 18-G needle from the abdominal aorta into the adjacent caval vein. Increased pulmonary flow has been demonstrated as an essential trigger for a severe form of PAH with distinct phases of disease progression, characterized by early medial hypertrophy followed by neointimal lesions and the progressive occlusion of the small pulmonary vessels. To measure the right heart and pulmonary hemodynamics in this model, right heart catheterization is performed by inserting a rigid cannula containing a flexible ball-tip catheter via the right jugular vein into the right ventricle. The catheter is then advanced into the main and the more distal pulmonary arteries. The histopathology of the pulmonary vasculature is assessed qualitatively, by scoring the pre- and intra-acinar vessels on the degree of muscularization and the presence of a neointima, and quantitatively, by measuring the wall thickness, the wall-lumen ratios, and the occlusion score.
서문
이 방법의 목적은 래트에서 심한 흐름 유도 폐동맥 고혈압 재현 모델을 작성하고 그 원리 혈역학 적 및 조직 병리학 종료점을 측정하는 방법이다.
폐동맥 고혈압 (PAH)는 우심실 실패와 죽음으로 이어지는 폐 혈관 저항의 점진적 증가를 포괄하는 임상 증후군이다. 폐 고혈압 질환 (PH)의 상위 질병 스펙트럼 내에서 PAH는 치료 1 않고 남아있는 가장 심각한 형태입니다. PAH의 기본 arteriopathy은 혈관 내강을 폐색 혈관 재 형성의 전형적인 양식을 특징으로한다. 정상이 아닌 muscularized 선박과 내측 용기 층의 비대의 Muscularization가 PAH 초기 질병 현상으로 간주되며, 또한 PH 2의 다른 형태로 볼 수 있으며, 3 가역 것으로 생각된다. PAH A와dvances, 내막 층은 결국 특성 신생 내막 병변 (2)을 형성, 개조하기 시작합니다. 신생 내막 형 폐 혈관 리모델링은 PAH에 배타적이며, 현재 4 돌이킬 수없는 것으로 간주된다.
PAH는 드문 질환으로 그 병인 학적 이해의 발전과 새로운 치료법의 개발은 동물 모델에 크게 의존하고있다. 쥐의 monocrotalin (MCT) 모델이있다 간단한 하나의 히트 모델이며, 여전히 자주 사용됩니다. MCT는 폐 세동맥과 지역 염증 5 부상을 유발하는 독소이다. / kg의 MCT 60 mg의 평균 폐동맥압 (mPAP), 폐 혈관 저항 (PVR)의 증가를 초래하고, (3) 후 우측 심실 비대 (RVH) - 4 6 주. histomorphology는 신생 내막 병변 (5)없이 고립 된 내측 비대 특징으로한다. 건교부그것은 일반적으로 후자로 제시되지만 쥐 모델에 따라서, 적당한 PH의 형태로, 그리고 PAH를 나타낸다.
선천성 좌우 션트 (PAH-CHD)과 연관된 PAH 소아에서 폐 혈류가 내막 병변 7, 8, 9의 발전을위한 핵심 트리거로 간주 증가. 래트에서 증가 된 폐 혈류가 복부 대동맥과 대정맥, 제 10 1990에 기재된 방법들 사이의 단락의 생성에 의해 유도 될 수있다. 증가 된 폐 흐름을 만들 수있는 대안은 일방적 인 전폐 절제술이나 폐 동맥 문합 (11)에 쇄골에 의해입니다. 이러한 모델의 단점은 개념적 또는 의한 폐 맥관계의 인성 부상 절제술에 의해 유도 된 잔여 폐 적응 통로 활성화의 잠재적 보상 성장 이루어져폐 동맥 문합을 모두 증가 폐 혈류의 영향을 교란.
대동맥 대정맥 션트 만들고 MCT 투여군에서 초 히트로 유도되는 폐 혈류가 증가 될 때, 특성 내막 병변이 발생하고, 증가 된 후 PAH의 심각한 형태와 관련된 우심실 실패 (RVF)는 3주 개발 12 흐른다. 이 모델에서 PAH의 혈역학 적 진행은 심 초음파 및 오른쪽 심장 카테터에 의해 생체 내에서 평가 될 수있다. 우심실 실패의 혈관 histomorphology, 혈관 벽의 두께, 동맥 폐색의 정도 및 매개 변수는 PAH의 생체 특성의 기둥을 형성한다.
이 방법은 대동맥 - 대정맥 션트 (AC-션트) 수술에 대한 자세한 프로토콜, 우측 심장 카테터, 혈관 histomorphology의 정성 및 정량 평가에 대해 설명합니다.
프로토콜
동물 주제와 관련된 절차는 동물 실험에 대한 네덜란드 중앙위원회와 대학 의료 센터 흐로 닝언에서 동물 관리위원회 (NL)에 의해 승인되었습니다. 180 300g 사이의 무게 모두의 Wistar 루이스 래트를 사용 하였다.
1. 주택과 순응
- 케이지 당 5 그룹의 중앙 동물 시설, 집 쥐에 도착 후. 7 일간의 적응 기간 동안 인간 취급 쥐를 익숙하지만, 모든 실험 절차를 수행하지 않는다.
2. 준비 및 멸균 Monocrotalin 사출
- 60 ㎎ / ㎖의 monocrotalin (MCT) 용액 1 ㎖를 들어, 2-㎖의 튜브에 monocrotalin 60 mg의 무게. 0.9 % NaCl을 700 μL를 추가합니다. 1 M 염산 200 μL를 추가합니다. 뜨거운 실행 수돗물과 소용돌이 그 아래 튜브에서 솔루션을 따뜻하게. 7.0으로 pH를 가지고 6 N의 NaOH를 사용합니다. 설치류에 주입을위한 MCT의 준비를 위해 무균 기술을 사용합니다.
- (300 g 쥐는 60 ㎎ / ㎖ MCT 0.3 ㎖) 목 kg 피하 당 멸균 60 ㎎ / ㎖가 MCT 용액 1 ㎖을 주입한다. 참고 : 우리는 인해 주사 투여가 적절하지 않을 것이라는 큰 기회로 작은 볼륨을 사용 안함.
3. 대동맥 - 대정맥 션트 수술
- 마취.
- (흐름 : / 분 1 L) 5 % 이소 플루 란 / 100 % O 2 유도 챔버를 입력하고 챔버에서 쥐를 놓습니다. 뒷 발가락 핀치를 수행하여 마취의 적절한 깊이를 확인합니다. 쥐의 무게를.
- 면도 약 8cm 길이 3cm 넓은 지역에 걸쳐 복부를 청소하십시오. 멸균 매트에 의해 덮여 열 매트 (37 ° C)에 그 뒷면에있는 쥐를 놓습니다.
- 3 % 이소 플루 란 / 100 % O 2 (: / 분 1 L 흐름) - 2 환기 마스크 / 후드에서 주둥이를 놓습니다. 뒷 발가락 핀치를 수행하여 마취의 깊이를 확인합니다. 마취 동안 건조를 방지하기 위해 눈 연고를 적용합니다.
- 션트 수르GERY.
- 소독 용 염화 hexidine로 피부를 문질러. kg 프레 노르 핀 피하 수술 후 통증에 대한 0.01 mg의 / 주입한다.
- 수술 멸균 악기를 사용합니다. 바로 성기 위 아래로 연장 격막 아래에 1cm를 시작, 중간 선에 복부에서 # 10 메스 블레이드와 절개를합니다.
- 멸균, 젖은 거즈 (0.9 % 염화나트륨)의 장을 포함, 면봉으로 장을 들어 올리고 동물의 왼쪽에 놓습니다.
- 복부 대동맥 및 주변 조직에 열등한 대정맥을 첨부 멤브레인을 분리하기 위해 면봉을 사용합니다.
참고 : 대동맥과 대정맥 사이의 세포막을 해부하지 마십시오. - 가시 집게를 사용하여 만 대동맥의 오른쪽에 만 바늘이 삽입되는 사이트에 바로 분기점 위의 혈관 주위 대동맥의 지방을 제거합니다.
- 2mm의 공중으로부터 대동맥과 대정맥을 분리하기 위해 면봉을 사용하여바늘이 Biemer 클램프를위한 공간을 만들기 위해 삽입되는 위치에 대한 뛰어난.
- 이 지역에서 먼저 대동맥 주위 느슨한 합자 (5-0 봉합사)를 배치합니다. 절개 (그림 1A)에 KOCHER 우수한 배치 한 다음에 KOCHER 클램프를 배치하여 합자에 긴장을 만들고. Biemer이 합자 (Figur 전자의 1A)에 불과 우수한 고정 배치합니다.
- 면봉을 사용하여, 플로우 (도 1a)을 방해하기 위해 원심 가능한 대정맥 압축. 벤드 외부 (그림 1A)을 향해 구멍을 가리키는 45도 각도로 바늘 (이 프로토콜에서 18 G).
- 90 도의 각도로 왼쪽 (도 1a)에 바늘 포인팅의 오리피스 바로 분기 위에 대동맥에서 바늘을 삽입한다. 왼쪽에있는 바늘의 끝을 조작하고 대정맥에 삽입합니다.
참고 : 바늘 끝이 지금해야 VISI대정맥 (그림 1B)에 BLE. - 혈전증을 방지하기 위해 삽입 부위에서 대동맥의 나머지 혈액을 밀어 제 면봉을 사용한다. 접착제가 충분히 충실하기 위해서는 멸균 거즈와 션트 주위를 닦아냅니다.
- 대동맥에서 전체 바늘을 당겨 즉시 대동맥의 천자 사이트에 조직 접착제 한 방울을 적용합니다. 조직에 면봉을 접착제하지 않도록합니다. 대동맥을 언 클램프.
- 에 당기고 션트에 대동맥 근위부의 합자를 해제하여 수동으로 션트를 확인합니다. 해리는 밝은 빨간색 션트에 대정맥의 말단 색상 및 션트 사이트에서 난류를 생성해야합니다.
참고 : 조임 다시 어두운 빨간색으로 대정맥의 혈액을 켜집니다. - 다시 동물의 창자를 놓습니다. 흡수성 4-0 봉합과 근육 층과 피부를 닫습니다. 마취에서 회복하기 위해 100 % O 2 동물을 환기.
참고 : 애니를 두지 마십시오이 흉골 드러 누움을 유지하기 위해 충분한 의식을 회복 할 때까지 말은 무인.
- 위장 수술.
- 대동맥 내로 바늘의 삽입을 제외한 상기 모든 절차를 수행한다.
- 수술 후 관리.
- 단일 케이지와 다음날 아침까지 37 ° C에서 인큐베이터에 쥐를 놓습니다.
- 수술 후 6 시간의 주위에, 수술 후 통증에 대해 kg 프레 노르 핀 피하 / 0.01 mg의 주입. 쥐가 불편의 흔적을 보여줍니다 경우 다음 날 아침을 반복합니다.
참고 : 수술 후 첫 3 일, 쥐 (우 또는 마시는 물이 약물과 혼합 할 때이 특히 중요합니다) 먹고 적게 마시는 경향이있다. 대부분의 쥐 3 일 수술 후 정상적인 동작을 보여줍니다. 그렇지 않은 경우, 긴밀하게 모니터링 할 수 있습니다. 일주 15 %를 초과하는 체중 감소, 비정상적인 것으로 간주되고, 이러한 래트 마취 동안 순환 혈액량의 추출에 의해 안락사한다.
4. PAH의 개발
주 :이 프로토콜에서, 동물은 마취 동안 순환 혈액량의 추출에 의해 안락사된다.
- 증가 폐 혈액의 흐름에 초기 세포 및 기능 반응 (예, 유전자 업 규정 또는 초기 전사 인자)에 대한 수술 (MF8) 후 일일를 희생.
- 초기 단계 PAH의 혈관 표현형 (신생 내막 병변없이 중간 비대)에 대한 수술 (MF14) 후 일주를 희생.
- RVP와 mPAP에 가벼운 상승과 고급 단계 PAH의 혈관 표현형에 대한 수술 (MF21) (표시 내측 비대 및 신생 내막 형성) 후 2 주 희생.
- RVP와 mPAP의 최종 단계 PAH의 혈관 표현형 수술 (MF28) (표시 신생 내막 폐쇄) 강한 상승 이후 3 주 희생. 우심실 장애의 임상 증상이 단계에서 일반적이다.
- 28 일 (MF-RVF 후 희생) 임상 호흡 곤란, 심한 혼수, 체중 감소 (<일주 10 %)으로 정의 PAH 관련 우심실 실패 (RVF)합니다. 이러한 징후 중 하나가 존재할 때 래트 종료. 자주, 쥐 일 (28)과 35 사이의 이러한 증상을 개발, 부주의 한 방치하면,이 시간 간격 동안 자발적으로 사망한다.
5. 오른쪽 심장 도관
- 마취.
- (흐름 : / 분 1 L) 5 % 이소 플루 란 / 100 % O 2 유도 챔버를 입력하고 상자에 쥐를 놓습니다. 뒷 발가락 핀치를 수행하여 마취의 적절한 깊이를 확인합니다. 쥐의 무게를.
- 심 초음파 프로토콜, 흉부 및 상복부를 들어, 면도와 쥐의 오른쪽 복부 측면에 목을 청소하고.
- 열 매트 (37 ° C)에 그 뒷면에있는 쥐를 놓고 2 환기 마스크 / 후드에서 주둥이를 배치 - 3 % 이소 플루 란 / 100 % O 2 (흐름 : / 분 1 L). 주둥이는 연구원으로 직면해야한다.
- 마취의 깊이를 확인합니다. 심한 PH와 쥐에주의하십시오. 심박수가 감소하는 경우, 마취 깊이를 감소시킨다. 바람직하게, 20 분 이내에 모든 측정을 수행한다. 마취 동안 건조를 방지하기 위해 눈 연고를 적용합니다.
- 심 초음파 프로토콜입니다.
- 브리 등의 알에 의해 기술 된 프로토콜에 따라 심장 초음파 검사를 수행합니다. 주피터 십삼인치
- 도관 프로토콜입니다.
주 :이 프로토콜은 미리 형성된 팁 단단한 캐 뉼러 선단으로부터 볼 2mm로 15 cm 실리콘 카테터를 안내하는 20도 절곡 이용한다. 내부에 약간 구부러진의 오리피스와 20-G 바늘이 오른쪽 경정맥에 캐 뉼러를 삽입하는 데 사용됩니다 (물질의 목록 참조). PAH 진행 및 제어의 어떤 단계에서 래트 프로토콜이 사용될 수있다.- 염화 hexidine와 목을 소독. 오른쪽 복부 측면에서 # 10 메스 블레이드와 1.5 cm의 절개를합니다목의 오른쪽 쇄골에서 하악 뼈.
- 가위를 사용하여 조직을 확산. 경정맥이 나타날 때까지 핀셋을 사용하여 부드럽게 떨어져 조직을 당깁니다. 가시 집게를 사용하여 정 맥 경정맥 주위의 세포막을 해부하다.
- 선박 주위에 느슨한 합자 (5-0 봉합사)를 배치하여 경정맥에 긴장을 넣습니다. 긴장을 높이고 환기 마스크 (그림 2A)에 합자를 테이프.
- 삽입 부위의 하류에, 캐뉼라 누설 및 압력 손실을 방지하기 위해 제자리 후 조여 용기 주위 느슨한 결찰 장소.
- 겸자의 손잡이를 약간 카테터 캐뉼라를 수행하는 내부에 구멍이있는 20-G 바늘 끝을 구부리.
- 정맥 내로 20-G 바늘의 선단을 소개하고 신속하게 용기의 내부 도관을 포함하는 캐 뉼러를 배치했다. 바늘을 당긴 다음 합자을 닫습니다그 단계 5.3.4 제조 하였다.
- 경정맥에 카테터를 포함하는 캐 뉼러를 실시한다. 정맥의 끝은 20도 곡선에있다 (단계 5.3.5 참조). 쇄골 아래 정맥을 기동과 우심방 (그림 2C)을 입력 조금 진행합니다.
- 우심실을 입력하려면, 마음 (그림 2D)으로 왼쪽에있는 정맥의 끝을 가리 킵니다. 침대 옆 모니터에서 캠핑카 압력 곡선은 그림 2D를 일치 나타납니다.
- RV의 압력 커브가 일정 할 때, 수축기 및 확장기 우심실 압력 1을 기록 (sRVP1 / dRVP1).
- 왼쪽 및 위쪽에 캐뉼라의 선단을 조작. 캐 뉼러 (그림 2E) 내에서 카테터를 진행합니다.
- 주 폐동맥 (PA)에 카테터를 진행합니다. 폐 밸브를 통과 할 때 어떤 저항을 느끼지해야합니다.
주 : 카테터 주요 폐동맥을 입력하면 D를iastolic 압력이 상승 할 것이다. 침대 옆 모니터에, PA 압력 곡선은 그림 2E를 일치 나타납니다. - 펜실바니아 압력 커브가 일정 할 때, 수축기, 이완기를 기록하고, PA 압력 1 (sPAP1, dPAP1, mPAP1)을 의미한다.
- 카테터의 끝에서 볼이 폐 동맥 쐐기 도착 때까지 또한 정맥 내 카테터를 진행합니다. 침대 옆 모니터 드롭 압력 곡선을 관찰하고 그림 2 층에 쐐기 압력 곡선을 일치합니다.
- 웨지 압력 곡선이 일정 할 때, 수축기, 확장기를 적어 쐐기 압력을 의미한다.
- 천천히 그리고 이후에 카테터를 뒤로 당겨 측정하고 침대 옆 모니터에 표시되는, sPAP2, dPAP2, mPAP2, sRVP2 및 dRVP2에 대한 값을 적어 둡니다.
- RV를에 약간 측정하는 정맥 및 카테터를 철수 할 때 오른쪽 심방 압력 (RAP)을 의미한다. 곡선은 그림 2A의 RAP 곡선과 일치해야합니다.
아니TE :이 프로토콜에서, 래트를 마취 동안 순환 혈액량의 추출에 의해 카테터 프로토콜 후에 안락사시켰다.
6. 형태학 평가 및 형태 계측
주 :이 프로토콜에서, 동물은 마취 동안 순환 혈액량의 추출에 의해 안락사된다. PAH 진행 및 제어의 어떤 단계에서 래트 프로토콜이 사용될 수있다.
- 희생 후, 5 기관지 분기 위의 mm와 심장에 폐를 연결하는 선박에 대한 기관을 절단하여 폐를 꺼내. 차가운 식염수에 폐를 넣습니다. 왼쪽 폐를 해부하다. 분기점에서 좌측 주기관지를 잘라.
- 4 % 파라 포름 알데히드로 50 ML의 주사기를 채우기 주사기로 정맥에 튜브를 연결하고, 작업 테이블 위에 미터에 대해 주사기를 끊습니다. 수동적으로 파라 포름 알데히드와 폐를 채우기 위해 좌측 주기관지의 캐 뉼러를 장착한다.주의 파라 포름 알데히드를 처리합니다.
- 48 시간 동안 파라 포름 알데히드의 왼쪽 폐를 품어.
- (70 % 에탄올 (1 시간) 80 % 에탄올 (1 시간) 90 % 에탄올 (1 시간), 100 % 에탄올 (3 H), 크 실롤 (2H), 파라핀에 연속적으로 배양하여 왼쪽 폐 탈수 2 H).
- 카세트 대향 폐의 폐문에 파라핀 왼쪽 폐를 포함.
- 제조업체의 지침 29 당 등의 Verhoeff 또는 엘라 밴 Gieson 염색을 이용하여 파라핀 포함, 4 μm의 폐 섹션을 얼룩. 확인 탄성 라미 잘 (그림 3과) 차별화된다. 40X 배율로 스테인드 섹션을 검색합니다.
- 4 사분면으로 폐를 나눈다. 각 사분면에서 <외경 50㎛의 (인트라 선포) 10 용기> 외부 직경 10 μm의 용기 (50) (프리 선방)를 찾는. 사진 (폐 당 2 × 40 사진)를 가져 가라. 무작위로 모든 선박 20 배 배율과 사진까지 확대볼이 필드에 선택 바이어스를 최소화합니다.
- > (2)의 긴 / 짧은 직경의 비, 불완전한 원형 또는 혈관벽 이상의 분기 붕괴가 혈관을 제외.
참고 : 제외 된 선박의 예는 같은 배율 (40 배)에 각각의 사진을 확인하고 스케일 바 등 3b는 그림에 표시됩니다. - 오픈 ImageJ에 첫 번째 사진. "분석한다"를 통해 규모를 설정하는 그림과 스케일 바의 직선을 그립니다 와 "규모를 설정합니다." 내용은 "알려진 거리"그림의 스케일 바의 값을 사용합니다. 길이의 단위로 마이크로 미터 (μm의)를 사용합니다. 세계적으로 규모를 설정합니다.
- "자유 선택"을 사용하여 내강 영역 (그림 3)의 내부 경계에 선을 그립니다, 와 "측정"을 사용 (CRTL의 m)이 면적을 측정한다. 그런 다음, 외부 ELAST 주위에 선을 그립니다IC의 라미 나 (도 3)은 전체 용기 면적을 측정한다.
- (내강 외경을 계산
 )를 사용하여
)를 사용하여  .
. - 사용하여 두께를 계산
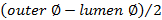 .
. - 사용 벽 / 루멘 비율을 계산
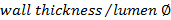 .
. - 사용 폐색 점수를 계산
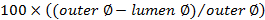 .
. - muscularization에 용기를 점수 (아니, 부분 또는 전체 muscularization) (그림 3B).
참고 : 완전히 muscularized로 절반 이상 원주에 대한 이중 탄성 얇은 판과 선박이 정의되어 있습니다. 부분적으로 muscularized로 이중 탄성 얇은 절반 이하 둘레 선박이 정의되어 있습니다. - neoi의 존재 용기 점수ntima 없습니다 (예 또는 아니오) (그림 3C).
참고 : (자주 편심) 내강 폐쇄와 함께 명확하게 정의 된 내부 탄성 얇은없이 선박은 신생 내막 병변으로 정의됩니다.
결과
대표 결과는 그림 4에 제시되어있다. 제어 (N = 3), MF8 (N = 5), MF14 (N = 5), MF28 (N = 5) 및 MF-RVF (: 제시된 결과는 MCT + 다음 그룹 루이스 래트에서의 흐름 특성을 보여 N = 10). 통계 분석은 본 페로 니 보정 된 일방 ANOVA를 사용하여 수행 하였다.
60 / kg의 MCT mg을하고 수축기 우심실 압력의 평균 상승 (sRVP) (23 ± 6 56 ± 11 mmHg로?...
토론
이 방법은 래트 원리 혈역학 및 PAH이 모델의 특징 병리학 끝점을 평가하는 유동 유발 PAH와 기술을 만들 MCT로 전처리에서 대동맥 대정맥 션트의 수술 과정을 설명한다.
프로토콜 및 문제 해결에서 중요한 단계
수술 및 수술 후. 대동맥 - 대정맥 션트 수술 중 가장 중요한 단계는 대동맥과 대정맥의 해부입니다. 대동맥과 대정맥이 충분히 해부한다 둘러싸는 ...
공개
The authors have nothing to disclose.
감사의 말
This study was supported by the Netherlands Cardiovascular Research Initiative, the Dutch Heart Foundation, the Dutch Federation of University Medical Centers, the Netherlands Organization for Health Research and Development, and the Royal Netherlands Academy of Sciences (CVON nr. 2012-08, PHAEDRA, The Sebald fund, Stichting Hartekind).
자료
| Name | Company | Catalog Number | Comments |
| Shunt Surgery | |||
| Sterile surgical gloves | |||
| Duratears Eye ointment | Alcon | 10380 | |
| Chloride-Hexidine | |||
| Cotton swabs | |||
| Histoacryllic tissue glue | B. Braun Medical | 1050052 | |
| Silkam 5-0 sutures black non-resorbable | B. Braun Medical | F1134027 | |
| Safil 4-0 sutures violet resorbable | B. Braun Medical | ||
| 18 G needle | Luer | NN1838R BD | tip bent in 45 degrees orifice to the outside |
| Gauzes 10 x 10 cm | Paul Hartmann | 407825 | |
| Temgesic Buprenorphine | RB Pharmaceuticals | 5429 | subcutaneous injection |
| Sodium Chloride 0.9% | |||
| Ventilation mask Rat | |||
| Scalple blade | |||
| Biemer clamp 18 mm, 5 mm opening | AgnTho | 64-562 | |
| Heat mat | |||
| Kocher Clamp | |||
| Shaving machine | |||
| Microscope | Leica | ||
| Right Heart Catheterization | |||
| Sterile surgical gloves | |||
| Eye ointment | Duratears | ||
| Chloride-Hexidine | |||
| Cotton swabs | |||
| Gauzes 10 x 10 cm | Paul Hartmann | 407825 | |
| Silkam 5-0 sutures black non-resorbable | B. Braun Medical | F1134027 | |
| Needle 20 G | Luer | Tip slightly bent to the inside | |
| Cannula 20 G | Luer | to introduce catheter, tip pre-formed in 20 degrees | |
| Silastic Catheter 15 cm long | 0.5 mm ball 2 mm from tip | ||
| Pressure transducer | Ailtech | ||
| Bedside monitor Cardiocap/5 | Datex-Ohmeda | ||
| Shaving machine | |||
| 10 mL Syringe | |||
| Sodium Chloride 0.9% | for flushing | ||
| Vascular Morphology | |||
| 50 mL Syringe | |||
| 4% Formaldehyde | |||
| 18 G cannula with tube | |||
| Verhoef staining kit | Sigma-Aldrich | HT254 | http://www.sigmaaldrich.com/catalog/product/sigma/ht254?lang=en®ion=US |
| Digital slide scanner | Hamamatsu | C9600 | |
| ImageJ | |||
| Elastic (Connective Tissue Stain) | Abcam | ab150667 | http://www.abcam.com/elastic-connective-tissue-stain-ab150667.html http://www.abcam.com/ps/products/150/ab150667/documents/ab150667-Elastic%20Stain%20Kit%20(website).pdf |
참고문헌
- Hoeper, M. M., Bogaard, H. J., Condliffe, R., et al. Definitions and diagnosis of pulmonary hypertension. J Am Coll Cardiol. 62, D42-D50 (2013).
- Stacher, E., Graham, B. B., Hunt, J. M., et al. Modern age pathology of pulmonary arterial hypertension. Am J Respir Crit Care Med. 186 (3), 261-272 (2012).
- Levy, M., Maurey, C., Celermajer, D. S., et al. Impaired apoptosis of pulmonary endothelial cells is associated with intimal proliferation and irreversibility of pulmonary hypertension in congenital heart disease. J Am Coll Cardiol. 49 (7), 803-810 (2007).
- Sakao, S., Tatsumi, K., Voelkel, N. F. Reversible or irreversible remodeling in pulmonary arterial hypertension. Am J Respir Cell Mol Biol. 43 (6), 629-634 (2010).
- Gomez-Arroyo, J. G., Farkas, L., Alhussaini, A. A., et al. The monocrotaline model of pulmonary hypertension in perspective. Am J Physiol Lung Cell Mol Physiol. 302 (4), L363-L369 (2012).
- Jones, J. E. Serial noninvasive assessment of progressive pulmonary hypertension in a rat model. Am J Physiol - Heart Circ Physiol. 283 (1), 364-371 (2002).
- Hoffman, J. I., Rudolph, A. M., Heymann, M. A. Pulmonary vascular disease with congenital heart lesions: Pathologic features and causes. Circulation. 64 (5), 873-877 (1981).
- van Albada, M. E., Berger, R. M. Pulmonary arterial hypertension in congenital cardiac disease--the need for refinement of the evian-venice classification. Cardiol Young. 18 (1), 10-17 (2008).
- Dickinson, M. G., Bartelds, B., Borgdorff, M. A., Berger, R. M. The role of disturbed blood flow in the development of pulmonary arterial hypertension: Lessons from preclinical animal models. Am J Physiol Lung Cell Mol Physiol. 305 (1), L1-L14 (2013).
- Garcia, R., Diebold, S. Simple, rapid, and effective method of producing aortocaval shunts in the rat. Cardiovasc Res. 24 (5), 430-432 (1990).
- Okada, K., Tanaka, Y., Bernstein, M., Zhang, W., Patterson, G. A., Botney, M. D. Pulmonary hemodynamics modify the rat pulmonary artery response to injury. A neointimal model of pulmonary hypertension. Am J Pathol. 151 (4), 1019-1025 (1997).
- van Albada, M. E., Schoemaker, R. G., Kemna, M. S., Cromme-Dijkhuis, A. H., van Veghel, R., Berger, R. M. The role of increased pulmonary blood flow in pulmonary arterial hypertension. Eur Respir J. 26 (3), 487-493 (2005).
- Brittain, E. Echocardiographic assessment of the right heart in mice. JVis Exp. (e81), (2013).
- Dickinson, M. G., Bartelds, B., Molema, G., et al. Egr-1 expression during neointimal development in flow-associated pulmonary hypertension. Am J Pathol. 179 (5), 2199-2209 (2011).
- Borgdorff, M. A., Bartelds, B., Dickinson, M. G., Steendijk, P., de Vroomen, M., Berger, R. M. Distinct loading conditions reveal various patterns of right ventricular adaptation. Am J Physiol Heart Circ Physiol. 305 (3), H354-H364 (2013).
- Ruiter, G., de Man, F. S., Schalij, I., et al. Reversibility of the monocrotaline pulmonary hypertension rat model. Eur Respir J. 42 (2), 553-556 (2013).
- van Albada, M. E., Bartelds, B., Wijnberg, H., et al. Gene expression profile in flow-associated pulmonary arterial hypertension with neointimal lesions. Am J Physiol Lung Cell Mol Physiol. 298 (4), L483-L491 (2010).
- Dickinson, M. G., Kowalski, P. S., Bartelds, B., et al. A critical role for egr-1 during vascular remodelling in pulmonary arterial hypertension. Cardiovasc Res. 103 (4), 573-584 (2014).
- van der Feen, D. E., Dickinson, M. G., Bartelds, M. G., et al. Egr-1 identifies neointimal remodeling and relates to progression in human pulmonary arterial hypertension. Jheart lung transplant. 35 (4), 481-490 (2016).
- Rungatscher, A. Chronic overcirculation-induced pulmonary arterial hypertension in aorto-caval shunt. Microvasc Res. 94, 73-79 (2014).
- O'Blenes, S. B., Fischer, S., McIntyre, B., Keshavjee, S., Rabinovitch, M. Hemodynamic unloading leads to regression of pulmonary vascular disease in rats. J Thorac Cardiovasc Surg. 121 (2), 279-289 (2001).
- Sakao, S., Taraseviciene-Stewart, L., Lee, J. D., Wood, K., Cool, C. D., Voelkel, N. F. Initial apoptosis is followed by increased proliferation of apoptosis-resistant endothelial cells. FASEB J. 19 (9), 1178-1180 (2005).
- Spiekerkoetter, E. FK506 activates BMPR2, rescues endothelial dysfunction, and reverses pulmonary hypertension. J Clin Invest. 123 (8), 3600-3613 (2013).
- Nickel, N. P., Spiekerkoetter, E., Gu, M., et al. Elafin reverses pulmonary hypertension via caveolin-1-dependent bone morphogenetic protein signaling. Am J Respir Crit Care Med. 191 (11), 1273-1286 (2015).
- Meloche, J., Potus, F., Vaillancourt, M., et al. Bromodomain-containing protein 4: The epigenetic origin of pulmonary arterial hypertension. Circ Res. 117 (6), 525-535 (2015).
- Happé, C. M. Pneumonectomy combined with SU5416 induces severe pulmonary hypertension in rats. Am J Physiol Lung Cell Mol Physiol. 310 (11), L1088-L1097 (2016).
- Ranchoux, B., Antigny, F., Rucker-Martin, C., et al. Endothelial-to-mesenchymal transition in pulmonary hypertension. Circulation. 131 (11), 1006-1018 (2015).
- de Raaf, M. A. SuHx rat model: Partly reversible pulmonary hypertension and progressive intima obstruction. Eur Respy J. 44 (1), 160-168 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유