JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
한 냄비 전자 렌지를 이용한 변환 Anomeric 질 산 에스테 르의 Trichloroacetimidates
요약
2-azido-1-질 산-에스테 르는 해당 2-azido-1-trichloroacetimidate 한 냄비 절차에서를 변환할 수 있습니다. 원고의 목표 탄수화물 합성에 전자 레인지 원자로의 유틸리티를 설명 하는 것입니다.
초록
다음 절차의 목표 trichloroacetimidate glycosyl 기증자에 게는 2-azido-1-질 산-에스테 르의 한 냄비 변환의 데모를 제공 하는 것입니다. glycal의 azido nitration, 다음 전자 레인지를 이용한 방사선에서 제품 2-azido-1-질 산 에스테 르를 분해 수 있습니다. 이 변환은 일반적으로 강하게 및 시 약 및 확장 된 반응 시간을 사용 하 여 이루어집니다. 마이크로파 방사선 조사는 가수분해, 짧은 반응 시간, 시 약의 부재에서 유도합니다. Denitration, 다음에 해당 2-azido-1-trichloroacetimidate를 같은 냄비에 중간 anomeric 알콜 변환 됩니다.
서문
분자 생물학에 있는 그들의 편 재 때문에 탄수화물 화학 합성에 대 한 오랜 목표 되었습니다. 1 , 2 , 3 어떤 성공적인 합성 캠페인의 핵심 처리한후 체인 만들려고 glycosylation 반응의 정확한 배포가입니다. 4 , 5 , 6 , 7 , 8 , 9 , 10 , 11 , 12 당연한, 있다 glycosidic 채권을 설치 하는 방법의 많은 수 없습니다. 13 , 14 는 Koenigs Knorr 메서드는 가장 이른 알려진된 절차 중 하나 이며 커플링 glycosyl 염화 또는 평범한 사람 중 금속 (수은 또는 은색) 활성화의 밑에 보통 알코올 구성 요소를 포함. 15 관련된 glycosyl 불 화물 처음 소개 기증자로 1981에서 Mukaiyama 그룹 그리고 그들의 증가 한 열과 화학 안정성 때문에 광범위 하 게 응용 프로그램을 발견 했다. 16 반응 스펙트럼의 반대쪽 끝에 다른 할로겐 보다 훨씬 반응성은 glycosyl iodides 있습니다. 증가 된 반응성 증가 stereocontrol, 특히 때 α 연결 oligosaccharides 형성을 동반 된다. 17 "haloglycosides", 뿐만 아니라 thioglycosides 발견 했다 다양 한 유틸리티, 부분적으로, 형성, 다양 한 반응 조건, 및 electrophilic 시 약으로 활성화 하는 안정성의 그들의 용이성으로 인해. 18
Anomeric 알코올 "산소"를 포함 하는에 잠재적인 그룹을 활성화 하 고 궁극적으로 수락자 분자에서 알코올에 의해 난민을 떠나 변환에 초점 위에서 설명한 방법. Anomeric 산소 활성화 슈미트 학교에 의해 설명 된 대로 자체, C1 산소 떠나는 그룹으로 변환에 집중 한다. 19 이 방법은 가장 강력한 이며 화학 glycosylation 반응에서 널리 이용 된다. Trichloroacetimidate 기증자는 쉽게 감소 설탕과 탄산 칼륨 (K2CO3) 또는 1, 8-diazabicyclo [5.4.0] undec-7-ene (DBU) 등 자료의 trichloroacetonitrile에서 준비 됩니다. 이러한 종 다음 루이스 산을 사용 하 여 활성화 됩니다. 20
최근에, 우리는 2-azido-1-trichloroacetimidate 기증자 직접 glycals에서 준비 될 수 있다 보고 있다. 과정 2 반응을, 2-azido-1-질 산 에스테 르에서 한 냄비 절차를 포함 한다. 21 이 상세한 프로토콜 고수익 변환을 성공적으로 완료에 실무자를 지원 하기 위한 것입니다. 특히 전자 레인지-열 denitration에는 초점을 맞추고 보조 난방 시퀀스의 첫 번째 단계가입니다. 우리는 또한 유기 합성 반응 기 전자 레인지 사용에 영상 자습서를 제공 하도록 하겠습니다.
프로토콜
1. 대표 전자 레인지-Denitration 지원
- Azido 질 산 에스테 르를 배치 (1.0 equiv., 0.2 m m o l) 8 mL 전자 레인지 반응 유리병에서. 반응의 규모는 반응 진행에 어떤 악영향 없이 여러 mmol을 늘릴 수 있습니다.
- Azido-질 산 에스테 르 20 %aq. 아세톤 (0.1 M 2.0 mL)에 녹. 반응 배를 피리 딘 (5.0 equiv., 0.08 mL, 1.0 mmol)을 추가 합니다. 전자 레인지 방사선 유리병 뚜껑과 전자 레인지 원자로 캐비티에 반응 배를 놓습니다.
- 교 반 및 고정된 유지 시간 15 분 동안 120 ° C에서 솔루션 비추는 보류 시간 얼마나 방사선 지정 된 온도 및 결과 압력 발생 합니다 나타냅니다. 램프 2 분 동안 모든 반응 보고 온도에 열. 내장 IR 센서가 온도 모니터링 합니다.
- 15 분 후 얇은 층 크로마토그래피 (TLC)를 사용 하 여 시작 물자의 소비를 확인 하는 반응 혼합물을 분석 합니다. Eluent는으로 1:1 에틸 아세테이트/hexanes를 사용 합니다.
- TLC 판 ceric 암모늄 molybate 얼룩을 사용 하 여 시각화. 반응 물 및 제품의 Rf 달라 집니다 하지만 줄이는 알코올 반응 보다 일반적으로 0.05에서 0.1 낮은 Rf .
2입니다.는 trichloroacetimidate의 형성
- 시작 물자의 완전 한 소비에 따라 항공사를 사용 하 여 감소 볼륨에 용 매를 증발. 다음, (dichloromethane) 채널2Cl2 (1.0 mL)로 희석 하 고 주사기를 사용 하 여 물 층을 제거. 물 레이어 제거 되 면 얼음 물 목욕을 사용 하 여 0 ° C에 반응 혼합물을 냉각 한다.
- 다음, 반응 배를 DBU (10 eq, 0.3 mL, 1.9 mmol)와 2,2,2-trichloroacetonitrile (50 eq, 1.0 mL, 10 mmol)을 추가 합니다. 두 시 약 과잉에 추가 되 고 기지의 1 해당 고 1 상응 하는 2,2,2 trichloroacetonitrile의 최소 필요.
- 주위 온도에 온난 하는 동안 저 어 반응 혼합물을 허용 한다. TLC 확인 시작 물자의 소비에 의해 반응을 모니터링 합니다.
- Eluent는으로 1:1 에틸 아세테이트/hexanes를 사용 합니다. TLC 판 ceric 암모늄 molybate 얼룩을 사용 하 여 시각화. 반응 물 및 제품의 Rf 달라질 수 있습니다.
- 시작 물자의 완전 한 소비 후 복구 플라스 크에 반응 혼합물을 전송 하 고 혼합물 vacuo에서 30 ° c.에 집중 솔벤트의 증발 갈색 기름 원유 옅은 노란색을 제공 합니다.
- Eluent로 1.5 cm 크로마토그래피 열과 1:4 에틸 아세테이트/hexanes 실리 카 젤 컬럼 크로마토그래피에 의해 원유 제품을 정화. imidate의 물리적 형태는 분자에서 분자를 달라 집니다.
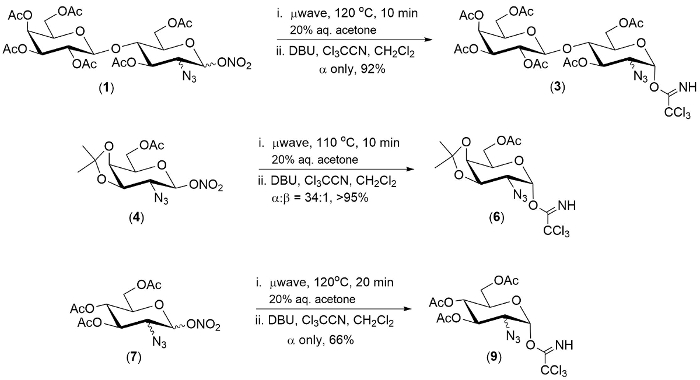
그림 1. 2-azido-1-trichloroimidates 2-azido-1-질 산 에스테 르의 한 냄비 변환의 대표적인 예. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
결과
3 2-azido-1-질 산 에스테 르의 수영장에 여기에 설명 된 기술을 시연 했다. 각각의 경우에는 반응의 첫 번째 단계 20 분 이내에 완료 했다.
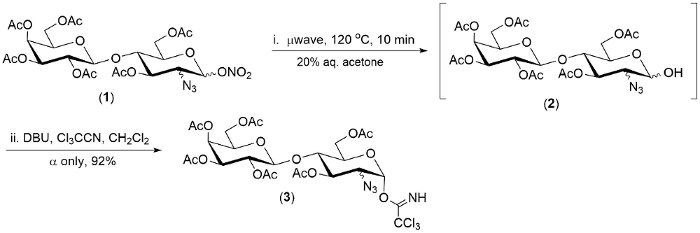
그림 2. 가수분해의 대표적인 예 (1 →2), 그리고 1 의 2-azido-1-질 산 에스테 ?...
토론
이 자습서에 설명 된 프로토콜 질 산 에스테 르 반응, 유용한 기능을 변환 하는 메서드를 제공 합니다. 넓은 의미에서 탄수화물 합성의 과정을 통해 특정 훈련을 완료 하는 데 전자 레인지 원자로 고용 수 있도록 어려운 변환 손쉬운 일상적인 가능성이 있다. 이 자습서에서 우리의 목표는 마이크로파 방사선의 맥락에서 탄수화물을 처리 하는 방법을 보여 줍니다.
부모 반응의 ?...
공개
저자 아무 경쟁 금융 관심사 있다.
감사의 말
저자 밴 더 빌 트 대학 재정 지원에 대 한 화학 생물학 연구소를 인정 하 고 싶습니다. 미스터 버클리 엘리스와 교수 존 맥 클린 High-Resolution 질량 스펙트럼 분석에 대 한 인정 됩니다.
자료
| Name | Company | Catalog Number | Comments |
| 230 400 mesh silica gel | SiliCycle Inc | R10030B | |
| TLC plates | SiliCycle Inc | TLG-R10014B-527 | |
| Ceric ammonium molybdate | Sigma-Aldrich | A1343 | |
| Solvent Still | Mbraun | MB-SPS-800 | |
| Infared spectrometer | Thermo | Thermo Electron IR100 | |
| Nuclear Magnetic Resonance | Bruker | 400, 600 MHz | |
| LC/MS | Thermo/Dionex | Single quad, ESI | |
| HRMS | Agilent | Synapt G2 S HDMS | |
| Microwave reactor | Anton Parr | Anton Parr G10 Monowave 200 | |
| DBU | Sigma-Aldrich | 139009 | |
| CCl3CN | Sigma-Aldrich | T53805 | |
| Pyridine | Sigma-Aldrich | 270970 | |
| Acetone | Fisher Scientific | A18-20 | Tech. grade |
| Phase separator | Biotage | 120-1901-A | |
| Rotary evaporator | Buchi | R-100 |
참고문헌
- Nicolaou, K. C., Mitchell, H. J. Adventures in Carbohydrate Chemistry: New Synthetic Technologies, Chemical Synthesis, Molecular Design, and Chemical Biology A list of abbreviations can be found at the end of this article. Telemachos Charalambous was an inspiring teacher at the Pancyprian Gymnasium, Nicosia, Cyprus. Angew. Chem. Int. Ed. Engl. 40 (9), 1576-1624 (2001).
- Danishefsky, S. J., Allen, J. R. From the laboratory to the clinic: A retrospective on fully synthetic carbohydrate-based anticancer vaccines. Angew. Chem. Int. Ed. Engl. 39 (5), 836-863 (2000).
- Nicolaou, K. C., Hale, C. R. H., Nilewski, C., Ioannidou, H. A. Constructing molecular complexity and diversity: total synthesis of natural products of biological and medicinal importance. Chemical Society Reviews. 41 (15), 5185-5238 (2012).
- Zhu, X., Schmidt, R. R. New principles for glycoside-bond formation. Angew. Chem. Int. Ed. Engl. 48 (11), 1900-1934 (2009).
- Danishefsky, S. J., Bilodeau, M. T. Glycals in organic synthesis: The evolution of comprehensive strategies for the assembly of oligosaccharides and glycoconjugates of biological consequence. Angew. Chem. Int. Ed. Engl. 35 (13-14), 1380-1419 (1996).
- Bongat, A. F., Demchenko, A. V. Recent trends in the synthesis of O-glycosides of 2-amino-2-deoxysugars. Carbohydr. Res. 342 (3-4), 374-406 (2007).
- Feizi, T., Fazio, F., Chai, W. C., Wong, C. H. Carbohydrate microarrays - a new set of technologies at the frontiers of glycomics. Curr. Opin. Struct. Biol. 13 (5), 637-645 (2003).
- Palmacci, E. R., Plante, O. J., Seeberger, P. H. Oligosaccharide synthesis in solution and on solid support with glycosyl phosphates. Eur. J. Org. Chem. (4), 595-606 (2002).
- Stallforth, P., Lepenies, B., Adibekian, A., Seeberger, P. H. 2009 Claude S. Hudson Award in Carbohydrate Chemistry. Carbohydrates: a frontier in medicinal chemistry. J. Med. Chem. 52 (18), 5561-5577 (2009).
- Danishefsky, S. J., Mcclure, K. F., Randolph, J. T., Ruggeri, R. B. A Strategy for the Solid-Phase Synthesis of Oligosaccharides. Science. 260 (5112), 1307-1309 (1993).
- Demchenko, A. V. Stereoselective chemical 1,2-cis O-glycosylation: From 'sugar ray' to modern techniques of the 21st century. Synlett. (9), 1225-1240 (2003).
- Fraserreid, B., Wu, Z. F., Udodong, U. E., Ottosson, H. Armed-Disarmed Effects in Glycosyl Donors - Rationalization and Sidetracking. J. Org. Chem. 55 (25), 6068-6070 (1990).
- Bohe, L., Crich, D. A propos of glycosyl cations and the mechanism of chemical glycosylation; the current state of the art. Carbohydr. Res. 403, 48-59 (2015).
- Toshima, K., Tatsuta, K. Recent Progress in O-Glycosylation Methods and Its Application to Natural-Products Synthesis. Chem. Rev. 93 (4), 1503-1531 (1993).
- Koenigs, W., Knorr, E. Ueber einige Derivate des Traubenzuckers und der Galactose. Chem. Ber. 34 (1), 957-981 (1901).
- Mukaiyama, T., Murai, Y., Shoda, S. An Efficient Method for Glucosylation of Hydroxy Compounds Using Glucopyranosyl Fluoride. Chem. Lett. (3), 431-432 (1981).
- Meloncelli, P. J., Martin, A. D., Lowary, T. L. Glycosyl iodides. History and recent advances. Carbohydrate Research. 344 (9), 1110-1122 (2009).
- Lian, G., Zhang, X., Yu, B. Thioglycosides in carbohydrate research. Carbohydr. Res. 403, 13-22 (2015).
- Schmidt, R. R., Kinzy, W. Anomeric-Oxygen Activation for Glycoside Synthesis - the Trichloroacetimidate Method. Advances in Carbohydrate Chemistry and Biochemistry. 50, 21-123 (1994).
- Schmidt, R. R., Toepfer, A. Glycosylation with highly reactive glycosyl donors: efficiency of the inverse procedure. Tetrahedron Lett. 32 (28), 3353-3356 (1991).
- Keith, D. J., Townsend, S. D. Direct, microwave-assisted substitution of anomeric nitrate-esters. Carbohydr. Res. 442, 20-24 (2017).
- Bukowski, R., et al. Synthesis and Conformational Analysis of the T-Antigen Disaccharide(B-D-Gal-(1->3)-a-D-GalNAc-OMe). Eur. J. Org. Chem. 14, 2697-2705 (2001).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유