Method Article
장 내 토굴에서 뮤린 기본 결장 상피 단층의 세대
요약
이 프로토콜에서, 우리는 장 지하실에서 직접 뮤린 기본 상피 결장 단층층을 생성하는 방법을 설명합니다. 우리는 투과성 필터에 컨천단층을 생성하기 위한 실험적 접근법, 스크래치 상처 치유 및 생화학 연구를 위한 컨큐리 단층, 면역 형광 분석을 위한 희소및 응수 단층층을 제공합니다.
초록
장 상피는 창 자 루멘과 신체의 내부 사이의 장벽 역할을 하는 세포의 단일 층으로 구성됩니다. 이 장벽의 연속성에 있는 중단은 선동적인 장 질병과 같은 선동적인 무질서 귀착될 수 있습니다. 장 상피 생물학의 연구 결과에 있는 한계의 한은 1 차적인 세포 배양 모형의 부족이었습니다, 이는 암종에서 파생된 모형 세포주를 사용하는 연구원을 의무했습니다. 3차원(3D) 장로이드의 출현은 상피 생물학자들에게 1차 세포 배양을 생성하는 강력한 도구를 제공하였고, 그럼에도 불구하고 이러한 구조는 세포외 매트릭스에 내장되어 있으며 분화된 장 상피 세포의 성숙특성이 결여되어 있다. 장 상피 단층층을 생성하는 몇 가지 기술이 발표되었지만, 대부분은 확립된 3D 엔테로이드에서 파생되어 공정을 힘들고 비싸게 만듭니다. 여기에서 우리는 뮤린 장 지하실에서 직접 기본 상피 결장 단층층을 생성하는 프로토콜을 설명합니다. 또한 투과성 필터에 대한 컨물류 배양의 생성, 스크래치 상처 치유 연구를 위한 컨캔트 단층, 면역 형광 분석을 위한 희소및 응수 단층과 같은 이 모델과 함께 사용할 수 있는 실험적 접근법을 자세히 설명합니다.
서문
장 상피 세포(IEC)는 내장이 미생물과 독소가 체내에 들어가는 것을 방지하면서 영양분과 수분 흡수를 허용하는 선택적으로 투과성 장벽을 형성한다. 장 점막은 villi (소장에만 존재)라고 불리는 발광 투영및 지하실이라는 질로 구성됩니다. 빌리와 결장 토굴의 표면은 분화 된 상피 세포로 덮여 있으며, 토굴의 기저는 3 일에서 7 일까지 회전율을 가지고 장 상피의 신속한 갱신을 만드는 줄기 세포로 구성됩니다. 장 내 줄기 세포 (ISC)는 장 항상성을 유지하는 데 중요할뿐만 아니라 손상된 상피2의적절한 수리를 위해 중요합니다.
장 상피 생물학의 연구는 변형 된 세포주를 가진 1 차적인 세포 배양의 부족에 의해 제한되었습니다 유일한 공구는 유효한. 장 상피 모델 세포주는 정상적인 장 상피의 생리학을 정확하게 복제 할 수 없습니다. ISC에서 파생된 3D 배양의 발달은 생체 내 창자 점막 조건 3에서 유사한 시험관 내 모형을 가진 장 점막 생물학자를 제공했습니다3. 지하실 막 매트릭스 배지(예를 들어, Matrigel)에 내장된 뮤린 샘플로부터 쉽게 격리할 수 있으며 Wnt3a, R-spondin 및 Noggin을 포함하는 조건부 배지에서 재배되어 엔테로이드(소장) 또는 대장형(대형장)으로알려진 3D 구조를 생성한다. 엔테로이드와 대장향은 정황 도메인이 내부 루멘을 향하고 있고 바소포측 영역이 세포외 매트릭스와 직접 접촉하는 편광 구형 구조입니다. 엔테로이드와 대장형은 엔테로세포/대장세포, 창구, 엔테로엔도크 및 잔류 세포와 같은 모든 주요 분화장 상피 하위 유형을 함유하고있으며, 5에서분리된 장의 섹션에서와 마찬가지로 비교적 동일한 비율로 나타납니다. 3D 장내 및 대장장이가 장 발달 및 생리학 연구에서 중요한 진전을 나타내지만, 이러한 모델은 상피 세포 (lumen)의 정표면에 대한 제한된 접근과 관심있는 분자의 높은 처리량 스크리닝을 달성하기 위해 배양을 상이 또는 아래로 확장 하는 능력과 같은 특정 단점을 제시한다. 이러한 한계를 극복하기 위해 3D 엔테로이드/콜로노이드로부터 파생된 IEC의 기본 2D 배양을 획득하는 프로토콜이 생성되었다. 2D 엔테로이드/대장형은 모델 세포주처럼 세포 시트처럼 자라며 장 내 상처 수리, 숙주 병원균 상호 작용 및 재생 의학을 연구하는 데 이상적입니다. 여러 출판 된 논문은 3D 구조에서 또는 장 지하실에서 직접 2D 단층층을 생성하는 방법을 설명합니다 (참조6,7,8,9,10,11)이러한 방법은 노동 집약적이고 재현하기 어려운 경향이있다. 새로 분리된 마우스 장 토굴에서 직접 단층층을 얻는 빠르고 간단하며 재현 가능한 방법은 이 프로토콜에 설명되어 있습니다.
여기서우리는 이 기술의 최소한의 파편, 세포외 매트릭스 선택 및 다양한 표면 및 응용 분야로 토굴 추출 과정을 자세히 설명합니다. 이 실험적인 접근 방식은 결장 토굴에 최적화되었지만 소장에 적용하면 유사한 결과를 얻을 수 있습니다.
프로토콜
아래에 설명된 모든 절차는 미시간 대학교 기관 동물 관리 및 사용 위원회가 정한 지침에 따라 승인되고 수행되었습니다.
1. 토굴 격리 및 문화에 대한 시약 준비 (조직 배양 후드준비)
- 50 mM 에틸렌디아민 테트라아세틱 산 (EDTA): 칼슘 (Ca2 +)및 마그네슘 (Mg 2+)없이 인산염 완충 식염수의 450 mL에 50 mL 0.5 M 스톡을 추가500 mL을 준비합니다. 이 프로토콜에서 PBS는 달리 명시되지 않는 한 칼슘과 마그네슘이없는 PBS를 참조합니다.
- 쉐이크 버퍼: PBS에서 7.4g 자당(43.3mMM)과 5g 소르비톨(54.9mMMMM)을 용해하여 500mL를 준비한다.
- L-WRN (L-Wnt-3A, R-spondin 및 Noggin) 미디어: 보충 고급 덜벡코의 수정 된 독수리 매체 / 햄의 F-12 (DMEM / F12) (780 mL) 20% 태아 보빈 세럼 (FBS) (200 mL), 1 x 상용화 가능한 글루타민 보충제 (10 mL), 100 U/mL 100 g/mL 연쇄상 구균 (10 mL), 필터 는 0.22 μm 필터로 살균.
- ATCC를 통해 L-WRN 세포를 얻고, T175 플라스크에서 성장하고, 유전학및 히그로마이신을 사용하여 선택하십시오. 미디어가 변경되어 12일 동안 수집됩니다.
참고: TOPflash Wnt 리포터 분석기를 사용하여 모든 미디어 배치가 Wnt 활동에 대해 테스트됩니다. 이 경우 미시간 의학 번역 조직 모델링 실험실 프로토콜 (https://www.umichttml.org/protocols)을 따랐다. TOPflash HEK 293 세포주T75 플라스크에서 합류하여 트립시닉화되어 96웰 플레이트에 도금된다. 수집된 매체의 다음 날 상이한 희석은 세포에 첨가되고 하룻밤 사이에 37°C에서 5% CO2 인큐베이터로 배양된다. 다음 날, 세포는 lysed, 그리고 반딧불 루시 파 아 세 이 제조 업체의 지침에 따라 수행. 분석은 재조합 Wnt-3A를 사용하여 정규화됩니다. 이 매체는 50mL 원내 25mL 알리코크로 나뉘며 -80°C에 저장한다.
- ATCC를 통해 L-WRN 세포를 얻고, T175 플라스크에서 성장하고, 유전학및 히그로마이신을 사용하여 선택하십시오. 미디어가 변경되어 12일 동안 수집됩니다.
- 기본 매체: 500mL의 경우, 2배 의 상용 글루타민 보충제(10mL), 20mMHEPES(10mL), 100 U/mL 페니실린을 보충하고, 100 g/mL 연쇄상 구균 (10 mL), 2 mM N-아세틸-L-시스테인 (2 mL), N2 보충 (10 mL) 및 B27 보충 (20 mL), 필터 살균 0.22 μm 필터. 미디어를 50mL 원문 튜브로 25mL 알리코크로 나누고 -80°C에 저장한다.
- LWRN 완성 매체: 25mL LWRN 미디어를 25mL의 기본 미디어와 결합하고 200 ng/mL 표피 성장 인자(EGF) (20μL) 및 2x 항생제 항진균용액(1mL)을 보충합니다. 전체 미디어를 4°C로 저장합니다.
- 콜라겐과 라미닌: 5mL의 필터 살균 100m 아세트산(분자등급 수의 9.94mL에 아세트산 육수 60 μL 추가)에 5 mg 분말을 녹여 1 mg/mL의 재고 농도를 생성합니다. 4°C에서 4시간 동안 회전하고 0.2mL 튜브에서 100 μL 알리코트를 만듭니다. -20 °C에서 동결하십시오. 라미닌은 100 μg/mL의 재고 농도로 구입됩니다.
- 성장 인자없이 완전한 미디어 (CMGF-): 보충 고급 DMEM/ F12 (500 mL) 1 x 상용화 가능한 글루타민 보충 (5 mL), 10 mMM HEPES (5 mL), 100 U /mL 페니실린 및, 100 g/mL 연쇄 상반신 (5 mL).
- 차별화 매체: CMGF-미디어 9.2mL에, B27 보충제 200 μL, N2 보충제 100 μL, N-아세틸-L-시스테인 20μL, 노긴 미디어12(노긴 생성 세포에서 만든) 및 EGF의 2μL을 10m의 다른 10mL로 추가합니다.
2. 플레이트, 챔버 슬라이드 및 세포 배양 막 인서츠의 준비
- 도금 48웰 플레이트 및 챔버 슬라이드 2D 단층: 라미닌(1:40 희석, 재료 표참조)과 콜라겐(1:30 희석)을 차가운 덜베코의 인산염 버퍼식 식염수에 Ca2+ 및Mg+(DPBS)로 구성하는 코팅 솔루션을 사용하십시오. 각 웰에 200 μL의 코팅 용액을 추가하고 플레이트/챔버 슬라이드를 37°C에서 37°C에서 최소 2시간 동안 배양한다.
- 코팅 0.4 μm 세포 배양 막 인서츠: 분자 등급 물에 콜라겐의 1:30 희석을 하고 각 삽입에 200 μL을 추가합니다. 멤브레인인이 포함된 플레이트를 얼음에 30분 동안 4°C로 보관하십시오. 30분 배양 후, 플레이트를 1.5-2h의 37°C에서 5% CO2 인큐베이터에 보관하십시오. 폴리에스테르 및 폴리카보네이트 멤브레인 인서트는 유사한 결과를 산출합니다.
참고: 모든 조직 배양 플레이트는 콜라겐/라미닌 부피를 조정하여 도금 표면의 전체 커버리지를 확보함으로써 이 프로토콜을 사용하여 시드(위 및 다운스케일링을 수행할 수 있음).
3. 토굴 격리
참고: 해부를 시작하기 전에 콜라겐 및/또는 라미닌 코팅 플레이트/멤브레인 인서트/챔버 슬라이드를 준비하고 37°C에서 5% CO2 인큐베이터에 둡니다. 수술에 적합한 깨끗한 작업 벤치와 멸균 수술 기구를 준비하고 2D 단층층을 배양하기위한 생물학적 안전 캐비닛을 준비하십시오. 가습 된 CO2 인큐베이터, 탁상 원심분리기 (4 °C에서 유지), 현미경 및 파이펫 (세로지학적 파이펫 포함)와 같은 2D 단층 배양에 대한 다른 모든 표준 장비가 준비되어 있는지 확인합니다.
- C57Bl/6 마우스를 사용 하 여, 8-12 주 오래 된. 안락사의 승인 된 방법을 사용하여 마우스를 안락사.
- 70% 에탄올(EtOH) 용액으로 마우스 시체를 분무하여 해부 부위를 청소하고 종이 조직을 사용하여 과도한 EtOH를 제거합니다.
참고: 암호화 격리 시약(예: PBS, 50mM EDTA, 흔들림 버퍼)의 토굴이 차가운 상태로 유지되는지 확인합니다. 이러한 시약은 1일 전에 제조될 수 있으며 4°C에 보관할 때 적어도 3개월 동안 사용하는 것이 좋다. 또한 LWRN 완성 매체가 사용 전까지 37°C에서 유지되는 비드/수조에 보관되어 있는지 확인하십시오. - 깨끗한 해부 가위와 집게를 사용하여 직장에서 cecum에 결장밖으로 해부합니다. 집게를 사용하여 결장의 끝을 잡고 20 G 급유 튜브(그림 1A)가장착 된 10 mL 주사기에서 얼음 차가운 PBS를 사용하여 대변을 매우 부드럽게 씻어 냅니다. 결장파열하지 않도록 하십시오.
- 근위 결장제거합니다. 이것은 일레오세칼 접합에 가장 가까운 결장의 부분이 될 것입니다.
- 집게로, 20G 급유 튜브에 부드럽게 말단 결장을 밀어 4-0 실크 봉합사실(도1B)으로팁으로 튜브 끝에 결장에서 묶는다.
- 결장 안쪽을 뒤집어 서 있는 끝에 손가락을 대고 다른 쪽 끝을 4-0 실크 봉합사실로 묶습니다. 외과 가위를 사용하여, 먹이 튜브의 끝 아래 결장 절단(도 1C,D, E).
- 1.25 mL 반복 주사기의 플런저를 사용하여 1.25 mL 반복 주사기의 끝에 반전 된 결장의 풀이 없는 끝을 부드럽게 엽니다. 반전된 결장을 주사기 끝에 밀어 내고 4-0 실크 봉합사실(그림1F,G)으로단단히 묶습니다.
- 플런저를 주사기에 삽입하고 결장부림을 팽창하여 소시지를 형성합니다. 결장 소시지가 눈에 보이는 주름없이 긴급 보일 때까지 팽창(그림 1H).
- 15mL 튜브에 주사기/콜론을 20분 동안 얼음에 5mL의 세포 회수 용액을 배치하고, 5분마다 한 번씩 결장수축(그림1I)을팽창시키고 수축시다. 소시지는 인큐베이션 중에 팽창해야 합니다.
- 콜론이 팽창된 반복 주사기의 끝 아래 4-0 실크 봉합사 실을 사용하여 묶습니다. 소시지를 반복 주사기에서 잘라 내고 15mL 튜브에 50mMM(소장용 2mM) EDTA를 40분 동안 들어놓고 4°C(그림1J,K)에서회전한다.
- EDTA 용액을 벗어내고 5mL의 쉐이크 버퍼로 교체하십시오. 소시지를 수직 자세(힘차게) 2분 동안 수동으로 흔들어 주세요.
- 흔들리는 용액을 새로운 15mL 튜브로 데킹하고 흔들리는 버퍼에서 총 10mL의 토굴을 연속하여 흔들림 단계를 반복합니다.
- 페트리 접시에 토굴 서스펜션의 20 μL을 가지고 현미경에서 토굴의 수를 계산합니다. 토굴/μL의 토굴 농도를 계산합니다. 농도에 따라 샘플을 희석하여 도금 시(1000crypts/cm2)에서5개의 암호화/μL을 얻습니다.
- 4°C에서 10분 동안 400 x g에서 탁상 원심분리기를 사용하여 격리된 토굴로 튜브를 회전시합니다.
- 한편, 인큐베이터에서 48웰 플레이트/인서트/챔버 슬라이드를 제거하고 생물안전 캐비닛에 넣습니다. P200을 사용하여 코팅 용액을 흡인하고 세포가 도금 될 준비가 될 때까지 뚜껑을 약간 오프셋으로 플레이트를 둡니다.
4. 2D 단층 배양
참고: 3D 콜로노이드에서 장 상피 단층층을 생성하는 방법에 대한 자세한 프로토콜은 에스테스와 Kovbasnjuk 실험실(7,11)에의한 프로토콜을 확인합니다.
- 10mL 세로지오피펫을 사용하여 흔들리는 버퍼를 제거합니다. 펠릿이 손상되지 않았는지 확인하고 P1000을 사용하여 남은 액체를 제거할 수 있습니다. LWRN 의 3mL에서 펠릿을 다시 일시 중단하고 P1000을 통해 위아래로 파이펫을 완성합니다. 미리 코팅된 48웰 플레이트/챔버 슬라이드의 각 웰에 200μL의 크립토를 추가하고 37°C에서 5% CO2 인큐베이터에 인큐베이터를 인큐베이트합니다.
- 다음 날 P200을 사용하여 미디어를 흡인하고 신선한 미디어를 추가합니다. 세포는 24-48 h에서 confluent된다.
- 세포 배양 막 인서트의 경우, 200 μL 암호(5개의 암호화/μL)를 인서트 상단에 추가하고 전체 L-WRN 용지의 600 μL을 하단 부분에 추가합니다. 다음 날 P200을 사용하여 미디어를 흡인하고 상단 챔버에만 신선한 미디어를 추가합니다. 플레이트를 37°C에서 5% CO2 인큐베이터로 배양한다. 환전성 전기 저항(TEER)은 상피 볼트/옴 미터(EVOM)를 사용하여 매일 측정됩니다.
참고: 문화권이 300 Ω.cm2보다큰 TEER 를 읽는 경우, 그들은 수렴될 것을 의미합니다. 인플루엔자(Confluency)는 3-4일 만에 달성됩니다. 2일마다 미디어를 변경합니다.
결과
기본 상피 결장 단층 배양물의 신뢰성을 설명하기 위해 프로토콜에서 파생된 암호화 격리 및 대표 이미지에 대한 요약이 표시됩니다. 사용자는 격리된 토굴이 멸균 조건에서 배양되어 있으므로 콜론의 올바른 해부 및 청소가 우선순위라는 점을 명심해야 합니다. 그림 1은 토굴 격리 중에 주요 단계를 특징으로 합니다. 격리된 토굴(도2A)은이제 5개의 암호화/μL의 농도를 얻기 위해 계산 및농축(도 2B)이다. 토굴의 농축 된 준비 후, 세포는 원하는 형식 (문화 접시, 멤브레인삽입 또는 챔버 슬라이드)로 도금되고 실험적 요구에 따라 적절한 매체로 배양됩니다. 도 3은 48웰 플레이트에서 24h와 48h의 문화 발전을 보여줍니다. 셀은 원하는 합류에 도달할 때까지 배양됩니다. 이 방법의 가능한 응용 프로그램을 예시하기 위해, 우리는 48 웰 플레이트 우물이 합류에 도달 할 수 있도록 허용하고 스크래치 상처 분석 작업을 진행했다. 도 4는 2D 콜로노이드 모노레이어와 동일한상처(도 4B)에서갓 만든 스크래치(도4A)를묘사한다. 문화는 여전히 건강하고 실행 가능하고 상처 수리가 있음이 분명합니다. 차별화된 단층층을 생성하기 위해 미디어는 LWRN에서 차별화 매체로 변경됩니다. 차별화는 높은 TEER 값(도5A),ISC 마커의 감소((류신-풍부한 반복 함유 G-단백질 결합 수용체 5(Lgr5) 및 2(Ascl2)와 같은 아케테-스큐드)를 나타내고 분화 마커의 증가를 나타내서 달성된다. (알라닐 아미노펩티다제(안펩), 뮤신 2(Muc2), 리소지메 1(lyz1), 수크로스 이소 말타제(시스), 크로그라닌 A(Chga))(도5B,C)PCR. CDX2 및 KRT20과 같은 다른 마커도 이 패널에 포함될 수 있습니다. mRNA 발현 수준 이외에, 분화 조건에서 자란 2D 콜로노이드에서 분화된 상피 세포의 하위 유형의 출현은 또한 면역형광(Muc2 및 Chga)에 의해 도시된다. 그림 5D).
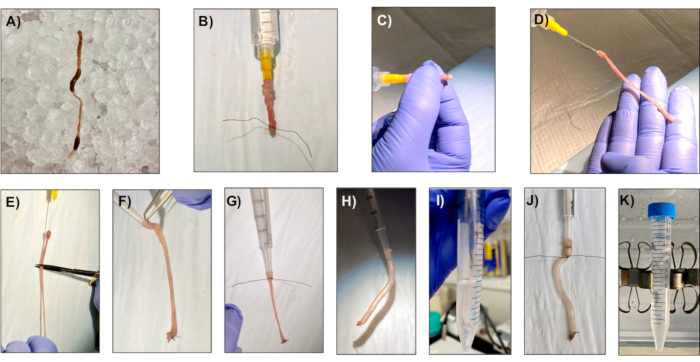
그림 1: 건강한 단층 생성을 위한 샘플 준비. 샘플 준비는 건강한 단층의 생성에 매우 중요합니다. 격리 프로세스의 주요 단계는 독자가 더 쉽게 만들 수 있도록 이 그림에 묘사됩니다. 결장은 마우스에서 절제되어 모피 남은 것이 없는지 확인합니다. 조심스럽게 당신이 결장천을 천명하지 않도록 대변을 제거; 이것은 결장이 공기를 잡고 팽창하고 수축 할 수 있어야하기 때문에 매우 중요합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
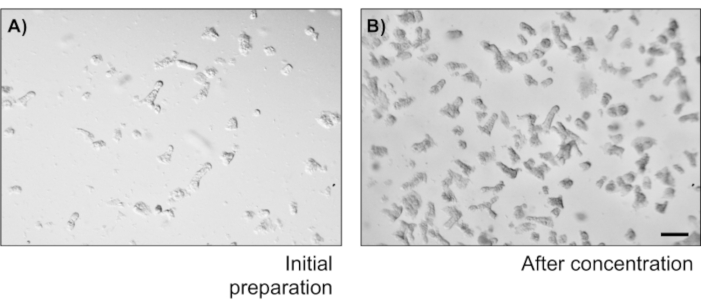
그림 2: 토굴 격리 수와 농도. (A)결장 소시지를 흔들후 식민지 토굴. 이미지는 20 μL 드롭필드를 묘사합니다. (B)5 개의 암호화 / μL. 스케일 바 : 1mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
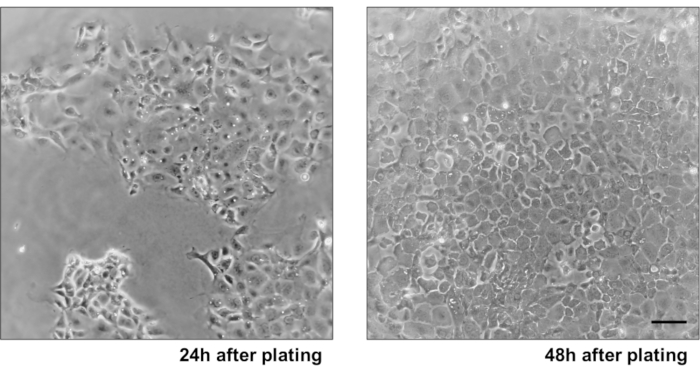
그림 3: 1차 IEC 모노레이어 성장. (A)24h 의 도금 및 세포 이물질의 제거 후 2D IEC 단층. (B)도금 후 48h의 컨서적 2D IEC 단층층. 스케일 바: 10 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
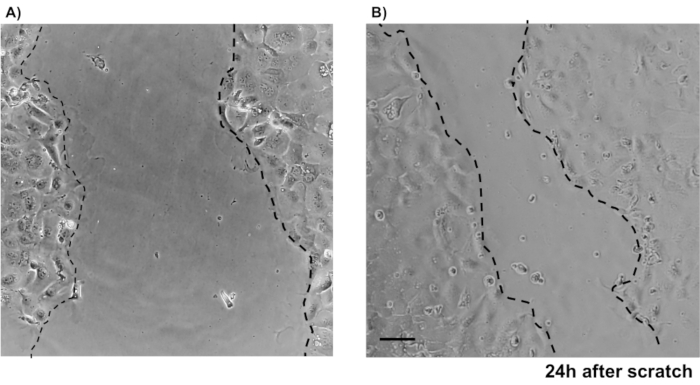
그림 4: 뮤린 프라이머리 IEC를 이용한 스크래치 상처 액세서. 상피 결장 단층에서 스크래치 후 상처 치유를 보여주는 이미지. 규모 표시줄: 5 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
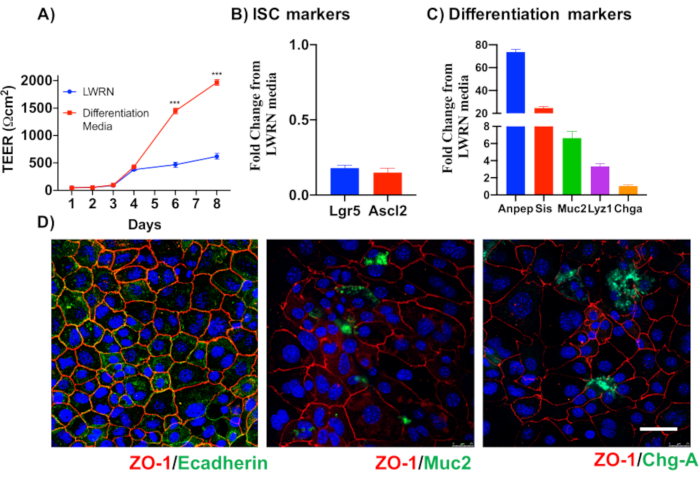
그림 5: 상피 결장 단층의 분화. (A)차별화 매체는 TEER에 의해 입증된 바와 같이 단단한 상피 장벽을 만듭니다. 분화 매체는(B)줄기세포 마커및(C)분화 마커의 mRNA 발현이 저하되는 원인이 된다. (D)Muc2 및 Chromogranin-A와 같은 특수한 분화 상피 세포의 마커는 또한 직접 2D 콜로노이드의 면역 형광을 통해 검출될 수 있다. 규모 표시줄: 5 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
당사의 프로토콜은 직접 기본 2D IEC 단층층을 생성하는 빠르고 재현 가능하며 신뢰할 수 있는 방법을 제공합니다. 결장 상피 단층층을 생성하기 위해 이전에 출판 된 프로토콜에 비해 우리의 프로토콜의 주요 차이점 중 하나는 우리가 토굴을 해방하기 위해 작은 조각으로 결장을 잘라하지 않는다는 것입니다. 대신, 우리는 매우 깨끗한 준비에서 토굴을 방출하는 화학 및 기계적 힘의 조합에 의해 장 상피(13)에서 장 상피를 분리하는 프로토콜을 적응,(그림 2),1 차 문화를 생성하는 이상적인 재료를 연구원을 제공. 우리의 격리 방법은 또한 3D 장용 및 대장을 생성하는 데 사용할 수 있습니다. 도금되는 암호화 수를 정규화하기 위해 실험을 수행할 때마다 토굴 수를 수행하는 것이 중요합니다. 콜론 소시지 터고, 격리 속도, 사용자 전문 지식과 같은 변수는 격리된 토굴 수에 영향을 줄 수 있습니다. 프로토콜에 언급된 권장 도금 토팅 토굴 농도는 시작점이지만 사용자 중심 변수를 고려하는 모든 사용자는 이를 최적화해야 합니다. 우리는 8에서 20 주에 구역 수색하는 남성과 여성 WT 마우스와 이 기술을 사용하고 우리는 젊은 마우스에서 고립된 이론에서 생존할 확률이 더 낫습니다 세포 생존에 있는 중요한 다름을 본 적이 없습니다. 지하실은 표면에 부착하고 생존의 작은 비율로 초과 도금된다. 도금 후 하루 에 50 %의 합류를 가질 수있는 충분한 암호가 있지만 죽어가는 지하실이 세포 독성 효과를 가질 수있는 너무 많은 토굴이없는 균형이 목표입니다. LWRN 미디어는 죽은 지하실과 파편을 제거하기 위해 도금 후 24 시간 신중하게 제거해야합니다, 이것은 이미 단층으로 성장하고있는 세포를 분리하지 않도록주의 깊게 수행해야합니다.
LWRN 미디어를 처음 제거한 후, 사용자는 실험 조건이 줄기 세포에 더 가깝게 남아 있고 신선한 LWRN 미디어를 추가하거나 단층의 분화가 필요한 경우 분화 매체로 대체하는 기본 IEC 단층층이 필요한지 여부를 결정해야 합니다. 이 프로토콜에서 가장 중요한 요소는 격리 프로세스 중에 결장의 무결성을 보장하는 것입니다. 파열이 발생하면 손상된 부위를 제거하기 위해 소시지를 단축할 수 있습니다. EDTA에 소시지를 넣기 전에 매듭이 가능한 한 단단하다는 것을 확인하십시오. EDTA 인큐베이션 후 소시지가 수축되면 프로토콜은 전체 토굴 수율에 거의 또는 전혀 영향을 미치지 않고 계속될 수 있습니다. 반복 주사기를 사용할 수 없는 경우 일반 주사기에 부착된 일반 마이크로피펫 팁도 인플레이션 및 디플레이션 프로세스에 사용할 수 있습니다. 또한 셀 회수 용액이 없는 경우 EDTA(2mM 소형 장, 50mM 콜론)에서 인플레이션 및 디플레이션 단계를 수행할 수 있지만 이 대체는 권장되지 않습니다. 인플루언스가 필요하지 않은 경우, 토굴은 콜라겐으로만 코팅된 플레이트와 코팅되지 않은 플레이트에서도 자랄 수 있습니다. 코팅되지 않은 플레이트 케이스만 사용하면 다른 옵션이 없지만, 세포는 콜라겐 코팅 플레이트에서와 같이 건강하게 자라지 않습니다. 배양 건강과 안정성에 관해서, 플라스틱으로 도금 된 단층은 4 ~ 5 일 동안 건강하며 트랜스웰에서 도금 된 단층은 최대 8 일 동안 운반 할 수 있습니다.
이 방법의 주요 한계 중 하나는 상피 결장 단층층을 성장하는 데 필요한 세포 매체입니다. LWRN 세포는 ATCC에서 사용할 수 있지만 LWRN 컨디셔닝 된 미디어 생성은 노동 집약적이며 Wnt 활동을 결정하기 위해 형광 분광계에 액세스해야합니다. 차별화 매체에는 사용하기 전에 새로 추가되는 여러 시약이 필요하며, 이는 지루한 프로세스입니다. 마지막으로, 이러한 시약의 대부분은 비용이 많이 들고 빠른 속도로 시약을 태우기 쉽습니다. 실험실은 이전 장 1 차 세포 배양 없이이 기술을 설립 하고자 하는 경우, 그것은 매우 경험이 있는 공동 작업자/대학을 찾을 하 고 그들의 회원 중 하나를 훈련 하는 것이 좋습니다.
3D 배양물의 유지보수는 지하막 매트릭스 배지의 비용 및 오르가노이드 배양에 필요한 고량의 조건부 배지의 비용으로 인해 비쌀 수 있지만, 생쥐의 감소된 수와 생성된 구조를 여러 번 통항할 수 있다는 장점이 있다. 엔테로이드(소장에서 파생)는 비교적 쉽게 분리하고 유지관리가 용이하며, 콜로노이드는 더 섬세하고, 느린 속도로 자라며, 더 제한된 통로 용량을 가지게 된다. 3D 콜로노이드에서 단층 생성은 이러한 종류의 실험을 시간과 비용이 많이 드는 3D 구조의 불균형 한 양을 필요로한다. 반대로, 직접적인 상피 결장 단층 준비는 빠르며 결과를 얻는 빠른 방법입니다. 하나의 결장 준비는 75cm2 (10 ~ 15 mL의 컨디셔닝 된 미디어) 2 ~ 3 일 의 물류 면적을 생성 할 수 있습니다 도금 후 2 ~ 3 일 (이 지역은 3D 콜로노이드의 144 우물을 필요로 할 것, 이는 거의 6mL의 Matrigel및 250 mL 이상의 조건부 미디어를 의미). 매체의 낮은 소비, 세포 배양의 저렴한 유지 보수 및 기능 성 테스트 및 빠른 다운스트림 처리를 수행하는 능력은 상피 결장 단층층의 큰 장점입니다.
이 프로토콜은 세포 접착, 극성 및 분화와 같은 분야에서 장 상피 세포 생물학의 연구에서 귀중한 도구입니다. 그것은 유전자 변형 된 마우스에서 1 차세포 배양을 생성하는 이점을 제공합니다 (녹아웃 아웃, 과잉 표현, 기자). 1 차장 상피 단층은 다른 세포 모형의 투과성, 장벽 및 환피이동의 연구를 허용하는 정색 및 바식자 표면에 쉽게 접근할 수 있습니다 (transwells에 도금될 때). 마지막으로,이 모델은 숙주 병원체 상호 작용, 상피 손상 및 수리 및 약물 발견과 같은 다른 분야에서 유용 할 수 있습니다.
공개
저자는 이해 상충이 없습니다.
감사의 말
이 작품은 크론과 대장염 재단 경력 개발 상 (544599, MQ) 및 NIH 보조금 (DK0555679, DK089763, DK059888, AN)에 의해 지원되었다. 우리는 그들의 지속적인 도움과 그들의 시약 및 프로토콜에 접근을 위한 미시간 의학 번역 조직 모델링 실험실에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Advanced DMEM/F12 | Gibco | 12634-010 | |
| Antibiotic Antimycotic solution | Corning | 30-004CI | |
| B27 supplement (50X) | Gibco | 12587-010 | |
| Cell Recovery Solution | Corning | 354253 | |
| Collagen from human placenta (type IV) | Sigma-Aldrich | C5533 | |
| D-Sorbitol | Sigma | 85529-250G | |
| D-Sucrose | Fisher Scientific | BP220-1 | |
| Dulbecco’s phosphate buffered saline, with Ca2+ and Mg2+ (DPBS) | Corning | 21-030-CV | |
| Epithelial Volt/Ohm meter | World Precision Instruments | 0-10KΩ with STX2 (EVOM2) | |
| Ethylenediamine tetraacetic acid (EDTA) | Lonza | 51201 | |
| Fetal Bovine Serum (FBS) | Corning | 35-016-CV | |
| Firefly Luciferase assay | Biotium | 30085-2 | |
| Geneticin | Gibco | 10131-035 | |
| GlutaMAX (100X) | Gibco | 35050-061 | |
| HEPES (1M) | Corning | 25060CI | |
| Human recombinant EGF | R&D systems | 236-EG | Stock Concentration: 500µg/mL |
| Human recombinant Wnt-3A | R&D systems | W3a-H-005 | |
| Hygromycin B | Invitrogen | 10687010 | |
| LWRN cells | ATCC | CRL-3276 | |
| Molecular grade water | Corning | 46-000-CV | |
| N2 supplement (100X) | Gibco | 17502-048 | |
| N-acetyl-L-cysteine | Sigma-Aldrich | A9165-5G | Stock Concentration: 500mM |
| Noggin | Conditioned media | - | |
| Nunc Lab-Tek Chamber slide system | Sigma-Aldrich | C7182-1PAK | |
| Pencillin-Streptomycin (10,000U/mL) | Corning | 30002CI | |
| Phospahte buffered saline, Ca2+ and Mg2+ free (PBS) | Corning | 21-040-CV | |
| Plastic 20G feeding tube | Fisher Scientific | 50-810-46 | |
| rh-laminin-521 | Gibco | A29248 | Stock concentration: 100µg/mL |
| Roboz Surgical 4-0 Silk Black Braided 100YD | Fisher Scientific | NC9452680 | |
| TOPflash HEK293 cells | ATCC | CRL-3249 | |
| Transwell Permeable supports (0.4µm) | Corning | 3470 |
참고문헌
- Quiros, M., Nusrat, A. Contribution of wound-associated cells and mediators in orchestrating gastrointestinal mucosal wound repair. Annual Reviews in Physiology. 81, 189-209 (2019).
- Blutt, S. E., et al. Use of organoids to study regenerative responses to intestinal damage. American Journal of Physiology-Gastrointestinal and Liver Physiology. 317 (6), 845-852 (2019).
- Zhang, M., Liu, Y., Chen, Y. G. Generation of 3D human gastrointestinal organoids: principle and applications. Cell Regeneration. 9 (1), 6 (2020).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Zachos, N. C., et al. Human enteroids/colonoids and intestinal organoids functionally recapitulate normal intestinal physiology and pathophysiology. Journal of Biological Chemistry. 291 (8), 3759-3766 (2016).
- Kozuka, K., et al. Development and characterization of a human and mouse intestinal epithelial cell monolayer platform. Stem Cell Reports. 9 (6), 1976-1990 (2017).
- In, J. G., Foulke-Abel, J., Clarke, E., Kovbasnjuk, O. Human colonoid monolayers to study interactions between pathogens, commensals, and host intestinal epithelium. Journal of Visualized Experiments. (146), e59357 (2019).
- Cardenas, D., et al. Two- and three-dimensional bioengineered human intestinal tissue models for cryptosporidium. Methods in Molecular Biology. 2052, 373-402 (2020).
- Moon, C., VanDussen, K. L., Miyoshi, H., Stappenbeck, T. S. Development of a primary mouse intestinal epithelial cell monolayer culture system to evaluate factors that modulate IgA transcytosis. Mucosal Immunology. 7 (4), 818-828 (2014).
- VanDussen, K. L., et al. Development of an enhanced human gastrointestinal epithelial culture system to facilitate patient-based assays. Gut. 64 (6), 911-920 (2015).
- Zou, W. Y., et al. Human intestinal enteroids: New models to study gastrointestinal virus infections. Methods in Molecular Biology. 1576, 229-247 (2019).
- Heijmans, J., et al. ER stress causes rapid loss of intestinal epithelial stemness through activation of the unfolded protein response. Cell Reports. 3 (4), 1128-1139 (2013).
- Nik, A. M., Carlsson, P. Separation of intact intestinal epithelium from mesenchyme. Biotechniques. 55 (1), 42-44 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유