JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
생체 내에서 마우스 뇌를 경두개로 자극하기 위해 밀리미터 크기의 코일과 결합된 저비용 뇌파 기록 시스템
요약
밀리미터 크기의 코일과 결합된 저비용 뇌파 기록 시스템은 생체 내에서 마우스 뇌의 경두개 자기 자극을 유도하기 위해 제안되었습니다. 맞춤형의 유연한 다중 전극 어레이 기판이 있는 기존의 나사 전극을 사용하여 경두개 자기 자극에 대한 반응으로 마우스 뇌에서 다중 부위 기록을 수행할 수 있습니다.
초록
밀리미터 크기의 코일을 사용하여 생체 내에서 마우스 뇌의 경두개 자기 자극(TMS)을 구동하기 위해 저비용 뇌파(EEG) 기록 시스템이 여기에서 제안됩니다. 맞춤형의 유연한 다중 전극 어레이 기판과 결합된 기존의 나사 전극을 사용하여 마우스 뇌에서 다중 부위 기록을 수행할 수 있습니다. 또한 실험실에서 흔히 볼 수 있는 저비용 장비를 사용하여 밀리미터 크기의 코일을 생산하는 방법을 설명합니다. 플렉서블 다중전극 어레이 기판을 제조하기 위한 실용적인 절차와 저잡음 EEG 신호를 생성하는 데 필요한 나사 전극의 외과적 주입 기술도 제시됩니다. 이 방법론은 작은 동물의 뇌에서 기록하는 데 유용하지만 현재 보고서는 마취된 마우스 두개골의 전극 구현에 중점을 둡니다. 또한, 이 방법은 공통 어댑터를 통해 테더링된 케이블로 연결되고 녹음 중에 TMS 장치로 머리에 고정되는 깨어 있는 작은 동물로 쉽게 확장할 수 있습니다. 최대 32개의 EEG 채널(예: 16개의 채널을 가진 장치가 더 적은 채널을 갖는 장치가 제시됨)과 하나의 TMS 채널 장치를 포함할 수 있는 EEG-TMS 시스템의 현재 버전에 대해 설명한다. 또한 마취된 마우스에 EEG-TMS 시스템을 적용하여 얻은 일반적인 결과가 간략하게 보고됩니다.
서문
경두개 자기 자극(TMS)은 비침습성/낮은 침습성으로 인해 인간 뇌 과학, 임상 응용 및 동물 모델 연구를 위한 유망한 도구입니다. TMS 적용의 초기 단계에서 인간과 동물의 단일 및 쌍 펄스 TMS에 대한 반응으로 피질 효과의 측정은 운동 피질로 제한되었습니다. 쉽게 측정할 수 있는 출력은 운동 피질 1,2를 포함하는 운동 유발 전위 및 유도 근전 전위로 제한되었습니다. TMS 변조로 측정할 수 있는 뇌 영역을 확장하기 위해 뇌파(EEG) 기록은 전체 뇌 영역에 걸쳐 영역의 흥분성, 연결성 및 시공간 역학을 직접 검사하는 유용한 방법으로 단일 및 쌍 펄스 TMS와 통합되었습니다 3,4,5. 따라서 뇌에 TMS 및 EEG 기록(TMS-EEG)을 동시에 적용하는 것은 피질 내 신경 회로를 조사하기 위해 인간과 동물의 다양한 표재성 피질 뇌 영역을 조사하는 데 사용되었습니다(Tremblay et al.6 참조). 또한, TMS-EEG 시스템은 다른 피질 영역으로의 신호 전파 및 진동 활동 생성을 포함하는 추가적인 피질 시공간 특성을 검사하는 데 사용될 수 있습니다 7,8.
그러나 뇌에서 TMS의 작용 메커니즘은 TMS의 비침습성으로 인해 추측에 불과하며, 이는 TMS 적용 중에 뇌가 어떻게 기능하는지에 대한 지식을 제한합니다. 따라서 설치류에서 인간에 이르는 동물에 대한 침습적 중개 연구는 TMS가 신경 회로와 그 활동에 미치는 영향의 메커니즘을 이해하는 데 매우 중요합니다. 특히, 동물에서의 TMS-EEG 결합 실험의 경우, 작은 동물에 대한 동시 자극 및 측정 시스템이 집중적으로 개발되지 않았습니다. 따라서 실험자는 특정 실험 요구 사항에 따라 시행 착오를 통해 이러한 시스템을 구성해야합니다. 또한, 마우스 모델은 많은 형질전환 및 균주-단리된 마우스 균주가 생물학적 자원으로서 이용가능하기 때문에 다른 생체내 동물 종 모델 중에서 유용하다. 따라서 마우스를 위한 TMS-EEG 결합 측정 시스템을 구축하는 편리한 방법은 많은 신경과학 연구자들에게 바람직할 것입니다.
본 연구에서는 연구에 사용되는 형질전환 동물의 주요 유형인 쥐 뇌의 동시 자극 및 기록에 적용할 수 있고 일반적인 신경과학 실험실에서 쉽게 구축할 수 있는 TMS-EEG 결합 방법을 제안한다. 먼저, 각각의 실험에서 전극 어레이 위치를 재현 가능하게 할당하기 위해 기존의 나사 전극 및 유연한 기판을 사용하여 저비용 EEG 기록 시스템이 설명됩니다. 둘째, 자기 자극 시스템은 밀리미터 크기의 코일을 사용하여 구성되며, 이는 일반적인 실험실에서 쉽게 맞춤 제작할 수 있습니다. 셋째, TMS-EEG 결합 시스템은 소리 및 자기 자극에 대한 반응으로 신경 활동을 기록합니다. 이 연구에서 제시된 방법은 작은 동물에서 특정 장애를 유발하는 메커니즘을 밝힐 수 있으며, 동물 모델에서 얻은 결과는 해당 인간 장애를 이해하기 위해 번역될 수 있습니다.
프로토콜
본 연구에서는 모든 동물실험을 국립보건원의 실험동물 관리 및 사용 가이드에 따라 홋카이도대학 기관동물관리이용위원회의 승인을 받아 실시하였다. 8 내지 10주령의 수컷 2마리와 암컷 3마리의 C57BL/6J 마우스를 본 연구에 사용하였다. 이것은 터미널 절차입니다. 동물들은 상업적 공급원으로부터 입수하였다 ( 재료의 표 참조).
1. 유연한 2차원 어레이 설계 및 구성
- EEG 기록 및 기준 전극으로 사용하기 위해 공칭 직경, 목 길이 및 헤드 직경이 각각 0.6mm, 1.5mm 및 1.1mm인 구조적 특성을 가진 필요한 수의 소형 나사 전극(스테인리스, SUS XM7, 재료 표 참조)을 준비합니다(그림 1A).
참고: 본 연구에서는 16개의 소형 나사 전극이 사용되었습니다. - 아래 단계에 따라 유연한 기판에 인쇄 회로도의 청사진을 준비합니다.
- 판독할 나사 전극을 위한 플렉서블 기판(전체 크기, 41.2mm × 19.9mm, 재료 표 참조)에 2차원(2D) 전극 패드 패턴을 만듭니다. 2D 전극 배열을 설계합니다. 그림 1B 는 이 연구에 사용된 특정 배열과 기준선(원점 [0, 0]에 십자 표시)의 상대 좌표를 보여줍니다.
참고: 본 연구에서 측두엽 내의 청각 피질의 신경 활동을 기록하기 위해 측면-내측(수평) 방향의 전극 배치는 주둥이-꼬리(수직) 방향의 전극 배치보다 더 길었습니다(그림 1B). - EEG 기록 전극의 경우 플렉시블 기판의 각 구리 패드( 재료 표 참조)가 외경 1.3mm, 내경 0.8mm의 링 모양인지 확인합니다(그림 1C, 왼쪽). 각 나사 전극이 기판을 통과할 수 있도록 중앙에 작은 구멍(직경 0.8mm)을 만듭니다. 기준 전극의 경우 각 구리 패드는 측면 길이가 1.4mm인 정사각형 모양이어야 합니다. 마찬가지로 각 나사가 기판의 정사각형 패드를 통과할 수 있도록 중앙에 작은 구멍(직경 0.8mm)을 만듭니다(그림 1C, 오른쪽).
- 다음으로, 표면 실장 커넥터(그림 1D, 왼쪽)를 납땜하기 위해 커넥터(그림 1D, 오른쪽)로 이어지는 판독 패드(2D 어레이)를 설계합니다. 예를 들어, 2개의 × 10핀이 있고 인접한 핀 사이에 1.27mm 피치가 있는 커넥터를 사용합니다(그림 1D, 오른쪽).
- 선 너비 0.03mm, 선 간격 0.03mm( 그림 1E의 가는 선)로 표면과 후면 레이어를 모두 사용하여 나사 전극 패드와 커넥터 패드를 배선합니다.
- 또한 기준 및 접지 채널을 증폭기에 연결하려면 기준 전극 및 접지 전극용 전극 패드를 유연한 2D 어레이 외부의 절연 부품에 연결합니다( 그림 1E 하단에 "G" 및 "HR"로 표시된 두 개의 수직 직사각형). 기준 및 접지 채널을 결정한 후 전극 패드를 해당 커넥터에 납땜하는 것을 잊지 마십시오(2.1단계 참조).
- 보호층(폴리이미드층)으로 덮이지 않은 노출된 영역을 적절하게 설계한다. 커넥터 패드를 표면층에 노출시키고 나사 전극 패드를 표면층과 후면 층 모두에 노출시킵니다. 전체 전극 설계, 크기 및 제작된 플렉시블 2D 어레이는 도 1E에 도시되어 있고, 제조된 기판의 이미지는 도 1F에 도시되어 있다.
- 유연한 2D 어레이의 상단 전극 부분(헤드 부분)에서 위에서 아래로 3층 구조가 다음(총 두께 49.0μm)으로 구성되도록 합니다: 상단 구리 층(12.0μm 두께), 코어 폴리이미드의 중간 층(25.0μm) 및 하단 구리 층(12.0μm)(그림 1G, 상단).
- 기판의 상부 및 하부 표면 상의 구리 층을 예를 들어 습식 에칭 및 표준 제조 기술9를 사용하여 에칭한다.
- 유연한 2D 어레이의 하단 정사각형 패드 부분(커넥터 부분)에서 6층 구조가 상단 구리 층(12.0μm 두께), 중간 코어 폴리이미드 층(25.0μm) 및 하단 구리 층(12.0μm)을 포함한 3개의 층으로 구성되어 있는지 확인합니다. 바닥에서 2mm 폴리이미드 보드를 보강재로 부착합니다(그림 1G, 하단).
참고: 유연성을 유지하기 위해 강화 폴리이미드 보드는 헤드와 커넥터 부분 사이의 유연한 2D 어레이의 목 부분에 장착되지 않습니다. - 유사하게, 커넥터 부분에서, 습식 에칭 및 표준 제조 기술을 사용하여 상부에 구리 및 보호 폴리이미드 층을 에칭한다.
참고: 커넥터를 포함하여 제작된 유연한 2D 어레이 장치의 총 무게는 0.84g입니다. 유연한 2D 어레이를 위한 레이아웃을 설계한 후 편의를 위해 상용 제조업체의 기판( 재료 표 참조)을 권장하는 경우가 있습니다.
- 판독할 나사 전극을 위한 플렉서블 기판(전체 크기, 41.2mm × 19.9mm, 재료 표 참조)에 2차원(2D) 전극 패드 패턴을 만듭니다. 2D 전극 배열을 설계합니다. 그림 1B 는 이 연구에 사용된 특정 배열과 기준선(원점 [0, 0]에 십자 표시)의 상대 좌표를 보여줍니다.
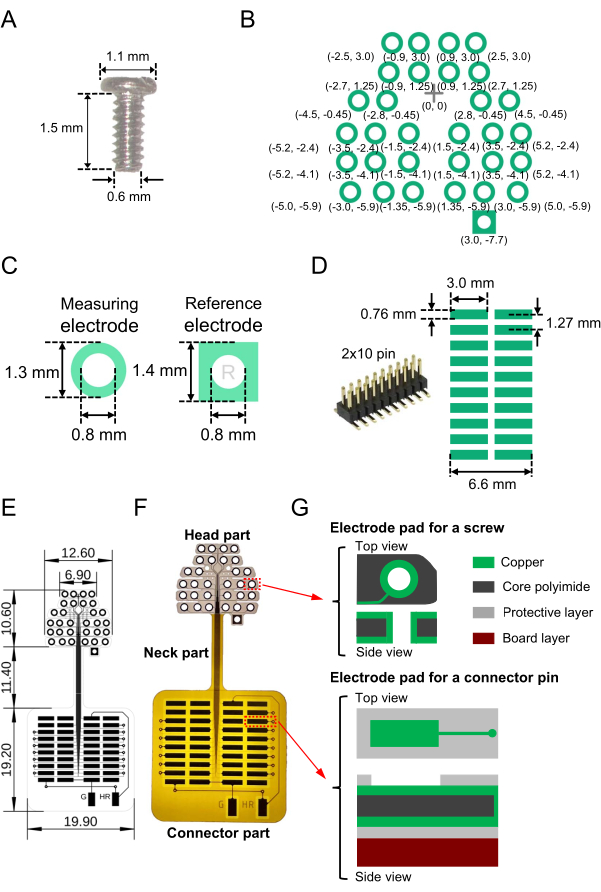
도 1: 뇌파(EEG) 기록을 위한 플렉서블 2차원(2D) 어레이의 구성요소 및 상기 어레이를 포함하는 제작된 장치. (A) 마우스 두개골에 내장된 소형 나사 전극. (B) 뇌 활동을 측정하기 위해 설계된 전극 패드(녹색 원)와 기준 채널(오른쪽 하단 사각형). 원점(0, 0)에서 기준점(십자 표시)으로부터 전극 패드의 상대 좌표가 도시된다; 밀리미터 단위의 크기는 괄호 안에 표시되어 있습니다. 전극 패드의 중심 좌표는 십자 표시를 통과하는 수직 축에 대해 대칭입니다. (C) 기록 전극(왼쪽)과 기준 전극(오른쪽)을 위한 전극 패드와 드릴 구멍이 예시되어 있습니다. (D) 유연한 2D 어레이(왼쪽)와 기판에 설계된 패드의 패턴 및 크기(오른쪽)에 사용되는 표면 실장 커넥터(2핀 × 10핀). (E) 밀리미터 단위의 각 부품 크기로 설계된 청사진. (F) E의 청사진에 의해 표시된 제작된 기판의 이미지. (G) 유연한 2D 어레이(헤드 및 커넥터 부품)의 레이어 구조. 상단 및 측면 view 나사 전극 패드(위)와 판독 패드(아래)가 그림입니다. 헤드와 커넥터 부분은 각각 3층 구조(상부)와 6층 구조(하부)로 구성된다. 또한 목 부분은 5층 구조로 구성됩니다. 보호 폴리이미드 층은 상부와 후면에 장착되고 강화 폴리이미드 기판은 목 부분에 장착되지 않습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 어댑터 구성 및 채널 매핑
- 아래 단계에 따라 어댑터 구성을 수행하십시오.
- 플렉서블 기판의 2 × 10 핀, 표면 실장 커넥터(그림 1D, 왼쪽) 및 2D 어레이의 커넥터 패드(그림 1D, 오른쪽)( 재료 표 참조)에 납땜 플럭스를 펼칩니다.
- 2핀 × 10핀 표면 실장 커넥터를 커넥터 패드에 납땜합니다. 특히 2D 어레이 하단에 있는 두 개의 패드와 기준 및 접지 채널로 사용되는 두 개의 커넥터 핀 사이의 연결을 확인합니다(그림 2A).
- 2개의 패드 각각을 개별 리드선에 연결하여 기준선 신호를 외부 지점(예: 측정 시스템의 접지 채널에 연결된 접지 지점)에 공급합니다. 그림 2A).
참고: 그러나 이 연구에서는 나사 전극이 있는 원형 전극 패드 중 하나를 커넥터 부분의 정사각형 전극 대신 기준 전극으로 사용했습니다. - 납땜 후 에폭시 수지( 재료 표 참조)를 사용하여 납땜 지점을 덮어 노출된 지점을 보호하고 단락을 방지합니다.
- 커넥터 케이블과 헤드 앰프를 아래 단계에 따라 고정합니다.
- 2개의 × 10핀 및 1.27mm 피치(그림 2B, 왼쪽 상단)와 20mm 피치의 플랫 0.635핀 리본 케이블(재료 표 참조)이 있는 절연 변위 커넥터(IDC)를 준비합니다(그림 2B, 왼쪽 하단). 납작한 리본 케이블을 필요한 길이(예: 40cm)로 자릅니다.
- IDC 압착 도구(그림 2B, 오른쪽 상단)를 사용하여 IDC와 플랫 리본 케이블의 한쪽 끝을 압착합니다( 재료 표 참조).
- 커터를 사용하여 케이블 반대쪽 끝의 각 라인을 팁 끝에서 최대 약 15mm까지 분리합니다. 단열재를 팁 끝에서 3mm 벗겨냅니다.
- 압착된 IDC를 플랫 리본 케이블에 연결하고 플렉서블 기판에 납땜된 2핀 × 10핀 커넥터를 연결합니다(그림 2C).
- 녹음 전극과 케이블의 분리된 라인 사이의 일치를 확인합니다. 사용된 각 행에서 잘못된 연결 오류가 발생하지 않는지 확인합니다.
- 각 전극의 출력에 해당하는 개별 라인의 노출된 구리선을 메인 증폭기를 포함한 측정 시스템의 20핀 커넥터(1.25mm 피치)에 납땜합니다(그림 2B, 오른쪽 하단).
- 납땜 후 테스트 장비(예: LCR 미터, 재료 표 참조)를 사용하여 나사 전극 패드와 커넥터 핀 사이의 전도를 확인합니다.
- 에폭시 수지와 차폐 테이프를 사용하여 납땜 지점을 덮어 손상으로부터 보호하고 다른 신호 라인과의 접촉을 방지하십시오.
- 에폭시 수지를 사용하여 얇은 스테인리스 스틸 막대(직경: 1.1-1.2mm, 길이: 100mm)를 플렉서블 기판의 2D 어레이 커넥터 부분 뒷면에 부착합니다.
알림: 이 스테인리스 스틸 막대는 실험 중에 미세 매니퓰레이터 홀더로 잡을 수 있습니다(그림 2C). - 마지막으로 나사 전극과 신호 출력 채널 간의 매핑을 확인합니다(그림 2D).
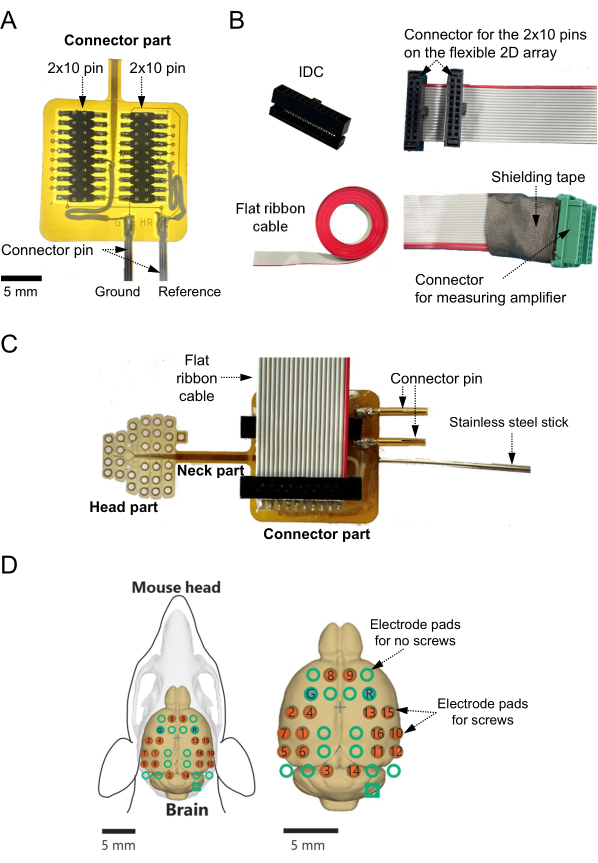
그림 2: 플렉서블 기판에 2차원(2D) 전극 어레이용 어댑터 구성 및 기록 채널 매핑. (A) 커넥터 부분에서 기준 및 접지 채널은 리드선으로 하단 전극 패드에 연결됩니다. 기준 및 접지 채널이 미리 결정된 경우 채널은 설계 단계에서 해당 하단 전극 패드에 연결되어야 합니다. 이러한 경우 리드선을 채널과 전극 패드에 납땜할 필요가 없습니다. (B) 절연 변위 커넥터(왼쪽 상단)는 플랫 케이블(왼쪽 하단)의 한쪽 끝에 압착되어 측정 증폭기 커넥터(오른쪽 상단)를 연결합니다. 사용할 채널에 해당하는 모든 라인은 녹색 커넥터(오른쪽 하단)에 납땜됩니다. 이 경우 헤드 앰프에 연결된 각 녹색 커넥터가 8 채널 측정에 할당되기 때문에 16 채널 뇌 활동 신호를 기록하려면 최소 2 개의 커넥터가 필요합니다. 납땜 지점은 다른 신호 라인과의 접촉을 방지하기 위해 에폭시 수지와 차폐 테이프로 덮여 있습니다. (C) 커넥터와 조립식 케이블은 유연한 2D 어레이 기판의 표면에 배치됩니다. 얇은 스테인리스 스틸 막대는 유연한 기판의 뒷면에 부착됩니다. (D) 마우스 뇌 표면의 기록 채널의 공간적 위치와 측정 시스템의 각 지점에 대한 채널 맵이 표시됩니다. 이 경우 나사 전극(빨간색 원)이 있는 16개의 녹음 채널이 있지만 가능한 총 녹음 사이트 수는 32개입니다. 다른 16 개의 비 녹음 채널도 뇌 표면에 녹색 원으로 표시됩니다. 매핑 플롯에서 "G"와 "R"은 각각 접지 및 기준 전극용으로 설계된 채널을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 동물 수술
- 무균 수술 환경을 준비하십시오.
- 동물과 관련된 전체 실험 절차 중에 라텍스 장갑과 같은 보호 장비를 착용하십시오.
- 입체 장치 및 수술 도구를 소독하십시오 ( 재료 표 참조).
- 수술 도구를 멸균 한 후 멸균 식염수를 사용하여 세척하십시오.
- 동물을 마취하십시오.
- 수술 전에 마우스의 무게를 측정하십시오. 아트로핀 설페이트(0.04 mg/kg, 재료 표 참조)를 복강내 주사 를 통해 투여합니다.
- 메데토미딘(0.3mg/kg), 미다졸람(4.0mg/kg) 및 부토르파놀(5.0mg/kg)의 혼합물을 복강내 주사 하여 마우스를 마취합니다.
- 발가락을 꼬집어 반응 수준으로 마취 깊이를 확인합니다.
알림: 마취는 약 40분 후에 사라집니다. 마우스가 발가락 꼬집음에 반응하면 복강 주사를 통해 동일한 용량의 마취 혼합물을 투여하십시오.
- 전극 이식 수술을 미리 준비합니다.
- 햅틱 감각을 방지하기 위해 마우스 수염을 자릅니다.
- 건조를 방지하기 위해 안과 용 연고로 양쪽 눈을 윤활하십시오. 눈꺼풀을 감아 시각을 방해하고 수선 테이프로 위 눈꺼풀과 아래 눈꺼풀을 접착하여 봉합을 유지합니다.
- 전기 가위로 마우스 머리의 머리카락을 면도하십시오. 직장에 체온계를 삽입하고 가열 패드를 사용하여 체온을 37 °C로 유지합니다.
- lidocaine hydrochloride를 절개할 마우스 두피 부분에 국소 국소 마취제로 투여합니다.
- 메스 또는 수술용 가위를 사용하여 주둥이에서 꼬리 방향으로 마우스 두피를 절개합니다(면적 크기: 7 × 10mm2).
- 핀셋으로 절개 부위 근처의 두피를 꼬집고 들어 올립니다. 메스 또는 수술 용 가위를 사용하여 두개골에 보이는 막을 제거하십시오. 수술 중 눈 주위의 혈관을 부러 뜨리지 마십시오.
- 두피 절개선의 양쪽 중심 부근을 집게로 잡고 절개된 부분을 넓혀 두개골 윗부분을 넓게 노출시킨다.
- 수술 용 가위로 두개골 표면의 모든 막과 람다 주변 조직이 완전히 제거되었는지 확인하십시오.
- 두개골 표면을 생리 식염수로 적셔 두개골 아래 뇌 표면의 가시성을 높이고 횡 부비동을 찾습니다.
알림: 나사 전극을 두개골에 이식할 때 위와 횡동에 삽입하지 않도록 하십시오.
4. 전극 주입
- 플렉서블 기판의 이면에 있는 2D 전극 어레이에 장착된 스테인리스 스틸 로드를 마이크로 매니퓰레이터에 부착합니다. 유연한 기판을 두개골에 놓습니다.
- 어레이의 채널(Chs) 3 및 14(그림 2D)의 위치를 하구에 맞도록 조정합니다.
참고: 하구는 횡동을 따라 위치합니다. 사전에 마우스 뇌 아틀라스를 사용하여 하구의 위치를 확인하는 것이 좋습니다. - 두개골의 Chs 3, 8, 9, 14(그림 2D) 위치에 작은 원을 그려 표적 랜드마크로 사용할 영구 마커를 사용합니다.
- 두개골 표면을 건조시켜 치과용 시멘트에 대한 접착력을 높이고 유연한 기판 상의 2D 전극 어레이를 마우스 두개골에서 전기적으로 분리합니다.
- 두개골 표면에 치과용 시멘트(두께 약 1mm, 재료 표 참조)를 바릅니다. 치과용 시멘트를 도포한 후 경화될 때까지 약 30분 정도 기다립니다.
- 두개골 표면의 작은 원형 표시에 따라 유연한 기판을 정렬합니다.
- 치과용 드릴의 끝을 플렉서블 기판의 각 전극 패드 구멍에 맞춥니다. 각 전극 패드 구멍을 통해 두개골에 조심스럽게 구멍을 뚫습니다.
- 소형 나사 전용 드라이버를 사용하여 두개골에 뚫린 구멍을 통해 각 소형 나사 전극을 나사로 고정합니다.
- 나사 전극의 헤드와 전극 패드를 단단히 압착합니다. 마지막으로 테스트 장비(예: LCR 미터)로 각 나사 전극과 커넥터 사이의 전도도를 측정하여 전기 전도도를 확인합니다.
5. 작은 코일 설계 및 건설
- CAD(Computer-Aided Design) 소프트웨어(재료 표 참조)를 사용하여 중앙에 구멍이 있는(내경: 2mm, 외경: 7mm, 두께: 1mm) 도넛 모양의 디스크(보충 코딩 파일 1 참조)를 설계합니다.
- 3D 프린터를 사용하여 비내열성 재료(예: 폴리락트산 필라멘트)로 만들어진 두 개의 디스크(그림 3A, 왼쪽)를 인쇄합니다. 내열성이 없는 재료가 항상 필요한 것은 아닙니다(아래 참조).
- 퍼멀로이-45 로드(직경: 2mm, 재료 표 참조)를 트리밍하여 짧은 샤프트(길이: 60mm)를 만듭니다.
- 샤프트를 3D 프린팅된 디스크 두 개의 각 구멍에 삽입합니다(그림 3A, 오른쪽). 하나의 디스크를 샤프트 끝에 놓고 다른 디스크를 끝에서 11mm 배치하여 두 디스크 사이의 거리를 10mm로 만듭니다. 순간 접착제로 디스크를 부착하십시오( 재료 표 참조).
- 디스크가 없는 샤프트의 끝을 임팩트 드라이버에 부착합니다(그림 3B). 퍼멀로이-45 샤프트에 작은 자석을 부착합니다. 샤프트에서 5mm 떨어진 자석 근처에 홀 효과 센서를 놓습니다. 홀 이펙트 센서를 데이터 수집 (DAQ, 재료 표 참조) 시스템에 연결합니다.
- 회전 수를 계산하려면 DAQ 시스템을 통해 홀 효과 센서의 출력 신호를 분석하는 컴퓨터 프로그램( 재료 표 참조)을 준비하십시오.
- 가는 구리선(직경: 0.16mm)을 샤프트에 연결하고 순간 접착제로 전선의 상단에 부착합니다.
- 임팩트 드라이버를 사용하여 두 디스크 사이에 구리선을 1,000바퀴 감습니다. 회전 속도는 임의적이지만 일반적으로 초당 약 5회전이 사용됩니다. 그런 다음 순간 접착제로 감긴 와이어를 붙입니다.
- 샤프트에서 두 개의 디스크를 분리합니다. 디스크가 샤프트에 강하게 부착된 경우 히트건을 사용하여 디스크를 녹입니다.
- 코일을 에폭시 수지로 덮어 표면을 절연하고 고정합니다. 그런 다음 풀린 샤프트 부분을 과도하게 잘라냅니다.
- 얻어진 코일의 높이가 10mm이고 직경이 6mm인지 확인합니다(그림 3B, 왼쪽). 코일 조작을 위해 코일 홀더를 구성하거나(그림 3C, 오른쪽) 스테인리스 스틸 막대를 코일에 부착합니다(여기에 표시되지 않음).
- LCR 미터를 사용하여 코일의 저항과 인덕턴스를 측정합니다( 재료 표 참조). 예를 들어, 여기에 사용된 코일은 1kHz 교류(AC) 입력에서 18.3 Ω의 직류(DC) 저항과 7.9mH의 인덕턴스를 가졌습니다. AC 특성(저항 및 인덕턴스)은 그림 3D에 나와 있습니다.
- 함수 발생기를 사용하여 코일에 양극 구형파를 적용합니다. 입력 전압의 일반적인 진폭은 2V 발전기 출력에 이어 10x 이득을 갖는 바이폴라 전원 공급 장치를 통해 20V입니다. 결과 파형은 대략 진폭이 20V(즉, 피크 대 피크 전압 40V)인 양극 구형파입니다(그림 3E).
- 홀 이펙트 센서와 DAQ 시스템을 사용하여 자속 밀도를 측정합니다. 이 경우, 예를 들어, 코일 바닥이 홀 효과 센서와 접촉했을 때 코일의 자속 밀도(B)는 113.6±2.5mT(평균 ± SEM)였습니다(그림 3F).
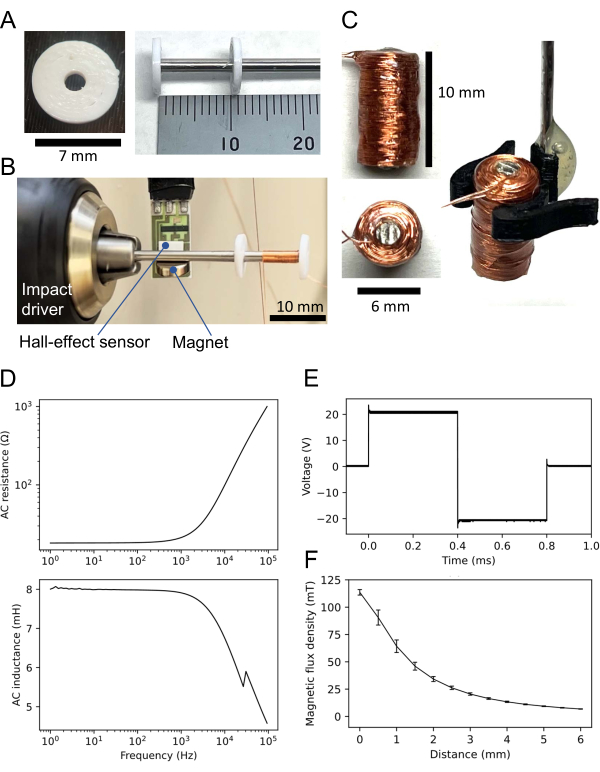
그림 3: 자기 자극을 위한 작은 코일. (A) 3차원(3D) 프린팅 디스크(왼쪽). 두 개의 동일한 디스크가 permalloy-45 샤프트에 부착됩니다. 하나는 샤프트 끝에 있고 다른 하나는 10mm 떨어져 있습니다(오른쪽). (B) 코일 감기 설정. 두 개의 디스크가 있는 60mm 샤프트는 임팩트 드라이버에 부착됩니다. 홀 이펙트 센서는 샤프트에 부착된 작은 자석 근처에 배치됩니다. 구리선은 두 디스크 사이에 감겨 있습니다. (C) 구성된 코일. 코일은 높이 10mm, 직경 6mm이며 구리선은 1,000 회전입니다. 그림의 오른쪽은 3D 프린팅된 코일 홀더로 조작된 코일을 보여줍니다. (D) LCR 미터에 의해 기록 된 코일의 AC 특성 : (상단) 저항 대 사인파 입력 주파수; (아래) 인덕턴스 대 입력 주파수. 일반적인 코일은 AC 입력의 1kHz에서 각각 21.6mH 및 7.9mH의 저항과 인덕턴스를 갖습니다. (E) 오실로스코프에 의해 기록된 코일 입력으로 사용되는 이상성 직사각형 파형. (F) 자속 밀도와 구성된 코일과 홀 효과 센서 사이의 거리 사이의 관계. 자속 밀도는 각 센서에 대해 한 번씩 5개의 서로 다른 홀 효과 센서에 의해 기록되었습니다. 5개 측정값의 평균이 표시되며, 오차 막대는 평균의 표준 오차를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
6. 신호 기록 시스템 및 절차
- 플랫 리본 케이블을 사용하여 유연한 2D 어레이를 레코딩 시스템( 재료 표 참조)에 연결합니다.
- 코일에 장착된 스테인리스 스틸 막대를 마이크로 매니퓰레이터에 부착합니다( 재료 표 참조).
- 코일을 브레그마 위에 놓고 꼬리 방향으로 위치를 조정하여 하구 위의 초점을 찾습니다. 방출 전기장의 초점은 코일의 바닥면에 있는 권선 영역의 정중선(즉, 가장자리에서 중심까지 1mm)입니다.
- 바이폴라 전원 공급 장치와 함수 발생기 ( 재료 표 참조)로 구성된 자극 시스템을 준비하고 코일을 시스템에 연결하십시오.
- 함수 생성기의 입력 단자와 DAQ 시스템의 출력 단자를 케이블로 연결하여 DAQ 시스템에서 함수 생성기로 트리거 신호를 적용합니다. 트리거 신호가 자극을 시작할 수 있도록 적절한 컴퓨터 프로그램을 준비하십시오. 또한, DAQ 시스템을 레코딩 시스템에 연결하여 자극 시간을 타임스탬프로 저장할 수 있습니다.
- 레코딩 시스템에 대한 획득 프로세스를 시작합니다.
알림: 녹음 시스템이 노이즈를 포착하는 경우 노이즈의 원인을 찾아 줄이십시오. - 자극 시스템을 트리거하여 자기 자극을 테스트합니다.
알림: 자기 자극에 의해 생성된 노이즈가 측정 범위를 포화시키면 범위를 적절하게 조정하십시오. 또한 녹음 시스템이 자극 타임스탬프를 제대로 저장하는지 확인합니다. - 반응 데이터 기록을 시작하고 자극 세션을 시작합니다. 각 자극 세션이 완료되면 녹음을 중지합니다. 후속 분석을 위해 기록된 모든 데이터를 저장합니다.
참고: 예를 들어 5가지 다른 자기 강도로 모든 실험 조건을 수행하기 위해 모든 세션에 필요한 총 시간은 약 75분이었습니다. 엔드포인트는 일반적으로 모든 녹음 세션이 끝난 후에 결정되었습니다. 그러나 동물이 기침, 호흡 곤란, 헐떡임 등의 임상 징후를 보이면 실험 세션을 즉시 종료했습니다. 안락사를 위해 동물이 마취 상태에있는 동안 날카 롭고 깨끗한 가위를 사용하여 참수되었습니다.
7. 데이터 분석
- 차단 주파수가 200Hz인 저역 통과 필터를 사용하여 광대역(원시) 신호를 필터링합니다.
- 각 자극 타임스탬프 주변의 기간 동안 필터링된 파형을 수집합니다. 파형의 평균을 구하여 이벤트 관련 전위(ERP) 파형을 구합니다(그림 4 및 그림 5).
결과
나사 전극과 결합된 유연한 기판을 사용하여 마취된 C57BL/6J 마우스에서 기록된 샘플 EEG 데이터는 아래에 나와 있습니다.
전형적인 예로, 소리 자극(8kHz 톤 버스트, 80dB 음압 레벨[SPL])에 대한 응답으로 생성된 평균 EEG 파형이 동일한 자극을 가진 60번의 시도에 대해 표시됩니다(그림 4A). 기록 채널 매핑의 개략도도 도 4A의 중간에 제시...
토론
이 연구는 생쥐를 포함한 작은 동물을 위해 설계된 자기 자극 시스템과 결합된 다중 사이트 EEG 기록 시스템을 다룹니다. 구축된 시스템은 비용이 저렴하고 생리학 실험실에서 쉽게 구축할 수 있으며 기존 측정 설정을 확장할 수 있습니다. 마우스 기록 시스템에서 데이터를 얻는 데 필요한 수술 절차는 이러한 실험실이 표준 전기 생리학 실험에 대한 이전 경험이 있는 경우 매우 간단합니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 연구는 무라타 과학 재단, 스즈켄 기념 재단, 나카타니 생물 의학 공학 측정 기술 발전 재단, 탐사 연구 보조금 (보조금 번호 21K19755, 일본) 및 과학 연구 (B) (보조금 번호 23H03416, 일본)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 3D printer | Zhejiang Flashforge 3D Technology Co., Ltd | FFD-101 | The printer used for 3D-printing the donut-shaped disks |
| ATROPINE SULFATE 0.5 mg | NIPRO ES PHARMA CO., LTD. | - | Atropine sulfate |
| Bipolar amplifier | NF Corp. | KIT61380 | For amplifying waveforms for coil input |
| Butorphanol | Meiji Seika Pharma Co., Ltd., Tokyo, Japan | - | For anathesis of animals |
| Commercial manufacturer of flexible 2D array | p-ban.com Corp. | - | URL: https://www.p-ban.com/ |
| Computer prograom to analyze output signals | Natinal Instruments | NI-DAQ and NI-DAQmx Python | To analyze output signals from the hall-effect sensor |
| Connector | Harwin Inc. | G125-FV12005L0P | For connector to conect to the measuring system |
| Copper pad | p-ban.com Corp. | copper | Copper pad on each substrate |
| Copper wire | Kyowa Harmonet Ltd. | P644432 | The windings of the coil |
| DAQ board | National Instruments Corp. | USB-6343 | For measuring the magnitic flux density of the coil |
| Dental cement | SHOFU INC. | Quick Resin | Self-Curing Orthodontic Resin |
| ECoG electrode | NeuroNexus Inc. | HC32 | For reference to design of the flexible 2D array |
| Epoxy resin | Konishi Co. Ltd. | #16123 | For coil construction |
| Ethyl Carbamate | FUJIFILM Wako Pure Chemical Corp. | 050-05821 | For urethan anesthesia |
| Flat ribbon cable | Oki Electric Cable Co., Ltd. | FLEX-B2(20)-7/0.1 20028 5m | For cable to connect between surface-mount connector and measuring sysytem |
| flexible substrate | p-ban.com Corp. | polyimide | Baseplate of flexible substrate |
| Function generator | NF Corp. | WF1947 | For generating waveforms for coil input |
| Hall-effect sensor | Honeywell International Inc. | SS94A2D | For measuring the magnitic flux density of the coil |
| IDC crimping tool | Pro'sKit Industries Co. | 6PK-214 | To crimp the IDC and one end of the flat ribbon cable; Flat cable connector crimping tool |
| Instant glue | Konishi Co. Ltd. | #04612 | For coil construction |
| Insulation-displacement connector (IDC ) | Uxcell Japan | B07GDDG3XG | 2 × 10 pins and a 1.27 mm pitch |
| LCR meter | NF Corp. | ZM2376 | For measuring the AC properties of the coil |
| Manipulator | NARISHIGE Group. | SM-15L | For manipulating the coil |
| Medetomidine | Kobayashi Kako, Fukui, Japan | - | For anathesis of animals |
| Midazolam | Astellas Pharma, Tokyo, Japan | - | For anathesis of animals |
| Miniature screw | KOFUSEIBYO Co., Ltd. | S0.6*1.5 | For EEG-senseing and reference electrode |
| Mouse | Japan SLC, Inc. | C57BL/6J (C57BL/6JJmsSlc) | Experimental animal |
| Permalloy-45 rod | The Nilaco Corp. | 780544 | The core of the coil |
| Recording system | Plexon Inc. | OmniPlex | For EEG data acquisition |
| Stainless wire | Wakisangyo Co., Ltd. | HW-136 | For grasp by manipulator |
| Stereotaxic apparatus | NARISHIGE Group. | SR-5M-HT | To fix a mouse head |
| Surface-mount connector | Useconn Electronics Ltd. | PH127-2x10MG | For connector to mount on the flexible 2D array |
| Testing equipment (LCR meter) | NF Corp. | ZM2372 | Contact check and impedance measurements |
| White PLA filament | Zhejiang Flashforge 3D Technology Co., Ltd | PLA-F13 | The material used for 3D-printing the donut-shaped disks |
| Xylocaine Jelly 2% | Sandoz Pharma Co., Ltd. | - | lidocaine hydrochloride |
참고문헌
- Ilmoniemi, R. J., et al. Neuronal responses to magnetic stimulation reveal cortical reactivity and connectivity. Neuroreport. 8 (16), 3537-3540 (1997).
- Hallett, M. Transcranial magnetic stimulation: a primer. Neuron. 55 (2), 187-199 (2007).
- Thut, G., Pascual-Leone, A. Integrating TMS with EEG: How and what for. Brain Topography. 22 (4), 215-218 (2010).
- Ilmoniemi, R. J., Kicic, D. Methodology for combined TMS and EEG. Brain Topograpy. 22 (4), 233-248 (2010).
- Daskalakis, Z. J., Farzan, F., Radhu, N., Fitzgerald, P. B. Combined transcranial magnetic stimulation and electroencephalography: its past, present and future. Brain Research. 1463, 93-107 (2012).
- Tremblay, S., et al. Clinical utility and prospective of TMS-EEG. Clinical Neurophysiology. 130 (5), 802-844 (2019).
- Pellicciari, M. C., Veniero, D., Miniussi, C. Characterizing the cortical oscillatory response to TMS pulse. Frontiers in Cellular Neuroscience. 11, 38 (2017).
- Lin, Y. J., Shukla, L., Dugue, L., Valero-Cabre, A., Carrasco, M. Transcranial magnetic stimulation entrains alpha oscillatory activity in occipital cortex. Scientific Reports. 11 (1), 18562 (2021).
- Takahashi, S., et al. Laminar responses in the auditory cortex using a multielectrode array substrate for simultaneous stimulation and recording. IEEJ Transactions Electrical and Electronic Engineering. 14 (2), 303-311 (2019).
- Yoshikawa, T., Higuchi, H., Furukawa, R., Tateno, T. Temporal and spatial profiles of evoked activity induced by magnetic stimulation using millimeter-sized coils in the mouse auditory cortex in vivo. Brain Research. 1796, 148092 (2022).
- Tang, A. D., et al. Construction and evaluation of rodent-specific rTMS coils. Frontiers in Neural Circuits. 10, 47 (2016).
- Li, L. Controlling annealing and magnetic treatment parameters to achieve high permeabilities in 55 Ni-Fe toroid cores. IEEE Transactions on Magnetics. 37 (4), 2315-2317 (2001).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유